T 9301:2016
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 構成······························································································································· 3
4.1 ごうしん(毫鍼)の構成 ································································································· 3
4.2 ごうしん(毫鍼)の種類 ································································································· 4
4.3 しん(鍼)柄の種類 ······································································································· 4
5 要求事項························································································································· 6
5.1 材料 ···························································································································· 6
5.1A しん(鍼)体の材料 ····································································································· 6
5.1B しん(鍼)体の潤滑剤の材料 ························································································· 6
5.1C はり(鍼)を電極として用いる場合のしん(鍼)体の材料··················································· 6
5.2 寸法 ···························································································································· 6
5.3 性能 ···························································································································· 8
5.4 滅菌保証 ····················································································································· 10
5.4A 化学的要求事項 ·········································································································· 10
5.4B エンドトキシン試験 ···································································································· 10
6 包装······························································································································ 11
6.1 一次包装 ····················································································································· 11
6.2 二次包装 ····················································································································· 11
7 表示······························································································································ 11
7.1 一次包装 ····················································································································· 11
7.2 二次包装 ····················································································································· 11
8 輸送及び保管 ·················································································································· 12
8.1 輸送 ··························································································································· 12
8.2 保管 ··························································································································· 12
附属書A(参考)しんせん(鍼尖)の強さ及び鋭利さ試験方法····················································· 13
附属書B(参考)しんせん(鍼尖)せん(穿)刺性試験方法 ························································ 17
附属書C(参考)耐腐食性試験方法 ························································································ 22
附属書D(参考)参考文献 ···································································································· 24
附属書JA(規定)金しん(鍼)材料 ······················································································· 26
附属書JB(規定)銀しん(鍼)材料 ······················································································· 28
附属書JC(参考)JISと対応国際規格との対比表 ······································································ 30
T 9301:2016
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本理学療法機器
工業会(JIPT)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正
すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 9301:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 9301:2016
単回使用ごうしん(毫鍼)
Acupuncture needle for single use
序文
この規格は,2014年に第1版として発行されたISO 17218を基とし,我が国の実情を反映するために,
技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JCに示す。
1
適用範囲
この規格は,はり治療に用いる1回限りで使い捨てる単回使用ごうしん(毫鍼)[以下,ごうしん(毫鍼)
という。]について規定する。この規格のごうしん(毫鍼)は,製造工程で滅菌し滅菌済みと表示しそのま
ま直ちに使用できる滅菌しん(鍼)と未滅菌のものとがある。
注記1 平成31年9月30日までJIS T 9301:2005を適用することができる。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 17218:2014,Sterile acupuncture needles for single use(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS C 2502 永久磁石材料
JIS G 3521 硬鋼線
JIS G 4308 ステンレス鋼線材
JIS G 4309 ステンレス鋼線
JIS G 4314 ばね用ステンレス鋼線
JIS H 3270 ベリリウム銅,りん青銅及び洋白の棒並びに線
JIS H 8620 工業用金及び金合金めっき
JIS H 8622 装飾用金及び金合金めっき
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and
testing within a risk management process(MOD)
JIS T 6101 歯科用ニッケルクロム合金線
2
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS T 6104 歯科用コバルトクロム合金線
JIS Z 2244 ビッカース硬さ試験−試験方法
注記 対応国際規格:ISO 6507-1:2005,Metallic materials−Vickers hardness test−Part 1: Test method
及びISO 6507-4:2005,Metallic materials−Vickers hardness test−Part 4: Tables of hardness values
(全体評価:MOD)
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
しん(鍼)体(body of the needle)
はり(鍼)の人体に刺入される部分。
注記 図1参照
3.2
しん(鍼)柄(handle of the needle)
はり(鍼)の人体に刺入されない部分。
注記 図1参照
3.3
しんせん(鍼尖)(tip of the needle)
人体に刺入されるはり(鍼)の先端の鋭利な部分。
注記 図1参照
3.4
しん(鍼)根(root of the needle)
しん(鍼)柄としん(鍼)体の接続部分。
注記 図1参照
3.5
しん(鍼)尾(tail of the needle)
しん(鍼)柄のしんせん(鍼尖)と反対側の端部。
注記 図1参照
3.6
滅菌しん(鍼)(sterile acupuncture needle)
滅菌しん(鍼)は,次による。
a) 滅菌済みのはり(鍼)。
b) ごうしん(毫鍼)であって,製造工程で滅菌し,滅菌済みと表示し,そのまま直ちに使用できるもの。
3.7
しん(鍼)管(guide tube)
位置決めと刺入を容易にする細く長い管状の補助器具。
注記 図2参照
3.8
しん(鍼)体の硬さ(hardness of the needle body)
しん(鍼)体の塑性変形のしにくさ。
3
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.9
一次包装(primary package)
はり(鍼)を直接封入し,微生物を防ぐ,密封又は密閉された包装システム,及びごうしん(毫鍼)を
直接に覆う包装で,物理的に保護するためのものをいう。さらに,これが二次包装される場合,いわゆる
“内袋”に該当する。滅菌しん(鍼)については,ごうしん(毫鍼)の無菌性を保持するための性能をも
つ。
注記 通常,最小のユニット包装を指し,しんきゅうしん(鍼灸鍼)一本又は複数本と直に接触して
いる包装
3.10
二次包装(secondary package)
流通・保護のため,一次包装の幾つかを包装したもの,及び一次包装を直接に覆う包装において,通常,
複数の一次包装されたごうしん(毫鍼)(例えば,100本入るもの)をいう。
3.11
公称線径
ごうしん(毫鍼)の被包又は容器に表示されたしん(鍼)体の線径の寸法。
3.12
公称長さ
ごうしん(毫鍼)の被包又は容器に表示されたしん(鍼)体長の寸法。
3.13
試験水
日本薬局方の第二部医薬品各条“精製水”,又はこれと同等の試験水。
3.14
エンドトキシン試験用水
日本薬局方の第二部医薬品各条“注射用水”,又はその他の方法によって製造した試験水で,エンドトキ
シン試験に用いるライセート試薬の検出限界で検出反応を示さないものをいう。
3.15
未滅菌しん(鍼)
ごうしん(毫鍼)であって,製造工程で滅菌を行わず,滅菌済みと表示できないものをいう。
4
構成
4.1
ごうしん(毫鍼)の構成
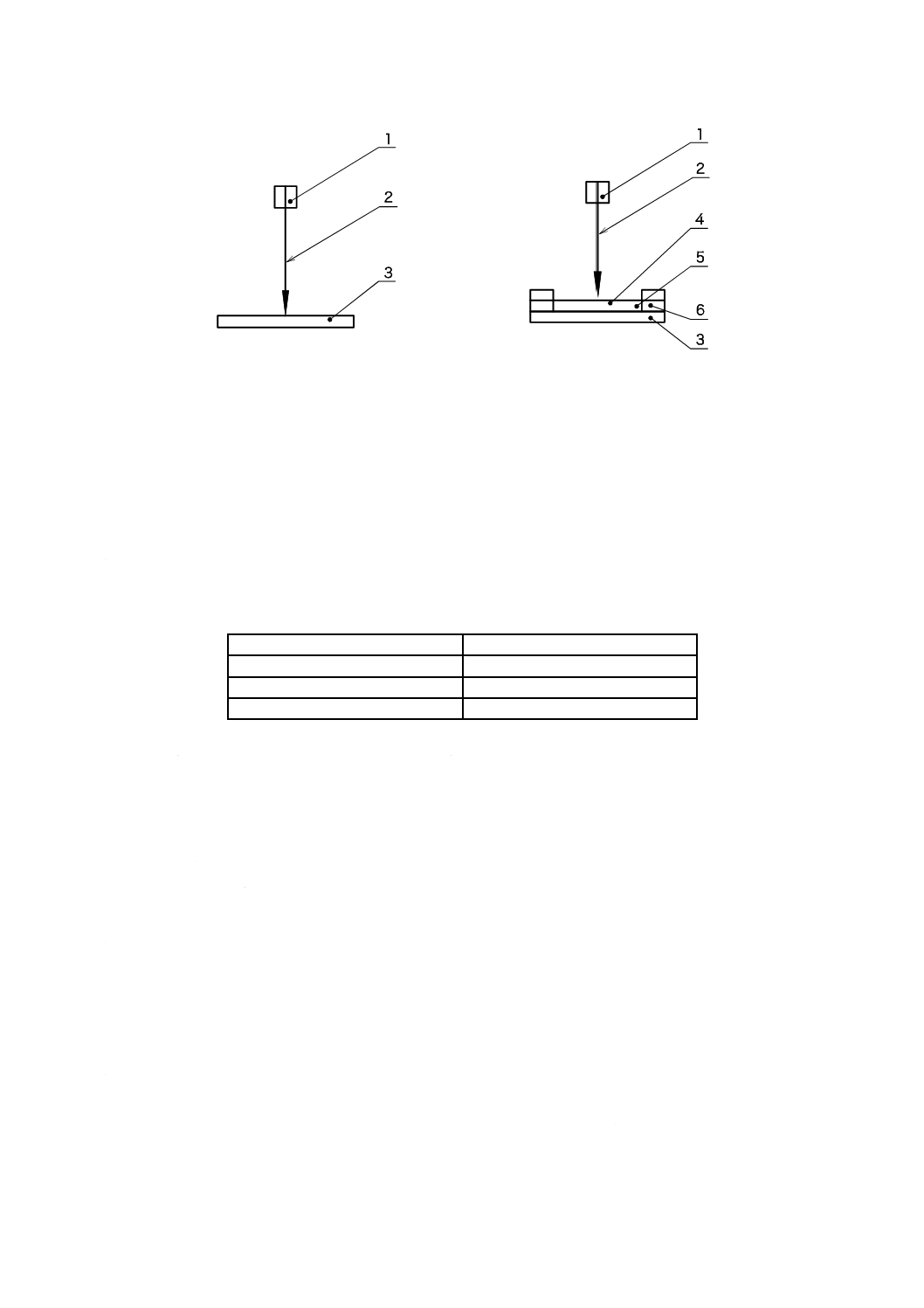
ごうしん(毫鍼)の構成及び各部分の名称を図1に示す。
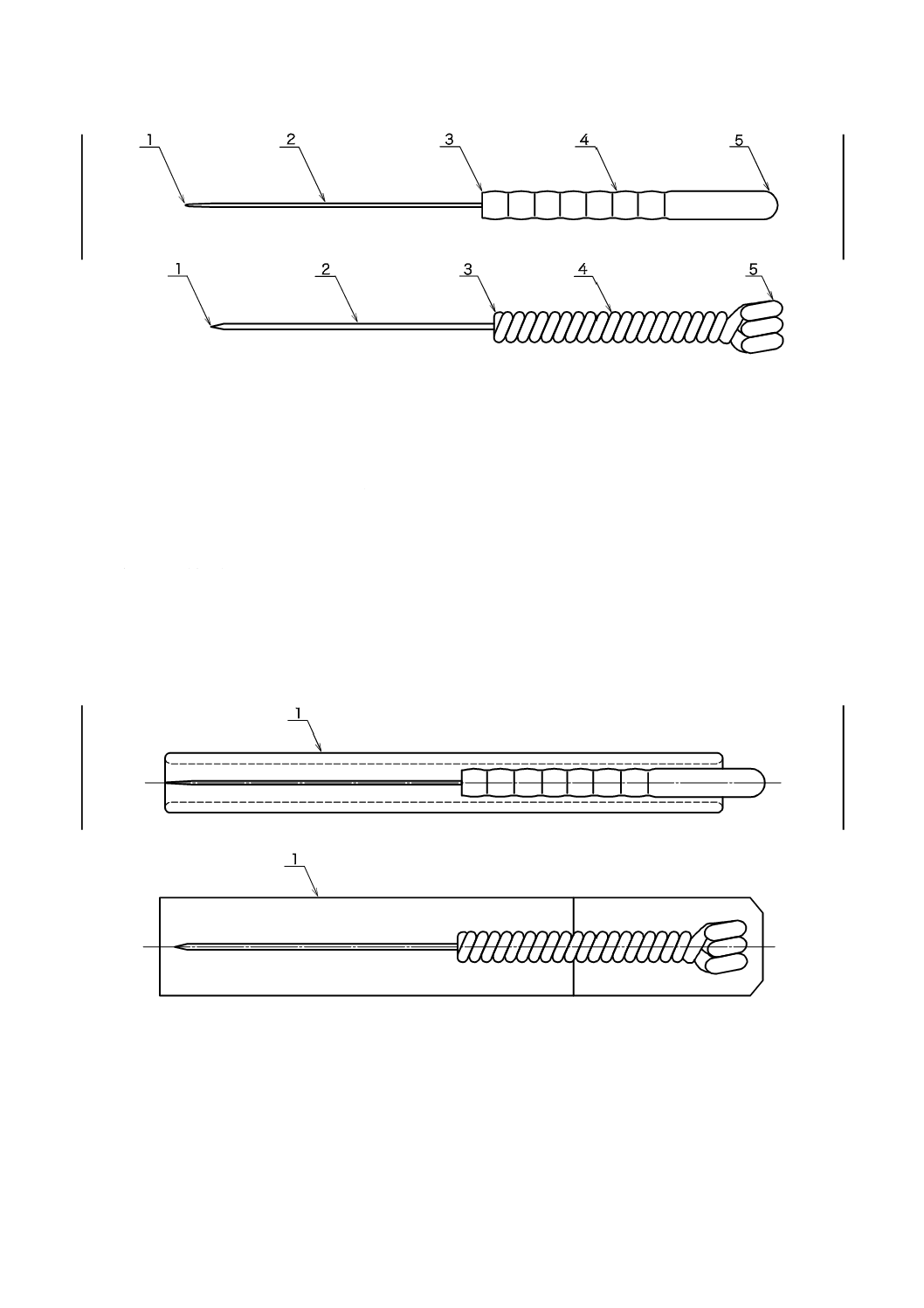
4
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
しんせん(鍼尖)
2
しん(鍼)体
3
しん(鍼)根
4
しん(鍼)柄
5
しん(鍼)尾
図1−ごうしん(毫鍼)の典型的な構造の例
4.2
ごうしん(毫鍼)の種類
ごうしん(毫鍼)には,次の二種類がある。
− しん(鍼)管の附属するもの
− しん(鍼)管の附属しないもの
しん(鍼)管が附属するごうしん(毫鍼)を図2に示す。ただし,しん(鍼)管の固定方法は,図2に
限らない。
1
しん(鍼)管
図2−しん(鍼)管付きのごうしん(毫鍼)
4.3
しん(鍼)柄の種類
しん(鍼)柄の種類は,リング,プレイン,花形,金属管,プラスチックなどがある。
ただし,しん(鍼)柄の種類は,図3に限らない(テープが附属する場合がある。)。
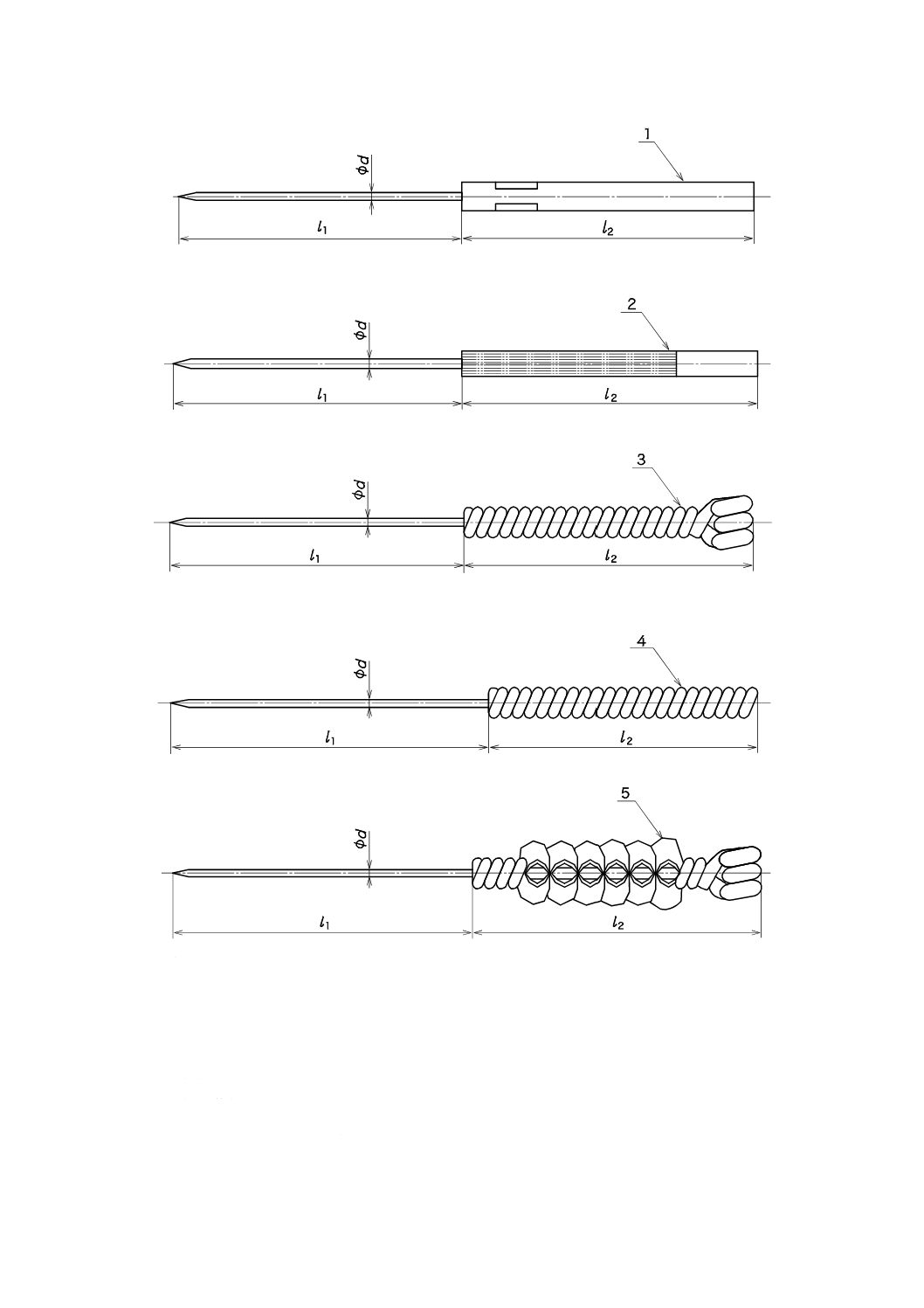
5
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
金属管しん(鍼)柄
2
プラスチックしん(鍼)柄
3
リングしん(鍼)柄
4
プレインしん(鍼)柄
5
花形しん(鍼)柄
l1
しん(鍼)体長
l2
しん(鍼)柄長
φd しん(鍼)体径
図3−ごうしん(毫鍼)のしん(鍼)柄の種類の例
6
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5
要求事項
5.1
材料
ごうしん(毫鍼)の生体適合性は,JIS T 0993-1の規定によって評価し,文書化しなければならない。
適合性確認は,次のいずれかによる。
a) 同様の臨床使用形態によって既に生体適合性を確認している材料を選択した場合
b) 既に流通している類似機器に使用しており,材料のトレーサビリティのエビデンスの観点から,ごう
しん(毫鍼)として使用することの妥当性も踏まえた生体適合性を確認している場合
c) 公表された試験手順に従って次の試験を実施し,生体適合性を確認した場合
1) 細胞毒性
2) 感作性
3) 皮内反応
4) エチレンオキサイドガス滅菌残留物(EO滅菌を行う場合)
しん(鍼)体の素材を変更する場合,及び/又は新しいコーティングを塗布する場合,もしこれらが人
体に対して副作用を起こすリスクの予見を示すならば,JIS T 0993-1によって試験を実施するのがよい。
注記 しん(鍼)体としん(鍼)柄の材料は,一定の規則はない。既に一般的に使用されている材料
には,ISO 15510:2010に規定されるX5CrNi18-9,X7CrNi18-9 Austenite Stainless Steelなどがあ
る。
5.1A しん(鍼)体の材料
しん(鍼)体の材料は,次のいずれか,又はこれらと同等以上の材料の中から一種類を選択して使用す
る。
a) JIS C 2502,JIS G 3521,JIS G 4308,JIS G 4309,JIS G 4314,JIS H 3270,JIS H 8620,JIS H 8622,
JIS T 6101,又はJIS T 6104のうちのいずれか一つ。
b) 附属書JA
c) 附属書JB
5.1B
しん(鍼)体の潤滑剤の材料
しん(鍼)体の潤滑剤としてシリコーン油を用いる場合,シリコーン油は,シリコーン油基準(II)又
はこれと同等以上の外国の基準に適合するものでなければならない。
5.1C はり(鍼)を電極として用いる場合のしん(鍼)体の材料
はり(鍼)を電極として用いる場合のしん(鍼)体の材料は,5.1Aのうち,JIS G 4308,JIS G 4309,
JIS G 4314のステンレス,又はこれらと同等以上の耐食性がある材料が望ましい。金しん(鍼)及び銀し
ん(鍼)は使用しないほうがよい。
なお,電極の材料は正極及び負極で同一の材料とする。
5.2
寸法
5.2.1
サイズ表記
サイズの表記は,次による。
a) ごうしん(毫鍼)のサイズは,次のように表記する。
1) ミリメートル表記による公称線径,しん(鍼)体が存在しない場合,しんせん(鍼尖)の最大径
2) ミリメートル表記による公称長さ
b) ごうしん(毫鍼)のサイズ表記はミリメートルで表し,公称線径×公称長さ(例えば,φ0.30×40 mm)
と表記する。
7
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.2.2
寸法の許容差
5.2.2.1
しん(鍼)体径
しん(鍼)体径は,次による。
a) マイクロメータ又は類似の道具を用いて測定する。しんせん(鍼尖)は含まない。
b) しん(鍼)体径を測ったとき,表1による。
c) はり(鍼)を電極として用いる場合のしん(鍼)体径は,φ0.20 mm以上であることが望ましい。
表1−しん(鍼)体径
単位 mm
しん(鍼)体径
許容差
0.25未満
±0.008
0.25以上 0.45以下
±0.015
0.45を超えるもの
±0.020
5.2.2.2
しん(鍼)体長
ノギス又は同等の道具を用い,しん(鍼)体長を測ったとき,表2による。
表2−しん(鍼)体長
単位 mm
しん(鍼)体長
許容差
25以下
±0.5
25を超え 60以下
±1.0
60を超え 100以下
±2.0
100を超えるもの
±3.0
5.2.2.3
しん(鍼)柄の寸法
しん(鍼)柄の寸法は,次による。
a) しん(鍼)柄は,目的の手技に適した直径及び長さでなければならない。
b) リングしん(鍼)柄,プレインしん(鍼)柄,及び花形しん(鍼)柄の製造においてコイル状に形成
するワイヤーの仕様は,表3に従うことが望ましい。
c) 円筒形で,かつ,プラスチックしん(鍼)柄,金属管しん(鍼)柄,又はしん(鍼)体に巻き付けず
に接合するコイル状のしん(鍼)柄は,しん(鍼)体径にかかわらず,しん(鍼)柄の直径が0.80 mm
以上,2.50 mm以下でなければならない。
表3−コイル状を形成するワイヤーの直径
単位 mm
しん(鍼)体径
コイル状を形成するワイヤーの直径
0.10以上 0.20未満
0.30
0.20以上 0.30未満
0.35
0.30以上 0.40未満
0.40
0.40以上 0.50未満
0.45
0.50以上 0.80未満
0.50

8
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.3
性能
5.3.1
外観及び清浄度
5.3.1.1
正常視力又は矯正視力での検査
正常視力又は矯正視力での検査は,次による。
a) しん(鍼)体の表面には,汚れ又は異物があってはならない。
b) しん(鍼)体は,真っ直ぐで,破損又は凹凸があってはならない。
c) しん(鍼)柄はきず又は切断などの原因となるいかなる突起があってはならない。コイル状に巻いて
作るしん(鍼)柄の場合,ら(螺)旋状のループは明確な隙間がなく対称的でなければならない。
d) しん(鍼)柄の色と光沢は,均一でなければならない。しん(鍼)柄にめっきがされている場合,層
状又は剝がれがあってはならない。
e) しん(鍼)体に潤滑剤を塗布する場合は,しん(鍼)体の表面に液滴として,潤滑剤が正常視力又は
矯正視力によって目視できてはならない。
5.3.1.2
10倍に拡大における検査
10倍に拡大における検査は,次による。
a) しん(鍼)体は,直線でいかなる破損又は凹凸があってはならない。
b) しん(鍼)体は,平滑で清浄でなければならず,異物又は金属加工時の付着物,荒れ,きず,曲がり,
溝,さび又はねじれのようなあきらかな欠陥があってはならない。
c) しんせん(鍼尖)は鋭く,鋭利に磨かれ,きず,片減り,スパイク状又は曲がりがあってはならない。
5.3.2
引抜き強さ
5.3.2.1
しん(鍼)体長が5 mm以上のごうしん(毫鍼)
しん(鍼)体長が5 mm以上のごうしん(毫鍼)は,次による。
a) しん(鍼)体をしん(鍼)柄としん(鍼)根とで確実に接合しなければならない。
b) しん(鍼)体の中心軸方向に対して,しん(鍼)体径に応じ表4の最小の静的力を負荷したとき,し
ん(鍼)体がしん(鍼)柄から引き抜けてはならない。
c) しん(鍼)体から3 mm以上しん(鍼)柄の軸が動いてはならない。
表4−しん(鍼)体長が5 mm以上の引抜力
しん(鍼)体径(mm)
引抜力(N)
0.10以下
5
0.10を超え 0.16以下
5.5
0.16を超え 0.20以下
7
0.20を超え 0.25以下
8
0.25を超え 0.35以下
15
0.35を超え 0.45以下
20
0.45を超え 0.55以下
25
0.55を超えるもの
30
5.3.2.1A しん(鍼)体長が5 mm未満のごうしん(毫鍼)
しん(鍼)体の中心軸方向に対して,しん(鍼)体長に応じ,表5の最小の静的力を負荷したとき,し
ん(鍼)体がしん(鍼)柄から引き抜けてはならない。
9
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5−しん(鍼)体長が5 mm未満の引抜力
しん(鍼)体長(mm)
引抜力(N)
2以下
1.5
2を超え 5未満
3
5.3.3
しん(鍼)体の硬さ
しん(鍼)体の材料がステンレスの場合,しん(鍼)体の硬さは,次による。
a) しん(鍼)体の硬さの評価はJIS Z 2244によるか,又はこれと同等の方法による。
b) しん(鍼)体の硬さは表6による。
c) 硬さは引張強さへ換算することもできる。硬さは,SAE J 417,Hardness Tests and Hardness Number
Conversionsの考え方で換算することができる。
表6−しん(鍼)体の硬さ
しん(鍼)体径(mm)
硬さ(HV 0.2)
0.25未満
480以上 680以下
0.25以上 0.30未満
460以上 655以下
0.30以上 0.45未満
450以上 655以下
0.45以上
420以上 630以下
5.3.4
しん(鍼)体の耐破損性
しん(鍼)体の耐破損性は,次による。
a) しん(鍼)体は,破損に十分耐えなければならない。
b) しん(鍼)体を,しん(鍼)体径の3倍の径の芯金に強く巻き付けたとき,そのしん(鍼)体にいか
なる割れ,折れ又は剝がれがあってはならない。
c) しん(鍼)体長が15 mm未満のはり(鍼)は2周,それ以上に長い場合は5周,巻き付けなければな
らない。
5.3.5
しんせん(鍼尖)のせん(穿)刺性及び強さ
5.3.5.1
概要
しんせん(鍼尖)は,良好な強さ及びせん(穿)刺性でなければならない。
5.3.5.2
しんせん(鍼尖)の鋭利さ及び強さ
しんせん(鍼尖)の鋭利さ及び強さは,次による。
a) 附属書Aに従い試験したとき,しんせん(鍼尖)は十分な強さがなければならない。
b) 押付力値まで負荷した後に,しんせん(鍼尖)にはフック又は曲がりがあってはならない。
c) 貫通抵抗力は表7に示した値を超えてはならない。しん(鍼)体の材料がステンレス以外の場合,こ
れに限るものではない。
d) 他の同等の方法も可能である。

10
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表7−押付力及び貫通抵抗力
しん(鍼)体径(mm)
押付力(N)
貫通抵抗力(N)
0.12以下
0.2
0.5
0.12を超え 0.25以下
0.4
0.7
0.25を超え 0.35以下
0.5
0.8
0.35を超え 0.45以下
0.6
0.9
0.45を超えるもの
0.7
1.0
5.3.5.3
しんせん(鍼尖)せん(穿)刺性
しんせん(鍼尖)せん(穿)刺性は,次による。
a) 附属書Bに従い試験したとき,しんせん(鍼尖)はせん(穿)刺性がよいことが望ましい。
b) 貫通抵抗力が小さければしんせん(鍼尖)が鋭利であることを示す。
c) この方法は,各製造業者のしんせん(鍼尖)によって選ぶことができる。
5.3.6
しん(鍼)体の耐腐食性
しん(鍼)体の耐腐食性は,次による。
a) しん(鍼)体は,耐食性に優れていなければならず,保管条件を満たすとき,しん(鍼)体は,使用
期限まで腐食してはならない。
b) 附属書Cに従い試験したとき,しん(鍼)体の浸せき部は,試験後に腐食があってはならない。附属
書Cはステンレス製のしん(鍼)体にだけ適用する。
5.4
滅菌保証
滅菌済み単回使用ごうしん(毫鍼)は,滅菌を保証するために,検証された滅菌工程で滅菌されなけれ
ばならない。
注記1 適切な滅菌方法は,附属書Dを参照。
注記2 医療機器の滅菌手順の日常管理及びバリデーションの要求事項は,ISO 11135-1,ISO 11137-1
及びISO 17665-1に規定されている。
5.4A 化学的要求事項
5.4A.1 抽出物の酸性・アルカリ性の限度
抽出液をpHメータと電極とを用いて測定し,pH値はコントロール溶液のpH値との差が1以内とする。
抽出液は,次による。
a) しん(鍼)体25本をほうけい酸ガラスでできた適切な容器を用いて試験水250 mLに浸せきする。
b) しん(鍼)体の全表面は試験水に接触するようにする。
c) その試験水を3730
+ ℃,60±2分間保つ。しん(鍼)体を取り除き,しん(鍼)体の外面から全ての
試験水を容器に戻すようにする。
5.4A.2 溶出金属の制限
5.4A.1のa) 〜c) によって用意された抽出液を原子吸光光度法などの微量分析法によって試験し,対照
液の金属含量が正しいとき,鉛,亜鉛,鉄の総量は,5 mg/L以下とする。また,カドミウムの抽出液の含
量は,対照液の正しいカドミウム含量のとき,0.1 mg/L以下とする。
5.4B
エンドトキシン試験
しん(鍼)体10本を取り,硬質ガラス容器に入れ,エンドトキシン試験用水30 mLを加え,融封又は
適切なせんで密封してよく振り混ぜた後,室温で1時間放置する。この溶液を試験液とし,日本薬局方の
11
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
エンドトキシン試験法によって試験を行うとき,0.5 EU/mL未満となるようにする。
6
包装
6.1
一次包装
目視検査で一次包装内に異物があってはならず,一次包装は通常の取り扱い,輸送及び保管中に内容製
品を適切に保護できるものとする。
滅菌済みしん(鍼)の場合は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することがで
き,一度開封したら包装は簡単に再シールできず,開封されたことが容易に分からなければならない。
注記 最終滅菌済み医療機器の材料,滅菌バリアシステム,及び包装システムの要求事項はISO
11607-1に規定されている。
6.2
二次包装
二次包装は,次による。
a) 二次包装は,一つ又は複数の一次包装を包装する。
b) 二次包装は出荷,輸送及び保管の際,内容物を守るために頑丈でなければならない。
c) 一つ又は複数の二次包装は,保管又は運送用箱に包装する場合がある。
7
表示
7.1
一次包装
一次包装には,次の事項を表示する。一次包装が小さく,表示できない場合には,ミシン目でつながっ
た一連とみなせる包装に表示する。
a) しん(鍼)体の線径及び長さ(mm)
b) 滅菌しん(鍼)の場合“滅菌済み”,“sterile”等滅菌済みの旨
c) 製造番号又は製造記号
d) 使用期限
7.2
二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いず,一次包装を最小販売単位の包装とし
て用いる場合は,次の事項を一次包装に表示する。
a) 製造業者又は輸入販売業者の氏名若しくは名称,及び住所
b) 医療機器の承認番号又は認証番号
c) 販売名
d) しん(鍼)体の線径及び長さ(mm)
e) 数量(入り数)
f)
滅菌しん(鍼)の場合“滅菌済み”,“sterile”等滅菌済みの旨
g) 一回限りの使用の旨(“ディスポーザブル”の表現を除く。)
h) きゅう(灸)頭しん(鍼)として使用する場合,ごうしん(毫鍼)を構成する全ての材料は,きゅう
(灸)の温度に耐えるものである。耐えない材料が使われている場合,きゅう(灸)頭しん(鍼)と
しては使用できない旨。また,施きゅう(灸)に当たっては局所のやけど(火傷)が生じないように
注意する旨。
i)
しん(鍼)体材料
j)
製造番号又は製造記号
12
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
k) 滅菌しん(鍼)の場合,滅菌年月
l)
使用期限
注記 製造番号又は製造記号が滅菌年月を表している場合,改めて滅菌年月の表示は必要ない。また,
滅菌年月の代わりに使用期限を表示してもよい。
8
輸送及び保管
8.1
輸送
輸送の要求事項は,契約内容に従うことが望ましい。
8.2
保管
保管は,次による。
a) はり(鍼)を損傷から十分保護することが望ましい。
b) はり(鍼)を包装した後は,清潔及び,換気の良い汚染されていない環境で保管することが望ましい。
c) 保管環境は湿度,温度,及び直射日光に対する管理をすることが望ましい。
13
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(参考)
しんせん(鍼尖)の強さ及び鋭利さ試験方法
A.1 概要
概要は,次による。
a) しんせん(鍼尖)の強さ しんせん(鍼尖)を垂直に鉄製台座に強く押し付けたときの耐破損性能力
b) しんせん(鍼尖)の鋭利さ アルミホイルにはり(鍼)を垂直に貫通させるのに,しんせん(鍼尖)
が必要とする力
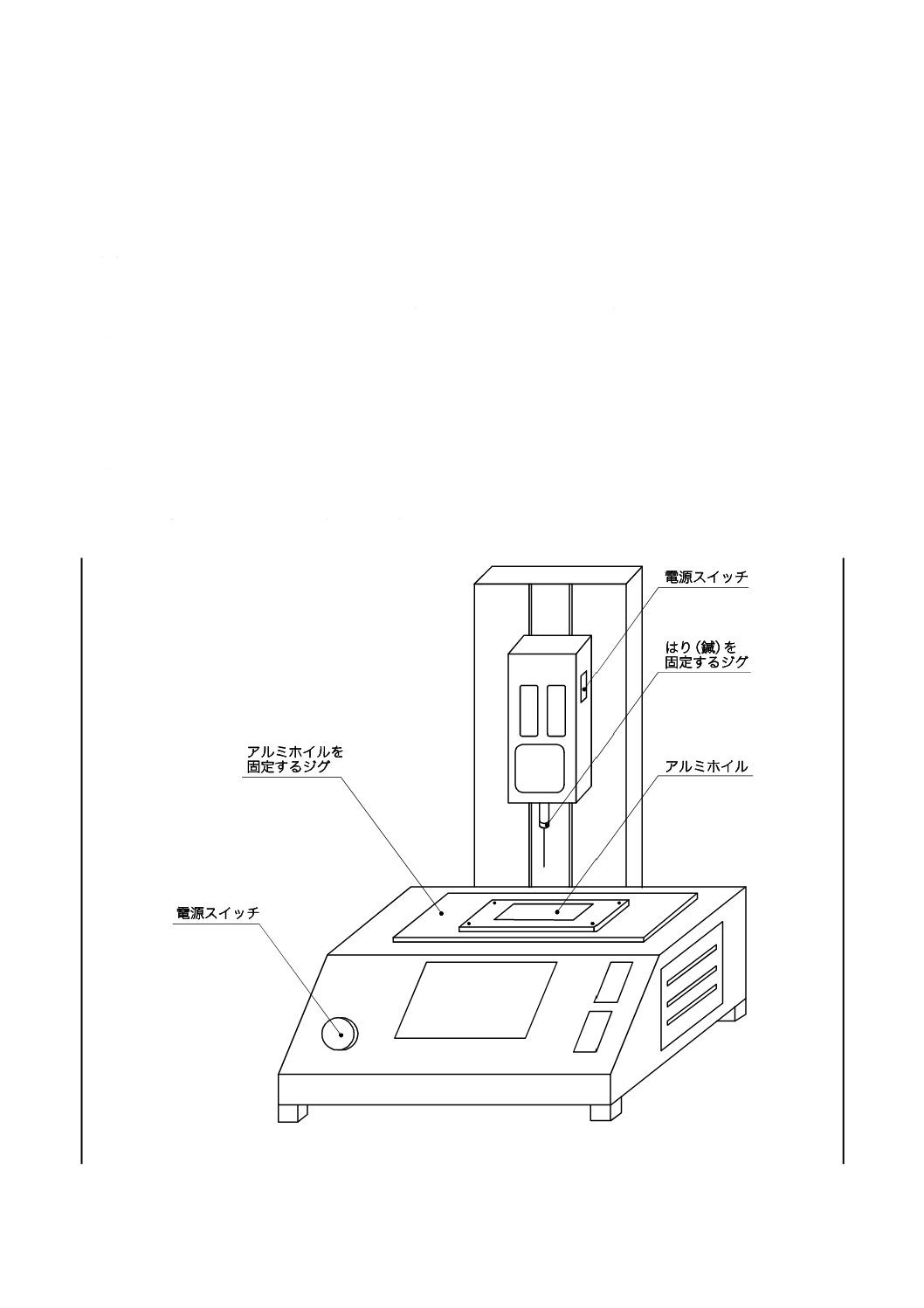
A.2 測定装置
測定装置は,次による。
a) しんせん(鍼尖)の鋭利さと強さを測定する典型的な装置を図A.1及び図A.2に示す。これらは同様
の性能及び精度(装置に附随するアンプ,データ解析,ディスプレイユニット,プリンター,フロッ
ピーディスク及びその他のデバイスを含む。)であれば他の装置を使用することもできる。
図A.1−測定装置の例
14
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
電源スイッチ
2
ファンクションスイッチ
3
ファンクションスイッチ
4
ファンクションスイッチ
5
アルミホイルを固定するジグ
6
はり(鍼)を固定するジグ
7
調整棒
8
水準器
図A.1−測定装置の例(続き)
15
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
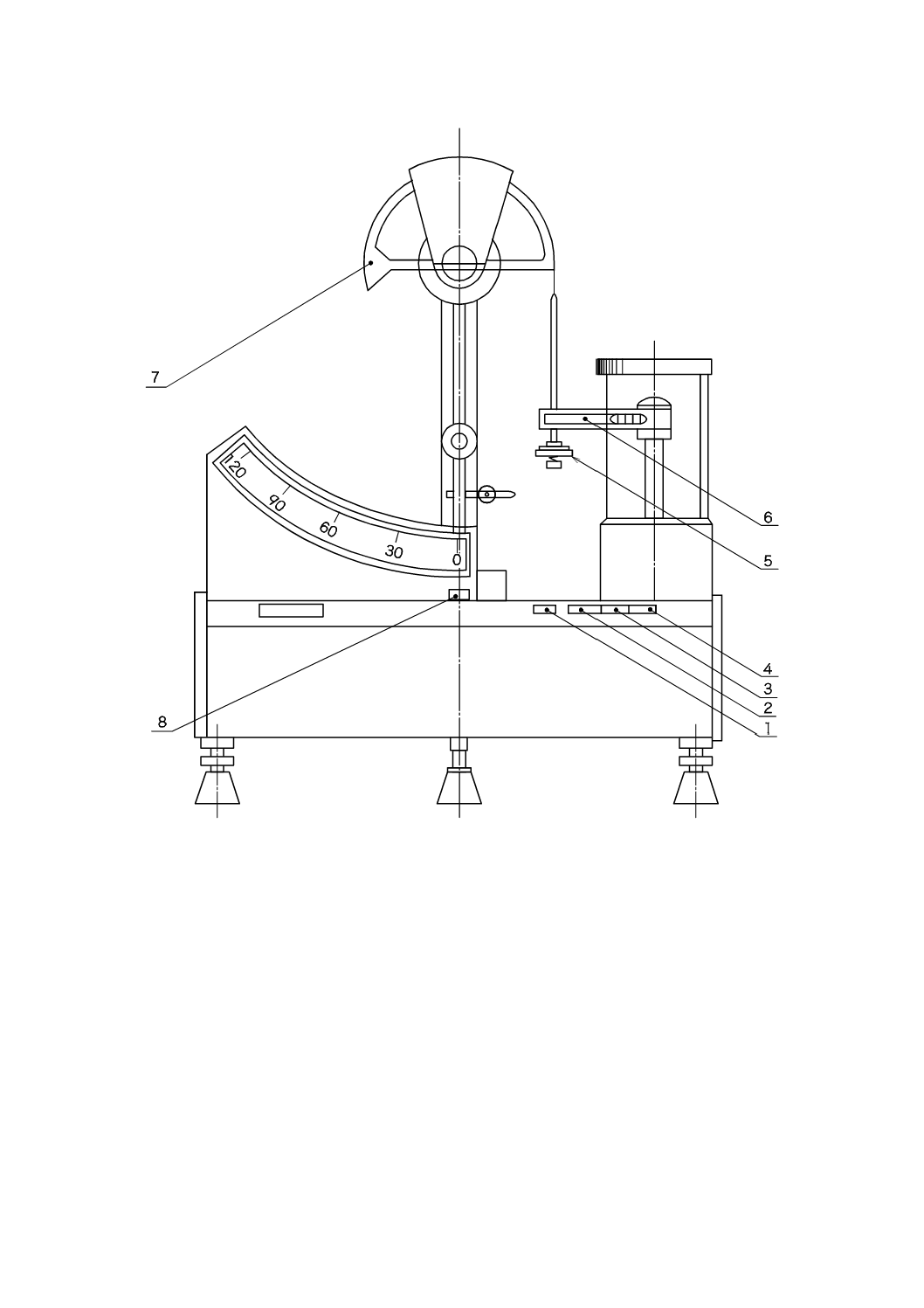
1
クランプヘッド
2
しん(鍼)体
3
鉄製台座
4
刺される材料
5
隙間
6
金属板
図A.2−しんせん(鍼尖)の鋭利さと強さの試験の原理
b) 装置のレンジ,最小値及び速度は,表A.1による。
表A.1−しん(鍼)体の強さ
項目
指定
レンジ
1.2 N以下
最小値
0.01 N
速度
0.1 mm/s以下
c) 装置の指示値の誤差は,0.01 N以下でなければならない。
d) 装置には,自動校正と衝撃吸収が備わっていること及び,はり(鍼)のクランプは試験中安定である
ことが望ましい。
e) 装置の伝達は,高感度で信頼できることが望ましい。
f)
装置の誘導開始初期値は0.02 N以下であることが望ましい。
g) アルミホイル固定装置の開口は5 mm,アルミホイルは固定後に緩みがあってはならない,かつ,平
らであることが望ましい。
h) サンプルのしんせん(鍼尖)の強さの鉄製台座表面は,平滑でさびがないことが望ましい。
A.3 アルミホイル
アルミホイルは,次による。
a) アルミホイル面は清潔で,平滑で,重なりがなく,しわ,白さび又は砂穴がないことが望ましい。
b) アルミホイルは柔軟な材料であり,また,0.05±0.002 mmの厚さ,及び99.5 %以上の純度であること
が望ましい。
c) アルミホイルの引張強さは,3 kg/mm2未満又は30 MPa未満,かつ,伸びは3 %以上であることが望
ましい。
16
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
A.4 手順
しんせん(鍼尖)の強さ検査は,しんせん(鍼尖)を5 mm露出させたはり(鍼)のサンプルを装置に
装着した後,しんせん(鍼尖)を垂直に鉄製台座へ押し付ける。表A.1に従い,力,速度,及び負荷を,
装置の数値が5.3.5.2の標準規定に届くまで増やしていき,数値が届いたとき,5〜10秒後に負荷を除く。
そして,サンプルのしんせん(鍼尖)を5倍の拡大鏡で観察し,屈曲又は引っ掛かりがないかを調べる。
さらに,コットンにしんせん(鍼尖)を当てて引いたときに,繊維が引っかからないかを確認する。
強さの検査後,サンプルのしんせん(鍼尖)は検査装置に装着したままにし,はり(鍼)がアルミホイ
ルに与える力を次第に増大させる。それに従い,揺れ動いていた棒(以下,振子棒という。)が反応を示す
はずである。はり(鍼)にかかっている力がアルミホイルの抵抗を超えたとき,しんせん(鍼尖)はアル
ミホイルを貫通し,電極に接触する。このとき,装置は力の増加を自動的に停止させ,振子棒上に検査装
置の針が指し示す値がしんせん(鍼尖)の貫通抵抗力を示している。別の機器の場合は,使用機器に応じ
て同等の手順を実施する。
オン・オフボタンを押し,振子棒及び検査装置の針が元の位置に戻るようにする。別の機器の場合は,
使用機器に応じて同等の手順を実施する。
孔と孔とがテストサンプルの3倍以上離れるようにアルミホイルを動かす。
A.5 試験報告
この試験報告は,次の情報を記載する。
a) しん(鍼)体の識別及びメートル法によるサイズ表記
b) 0.01 Nの位に四捨五入した貫通抵抗力
c) 試験日
17
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(参考)
しんせん(鍼尖)せん(穿)刺性試験方法
B.1
概要
この附属書に記載する試験方法は,模範的なものである。試験条件,試験材料,及び限界値をはり(鍼)
の特性及びサイズに従った標準及び基準値によって決めることが望ましい。したがって,試験装置の精度,
レンジ,及びセッティング状態に関しても,試験するはり(鍼)に合わせて方法を選ぶことが望ましい。
B.2
方法1−質的試験方法
直径100 mmのカップの口を,ISO 10282に従って手術用ラバーグローブの膜で覆い,輪ゴムできつく
締めて固定する。この膜をはり(鍼)で垂直に孔をあける。孔をあけているとき,膜のへこみが小さく抵
抗がほとんどなければ,このしんせん(鍼尖)は鋭いことを示す。そうでなければ,そのしんせん(鍼尖)
は鈍いということである。
注記 この方法は,はり(鍼)のせん(穿)刺性能によって品質評価をすることができ,購買者の相
互比較及び製品の品質管理に適している。
B.3
方法2−量的試験方法
B.3.1 せん(穿)刺力を評価する検査装置
装置は,次を備えることが望ましい。
a) 速度 V=50〜250 mm/min
b) 平均駆動精度 設定した駆動速度の±5 %以内
c) 50 N以下におけるセンサの平均精度 フルスケールの±5 %
d) 固定後の貫通用重合膜の直径が10 mmである。
注記1 測定のための代表的な装置とせん(穿)刺力の記録方法の概略図を図B.1に提示する。
注記2 その他の同様な性能と精度の装置を使用してもよい。
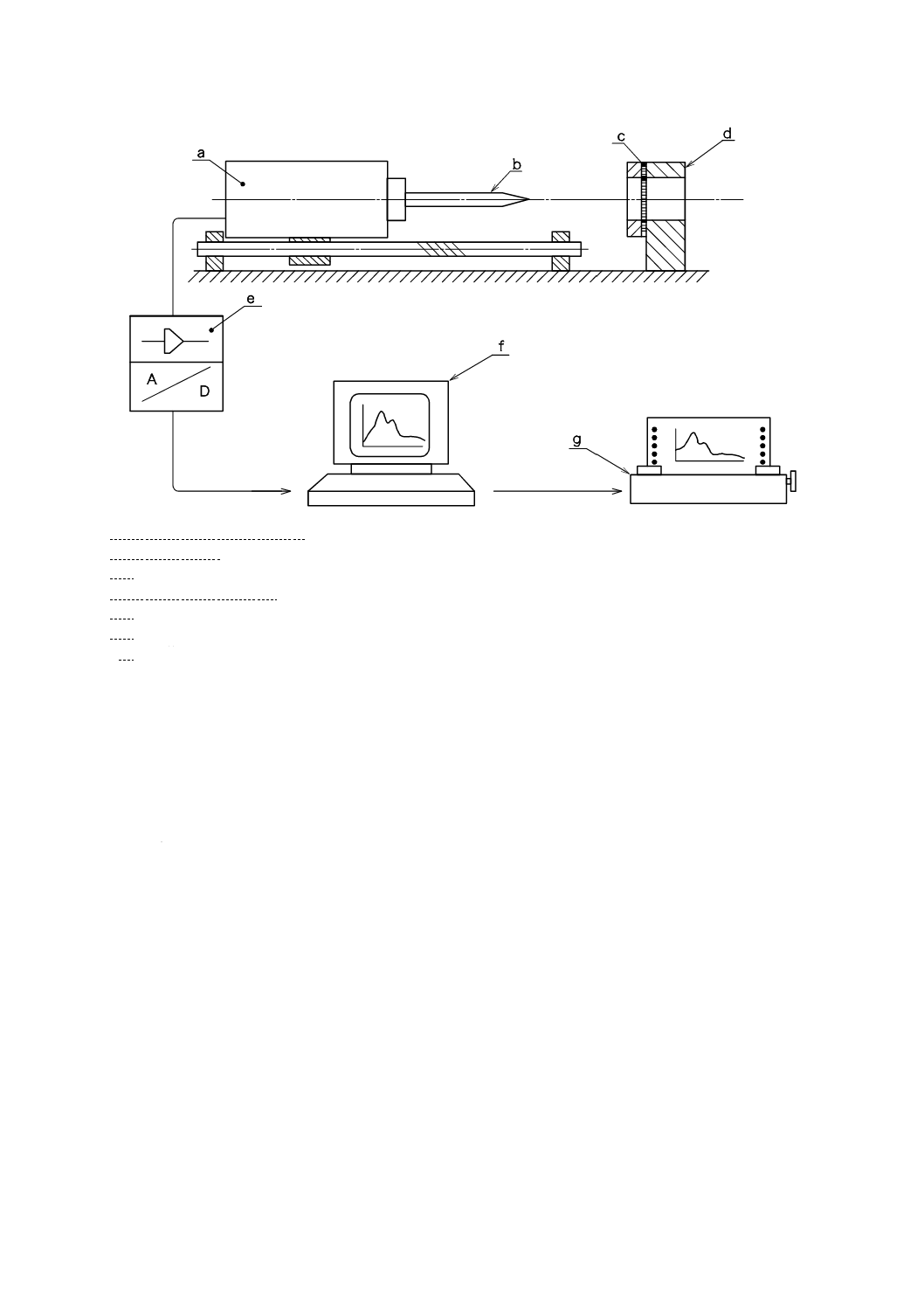
18
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
a
はり(鍼)を固定するジグ
b
しん(鍼)体
c
重合膜
d
重合膜を固定するジグ
e
AD変換器
f
記録計
g
出力装置
図B.1−代表的な試験装置の概略図
B.3.2 重合膜の素材
重合膜の素材は,次による。
a) 孔あけ検査に適した重合ワックスは0.35±0.05 mmの厚さの弾力性のあるものである。
b) ポリウレタンフィルムのデュロメータ硬さは,A 85±10である。
B.3.3 手順
重合膜は22±2 ℃のところに24時間静置し,同じ温度で検査も行う。
重合膜の一部を,適宜の長さだけ装置の上に垂直に固定する。重合膜は強く張られないほうがよい。重
合膜に精製処理された面がある場合,その面をしんせん(鍼尖)面にするのがよい。
検査に使うサンプルのしん(鍼)柄を固定した装置に取り付け,しん(鍼)体が重合膜の表面と垂直に
なるように固定する。このとき,しんせん(鍼尖)が膜の中央を刺すようにする。
駆動速度は100 mm/minである。検査装置の電源を入れる。重合膜に孔をあけ,対応する変位量に対す
る力をグラフに記録する。
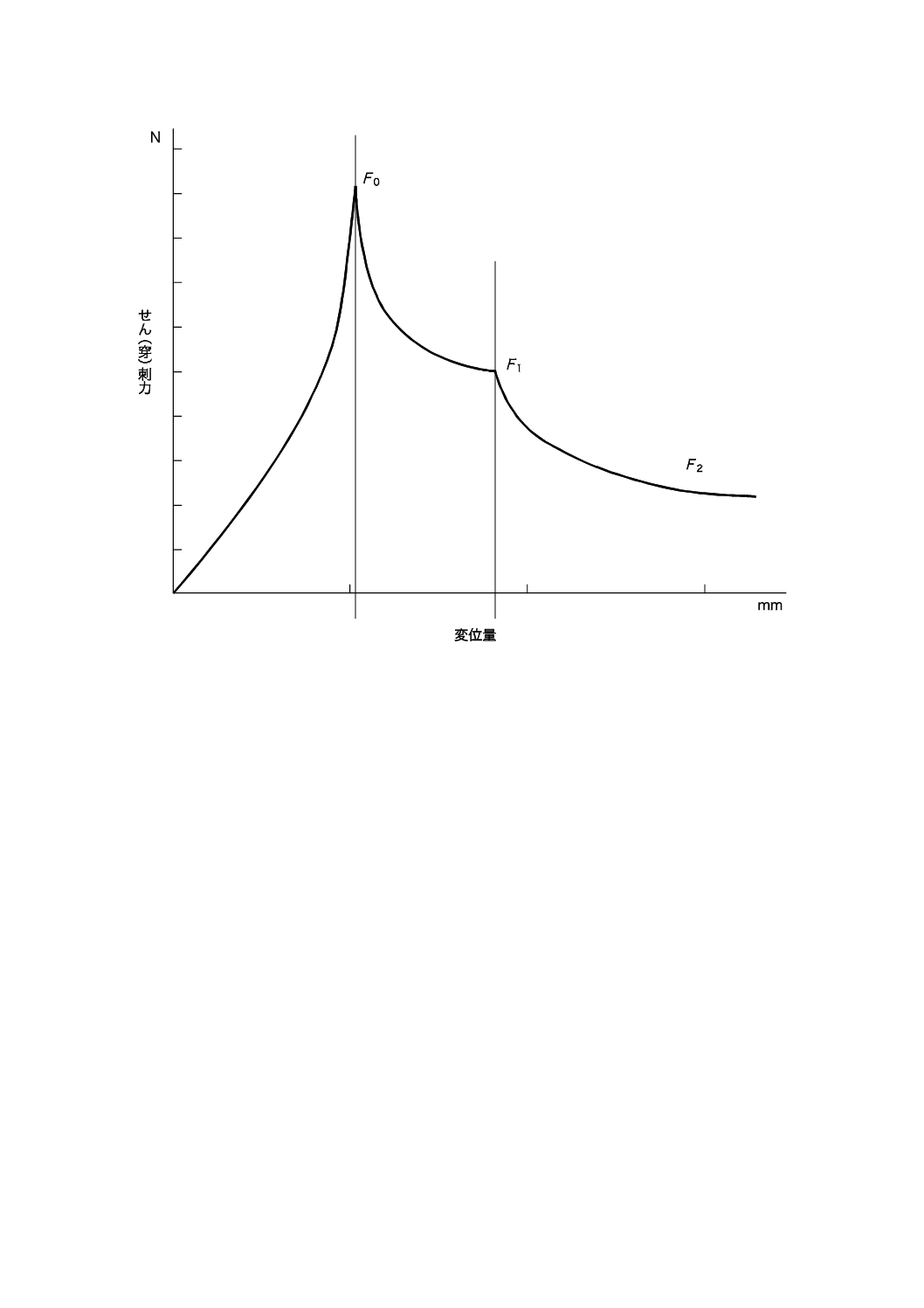
相当するピーク値F0,F1,及びF2を測定する。
重合膜の孔あけごとに,未使用又は孔あけが行われていない箇所を選ぶ。
B.3.4 座標図の最大値の記録
座標図の最大値の記録は,次による。
a) はり(鍼)が重合膜を貫通する間に示す特徴的なピーク値によって各力の値を特定する。
19
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) はり(鍼)が重合膜を貫通する典型的な特徴を図B.2に示す。
c) 典型的なはり(鍼)のせん(穿)刺力F0,F1,F2を図B.3に示す。
B.3.5 結果の表示
結果の表示は,次による。
a) 力と位置の関係を表す座標グラフを評価するには,既知の性質及び性能をもつ同種のはり(鍼)で比
較する。
b) せん(穿)刺性能は力のピーク値から判読できる。
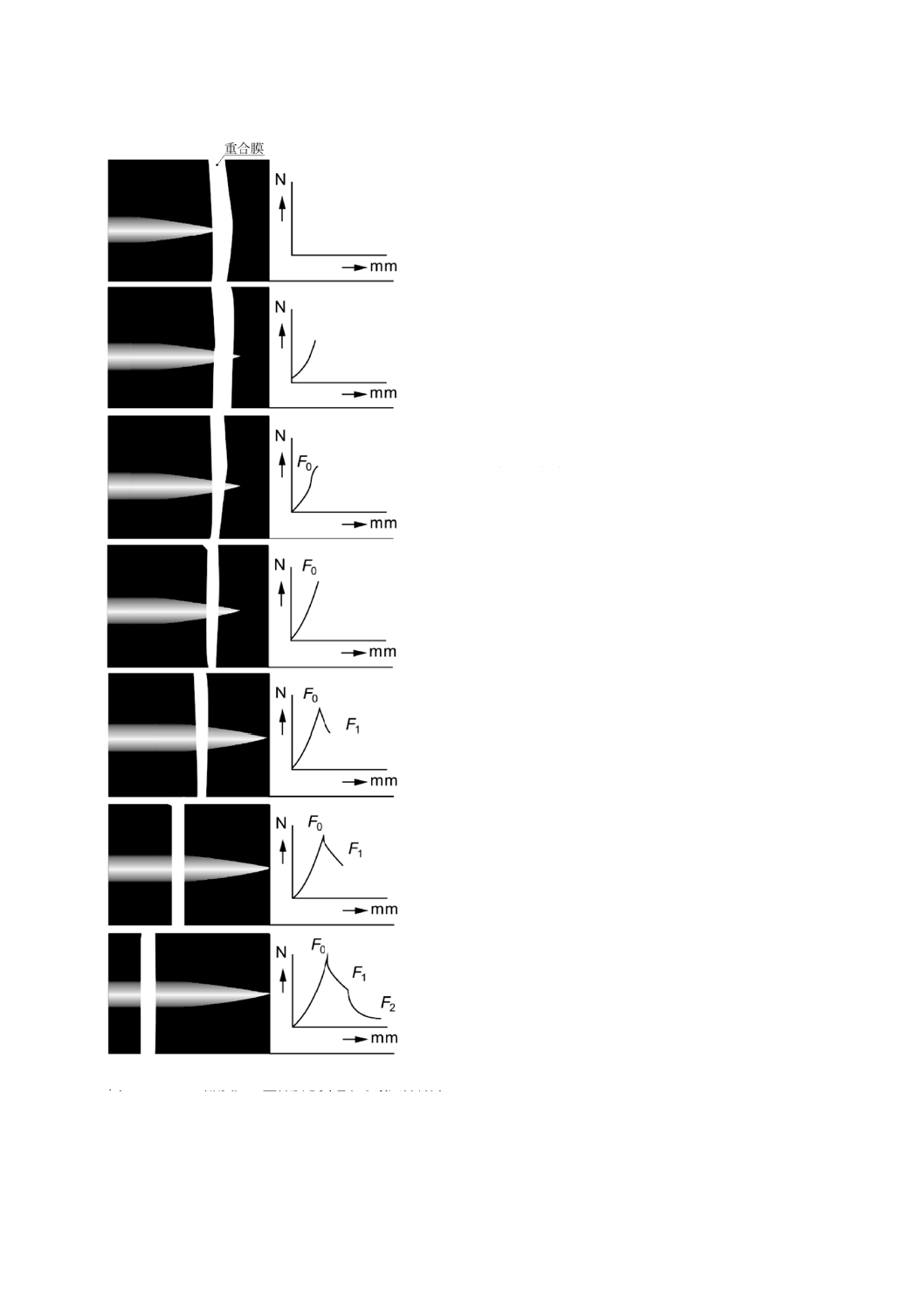
20
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
はり(鍼)の動きの初期状態。
はり(鍼)が重合膜に接触し,押付力が増加しF0に近づく。
はり(鍼)先が重合膜を貫通する。
はり(鍼)先のテーパ部分によって,重合膜が膨張し,F1へ押付
力が減少する。
はり(鍼)先のテーパ部分が重合膜を貫通する。
全てのテーパ部分が重合膜を貫通する。
はり(鍼)先の摩擦による押付力値はF2に減少する。
F0 しんせん(鍼尖)が重合膜を貫通する最大押付力
F1 はり(鍼)先のテーパ面が重合膜を通り抜けるときの最大値
F2 しん(鍼)体が重合膜を通り抜けるときの最大摩擦力
図B.2−はり(鍼)が重合膜を貫通するときの典型的な特徴を示す図
21
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図B.3−典型的なはり(鍼)のせん(穿)刺力を示す図
22
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(参考)
耐腐食性試験方法
C.1 原則
しん(鍼)体を塩化ナトリウム水溶液,又はクエン酸に部分的に特定の時間浸せき後,浸せき部と非浸
せき部との腐食の状態を比較する。
C.2 方法1−塩化ナトリウム水溶液による試験
C.2.1 試薬及び装置
C.2.1.1 試薬
試験水を使用したモル濃度0.5 mol/LのNaCl(分析グレード試薬)水溶液
C.2.1.2 装置
腐食試験用ほうけい酸ガラス製を選択
C.2.2 手順
しん(鍼)体であるオーステナイトステンレス,又は製造されたしん(鍼)体に付着した全ての油及び
ほこりを拭き取る。拭き取り後,テストサンプルを更に脱脂するためにアセトン又は,その他の有機溶剤
につける。サンプルを水洗し,試験水ですすぎ,後の使用のため置いておく。
23±2 ℃塩化ナトリウム水溶液(C.2.1.1)を入れたガラス容器(C.2.1.2)に,しん(鍼)体の一部をそ
の長さの約半分まで浸せきする。しん(鍼)体と液を23±2 ℃に7時間±5分間維持する。
しん(鍼)体を取り出し,拭いて乾燥させる。浸せきの影響による腐食の兆候を浸せきの有無部分で正
常視力又は矯正視力で比較し,浸せき部が腐食していないことを確認する。
C.3 方法2−クエン酸水溶液による試験
C.3.1 試薬及び装置
C.3.1.1 試薬
試験水を使用した100 g/L(濃度10 %)のクエン酸(分析グレード試薬)水溶液
C.3.1.2 装置
腐食試験用ほうけい酸ガラス製を選択
C.3.2 手順
しん(鍼)体であるオーステナイトステンレス,又は製造されたしん(鍼)体に付着した全ての油及び
ほこりを拭き取る。拭き取り後,テストサンプルを更に脱脂するためにアセトン又は,その他の有機溶剤
につける。サンプルを水洗し,試験水ですすぎ,後の使用のために置いておく。
クエン酸水溶液にサンプルを浸し,室温環境で5時間±5分間維持する。クエン酸水溶液からサンプル
を取り出し,試験水を使用して水洗する。ガラス容器にサンプルと試験水とを入れ30±5分間煮沸し,冷
却した後に室温環境の元で48±1時間保管する。
サンプルを取り出し,拭いて乾燥させる。しん(鍼)体の浸せき部と非浸せき部とを10倍に拡大し,正
常視力又は矯正視力で比較することで,しん(鍼)体の浸せき部が腐食していないことを確認する。
23
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
C.4 試験報告
この試験報告は,次の情報を記載する。
a) しん(鍼)体の識別及びメートル法によるサイズ表記
b) 浸せき部の腐食の有無
c) 試験日
24
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(参考)
参考文献
[1] ISO 780:1997,Packaging−Pictorial marking for handling of goods
[2] ISO 2859-1:1999,Sampling procedures for inspection by attributes−Part 1: Sampling schemes indexed by
acceptance quality limit (AQL) for lot-by-lot inspection
[3] ISO 3696:1987,Water for analytical laboratory use−Specification and test methods
[4] ISO 6507-2:2005,Metallic materials−Vickers hardness test−Part 2: Verification and calibration of testing
machines
[5] ISO 6507-3:2005,Metallic materials−Vickers hardness test−Part 3: Calibration of reference blocks
[6] ISO 7864:1993,Sterile hypodermic needles for single use
[7] ISO 7000:2012,Graphical symbols for use on equipment−Registered symbols
[8] ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices (Amendment 1 published
2001)
[9] ISO 10282:2002,Single-use sterile rubber surgical gloves−Specification
[10] ISO 10993-1:2009,Biological evaluation of medical devices−Part 1: Evaluation and testing within a risk
management process
[11] ISO 10993-5:2009,Biological evaluation of medical devices−Part 5: Tests for in vitro cytotoxicity
[12] ISO 10993-7:2008,Biological evaluation of medical devices−Part 7: Ethylene oxide sterilization residuals
[13] ISO 10993-10:2010,Biological evaluation of medical devices−Part 10: Tests for irritation and skin
sensitization
[14] ISO 10993-11:2006,Biological evaluation of medical devices−Part 11: Tests for systemic toxicity
[15] ISO 11135-1:2007,Sterilization of health care products−Ethylene oxide−Part 1: Requirements for
development, validation and routine control of a sterilization process for medical devices
[16] ISO 11137-1:2006,Sterilization of health care products−Radiation−Part 1: Requirements for development,
validation and routine control of a sterilization process for medical devices
[17] ISO 11137-2:2013,Sterilization of health care products−Radiation−Part 2: Establishing the sterilization dose
[18] ISO 11138-1:2006,Sterilization of health care products−Biological indicators−Part 1: General requirements
[19] ISO 11138-2:2006,Sterilization of health care products−Biological indicators−Part 2: Biological indicators
for ethylene oxide sterilization processes
[20] ISO 11607-1:2006,Packaging for terminally sterilized medical devices−Part 1: Requirements for materials,
sterile barrier systems and packaging systems
[21] ISO 11607-2:2006,Packaging for terminally sterilized medical devices−Part 2: Validation requirements for
forming, sealing and assembly processes
[22] ISO 11737-1:2006,Sterilization of medical devices−Microbiological methods−Part 1: Determination of a
population of microorganisms on products
[23] ISO 11737-2:2009,Sterilization of medical devices−Microbiological methods−Part 2: Tests of sterility
performed in the definition, validation and maintenance of a sterilization process
25
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[24] ISO 13485:2003,Medical devices−Quality management systems−Requirements for regulatory purposes
[25] ISO 14971:2007,Medical devices−Application of risk management to medical devices
[26] ISO 15223-1:2012,Medical devices−Symbols to be used with medical device labels, labelling and information
to be supplied−Part 1: General requirements
[27] ISO 15223-2:2010,Medical devices−Symbols to be used with medical device labels, labelling, and
information to be supplied−Part 2: Symbol development, selection and validation
[28] ISO 15510:2010,Stainless steels−Chemical composition
[29] ISO 17665-1:2006,Sterilization of health care products−Moist heat−Part 1: Requirements for the
development,validation and routine control of a sterilization process for medical devices
[30] EN 980:2008,Graphical symbols for use in the labelling of medical devices
[31] EN 1041:2008,Information supplied by the manufacturer of medical devices
[32] EN 10088-1:2005,Stainless steels. List of stainless steels
[33] WFAS STANDARD-001:2012,Acupuncture needles
[34] GB/T 1031-1995,Surface roughness parameters and their values
[35] GB 2024-1994,Acupuncture needles
[36] GB/DRT 2024-2010,Acupuncture needles (Draft standard)
[37] KS P 3007:2009,Sterile disposable acupuncture needle
[38] YY 0043-2005,Medical suture needle
[39] YY/T 0149-2006,Medical instruments of stainless steel−Test methods of corrosive resistance
[40] YY 0666-2008,Method for the test of sharpness and strength of needles tips
[41] 93/42/EEC,Council Directive 93/42/EEC of 14 June 1993 concerning medical devices
[42] 2007/47/EC,Directive of the European Parliament and of the Council of 5 September 2007 amending Council
Directive 90/385/EEC on the approximation of the laws of the Member States relating to active implantable
medical devices,Council Directive 93/42/EEC concerning medical devices and Directive 98/8/EC concerning
the placing of biocidal products on the market
26
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(規定)
金しん(鍼)材料
JA.1 概要
この附属書は,金しん(鍼)の線材について規定する。
JA.2 金しん(鍼)線材
線材は金,銀,銅及び亜鉛で構成され,主成分である金の含有量によって表JA.1の三つに分類する。
表JA.1−金しん(鍼)線材
規格名称
成分
金しん(鍼)A
金91〜100 %,銀0〜9 %,銅0〜9 %,亜鉛0〜9 %
金しん(鍼)B
金81〜90 %,銀0〜19 %,銅0〜19 %,亜鉛0〜19 %
金しん(鍼)C
金71〜80 %,銀0〜29 %,銅0〜29 %,亜鉛0〜29 %
JA.3 材折り曲げ試験
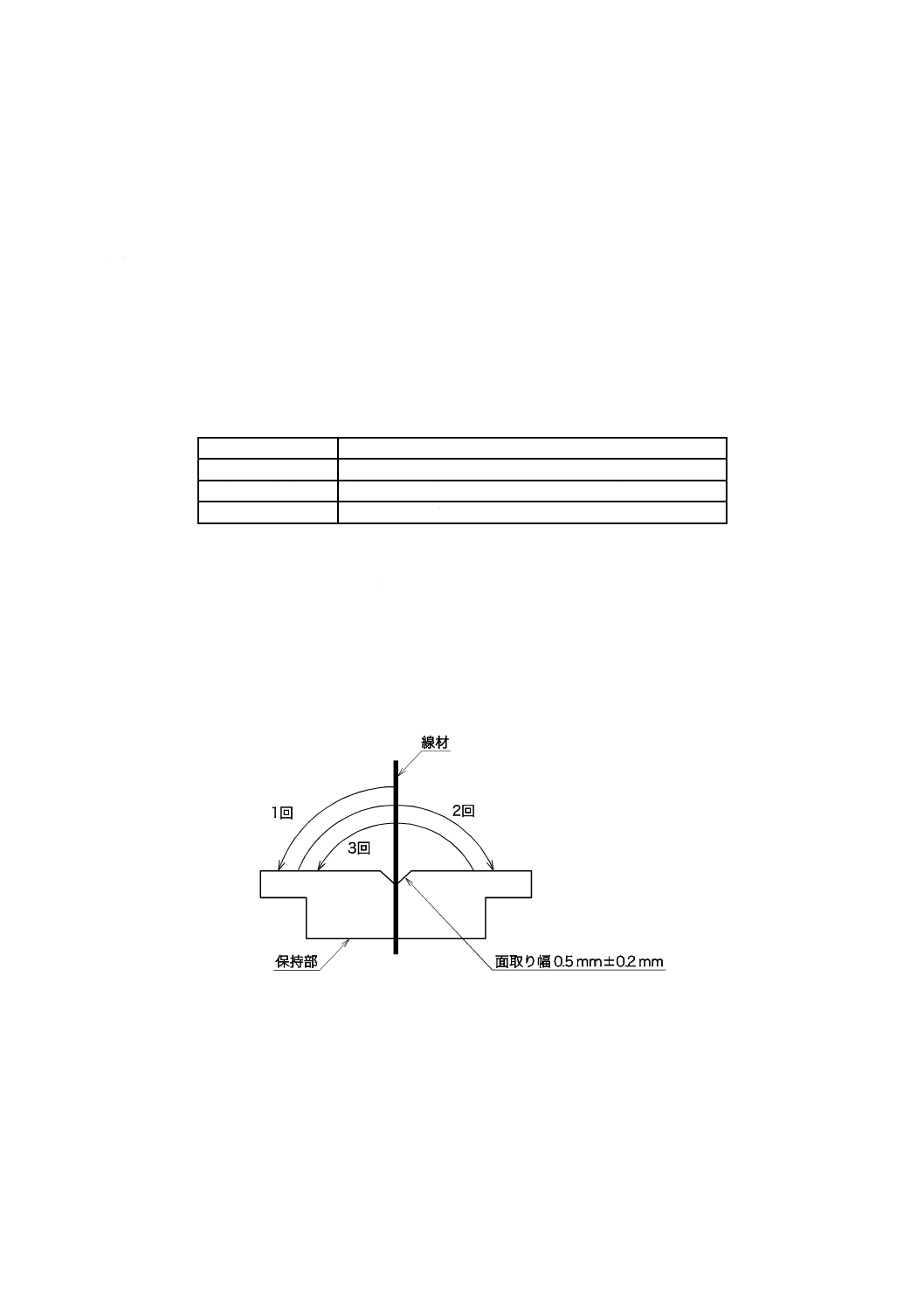
材折り曲げ試験は,図JA.1のように線材を保持し,次のとおり矢印の方向へ折り曲げる。
− (1回目)90度折り曲げ
− (2回目)180度反対に折り返す
− (3回目)180度反対側に戻す
試験は,被検査ロットから折り曲げ試験試料10本をサンプリングし,次のとおり実施する。
図JA.1−金しん(鍼)線材折り曲げ試験法
JA.4 検査
この試験は使用線径規格ごとに実施するものとし,判定基準は次のとおりとする。
サンプル10本中7本以上が,3回以上の折り曲げに耐えて,切断しない。

27
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.5 線径の許容差
線径の公称線径に対する許容差は,表JA.2による。
表JA.2−線径の許容差
単位 mm
線径
許容差
0.10以下
±0.005
0.10を超え 0.20以下
±0.006
0.20を超え 0.40以下
±0.008
0.40を超えるもの
±0.010
28
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JB
(規定)
銀しん(鍼)材料
JB.1
概要
この附属書は,銀しん(鍼)の線材について規定する。
JB.2
銀しん(鍼)線材
線材は,銀・銅・亜鉛・ニッケルで構成され,主成分である銀の含有量によって表JB.1の四つに分類す
る。
表JB.1−銀しん(鍼)線材
規格名称
成分
銀しん(鍼)A
銀91〜100 %,銅0〜9 %,亜鉛0〜9 %,ニッケル0〜0.5 %
銀しん(鍼)B
銀81〜90 %,銅0〜19 %,亜鉛0〜19 %,ニッケル0〜0.5 %
銀しん(鍼)C
銀71〜80 %,銅0〜29 %,亜鉛0〜29 %,ニッケル0〜0.5 %
銀しん(鍼)D
銀61〜70 %,銅0〜39 %,亜鉛0〜39 %,ニッケル0〜0.5 %
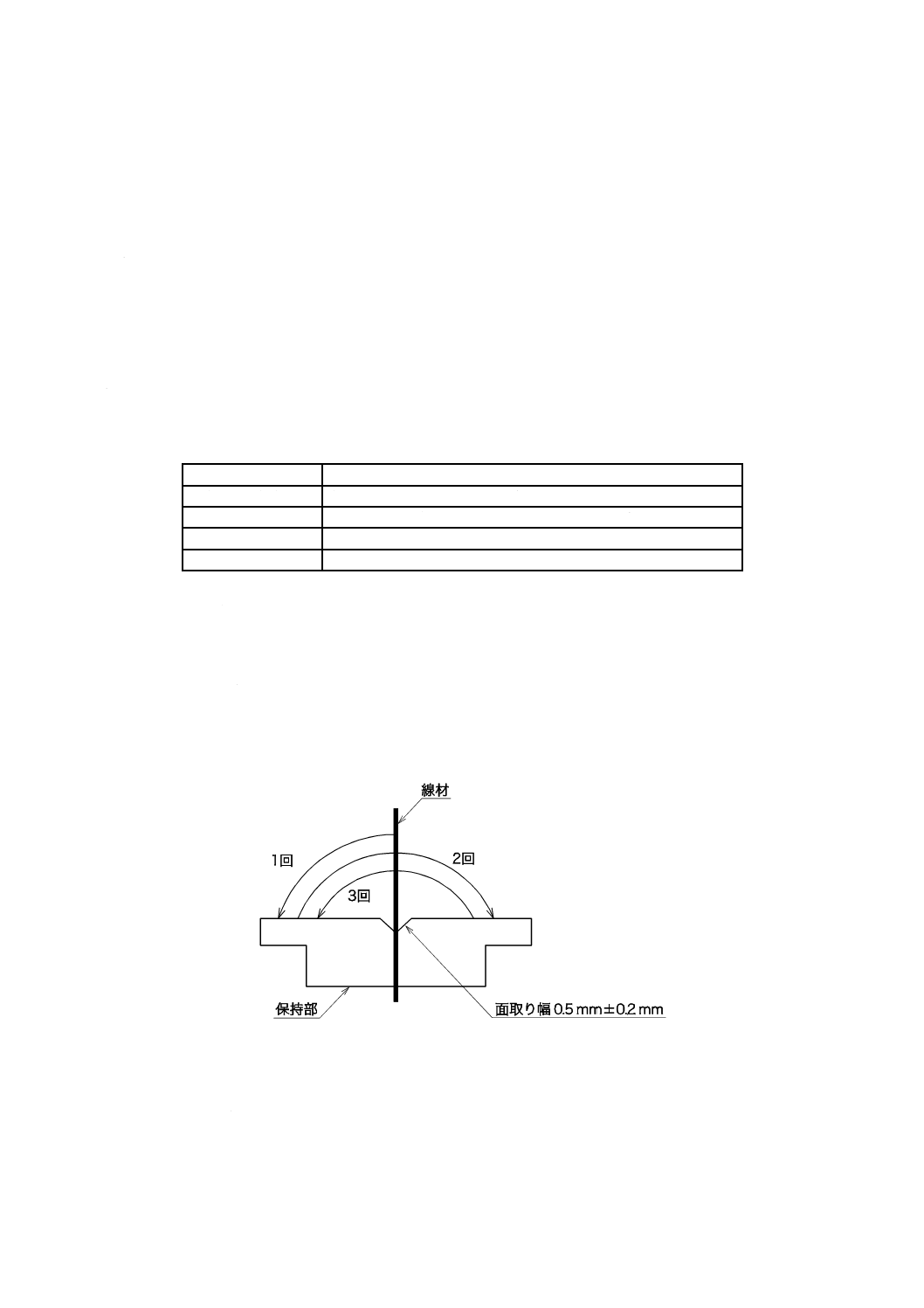
JB.3
材折り曲げ試験
材折り曲げ試験は,図JB.1のように線材を保持し,次のとおり矢印の方向へ折り曲げる。
− (1回目)90度折り曲げ
− (2回目)180度反対に折り返す
− (3回目)180度反対側に戻す
試験は,被検査ロットから折り曲げ試験試料10本をサンプリングし,次のとおり実施する。
図JB.1−銀しん(鍼)線材折り曲げ試験法
JB.4
検査
この試験は使用線径規格ごとに実施するものとし,判定基準は次のとおりとする。
サンプル10本中7本以上が,3回以上の折り曲げに耐えて,切断しない。

29
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JB.5
線径の許容差
線径の公称線径に対する許容差は,表JB.2による。
表JB.2−線径の許容差
単位 mm
線径
許容差
0.10以下
±0.005
0.10を超え 0.20以下
±0.006
0.20を超え 0.40以下
±0.008
0.40を超えるもの
±0.010

30
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
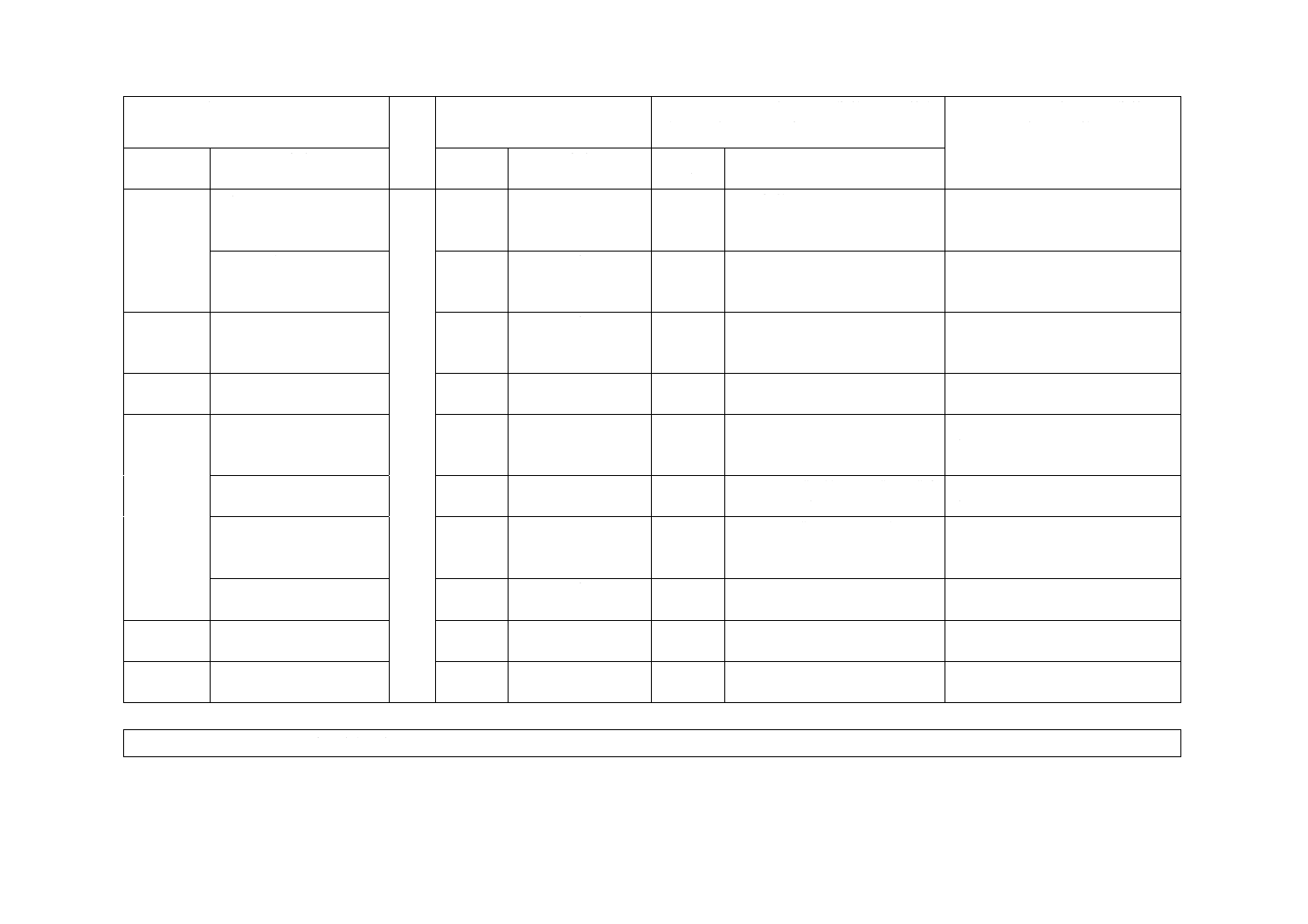
附属書JC
(参考)
JISと対応国際規格との対比表
JIS T 9301:2016 単回使用ごうしん(毫鍼)
ISO 17218:2014,Sterile acupuncture needles for single use
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 滅菌しん(鍼)及び未滅
菌しん(鍼)の両方を規
定
1
滅菌しん(鍼)につ
いてだけ規定
変更
ISO規格にはない未滅菌しん
(鍼)について規定した。
旧JISで規定していた未滅菌のご
うしん(毫鍼)を引き続き対象とす
るため。
3 用語及び
定義
3.6 滅菌しん(鍼)(sterile
acupuncture needle)
3.6
JISとほぼ同じ
追加
“ごうしん(毫鍼)であって,
製造工程で滅菌し,滅菌済みと
表示し,そのまま直ちに使用で
きるもの。”を追加した。
旧JISから引用
3.9 一次包装(primary
package)
3.9
JISとほぼ同じ
追加
“ごうしん(毫鍼)を直接に覆
う包装で,物理的に保護するた
めのものをいう。さらに,これ
が二次包装される場合,いわゆ
る“内袋”に該当する。滅菌し
ん(鍼)については,ごうしん
(毫鍼)の無菌性を保持するた
めの性能をもつ。”を追加した。
旧JISから引用
3.10 二次包装(secondary
package)
3.10
JISとほぼ同じ
追加
“一次包装を直接に覆う包装に
おいて,通常,複数の一次包装
されたごうしん(毫鍼)(例え
ば,100本入るもの)をいう。”
を追加した。
旧JISから引用
3.11 公称線径
−
−
追加
ISO規格にはない公称線径の定
義を追加した。
旧JISから引用
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
31
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及び
定義
(続き)
3.12 公称長さ
−
−
追加
ISO規格にはない公称長さの定
義を追加した。
旧JISから引用
3.13 試験水
−
−
追加
ISO規格にはない試験水の定義
を追加した。
旧JISから引用
3.14 エンドトキシン試験
用水
−
−
追加
ISO規格にはないエンドトキシ
ン試験用水の定義を追加した。
旧JISから引用
3.15 未滅菌しん(鍼)
−
−
追加
ISO規格にはない未滅菌しん
(鍼)の定義を追加した。
旧JISから引用
4 構成
4.1 ごうしん(毫鍼)の構
成
4.1
JISとほぼ同じ
追加
我が国において一般的に流通及
び使用されているごうしん(毫
鍼)の典型的な構造の例を追加
した。
利用者の利便性のため。
4.2 ごうしん(毫鍼)の種
類
4.2
JISとほぼ同じ
追加
我が国において一般的に流通及
び使用されているしん(鍼)管
付きのごうしん(毫鍼)を追加
した。
利用者の利便性のため。
4.3 しん(鍼)柄の種類
4.3
JISとほぼ同じ
追加
JISではテープが附属する場合
があると規定した。
旧JISから引用
5 要求事項 5.1 材料
5.1
JISとほぼ同じ
削除
“公表されたデータから,材料
の同等性を確認できる場合”を
削除した。
我が国の薬事申請において,公表さ
れたデータだけで前例データとみ
なすと誤解が生じるため。
5.1A しん(鍼)体の材料
5.1
JISとほぼ同じ
追加
ISO規格にはないしん(鍼)体
の材料の選択について規定し
た。
旧JISから,しん(鍼)体材料の引
用は有用であるため継続すること
としたが,他の材料を排他するもの
ではない。
5.1B しん(鍼)体の潤滑
剤の材料
5.1
JISとほぼ同じ
追加
ISO規格にはないしん(鍼)体
の潤滑剤として用いるシリコー
ン油について規定した。
旧JISから,シリコーン基準の引用
は有用であるため継続することと
したが,他の材料を排他するもので
はない。
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
32
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5 要求事項
(続き)
5.1C はり(鍼)を電極と
して用いる場合のしん
(鍼)体の材料
5.1
JISとほぼ同じ
追加
ISO規格にはないはり(鍼)を
電極として用いる場合のしん
(鍼)体の材料について規定し
た。
はり(鍼)電極低周波治療器の認証
基準における,使用するはり(鍼)
の要求と一致させた。ISOでも同類
の機器の規格開発が進行中であり,
制定後に再検討する。
5.2.1 サイズ表記
−
−
追加
“しん(鍼)体が存在しない場
合,しんせん(鍼尖)の最大径”
を追加した。
旧JISに含まれているしん(鍼)体
長が5 mm未満のごうしん(毫鍼)
を包含するため。
5.2.2.1 しん(鍼)体径
−
−
追加
“しんせん(鍼尖)は含まない”
を追加した。
旧JISに含まれているしん(鍼)体
長が5 mm未満のごうしん(毫鍼)
を包含するため。
−
−
追加
“はり(鍼)を電極として用い
る場合のしん(鍼)体径は,φ
0.20 mm以上であることが望ま
しい。”を追加した。
はり(鍼)電極低周波治療器の認証
基準における,使用するはり(鍼)
の要求と一致させた。ISOでも同類
の機器の規格開発が進行中であり,
制定後に再検討する。
5.2.2.1
JISとほぼ同じ
変更
最小値及び最大値を除いて規定
した。
しん(鍼)体径が0.1 mm未満及び
0.8 mmを超えるものを包含するた
め。
5.2.2.2 しん(鍼)体長
5.2.2.2
JISとほぼ同じ
変更
最小値及び最大値を除いて規定
した。
しん(鍼)体長が5 mm未満及び
200 mmを超えるものを包含するた
め。
5.2.2.3 しん(鍼)柄の寸
法
5.2.3
JISとほぼ同じ
削除
“ごうしん(毫鍼)のしん(鍼)
柄長は13 mm未満であってはな
らない。”を削除した。
ISO 18746,Traditional Chinese
medicine
−
Sterile
intradermal
acupuncture needles for single useを
包含するため。次回改正時にも包含
させるか再検討する。
5.3.2.1 しん(鍼)体長が
5 mm以上のごうしん(毫
鍼)
5.3.2
JISとほぼ同じ
変更
最小値及び最大値を除いて規定
した。
しん(鍼)体径が0.1 mm以下及び
0.8 mmを超えるものを包含するた
め。
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

33
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5 要求事項
(続き)
5.3.2.1A しん(鍼)体長が
5 mm未満のごうしん(毫
鍼)
−
−
追加
ISO規格にはないしん(鍼)体
長が5 mm未満のごうしん(毫
鍼)について規定した。
5 mm未満に適する試験方法をISO
18746から引用する。次回改正時に
も包含させるか再検討する。
5.3.3 しん(鍼)体の硬さ
5.3.3
JISとほぼ同じ
変更
最小値及び最大値を除いて規定
した。
しん(鍼)体径が0.1 mm未満及び
0.8 mmを超えるものを包含するた
め。
5.3.3
JISとほぼ同じ
追加
“硬さは,SAE J 417,
Hardness Tests and Hardness
Number Conversionsの考え方で
換算することができる。”を追加
した。
利用者の利便性のため。
5.3.5.2 しんせん(鍼尖)
の鋭利さ及び強さ
5.3.5.2
JISとほぼ同じ
変更
JISではしん(鍼)体の材料がス
テンレス以外の場合,押付力と
貫通抵抗力の値は表7に限るも
のではないと規定した。
材質の違いによって,強さが異な
る。日本特有の金銀のはり(鍼)を
適合させるため。
5.3.5.2
JISとほぼ同じ
変更
最小値及び最大値を除いて規定
した。
しん(鍼)体径が0.1 mm未満及び
0.8 mmを超えるものを包含するた
め。
5.4A 化学的要求事項
−
−
追加
ISO規格にはない化学的要求事
項について規定した。
旧JISから引用
5.4A.1 抽出物の酸性・ア
ルカリ性の限度
−
−
追加
ISO規格にはない抽出物の酸
性・アルカリ性の限度について
規定した。
旧JISから引用
5.4A.2 溶出金属の制限
−
−
追加
ISO規格にはない溶出金属の制
限について規定した。
旧JISから引用
5.4B エンドトキシン試験
−
−
追加
ISO規格にはないエンドトキシ
ン試験について規定した。
旧JISから引用
6 包装
6.1 一次包装
6.1
JISとほぼ同じ
変更
この規格では旧JISを引用し,
ISO規格から目視検査及び注記
を規定した。
JISでは未滅菌のごうしん(毫鍼)
を含むが,ISOは含まないことによ
る。
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
34
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
7 表示
7.1 一次包装
7.2
JISとほぼ同じ
変更
この規格では旧JISを引用し,
ISO規格から使用期限だけを規
定した。
旧JISの必要項目を適用
7.2 二次包装
7.3
JISとほぼ同じ
変更
この規格では旧JISを引用し,
ISO規格から使用期限だけを規
定した。
旧JISの必要項目を適用
附属書A
(参考)
A.2 測定装置
A.2
JISとほぼ同じ
追加
我が国において一般的に流通及
び使用されている測定装置の例
を追加した。
利用者の利便性のため。
附属書B
(参考)
B.3.1 せん(穿)刺力を評
価する検査装置
B.3.1
JISとほぼ同じ
追加
ISO規格にはない図B.1の項目
を規定した。
利用者の利便性のため。
附属書C
(参考)
C.2.1.1 試薬
C.2.1.1
JISとほぼ同じ
変更
JISでは,“ISO 3696に従った三
等級の蒸留水,又は脱イオン水”
を“試験水”と規定した。
JISでは試験水の定義を本体で規
定
C.2.2 手順
C.2.2
JISとほぼ同じ
変更
JISでは,“三等級の水”を“試
験水”と規定した。
JISでは試験水の定義を本体で規
定
C.3.1.1 試薬
C.3.1.1
JISとほぼ同じ
変更
JISでは,“ISO 3696に従った三
等級の蒸留水,又は脱イオン水”
を“試験水”と規定した。
JISでは試験水の定義を本体で規
定
C.3.2 手順
C.3.2
JISとほぼ同じ
変更
JISでは,“三等級の水”を“試
験水”と規定した。
JISでは試験水の定義を本体で規
定
附属書JA
(規定)
金しん(鍼)材料
−
−
追加
ISO規格にはない金しん(鍼)
の材料について規定した。
旧JISから引用したが,他の材料を
排他するものではない。
附属書JB
(規定)
銀しん(鍼)材料
−
−
追加
ISO規格にはない銀しん(鍼)
の材料について規定した。
旧JISから引用したが,他の材料を
排他するものではない。
JISと国際規格との対応の程度の全体評価:ISO 17218:2014,MOD
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

35
T 9301:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
T
9
3
0
1
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。