T 82304-1:2018 (IEC 82304-1:2016)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 目的及び適用範囲 ············································································································· 2
1.1 目的 ···························································································································· 2
1.2 適用範囲 ······················································································································ 2
1.3 適合性 ························································································································· 3
2 引用規格························································································································· 3
3 用語及び定義 ··················································································································· 3
4 *ヘルスソフトウェア製品の要求事項 ··················································································· 7
4.1 一般要求事項及び初期のリスクアセスメント ······································································· 7
4.2 ヘルスソフトウェア製品の製品要求事項············································································· 7
4.3 ヘルスソフトウェア製品の製品要求事項の検証 ···································································· 8
4.4 ヘルスソフトウェア製品の製品要求事項の更新 ···································································· 8
4.5 システム要求事項 ·········································································································· 8
4.6 システム要求事項の検証 ································································································· 9
4.7 ヘルスソフトウェア製品のシステム要求事項の更新 ······························································ 9
5 *ヘルスソフトウェア−ソフトウェアライフサイクルプロセス ·················································· 9
6 *ヘルスソフトウェア製品のバリデーション ·········································································· 9
6.1 バリデーション計画 ······································································································· 9
6.2 バリデーションの実施 ··································································································· 10
6.3 バリデーション報告 ······································································································ 10
7 ヘルスソフトウェア製品の識別情報及び附属文書 ·································································· 10
7.1 *識別情報 ···················································································································· 10
7.2 附属文書 ····················································································································· 11
8 ヘルスソフトウェア製品のための市販後の活動 ····································································· 14
8.1 一般 ··························································································································· 14
8.2 ソフトウェア保守 ········································································································· 14
8.3 再バリデーション ········································································································· 14
8.4 ヘルスソフトウェア製品の市販後コミュニケーション ·························································· 14
8.5 ヘルスソフトウェア製品の使用停止及び廃棄 ······································································ 15
附属書A(参考)根拠 ·········································································································· 16
参考文献 ···························································································································· 21
附属書JA(参考)定義した用語の索引 ···················································································· 23
T 82304-1:2018 (IEC 82304-1:2016)
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,一般社団法人電子情報技術産業協会(JEITA)
から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日本工業標準調査会の審議を経
て,厚生労働大臣及び経済産業大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣,経済産業大臣及び日本工業標準調査会は,このような特許権,出願公開後の
特許出願及び実用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 82304-1:2018
(IEC 82304-1:2016)
ヘルスソフトウェア−
第1部:製品安全に関する一般要求事項
Health software-Part 1: General requirements for product safety
序文
この規格は,2016年に第1版として発行されたIEC 82304-1を基に,技術的内容及び構成を変更するこ
となく作成した日本工業規格である。
なお,この規格で点線の下線を施してある参考事項及び附属書JAは,対応国際規格にはない事項であ
る。
この規格でアスタリスク(*)がある箇所は,指針又は根拠についての説明を,附属書Aに記載してい
る。また,本文中の太字は,この規格で定義した用語である。この規格で定義した用語が,太字で表記し
ていない場合,定義は適用せず意味は文脈に沿って解釈する。
この規格においては,ヘルスソフトウェア製品は,ソフトウェア単独の製品のことであり,そのソフト
ウェアを実行するために特別に開発されたものではないコンピュータ機器での使用を意図している。ヘル
スソフトウェア製品は,特定のプラットフォームを要求してもよい。
ヘルスソフトウェア製品は,個人の健康の管理,維持,改善又は医療(care)1) の提供のために使用す
ることを各製造業者が意図しているものである。ヘルスソフトウェアによっては,危険状態の一因になり
得るものもある。したがって,箇条5では,全てのヘルスソフトウェアに対してリスクマネジメントプロ
セスを要求している。危険状態の一因になり得るヘルスソフトウェアについては,危害を防止する又は危
害が発生する可能性を減らすためにリスクコントロールが必要である。最終製品を試験するだけでは,ヘ
ルスソフトウェアの安全を担保するのに十分ではない。そのため,ヘルスソフトウェアの開発プロセスに
対する要求事項が必要となる。この規格は,ヘルスソフトウェア製品に適用することができるソフトウェ
ア開発プロセスについて,JIS T 2304:2017に大きく依拠している。
注1) 対応国際規格では,介護・看護・医療領域を広く示す“care”を使用しているが,この規格では,
“医療”と表現している。
ヘルスソフトウェア製品を規制要求事項に適合させるかどうかは,各国の法規制の問題である。この規
格は,ヘルスソフトウェア製品を規制するか,又は規制することが望ましいかどうかについて判断しよう
とするものではない。
この規格は,ヘルスソフトウェア製品の安全及びセキュリティに対する要求事項のうち,特にソフトウ
ェア単独の製品に対する要求事項について規定している。ヘルスソフトウェアが装置の一部として組み込
まれている場合は,この規格の適用範囲外であり,例えば,JIS T 0601-1,関連する副通則及び個別規格で
別途取り扱う。
この規格は,“健康(health)”が世界保健機関(WHO)の定義(1946年)のような意味であることは理
解している。すなわち,“健康とは,病気でないとか,弱っていないということではなく,肉体的にも,精
2
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
神的にも,さらに,社会的にも,全てが満たされた状態にあることをいう(公益社団法人日本WHO協会
参照)。”しかし,この定義は,実際にはそれほど適切ではないと思われる。社会的な面も含めて“全てが
満たされた状態にある”と表現しているので,妥当な範囲を超えて広く解釈され得るからである。例えば,
出会い系アプリ(dating software),ゲームソフト,又はフライトシミュレータをこの規格の適用範囲内で
あるとみなすことができるかもしれないが,これは明らかに意図するところではない。しかし,“ヘルス
ソフトウェア(HEALTH SOFTWARE)”の“ヘルス(health)”という言葉の意味は,正確に定義すること
も表現することもできない。
ヘルスソフトウェアは,個人の健康に寄与するソフトウェアのことをいう。この“健康”とは,健康上
のパラメータの測定又は臨床的専門知識によって観察され,実証されるものであり,WHOの定義に含ま
れる。規格の要求事項は,健康上のパラメータに影響するソフトウェア,並びに/又はセキュリティ侵害
によってプライバシー若しくは健康及び福祉に関する秘密情報を損なう可能性があるソフトウェアに対し
て適用する。
この規格の適用範囲及び適用範囲外の例については,表A.1を参照。
注記 ヘルスケアは,健康を管理,維持又は改善するための行為である。ヘルスケアは,医療行為を
含むがそれだけには限定しない。この規格では,ヘルスソフトウェア製品を規制の対象かどう
かにかかわらず広い範囲で扱うので,ヘルスケアも同様に広い概念として捉える。
1
目的及び適用範囲
1.1
目的
この規格は,汎用コンピューティングプラットフォームで動作し,専用ハードウェアなしで市場出荷す
るヘルスソフトウェア製品の安全及びセキュリティに適用し,製造業者に対する要求事項について規定す
る。
1.2
適用範囲
この規格は,設計,開発,バリデーション,インストール,保守及び廃棄を含むヘルスソフトウェア製
品の全てのライフサイクルを対象とする。
引用規格で“医療機器”又は“医療機器ソフトウェア”という用語を使用している場合は,適宜,“ヘル
スソフトウェア”又は“ヘルスソフトウェア製品”という用語に置き換えている。
この規格又は引用規格で“患者”という用語を使用する場合は,ヘルスソフトウェアを使用して健康上
の効果を得る人を示している。
この規格は,健康用途のために設計された特定のハードウェアの一部となることを意図するヘルスソフ
トウェアには適用しない。特に,次には適用しない。
a) JIS T 0601規格群,JIS T 60601規格群又はJIS T 80601規格群の対象となる医用電気機器又は医用電
気システム
b) JIS C 1010規格群の対象となるIVD(In vitro diagnostic,体外診断)機器
c) ISO 14708規格群の対象となる体内植込み機器
注記1 この規格は,モバイルコンピューティングプラットフォームと組み合わせて使用することを
意図するヘルスソフトウェア製品(例えば,医療用アプリ及び健康用アプリ)にも適用でき
る。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
IEC 82304-1:2016,Health software−Part 1: General requirements for product safety(IDT)
3
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
なお,対応の程度を表す記号“IDT”は,ISO/IEC Guide 21-1に基づき,“一致している”
ことを示す。
1.3
適合性
規格の適合性の判断は,この規格が要求する全ての文書の調査によって行う。
適合性の評価は,製造業者が実施し文書化する。ヘルスソフトウェア製品が規制要求事項に適合する必
要がある場合には,外部評価が行われることがある。
この規格において,安全又はセキュリティに関する他の規格の一部又は箇条を引用している箇所につい
ては,製造業者は,この規格の要求事項に適合することを示すために,別の方法を使用してもよい。別の
方法は,そのプロセスの結果がトレーサビリティを含めて同等であることが示され,残留リスクが受容で
きる場合に使用してもよい。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。この引用
規格は,記載の年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 2304:2017 医療機器ソフトウェア−ソフトウェアライフサイクルプロセス
注記 対応国際規格:IEC 62304:2006,Medical device software−Software life cycle processes及び
Amendment 1:2015(IDT)
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
なお,定義した用語の索引を附属書JAに示す。
3.1
附属文書(ACCOMPANYING DOCUMENT)
ヘルスソフトウェアに附属し,責任部門又はユーザのために,特に安全及び/又はセキュリティに関す
る情報を記載した文書。
注記 JIS T 0601-1:2017の3.4の“ME機器,MEシステム,機器又は附属品”を“ヘルスソフトウェ
ア”に,“操作者”を“ユーザ”に,“基礎安全及び基本性能”を“安全及び/又はセキュリテ
ィ”に置き換えた。
3.2
異常(ANOMALY)
要求仕様書,設計文書,規格などからの逸脱,又は既存の認識若しくは経験に基づいて予想した結果を
逸脱する状態。
注記 異常は,ヘルスソフトウェア又は該当する文書の,レビュー,試験,分析,コンパイル又は使
用中に発見されることがあるが,これらの場合に限定しない。
(IEEE 1044:1993の3.1参照)
3.3
危害(HARM)
人への傷害若しくは健康障害,又は財産若しくは環境への損害。
(JIS Z 8051:2015の3.1参照)
4
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.4
ハザード(HAZARD)
危害の潜在的な源。
注記1 危害の潜在的な源には,セキュリティ侵害及び有効性の低下を含む。
注記2 JIS Z 8051:2015の3.2に注記1を追加した。
3.5
危険状態(HAZARDOUS SITUATION)
人,財産又は環境が,一つ以上のハザードにさらされる状況。
(JIS Z 8051:2015の3.4参照)
3.6
*ヘルスソフトウェア(HEALTH SOFTWARE)
個人の健康を管理,維持若しくは改善するために,又は医療(care)1) を提供するために使用すること
を意図するソフトウェア。
注記1 ヘルスソフトウェアは,医療機器としてのソフトウェア[SaMD(A.1参照)]を全て含む。
注記2 この規格の適用範囲においては,ヘルスソフトウェアのうち,汎用コンピューティングプラ
ットフォームで動作することを意図するソフトウェアを対象とする。
3.7
ヘルスソフトウェア製品(HEALTH SOFTWARE PRODUCT)
ヘルスソフトウェア及び附属文書の組合せ。
3.8
意図する使用,意図する目的(INTENDED USE,INTENDED PURPOSE)
製造業者が供給する仕様,説明及び情報に従った製品,プロセス又はサービスの使用。
(JIS T 14971:2012の2.5参照)
3.9
ITネットワーク(IT-NETWORK)
物理的なリンク伝送又は無線伝送を二つ以上の指定されたノード間で提供する通信ノード及び伝送リン
クからなるシステム。
注記1 この規格におけるITネットワークの適用範囲は,ヘルスソフトウェアのITネットワーク内
の位置及び定義したITネットワークの使用方法に基づいて,責任部門が定義する。ヘルス
ケアで使用することを意図した設計ではないITインフラストラクチャ,在宅医療用又は汎用
のコンピュータコンポーネント若しくはシステムを含むことがある(7.2.3.2参照)。
注記2 IEC 61907:2009の3.1.1を言い換え,注記1を追加した。
3.10
製造業者(MANUFACTURER)
ヘルスソフトウェア製品の市場出荷又は使用開始の前に,ヘルスソフトウェア製品の設計,開発,こん
(梱)包若しくはラベリング,又はヘルスソフトウェア製品の変更に責任を負う個人又は法人。その業務
をその個人若しくは法人又は代理を受けた第三者が行うか否かを問わない。
注記1 ラベリングの定義は,JIS Q 13485:2018の3.8を参照。
注記2 健康関連のIT分野では,“製造業者”の代わりに“開発者”又は“開発組織”が一般的に用
いられる。
5
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.11
残留リスク(RESIDUAL RISK)
リスクコントロール手段を講じた後にも残るリスク。
(JIS T 14971:2012の2.15参照)
3.12
責任部門(RESPONSIBLE ORGANIZATION)
ヘルスソフトウェア製品の使用及び適切な運用に責任をもつ実体。
注記1 責任をもつ実体とは,例えば,病院,ヘルスケアの提供者又は遠隔医療を行う組織である。
注記2 JIS T 0601-1:2017の3.101の“ME機器又はMEシステムの使用及び保守”を“ヘルスソフト
ウェア製品の使用及び適切な運用”に置き換えた。
3.13
リスク(RISK)
危害の発生確率とその危害の重大さとの組合せ。
注記1 発生確率には,危険状態の顕在及び危害の回避又は制限の可能性を含む。
注記2 JIS Z 8051:2015の3.9を変更し,注記1から危険事象への言及を削除した。
3.14
リスク分析(RISK ANALYSIS)
利用可能な情報を体系的に用いてハザードを特定し,リスクを推定すること。
(JIS Z 8051:2015の3.10参照)
3.15
リスクアセスメント(RISK ASSESSMENT)
リスク分析及びリスク評価からなる全てのプロセス。
(JIS Z 8051:2015の3.11参照)
3.16
リスクコントロール(RISK CONTROL)
規定したレベルまでリスクを低減するか又はそのレベルでリスクを維持するという決定に到達し,かつ,
そのための手段を実施するプロセス。
(ISO/IEC Guide 63:2012の2.12参照)
3.17
リスク評価(RISK EVALUATION)
判断基準に照らして推定したリスクが受容できるかを判断するプロセス。
(ISO/IEC Guide 63:2012の2.14参照)
3.18
リスクマネジメント(RISK MANAGEMENT)
リスクの分析,評価,コントロール及び監視に対して,管理方針,手順及び実施を体系的に適用するこ
と。
(ISO/IEC Guide 63:2012の2.15参照)
3.19
安全(SAFETY)
受容できないリスクがないこと。
6
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(ISO/IEC Guide 63:2012の2.16参照)
3.20
セキュリティ(SECURITY)
権限を与えられていない者又はシステムが読み込んだり変更できないように,かつ,権限を与えられて
いる者又はシステムがアクセスを拒否されないように,情報及びデータを保護すること。
(JIS X 0160:2012の4.39参照)
3.21
ソフトウェア保守(SOFTWARE MAINTENANCE)
意図する使用のためにリリースした後に行う,ヘルスソフトウェア製品に対する次の一つ以上の理由に
よる変更。
a) 欠陥を修正する,是正保守
b) 新しいハードウェア又はソフトウェアプラットフォームに適応する,適応保守
c) 新しい要求事項を実装する,完全化保守
d) 製品をより保守しやすくする,予防保守
注記 JIS X 0161:2008も参照。
3.22
ユーザ(USER)
ヘルスソフトウェア製品とやりとりする人。
注記 一般には,ユーザは,責任部門であるとはみなさない。ただし,一般消費者向けヘルスソフト
ウェア製品(例えば,個人向け健康用アプリケーション又は一般の人が使用するヘルスソフト
ウェア製品)を除く。
3.23
バリデーション(VALIDATION)
客観的証拠を提示することによって,特定の意図する使用又は適用に関する要求事項が満たされている
ことを確認すること。
注記1 バリデーションのために必要な客観的証拠は,試験の結果,又は別法による計算の実施若し
くは文書のレビューのような他の形の確定の結果である。
注記2 “バリデーション済み”という言葉は,バリデーションが完了している状態を示すために用
いられる。
注記3 バリデーションのための使用条件は,実環境の場合も,模擬の場合もある。
(JIS Q 9000:2015の3.8.13参照)
3.24
検証(VERIFICATION)
客観的証拠を提示することによって,規定要求事項が満たされていることを確認すること。
注記1 検証のために必要な客観的証拠は,検査の結果,又は別法による計算の実施若しくは文書の
レビューのような他の形の確定の結果であることがある。
注記2 検証のために行われる活動は,適格性プロセスと呼ばれることがある。
注記3 “検証済み”という言葉は,検証が済んでいる状態を示すために用いられる。
(JIS Q 9000:2015の3.8.12参照)
7
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
*ヘルスソフトウェア製品の要求事項
4.1
一般要求事項及び初期のリスクアセスメント
製造業者は,次を決定し文書化する。
a) ヘルスソフトウェア製品の意図する使用。意図するユーザ及び意図する使用環境を含む。
b) ヘルスソフトウェア製品の安全及び/又はセキュリティに関係する特性。ハザードの特定及び関連す
るリスクの推定。該当する場合は,ヘルスソフトウェア製品が構成可能である状況及び/又は他の製
品とのインタフェースをサポートする状況を含める。
c) 推定した,受容できないリスクに対するリスクコントロール手段の必要性
注記1 4.1は,例えば,JIS T 14971に基づく,正式及び完全なリスクマネジメントを要求するもの
ではない。しかし,リスクマネジメントの初期段階のプロセスを実施することは,良い方法
であると考えられる。
注記2 リスクコントロール手段は,ハードウェア,独立したソフトウェアシステム,ヘルスケア行
為又は他の手段とすることができる。
注記3 セキュリティぜい(脆)弱性に関する情報源には,専門家が公開する報告書,及びOS,サー
ドパーティソフトウェアなどの供給者からの公開情報を含む。
4.2
ヘルスソフトウェア製品の製品要求事項2)
製造業者は,次を決定し文書化する。
注2) 対応国際規格では“use requirements”と,使用に関する側面を強調する表現を採用しているが,
ソフトウェアの使用に関連する要求事項に限定するものでなく,製品全体の要求事項を示して
いるため,“製品要求事項”とした。
a) 意図する使用に対する要求事項
b) インタフェースの要求事項。該当する場合は,ユーザインタフェースの要求事項を含める。
注記1 ヘルスソフトウェア製品のシステム要求事項の一部としてのユーザインタフェース仕様と
は異なり,ユーザインタフェース要求事項は,必ずしも技術的な(実現可能な)要求事項
を記載しないが,技術的要求事項の目的については記載する。
例 “表示する情報は,救急病棟において3 mの距離から視認可能でなければならな
い。”
注記2 IEC 62366-1:2015は,ユーザインタフェース要求事項を確立するプロセスを規定している。
c) 同じハードウェア資源を使用する他のソフトウェアによる,意図しない影響に対する耐性又は感受性
についての要求事項
d) プライバシー及びセキュリティ要求事項。許可された使用,人の認証,健康に関するデータの完全性
及び信頼性,並びに悪意に対する保護のような領域に対応する。
注記3 セキュリティについては,7.2.3.1及びIEC/TR 80001-2-2(セキュリティ機能のリスト)を
参照。
e) 取扱説明書など,附属文書の要求事項(7.2.2参照)
f)
次をサポートするための要求事項
1) データ完全性の維持を含む古いバージョンからのアップグレード及び以前のバージョンとの互換性
2) アップグレード前のバージョンへの回復
3) セキュリティに関するタイムリーなパッチ及びアップデート
4) インストールの完全性を保証するソフトウェア配布メカニズム
8
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5) データの使用停止,完全削除,転送及び/又は保持
g) 適用可能な法規制に基づく要求事項。情報保護のルールを含む。
注記4 一部の法規制では,データ保護法(例えば,2016年に改定された欧州データ保護指令
95/46/EC)が,削除又は持出しのような個人情報の処理には本人の明確な同意が必要である
と規定している。欧州データ保護指令95/46/ECは,2018年5月25日に,欧州一般データ保
護規制(2016/679)に置き換えられる。
4.3
ヘルスソフトウェア製品の製品要求事項の検証
製造業者は,ヘルスソフトウェア製品の製品要求事項について次の点を検証する。
a) システム要求事項のインプットとなるよう定義され,文書化されている。
b) 定義した製品要求事項は,製造業者が達成することができるような内容である。
検証の結果は,記録する。
4.4
ヘルスソフトウェア製品の製品要求事項の更新
製造業者は,例えば,ヘルスソフトウェア製品の製品要求事項の検証(4.3参照)の結果又はバリデー
ションの結果を受け,ヘルスソフトウェア製品の製品要求事項を適宜更新することを確実に実施する。
4.5
システム要求事項
製造業者は,ヘルスソフトウェア製品のシステム要求事項を特定し文書化する。この要求事項には,意
図する使用に対する機能を含み,該当する場合は次の事項を含める。
a) 相互運用性
b) 地域化及び言語対応
c) 4.1の初期のリスクアセスメントに基づいて,ヘルスソフトウェア製品のシステムレベルで実施しな
ければならないリスクコントロール手段
d) ユーザインタフェース仕様
e) 期待する負荷状況の下で期待どおりに機能し,要求するパフォーマンスレベルで機能するための,ヘ
ルスソフトウェア製品のソフトウェア及びハードウェアプラットフォームの要求事項
f)
正常な使用において,セキュリティ侵害を検出し,認識し,時刻を含めて記録し,対応する動作を行
えるようにする機能
g) ソフトウェアのセキュリティ侵害が起こった場合にも,基本機能を保護する特性
h) 認証された特権ユーザが,製品の構成を保持し,回復する方法
ヘルスソフトウェア製品のシステム要求事項は,ヘルスソフトウェア製品の製品要求事項(4.2参照)
に適合しなければならない。
注記1 相互運用性についての情報源の例を,次に示す。
− HIMSS“Interoperability and standards”
入手先:<http://www.himss.org/library/interoperability-standards/what-is-interoperability>
− 経済産業省,独立行政法人情報処理推進機構 情報システムに係る相互運用性フレーム
ワーク Version 1.0 平成19年6月
入手先:<https://www.ipa.go.jp/files/000024851.pdf>
注記2 ユーザインタフェースの技術的要求事項には,表示の色,文字の大きさ,制御ボタンの配置
などが含まれる。
注記3 ソフトウェアプラットフォームには,OS,デバイスドライバ,ソフトウェアライブラリ及び
その他のユーザアプリケーションが含まれるが,これに限定しない。
9
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記4 JIS T 2304:2017の5.2.1のソフトウェアシステム要求事項と,ヘルスソフトウェア製品のシ
ステム要求事項との間には,必ずしも相違があるとはいえない。
4.6
システム要求事項の検証
製造業者は,システム要求事項について次の点を検証する。
a) 相互に矛盾しない。
b) 曖昧さを回避した用語で表現している。
c) 試験基準を確立して,試験基準に適合するかを判断する試験が,実施できる表現で記載している。
d) 一意に識別できる。
検証の結果は,記録する。
4.7
ヘルスソフトウェア製品のシステム要求事項の更新
製造業者は,ヘルスソフトウェア製品のシステム要求事項の適切な更新を確実に実施する。例えば,ヘ
ルスソフトウェア製品の製品要求事項の変更の結果,システム要求事項の検証(4.6参照)の結果又はソ
フトウェア要求事項分析(JIS T 2304:2017の5.2参照)の適用の結果を受けての更新。
5
*ヘルスソフトウェア−ソフトウェアライフサイクルプロセス
4.5で確立したヘルスソフトウェア製品のシステム要求事項は,ヘルスソフトウェア製品のライフサイ
クルプロセスの最初の設計インプットとして使用する。
この規格の他の要求事項に加えて,JIS T 2304:2017の4.2,4.3及び箇条5〜箇条9の要求事項をヘルス
ソフトウェアに適用する。
JIS T 2304:2017は,JIS T 14971を引用規格としている。製造業者は,ヘルスソフトウェアを構成する,
独占所有権のある(proprietary)コンポーネント,ヘルスケア由来でないサブシステム,及び既存のソフト
ウェアのような各々のコンポーネントについて,JIS T 14971に規定する全ての手順に従うことができない
かもしれない。この場合,製造業者は,残留リスクを考慮して,受容できないと判断したリスクに対する
リスクコントロールを実施する。
6
*ヘルスソフトウェア製品のバリデーション
6.1
バリデーション計画
製造業者は,4.2で確立したヘルスソフトウェア製品の製品要求事項の全てに対応するバリデーション
計画を確立する。
バリデーション計画において,製造業者は,次を行う。
a) バリデーションの範囲及び対応するバリデーション活動を特定する。
b) バリデーション活動の実行可能性を潜在的に制限する制約事項を特定する。
c) バリデーションを行うための適切な方法,入力情報及び合否判定基準を選択する。
d) 動作条件のような,実行可能にするシステム又はサービスを特定する。それには,バリデーションを
行う上で必要なハードウェア及びソフトウェアのプラットフォームを含める。
e) バリデーションを行う要員に必要な資格要件を特定する。教育訓練が必要な場合は,バリデーション
を始める前に完了しておく。
f)
バリデーションチームの,設計チームに対する適切な独立性レベルを定める。
注記1 制約事項には,技術的な実行可能性,コスト,時間,バリデーションができる要員又は資格
認定した要員がいるかどうか,契約上の制限,業務の重大性などが含まれる。
10
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記2 バリデーションの方法には,調査,分析,類推又は類似性,実証,シミュレーション,査読,
及び試験又は認定が含まれる。関連情報としては,規格及び互換性基準のようなその他の出
版物,規制当局のガイダンス文書,並びに臨床文献がある。
6.2
バリデーションの実施
製造業者は,次の事項によってバリデーションの準備が整ったことを確認する。
a) バリデーション計画が確立されている。
b) バリデーションチームが適切に資格認定した要員によって組織されている。
c) 必要な場合は,ヘルスソフトウェア製品のバリデーションを行う部分に対して,箇条5で要求する開
発ライフサイクルが完了している。
バリデーションチームは,6.1のバリデーション計画に従って,意図する操作環境でバリデーション活
動を実行する。バリデーション計画からの逸脱が必要であると判断した場合は,それを正当化する根拠を
バリデーション報告書に記載する。
バリデーションにおいてヘルスソフトウェア製品に異常を発見した場合には,JIS T 2304:2017の箇条9
に従った問題解決プロセスでそれを解消する。問題解決プロセスの結果,ヘルスソフトウェア製品に変更
が生じる場合は,変更の影響範囲を考慮して,影響があったバリデーションの部分を再度行う。
6.3
バリデーション報告
バリデーションチームは,バリデーションを行ったヘルスソフトウェア製品のバリデーション報告書を
作成する。
バリデーション報告書は,次の事項に対する証拠を提示する。
a) バリデーション結果は,インプットとしたヘルスソフトウェア製品の製品要求事項にトレース可能で
ある。
b) ヘルスソフトウェア製品は,4.2で確立した製品要求事項に適合する。
c) ヘルスソフトウェア製品の残留リスクは,受容可能である。
バリデーション報告書には,バリデーションを行った条件及び活動の結果を記載する。バリデーション
においてヘルスソフトウェア製品に異常を確認した場合には,バリデーション報告書に記載する。
バリデーション報告書には,バリデーションチームのメンバー(氏名,所属及び職務)を記載する。
バリデーション報告書には,バリデーション結果の要約を含め,製品要求事項に基づき,ヘルスソフト
ウェア製品が意図する使用についてバリデーション済みであるという結論を記載する。
7
ヘルスソフトウェア製品の識別情報及び附属文書
7.1
*識別情報
ヘルスソフトウェア製品は,次の事項によって識別する。
− 製造業者の名称又は商標
− 製品の名称又は形式名
− 改版(revision)レベル,リリース日又は発行日のような一意なバージョン識別子
注記1 一部の国の法規制では,機器固有識別子(Unique Device Identification,UDI)が義務化されて
いる。
ヘルスソフトウェア製品の識別情報は,ユーザがヘルスソフトウェアを使用する際にアクセス可能とす
る。
注記2 ソフトウェアの最初の画面又はログイン画面に識別情報を表示することは,良い方法である。
11
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
7.2
附属文書
7.2.1
一般
製造業者は,ヘルスソフトウェアの附属文書を用意し,ユーザ及び/又は責任部門がヘルスソフトウェ
ア製品を意図するとおりに実行し使用することができるようにする。
附属文書には,次を含める。
a) 製造業者の名称及び連絡先情報(ウェブサイトを含む。)
b) ヘルスソフトウェア製品の識別情報(7.1参照)
c) ヘルスソフトウェア製品のバージョン識別子。例えば,改版レベル,リリース日又は発行日のような,
ヘルスソフトウェア製品を識別するために必要な情報。
d) 附属文書のバージョン識別子。例えば,改版レベル,リリース日又は発行日。
e) 取扱説明書(7.2.2参照)
f)
技術解説(7.2.3参照)
附属文書には,ソフトウェアリリースノート及び標準的なインストール環境の記載を含めてもよい。
附属文書には,意図するユーザ又は責任部門に必要な特殊技能,訓練及び知識,ヘルスソフトウェア製
品を使用することができる場所又は環境についての制限事項,並びに該当する場合は,システムインタフ
ェース,ソフトウェアプラットフォーム,ツール及びハードウェア要求事項又は制限事項を記載する。
附属文書は,意図するユーザに対する教育,訓練及びその他の特別なニーズに見合うレベルで作成する。
注記 附属文書を電子データで提供することで,使い勝手を改善できる。規制当局は,附属文書の一
部又は全部が電子的に提供される場合に,電子データのフォーマットを指定することがある。
7.2.2
取扱説明書
7.2.2.1
一般
取扱説明書には,ヘルスソフトウェア製品を正しく使用するために必要な全ての情報を文書化し,必要
な場合は,インストール手順を含める。
該当する場合,取扱説明書には,ヘルスソフトウェア製品が使用を意図するITネットワークに対する
制限事項を特定する(7.2.3.2参照)。
注記 取扱説明書は,ユーザ及び責任部門を対象としており,ユーザ又は責任部門にとって有用な情
報だけが必要である。補足説明は,技術解説に含めることができる(7.2.3も参照)。
7.2.2.2
ヘルスソフトウェアについての記載
取扱説明書には,次を記載する。
a) 製造業者が定めたヘルスソフトウェア製品の意図する使用
b) ヘルスソフトウェア製品の簡単な説明。ヘルスソフトウェア製品の基本機能を含める。
c) ヘルスソフトウェアの使用上の,設定可能なセキュリティオプション
d) ヘルスソフトウェア製品の使用に対する既知の技術的な問題点,制限事項,免責事項又は禁忌事項
7.2.2.3
安全及び/又はセキュリティに対する警告及び注意事項
取扱説明書には,ヘルスソフトウェア製品の使用に伴う,安全及び/又はセキュリティ上の警告及び注
意事項を全て含める。警告及び注意事項の文章だけでは内容が十分に分からない場合には,具体的に説明
を加える。
安全及び/又はセキュリティ上の一般的な警告及び注意事項は,取扱説明書の特定のセクションにまと
めて記載するのがよい。特定の操作方法又は動作だけに対する安全又はセキュリティ上の警告又は注意事
項は,その操作説明の直前に記載するのがよい。
12
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
7.2.2.4
インストール
取扱説明書には,次を記載する。
a) インストールがユーザだけで行えるか,製造業者若しくは認定された人が行わなければならないか,
又はそれらの人の協力の下で行わなければならないかについての記載
b) ヘルスソフトウェアを実行するための,ソフトウェア及びハードウェアプラットフォームのシステム
要求事項
c) ヘルスソフトウェアのインストール時に設定するセキュリティオプション
d) 他のアプリケーションに対する重要な依存関係
e) 構成に関する要求事項
f)
システムインタフェースの要求事項(必須事項及び選択事項)
g) サポートするソフトウェアプラットフォームの詳細
h) インストール手順又はインストール手順の参照先情報
7.2.2.5
起動手順
取扱説明書には,ヘルスソフトウェアをユーザが起動して使用できるようにするために必要な情報を記
載する。
7.2.2.6
シャットダウン手順
取扱説明書には,ヘルスソフトウェアをユーザが安全にシャットダウンするために必要な情報を記載す
る。
7.2.2.7
操作説明
取扱説明書には,ヘルスソフトウェアの操作に必要な全ての情報を記載する。これには,制御機能,表
示機能及び通知機能,並びに操作手順についての説明を含める。
取扱説明書には,図,シンボル,警告メッセージ及び略称の意味について説明する。
7.2.2.8
メッセージ
取扱説明書には,表示するシステムメッセージ,エラーメッセージ及び故障メッセージを全て一覧にす
る。ただし,メッセージが説明を要しない場合については,この限りではない。
注記 メッセージは,グループにまとめることができる。
メッセージの一覧には,重要な原因及びユーザができる処置を併せて記載する。メッセージが示す状況
の解決に必要な処置がある場合には,それについても記載する。
7.2.2.9
ヘルスソフトウェアの使用停止及び廃棄
取扱説明書には,ユーザ又は責任部門がヘルスソフトウェアを安全に使用停止及び廃棄するために必要
な全ての情報を記載する。これには,必要に応じて,セキュリティ及びプライバシーにつながる,個人情
報及び健康関連情報の保護を含める。
注記 規制当局は,個人情報及び健康関連情報を取り扱う際の要求事項を定めることができる。
7.2.2.10 技術解説の参照
取扱説明書には,技術解説(7.2.3参照)を含めるか,又は参照先情報を記載する。
7.2.3
技術解説
7.2.3.1
一般
技術解説は,ヘルスソフトウェアの安全な操作,輸送,保管,インストール及び使用準備の方法と条件
とに対する必要なデータ全てを提供する。これには,次を含める。
a) ヘルスソフトウェアを実行するための,ソフトウェア及びハードウェアプラットフォームのシステム
13
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
要求事項
b) サポートするソフトウェアプラットフォームの詳細
c) ヘルスソフトウェアを格納するメディアの輸送及び保管の許容環境条件
d) ヘルスソフトウェアの全ての特性。これには,表示する値の範囲,正確度及び精度,又はそれらの情
報の参照先情報を含める。
e) 特別のインストール条件又は制限事項
f)
保守の要求事項。例えば,チェックするログファイル,必要な場合はクリアするログファイル,デー
タベースの保守,及び保管メディアの交換。
g) ヘルスソフトウェア製品内に構成可能で,責任部門が設定可能である技術的セキュリティオプション。
これには,次を含んでもよい。
1) 構成オプション。例えば,必要最小限のネットワークポート及びコンピュータサービスのリスト。
2) ソフトウェアオプション。例えば,暗号化設定及びデフォルトログイン認証情報の変更。
3) 運用オプション。例えば,監査及びログ管理の設定。
h) セキュリティの維持についての問題を検出したときに,ソフトウェアが何を行うかの記載。患者の治
療,データ又は臨床のワークフローに対する影響について記載する。
注記 ヘルスソフトウェアは,通常様々なハードウェア及びソフトウェアプラットフォームで動作す
るため,適切に実行するための詳細説明又は代表的特性及び制限文書が効果的な手助けになる
場合もある。
製造業者は,ユーザ及び/又は責任部門が,ハードウェア及びソフトウェアプラットフォームの変更(例
えば,アンチウィルスソフトウェア,ファイアウォールソフトウェア,システムライブラリ,ファームウ
ェア及びその他ソフトウェアのパッチ又はアップデート)にどう対処すればよいか,セキュリティ目標及
びセキュリティ機能をサポートするために適切なプラットフォームの設定をどのように選択すればよい
かについての説明を技術解説に含める。
7.2.3.2
*ITネットワークで使用することを意図するヘルスソフトウェア
ITネットワークの範囲には,ヘルスケアでの使用を明確には意図していないITインフラストラクチャ
又はシステムが含まれる場合がある(3.9参照)。
ヘルスソフトウェアを,製造業者の管理対象外であるITネットワークで使用することを意図している
場合は,製造業者は,使用に際して必要な指示を技術解説の一部として提供する。これには次を含めるが,
これらに限らない。
a) ヘルスソフトウェアの目的を達成するために要求される,ITネットワークの特性及び構成
b) ヘルスソフトウェアの目的を達成するために必要なITネットワークの技術仕様。これには,セキュ
リティ仕様及びマルウェア(悪意のあるソフトウェア)に対する保護又は類似のものを含める。
c) ヘルスソフトウェアと,ITネットワークを使う他のソフトウェア又はシステムとの間の,意図する情
報の流れ
製造業者は,ITネットワークの故障に伴う危険状態の一覧を技術解説に含め,ITネットワークを使用
する際のヘルスソフトウェアの目的に対して必要な特性及びサービスを提供する。
技術解説において,製造業者は,責任部門に対して次の事項の情報提供を行う。
a) ヘルスソフトウェアをITネットワーク上で実行することで,患者,ユーザ又は第三者に対して,事
前に特定していなかったリスクが生じる可能性がある。
b) 責任部門は,上記のリスクを特定,分析,評価及びコントロールすることが推奨される。
14
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) ITネットワークを変更すると,新たなリスクが生じて追加の分析が必要となる可能性がある。
d) ITネットワークの変更には,次が含まれる。
1) ITネットワークの構成変更
2) ITネットワークに対する構成要素(ハードウェア及び/又はソフトウェアプラットフォーム,又は
ソフトウェアアプリケーション)の追加
3) ITネットワークの構成要素の削除
4) ITネットワークのハードウェア及び/又はソフトウェアプラットフォーム,又はソフトウェアアプ
リケーションの更新
5) ITネットワークのハードウェア及び/又はソフトウェアプラットフォーム,又はソフトウェアアプ
リケーションのアップグレード
注記 IEC 80001-1:2010は,ヘルスソフトウェアの製造業者,IT技術の提供者及び責任部門が,ITネ
ットワークの変更に関わるリスクに対応するための要求事項を規定している。
8
ヘルスソフトウェア製品のための市販後の活動
8.1
一般
箇条1に規定するとおり,この規格は,ヘルスソフトウェアの全てのライフサイクルを対象としている。
そのライフサイクル期間中,ヘルスソフトウェアは,ソフトウェア保守を受け,最後は使用停止及び廃棄
されることになる。4.2は,製品を市場に投入する前に実装しバリデーションを行う製品要求事項を規定す
る。その製品要求事項には,ヘルスソフトウェア製品の使用停止及び廃棄も含める。この規格を規制目的
に使用する場合は,製品の設計及び開発に関わる市販後の活動だけに適用する。
8.2
ソフトウェア保守
製造業者が,ソフトウェア保守が関連する又は必要であると判断した場合,例えば,検出したエラーが
安全及び/又はセキュリティに影響を与える可能性がある場合,製造業者は,この規格に適合してヘルス
ソフトウェア製品の設計変更を行う(箇条5参照)。
注記1 保守には,附属文書の変更も含まれる。例えば,ヘルスソフトウェアが実行されるプラット
フォームについての記載。
注記2 ソフトウェア保守が,安全及び/又はセキュリティへ影響を与えるエラーによる場合は,規
制上の要求事項が発生することがある。
8.3
再バリデーション
製造業者は,ソフトウェア保守によって影響を受けたヘルスソフトウェア製品について,変更の範囲を
考慮して確実に再バリデーションを実施する。製造業者は,それに応じてバリデーション計画を更新する。
製造業者は,ヘルスソフトウェアの変更したバージョンが,サポートを表明しているハードウェア及び
ソフトウェアプラットフォームで機能することを確実にする。
8.4
ヘルスソフトウェア製品の市販後コミュニケーション
製造業者は,製造業者が気付いたセキュリティぜい(脆)弱性及びヘルスソフトウェア製品の使用に影
響を与える規制要求事項の変更について,ヘルスソフトウェア製品のユーザ及び影響を受ける責任部門に
対して情報提供を行う。
ソフトウェア保守においては,製造業者は,ヘルスソフトウェア製品の更新版が入手可能であることを
ユーザ及び責任部門に情報提供し,必要に応じて,次の情報も提供する。
a) 新しい機能
15
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 修正したエラー又は故障
c) 変更したソフトウェアの安全及び/又はセキュリティ上の影響
d) ヘルスソフトウェアの識別についての更新(7.1参照)
e) 附属文書の更新(7.2参照)
ユーザ又は責任部門がヘルスソフトウェアの変更版をインストールするかどうかは,変更の安全及び/
又はセキュリティ上の影響に基づいて決定するのがよい。変更したヘルスソフトウェア製品が安全及び/
又はセキュリティに良い影響を及ぼす場合は,製造業者は,ユーザ及び責任部門に対して早めの更新を促
してもよい。
8.5
ヘルスソフトウェア製品の使用停止及び廃棄
ユーザ又は責任部門は,ヘルスソフトウェア製品の製品寿命が尽きたときには,安全に使用停止及び廃
棄ができるようにする。これには,必要に応じて,セキュリティ及びプライバシーにつながる個人情報及
び健康関連情報の保護を含める。ヘルスソフトウェアは,この機能を4.2で特定する製品要求事項に整合
するように提供する。
16
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(参考)
根拠
A.1 一般
ヘルスソフトウェアは,製造業者が特に健康目的用を意図するソフトウェアである。これには,患者の
診断,治療若しくはモニタリング,又は疾病,傷害,身体障害の補助若しくは緩和を目的とするアプリケ
ーションを含む。
この規格の開発の初期段階では,(ハードウェアである)医療機器の一部であるソフトウェアを“医療機
器ソフトウェア”,そのものが医療機器であるソフトウェアを“ソフトウェア医療機器”という用語で表し
ていた。それぞれの定義は,“医療機器ソフトウェア”は,医療機器のハードウェアに組み込むことを意図
するソフトウェア,“ソフトウェア医療機器”は,そのものが医療機器であることを意図するソフトウェア
である。この二つのサブカテゴリ,すなわち,医療機器のハードウェアに組み込むことを意図するソフト
ウェアとソフトウェア医療機器であることを意図するソフトウェアとを合わせたものを“医療ソフトウェ
ア”と定義した。
ヘルスソフトウェアは,3.6に“個人の健康を管理,維持若しくは改善するために,又は医療(care)を
提供するために使用することを意図するソフトウェア”と定義しており,これは“医療ソフトウェア”全
体を含み,それより広い概念である。医療ソフトウェアは,各国の法規制によって多様に定義される“医
療機器”という用語と密接に関連する。この規格の目的に対しては,ヘルスソフトウェアという用語がよ
り適切であると考えた。より広い範囲を扱うことで,この規格は,健康に関連するソフトウェア製品全て
について,それが医療機器として規制されるかどうかにかかわらず,安全,セキュリティ及び性能に対し
て共通のアプローチをすることができる。
国際医療機器規制当局フォーラム(IMDRF)は,SaMD WG/N10FINAL:“医療機器としてのソフトウェ
ア(SaMD):主要な定義[Software as a Medical Device (SaMD): Key Definitions]”という文書を発行してい
る。ヘルスソフトウェアが医療目的であり,かつ,専用のハードウェアでの動作を意図していない場合は,
SaMD(医療機器としてのソフトウェア)と全く同じ意味である。
この規格は,ヘルスソフトウェア製品,すなわち,単体の製品として入手できるヘルスソフトウェアだ
けに対する要求事項を規定することに注意が必要である。専用のハードウェアで動作することを意図する
ヘルスソフトウェアは,“組込み”ソフトウェアと呼ばれることもあるが,それは装置の一部であり,そ
れ自身は製品ではないと考えられる(A.2も参照)。
ヘルスソフトウェアは,健康,健康管理及びヘルスケアのリソース管理を扱うアプリケーションを含ん
でいる。表A.1に,この規格が取り扱うソフトウェア製品の例を示す。現存する規格において,ヘルスソ
フトウェアが対象範囲に含まれているかどうかについては,ヘルスソフトウェアの規格の状況を示す
ISO/TR 17791に特定されている。単体の健康用アプリケーションに対して,安全及びセキュリティを参照
する規格は見当たらない。この規格の目標は,その空隙を埋めることにある。
各国の法規制においては,どのヘルスソフトウェア製品が医療機器規制対象となり,どれがならないか,
ならない場合にはどの規制を適用するかについて,それぞれ判断を下す必要がある。ヘルスソフトウェア
であるソフトウェア単独の製品を,この規格を適用して規制対象として市場に出荷しようとしている製造
業者は,どの法体系が適用されるのかを調査することが望ましい。
17
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
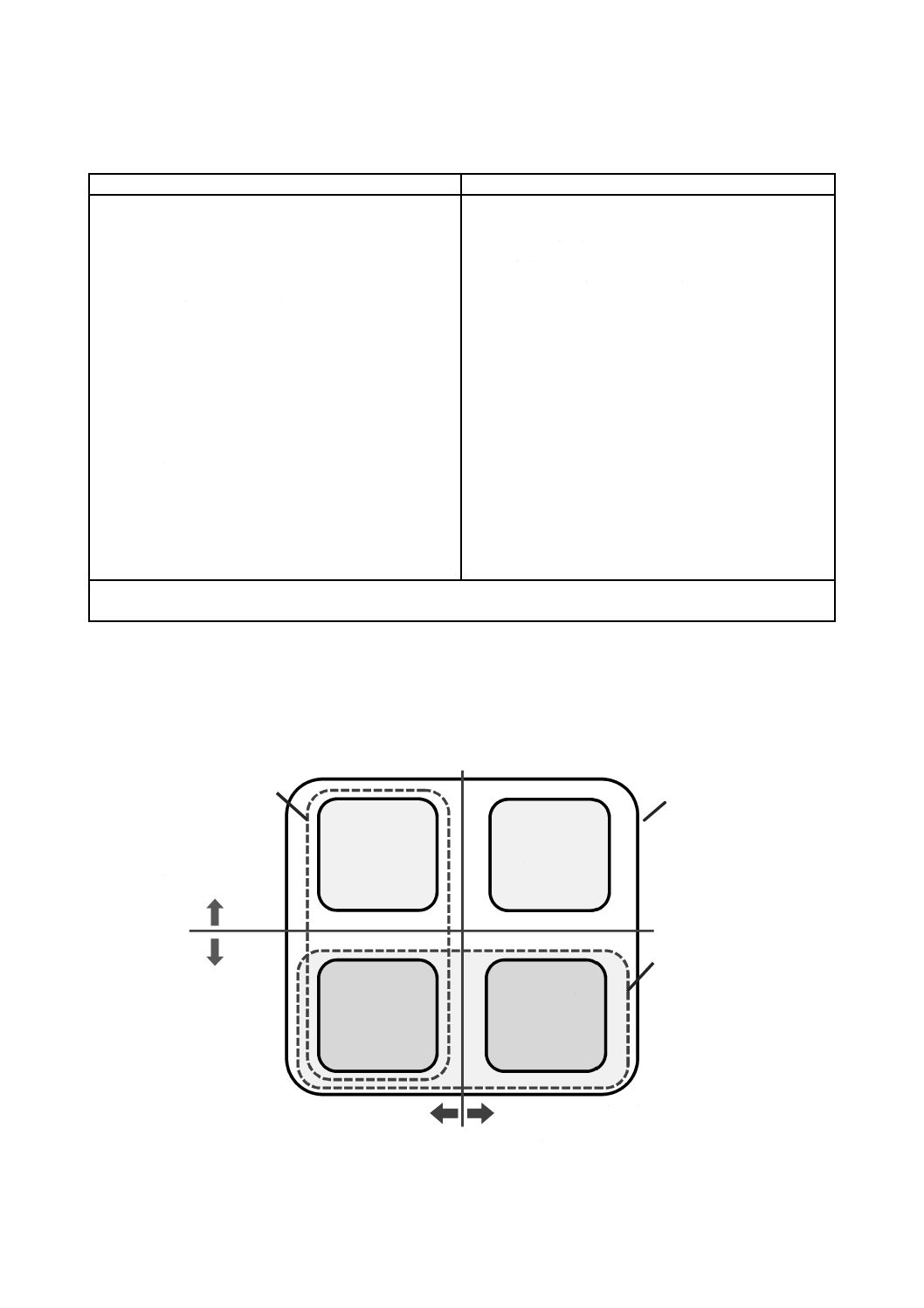
表A.1−この規格の範囲内及び範囲外のソフトウェアの例
範囲内
範囲外
− 健康用途のソフトウェア単独の製品
− 特別なセンサ又は検出器a) を使わない機器で動作す
るモバイルアプリケーション
− 検査情報ソフトウェア
− 放射線科情報ソフトウェア
− フィットネスセンターの個人用ソフトウェア
− 受胎調節ソフトウェア
− コンピュータ支援診断ソフトウェア
− 医用画像解析ソフトウェア
− 個人の診断,治療及び健康管理を目的とする臨床診断
支援ソフトウェア
− フィードバック機能付き個人向けストレス緩和ソフ
トウェア
− バリデーション療法の訓練計画ソフトウェア
− アルツハイマー患者の活動刺激ソフトウェア
− 電子カルテシステムを含む,電子健康記録システム
− 病院情報システム
− 外部組織によって提供されるサービスとしてのヘル
スソフトウェア
− 実行可能でないソフトウェア。例えば,基準値の一覧
など。
− 個人の健康を扱わないソフトウェア
− 医事会計用ソフトウェア
− 病院の機器保守スケジュール管理ソフトウェア
− 疫学研究用ソフトウェア
− 看護師訓練用ソフトウェア
− 医療従事者の自己教育ソフトウェア
− 介護施設の電子日誌
次の機器を制御するソフトウェア又はそのアップデート
も適用範囲外である。
− JIS T 0601規格群,JIS T 60601規格群又はJIS T 80601
規格群の対象である医用電気機器又は医用電気シス
テム
− JIS C 1010規格群の対象であるIVD機器
− ISO 14708規格群の対象である体内植込み機器
注a) カメラ,マイク又はその他の,スマートフォン又はタブレットに一般的に用いられている機能は,特別なセン
サ又は検出器とはみなさない。
A.2 ヘルスソフトウェア製品の要求事項
この規格は,単体製品として入手できるヘルスソフトウェアだけに対する要求事項を規定することに注
意することが必要である。図A.1にヘルスソフトウェアの適用領域及び関連する規格(この規格及びJIS T
2304:2017)の適用範囲を示す。
図A.1−ヘルスソフトウェアの適用領域及び関連規格の適用範囲
ヘルスソフトウェア
医療機器である
ソフトウェア
単独の製品
医療機器に
組み込む
ソフトウェア
専用ハードウェア
汎用
コンピューティング
プラットフォーム
その他の健康用途に使用
医療機器への使用
この規格の
適用範囲
その他の健康用
ソフトウェア
単独の製品
その他の健康用
ハードウェアに
組み込む
ソフトウェア
JIS T 2304の
適用範囲
18
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ヘルスソフトウェアは,通常ハードウェア的にもソフトウェア的にも様々なプラットフォーム上で動作
する。例えば,固定機器又はモバイル機器,仮想マシン,オフライン,ネットワーク接続,又はインター
ネットのクラウドサービスである。これらのプラットフォームは,多くの場合,製造業者の影響外にあり,
管理外である。したがって,この規格は,製造業者及び責任部門に,多様な使用方法及び頻繁に変わるプ
ラットフォームに起因するハザードを適切に対処するために必要な考慮,タスク及び文書化を行うことを
注意喚起することも意図している。
専用のハードウェアで動作することを意図するヘルスソフトウェアは,装置の一部とみなされ,“組込
み”ソフトウェアとも呼ばれる。そのようなソフトウェアは,それ自体では製品として考えることはでき
ない。医療機器として規制される製品に含まれるソフトウェア及び医療機器として規制されない装置の一
部であるソフトウェアにおいても,また,同様である。
A.3 特定の箇条及び細分箇条に対する根拠
注記 このA.3の箇条番号又は細分箇条番号に付した“†”は,対応する要求事項に対する根拠であ
ることを示し,かつ,要求事項の文章でないことを容易に識別できるようにしたものである。
3.6† ヘルスソフトウェアの定義
ISO/TR 17791:2013によれば,ヘルスソフトウェアは,基本的にはソフトウェアシステム,ソフトウェ
アアイテム及びソフトウェアユニットによって構成される(JIS T 2304:2017の3.30,3.25及び3.28を参照)。
また,ヘルスソフトウェアには,関連する符号化方式,推論エンジン,診療情報のデータモデルであるア
ーキタイプ(archetype),及び臨床医学の概念を表現するオントロジー(ontology)も含める。さらに,ヘ
ルスソフトウェアは,全ての健康関連部門(全ての公的及び私的組織又は企業,消費者を含む。)に採用
され,利益をもたらし,適用されるソフトウェアであり,市販品の場合も非市販品の場合もある。
3.6のヘルスソフトウェアの定義は,ISO/TR 17791:2013の2.6での同じ用語の定義と矛盾するものでは
ない。
箇条4† ヘルスソフトウェア製品の要求事項
製品の製品要求事項をその意図する使用に基づいて確立し,最終製品のバリデーションを行うための合
否判断基準を顧客要求事項又は製品要求事項に基づいて定めることは,一般的に行われる方法である。シ
ステム要求事項の定義から最終製品のバリデーションまでの段階が製品開発のプロセスである。図A.2に
開発プロセスを示した。実際のプロセスは,いろいろなスキームに基づいて行うことができる。例えば,
ウォータフォールモデル又は反復型開発モデルである。この規格は,特定のプロセススキームを要求しな
いし,優先もしない。
19
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
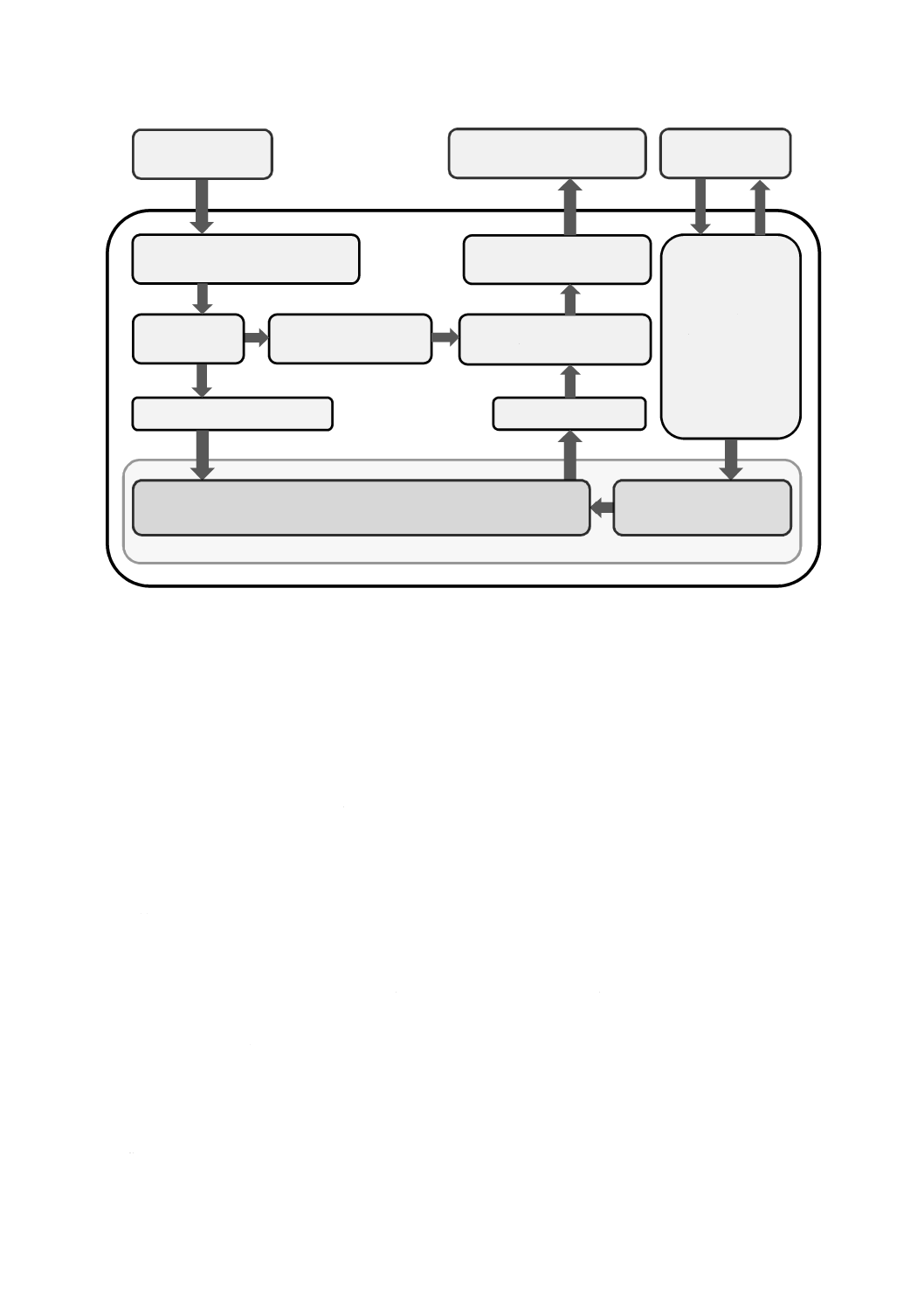
注a) ヘルスソフトウェア製品=ヘルスソフトウェア+附属文書
図A.2−この規格に規定するヘルスソフトウェア製品のプロセス
ユーザニーズは,開発プロセスのインプットであり,ユーザニーズを解釈する一連のプロセスを流れて
いく。JIS T 2304:2017に規定されているプロセスは,システム要求事項を確立した後に開始できる。これ
らのプロセスの結果として,検証済みのヘルスソフトウェアが文書とともにリリースされる。この文書を
基にして附属文書が作成され,ヘルスソフトウェアがバリデーションの対象にできる真のヘルスソフトウ
ェア製品となる。
ヘルスソフトウェア製品のバリデーションについては,この規格では製品要求事項(4.2及び4.3参照)
に基づくバリデーション計画を要求している。バリデーションに合格すれば,ヘルスソフトウェア製品は,
ユーザニーズに適合しているとみなすことができる。ヘルスソフトウェア製品をリリースして市場投入す
るかどうかを決定するのは,製造業者の責任である。この決定には,バリデーションの結果以外の考慮事
項が影響することがある。
市販後の段階においては,製造業者は,ヘルスソフトウェア製品に対するフィードバックを受け取るか,
又は積極的に収集することになる。この情報又はその他の考慮事項に従って,市販後の活動について決定
してもよい。この活動には,ソフトウェア保守が含まれ,ソフトウェア保守は,該当する場合,最初に行
った開発と同じプロセスに従う必要がある。その他の市販後の活動は,例えば,セキュリティぜい(脆)
弱性について,ユーザ又は専門家と情報交換することである。
ヘルスソフトウェアに関連するハザードは,ユーザビリティの問題によって発生することがある。製品
要求事項を確立する際,ユーザビリティエンジニアリングプロセスについては,IEC 62366-1:2015を参考
にすることが望ましい。
JIS T 2304:2017は,医療機器ソフトウェアのライフサイクルプロセスを扱っており,ソフトウェア開発
ユーザニーズ
ユーザニーズへの適合
バリデーション報告書の
作成
バリデーション計画の
確立
ヘルスソフトウェア製品a)
のバリデーション
ソフトウェア保守
及び/又は
市販後の活動の
決定
市販後コミュニ
ケーション
意図する使用の確立,
初期リスクアセスメントの実施
製品要求事項の
確立
附属文書の作成
システム要求事項の確立
ヘルスソフトウェアの開発及びリリース
ヘルスソフトウェアの
保守
JIS T 2304に規定するソフトウェアライフサイクルプロセス
20
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
スキーム全体を対象とする。JIS T 2304は,他のシステム安全規格によって参照されるよう設計された。
この規格は,製品のライフサイクル全てを対象としており,該当する場合は,JIS T 2304:2017を引用する。
箇条5† ヘルスソフトウェア−ソフトウェアライフサイクルプロセス
この規格は,リスク/効用ベースのアプローチを組み込んでいる。この規格の利用者は,適合性を確認
するための一部として,リスクマネジメントプロセスを確立し,維持及び適用することが要求されている。
この要求事項は,他のソフトウェアライフサイクルプロセスの要求事項とともに,JIS T 2304:2017に規定
されている。この要求事項は,全てのヘルスソフトウェアに等しく適用し,この規格では,引用規格とし
て参照している。
箇条6† ヘルスソフトウェア製品のバリデーション
ヘルスソフトウェアの開発ライフサイクルモデルの最終段階は,ヘルスソフトウェア製品のバリデーシ
ョンである。バリデーションプロセスの目的は,ヘルスソフトウェア製品が意図する使用環境の下で,そ
の製品要求事項(4.2参照)を満たすことの客観的証拠を提示することである。ヘルスソフトウェア製品
のバリデーションは,正しい製品が製造されていることの保証を意図している。バリデーションは,バリ
デーションだけによって発見されるような予期しない相互作用が機能間で起こる可能性があるので,ヘル
スソフトウェア製品に対して重要である。
ヘルスソフトウェア製品のバリデーションには,大量のデータに対する試験,重い負荷又はストレス,
人的要因,性能,構成の両立性,データ,環境及びシステムの完全性,故障試験,文書化,安全並びにセ
キュリティを含めることができる。
利害関係の衝突を避け,かつ,設計者の憶測がヘルスソフトウェア製品のバリデーションの範囲を制限
しないこと又は範囲に影響しないことが望ましいので,(バリデーションの)独立性は,必要であり,強
く推奨される。独立性のレベルとして,例えば,次を含める。
a) 独立した要員
b) 独立した管理
c) 独立した組織
7.1† 識別情報
ソフトウェアは,簡単に更新又はアップグレードでき,その際にユーザが関与しなくてもよい場合もあ
る。重要なことは,使用しているヘルスソフトウェアのバージョンが識別できることである。“バージョ
ン識別子”という用語は,ヘルスソフトウェアの特定のバージョンを識別するために使用し,ソフトウェ
アのコピーそれぞれを識別するためには使用しない。各バージョンに使用する識別子は,使用しているヘ
ルスソフトウェアを,同じソフトウェアの以前のバージョンと区別することができるように,一意なもの
であることが望ましい。
7.2.3.2† ITネットワークで使用することを意図するヘルスソフトウェア
IEC 80001-1:2010及びIEC/TR 80001-2-2:2012は,適用範囲を医療機器及び/又は医療機器ソフトウェ
アに限定しているが,この規格では,上記規格を追加情報及び有用なガイダンスとして提言している。
IEC 80001-1:2010及びIEC/TR 80001-2-2:2012をこの規格とともに使用する際には,用語“医療機器”
は,“ヘルスソフトウェア製品”に,“医療機器製造業者”は,“ヘルスソフトウェア製品の製造業者”に
読み替える。
21
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] JIS Q 9000:2015 品質マネジメントシステム−基本及び用語
注記 原国際規格では,ISO 9000:2015,Quality management systems−Fundamentals and vocabularyを
記載している。
[2] JIS Q 13485:2018 医療機器−品質マネジメントシステム−規制目的のための要求事項
注記 原国際規格では,ISO 13485:2016,Medical devices−Quality management systems−Requirements
for regulatory purposesを記載している。
[3] JIS T 0601-1:2017 医用電気機器−第1部:基礎安全及び基本性能に関する一般要求事項
注記 原国際規格では,IEC 60601-1:2005,Medical electrical equipment−Part 1: General requirements
for basic safety and essential performance及びAmendment 1:2012を記載している。
[4] JIS T 0601(規格群)及びJIS T 60601(規格群) 医用電気機器
注記 原国際規格では,IEC 60601 (all parts),Medical electrical equipmentを記載している。
[5] JIS T 80601(規格群) 医用電気機器
注記 原国際規格では,IEC 80601 (all parts),Medical electrical equipmentを記載している。
[6] JIS T 14971:2012 医療機器−リスクマネジメントの医療機器への適用
注記 原国際規格では,ISO 14971:2007,Medical devices−Application of risk management to medical
devicesを記載している。
[7] JIS X 0160:2012 ソフトウェアライフサイクルプロセス
注記 原国際規格では,ISO/IEC 12207:2008,Systems and software engineering−Software life cycle
processesを記載している。
[8] JIS X 0161:2008 ソフトウェア技術−ソフトウェアライフサイクルプロセス−保守
注記 原国際規格では,ISO/IEC 14764:2006,Software Engineering−Software Life Cycle Processes−
Maintenanceを記載している。
[9] JIS Z 8051:2015 安全側面−規格への導入指針
注記 原国際規格では,ISO/IEC Guide 51:2014,Safety aspects−Guidelines for their inclusion in
standardsを記載している。
[10] ISO 14708 (all parts),Implants for surgery−Active implantable medical devices
[11] ISO/TR 17791:2013,Health informatics−Guidance on standards for enabling safety in health software
[12] ISO/IEC Guide 63:2012,Guide to the development and inclusion of safety aspects in International Standards
for medical devices
[13] IEC 61907:2009,Communication network dependability engineering
[14] IEC 62366-1:2015,Medical devices−Part 1: Application of usability engineering to medical devices
[15] IEC 80001-1:2010,Application of risk management for IT-networks incorporating medical devices−Part 1:
Roles, responsibilities and activities
[16] IEC/TR 80001-2-2:2012,Application of risk management for IT-networks incorporating medical devices−Part
2-2: Guidance for the disclosure and communication of medical device security needs, risks and controls
[17] IEEE 1044:1993,Classification for software anomalies
[18] WHO:1946−Preamble to the Constitution of the World Health Organization as adopted by the International
22
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
Health Conference, New York, 19-22 June, 1946; signed on 22 July 1946 by the representatives of 61 States
(Official Records of the World Health Organization, no. 2, p. 100) and entered into force on 7 April 1948.
[19] IMDRF/SaMD WG/N10FINAL:2013, Software as a Medical Device (SaMD): Key Definitions
<http://www.imdrf.org/docs/imdrf/final/technical/imdrf-tech-131209-samd-key-definitions-140901.pdf>
[20] HIMSS/NEMA HN 1-2013 Manufacturer Disclosure Statement for Medical Device Security
<https://www.nema.org/Standards/Pages/Manufacturer-Disclosure-Statement-for-Medical-Device-Security
.aspx>
[21] 公益社団法人日本WHO協会
<http://www.japan-who.or.jp/>
[22] JIS C 1010(規格群) 測定用,制御用及び試験室用電気機器の安全性
23
T 82304-1:2018 (IEC 82304-1:2016)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
定義した用語の索引
この規格で定義した用語を五十音順に,次に示す。
定義した用語
細分箇条
あ
ITネットワーク(IT-NETWORK)
安全(SAFETY)
3.9
3.19
い
異常(ANOMALY)
意図する使用,意図する目的(INTENDED USE,INTENDED PURPOSE)
3.2
3.8
き
危害(HARM)
危険状態(HAZARDOUS SITUATION)
3.3
3.5
け
検証(VERIFICATION)
3.24
さ
残留リスク(RESIDUAL RISK)
3.11
せ
製造業者(MANUFACTURER)
責任部門(RESPONSIBLE ORGANIZATION)
セキュリティ(SECURITY)
3.10
3.12
3.20
そ
ソフトウェア保守(SOFTWARE MAINTENANCE)
3.21
は
ハザード(HAZARD)
バリデーション(VALIDATION)
3.4
3.23
ふ
附属文書(ACCOMPANYING DOCUMENT)
3.1
へ
ヘルスソフトウェア(HEALTH SOFTWARE)
ヘルスソフトウェア製品(HEALTH SOFTWARE PRODUCT)
3.6
3.7
ゆ
ユーザ(USER)
3.22
り
リスク(RISK)
リスクアセスメント(RISK ASSESSMENT)
リスクコントロール(RISK CONTROL)
リスク評価(RISK EVALUATION)
リスク分析(RISK ANALYSIS)
リスクマネジメント(RISK MANAGEMENT)
3.13
3.15
3.16
3.17
3.14
3.18


