T 8061:2015
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 原理······························································································································· 5
5 微生物及び試薬 ················································································································ 5
6 試験装置························································································································· 5
6.1 浸透テストセル ············································································································· 5
6.2 その他の装置 ················································································································ 6
6.3 実験用器具 ··················································································································· 6
7 試験片···························································································································· 6
7.1 試験片の採取 ················································································································ 6
7.2 試験片の準備 ················································································································ 7
8 試験······························································································································· 7
8.1 試験培地の調製 ············································································································· 7
8.2 コントロール ················································································································ 8
8.3 バクテリオファージ負荷試験懸濁液の調製 ·········································································· 8
8.4 材料適合性の判定 ·········································································································· 8
8.5 平板培地の調製 ············································································································· 9
8.6 材料の予備測定 ············································································································· 9
8.7 浸透テストセルの準備 ···································································································· 9
8.8 バクテリオファージ負荷試験懸濁液への材料の暴露 ····························································· 10
8.9 回収液の定量 ··············································································································· 11
8.10 試験結果の解析 ··········································································································· 11
9 試験報告書 ····················································································································· 12
附属書JA(参考)液体培養によるバクテリオファージ原液の調製方法 ·········································· 16
附属書JB(参考)平板培地を用いたバクテリオファージ原液の調製方法 ······································· 17
参考文献 ···························································································································· 18
附属書JC(参考)JISと対応国際規格との対比表 ······································································ 19
T 8061:2015
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,公益社団法人日本
保安用品協会(JSAA)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格
を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣及び経済産業大臣が改正
した日本工業規格である。これによって,JIS T 8061:2010は改正され,この規格に置き換えられた。
また,令和2年10月26日,産業標準化法第17条又は第18条の規定に基づく確認公示に際し,産業標
準化法の用語に合わせ,規格中“日本工業規格”を“日本産業規格”に改めた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣,経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の
特許出願及び実用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
T 8061:2015
血液及び体液の接触に対する防護服−防護服材料の
血液媒介性病原体に対する耐浸透性の求め方−
Phi-X174バクテリオファージを用いる試験方法
Clothing for protection against contact with blood and body fluids-
Determination of resistance of protective clothing materials to penetration by
blood-borne pathogens-Test method using Phi-X174 bacteriophage
序文
この規格は,2004年に第1版として発行されたISO 16604を基とし,利用者の利便性を考慮するため,
技術的内容を変更して作成した日本産業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JCに示す。また,附属書JA及び附属書JBは対応国際規格に
はない事項である。
1
適用範囲
この規格は,血液媒介性病原体に対する防護服材料の耐浸透性の求め方について規定する。この規格で
は,継続的な液体接触の条件下で代用微生物(Phi-X174バクテリオファージ)を使用して行う。防護服の
性能の評価は,JIS T 8031に規定する試験装置を使用する。特定の静水圧におけるウイルス浸透の検知に
よって行う。
この規格は,試験液を容易に吸収する厚いライナを内張りした防護服材料については,必ずしも有効で
あるとは限らない。この規格で規定する試験方法は長時間を要するため,材料又は防護服の品質管理又は
品質保証手順には適切でない場合がある。
また,この規格で規定する試験方法は,バクテリオファージの培養等基礎的な微生物学的手法に関する
知識が必要である。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 16604:2004,Clothing for protection against contact with blood and body fluids−Determination of
resistance of protective clothing materials to penetration by blood-borne pathogens−Test method
using Phi-X174 bacteriophage(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
2
T 8061:2015
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3362 家庭用合成洗剤試験方法
JIS K 8008 生化学試薬通則
JIS L 1096 織物及び編物の生地試験方法
注記 対応国際規格:ISO 3801,Textiles−Woven fabrics−Determination of mass per unit length and
mass per unit area,ISO 5084,Textiles−Determination of thickness of textiles and textile products
(全体評価:MOD)
JIS T 8031 化学防護服−防護服材料の加圧下における耐液体浸透性試験
注記 対応国際規格:ISO 13994,Clothing for protection against liquid chemicals−Determination of the
resistance of protective clothing materials to penetration by liquids under pressure(MOD)
JIS T 8060 血液及び体液の接触に対する防護服−防護服材料の血液及び体液に対する耐浸透性の求
め方−人工血液を用いる試験方法
注記 対応国際規格:ISO 16603,Clothing for protection against contact with blood and body fluids−
Determination of the resistance of protective clothing materials to penetration by blood and body
fluids−Test method using synthetic blood(MOD)
ISO 304,Surface active agents ‒ Determination of surface tension by drawing up liquid films
ISO 3696,Water for analytical laboratory use−Specification and test methods
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
寒天培地(agar)
寒天を用いた細菌及びその他の微生物を培養する半流動混合物。
3.2
測定(assay)
特定の要素の存在又はその濃度を決定するための試験。
注記 この規格における特定の要素とは,微生物(Phi-X174バクテリオファージ)である。
3.3
回収液(assay fluid)
微生物の浸透を測定するため,試験材料の表面洗浄に使用する滅菌された液。
注記 この規格では,回収液をブイヨンとし,試験微生物はPhi-X174バクテリオファージを用いてい
る。この液は,試験片の内側表面からPhi-X174バクテリオファージを洗浄,回収するために使
用している。
3.4
バクテリオファージ(bacteriophage)
バクテリアに感染するウイルスの1タイプ。
注記 この規格で使用するバクテリオファージは,Phi-X174バクテリオファージ(ATCC 13706-B1)
(以下,Phi-X174バクテリオファージという。)である。Phi-X174バクテリオファージは,ヒト
に対しての病原性はないが,ヒトに対する病原性ウイルスのシミュレーションとして使用され
ている。
3
T 8061:2015
3.5
血液媒介性病原体(blood-borne pathogen)
血液又はその他の体液を介して伝ぱ(播)する病原体の総称。
3.6
体液(body fluid)
体内で作られる(分泌性又は外分泌性の)全ての液体。
注記 この規格では,体液には,血液,精液,ちつ(膣)分泌液,脳脊髄液,滑液,腹膜液,羊膜液,
及び歯科治療における唾液だけではなく,明らかに血液又は病原体に汚染している可能性のあ
る体液,及び同定不能な全ての体も含まれている。
3.7
擬似体液(body fluid simulant)
人間の体液モデルとしての機能を果たす液体。
注記 この規格では,擬似体液はバクテリオファージブイヨン又は人工血液とし,血液及び体液(唾
液を除く。)の表面張力の下限(0.042±0.002)N/mに調整したものをヒトの体液モデルとして
使用している。
3.8
負荷試験懸濁液(challenge suspension)
材料の耐浸透性試験に使用する要素を含む液体。
注記 この規格では,負荷試験懸濁液はPhi-X174バクテリオファージを含むブイヨン又は人工血液と
している。
3.9
ローン(lawn)
ペトリ皿内の表層寒天培地の薄層内の細菌層。
注記 この規格では,ローン形成に使用する細菌として大腸菌[E.coli. C(ATCC 13706)](以下,大
腸菌という。)を選択している。
3.10
溶菌(lysis)
細菌細胞全体の分解又は崩壊。
注記 この規格では,宿主菌である大腸菌はバクテリオファージにて溶菌される。
3.11
培地(medium,media)
特定の微生物を培養する混合物(例えば,バクテリオファージのブイヨン及び寒天培地)。
3.12
形態(morphology)
特定生物体の形及び構造。
3.13
ブイヨン(nutrient broth)
液体培地。
注記 この規格では,ブイヨンは宿主菌である大腸菌の培養に使用する。また,Phi-X174バクテリオ
ファージの懸濁液の作製,洗浄用の回収液及び希釈液として,この試験の各段階で使用してい
4
T 8061:2015
る。
3.14
浸透(penetration)
粒子又は液状物質が,防護服の多孔質材料,縫合部,ピンホール,その他の不完全な部分などを非分子
レベルで通過するプロセス。
3.15
プラーク(plaque)
理論的に生育可能な単一のウイルスによる感染及び宿主菌の溶菌の結果,生成する目視可能な透明な領
域。
注記 この規格では,プラークは表層寒天培地に植え付けた大腸菌のローン内の目に見える透明な領
域をいう。この領域は理論的に生育可能な単一のPhi-X174バクテリオファージによってもたら
されるものであり,その領域ではバクテリオファージの感染及び溶菌作用によって細菌が破壊
されている。
3.16
プラーク形成単位 PFU(plaque-forming unit)
プラークを形成する能力をもつウイルス粒子の単位。
注記 理論的には,ローン内の1 PFUが生育可能な単一のウイルスに相当する。
3.17
平板培地(plate)
寒天培地の入ったペトリ皿。
3.18
防護服(protective clothing)
有害物質の暴露又は接触から,作業者の身体の全体又は一部を防護するために着用する衣服。
3.19
人工血液(synthetic blood)
アマランス色素,界面活性剤,増粘剤,無機塩類及び蒸留水の混合液で,血液及び幾つかの体液を代表
する表面張力及び粘度をもつ液体。
注記 この規格における人工血液は,実際の血液又は体液の全ての特性(色,凝固,細胞物質の構成
など)を模擬するものではない。
3.20
代用微生物(surrogate microbe)
この試験方法で,病原体の代わりに使用する微生物。
注記 この規格では,Phi-X174バクテリオファージを代用微生物としている。
3.21
力価(titre)
特定量の他の物質との反応に必要な物質量又はそれに相当する物質量。
注記 この規格では,mL当たりのプラーク形成単位(PFU/mL)で測定した生育可能なバクテリオフ
ァージの量を示すために力価を使用している。
5
T 8061:2015
3.22
ウイルス(virus)
代謝機能がなく,生きている宿主細胞内でだけ複製できる微生物。
3.23
ウイルス浸透(viral penetration)
ウイルスが材料を通過するプロセス。
注記 この規格では,防護服材料の開閉具,縫合部,多孔質材料,その他の不完全な部分などをPhi-X174
バクテリオファージが通過するプロセスをいう。
3.24
耐ウイルス浸透性(viral resistant)
特定の試験条件下及び検出方法の下でのウイルス浸透を阻止する材料の性能。
4
原理
JIS T 8031で規定する試験装置内に置かれた,擬似体液であるウイルスの入ったブイヨン又はJIS T 8060
の箇条5(人工血液)の人工血液に,規定時間及び規定圧力に従って試験片を暴露する。液体の浸透が目
視できない場合でも,材料を浸透する生育可能なウイルスを検出することができる手順を用いて,目視で
きない浸透を検出する。
5
微生物及び試薬
5.1
Phi-X174バクテリオファージ[Phi-X174(ATCC 13706-B1)]
5.2
Phi-X174バクテリオファージ負荷試験懸濁液 試験終了後,浸透テストセルから回収されたバクテ
リオファージ負荷試験懸濁液の力価は,1.0×108 PFU/mL(mL当たりのプラーク形成単位)以上でなけれ
ばならない。
注記 この規格で用いる代用微生物であるPhi-X174バクテリオファージは,その微小なサイズ,球状
形態(正二十面体),環境安定性,ヒトへの非感染性,高い分析感度,迅速な分析,高力価など
の理由で,血液媒介性病原体の最適なモデルとして選択した。Phi-X174バクテリオファージに
は外被がなく,また,既知のウイルスの中で最も小さなウイルスの一つである(直径0.027 µm)。
5.3
大腸菌[E.Coli. C(ATCC 13706)]
5.4
精製水 ISO 3696に規定するグレード3の水,又はJIS K 8008の3.2(水)に規定した精製水,又
は同等以上の精製水。
5.5
ブイヨン
5.6
塩化カルシウム
5.7
塩化カリウム
5.8
水酸化ナトリウム
5.9
界面活性剤 濃度0.1 %のもの。例えば,ポリソルベート80。
5.10
細菌用寒天
6
試験装置
6.1
浸透テストセル
浸透テストセルは,JIS T 8031に規定するもので,加圧した試験液に接触する試験片を固定するものと
6
T 8061:2015
し,次による。
a) 試験片は,浸透テストセル内で,Phi-X174バクテリオファージ負荷試験懸濁液と浸透テストセルの観
測面とを分離する隔壁としての役割を果たす。
b) セル本体は,セル支持台にしっかりと固定する。
c) セル本体には,約60 mLのPhi-X174バクテリオファージ負荷試験懸濁液を満たす。開口部のあるフ
ランジカバー(透明カバーを含む。)によって目視観察ができる。セル本体には,液体を注入するトッ
プポート及び液体を排出する排出弁を備える。セル本体のトップポートに空気ホースを接続する継手,
ガスケット,支持スクリーンなどのその他の部品も必要である。
d) 支持スクリーン付き浸透テストセル例及び試験装置例を,それぞれ図1及び図2に示す。内径が57 mm
である浸透テストセル本体の仕様例を,図3に示す。
6.2
その他の装置
6.2.1
厚さゲージ 0.02 mmの厚さまで測定できるものとする。
6.2.2
支持スクリーン 平滑に仕上げたプラスチック又は金属製のスクエアメッシュスクリーンで,伸縮
性のある材料又は弾性のある材料を支持し,その仕様は,次による。
a) 開口率は,50 %を超えるものとする。
b) 試験片のたわみは,5.0 mm以下とする。
6.2.3
空気源 (20 02
+)kPaで空気を供給できるものとする。
6.2.4
インキュベータ 温度範囲36±1 ℃を保持できるものとする。
6.2.5
ウォーターバス 温度範囲45±2 ℃を達成できるものとする。
6.2.6
はかり(秤) 精度0.001 g以内で計測できるものとする。
6.2.7
ボルテックスミキサ
6.2.8
冷蔵庫 温度範囲5±3 ℃を保持できるものとする。
6.2.9
オートクレーブ 122±1 ℃及び(214±7)kPa(絶対圧力)を保持できるものとする。
6.2.10
ストップウォッチ又は適切な時間計測器
6.2.11
回転シェーカ
6.2.12
pH計 精度0.1で計測できるものとする。
6.2.13
接種用ループ
6.2.14
分光光度計 640 nmの波長の吸光度を測定できるものとする。
6.2.15
遠心分離機 遠心加速度10 000 gの加速ができるものとする。
6.3
実験用器具
6.3.1
ペトリ皿 滅菌済みで,高さ15 mm×直径100 mmのものとする。
6.3.2
ピペット 滅菌済み,容量1 mL,5 mL,及び10 mLとする。
6.3.3
試験管 直径13 mm×長さ100 mmとする。
6.3.4
試験管立て
6.3.5
ガラス瓶 滅菌済み,容量100〜500 mLとする。
6.3.6
マイクロピペット 正確に2 µLを注入できるものとする。
7
試験片
7.1
試験片の採取
試験片の採取方法は,次による。
7
T 8061:2015
a) 材料サンプル又は防護服完成品から試験片を採取する。これらの試験片は,単一層又は全ての構成層
が防護服完成品と同じ順序で配置された複数層複合材料からなる(必要に応じて滅菌する)。
b) 防護服の設計において,異なる部位に異なる材料又は異なる厚さの材料が用いられる場合は,それぞ
れの部位から試験片を採取する。
c) 防護服の設計において,縫合部が基材と同じ防護性をもたせる場合は,縫合部を含む試験片を追加し
て試験する。
d) 試験片の大きさは,1辺の長さが70 mm以上の正方形とする。
e) 試験枚数は3枚とし,各材料,各複合材料,各部位(異なる材料からなる場合)又は他の異なる条件
の部分から各々3枚をランダムに採取し試験する。
f)
2枚の織物層の間に不浸透性層が存在する防護服材料は,縁辺部での毛細管現象による見せかけの不
合格が発生する可能性がある。試験片の縁辺部をシールし,毛細管現象による影響を防止する。試験
実施前に,接着剤,パラフィルム,パラフィンワックス又は裏面粘着式の発泡体で試験片をシールす
る。試験片の縁辺部だけをシールし,中央の57 mm試験領域(57 mm角)を試験用にあけておく。試
験領域の試験片内部にシール剤が浸入し,ブロック・遮断すると試験の信頼性が損なわれるため,こ
れらを防止しなければならない。防護服材料に適したシール剤又はシール方法を選択する。
7.2
試験片の準備
特に指定がない場合は,試験片を気温21±5 ℃及び相対湿度(60±10)%に最低24時間暴露して調整
する。試験に使用する試験片は,必ず滅菌するものとする。
必要であれば,滅菌などの他の試料調整を行い,防護服の機能劣化を評価する。
8
試験
8.1
試験培地の調製
8.1.1
ブイヨン
ブイヨンは,次による。
− バクトトリプトン(Bacto-trypton) (8.0±0.1)g
− 塩化カリウム
(5.0±0.06)g
− 塩化カルシウム
(0.2±0.003)g
− 精製水(5.4参照)
(1 000±12.5)mL
− 界面活性剤(5.9参照)
(0.1±0.001 25)mL
a) バクトトリプトン,塩化カリウム,塩化カルシウム及び精製水を混合する。
b) a) で混合した溶液のpHを,7.3±1に調整する(例えば,2.5 mol/Lの水酸化ナトリウムを用いる)。
c) 1容量の0.1 %界面活性剤溶液を,9容量のb) の溶液で薄めて(容量比1:9で希釈して),ブイヨン
とする。滅菌前に両者を十分に混合させるために,界面活性剤のかくはん中は,ブイヨンを加熱する。
表面張力を(0.042±0.002)N/mに調整するためには,濃度0.01 %の界面活性剤を用いることが望
ましい。
d) ブイヨンをオートクレーブに入れて滅菌する。
e) 滅菌溶液の表面張力は,ISO 304又はJIS K 3362の8.4(表面張力)に従って測定する。ブイヨンは,
修正後の表面張力が(0.042±0.002)N/mの範囲内でない限り,使用してはならない。
8.1.2
底層培地
底層培地は,次による。
8
T 8061:2015
− 細菌用寒天(Bacto-agar)
(15.0±0.19)g
− ブイヨン
(8.0±0.1)g
− 塩化カリウム
(5.0±0.06)g
− 精製水(5.4参照)
(1 000±12.5)mL
− 塩化カルシウム溶液
(1.0±0.012 5)mL
a) 細菌用寒天,ブイヨン,塩化カリウム及び精製水の混合溶液を,オートクレーブに入れて滅菌する。
b) 精製水を用いて,1 mol/Lの塩化カルシウム溶液を調製し,オートクレーブに入れて滅菌する。
c) a) の混合溶液にb) の塩化カルシウム溶液を加えて,底層培地とする。
d) c) の底層培地のpHを7.3±1に調整する(例えば,2.5 mol/Lの水酸化ナトリウムを用いる)。
e) pHを調整した底層培地を,再度オートクレーブに入れて滅菌する。
f)
大腸菌の増殖が悪い場合は,ブイヨンに替えて,バクトトリプトンを使用してもよい。
8.1.3
表層培地
表層培地は,次による。
− 細菌用寒天(Bacto-agar)
(7.0±0.09)g
− ブイヨン
(8.0±0.1)g
− 塩化カリウム
(5.0±0.06)g
− 精製水(5.4参照)
(1 000±12.5)mL
− 塩化カルシウム溶液
(1.0±0.012 5)mL
a) 細菌用寒天,ブイヨン,塩化カリウム及び精製水の混合溶液をオートクレーブに入れて滅菌する。
b) 精製水を用いて,1 mol/Lの塩化カルシウム溶液を調製し,オートクレーブに入れて滅菌する。
c) a) の混合溶液にb) の塩化カルシウム溶液を加えて,表層培地とする。
d) c) の表層培地のpHを7.3±1に調整する(例えば,2.5 mol/Lの水酸化ナトリウムを用いる)。
e) pHを調整した表層培地を,再度オートクレーブに入れて滅菌する。
f)
大腸菌の増殖が悪い場合は,ブイヨンに替えて,バクトトリプトンを使用してもよい。
8.2
コントロール
次のコントロールを,各防護服材料の試験を行うとき,同時に使用して評価する。
a) バックグラウンドの判定は,平板培地又は適切な手段による。
b) 少なくとも1日1回,次のものを標品として使用する。
1) 陰性試験の標品 医療包装用ポリエステルフィルムなどの,厚い不浸透性モノリシックフィルムか
ら作られたサンプル。
2) 陽性試験の標品 Phi-X174バクテリオファージの平均直径0.027 µmを僅かに超える孔径(0.050±
0.005)µmのマイクロフィルタから作られたサンプル。
8.3
バクテリオファージ負荷試験懸濁液の調製
バクテリオファージ負荷試験懸濁液の調製方法は,8.4で指定した濃度となるように,バクテリオファー
ジ原液をブイヨン又は人工血液を用いて薄め,バクテリオファージ負荷試験懸濁液を調製する。8.9で規定
する測定手順を用いて最終的なバクテリオファージ濃度(力価)を確認する。
なお,バクテリオファージ原液調製方法の例を,附属書JA及び附属書JBに示す。
8.4
材料適合性の判定
バクテリオファージ負荷試験懸濁液の力価に影響を及ぼす可能性がある防護服材料の適合性試験を行う。
a) 試験対象の各材料を代表する3試験片を試験する。
9
T 8061:2015
b) セル本体を水平に置いた状態で,滅菌試験片の外側表面をセルのバクテリオファージ負荷試験懸濁液
充塡側に向けて,無菌状態を保持しながらセル本体の上に置く。
c) 図1に示すとおりにセルの滅菌済部品を組み立てる。
注記 透明カバーは,この時点では装着しない。
d) 浸透テストセルのボルトを,均等に締める。
e) 浸透セルを水平に置いたまま,バクテリオファージ試験懸濁液2.0 µL[Phi-X174が(900〜1 200)PFU]
の入ったブイヨンを各試験片の中心部付近に滴下し,10分間放置する。
f)
8.8 l) によって,試験片に滴下したバクテリオファージ試験懸濁液を回収する。
g) 8.9によって定量的に測定する。
h) Phi-X174バクテリオファージ試験懸濁液2.0 µLを,5.0 mLの滅菌ブイヨンに直接加え,力価の標準液
とする。
i)
h) の力価とe) の試験材料適合性試験のPhi-X174バクテリオファージの力価との比率を計算する。
j)
材料試験片の暴露試験(8.8参照)に使用するPhi-X174バクテリオファージ負荷試験懸濁液(8.3参照)
の力価は,(2〜3)×108 PFU/mLにi) で計算された比率を乗じた値に等しくなるように調製する。計
算された比率が5.0を超えた場合,バクテリオファージ負荷試験懸濁液の最大力価は,1×109 PFU/mL
となるように調整する。
8.5
平板培地の調製
平板培地を選択した場合は,無菌試験片の取付け,充塡,試験,廃液,測定などの操作を行う間,エア
ロゾル化した又は浮遊粒子としてのPhi-X174バクテリオファージによる影響を受けないようにする。平板
培地を,次のように調製する。
a) 溶かした滅菌表層培地2.5 mLを滅菌試験管に分注し,表層培地の温度を45±2 ℃に保つ。平板培地
それぞれに対して試験管1本分を調製する。
b) 5〜6時間培養した大腸菌100 µLを各試験管の表層培地に加える。
c) 試験管を十分にかくはんし,内容物を底層培地の表面に注入する。
d) 培地を固化する。静置平板培地を直ちに使用してもよい。
e) 使用後,バックグラウンド,試験サンプル地及び陽性・陰性標品の試験のため,平板培地は各2枚準
備する。
8.6
材料の予備測定
a) 滅菌前に,JIS L 1096の8.4(厚さ)A法(JIS法)に従って各試験片の厚さを0.02 mm単位まで測定
する。
b) 滅菌前に,JIS L 1096の8.3(単位面積当たりの質量)A法(JIS法)によって単位面積当たりの各試
験片の質量を10 g/m2単位で測定する。
c) 伸縮性又は弾性の材料を測定する場合は,支持スクリーンを用いてもよい。
d) 8.4によって,各材料の適合性を判定する。
8.7
浸透テストセルの準備
浸透テストセルを122±1 ℃及び(214±7)kPa(絶対圧力)で15分間オートクレーブで滅菌する。そ
の後,テストセルを室温まで冷やす。
セル本体を水平に置いた状態で,試験片の外側表面をPhi-X174バクテリオファージ負荷試験懸濁液充塡
側に向けて,試験片を無菌状態でセル本体の上に置く。
伸縮性又は弾性のある試験片は,フランジカバーと試験片との間に,支持スクリーンを用いてもよい。
10
T 8061:2015
テストセルの各滅菌部品を,次のように組み立てる。
a) セル本体と試験片との間,試験片と支持スクリーン(使用する場合)との間及び支持スクリーンとフ
ランジカバーとの間に図1で示すようにガスケットを置く。
b) フランジカバー及び透明カバーを載せてテストセルを閉じる(滅菌された透明のプラスチックフィル
ムを透明カバーの代用品として使用してもよい)。セル本体と試験片との間に使用する液漏れ防止用の
ガスケット材料には,圧縮性ポリテトラフルオロエチレン(PTFE)を推奨する。
c) 浸透テストセルのねじを,均等に締める。
d) 図2で示すように,浸透テストセルを試験装置内に垂直に取り付ける(排出弁が下向きになるように)。
この時点では浸透テストセルに図2の8の空気ホースは接続しない。
e) 排出弁を閉じる。
8.8
バクテリオファージ負荷試験懸濁液への材料の暴露
次の手順で,各材料試験片をバクテリオファージ負荷試験懸濁液に暴露する。
a) 表1から試験手順を選択する。
b) トップポートから約60 mLのPhi-X174バクテリオファージ負荷試験懸濁液を慎重に注入し(滅菌注
射器又はロートを用いると注入しやすい。)浸透テストセルのセル本体を満たす。試験中に試験片から
液が浸透してきたら,k) の手順に進む。
c) 図2の8の空気ホースを浸透テストセルに接続する。
d) 圧力調整器を0 kPaの圧力に設定し,セル用ベントバルブを閉じる。
e) 表1の手順で指示された圧力及び時間をバクテリオファージ負荷試験懸濁液に加え,セル用ベントバ
ルブを開き,(3.5±0.5)kPa/s又はそれ未満の速度で昇圧させる。規定された時間,規定されたレベル
の圧力を維持する。
f)
各圧力における時間の最後に,液体の浸透又はその他,ぬれの痕跡が試験片の観察表面(内側表面)
に現れるかを観察する。これらの現象が見られた場合は,液体の浸透又はぬれが観察された時間を記
録する。
g) 浸透又はぬれが見られない場合は,次の時間・圧力条件に進み,試験を続行する。
h) 試験結果が確認された時点で,セル用ベントバルブを閉じ,加圧を停止する。
i)
試験の終了時には,排出弁を開いて浸透テストセル内のバクテリオファージ負荷試験懸濁液を排出す
る。
j)
バクテリオファージの生存率が試験中に減少しなかったことを確認するため,試験後に,少なくとも
最後の浸透テストセルから採取したPhi-X174バクテリオファージ負荷試験懸濁液を薄めて測定する。
k) セルを水平に置いて透明カバーを外す。
l)
透明カバーを外してすぐに,試験片の観測表面(内側表面)に0.01 %の界面活性剤を入れた5.0 mL
の滅菌ブイヨンをゆっくりと滴下する。浸透セルを1分間静かに旋回させるか又は揺り動かし,この
回収液を試験片の観察表面全体に確実に接触させる。滅菌済みピペットを使用して,回収液をできる
だけ吸い取り滅菌済みガラス瓶に移す。試験片に回収液が染み込んでいる場合は,大量の水で洗浄,
回収する。大量の水で洗浄しなければならない場合には,試験報告書内のPFU/mLの計算結果を換算
する。
m) 8.9によって速やかに測定する。長時間経過すると,回収液内バクテリオファージの安定性を検証する
ために採取した回収液と実際の回収液とで差が生じて無効になることがある。
n) 試験装置を分解し,浸透テストセルを洗浄する。汚染を避けるために空気ホースを定期的に滅菌する。
11
T 8061:2015
適切な薬剤で浸透セルをすすぎ洗いし,122±1 ℃及び(214±7)kPa(絶対圧力)のオートクレーブ
で滅菌処理を行う。
o) 残りの試験片を,表1に従って試験する。
表1−試験手順
手順
圧力及び時間
選択の目安
A
5分間0 kPa,
続いて1分間14 kPa,
続いて4分間0 kPa
この手順を採用する材料及び構成要素は,次
の場合を想定している。
a) 大量の血液又は体液を取り扱う場合。
b) 液体に直接接触する場合。
B
5分間0 kPa,
続いて5分間1.75 kPa,
続いて5分間3.5 kPa,
続いて5分間7 kPa,
続いて5分間14 kPa,
続いて5分間20 kPa
この手順を採用する材料及び構成要素は,次
の場合を想定している。
a) 血液又は体液を取り扱う場合。
b) 手順Aと異なる圧力下で使用する場合。
C
5分間0 kPaの後は,各条件のうち,いずれかの1条件を
選択して続ける。
5分間1.75 kPa,
5分間3.5 kPa,
5分間7 kPa,
5分間14 kPa,
5分間20 kPa
伸縮性材料又は弾性材料の試験で,支持スクリーンを使用した場合は,その旨を試験報告書に記載する。
注記1 現場の作業内容並びにその分析及び予想される暴露量に基づいて,必要とされる防護レベルを決定するこ
とが望ましい。
注記2 JIS T 8060での目視による浸透が確認できなかった最高圧力を,この規格の手順Cの試験圧力として用い
てもよい。
8.9
回収液の定量
回収液中のバクテリオファージ数を,次の手順で定量する。
a) 溶かした滅菌表層培地2.5 mLを滅菌試験管に分注し,表層培地を45±2 ℃に保つ。
b) 各測定用の平板培地を2枚用意する。
c) 試験管を熱源から離し,各試験片の回収液0.5 mLを表層寒天培地の入った試験管に注入して,接種用
試験管とする。
d) 5〜6時間培養した大腸菌100 μLをそれぞれ接種用試験管に加える。
e) 試験管を十分にかくはんし,底層平板培地の表面に注入する。
f)
培地を固化し,プラークがはっきりと目視できるまで36±1 ℃で培養する(通常6時間以上)。
g) プラークの存在を観察し,8.10によってその結果を解析する。
h) 定量化する必要がある場合及びプラーク数があまりに多すぎる場合は,回収液のバクテリオファージ
ブイヨンでそれぞれに1:10の希釈液を調製し,8.9の手順a)〜g) に従ってバクテリオファージを測
定する。
8.10
試験結果の解析
試験の成立条件及び試験結果の解析は,次による。
12
T 8061:2015
a) 試験の成立条件
1) 次の条件を全て満たすとき,その試験は有効と判定する。
1.1) バックグラウンドで,1 PFU/mL以上のPhi-X174バクテリオファージの検出が認められない場合。
1.2) 陰性試験の標品で,1 PFU/mL以上のPhi-X174バクテリオファージの検出が認めらない場合。
1.3) 陽性試験の標品で,1 PFU/mL以上のPhi-X174バクテリオファージの検出が認められた場合。
2) バックグラウンドで,1 PFU/mL以上のPhi-X174バクテリオファージの検出が認められた場合でも,
試験片にバクテリオファージの浸透又はぬれが認められない場合,その試験は有効としてもよい。
b) 試験結果の解析
負荷力価において,1 PFU/mL以上のPhi-X174バクテリオファージの検出が認められた場合,その
試験片は,浸透又はぬれがあったものとする。
9
試験報告書
試験報告書には,次の情報を記載する。
a) この規格に従って試験したことの記載(例えば,JIS T 8061:2015)
b) 製造業者名及び材料名(例えば,品名,品番など)
c) 試験片採取方法(ロール原反から採取,防護服完成品から採取など)の説明
d) 試験片の材料特性
1) 試験片の繊維及びコーティングの種類
2) 防護服完成品から採取した試験片については,次の項目を明示する。
2.1) 構成(例えば,複合材料など)
2.2) 縫合部のタイプ
2.3) 各試験片の製品での部位
3) 滅菌した方法
4) その他(例えば,前処理条件など)
e) 各試験片の厚さ及び必要な場合は,試験実施後の平均厚さ(mm)
f)
各試験片の単位面積当たりの質量及び必要な場合は,試験実施後の単位面積当たりの平均質量(g/m2)
g) 表1から選択した手順
h) 支持スクリーンを使用した場合は,その種類及び仕様
i)
適合性試験(8.4参照)で算出した比率
j)
この試験の有効性を確認するための試験結果
1) バックグラウンドのPFU/mL
2) 陽性・陰性試験標品,それぞれの回収液のPFU/mL
3) 開始時及び終了時のバクテリオファージの力価
k) 各試験片については,規定圧力及び規定時間ごとの浸透又はぬれの有無
l)
各陽性・陰性試験の標品については,浸透又はぬれを認めて試験を中止した圧力
m) 各試験片に液の浸透又はぬれが認められた時間(報告する場合)
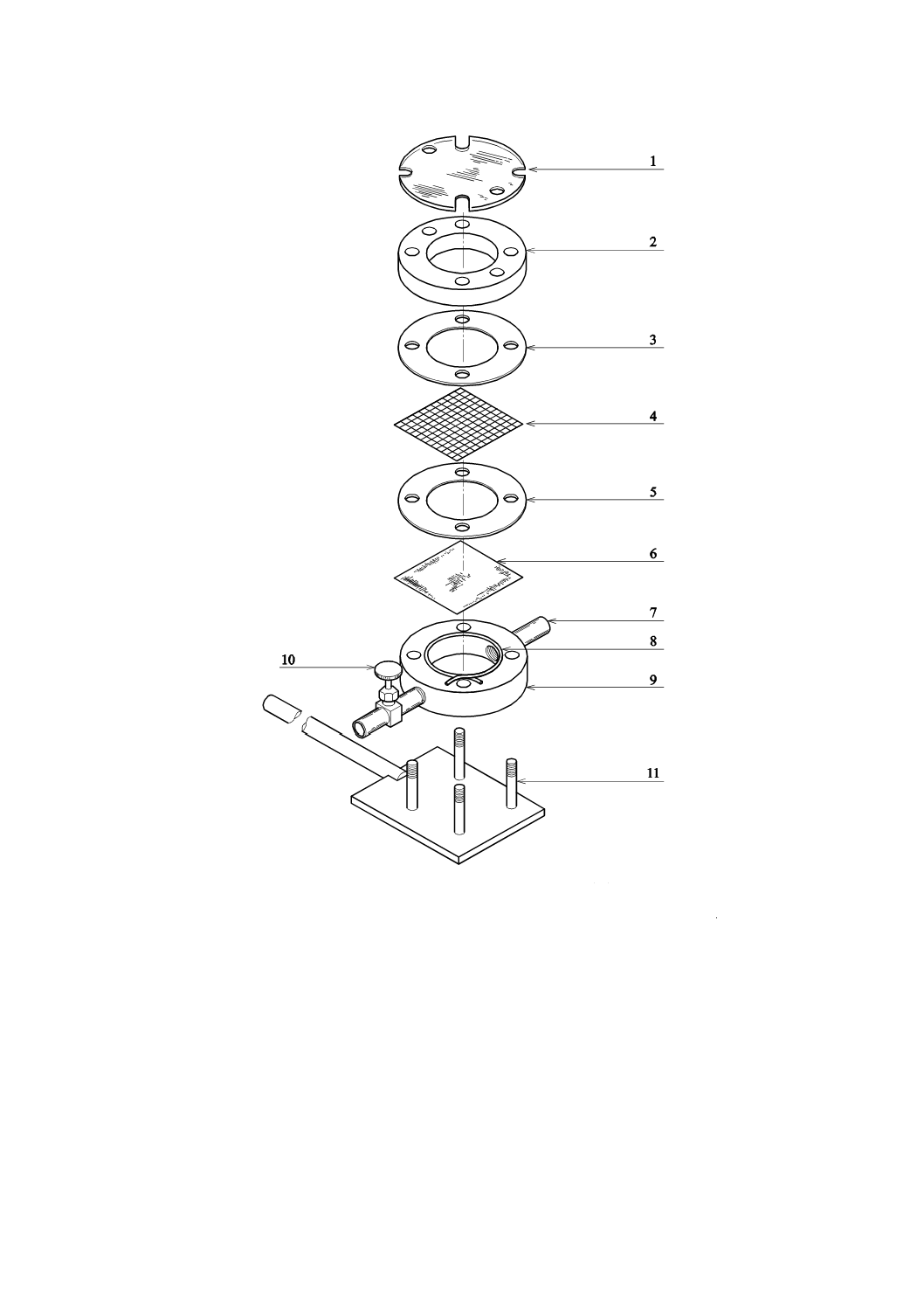
13
T 8061:2015
1 透明カバー(任意)
7 トップポート
2 フランジカバー
8 PTFEガスケット(推奨)
3 ガスケット(支持スクリーンを使用する場合)
9 セル本体
4 支持スクリーン(使用する場合)
10 排出弁
5 ガスケット
11 セル支持台
6 試験片
図1−支持スクリーン付き浸透テストセル例(分解部品配列図)
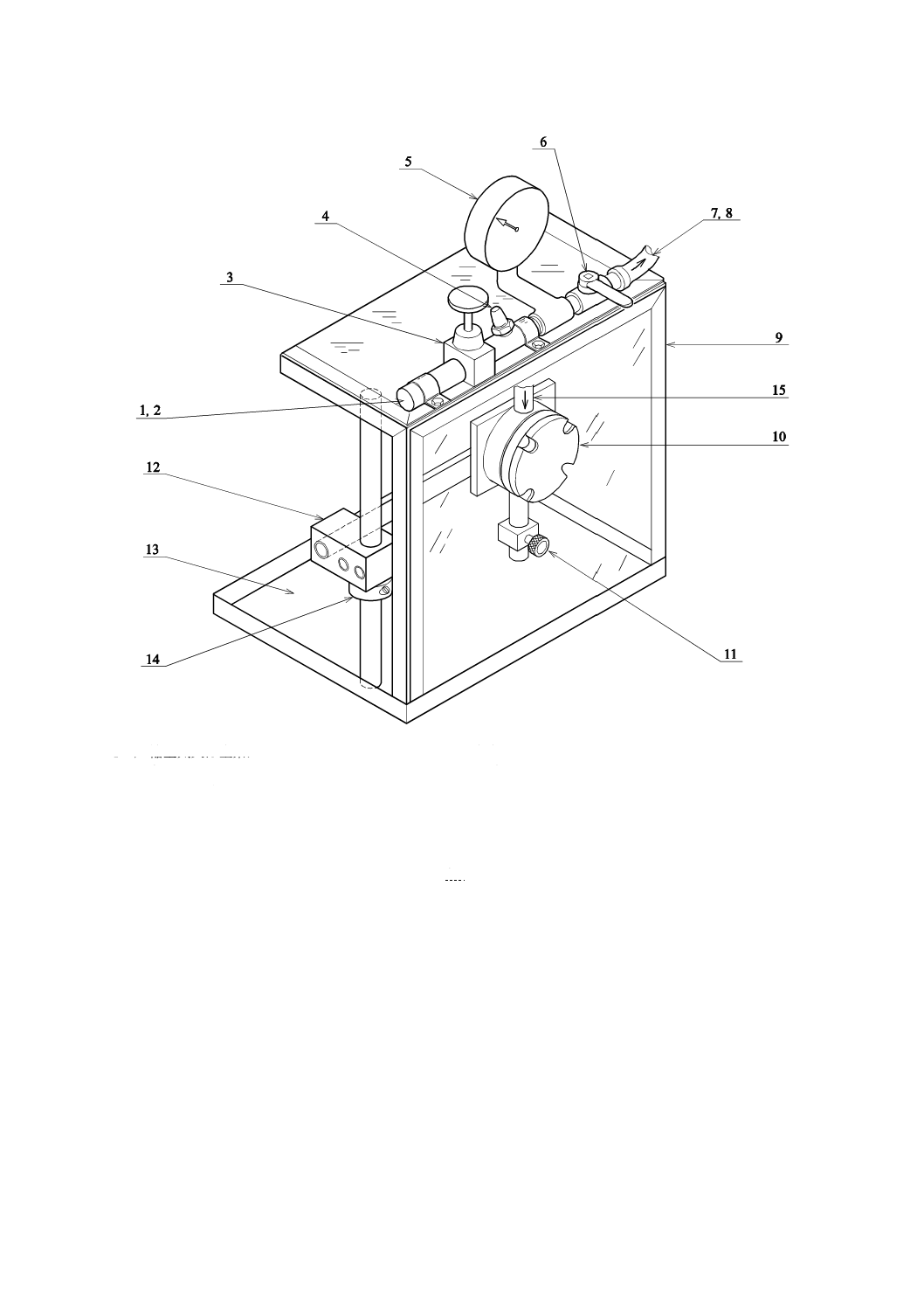
14
T 8061:2015
1 圧縮空気又は窒素ガス
2 コネクタ
3 空気圧力調整器
4 安全弁
5 圧力計
6 セル用ベントバルブ
7 8のゴム製空気ホースを接続する めす継手
8 7に接続する おす継手及び15に接続する めす
継ぎ手付きゴム製空気ホース
9
安全カバー
10 浸透テストセル
11 排出弁
12 クランプ
13 受け皿
14 クランプ止め具
15 8のゴム製空気ホースを接続する おす継ぎ手付きトッ
プポート(試験液注入口を兼ねる。)
図2−試験装置例(三次元側面図)
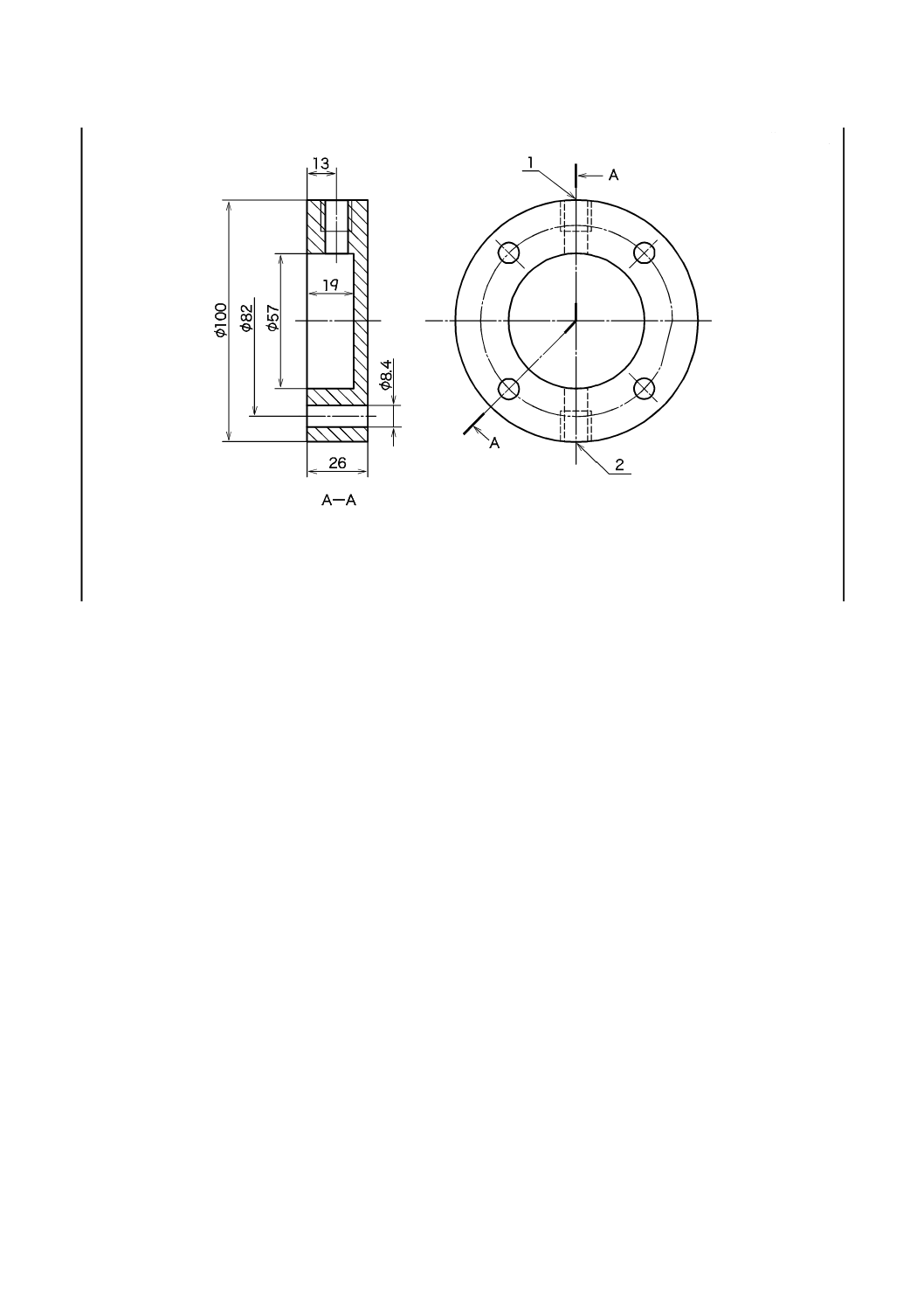
15
T 8061:2015
単位 mm
1 ホース継手用ねじ山
2 排出弁用ねじ山
図3−浸透テストセル本体例
16
T 8061:2015
附属書JA
(参考)
液体培養によるバクテリオファージ原液の調製方法
JA.1 調製方法の例
この規格に用いる液体培養によるバクテリオファージ原液の調製方法について記載する。
JA.2 大腸菌の培養
大腸菌の培養方法は,次による。
a) 大腸菌株から,ブイヨン10〜25 mLを入れた250 mLの三角フラスコに1白金耳を接種し,温度36±
1 ℃に設定した培養器で一晩培養する。
b) 一晩培養した細菌培養液の1/100量(0.1〜0.25 mL)を新たなブイヨン100 mLを入れた1 000 mLの三
角フラスコに移植する。
注記 菌が増殖しやすい環境を作るため,ブイヨンの量はフラスコの容量の1/6以下とする。
c) 36±1 ℃に設定した振とう(盪)培養器又は振とう可能な恒温水槽で振とう培養する。大腸菌が(3.0
±1.0)×108 CFU/mLの密度に達するまで培養を継続する。
注記 あらかじめ,大腸菌数及び大腸菌液の透過率(濁度)の関係を,分光光度計などで求めてお
くとよい。
JA.3 バクテリオファージ原液の調製
a) 大腸菌濃度が(3.0±1.0)×108 CFU/mLになった時点で,m.o.i(Multiplicity of infection,多重感染価,
バクテリオファージ感染価/大腸菌数)が,0.1〜2.0程度になるように希釈した感染用バクテリオフ
ァージ液を,大腸菌を入れたフラスコに加えて感染させる。
b) バクテリオファージを感染させた大腸菌液を,36±1 ℃で,1〜5時間激しく振とうしながら培養する。
又は,完全に溶菌するまで培養する。吸光度の低下が止まったときに,完全に溶菌したとみなされる。
c) 培養液を遠心分離(4 ℃,10 000 xg,20分間)した後,上澄みをきれいな試験管に移す。
注記 遠心後の沈さ(渣)と上澄みとの界面には,溶菌した大腸菌の層が存在するので,界面近く
まで上澄みを取らないように注意深く作業する。
d) バクテリオファージを含む上澄みをポアサイズが0.22 µm径のポリビニリデンフルオライド(PVDF)
製又はポリエーテルスルホン(PES)製ディスポーザブル・メンブラン・フィルタでろ過する。
e) ろ過液を,バクテリオファージ原液として,力価を測定し,5±3 ℃で冷蔵保存する。
17
T 8061:2015
附属書JB
(参考)
平板培地を用いたバクテリオファージ原液の調製方法
JB.1 調製方法の例
この規格に規定する平板培地を用いたバクテリオファージ原液の調製方法について記載する。
JB.2 大腸菌の培養
平板培地を用いた大腸菌の培養方法は,次による。
a) 大腸菌株から普通寒天培地(Nutrient agar)に移植し,温度36±1 ℃に設定した培養器で(18〜24)
時間培養する。
b) この培養菌から,ブイヨン培地100 mLに1白金耳移植する。
c) 36±1 ℃で静置培養若しくは,振とう(盪)培養器又は振とう可能な恒温水槽で振とう培養する。(1.0
×108)CFU/mL以上の密度に達するまで培養を継続する。
注記 あらかじめ,大腸菌数及び大腸菌液の透過率(濁度)の関係を.分光光度計などで求めておく
とよい。
JB.3 バクテリオファージ原液の調整
a) 90 mmのペトリ皿に底層培地を約15〜20 mL分注し,作製した平板培地を,必要な枚数用意する。
注記 必要に応じて,90 mmより大きなペトリ皿を用いる場合もある。
b) 表層培地を45〜50 ℃に設定した恒温槽で保温する。
c) 大腸菌濃度が(1.0×108)CFU/mLになった時点で,m.o.i(Multiplicity of infection,多重感染価,バク
テリオファージ感染価/大腸菌数)が,0.1〜1.0程度になるように希釈した感染用バクテリオファー
ジ液を,大腸菌を入れた試験管に加えて感染させる。この試験管を,試験管ミキサーで混合し,36±1 ℃
で10分間静置する。静置後の試験管に,45〜50 ℃に保温した表層培地を加え,試験管ミキサーで混
合する。その後,底層培地に重層し,36±1 ℃で18〜24時間培養する。
d) 培養後の表層培地を試験管に回収し,遠心分離(4 ℃,10 000 xg,20分間)した後,上澄みをきれい
な試験管に移す。
注記 遠心後の沈さ(渣)と上澄みとの界面には,溶菌した大腸菌の層が存在するので,界面近く
まで上澄みを取らないように注意深く作業する。
e) バクテリオファージを含む上澄みをポアサイズが0.22 µm径のポリビニリデンフルオライド(PVDF)
製又はポリエーテルスルホン(PES)製ディスポーザブル・メンブラン・フィルタでろ過する。
f)
ろ過液を,バクテリオファージ原液として,力価を測定し,(5±3)℃で冷蔵保存する。
18
T 8061:2015
参考文献
[1] TELFORD, G.L. and QUEBBEMAN, E.J. Assessing the risk of blood exposure in the operating room.
American Journal of Infection Control, 21 (6), December 1993, pp. 351-356
[2] Geigy Scientific Tables, Volume 1: Units of measurement, body fluids, composition of blood, hematology,
somatometric data. (Lentner, C. ed.) Medical Education Division, Ciba-Geigy Corporation, West Caldwell, NJ,
1984
[3] MCCULLOUGH, E.A. and SCHOENBERGER, L.K. Liquid barrier properties of nine surgical gown fabrics.
INDA Journal of Nonwovens Research, 3 (3), 1991, pp. 14-20
[4] SMITH, J.W. and NICHOLS, R.L. Barrier efficiency of surgical gowns. Archives of Surgery, 126, June 1991,
pp. 756-762
[5] ALTMAN, K.W. et. al. Transmural surgical gown pressure measurements in the operating theater. American
Journal of Infection Control, 19, 1991, pp. 147-155
[6] LYTLE, C.D. and BAKER, K.H. Ability of a viral penetration test (ASTM F1671-95) to detect small holes.
Journal of Testing and Evaluation (JTEVA), 27 (3), May 1999, pp. 231-233
[7] ASTM F1671, Standard test method for resistance of materials used in protective clothing to penetration by
blood-borne pathogens using Phi-X174 bacteriophage penetration as a test system
[8] 一般社団法人日本電機工業会:空気清浄機の浮遊ウイルスに対する除去性能評価試験方法
[9] JIS R 1706:2013 ファインセラミックス−光触媒材料の抗ウイルス性試験方法−バクテリオファージ
Qβを用いる方法
19
T 8061:2015
附属書JC
(参考)
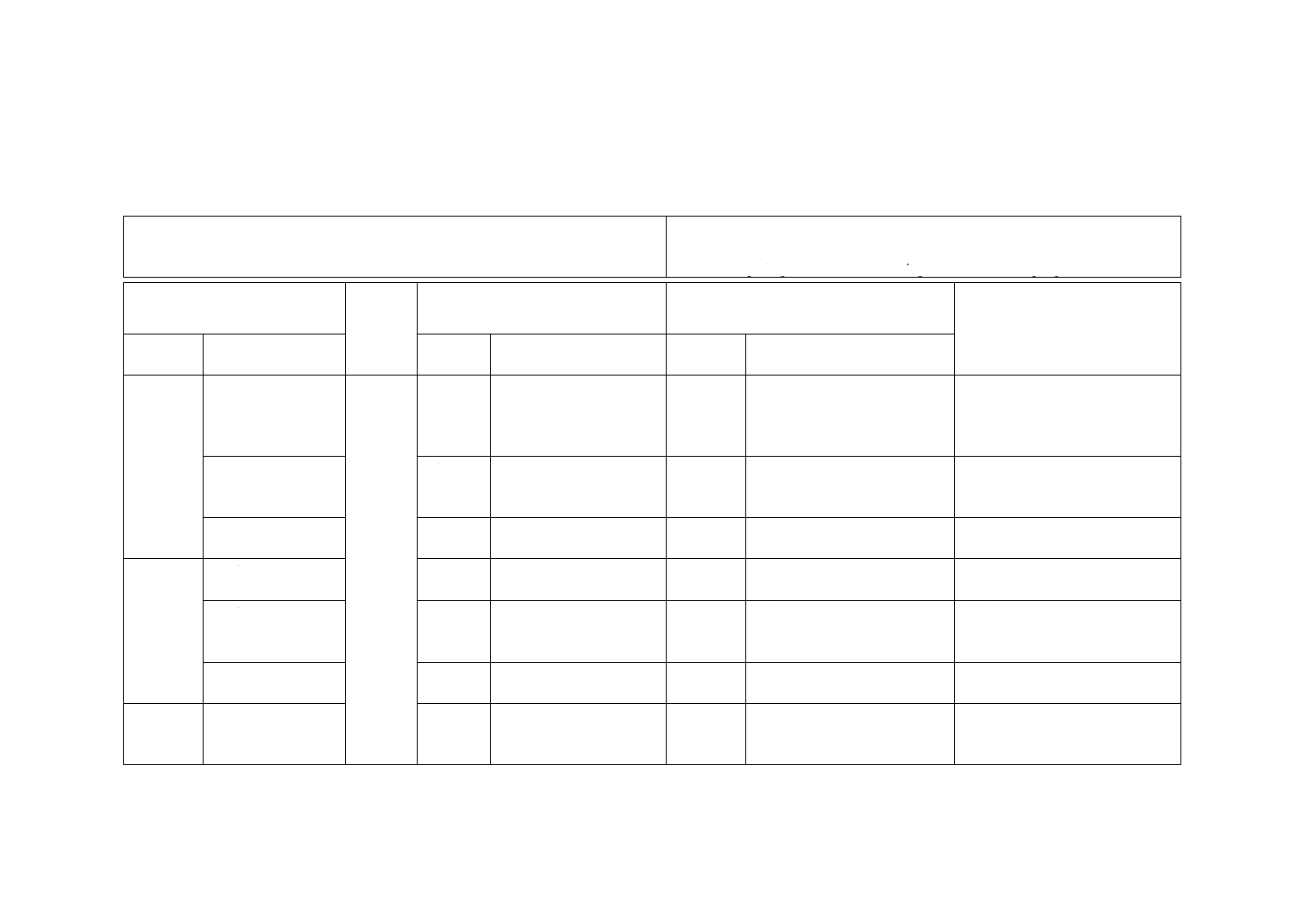
JISと対応国際規格との対比表
JIS T 8061:2015 血液及び体液の接触に対する防護服−防護服材料の血液媒介性病
原体に対する耐浸透性の求め方−Phi-X174バクテリオファージを用いる試験方法
ISO 16604:2004,Clothing for protection against contact with blood and body fluids
−Determination of resistance of protective clothing materials to penetration by
blood-borne pathogens−Test method using Phi-X174 bacteriophage
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5 微生物
及び試薬
5.2 Phi-X174バクテ
リオファージ負荷
試験懸濁液
−
追加
ISO規格の5.1で定義されてい
る内容が,負荷懸濁液の内容で
あるので,新たに項を追加し
た。
技術的内容に差異はない。
5.4 精製水
5.3
ISO規格に規定するグレ
ードの水
追加
JISの精製水,又はそれと同等
以上のものを使用できるよう
にした。
国内で入手可能な水を追加した
が実質的な差異はない。
5.9 界面活性剤
5.8
JISとほぼ同じ
変更
濃度を追加して,ポリソルベー
トを一例とした。
実質的な差異はない。
6 試験装
置
6.1 d) 図2
4 安全弁
6.1
JISとほぼ同じ
変更
部品の位置を示す矢印を,正確
な位置に変更した。
ISOに改正を提案する。
6.1 d) 図2
15 トップポート
−
追加
理解を容易にするため,トップ
ポートの位置を追加したもの
で,差異はない。
実質的な差異はない。
6.1 d) 図3
−
−
追加
分かりやすくするために例を
追加した。
実質的な差異はない。
8 試験
8.1.1 e) 表面張力の
測定(ISO 304又は
JIS K 3362)
8.1.1
JISとほぼ同じ。
追加
JISの測定方法も使用できるよ
うにした。
実質的な差異はない。
2
T
8
0
6
1
:
2
0
1
5
20
T 8061:2015
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
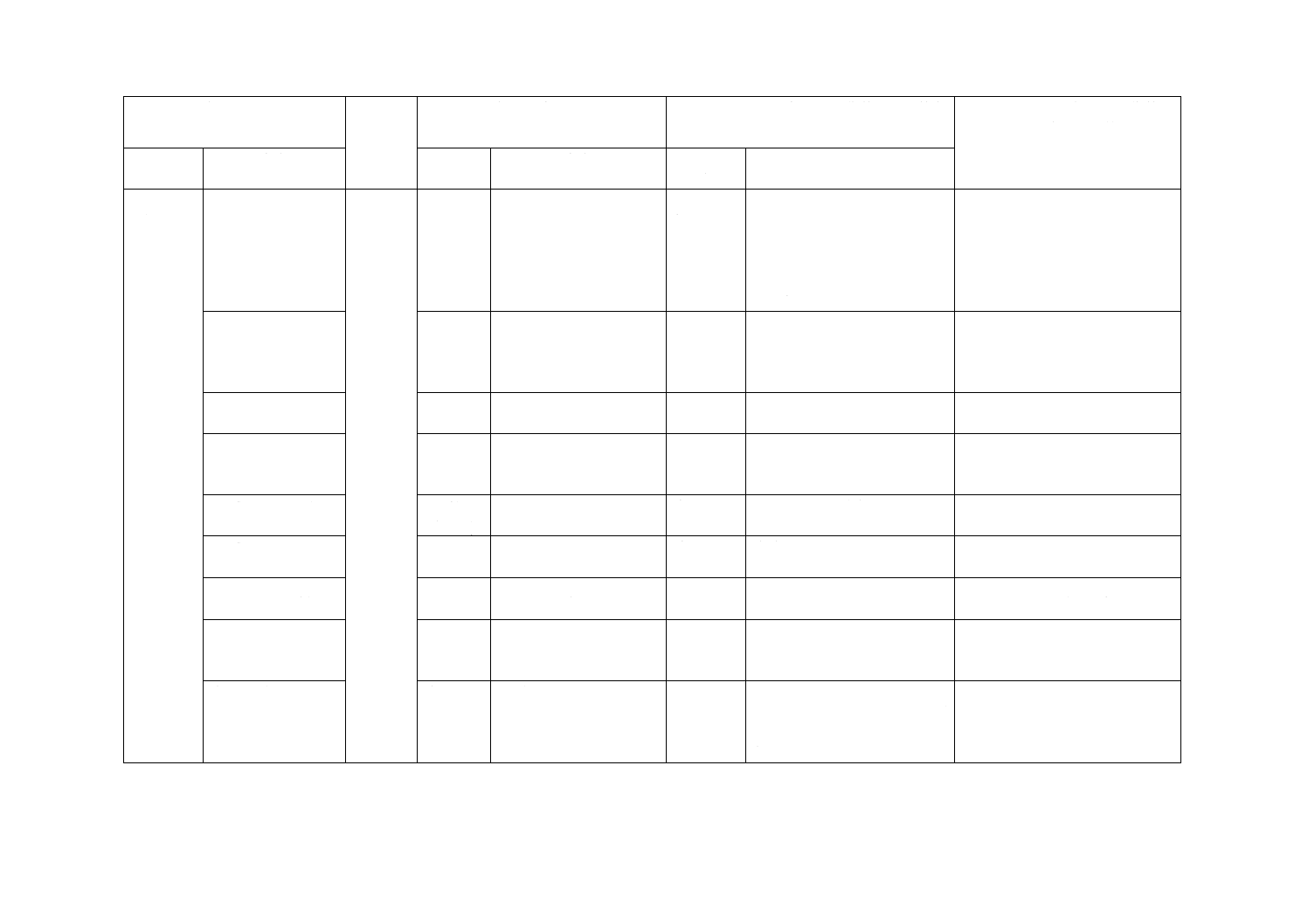
8 試験(続
き)
8.3 バクテリオファ
ージ負荷試験懸濁
液の調製
8.4
バクテリオファージ負荷
試験懸濁液の調製
変更・追
加
バクテリオファージ原液の調
製方法は,ISO規格の方法を附
属書JA(参考)及びJIS R 1706
の方法を附属書JB(参考)と
し,JISの調製方法も使用でき
るようにした。
参考であり,実質的な差異はな
い。
8.4 材料適合性の判
定
8.3
JISとほぼ同じ
変更
調製したバクテリオファージ
原液を使って行う項目なので,
8.3の調製の後とした。内容に
変更はない。
ISOに改正を提案する。
8.4 c) 注記及びf)
−
−
追加
理解を容易にするため,追加し
た。
ISOに改正を提案する。
8.5 b) 5〜6時間
8.5 b)
一晩
変更
一晩培養した大腸菌は,プラー
クができない(できにくい)こ
とがあるため。
ISOに改正を提案する。
8.7 d) 及び8.8 c) 空
気ホース
8.7 b) 及
び8.8 c)
JISとほぼ同じ
変更
表現を図2に整合させた。
実質的な差異はない。
8.8 d) 及びe)
−
−
追加
意味を明確にしたもので,差異
はない。
−
8.8 n) 適切な薬剤
8.8 n)
10 %の漂白剤
変更
消毒薬を適宜選べるようにし
た。
ISOに改正を提案する。
−
8.10 d)
統計的手法の推奨
削除
統計的手法の文言で,試験方法
に直接関係しないため,削除し
た。
ISOに改正を提案する。
表1手順A,B,C
表1
手順A,B,C,D
変更・追
加
ISO規格の手順A,B,C,D
を,注記を入れることで手順
A,Bにまとめた。手順Cを追
加した。
ISOに改正を提案する。
2
T
8
0
6
1
:
2
0
1
5
21
T 8061:2015
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
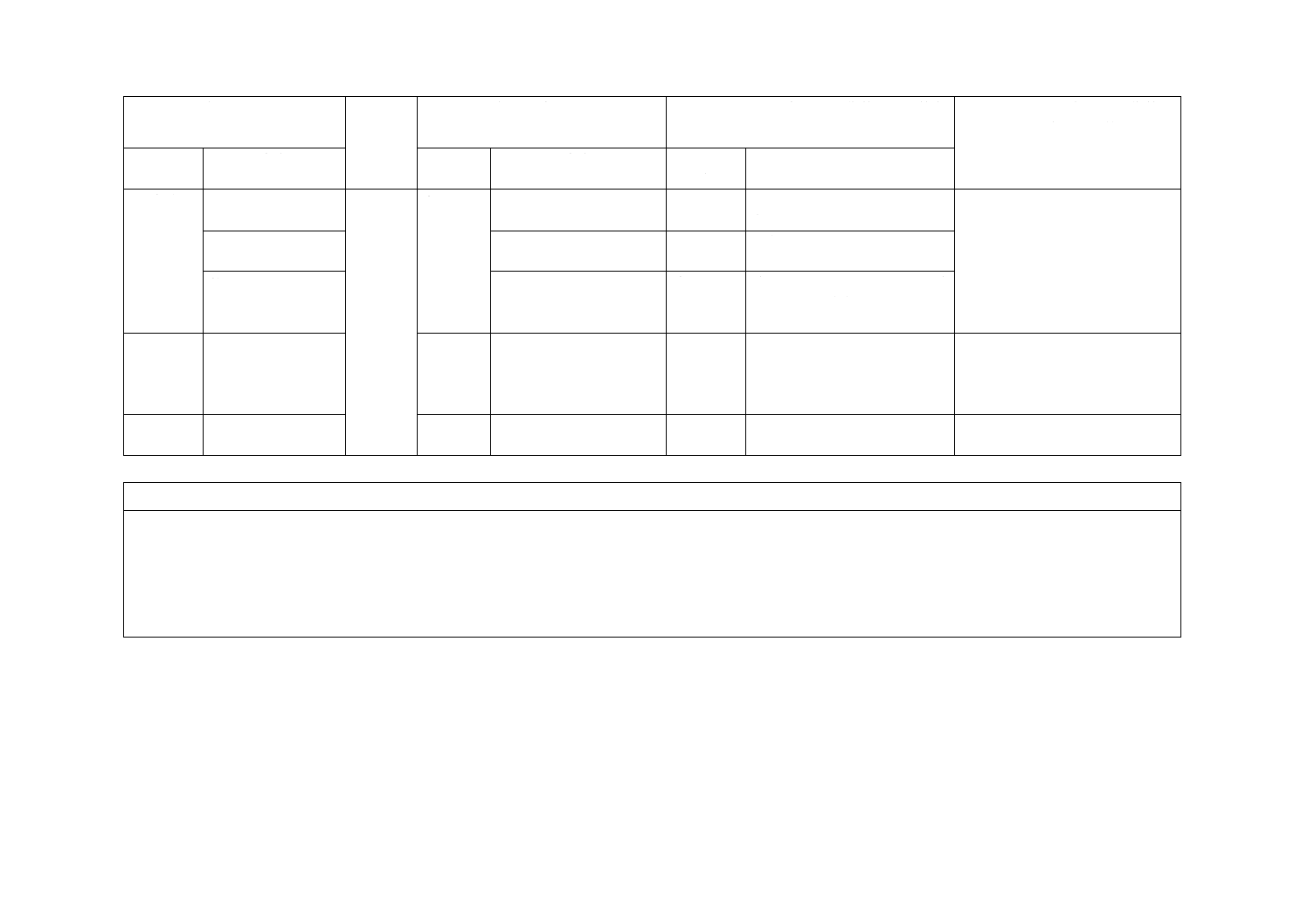
9 試験報
告書
d) 2.1) 例示
9
−
追加
理解を容易にするため,例を追
加した。
ISOに改正を提案する。
d) 3) 滅菌した方法
−
追加
理解を容易にするため追加し
た。
k) 及びl)
k) 及びl)
変更
合否の判定ではなく,液の浸透
又はぬれの有無を確認するこ
ととした。
附属書JA
(参考)
−
変更
JISの調製方法を使用できるよ
うにしたため調製方法を,附属
書JA及び附属書JBとして併
記した。
−
附属書JB
(参考)
−
変更
JISの調製方法を使用できるよ
うにした。
−
JISと国際規格との対応の程度の全体評価:ISO 16604:2004,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
2
T
8
0
6
1
:
2
0
1
5






