T 62366-1:2019 (IEC 62366-1:2015)
(1)
目 次
ページ
序文 ··································································································································· 1
1 *適用範囲 ······················································································································· 2
2 引用規格························································································································· 2
3 用語及び定義 ··················································································································· 2
4 原則······························································································································· 8
4.1 一般要求事項 ················································································································ 8
4.2 *ユーザビリティエンジニアリングファイル ········································································ 9
4.3 ユーザビリティエンジニアリングのテーラリング ································································· 9
5 *ユーザビリティエンジニアリングプロセス ·········································································· 9
5.1 *使用関連仕様の作成 ······································································································ 9
5.2 *安全に関連するユーザインタフェース特性及び潜在的な使用エラーの特定 ······························ 9
5.3 *既知の,又は予見可能なハザード及び危険状態の特定 ························································ 10
5.4 *ハザード関連使用シナリオの特定及び記述 ······································································· 10
5.5 *総括的評価のためのハザード関連使用シナリオの選択 ························································ 10
5.6 *ユーザインタフェース仕様の確立 ··················································································· 11
5.7 *ユーザインタフェース評価計画の確立 ············································································· 11
5.8 *ユーザインタフェース設計,実装及び形成的評価の実施 ····················································· 13
5.9 *ユーザインタフェースのユーザビリティに関する総括的評価の実施 ······································ 13
5.10 UOUP ······················································································································· 14
附属書A(参考)指針及び根拠 ······························································································ 15
附属書B(参考)ユーザビリティに関連する危険状態の例 ··························································· 32
附属書C(規定)開発過程が不明なユーザインタフェース (UOUP)の評価 ·································· 34
附属書D(参考)医療機器の使用の種類及び例 ········································································· 36
附属書E(参考)基本要件との対応 ························································································ 38
参考文献 ···························································································································· 39
用語索引(五十音順) ·········································································································· 42
T 62366-1:2019 (IEC 62366-1:2015)
(2)
まえがき
この規格は,産業標準化法第12条第1項の規定に基づき,一般社団法人電子情報技術産業協会(JEITA)
から,産業標準原案を添えて日本産業規格を制定すべきとの申出があり,日本産業標準調査会の審議を経
て,厚生労働大臣及び経済産業大臣が制定した日本産業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣,経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の
特許出願及び実用新案権に関わる確認について,責任はもたない。
注記 工業標準化法に基づき行われた申出,日本工業標準調査会の審議等の手続は,不正競争防止法
等の一部を改正する法律附則第9条により,産業標準化法第12条第1項の申出,日本産業標準
調査会の審議等の手続を経たものとみなされる。
日本産業規格 JIS
T 62366-1:2019
(IEC 62366-1:2015)
医療機器−第1部:ユーザビリティ
エンジニアリングの医療機器への適用
Medical devices-
Part 1: Application of usability engineering to medical devices
序文
この規格は,2015年に第1版として発行されたIEC 62366-1(Corrigendum 1:2016を含む。)を基に,技
術的内容及び構成を変更することなく作成した日本産業規格である。
なお,この規格で点線の下線を施してある参考事項は,対応国際規格にはない事項である。
この規格でアスタリスク(*)印がある箇所は,指針又は根拠についての説明を,附属書Aに記載して
いる。また,本文中の太字は,この規格の箇条3及び関連する他の引用規格で定義した用語である。この
規格で定義した用語を太字で表記していない場合,定義は適用せず,意味は文脈に沿って解釈する。
患者の観察及び治療に対して医療機器を使用することが増えており,医療機器のユーザビリティが適切
でないために起こる使用エラーに対する懸念が高まってきている。ユーザビリティエンジニアリング(ヒ
ューマンファクタエンジニアリング)プロセスを適用せずに開発した医療機器は,使用方法が直感的でな
く,習得も使用も難しいことが多い。ヘルスケアの発達に伴い,患者自身を含む熟練度の低いユーザが医
療機器を使用するようになってきており,また,医療機器もますます複雑になってきている。適切なユー
ザビリティを実現するユーザインタフェースを設計するためには,ユーザインタフェースを技術的に実装
するのとは異なるプロセス及び技能が要求される。
ユーザビリティエンジニアリングプロセスは,使用エラーを特定して最小限にすることによって,使用
に関連するリスクを低減することを意図している。正しくない使用の中には,製造業者がコントロールす
るのに適しているものもある。図A.4に示すとおり,ユーザビリティエンジニアリングプロセスは,リス
クマネジメントプロセスと関連がある。
この規格は,医療機器のユーザビリティに関連するリスクを受容可能にするためのユーザビリティエン
ジニアリングプロセスを規定する。この規格は,医療機器の製造業者だけではなく,医療機器の規格を作
成する国際規格の専門委員会にとっても有用である。
この規格は,ユーザビリティエンジニアリングプロセスを適用して医療機器の安全に関連するユーザビ
リティを最適化することに特化している。関連する技術報告書[IEC TR 62366-2 1)]は,包括的であり,
より幅広い内容である。この技術報告書は,安全に関連するユーザビリティだけではなく,タスクの正確
性,完全性及び有効性並びにユーザの満足度にユーザビリティがどのように関連するかについても着目し
ている。
注記 安全とは,受容できないリスクがないことである。受容できないリスクは,使用エラーから発
生する場合がある。使用エラーによって,ハザードに直接さらされるか,臨床機能が喪失又は
低下することがある。
2
T 62366-1:2019 (IEC 62366-1:2015)
注1) IEC TR 62366-2,Medical devices−Part 2: Guidance on the application of usability engineering to
medical devices
製造業者は,ユーザビリティエンジニアリングを安全に限定して実施することもできるし,安全に加え
て上に示したような他の属性をより幅広く扱うようにもできる。より幅広い範囲に着目することは,例え
ば,ユーザが安全に関連しないタスクをうまく実行できるかどうかを確認する必要がある場合など,ユー
ザビリティエンジニアリングへの特定の期待に応えるためにも有用かもしれない。製造業者は,医療機器
が安全に使用できるだけでなく,優れたユーザビリティを提供するといった商業上の優位性を実現するた
めに,幅広い範囲で実施することもあり得る。
1
*適用範囲
この規格は,製造業者が医療機器の安全に関連するユーザビリティを分析し,仕様を定め,開発し,評
価するためのプロセスを規定する。このユーザビリティエンジニアリング(ヒューマンファクタエンジニ
アリング)プロセスは,製造業者が,通常使用(すなわち,正しい使用及び使用エラー)に伴うリスクを
評価し,低減することができる。この規格は,異常使用に伴うリスクの評価又は低減を行うものではない
が,異常使用の特定に使用することはできる。
注記1 安全とは,受容できないリスクがないことである。受容できないリスクは,使用エラーから
発生し,物理的ハザードに直接さらされる,又は臨床的な機能が喪失若しくは低下すること
がある。
注記2 ユーザビリティエンジニアリングの医療機器への適用に関する指針は,IEC TR 62366-2 1)に
示しており,安全だけでなく,安全に関連しないユーザビリティの側面も対象としている。
この規格で規定するユーザビリティエンジニアリングプロセスに適合する場合,それを覆す客観的証拠
がない限り,その医療機器の安全に関するユーザビリティは,受容可能とみなす。
注記3 製造後の監視によって,そのような客観的証拠が,後から見つかることがある。
注記4 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
IEC 62366-1:2015,Medical devices−Part 1: Application of usability engineering to medical devices
(IDT)
なお,対応の程度を表す記号“IDT”は,ISO/IEC Guide 21-1に基づき,“一致している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。この引用
規格は,記載の年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 14971:2012 医療機器−リスクマネジメントの医療機器への適用
注記 対応国際規格:ISO 14971:2007,Medical devices−Application of risk management to medical devices
3
用語及び定義
この規格で用いる主な用語及び定義は,JIS T 14971:2012によるほか,次による。
注記 定義した用語の索引を,末尾に示す。
3.1
*異常使用(ABNORMAL USE)

3
T 62366-1:2019 (IEC 62366-1:2015)
通常使用と異なるか,これに違反し,さらに,製造業者によるユーザインタフェースに関連するリスク
コントロールのあらゆる妥当な手段を逸脱する,意識的若しくは意図的な行為,又は意図的な行為の省略。
例 無謀な使用若しくは妨害行為,又は安全に関する情報の意図的な無視が,このような行為に当た
る。
注記1 4.1.3も参照。
注記2 異常使用に当てはまらない,意図するとおりだが誤った行為は,使用エラーの一種とみなす。
注記3 製造業者は,異常使用の場合であっても,ユーザインタフェースに関係しないリスクコント
ロール手段を検討することが求められる。
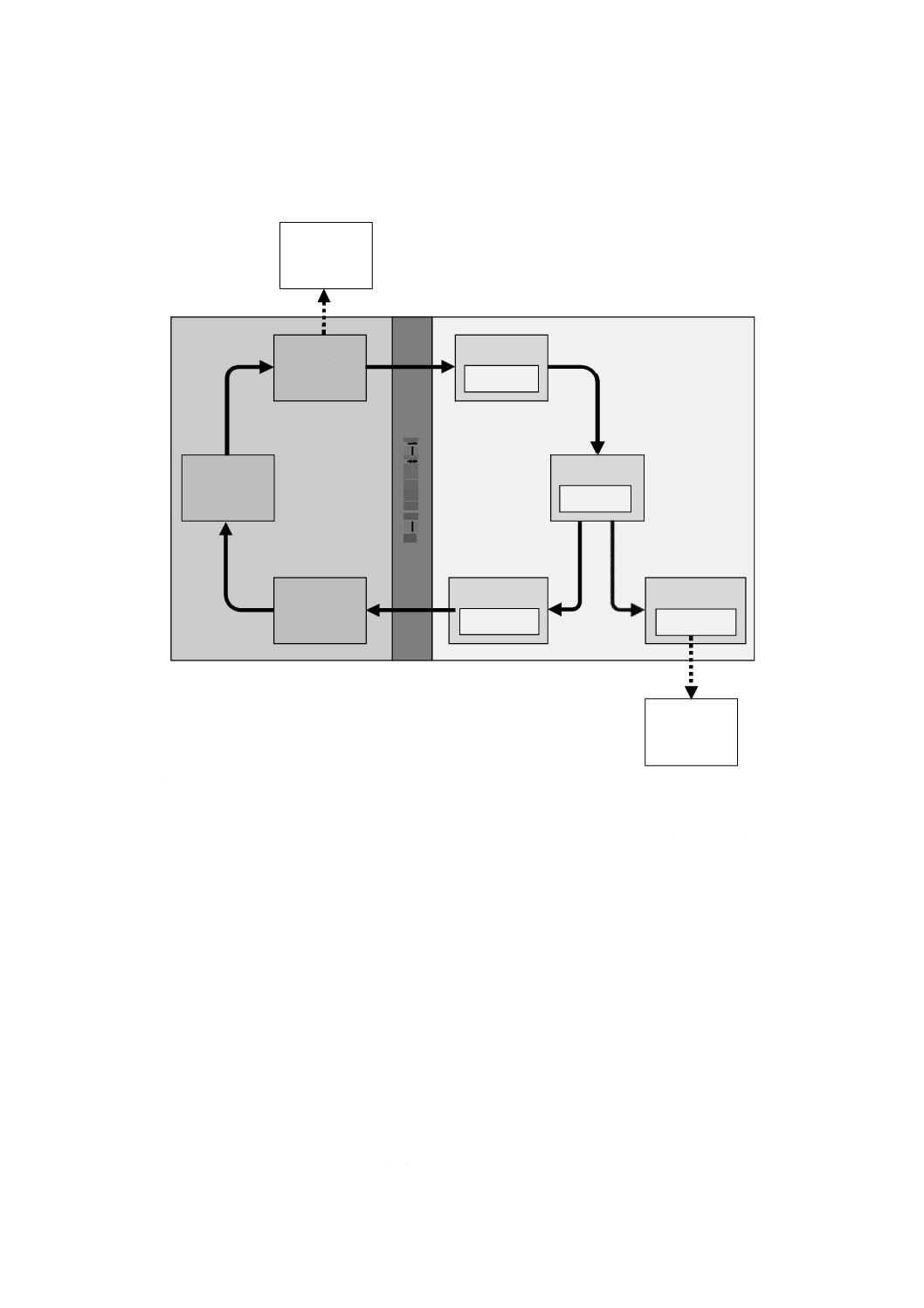
注記4 図1に,“使用”の種類の関係を示す。
注記 図D.1に,追加詳細を示す。
図1−使用の種類の関係
3.2
附属資料(ACCOMPANYING DOCUMENTATION)
医療機器に附属し,医療機器の据付け,使用及び保守に責任をもつ者又はユーザに対する情報で,特に
安全な使用に関する情報を記載した資料。
注記1 附属資料は,取扱説明書,技術解説,据付手順書,簡易参照ガイドなどで構成することがで
きる。
注記2 附属資料は,必ずしも,書面又は印刷した文書である必要はなく,視覚的,聴覚的又は触覚
的な資料及びマルチメディアを含むことがある。
注記3 取扱説明書がなくても安全に使用できる医療機器は,規制当局が取扱説明書の作成を免除す
る場合もある。
注記4 JIS T 14971:2012の2.1の用語を“附属文書(accompanying document)”から“附属資料
(ACCOMPANYING DOCUMENTATION)”に変更し,定義を“文書”から“資料”に置き換
え,“使用者”から“ユーザ”に置き換え,“操作者”を削除し,注記を追加した。
3.3
正しい使用(CORRECT USE)
使用エラーのない通常使用。
注記1 取扱説明書からの逸脱は,製造業者が意図するものとは異なる,又はユーザが期待したもの
とは異なる医療機器の応答につながる場合にだけ,使用エラーとみなされる。
注記2 図1に,“使用”の種類の関係を示す。
医療機器の使用(MEDICAL DEVICE use)
通常使用(NORMAL USE)
正しい使用(CORRECT USE)
使用エラー(USE ERROR)
異常使用(ABNORMAL USE)
4
T 62366-1:2019 (IEC 62366-1:2015)
3.4
有効性(EFFECTIVENESS)
ユーザが,指定された目標を達成する上での正確さ及び完全さ。
注記1 これは,臨床上の有効性とは異なる概念である。
注記2 JIS Z 8521:1999の3.2の“利用者”を“ユーザ”に置き換え,注記1を追加した。
3.5
*効率(EFFICIENCY)
有効性に関連して費やした資源。
注記 JIS Z 8521:1999の3.3の定義のうち,この規格の3.4の定義と同じ部分を“有効性”という用
語に置き換えた。
3.6
予測耐用期間(EXPECTED SERVICE LIFE)
製造業者の指定した期間で,その期間内は医療機器が安全に使用できると予測する期間(すなわち,基
礎安全及び基本性能を維持する期間)。
注記1 予測耐用期間の間に,保守が必要な場合がある。
注記2 JIS T 0601-1:2017の3.28の“ME機器又はMEシステム”を“医療機器”に置き換えた。
3.7
形成的評価(FORMATIVE EVALUATION)
ユーザインタフェース設計の強み,弱み及び予期しない使用エラーを調査する意図で行う,ユーザイン
タフェース評価。
注記 一般に,形成的評価は,ユーザインタフェース設計を必要に応じて手引するために,設計・開
発プロセス全体を通して実施し,総括的評価の前に繰り返し実施する。
3.8
ハザード関連使用シナリオ(HAZARD-RELATED USE SCENARIO)
危険状態又は危害に至る可能性を含んだ使用シナリオ。
注記1 ハザード関連使用シナリオは,使用エラーに結び付く可能性が高い。
注記2 医療機器の故障が使用エラーによるものである場合を除き,ハザード関連使用シナリオは,
医療機器の故障とは関連しない。
3.9
*通常使用(NORMAL USE)
取扱説明書に従った,ユーザが行う日常の点検,調整及び待機運転を含む操作,又は取扱説明書が附属
されていない医療機器での,一般に認められた使い方に従った操作。
注記1 通常使用と意図する使用とを混同しないことが望ましい。いずれも製造業者の意図するとお
りの使用という概念を含んでいるが,意図する使用は,医療目的に重心をおき,通常使用は
医療目的だけでなく,保守,輸送なども同様に含んでいる。
注記2 使用エラーは,通常使用で生じることがある。
注記3 取扱説明書がなくても安全に使用できる医療機器は,規制当局が取扱説明書の作成を免除す
る場合もある。
注記4 図1に,“使用”の種類の関係を示す。
注記5 JIS T 0601-1:2017の3.71に注記2,注記3及び注記4を追加し,“操作者”を“ユーザ”に置
5
T 62366-1:2019 (IEC 62366-1:2015)
き換え,取扱説明書が附属されていない医療機器の場合について追加した。
3.10
*患者(PATIENT)
医科又は歯科の診療の対象となっている生物(人)。
注記1 患者は,ユーザになることがある。
注記2 JIS T 0601-1:2017の3.76の“又は動物”を削除し,注記の“操作者”を“ユーザ”に置き換
えた。
3.11
*主要操作機能(PRIMARY OPERATING FUNCTION)
医療機器の安全に関連する,ユーザとのやり取りを伴う機能。
注記1 主要操作機能は,多くの場合,ユーザとの一連のやり取りに分解できるタスクの連なりと相
互作用する。
注記2 安全の概念には,ユーザが意図する医療目的を達成するための医療機器の効果的な使用を妨
げる使用エラーを含めた,患者に対する受容できないリスクを引き起こす性能の喪失又は低
下が含まれる。JIS T 0601-1:2017では,これを“基本性能”と呼んでいる。
3.12
責任部門(RESPONSIBLE ORGANIZATION)
医療機器又は医療機器の組合せの使用及び保守に責任をもつ実体。
注記1 責任をもつ実体とは,例えば,病院,個々の臨床医又は非専門家である。家庭用では,患者,
ユーザ及び責任部門は,同一の人であることができる。
注記2 “使用”は,教育及びトレーニングを含んでいる。
注記3 JIS T 0601-1:2017の3.101の“ME機器又はMEシステム”を“医療機器又は医療機器の組
合せ”,注記の“操作者”を“ユーザ”に置き換えた。
3.13
総括的評価(SUMMATIVE EVALUATION)
ユーザインタフェースを安全に使用できるという客観的証拠を得ることを意図して,ユーザインタフェ
ース開発の終了時に実施するユーザインタフェース評価。
注記 総括的評価は,ユーザインタフェースの安全使用のバリデーションに関連する。
3.14
タスク(TASK)
期待する結果を得るためにユーザが行う,医療機器との一つ以上のやり取り。
注記1 タスクの記述には,ユーザの動作,医療機器の応答及び操作ステップを含めることが望まし
い。
注記2 タスクは,医療機器が提供する機能又は特徴だけを記述したものでないことが望ましい。
3.15
開発過程が不明なユーザインタフェース,UOUP(USER INTERFACE OF UNKNOWN PROVENANCE)
この規格のユーザビリティエンジニアリングプロセスの適切な記録が得られない,既に開発済みの医療
機器のユーザインタフェース又はその一部。
3.16
*ユーザビリティ(USABILITY)
6
T 62366-1:2019 (IEC 62366-1:2015)
意図する使用環境における使用を容易にし,有効性,効率及びユーザの満足度を確立するユーザインタ
フェースの特性。
注記 有効性,効率及びユーザの満足度を含むユーザビリティの全ての側面は,安全を向上又は低下
させることがある。
3.17
*ユーザビリティエンジニアリング,ヒューマンファクタエンジニアリング(USABILITY ENGINEERING,
HUMAN FACTORS ENGINEERING)
適切なユーザビリティを達成するための,医療機器(ソフトウェアを含む。),医療機器のシステム及び
タスクの設計における人の振る舞い,能力,限界及び他の特性に関わる知識の適用。
注記 適切なユーザビリティを実現すると,使用に関するリスクが受容可能となる。
3.18
*ユーザビリティエンジニアリングファイル(USABILITY ENGINEERING FILE)
ユーザビリティエンジニアリングプロセスによって作成した記録及び文書のまとまり。
3.19
ユーザビリティ試験(USABILITY TEST)
指定された意図する使用環境において,意図するユーザとのユーザインタフェースを調査又は評価する
方法。
3.20
使用環境(USE ENVIRONMENT)
ユーザが医療機器と相互作用するときの,実際の条件及び設定。
注記 使用条件又は使用環境の属性には,衛生上の要求事項,使用頻度,場所,照明,騒音,温度,
可搬性及び国際化対応の度合いが含まれることがある。
3.21
*使用エラー(USE ERROR)
製造業者が意図するものとは異なる,又はユーザが期待するものではない結果を引き起こす,医療機器
を使用する際のユーザの行為又はユーザの行為の欠如。
注記1 使用エラーには,ユーザがタスクを完遂できないことが含まれる。
注記2 使用エラーは,ユーザ,ユーザインタフェース,タスク又は使用環境の間の特性の不一致に
よることがある。
注記3 ユーザが,使用エラーが生じたことに気付くこともあれば,気付かないこともある。
注記4 患者の想定外の生理学的反応は,それ自体を使用エラーとはみなさない。
注記5 想定外の結果を引き起こす医療機器の誤作動は,使用エラーとはみなさない。
注記6 図1に,“使用”の種類の関係を示す。
3.22
*使用シナリオ(USE SCENARIO)
特定の使用環境において,特定のユーザが実施するタスクの特定のシーケンス及びその結果として生じ
る医療機器の何らかの応答。
3.23
*使用関連仕様(USE SPECIFICATION)
医療機器の使用状況に関連する重要特性の要約。
7
T 62366-1:2019 (IEC 62366-1:2015)
注記1 意図する医学的適応,患者集団,相互に作用し合う対象の体の部分又は生体組織の種類,ユ
ーザプロファイル,使用環境及び動作原理が,使用関連仕様の典型的要素である。
注記2 医療機器の使用関連仕様の要約は,一部の規制当局で“意図する使用の記載”と呼ばれてい
る。
注記3 使用関連仕様は,JIS T 14971:2012の意図する使用を決定するためのインプットである。
3.24
*ユーザ(USER)
医療機器とやり取りをする(相互に作用し合う,例えば,操作をする又は取扱いをする)人。
注記1 医療機器のユーザは,二人以上のことがある。
注記2 通常のユーザには,臨床医,患者,洗浄員及び保守整備員が含まれる。
3.25
ユーザグループ(USER GROUP)
年齢,文化,専門知識,医療機器とのやり取りの種類など,ユーザビリティに影響を与える可能性のあ
る要因によって区別した,意図するユーザの部分集合。
3.26
*ユーザインタフェース(USER INTERFACE)
ユーザと医療機器とがやり取りをする手段。
注記1 附属資料は,医療機器及びそのユーザインタフェースの一部とみなす。
注記2 ユーザインタフェースは,視覚,聴覚,触覚ディスプレイなど,ユーザが相互作用する医療
機器の全ての要素,及び医療機器の物理的側面を含み,ソフトウェアインタフェースに限定
しない。
注記3 この規格では,医療機器のシステムを単一のユーザインタフェースとして扱うことができる。
3.27
ユーザインタフェース評価(USER INTERFACE EVALUATION)
製造業者が,ユーザインタフェースとユーザとのやり取りを調査又は評価するプロセス。
注記1 ユーザインタフェース評価は,次の手法の一つ以上で構成してもよい。
ユーザビリティ試験,専門家のレビュー,ヒューリスティック分析,設計監査又は認知的
ウォークスルー。
注記2 ユーザインタフェース評価は,設計・開発のプロセス全体を通じて頻繁に繰り返し実施する
(これが,形成的評価である。)。
注記3 ユーザインタフェース評価は,医療機器設計の全体の検証及びバリデーションに関する活動
の一部である(これが,総括的評価である。)。
3.28
*ユーザインタフェース仕様(USER INTERFACE SPECIFICATION)
医療機器のユーザインタフェースを包括的及び事前に記述した仕様集。
3.29
ユーザプロファイル(USER PROFILE)
意図するユーザグループの,精神的特質,身体的特質及び人口統計的特質の概要,並びに職業能力,職
務上の必要条件及び労働条件のような,設計上の決定に影響を与える可能性がある特有な特性。
8
T 62366-1:2019 (IEC 62366-1:2015)
4
原則
4.1
一般要求事項
4.1.1
*ユーザビリティエンジニアリングプロセス
製造業者は,患者,ユーザ及びその他の人に安全を提供するため,箇条5で規定している,ユーザビリ
ティエンジニアリングプロセスを確立し,文書化し,実施し,維持する。そのプロセスは,附属資料に従
って,医療機器とユーザとのやり取りを扱い,次を含むが,これらに限らない。
− *輸送
− *保管
− 据付け
− 操作
− 保守及び修理
− 廃棄
医療機器に対するユーザビリティエンジニアリングの活動は,適切な教育,訓練,技能又は経験に基づ
いた力量のある要員が,計画し,実施し,文書化する。
JIS Q 13485:2018の箇条7のような,文書化された製品実現プロセスが存在する場合には,ユーザビリ
ティエンジニアリングプロセスの該当する部分を取り入れるか,又はこれを参照する。
注記 JIS Q 13485:2018の6.2には,要員の力量に関連する追加情報が示されている。
JIS T 14971:2012のリスクマネジメントプロセスとこの規格で説明するユーザビリティエンジニアリン
グプロセスとの相互関係を図A.4に示す。
図A.4に示すように,箇条5に規定する活動は,論理的順序で記載しているが,必要に応じて適切な順
序で実施してもよい。
この規格の要求事項を満たしている場合,この細分箇条に適合しているとみなす。
4.1.2
*ユーザインタフェース設計に関連するリスクコントロール
使用に関連するリスクを低減するために,製造業者は,(JIS T 14971:2012の6.2で要求されているよう
に)次の優先順位に従って,一つ以上のリスクコントロール手段を用いる。
a) 設計による本質的な安全
b) 医療機器自体又は製造プロセスによる防護手段
c) 安全に関する情報
注記 安全に関する情報は,製品規格及び他の基準で要求される場合もある。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
4.1.3
ユーザビリティに関連する安全に関する情報
4.1.2の優先順位に従って,安全に関する情報をリスクコントロール手段として使用する場合,製造業者
は,その情報をユーザビリティエンジニアリングプロセスの対象とし,意図するユーザプロファイルのユ
ーザに対して,意図する使用環境の状況において,この情報が次を満たすようにする。
− 認知できる。
− 理解できる。
− 医療機器の正しい使用を支援する。
注記1 ユーザの認知,認識及び行為の関係を図A.1に示す。
注記2 安全に関する情報の例がIEC TR 62366-2に示されている。
このような安全に関する情報をユーザが意識的に無視することは,通常使用と異なるか,これに違反し,
9
T 62366-1:2019 (IEC 62366-1:2015)
さらに,製造業者によるユーザインタフェースに関連するリスクコントロールのあらゆる妥当な手段を逸
脱する,意図的な行為又は意図的な行為の省略(すなわち,異常使用)とみなす。
適合性は,安全に関する情報及びユーザビリティエンジニアリングファイルの調査によって確認する。
4.2
*ユーザビリティエンジニアリングファイル
ユーザビリティエンジニアリングプロセスの結果は,ユーザビリティエンジニアリングファイルに保管
する。ユーザビリティエンジニアリングファイルを構成する記録及び文書は,他の文書及びファイルの一
部分となることがある。
例1 製造業者の製品設計ファイル
例2 リスクマネジメントファイル
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
4.3
ユーザビリティエンジニアリングのテーラリング
ユーザビリティエンジニアリングプロセスを実施するための,作業のレベル並びに使用する方法及びツ
ールの選択は,次に基づいて変わることがある。
a) ユーザインタフェースの規模及び複雑さ
b) 医療機器の使用に伴う危害の重大さ
c) 使用関連仕様の範囲又は複雑さ
d) UOUPの存在
e) ユーザビリティエンジニアリングプロセスの対象となった既存の医療機器ユーザインタフェースか
らの修正の範囲
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5
*ユーザビリティエンジニアリングプロセス
5.1
*使用関連仕様の作成
製造業者は,使用関連仕様を作成する。
この使用関連仕様には,次を含める。
− *意図する医学的適応
注記1 これには,検査,モニタ,治療,診断又は予防する,状態又は疾病を含むことができる。
− 意図する患者集団
注記2 これには,年齢層,体重範囲,健康又は容態を含むことができる。
− 適用する又は対応する,意図する体の部分又は生体組織の種類
− *意図するユーザプロファイル
− *使用環境
− *動作原理
注記3 医療機器の使用関連仕様の要約は,一部の規制当局で“意図する使用の記載”と呼ばれてい
る。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.2
*安全に関連するユーザインタフェース特性及び潜在的な使用エラーの特定
製造業者は,JIS T 14971:2012の4.2に従って実施するリスク分析の一部として,安全に関連する可能性
があるユーザインタフェース特性を特定する。これは,ユーザビリティエンジニアリングプロセスのツー
ル及び技法を用いて特定してもよい。この特定において,該当する個別の医療機器安全規格に規定してい
10
T 62366-1:2019 (IEC 62366-1:2015)
る主要操作機能を考慮する。
注記1 JIS T 14971:2012のC.2.29〜C.2.34には,安全に影響するユーザインタフェースの特性を明
確化するために使用できる質問事項のリストがある。このリストは,全てを網羅するもので
はない。
製造業者は,特定したユーザインタフェース特性及び使用関連仕様に基づいて,発生する可能性がある
ユーザインタフェース関連の使用エラーを特定する。これは,タスク分析を実施し特定してもよい
[27][28][29]。
注記2 タスク分析は,IEC TR 62366-2で説明している。
安全に関連する特性を特定した結果は,ユーザビリティエンジニアリングファイルに保管する。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.3
*既知の,又は予見可能なハザード及び危険状態の特定
製造業者は,医療機器の使用に関連して,患者,ユーザ又はその他の人に悪影響を与える可能性がある,
既知の,又は予見可能なハザード及び危険状態を特定する。これは,JIS T 14971:2012の4.3及び4.4の第
1段落に従って,リスク分析の一部として実施し特定する。
注記1 附属書Bに,ユーザビリティに関連する,考えられるハザード及び危険状態の例を示す。
ハザード及び危険状態を特定するときは,次を考慮する。
− ユーザプロファイルを含む使用関連仕様(5.1参照)
− 使用できる場合は,同種の医療機器の既存のユーザインタフェースに関して判明している,ハザード
及び危険状態に関する情報
− 特定した使用エラー(5.2参照)
ハザード及び危険状態を特定した結果は,ユーザビリティエンジニアリングファイルに保管する。
注記2 ハザード又は危険状態を特定する過程で,異常使用の条件を特定できる。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.4
*ハザード関連使用シナリオの特定及び記述
製造業者は,特定したハザード及び危険状態について,合理的に予見可能なハザード関連使用シナリオ
を特定し,記述する。特定した各ハザード関連使用シナリオの記述には,関連する危害の重大さだけでな
く全てのタスク及びそれらのシーケンスを含める。
注記 附属書Bに,ユーザがハザードにさらされる結果となりかねない一連の事象の例を記載する。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.5
*総括的評価のためのハザード関連使用シナリオの選択
製造業者は,総括的評価に含めるハザード関連使用シナリオを選択する。
製造業者は,次のいずれかを選択する。
− 全てのハザード関連使用シナリオ
− 使用エラーが原因となる危害(例えば,医学的介入を必要とする危害)の重大さに基づく,一部のハ
ザード関連使用シナリオ
さらに,ハザード関連使用シナリオを選択する方法の決定は,医療機器及び製造業者に固有の他の状況
に基づいてもよい。
注記 選択方法の例を,附属書Aの5.5†及びIEC TR 62366-2に示す。
選択方法の要約,その使用の根拠,及びそれを適用した結果は,ユーザビリティエンジニアリングファ
イルに保管する。
11
T 62366-1:2019 (IEC 62366-1:2015)
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.6
*ユーザインタフェース仕様の確立
製造業者は,ユーザインタフェース仕様を確立し,維持する。
ユーザインタフェース仕様は,次を考慮する。
− 使用関連仕様(5.1参照)
− 医療機器に関連する既知の,又は予見可能な使用エラー(5.2参照)
− ハザード関連使用シナリオ(5.4参照)
ユーザインタフェース仕様は,次を含む。
− ユーザインタフェースに関連する試験可能な技術的要求事項。これには,選択したリスクコントロー
ル手段に関連するユーザインタフェースに対する要求事項を含める。
注記 ユーザインタフェースの技術的要求事項には,表示の色,文字の大きさ,制御ボタンの配置
を含む。
− 附属資料が必要かどうかの指示
− 医療機器に特有のトレーニングが必要かどうかの指示
ユーザインタフェース仕様は,ユーザビリティエンジニアリングファイルに保管する。ユーザインタフ
ェース仕様は,他の仕様に統合してもよい。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.7
*ユーザインタフェース評価計画の確立
5.7.1
一般
製造業者は,ユーザインタフェース仕様に対するユーザインタフェース評価計画を確立し,維持する。
ユーザインタフェース評価計画は,次を含む。
a) 目的を文書化し,計画した形成的評価及び総括的評価の方法を明確にする。
注記1 形成的評価及び総括的評価の方法の例をIEC TR 62366-2に示す。
b) ユーザビリティ試験を採用する場合は,次を含む。
− 代表的な意図するユーザの関与及びこれらユーザのユーザプロファイルを文書化する。
例1 形成的評価では,ユーザである看護師ユーザグループとして製造業者の臨床担当者を利用
する。
例2 総括的評価では,救命救急診療看護ユーザプロファイルとして集中治療を実際に行ってい
る看護師を活用する。
ユーザビリティ試験のために,複数のユーザプロファイルを一つのユーザグループにまとめても
よい。
− 使用関連仕様に基づいて,試験環境及び他の使用条件を文書化する。
注記2 これらは,特定の使用条件であって,ユーザのタスクの実行に悪影響を及ぼす可能性が
ある。
例3 使用条件には,照明,騒音及び活動レベルのような,場所に固有の条件を含めることがあ
る。
例4 使用条件には,個人用保護具(例えば,手術用手袋及び保護眼鏡)を着用して医療機器を
使用するような,個人に固有の条件を含めることがある。
例5 使用条件には,ストレスレベル及びチームでの作業のような,社会的条件を含めることが
ある。
12
T 62366-1:2019 (IEC 62366-1:2015)
− 附属資料を試験中に提供するかどうかを定める。
− その医療機器に特有のトレーニングを試験前に提供するかどうかとトレーニングから試験開始まで
の最短の経過時間とを定める。
ユーザインタフェース評価の方法は,定量的でも定性的でもよい。ユーザインタフェース評価は,試験
所環境,模擬した使用環境又は実際の使用環境のような様々な場所で実施してもよい。
注記3 ユーザビリティエンジニアリングの取組みの規模については,4.3を参照。
ユーザインタフェース評価計画は,別の計画に統合してもよい。
ユーザインタフェース評価計画は,ユーザビリティエンジニアリングファイルに保管する。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.7.2
*形成的評価の計画
形成的評価のためのユーザインタフェース評価計画は,次を含む。
a) 使用する評価方法
注記1 形成的評価の目的には,ユーザインタフェースの要素がユーザに認識可能で,理解可能で,
また,運用可能である度合いを調査することを含めることがある。
b) ユーザインタフェースの評価する部分
c) ユーザビリティエンジニアリングプロセスにおいて,各ユーザインタフェース評価を実施する時期
注記2 製造業者は,早い段階で形成的評価に重点をおいた取組みを行うことが有益であると気付
くことがある。これは,この評価から得る情報が設計プロセスへの貴重なインプットとな
るからである。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.7.3
*総括的評価の計画
選択したハザード関連使用シナリオ(5.5参照)のそれぞれについて,総括的評価のためのユーザイン
タフェース評価計画で,次を定める。
a) 採用した評価方法及びその方法で客観的証拠が得られるという根拠
注記1 安全に関する情報の総括的評価では,ユーザインタフェースの他の部分とは異なる方法が
要求されることがある。
b) ユーザインタフェースの評価する部分
c) 該当する場合,安全に関する情報が認知でき,理解でき,さらに,医療機器の正しい使用を支援して
いるかどうかを判断するための基準(4.1.3)
注記2 安全に関する情報の総括的評価は,通常,ユーザインタフェースのその他の部分の総括的
評価を開始する前に終了させる。その評価は,通常,その他の部分の評価とは異なるユー
ザを対象とした独立したユーザビリティ試験になる。
d) *総括的評価の期間における附属資料の使用及びトレーニングの提供
注記3 総括的評価には,現実的な使用を模擬するために,必要に応じて,トレーニングを評価計
画の一部に含めることができる。典型的な学習記憶の減退を考慮して,トレーニングと残
りの総括的評価との間には適切な待機時間が必要となることがある。
e) *ユーザビリティ試験の場合,
− 試験環境及び使用条件,並びにこれらがどのように実際の使用条件を適切に代表するかの根拠
− 観測された使用エラーのその後の分析のための,ユーザビリティ試験におけるデータ収集の方法
総括的評価は,1回でも複数回でもよい。
13
T 62366-1:2019 (IEC 62366-1:2015)
注記4 総括的評価の計画は,形成的評価の完了までは最終的に確定しない可能性がある。
注記5 リスクコントロール手段の適切性を評価する指針は,JIS T 14971:2012のD.4にある。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.8
*ユーザインタフェース設計,実装及び形成的評価の実施
製造業者は,必要に応じて附属資料及びトレーニング機能を含めて,ユーザインタフェース仕様に記述
したとおりにユーザインタフェースを設計及び実装する。
製造業者は,この設計及び実装を達成するため,形成的評価を含むユーザビリティエンジニアリングの
方法及び技術を,適切に使用する。使用した形成的評価の結果は,ユーザビリティエンジニアリングファ
イルに保管する。この間に新たな使用エラー,ハザード,危険状態又はハザード関連使用シナリオが見つ
かった場合,製造業者は,箇条5のステップを必要に応じて繰り返す。
注記1 JIS T 14971:2012の6.6は,他のハザード又は危険状態が発生していないかどうかを判断する
ために,ユーザビリティエンジニアリングプロセスから生じた設計変更をレビューすること
を要求している。
意図するユーザが医療機器を安全に使用するために,特定の医療機器についてのトレーニングを必要と
する場合,製造業者は,少なくとも次のうちの一つを行って,医療機器の予測耐用期間に必要なトレーニ
ング機能を設計し,実装する。
− トレーニングに必要な教材を提供する。
− トレーニングに必要な教材を確実に使用できるようにする。
− トレーニングを利用できるようにする。
− 責任部門がそのユーザに対しトレーニングを提供できるようにする。
注記2 トレーニング機能は,責任部門がそのユーザに対して,医療機器の予測耐用期間の間,トレ
ーニングを提供できるようにすることを意図している。
適合性は,形成的評価を実施した場合はその証拠を,及び必要な場合はトレーニング計画の存在を含め
た,ユーザビリティエンジニアリングファイルの調査によって確認する。
5.9
*ユーザインタフェースのユーザビリティに関する総括的評価の実施
ユーザインタフェースの設計及び実装が完了した後,製造業者は,ユーザインタフェース評価計画に従
って,最終的な,又は製品と同等のユーザインタフェースについて,5.5で選択した各ハザード関連使用
シナリオの総括的評価を行う。総括的評価の場合,製造業者は,データの適用方法に対する技術的根拠が
あれば,同等のユーザインタフェースをもつ製品の総括的評価から得たデータを使用してもよい。この結
果は,ユーザビリティエンジニアリングファイルに保管する。
総括的評価から得たデータは,発生した全ての使用エラーから生じる可能性のある結果を明らかにする
ために分析する。この結果が危険状態につながるならば,各使用エラーの根本原因を確定する。根本原因
は,ユーザの行動の観察及びその行動に関するユーザの主観的意見に基づいて究明することが望ましい。
このデータ分析の間に,新たな使用エラー,ハザード,危険状態又はハザード関連使用シナリオが,
− 見つかった場合は,製造業者は,必要に応じて箇条5の活動を繰り返す。
− 見つからなかった場合は,製造業者は,安全に関連するユーザインタフェース設計を,更に改善が必
要で,かつ,実施可能かどうかを決定する。
1) 更なる改善が必要で,かつ,実施可能な場合は,製造業者は,ユーザビリティエンジニアリングプ
ロセスを5.6から再び実施する。
2) 更なる改善が必要ではない,又は実施可能ではない場合は,製造業者は,次のように行う。
14
T 62366-1:2019 (IEC 62366-1:2015)
注記1 ユーザインタフェースには関連がないが,実質的にユーザインタフェース関連のリスク
を低減するリスクコントロールが存在するかもしれない。
i)
なぜ改善が実施可能でないかを文書化する。
注記2 ユーザインタフェースにおいて,更なるリスクの低減が実施可能でないと決定するた
めの指針は,JIS T 14971:2012の6.2にある。
ii) 使用に関連する残留リスクを決定するために必要なユーザビリティエンジニアリングプロセスか
らのデータを特定する。
iii) JIS T 14971:2012の6.4に従って,残留リスクを評価する。
注記3 JIS T 14971:2012の6.6は,ユーザインタフェース関連ではないハザード又は危険状態が発生
していないかどうかを判断するために,ユーザビリティエンジニアリングプロセスから生じ
た設計変更をレビューすることを要求している。
注記4 JIS T 14971:2012の箇条7は,医療機器の全体的な残留リスクを評価する際に,医療機器の
ユーザビリティに伴う残留リスクを含めた全ての残留リスクを考慮することを要求している。
この規格に規定するユーザビリティエンジニアリングプロセスに適合する場合,それを覆す客観的証拠
がない限り,医療機器の安全に関するユーザビリティは,受容可能とみなす。
注記5 製造後の監視によって,そのような客観的証拠が,後から見つかることがある。
適合性は,ユーザビリティエンジニアリングファイルの調査及びJIS T 14971:2012の6.4の要求事項の
適用によって確認する。
5.10 UOUP
5.1〜5.9の全ての要求事項の代わりに,附属書Cに従ってUOUPを評価してもよい。
適合性は,附属書Cの適用によって確認する。
15
T 62366-1:2019 (IEC 62366-1:2015)
附属書A
(参考)
指針及び根拠
A.1 指針
この附属書は,この規格の一部の要求事項に対する根拠を提供し,また,この規格の主題に精通してい
るが,この規格の対応国際規格の開発には関わらなかった人に向けたものである。これら要求事項の基礎
となる根拠を理解することは,これら要求事項を適切に適用するために不可欠であると考える。さらに,
臨床診療及び技術は時間の経過とともに変化するので,それらの進展に伴って必要になる規格の改正作業
も,この附属書の記載によって容易に進めることができると考える。
A.2 各箇条及び細分箇条の要求事項の根拠
この附属書Aは,この規格の特定の箇条及び細分箇条に対する根拠である。それらの番号は,この規格
の本文中の番号に一致している。
注記 このA.2の箇条又は細分箇条番号に付した“†”印は,対応する要求事項に対する根拠であるこ
とを示し,かつ,要求事項の文章でないことを容易に識別できるようにしたものである。
1† 適用範囲
この規格は,開発過程における医療機器のユーザインタフェースの安全に関連するユーザビリティに焦
点を当てている。“ユーザビリティ”には,一般的に,医療機器に対するユーザの満足度及び見栄え
(aesthetics)のような属性が含まれているが,それらは医療機器の安全には直接関係していないので,結
果としてこの規格では取り上げていない。
この規格では,使用エラーという概念を用いている。この用語を,より広く用いられている“ユーザエ
ラー”又は“ヒューマンエラー”という用語の代わりに選んだのは,医療機器の使用に関連する全てのエ
ラーが,必ずしも医療機器のユーザ側の見落とし又は不注意の結果とは限らないからである。広く一般的
には,使用エラーは,貧弱なユーザインタフェース設計によって直接的に引き起こされる[44]。
一部のユーザインタフェース設計には,それが直観的に理解できないか,直観に反しているか,又は学
習が困難な表示若しくは制御装置を採用しているために,使用エラーの原因となるものがある。このよう
な設計の欠陥は,時として,ユーザが医療機器を緊急時又は緊張に満ちた状況で使用したり,疲れていた
り,医療機器をごくまれにしか使用しないときには顕著になる。
この規格の適用範囲は,医療機器を取扱説明書に従って使用する場合,すなわち,通常使用の場合であ
る。ユーザは,医療機器を取扱説明書に従って使おうとするときに使用エラーを起こす。使用エラーは,
通常使用で起こるので,この規格では,正しい使用という新しい概念の用語を導入して,ユーザが使用エ
ラーを起こすことなく指示に従っている状況を規定している。附属書Dに,医療機器の使用の種類につい
て,例を付して追加情報を提供している。
ユーザビリティエンジニアリングプロセスは異常使用を特定するために使用できるが,この規格では,
異常使用に伴うリスクの評価又は低減のために,ユーザビリティエンジニアリングプロセスを使用するこ
とは要求していない。
この規格の適用範囲には,医療機器の使用に関係する臨床上の意思決定は含まれていない。特定の臨床
治療の状況で医療機器を使用するという決定には,予期する治療の効果と残留リスクとのバランスがとれ
16
T 62366-1:2019 (IEC 62366-1:2015)
ている必要がある。そのような判断では,意図する使用,性能及び医療機器に関連するリスク,並びに臨
床治療又は使用状況に関連するリスク及びベネフィットを考慮することが望ましい。このような判断の中
には,個々の患者の健康状態又は患者自身の考えを知った上で,資格をもつ医師だけが下せるものがある。
この規格は,ユーザビリティエンジニアリングプロセスを,安全に関連する医療機器ユーザビリティの
最適化のために適用することに限って焦点を当てている。この規格に対応する技術報告書(IEC TR
62366-2)は,包括的で,かつ,より広範囲に焦点を当てている。これは,安全に関連する範囲のユーザビ
リティだけでなく,タスクの正確さ,完全性及び効率,並びにユーザの満足度のような属性に対して,ユ
ーザビリティがいかなる関係にあるかにも焦点を当てている。
製造業者は,ユーザビリティエンジニアリングの一連のプロセスを実施する際,安全に注目した狭い範
囲で実施するか,安全に加えて上記の他の属性に注目したより広い範囲で実施するか,いずれかを選択で
きる。より広い範囲に注目することは,ユーザビリティエンジニアリングに対する具体的な期待,例えば,
ユーザが安全には関連しないタスクをうまく実施できることを確認する必要がある場合に,役に立つこと
もある。製造業者は,安全に使用できるだけでなく,優れたユーザビリティも提供するといった,医療機
器の商業的ベネフィットを実現するために,より広い範囲でプロセスを実施することもできる。
3.1† 異常使用
異常使用には,次の下位カテゴリを含む。
− 例外的な違反(例えば,医療機器をハンマーとして使用する。)
− 禁忌に対する意識的な無視(すなわち,4.1.3,5.7.2及び5.7.3に従って評価した,誤り及びそれに対
するリスクについて,ユーザに提供した安全に関する情報の無視)
− 無謀な使用(すなわち,ユーザが自分で勝手にリスク・ベネフィットを判断してしまうような危険に
対する無関心)
例1 保護ガードを取り外して医療機器を使用する。
例2 患者に対するリスク又はベネフィットを考慮せずに出力制限を無視する。
− 妨害行為
異常使用を定義することで,この規格の箇条1に記載したものが特定できる。
ユーザビリティ試験では,医療機器を使用するユーザが適切な使い方を知っていて,これに反する行為
をする(又は行為をしない)という意識的な決断をしたことが,試験後インタビューにおいて確定された
場合は,そうしたユーザの行為又は行為の欠如を異常使用とみなすことが望ましい。試験後インタビュー
においてユーザが適切な使用を知らなかったと分かった場合は,附属資料又はトレーニングが不十分であ
った可能性がある。
3.5† 効率
効率は,ユーザビリティの定義に含まれており,それ自体,費やした資源に関する有効性と定義されて
いる。効率は,常に望ましいものであり,また,常にではないが,しばしば安全にとって重要な意味をも
つ。効率の欠如は,リスクの原因となったり,既存のリスクを増加させたりする。また,一方で,効率の
良い医療機器はある種のリスクを低減できる。
医療機器において,効率が安全に最も関連する事例の幾つかに,タスクの実行時間が患者にとって重大
な結果となる場合がある。実行効率が安全にとって重要な医療機器の一例が,自動体外式除細動器(AED)
である。これらの医療機器は,人の生命を救うために1秒を争う場面で使用される。効率的に使用できな
いAEDは,患者の生存確率を低下させる。同様に,侵襲的手術を受ける患者は,術中に感染及び麻酔に
よるリスクにさらされる。重要臓器がばく(曝)露される時間及び患者が麻酔を受ける時間を最小限にす
17
T 62366-1:2019 (IEC 62366-1:2015)
ることが,安全にとって重要な意味をもつ。したがって,外科手術の間に使用される医療機器である手術
道具は,感染及び麻酔による現状のリスクを更に増加しないように,可能な限り効率的である必要がある。
3.9† 通常使用
使用エラーは,医療機器を取扱説明書に従って使おうとするときに発生することがあるので,通常使用
と正しい使用とは区別される。
通常使用には,ユーザが,医療機器を製造業者の意図する使用に従って操作するときの,予見可能なユ
ーザの全ての行為が含まれる。通常使用から明らかに除外されるのは,異常使用である。図D.1 2)も参照。
通常使用は,通常の使用条件下で予見可能なユーザの行為であり,正しい行為も誤った行為も含まれてい
るが,いずれも製造業者の設計意図に反するものではない。
注2) 対応国際規格には図B.1とあるが,誤記なので訂正した。
例えば,ピンセット,メスのように,取扱説明書がなくても安全に使用できる医療機器がある。このよ
うな医療機器の場合は,一般に認められた使い方によって通常使用が確立される。
3.10† 患者
JIS T 0601-1:2017の定義には,動物が含まれている。JIS Q 13485:2018の医療機器の定義と整合させる
ために,患者の定義から動物を除外した。
3.11† 主要操作機能
この規格でいう主要操作機能とは,医療機器の安全に直結した機能である。
安全に直結している主要操作機能の例には,次の事項が挙げられる。
− ユーザが行うアラーム関連の設定
− X線線量パラメータ(例えば,kVp,mA)の設定
− 点滴パラメータ(例えば,流量)の設定
− ガス流量及び麻酔薬気化器の濃度の調整
− 医療機器を使用するためにユーザが組み立てる必要のある医療機器の部品
− 医療機器を使用するためにユーザが理解する必要のある医療機器の制御装置
− ユーザが操作する必要のある一連の表示画面
− 医療機器を使用するためにユーザが学ばなければならない医療機器操作手順
3.16† ユーザビリティ
ユーザビリティは,使用を容易にするユーザインタフェースの特性によって達成される。すなわち,ユ
ーザビリティとは,ユーザがユーザインタフェースによって提供される情報を認知し,理解し,その情報
に基づいて決定を下し,さらに,意図する使用環境において定める目標を達成するために,医療機器と相
互に作用し合うことを支援することである。これら要因の多くは,様々な度合いで安全に影響することが
ある。
医療機器及びその操作を熟知するために要する時間を,“学習性”(JIS Z 8521:1999,附属書表B.2)と
呼び,これは安全に影響を及ぼすことがある。医療機器の使用法に不安感がなく,肯定的な態度を“満足
度”(JIS Z 8521:1999の3.4)と呼ぶ。
注記 医療機器の詳細な操作法がいかに容易に覚えられるかは,“覚えやすさ”[32]と考えることがで
きる。覚えやすさは,ユーザが頻繁に使用しない医療機器又は機能では特に重要となる。
3.17† ユーザビリティエンジニアリング又はヒューマンファクタエンジニアリング
“ヒューマンファクタエンジニアリング”及び“ユーザビリティエンジニアリング”の用語は,互換性
があるように使用する人々もいれば,これらを区別する向きもある。区別をする人々は,人に関する知識
18
T 62366-1:2019 (IEC 62366-1:2015)
及びユーザインタフェース設計についての知識を構築及び適用することを“ヒューマンファクタエンジニ
アリング”(ときには,単にヒューマンファクタ)といい,主として合否基準の設定及びユーザビリティ
試験の実施によるユーザインタフェース評価を“ユーザビリティエンジニアリング”といっている。
用語に関係なく,ユーザビリティエンジニアリングプロセス(又は同じプロセスであるが別の名称で呼
ばれるもの)を効果的に適用することで,ユーザビリティは改善される。反対に,ユーザビリティエンジ
ニアリングプロセスの適用が効果的でなかったり,又はユーザビリティエンジニアリングが完全に欠如し
ていたりすると,ユーザビリティは低くなる。基本的な考え方は,通常,設計上の常識を当たり前に適用
するだけではユーザビリティは生じないということである。むしろ,ユーザビリティとは,望ましい最終
製品のことであり,医療機器の設計プロセスの初めから終わりまで全体を通じて,ユーザビリティエンジ
ニアリングを適用して得られるものである。
この規格では,ユーザビリティエンジニアリング(USABILITY ENGINEERING)及びヒューマンファク
タエンジニアリング(HUMAN FACTORS ENGINEERING)を同義語として扱っている。
3.18† ユーザビリティエンジニアリングファイル
ユーザビリティエンジニアリングファイルは,リスクマネジメントファイルの一部分とすることができ
る。ユーザビリティエンジニアリングファイルを,リスクマネジメントファイルから独立させて保管する
必要はない。ユーザビリティエンジニアリングファイルに,ユーザビリティエンジニアリング作業で作成
した全ての記録及び文書を物理的に収録する必要はない。ただし,少なくとも,必要とする全ての文書に
対する参照又は収録先を含めることが望ましい。
3.21† 使用エラー
使用エラーは,ユーザインタフェース設計の欠陥の兆候であることが多い。使用エラーは,ユーザが医
療機器とやり取り(相互作用)する際の,ユーザの行為(又は行為の欠如)である。ユーザと医療機器と
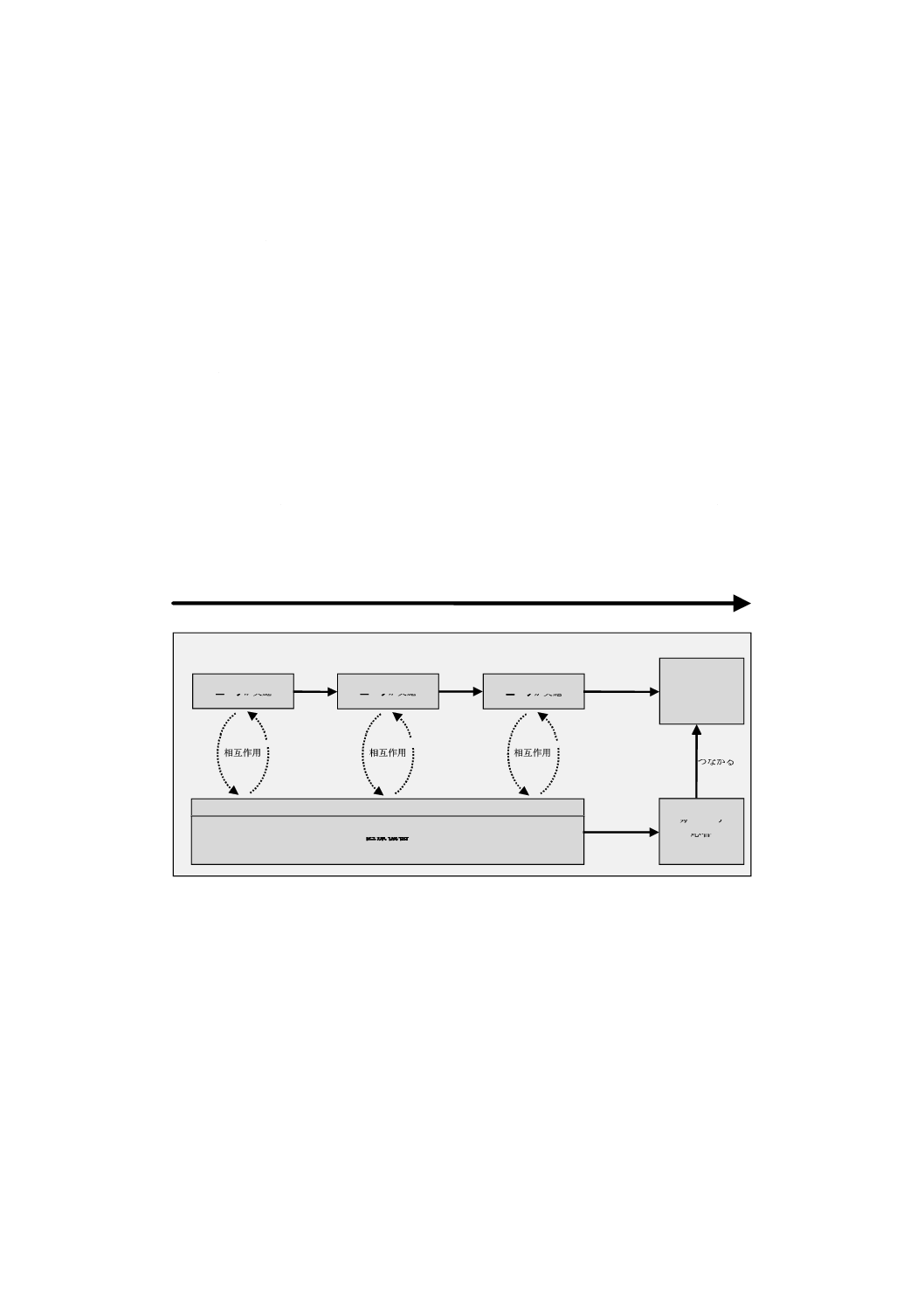
のやり取りは,図A.1に示す使用シナリオの一部としてモデル化できる。医療機器とやり取りしている間,
ユーザは,情報を認知し(例えば,ディスプレイから情報を読み出す。),この情報を認識できるように変
換し(例えば,ディスプレイの表示を解釈し),最後の行為を決定する(例えば,ユーザインタフェース
のボタンを押す。)。医療機器の側は,ユーザからのインプットを受け取り,それに基づいて作動して,ア
ウトプットを生成する。
図A.1に,使用エラーが危険状態に至ると考えられる二つの経路を示す。
− この医療機器の応答に起因する危険状態(A):使用エラーは,医療機器への誤ったインプットであり,
それによって危険状態に直接つながるアウトプットが生成される。
− この医療機器から得た情報に基づく(患者に対する又は別の医療機器を用いる際の)ユーザの行為又
は行為の欠如に起因する危険状態(B):この使用エラーは,医療機器ユーザインタフェースではなく,
使用環境で起こり,危険状態(B)に至る。
この規格の定義から,使用エラーは,この相互作用サイクルの“行為”の段階で発生する。すなわち,
認知の段階で発生する誤り(例えば,ディスプレイの誤読)又は認識の段階で発生する誤り(例えば,数
字の解釈の誤り)は,使用エラーとはみなさない。認知時の誤り及び認識時の誤りは,使用エラーに寄与
する要因又はその原因となる。使用エラー(誤った行為又は行為の欠如)は,医療機器からのアウトプッ
トの誤読又は解釈の誤りによって起こることがあるが,使用エラー自体は,誤った行為又は行為の欠如が
生じたときにだけ現れる。
例1 ユーザがCT画像システムの表示を読み違えて,左右を取り違え,患者の治療を間違った側に
施す。
19
T 62366-1:2019 (IEC 62366-1:2015)
例2 ユーザ(及び患者)が血糖値測定器の表示を読み違え,実際は血糖値が低すぎるにもかかわら
ず,高すぎると判断を下す。糖を摂取する替わりに,患者がインスリンペンを使用し,その結
果,こん(昏)睡状態を招く。
A この医療機器の応答に起因する危険状態
B この医療機器から得た情報に基づく,患者に対する又は別の医療機器を用いる際の,ユーザ
の行為又は行為の欠如に起因する危険状態
ここで,“認知”は,“認知又は認知の欠如”を,“認識”は,“認識又は認識の欠如”を,“行為”
は,“行為又は行為の欠如”を表す。淡灰色のエラーボックスは,誤りが発生し得る場所である。
参考文献[36]参照。
図A.1−ユーザ・医療機器相互作用のモデル
危険状態を引き起こす可能性のある使用エラーを低減することが,この規格に規定するユーザビリティ
エンジニアリングプロセスの焦点である。ただし,使用エラーが,常に危険状態を引き起こしたり,危害
につながったりするわけではない。したがって,使用エラーはリスクではなく,また,重大さもない。
医療機器の使用中,発生した使用エラーの全てが危険状態を引き起こすわけではなく,また,発生した
使用エラーの全てが危害につながるわけでもない。同じ種類の使用エラーが,一方では危害につながり,
他方では無害であることがある。例えば,血糖値測定器の表示を読み違えて,140 mg/dlではなく141 mg/dl
としても問題にはならないかもしれないが,同じ表示を140 mg/dlではなく240 mg/dlと読み違えると,危
害につながることもある。しかしながら,使用エラーが危険状態を引き起こす可能性をもつ場合,使用エ
ラーは,ユーザビリティエンジニアリングプロセスの対象となることを理解することが重要である。
行為
使用エラー
行為
使用エラー
認識
認識誤り
認知
認知誤り
インプット
アウトプット
処理
危険状態
危険状態
ユ
ー
ザ
イ
ン
タ
フ
ェ
ー
ス
医療機器
ユーザ
A
B
20
T 62366-1:2019 (IEC 62366-1:2015)
3.22† 使用シナリオ
使用シナリオは,指定した使用条件で特定の結果を達成するために行う,ユーザと医療機器とのやり取
りを記述したものである。使用シナリオには,物語風の解説文のようなものからユーザのタスク又は一つ
のタスクの複数のステップを列挙したものまで,多くの異なった書式で文書にすることができる。使用シ
ナリオの目的は,ユーザが成果を上げようと努力する際に,医療機器の機能がどのように使用されるかを
解説することにある。図A.2は,使用シナリオがユーザのタスクと医療機器の機能とをどのように結び合
わせているかを示している。
例1 ユーザが誤って,間違った流量を輸液ポンプシステムにダイヤル入力し(使用エラー),それに
よって輸液ポンプが患者に過剰投与する(有害なアウトプット)。
例2 ユーザが間違ったボタンを押して(使用エラー),メッセージがディスプレイに表示される(誤
ったアウトプット)。これが危険状態につながる。
使用シナリオは,広い範囲の状態を網羅することができる。例えば,正しい使用でユーザが望む成果を
上げることに成功する使用シナリオ,使用エラーを伴う通常使用の場合に使用エラーがいかにして望まし
くない結果とつながるかを明記した使用シナリオが含まれる。使用シナリオが危険状態につながる場合,
この使用シナリオを,ハザード関連使用シナリオと呼ぶ。図A.3は,使用シナリオがハザード関連使用シ
ナリオ内でどのようにユーザのタスクと医療機器の機能とを結び合わせているかを図示している。
ハザード関連使用シナリオの実例を,表B.2に示す。
図A.2−使用シナリオにおけるタスク及び機能の関係
使用シナリオ
意図する
結果
タスク1を
ユーザが実施
タスク2を
ユーザが実施
タスク3を
ユーザが実施
医療機器
ユーザインタフェース
期待する
応答
相互作用
相互作用
相互作用
つながる
時間
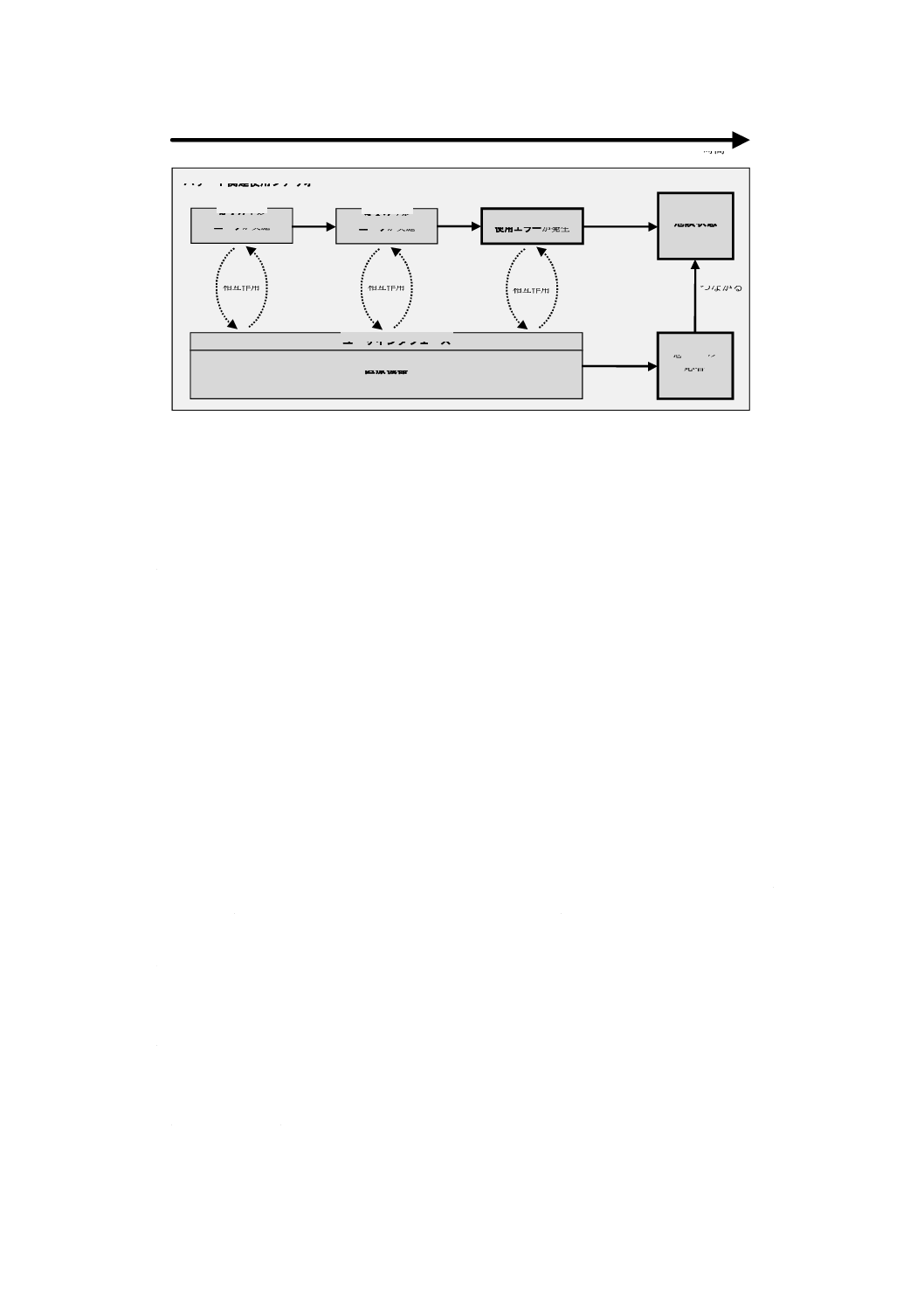
21
T 62366-1:2019 (IEC 62366-1:2015)
図A.3−ハザード関連使用シナリオ内におけるタスク,機能及び使用エラーの関係
3.23† 使用関連仕様
使用関連仕様(use specification)は,この規格の対応国際規格の旧版であるIEC 62366:2014では“用途
仕様(application specification)”としてきた。5.1†の根拠も参照。
3.24† ユーザ
ユーザは,医療機器を取り扱い,操作し,又は医療機器と相互に関わり合う全ての人々を指すものとし
て,ユーザビリティエンジニアリングの専門家に広く使用されている用語である。医療機器に関係する
人々は,多種多様であり,据付け担当者,エンジニア,技師,臨床医,患者,介護者,洗浄員,販売員,
営業員などを含む。ユーザは,ユーザインタフェースを介して医療機器と相互に関わり合う。ユーザは,
責任部門と呼ばれる実体とは別であるが,責任部門を構成するメンバである場合がある。
この規格の目的のため,医療機器を操作又は取り扱う全ての人を含む用語及び定義が必要である。他の
規格では,“操作する”又は“取り扱う”という言葉ではなく“相互に作用し合う”という言葉を用いてい
る。患者は,治療を受け,モニタされ,又は診断を受ける個人として医療機器と相互に作用し合う。この
相互作用は,医療機器の操作又は取扱いとは無関係のこともあるが,例えば,自宅で血糖値を測定するよ
うな,患者自身がユーザとなる状況もある。
多くの状況では,医療機器を操作又は取り扱う人が,患者の治療,モニタ又は診断とは関係のない,例
えば,据付け,洗浄,移動及び保守のタスクを行っている。
医療専門家(例えば,医師,看護師,技師及びセラピスト)及び非専門家(例えば,患者及び介護士)
を含む一部のユーザは,操作者と呼ばれることがある。他のユーザには,組立作業員,据付け担当者,輸
送担当者及び保守要員が含まれる。
ユーザは,臨床環境(例えば,医師の診療室,外来クリニック,病院,救急車又は検査室)又は非臨床
環境(例えば,家庭,オフィス又は屋外状況)において医療機器と相互に作用することがある。
3.26† ユーザインタフェース
ユーザインタフェースには,ハードウェア及びソフトウェアインタフェースの両方を含めた,医療機器
とユーザとの間の全ての相互作用手段が含まれる。これらの手段には次があるが,これに限らない。
− 手動操作が必要な要素
− ケーブル及びチューブの接続部
− 附属品
ハザード関連使用シナリオ
危険状態
時間
タスク1を
ユーザが実施
タスク2を
ユーザが実施
タスク3で
使用エラーが発生
医療機器
ユーザインタフェース
想定外の
応答
相互作用
相互作用
誤った
相互作用
つながる
22
T 62366-1:2019 (IEC 62366-1:2015)
− ハンドル
− 動かすのに必要な力
− 作業台の高さ
− 届く範囲の要求事項に影響を及ぼす寸法
− マーク表示及び附属資料
− ビデオディスプレイ
− 押しボタン
− タッチパネル
− ユーザに情報を送るための聴覚,振動,触覚及び視覚的な信号
− 音声認識
− キーボード及びマウス
− タッチ式の制御装置
3.28† ユーザインタフェース仕様
ユーザインタフェース仕様は,医療機器に特有の,ユーザインタフェースの技術特性を記述する設計要
求事項の集合である。特に,ユーザインタフェース仕様は,リスクコントロール手段などの安全使用に関
連するユーザインタフェースの要素に関する設計要求事項を含む。ユーザインタフェース仕様は,十分な
詳細を提供し,また,ハードウェア及びソフトウェアエンジニアが設計管理原則に合致するユーザインタ
フェースを実装できるような方法で記述されていることが望ましい。
ユーザインタフェース設計要求事項の例は,次のとおりである。
− ディスプレイは,1 mの距離に並んで立っている3人が視認できて,全員がテキストを読み取れるも
のでなければならない。
− 医療機器は,その前面から1 mのところで測定したとき,45 dBA〜80 dBAの範囲で調整できる音圧
レベルをもつ聴覚アラーム信号を発生できるものでなければならない。
− タッチペンは,ディスプレイの中心軸から±50°の水平角度とディスプレイの中心軸から±30°の垂
直角度とで見たときに,ディスプレイ上のソフトウェア制御装置を作動させるものでなければならな
い。
ユーザインタフェース仕様は,医療機器を実装するエンジニアリングチームに対して必要な設計インプ
ットを提供するために,ユーザビリティエンジニアリングプロセスの十分に早い段階で確立することが望
ましい。ただし,反復設計法を採用する場合,ユーザインタフェース仕様は,予想されるユーザインタフ
ェースに関して新たな知見が形成的評価を通じて得られるのに応じて,更新及び改良を施す必要があるか
もしれない。最終的に十分に完成したとき,ユーザインタフェース仕様は,最終的ユーザインタフェース
の技術特性を記述する包括的な設計仕様を構成する。
この規格の対応国際規格の旧版では,“ユーザビリティ仕様”にこの資料が含まれていて,ユーザイン
タフェース仕様は,ユーザビリティ仕様の一部であった。ユーザビリティ仕様は,使用シナリオはもちろ
ん,試験可能なユーザインタフェース要求事項を含んでいた。この規格は,これら二つの概念的な構成要
素を,独立した項目,すなわち,ユーザインタフェース仕様(5.6)及び危険状態に焦点を当てた使用シナ
リオ(5.4)として扱っている。
4.1.1† ユーザビリティエンジニアリングプロセス
(輸送)
輸送中に,設計に起因する使用エラーで,例えば,輸送しているときの運搬用ハンドルの不適切な使用
23
T 62366-1:2019 (IEC 62366-1:2015)
で,医療機器に損傷を招くことがある。設計に起因する使用エラーのもう一つの例は,発送する前に医療
機器を不適切な配置でこん(梱)包することであり,それによって移動中の損傷を招くことがある。
(保管)
同様に,医療機器の保管中の不適切な配置による使用エラーが損傷を招くことがある。例えば,設計に
よっては,損傷を招きかねないやり方でユーザが医療機器を積み重ねてしまうことがある。ユーザが,設
計に起因する使用エラーによって,不適切な状態で医療機器を保管してしまうこともあり得る。例えば,
ドアが開いたままで保管する,上下逆さまに保管するなどで,結果的に損傷を招いてしまう場合である。
4.1.2† ユーザインタフェース設計に関連するリスクコントロール
実施可能な場合,医療機器は,本質的安全で設計することが望ましい。これができない場合は,柵のよ
うな防護手段,又はユーザへの積極的な通知などが適切である。文書による厳重注意又は禁忌のような安
全に関する情報を防護手段とするのは,最も好ましくない。製造業者は,選んだ選択肢の根拠をユーザビ
リティエンジニアリングファイルに文書化することが望ましい。
4.2† ユーザビリティエンジニアリングファイル
この規格では,ユーザビリティエンジニアリングに適用する全ての記録及び文書の場所を製造業者が特
定するために,ユーザビリティエンジニアリングファイルという用語を用いている。これは,ユーザビリ
ティエンジニアリングプロセスの実践を容易にし,また,この規格に対するより効率的な監査を可能にす
る。トレーサビリティは,ユーザビリティエンジニアリングプロセスが適用されたことを明らかにするた
めに必要である。
ユーザビリティエンジニアリングファイルを構成する記録及び文書は,例えば,リスクマネジメントフ
ァイルが要求する他の文書及びファイルの一部とすることができる。ユーザビリティエンジニアリングフ
ァイルには,必ずしも全ての記録及び文書を含める必要はない。ただし,少なくとも要求する全ての必要
な文書に対する参照又は収録先を含めることが望ましい。
5† ユーザビリティエンジニアリングプロセス
この規格に規定するユーザビリティエンジニアリングプロセスの目的は,患者,ユーザ及びその他のユ
ーザビリティに関連する人々に安全を提供することである。このために,ユーザビリティエンジニアリン
グプロセスは,正しい使用及び使用エラー,すなわち,通常使用に伴うユーザビリティの問題で生じるリ
スクを低減する。成否(success)は,ユーザインタフェース仕様で定める合否基準に従って,ユーザイン
タフェースのユーザビリティを評価することで検証する。したがって製造業者は,この合否基準を決定す
る際には,この基準を満たしてユーザビリティに関連する残留リスクを受容可能なレベルまでコントロー
ルできることを確実にするために必要とされる要因(例えば,技術の現状,類似医療機器での経験,製造
後の監視報告)を考慮する。製造業者は,JIS T 14971:2012の3.4 d)に従って決定した合否基準を適用する
ことができる。
JIS T 14971に規定する総合的なリスクマネジメントプロセスでは,製造業者が,医療機器に関連するハ
ザード及び危険状態を特定し,プロセスを特定し,それに伴うリスクの推定及び評価を行い,リスクをコ
ントロールし,そのリスクコントロールの有効性をライフサイクル全体で監視するためのプロセスを確立
し,文書化し,維持することを要求している。このようなプロセスには,次の要素を含む。
− リスク分析
− リスク評価
− リスクコントロール
− 製造及び製造後の情報
24
T 62366-1:2019 (IEC 62366-1:2015)
総合的なリスクマネジメントプロセスをユーザインタフェースに適用するとき,個々の使用エラーのリ
スクの推定が困難になり得る。特に,人が使用エラーを起こす可能性を前もって予測する有効な手段が存
在しないからである。しかし,この規格は,製造業者が医療機器のユーザビリティを分析し,仕様を定め,
設計し評価するために活用できるプロセスを規定している。このプロセスを実施すれば,ユーザの行動を
予測できない状況に製造業者が取り組めて,使用エラーを少なくすることができる。このプロセスは,次
によって,製造業者の目標達成を助ける。
a) ユーザインタフェースに関係するハザード及び危険状態の発見
b) ユーザインタフェースに関係するリスクコントロール手段の設計及び実施
c) リスクコントロール手段の評価
ユーザビリティエンジニアリングプロセスの効果として,この他に顧客満足の改善があるが,これは,
この規格の適用範囲を超えるものである。
図A.4は,JIS T 14971のリスクマネジメントプロセスとこの規格のユーザビリティエンジニアリングプ
ロセスとの関係及び相互作用の概要を示したものである。リスクマネジメントは,受容可能なリスクを決
めるための意思決定プロセスであり,ユーザビリティエンジニアリングは,ユーザビリティに伴うリスク
の原因となる使用エラーの可能性を低減するためのユーザインタフェースの設計・開発プロセスである。
製造業者がJIS T 14971:2012の4.2に従って医療機器の安全に関連する特性を特定する際,医療機器の
ユーザインタフェースについては,ユーザビリティエンジニアリングプロセスによって,このステップに
必要な詳細情報(5.2)が提供できる。
さらに,製造業者がJIS T 14971:2012の4.3に従って医療機器に関連する既知の又は予見可能なハザー
ド及び危険状態のリストをまとめる際,ユーザビリティエンジニアリングプロセスは,医療機器のユーザ
インタフェースについてこのステップで考慮する項目(5.3)のリストを提供する。
JIS T 14971では,特定した各危険状態に関連するリスクを推定し(JIS T 14971:2012の4.4),評価(JIS
T 14971:2012の箇条5)するように要求している。製造業者のリスク受容基準に従ってリスクが受容でき
なければ,製造業者は,リスクを受容可能なレベルまで低減するために適切なリスクコントロール手段を
明らかにする必要がある(JIS T 14971:2012の6.2)。次に製造業者は,特定したリスクコントロール手段
を実施して(JIS T 14971:2012の6.3),それがリスクを受容可能なレベルまで低減するのに効果的である
ことを検証する必要がある。
ユーザビリティエンジニアリングプロセスでは,ハザード関連使用シナリオを選択する(5.5)前に,全
ての既知の又は予見可能なハザード関連使用シナリオ(5.4)を取り扱い,それらをユーザインタフェース
評価計画の作成に使用することを要求している。この規格では,使用に関連するリスクコントロールの選
択肢を,試験可能なユーザインタフェース仕様の要求事項を開発する間に特定する(5.6)。
実施したユーザインタフェースの形成的評価及び総括的評価は,ユーザインタフェース評価計画書に計
画する(5.7)。形成的評価は,ユーザインタフェースを調査するため,改善の必要性を特定するため,又
はユーザインタフェースの適切性を確認するために,ユーザインタフェースの設計・実装(5.8)の間に実
施する。
実施したユーザインタフェースは,ユーザインタフェース評価計画書の試験可能な要求事項を基準とし
て,総括的評価を行う。これは,JIS T 14971:2012の4.4〜6.3と同じ目的を達成するものである。
ユーザインタフェースがユーザビリティ仕様を満たしているとしても,製造業者は,評価を行って,JIS
T 14971:2012の6.6で求めているように,医療機器で,新たなハザード又は危険状態が発生したか否かを
判定することが望ましい。そのユーザインタフェースがユーザビリティ仕様を満たしていなければ,製造
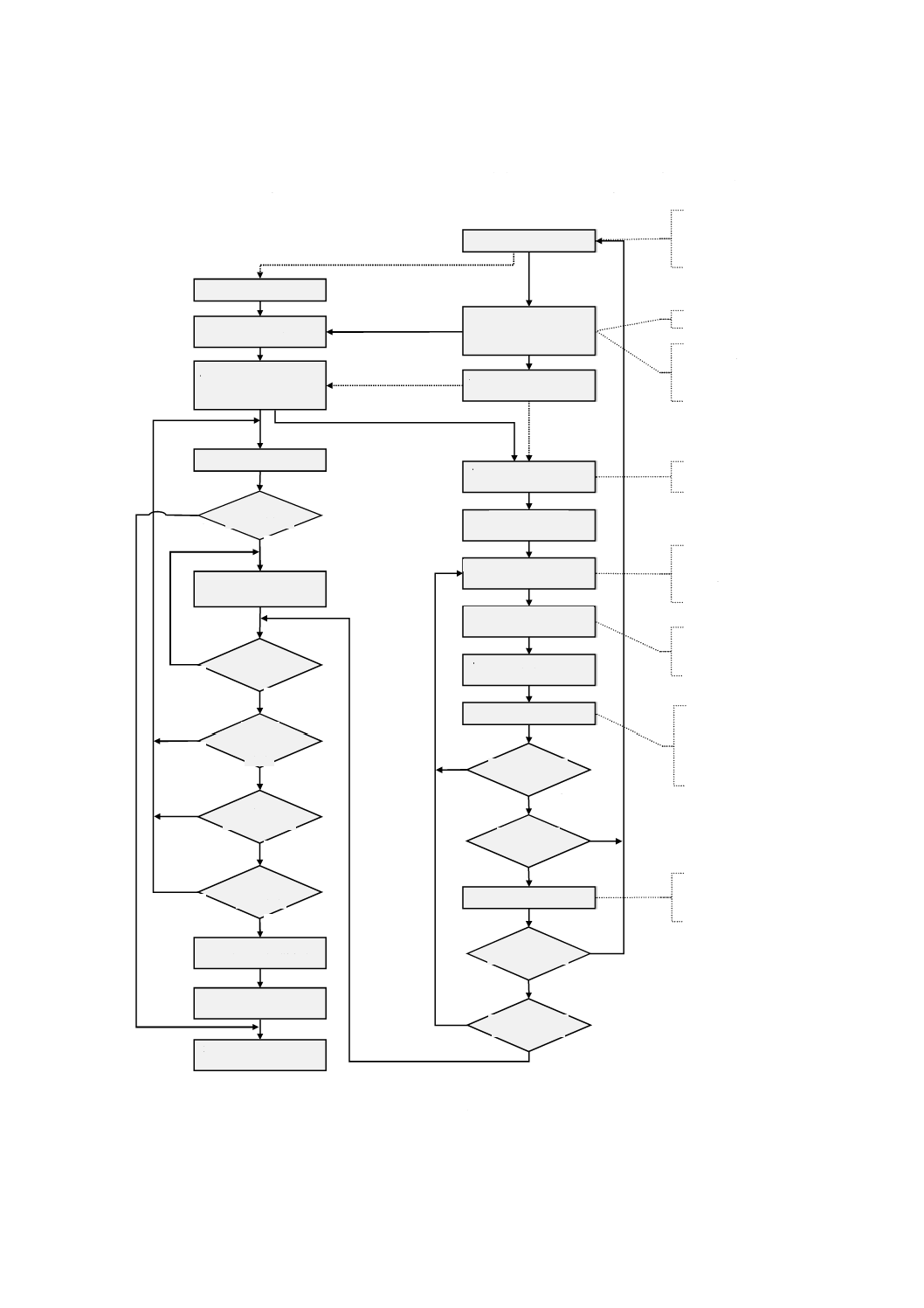
25
T 62366-1:2019 (IEC 62366-1:2015)
業者は,JIS T 14971:2012の6.4が求める残留リスクの評価を行うことが望ましい。
リスクマネジメント:JIS T 14971
ユーザビリティエンジニアリング:この規格
(意思決定プロセス)
(設計・開発プロセス)
図A.4−リスクマネジメントプロセス(JIS T 14971:2012)と
ユーザビリティエンジニアリングプロセス(この規格)との関係
機能分析
A
安全に関連する
ユーザインタフェース特性の
特定(5.2)
既知の又は予見可能なハザード
及び危険状態の特定(5.3)
総括的評価のための
使用シナリオの選択(5.5)
ユーザインタフェース仕様の確立
(5.6)
ユーザインタフェース評価計画の
確立(5.7)
ユーザインタフェースの設計
(5.8)
形成的評価の実施(5.8)
更なる改善が必要か
(5.8)
新たな問題点が
特定されたか
総括的評価の実施(5.9)
新たな問題点が
特定されたか(5.9)
更なる改善が必要で
実施可能か(5.9)
安全に関する
特質の明確化(4.2)
リスクの推定(4.4)
リスクの低減は
必要か(箇条6)
リスクコントロール手段の特定,
実施及び検証(6.2,6.3)
残留リスクは
受容可能か(6.4)
リスク・
ベネフィットは
受容可能か
(6.5)
他のハザードは発生
しているか(6.6)
特定した
全てのハザードを検討
したか(6.7)
残留リスクの全体的な
受容可能性の評価(箇条7)
リスクマネジメント報告書の
作成(箇条8)
製造及び市場出荷後情報の
レビュー(箇条9)
B
C
D
はい
いいえ
いいえ
はい
いいえ
はい
はい
はい
いいえ
いいえ
いいえ
いいえ
はい
はい
はい
いいえ
はい
E
タスク分析
認知タスク分析
作業負荷の評価
面談
詳細仕様
使用シナリオ
設計仕様
プロトタイプ作り
参加型設計
スタイルガイド
合否基準としての
ユーザビリティ目標
生産ユニット最終バリ
デーション
ユーザの調査
状況の調査
概念モデル
比較分析
エキスパートレビュー
ヒューリスティック分析
設計監査
認知的ウォークスルー
ユーザビリティ試験
ユーザビリティ試験
臨床シミュレーション
環境及び臨床現場に
おける試験
いいえ
ハザードの特定及び危険状態に
至る一連の事象の特定
(4.3,4.4)
ハザード関連使用シナリオの
特定及び記述(5.4)
意図する使用(4.2)
使用関連仕様の作成(5.1)
26
T 62366-1:2019 (IEC 62366-1:2015)
A,B,C,D及びEは,二つのプロセス間の情報の流れを表す。太い実線(B,D及びE)は,この規格が要求する
情報の流れを表す。“新たな問題点が特定されたか”は,新たなハザード,危険状態若しくはハザード関連使用シナリ
オが見つかった,又は実施したリスクコントロール手段が効果を発揮できていないことを意味していると解釈するこ
とが望ましい。
A 使用関連仕様は,JIS T 14971:2012の4.2に対するインプットである。
B 特定した安全に関連するユーザインタフェースの特性(5.2参照)
C 特定した予見可能なハザード及び危険状態(5.3参照)
D JIS T 14971:2012の4.4で特定した,危険状態に至る一連の事象は,ハザード関連使用シナリオを決定するインプ
ットである(5.4参照)。
E
残留リスクを評価する。
図A.4−リスクマネジメントプロセス(JIS T 14971:2012)と
ユーザビリティエンジニアリングプロセス(この規格)との関係(続き)
5.1† 使用関連仕様の作成
この規格に規定するユーザビリティエンジニアリングプロセスは,医療機器の使い方に関する最も重要
な特性を特定することで始まる。この特性は,製造業者が定義し,意図する医学的適応,意図する患者集
団及び動作原理のような要素に基づいており,医療機器の機能の基本となるものである。この情報は,医
療機器の使用関連仕様にまとめられる。この属性は,ユーザインタフェースに関係する既知で予見可能な
ハザード及び危険状態を特定するための,基本的な設計へのインプットである。医療機器の使用関連仕様
は,ユーザインタフェース仕様を定めるための基礎である。使用関連仕様に関連する特性のリストは,JIS
T 14971に規定する意図する使用の部分集合である。
(意図する医学的適応)
意図する医学的適応は,極めて広範にも,ごく狭いものにもなり得る。製造業者は,意図する医学的適
応を附属資料に明瞭に特定し,示すことが重要である。ユーザは,意図する医学的適応を理解し,所定の
医療機器が当該の患者に適しているかどうかを判定する必要がある。
医療機器の中には,意図する医学的適応が極めて広範なものがある。
例1 安全機構付き注射器:患者の筋肉及び皮下に薬剤を注入するのに適応
例2 マルチパラメータ患者モニタ:患者の複数の生理的パラメータのモニタが必要な場合はいつで
も適応
意図する医学的適応が,極めて狭い他の医療機器もある。
例3 中隔切開用カテーテル:心血管及び/又は心室の血管造影用カテーテル法に適応
例4 髄液マノメータ:腰椎せん(穿)刺による脳脊髄圧の測定に適応
(意図するユーザプロファイル)
意図するユーザに合わせて,医療機器を設計することが重要である。ユーザプロファイルを作成すると
きに考慮することが望ましい要素には,年齢,性別,言語及び文化的な背景,教育水準並びに専門的能力
が含まれる。意図するユーザに,身体的な障害がある可能性を考慮することが望ましい。例えば,糖尿病
患者が使用する医療機器は,糖尿病患者の視力が弱いこと,及び触覚が鈍いことがあることを考慮するこ
とが望ましい。
(使用環境)
意図する使用条件又は使用環境の属性は,問題となる特定の医療機器の使用法に関する重要な考慮事項
である。これには,次のような属性を含めることができる。
− 無菌又は非無菌
27
T 62366-1:2019 (IEC 62366-1:2015)
− 単回使用又は再使用可能(使用と使用との間で再処理が必要)
− 病院用又は一般家庭用
− 救急車用,病院内の搬送用又は壁取付け用
− 一般病棟用又は手術室用
− 周囲照明又は騒音レベル
− ユーザのための個人用保護具
(動作原理)
医療機器の動作原理には,次の事項の記述を含める。
− 意図する使用を達成するために用いる物理的方法
例1 高出力のエネルギーを用いるレーザメス
例2 ステンレス鋼製の鋭利な刃のメス
例3 高出力の高周波電磁場を用いるメス
− その動作メカニズム
例4 静脈注入ポンプは,プラスチック製チューブに液を送り入れるためにローラ及び機械式フィ
ンガを採用したぜん動機構によって,患者のカテーテルにつながれた静脈ラインに薬剤を送
り出す。
例5 静脈注入ポンプは,カセット内に真空を作り出してIVバッグから液を送り出す,患者のチュ
ーブにつながれたカセット機構のダイアフラムにつながれたプランジャをもつ容量制御ポン
プによって,患者のカテーテルにつながれた静脈ラインに薬剤を送り出す。
5.2† 安全に関連するユーザインタフェース特性及び潜在的な使用エラーの特定
安全に関連する特性は,使用関連仕様,及び次を含む医療機器の使用(JIS T 14971:2012のC.2.1)に関
する特性を含む。
a) 医療機器は,定期的に洗浄及び消毒すること,又は洗浄及び滅菌することを意図するかどうか(JIS T
14971:2012のC.2.9参照)。
b) 医療機器は,解釈機能をもつかどうか(JIS T 14971:2012のC.2.12参照)。
c) 医療機器の使用には,特別なトレーニングを必要とするかどうか(JIS T 14971:2012のC.2.26参照),
又は安全に対する他の情報が一般に与えられているかどうか(JIS T 14971:2012のC.2.27参照)。
d) 医療機器の適切な使用は,一般に人的要因に依存しているかどうか(JIS T 14971:2012のC.2.29参照)。
これには,使用エラーが,次のようなユーザインタフェースによって起こるかどうかも含む。
− 接続を行うタスク
− 表示関連
− 操作メニュー
− 使用環境によるもの
安全に関連する可能性のあるユーザインタフェース特性を特定するためには,最上位の機能をユーザに
対するタスクと医療機器に対する機能とに分解するとよい。このための一つの方法が,機能分析である。
このタスク及び対応する機能のリストは,ユーザインタフェース仕様を含む医療機器の技術的要求事項を
特定するためのインプット及びタスク分析のようなユーザビリティ分析を行うためのインプットを提供
する。特定したこれら両方の結果は,安全に関連する更なる他の特性を形成し,また,これを特定するこ
とを助ける。
28
T 62366-1:2019 (IEC 62366-1:2015)
5.3† 既知の,又は予見可能なハザード及び危険状態の特定
製造業者は,JIS T 14971に規定するリスクマネジメントプロセスの一部として,医療機器の使用に伴っ
て予測されるハザード及び危険状態のリストを作成する必要がある。患者,ユーザ又は第三者が実際にハ
ザードにさら(曝)されること(すなわち,危険状態の発生)がなければ,ハザードが危害をもたらすこ
とはない。JIS T 14971:2012の図E.1は,ばく(曝)露及びその他の概念を示している。図A.1は,引き起
こされる危険状態と,その原因となる使用エラーとの関連を示している。
5.4† ハザード関連使用シナリオの特定及び記述
ハザード関連使用シナリオの特定に当たり,製造業者は,ユーザが実施することを意図する特定のタス
クだけでなく,ユーザが実施することを意図するものではないが合理的に予見できる,他のタスク及び行
為についても調査することが望ましい。
5.5† 総括的評価のためのハザード関連使用シナリオの選択
医療機器のハザード関連使用シナリオは,少数だけの場合も非常に多数の場合もある。数が多い場合に
は特に,製造業者は,医療機器とユーザとの相互作用に最も大きな影響を与え得るユーザインタフェース
要素に注力し,資源を集中することが重要である。このことは,製造業者がハザード関連使用シナリオを
選択する(すなわち,そのシナリオを総括的評価に含める。)ための決定のスキームを策定することを要
求している。
ハザード関連使用シナリオの選択は,関連するハザードの潜在的結果の重大さに基づいて行うことがで
きる。特に,製造後データが使用できない新しい医療機器の場合には,リスクの一つの構成要素であるハ
ザードに遭遇する発生確率を推定することが非常に難しいので,リスクよりはむしろ,ハザードに焦点を
当てる必要がある。
ハザード関連使用シナリオを選択する際のもう一つの基本が,患者又はユーザに対して危害が発生する
リスクである。リスクの度合いは,発生確率と密接に関連する想定に基づいているので決定が困難なこと
があり,また,データがないため根拠を示すことも難しい。最終的には,正当な根拠を示すデータがある
場合に限り,ハザードの重大さと発生確率との組合せに基づくリスクの度合いを,ハザード関連使用シナ
リオの優先順位決定の根拠として使用することが望ましい。リスクの起こりやすさ,すなわち,発生確率
の値は,同一医療機器の現行製品若しくは以前の製品に関する製造後データ,又はリスクコントロール手
段が有効であるという確実性のレベルに関する製造後データから得ることができ,これらもデータで正当
性を証明することが望ましい。
ハザード関連使用シナリオの優先順位決定において,時間の影響を考慮に入れた手法は,より議論を呼
ぶものとなる。例えば,JIS T 60601-1-8:2012の表1は,このアプローチを用いている。ユーザビリティ試
験に含めるタスクの優先順位を決めるために,同様の手法を採用することができる。
この手法は,危害につながる一連の事象の分析に基づき,例えば,故障の木解析(Fault Tree Analysis)
を使用して確率の構成要素を推定するリスク推定と同様である。
5.6† ユーザインタフェース仕様の確立
先行するプロセスの各段階で収集した情報に基づき,ユーザインタフェース仕様は,ユーザインタフェ
ースに対する詳細で,かつ,試験可能な設計要求事項を含めることで,医療機器のユーザビリティ問題を
原因とするリスクが受容可能であることを確実にする。この要求事項は,特定した使用エラー及びハザー
ド関連使用シナリオだけでなく,使用関連仕様にも基づいており,医療機器機能固有のものである。
5.7† ユーザインタフェース評価計画の確立
製造業者は,ユーザインタフェース評価には一つ以上の方法を適用することが望ましい。単一の方法に
29
T 62366-1:2019 (IEC 62366-1:2015)
基づく知見では不十分なことがある(例えば,ある種のハザード関連使用シナリオを調査するためには,
使用を模擬するだけでは不適切な場合がある。)。この場合には,実際の使用条件下で追加のユーザインタ
フェース評価を必要とするかもしれない。
5.7.2† 形成的評価の計画
(それ以上の反復が必要ないことを決定するための基準)
ユーザビリティ試験を含むユーザビリティの形成的評価には,通常,正式な合否基準がない。これら評
価の目的は,ユーザインタフェースの設計を反復することで定めた品質レベルを達成し,また,ユーザイ
ンタフェースのユーザビリティの最終総括的評価が成功する可能性を増大させることである。ユーザイン
タフェース設計の反復を停止する決定は,形成的評価の後の段階で測定された品質レベルに基づいて行う。
反復的設計サイクルの終了時に総括的評価を実施したときに,最終合否基準が満たされていることを製造
業者が確信できるような品質レベルを達成したときは,それ以上の設計反復は不要である。
5.7.3† 総括的評価の計画
d)(附属資料の使用可能性及びトレーニングの提供)
附属資料は,医療機器ユーザインタフェースの一部であり,実際の使用を模擬するため必要に応じて,
総括的評価の間にユーザが使用可能であることが望ましい。総括的評価は,意図するユーザによる実際の
使用を模擬することを意図している。その目的は,ハザード関連使用シナリオにあるタスクをユーザがう
まく完了できたかという観点で,ユーザインタフェースのユーザビリティを評価することである。総括的
評価を実際の使用の現実に即した模擬にするためには,ユーザが実際の附属資料を使用でき,また,ユー
ザは,想定するトレーニングを実施済みである必要がある。
ユーザのトレーニングがリスクコントロール手段であり,また,使用の前に実施することを計画してい
る場合,トレーニングを実施した後にユーザが習得したことを忘れてしまう状況を想定するために適切な
経過時間を置く必要がある。この場合,トレーニングがリスクコントロール手段なので,トレーニングを
現実に近い形で提供しないと,総括的評価で“リスクコントロール手段としての有効性”を評価すること
はできない。同様に,附属資料の“リスクコントロール手段としての有効性”は,ユーザが附属資料を現
実に近い形で,使用可能でなければ,評価することはできない。
注記 “リスクコントロール手段としての有効性”は,JIS T 14971:2012の6.3に関連するもので,定
義した用語の“有効性”に対するものではない。
e)(ユーザビリティ試験)
ユーザビリティの総括的評価には,正式な合否基準がある。ユーザがハザード関連使用シナリオに関連
するタスクをうまく完了できたかどうかを判断するための基準を文書化する必要がある。この基準は,JIS
T 14971:2012の3.4 d)で要求しているリスクの受容可能性についての判断基準に当たる。さらに,この基
準は,JIS T 14971:2012の3.2で要求するリスクの受容可能性についての判断基準を設定する製造業者の方
針と一致する必要がある。この基準を表現する一つの方法は,危害につながる使用エラーは発生しないと
いうものである。受容できないリスクにつながる使用エラーは,発生しないという表現もある。
ユーザがタスクの実行中に使用エラーを起こすことがないとしても,タスクの実行が困難なことがある。
使用が困難だと使用エラーが発生し,更に危害につながることがある。使用の困難さは,ユーザビリティ
試験の中で,例えば,ユーザのちゅうちょ(躊躇),ユーザインタフェースの“試行錯誤”,附属資料を参
照しないと正しく操作できない,又は試験後の面談で実施するのが難しい点があったと意見が出る,のよ
うな形で現れることがある。困難さは,ユーザの混乱が要因となり生じ,様々なユーザ又は様々な使用条
件で,使用エラーを増やす可能性があるユーザインタフェースの特徴を示していることがある。
30
T 62366-1:2019 (IEC 62366-1:2015)
使用の困難さの例を,次に示す。
− ユーザが,患者モニタのアラーム設定画面を開こうとするが,別の画面を幾つも経過しないとたどり
つけない。
− ユーザが,目盛の印が細い線で,背景表面に対して低コントラストになっているため,薬剤が入って
いるガラス製注射器の目盛が読み取りにくいと意見する。
− ユーザが,滅菌処理済みの医療機器が入っているパッケージを開こうとしてタブを強く引くと,突然,
パッケージが破れて,中身をこぼしそうになる。
− ユーザが,流体チューブを繰り返しエアディテクタ内に押し込んで,チューブを定位置に維持しよう
とする。
− ユーザが,輸液ポンプの表示が反射して読み取りにくいと意見する。その結果としてユーザが,正し
い流量の確認に悪戦苦闘し,ようやく,流量の設定に成功する。
5.8† ユーザインタフェース設計,実装及び形成的評価の実施
ユーザインタフェースの設計は,ユーザのニーズ及び要求事項に着目して行うことが望ましい。ユーザ
インタフェース設計に対して,複数の専門分野にわたるチームによるアプローチが必要となる。このチー
ムには,実際のユーザ,エンジニア,ユーザインタフェース専門家,認知心理学者,マルチメディアのプ
ログラマ,ユーザビリティエンジニア,マーケティング及びトレーニング担当者を含んでもよい。製造業
者は,反復的なユーザインタフェースの設計・開発を行うことが望ましい。形成的評価を含むユーザビリ
ティエンジニアリングは,早い段階で開始し,医療機器の設計・開発プロセス全体を通じて反復的に継続
することが望ましい。
5.9† ユーザインタフェースのユーザビリティに関する総括的評価の実施
ユーザビリティエンジニアリングプロセスの最終段階は,選択したハザード関連使用シナリオのユーザ
ビリティの総括的評価である。総括的評価は,医療機器設計全体の検証及びバリデーションに関する活動
の一部である。これは,ユーザインタフェースの使用に関連する安全面のバリデーションとみなすことが
できる。
注記 安全の概念には,患者に対する受容できないリスクをもたらす性能の欠如又は低下が含まれる。
性能の欠如又は低下には,ユーザの意図する医療目的を達成するための医療機器の効果的な使
用を妨げる使用エラーによるものも含まれる。JIS T 0601-1:2017では,これを“基本性能”と
呼んでいる。
設計変更の場合,変更されていない部品に対しては,以前の総括的評価から得たデータをレビューして,
総括的評価を行うことができる。これは,製造後の設計変更で使用するプロセスと同じである。
例1 新規の薬剤に関する側面だけを試験する場合は,ユーザグループ,ユーザプロファイル及び使
用環境が同一の用途向けのペン型注射器に,新規の薬剤を充塡した充塡式ペン型注射器で得ら
れた総括的評価のデータ
例2 追加したユーザグループ又は追加した使用環境だけを試験する場合は,同一の充塡式ペン型注
射器に対して,追加のユーザグループ又は使用環境で得られた総括的評価のデータ
例3 変更したディスプレイ部品だけを試験する場合は,以前の版の充塡式ペン型注射器で得られた
総括的評価のデータ
ユーザインタフェース設計に直接責任をもつ人々は,総括的評価を行わないことが望ましい。
ほぼ全ての総括的評価において,ユーザビリティ試験の間に,ユーザによる使用エラーが見つかる。こ
の場合,製造業者は,これらデータを分析して,こうした知見の根本原因を特定する必要がある。ユーザ
31
T 62366-1:2019 (IEC 62366-1:2015)
の挙動の観察結果と,こうした挙動に対するユーザの主観的意見との両方を使用して,根本原因の特定に
当たるのが望ましい。
複数の使用シナリオにおいて,同じ使用エラー又は使用の困難さが起こることがある。この観察された
使用エラーの分析の目的の一つは,観察された使用エラーに関連するハザード関連使用シナリオを特定し,
他のハザード関連使用シナリオも影響を受ける可能性があるかどうかを決定することである。このことは,
全てのハザード関連使用シナリオについて,関連する危害の重大さが同じであるとは限らないため重要で
ある。観察された使用エラー又は使用の困難さは,異なるハザード関連使用シナリオにおいてより大きな
重大さで発生する可能性がある。
製造業者が,総括的評価の結果を分析した後に,ユーザインタフェースにおける一部のリスクコントロ
ール手段が効果的でないことを発見することがある(例えば,ユーザインタフェース評価計画に文書化し
た基準を満たしていない。)。この場合,総括的評価は,実際には形成的評価となり,製造業者は,ユーザ
ビリティエンジニアリングプロセスのステップ5.6に戻る。
さらに,総括的評価の間には,新たなハザード又は危険状態が見つかる可能性があり,新たなハザード
関連使用シナリオさえも見つかる可能性がある。この場合,新たなハザード又は危険状態を特定したこと
から,製造業者は,ユーザビリティエンジニアリングプロセスのステップ5.3に戻る。
C.2.1† 使用関連仕様
使用関連仕様は,医療機器の使用法に関連する最も重要な特性を特定するための基本的な情報源である。
UOUPを含むユーザインタフェースを評価する場合,附属資料は,使用関連仕様を過去に遡って確定する
ための貴重な情報源となる。
さらに,使用関連仕様は,附属資料と整合している必要がある。したがって,附属資料を慎重にレビュ
ーすることが最重要である。附属資料から得る(決定する)ことができない使用関連仕様の要素は,他の
情報源を用いて決定する必要がある。
C.2.2† 製造後情報のレビュー
入手可能な製造後情報をレビューして,UOUPをもつ医療機器における,ユーザインタフェースのユー
ザビリティの問題点によって引き起こされたかもしれない既知の問題点を特定する。製造後情報は不完全
なことがあり(例えば,有害な事象及び顧客の苦情の過小報告による。),また,問題の根本原因を特定す
るのが困難なことから,製造業者は,事象報告,顧客の苦情又は製品リコールの数ではなく,特定した問
題点に関連する潜在的危害の重大さを分析することが望ましい。
32
T 62366-1:2019 (IEC 62366-1:2015)
附属書B
(参考)
ユーザビリティに関連する危険状態の例
使用エラー又はユーザビリティ不良による医療機器の全てのリスクを分析するために,製造業者は,危
害につながる使用シナリオ及び関連する要因の全体を,意図する医療目的を実現するために医療機器を効
果的に使用しようとするユーザの妨げとなるものを含めて,慎重にレビューする必要がある。これら要因
を分析して成果をあげるために,表B.1に示す用語の意味及び用語間の関係を把握することが重要である。
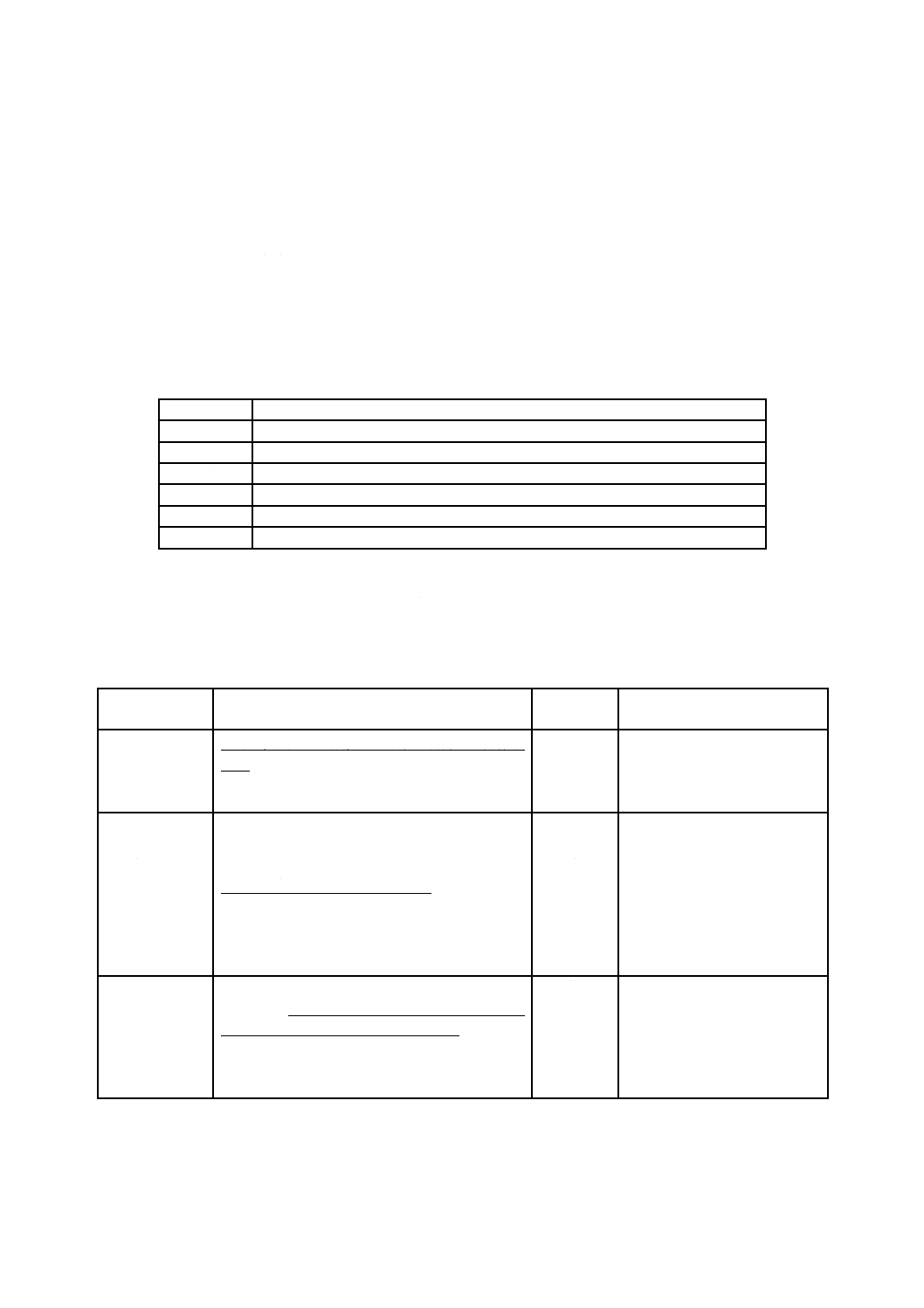
表B.1−リスクマネジメント関連用語集
用語
JIS T 14971:2012による意味
危害
人の受ける身体的傷害若しくは健康障害,又は財産若しくは環境の受ける害
ハザード
危害の潜在的な源
危険状態
人,財産又は環境が,一つ以上のハザードにさらされる状況
リスク
危害の発生確率とその危害の重大さとの組合せ
安全
受容できないリスクがないこと
重大さ
ハザードから生じる可能性がある結果(危害)に対する尺度
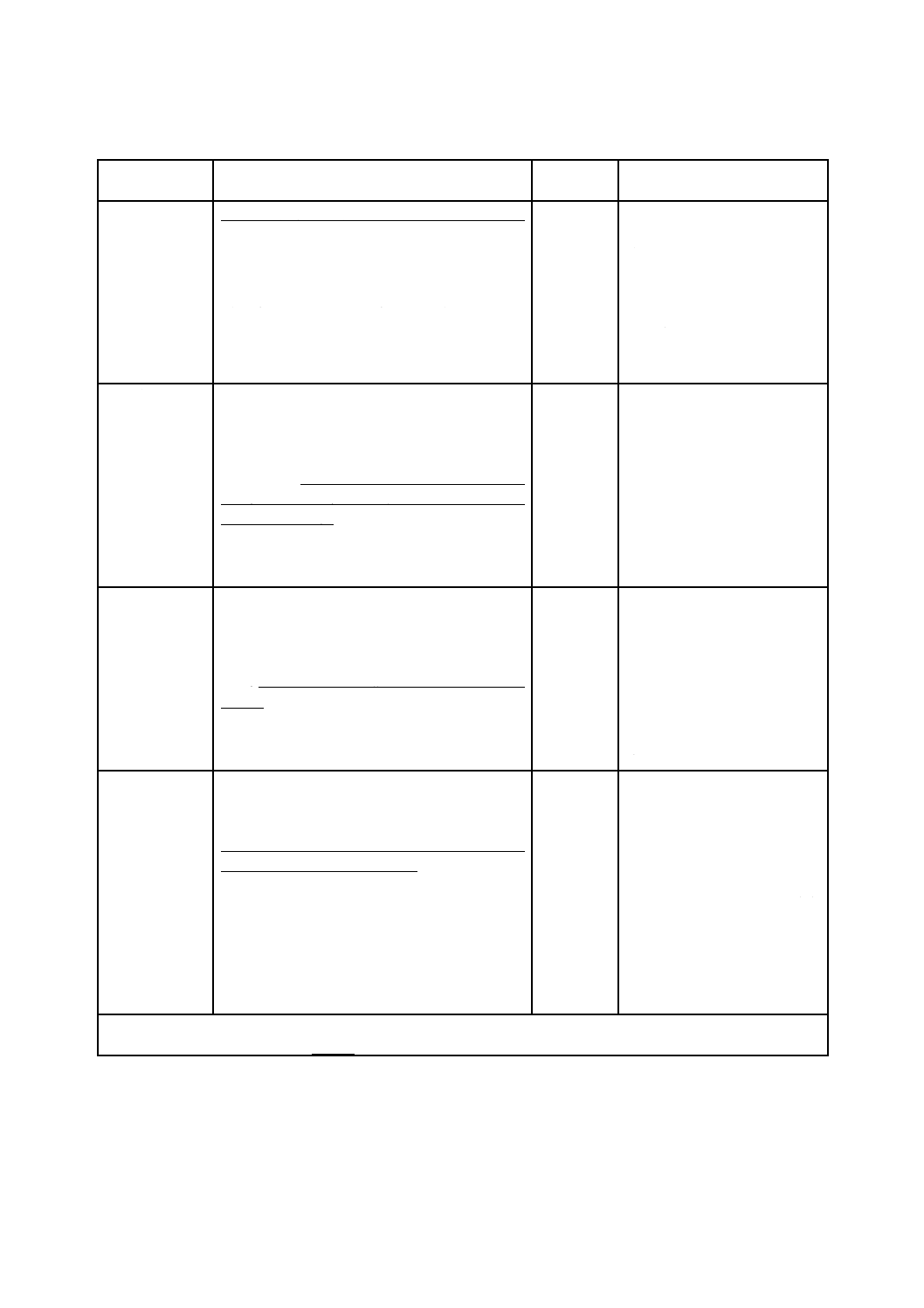
表B.2は,ハザードの代表例を,ハザード関連使用シナリオの内容及び結果として生じる危害とともに
示す。さらに,表B.2には,考えられるユーザインタフェースのリスクコントロール手段又は低減戦略に
ついても示している。
表B.2−使用エラー又はユーザビリティ不良が原因のリスクによる危害の例
ハザード
ハザード関連使用シナリオの内容a)
危害
ユーザインタフェース
リスクコントロール手段
放射線エネルギ
ー
医師が,偶発的に保護のない放射制御盤を操作す
る。
エネルギー源作動,
エネルギー源が周囲の人に向けられる。
火傷
放射制御盤にヒンジ止めカバ
ーを被せる。
防護手段(ガード)
注射針のとがっ
た先端(汚染し
た注射針)
静脈内カテーテルを挿入後,医師が保護されてい
ない使用済み注射器を病院のベッドのシーツ上
に置く。
医師が注射器の片付けを忘れる。
病院の職員がベッドシーツを交換する。
保護されていない注射器が病院のベッド上に残
る。
病院の職員が針刺し事故による怪我を被る。
皮膚せん
(穿)刺
(感染)
針刺し防止機構
防護手段(ガード)
硬い床への落下
病院ベッドのベッドガードのロック機構がかか
りにくい。看護師が,ガードレールが完全にロッ
クしていないことを認識していない。
ベッドガードが正しくロックしていない。
患者が,ベッドガードを押しながら横に転がる。
ベッドガードが下がり,患者が床に落下する。
股関節骨折 ベッドガードを使いやすい機
構にする。ロックしていないこ
とを明確に表示する。ベッドガ
ードのロック解除を2段階機構
にする。
設計による本質的な安全
33
T 62366-1:2019 (IEC 62366-1:2015)
表B.2−使用エラー又はユーザビリティ不良が原因のリスクによる危害の例(続き)
ハザード
ハザード関連使用シナリオの内容a)
危害
ユーザインタフェース
リスクコントロール手段
不正確な出力
看護師が静脈内投薬源のチューブを中枢神経へ
のアクセスポートに誤接続する。異なる2種類の
注入経路に同一のルアーコネクタを使用してい
る。看護師は,投薬源からアクセスポートへのチ
ューブの接続を確認しなかった。
静脈内投薬源のチューブを中枢神経へのアクセ
スポートに誤接続する。
静脈内投薬が患者の脊髄神経カラムに送出され
る。
永久麻ひ
(痺)
機械的に非互換である特定用
途の小口径コネクタを使用す
る。
設計による本質的な安全
注入する前に適切な流入流路
を確認するような追加トレー
ニング。
安全に関する情報(トレーニン
グ)
不正確な出力
モニタが再校正を要求していたが校正しなかっ
たため,前回の吸入ガス混合物中の許容可能な酸
素濃度の有効値がディスプレイ上に残った。適切
な校正ができていないことがはっきりと表示さ
れていない。麻酔科医がモニタの校正を確認し損
なう。麻酔科医は,酸素供給が適切に行われてい
ると考えている。
校正不良のガスモニタには,危険な,誤った値の
酸素濃度が表示される。
麻酔科医が低酸素の混合気を患者に送出する。
低酸素性脳
障害
“要モニタ校正”の警報条件を
追加する。
バックアップ酸素供給障害の
警報条件
防護手段(警報条件)
薬剤(モルヒネ)
の不適切な投与
周囲の照明が暗く,高い精神的負担のある救急治
療の状況で,多量のモルヒネが患者に投与されて
いる。救急医は,投与量を変更する必要があるが,
輸液ポンプの表示をはっきりと読むことができ
ない。救急医がモルヒネ輸液の流量を誤って入力
する。
この使用環境では,読み取りにくい輸液ポンプを
使用する。
輸液ポンプで過剰量のモルヒネを投与する。
呼吸停止
ディスプレイにバックライト
を追加する。
設計による本質的な安全
ユーザに限度外濃度であるこ
と,又は確認が必要な投与量で
あることを知らせるソフトウ
ェアによるメッセージを輸液
ポンプに組み込む。
防護手段
薬剤(インスリ
ン)の不適切な
投与
患者(ユーザ)の視力が弱い。血糖値測定器の測
定単位のラベルがはっきりしていない。患者の自
宅の周囲照明が不十分である。
患者が間違った単位の血糖値の表示を選択し,現
在の血糖値レベルを読み違える。
患者が読み取りにくい血糖値測定器を使用する。
患者が過剰量のインスリンを投与する。
こん(昏)
睡
表示装置にバックライトを設
ける。
ユーザによって校正可能な表
示文字サイズ
設計による本質的な安全
入力された血糖値の測定単位
が,指定された国の使用に適合
しない場合,確認ステップを必
要とするソフトウェアメッセ
ージを血糖値測定器に組み込
む。
防護手段
注a) 使用シナリオの記述は,少なくとも一つが使用エラーである一連の事象及びハザードが危険状態を経て危害
に至る有力な要因を含む。下線部は,使用エラーを示す。斜体部は,危険状態を示す。
34
T 62366-1:2019 (IEC 62366-1:2015)
附属書C
(規定)
開発過程が不明なユーザインタフェース
(UOUP)の評価
C.1 一般
この附属書は,この規格に定義するツールを,この規格の発行前に既に商品化していたユーザインタフ
ェース又はユーザインタフェースの一部に適用することに,多くの製造業者が関心を寄せるようになると
いう認識で作成した。このようなユーザインタフェース又はユーザインタフェースの一部は,この規格の
プロセスを使用せずに開発されており,結果として,これらのプロセスに関しては,その開発過程が不明
である。この規格は,ユーザビリティエンジニアリングを製品開発プロセスの一部として重視しているた
め,開発過程が不明なユーザインタフェース又はユーザインタフェースの一部を取り扱うためには,(こ
の規格の4.3に規定しているように)適切に調整した代替プロセスを開発することが望ましいと決定した。
次に示すものは,旧来の(legacy)ユーザインタフェース又はユーザインタフェースの一部の開発の過
程で作成された既存の文書に可能な限り依存するプロセスである。これは,また,組織的資源をできるだ
け効率的に活用しながらプロセスを適用しようと試みるものでもある。完了すれば,ユーザビリティエン
ジニアリングファイルが作成され,また,リスクマネジメントファイルが,ユーザインタフェースのユー
ザビリティ問題に起因するリスクを特定できるようになる。
この附属書のプロセスは,この規格のユーザビリティエンジニアリングプロセスを使用した十分な開発
記録が入手できない,開発過程が不明なユーザインタフェース(UOUP)又はユーザインタフェースの一
部に適用することができる。ただし,ユーザインタフェース又はその一部に何らかの修正が加えられてい
る場合は,ユーザインタフェースの変更されていない部分だけはUOUPのままであり,ユーザインタフェ
ースの変更された部分は,5.1〜5.9の対象となる。
例1 この規格の発行前に設計・開発されて,変更がなされていない,旧来のユーザインタフェース
については,この附属書を使用して評価し,この規格への適合を判定する。
例2 この規格に従って開発された十分な記録のないユーザインタフェースを修正する場合:修正し
た部分は,この規格の5.1〜5.9を使用して評価し,この規格への適合を判定する。ユーザイン
タフェースの変更されていない部分については,この附属書を使用して評価し,この規格への
適合を判定する。
例3 この規格の発行前に設計・開発されたユーザインタフェースに対し,新しいソフトウェア機能
を追加して修正する場合:ソフトウェア機能を追加したユーザインタフェース,及び追加のソ
フトウェア機能によって影響を受けるユーザインタフェースの全ての部分は,5.1〜5.9を使用
して評価し,この規格への適合を判定する。元々のユーザインタフェースの修正していない部
分については,この附属書を使用して評価し,この規格への適合を判定する。
例4 既存のユーザインタフェースに,この規格を使用して開発された十分な記録のない汎用コンポ
ーネントを使用して変更する場合:汎用コンポーネントを医療機器に組み込むには,既存のユ
ーザインタフェースに対する変更が必要である。汎用コンポーネントの組込みに伴うユーザイ
ンタフェースに必要な変更は,5.1〜5.9を使用して評価し,この規格への適合を判定する。元々
のユーザインタフェースの修正していない部分については,この附属書を使用して評価し,こ
35
T 62366-1:2019 (IEC 62366-1:2015)
の規格への適合を判定する。
この附属書では,この規格の発行前に設計・開発したユーザインタフェースを想定しているが,この規
格と対応国際規格の発行時期が異なるため,この附属書を適用して,この規格に適合した場合でも,対応
国際規格IEC 62366-1:2015への適合を示すことができない場合がある。
C.2 開発過程が不明なユーザインタフェースのユーザビリティエンジニアリングプロセス
C.2.1 *使用関連仕様
製造業者は,5.1で要求しているように,使用関連仕様を確立する。製造業者は,ユーザビリティエン
ジニアリングファイルに,使用関連仕様を保管する。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
C.2.2 *製造後情報のレビュー
UOUPをもつ医療機器の製造業者は,苦情及び事故又はヒヤリ・ハットに関する現場の報告を含め,入
手可能な製造後情報をレビューする。
危険状態の原因となり得る特定した全ての使用エラーの事例,又は不十分なユーザビリティに起因する
ハザード若しくは危険状態が起こりかねなかったと現場の情報が示唆する事例は,ユーザビリティエンジ
ニアリングファイルに保管し,C.2.3及びC.2.4で取り扱う。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
C.2.3 ユーザビリティに関連するハザード及び危険状態
製造業者は,UOUPを備える医療機器のリスク分析をレビューしてユーザビリティに関連するハザード
及び危険状態を特定し,文書化する。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
C.2.4 リスクコントロール
製造業者は,C.2.3において特定した全てのハザード及び危険状態に対して,十分なリスクコントロール
手段が実施されていること,及び全てのリスクがリスクアセスメントで示された受容可能なレベルまで低
減されていることを検証し,文書化する。
製造業者が,リスクを受容可能なレベルまで低減するためには,ユーザインタフェースの何らかの部分
に対する変更が必要であると判定した場合,変更する部分は,UOUPとみなしてはならず,5.1〜5.9の要
求事項に従う必要がある。
適合性は,ユーザビリティエンジニアリングファイルの調査によって確認する。
C.2.5 残留リスクの評価
ステップC.2.3及びC.2.4の実施によって確認された全ての新情報に基づいて,製造業者は,JIS T
14971:2012の箇条7 3)に従って残留リスクを全体的に再評価し,その結果をユーザビリティエンジニアリ
ングファイル又はリスクマネジメントファイルのいずれかにおいて文書化する。
注3) 対応国際規格の誤記を訂正した。
適合性は,ユーザビリティエンジニアリングファイル又はリスクマネジメントファイルの調査によって
確認する。
36
T 62366-1:2019 (IEC 62366-1:2015)
附属書D
(参考)
医療機器の使用の種類及び例
この規格では,医療機器の使用は,予見可能な行為及び予見不可能な行為に大きく分類することができ
る。予見不可能なユーザの行為又は行為の欠如については,この規格又は他の規格で対応できないのは明
らかである。この規格は,予見可能なユーザの行為又は行為の欠如に取り組むプロセスを規定している。
図D.1に,医療機器の様々な使用の種類について,相互関係を幾つかの原因の例とともに示す。
通常使用に分類される使用には,製造業者が意図し,かつ,ユーザが期待する応答,すなわち,正しい
使用が含まれる。この他には,使用エラーから生じる使用もあり,また,製造業者によるリスクコントロ
ールの追加手段の範囲を超えた行為から生じる使用(すなわち,異常使用)もある。異常使用の結果は,
必ずしも患者にとって好ましくない結果になるわけではない。こうした使用法が患者にとって最良である
と,ユーザが臨床的に判断することがしばしばある。

37
T 62366-1:2019 (IEC 62366-1:2015)
図D.1−様々な医療機器の使用の種類の相互関係及びその例
通常使用
使用エラー
正しい使用
●
使用エラーのない通常使用
次のような認識の誤りによる使用エラー
●
記憶障害
○
以前取得した知識を思い出せない。
○
計画した段階を省略してしまう(例 忘れている。)。
●
ルールに基づく障害
○
一般に認められた適切な規則を誤って適用する。
○
過去に得た知識を思い出せない。
●
知識に基づく障害
○
異常な状況下で準備のないままに使用する。
○
欠陥のあるメンタルモデルによって情報を誤って解釈してしまう。
次のような行為の誤りによる使用エラー
●
制御装置に届かない(例 制御できない。)(例 部品が遠すぎる。)。
●
間違った部品と接触する(例 部品が近すぎる。)
●
部品に不適切な力をかける。
(例 必要な力が実際の使用条件に一致しない。)
●
制御装置が起動できない(例 作動しない。)。
(例 必要な力が意図するユーザの特性に一致しない。)
次のような認知の誤りによる使用エラー
●
視覚的情報の見落とし(例 見ることができない。)
(例 ディスプレイが部分的に覆われている,又はディスプレイ上で光
が反射している。)
●
聴覚的情報の聞き落とし(例 聞くことができない。)
(例 周囲騒音による,又は情報の詰め過ぎによるもの)
異常使用
●
例外的な違反(例 医療機器をハンマー代わりに使用する。)
●
無謀な使用(例 保護ガードを取り外して医療機器を使用する。)
●
妨害行為(例 ソフトウェア制御の医療機器へのハッキング)
●
禁忌の意識的無視(例 ペースメーカ植込み患者に使用する。)
38
T 62366-1:2019 (IEC 62366-1:2015)
附属書E
(参考)
基本要件との対応
(対応国際規格の規定を不採用とした。)
39
T 62366-1:2019 (IEC 62366-1:2015)
参考文献
[1] JIS T 0601-1:2017 医用電気機器−第1部:基礎安全及び基本性能に関する一般要求事項
注記 原国際規格では,IEC 60601-1:2005,Medical electrical equipment−Part 1: General requirements
for basic safety and essential performance及びAmendment 1:2012を記載している。
[2] IEC 60601-1-6:2010,Medical electrical equipment−Part 1-6: General requirements for basic safety and
essential performance−Collateral standard: Usability及びAmendment 1:2013
[3] JIS T 60601-1-8:2012 医用電気機器−第1-8部:基礎安全及び基本性能に関する一般要求事項−副通
則:医用電気機器及び医用電気システムのアラームシステムに関する一般要求事項,試験方法及び適
用指針
注記 原国際規格では,IEC 60601-1-8:2006,Medical electrical equipment−Part 1-8: General
requirements for basic safety and essential performance−Collateral standard: General requirements,
tests and guidance for alarm systems in medical electrical equipment and medical electrical systems
及びAmendment 1:2012を記載している。
[4] IEC 60601-1-11:2015,Medical electrical equipment−Part 1-11: General requirements for basic safety and
essential performance−Collateral standard: Requirements for medical electrical equipment and medical
electrical systems used in the home healthcare environment
[5] IEC TR 61258:2008,Guidelines for the development and use of medical electrical equipment educational
materials
[6] ISO/IEC Guide 63:2012,Guide to the development and inclusion of safety aspects in International Standards
for medical devices
[7] ISO 7010:2011,Graphical symbols−Safety colours and safety signs−Registered safety signs
注記 JIS Z 8210:2017 案内用図記号が,この国際規格に対応している。
[8] JIS Q 9000:2015 品質マネジメントシステム−基本及び用語
注記 原国際規格では,ISO 9000:2015,Quality management systems−Fundamentals and vocabularyを
記載している。
[9] JIS Q 9001:2015 品質マネジメントシステム−要求事項
注記 原国際規格では,ISO 9001:2015,Quality management systems−Requirementsを記載している。
[10] JIS Z 8521:1999 人間工学−視覚表示装置を用いるオフィス作業−使用性についての手引
注記 原国際規格では,ISO 9241-11:1998,Ergonomic requirements for office work with visual display
terminals (VDTs)−Part 11: Guidance on usabilityを記載している。
[11] JIS Q 13485:2018 医療機器−品質マネジメントシステム−規制目的のための要求事項
注記 原国際規格では,ISO 13485:2016,Medical devices−Quality management systems−Requirements
for regulatory purposesを記載している。
[12] (ISO/TR 16142は,附属書Eを不採用としたので削除した。)
[13] ANSI/AAMI HE 48:1993,Human factors engineering guidelines and preferred practices for the design of
medical devices
[14] ANSI/AAMI HE 74:2001,Human factors design process for medical devices
[15] ANSI/AAMI HE 75:2009,Human factors engineering−Design of medical devices
40
T 62366-1:2019 (IEC 62366-1:2015)
[16] EN 1041:2008,Information supplied by the manufacturer of medical devices及びAmendment 1:2013
[17] GHTF SG2N31R8:2003,Global Harmonization Task Force (GHTF), Study Group 2 (SG2), Medical Device
Post Market Vigilance and Surveillance: Proposal for Reporting of Use Errors with Medical Devices by their
Manufacturer or Authorized Representative
[18] BEYER, H., HOLTZBLATT, K., Contextual Design: defining customer-centred systems. Morgan Kaufmann
Publishers Inc, San Francisco CA, 1998
[19] BROWN, D. The challenges of user-based design in a medical device market. In D. Wixon and Ramey (Eds.),
Field Methods Casebook for Software Design. New York: Wiley, 1996, pp. 157-176.
[20] CALLAN, J. R., KELLY, R. T., QUINN, M. L., GWYNNE, J. W. III, MOORE, R. A., MUCKLER, F.A.,
KASUMOVIC, J., SAUNDERS, W.M., LEPAGE, R.P., CHIN, E., SCHOENFELD, I., and SERIG, D.I. (1995).
Human factors evaluation of remote afterloading brachytherapy. (NUREG/CR-6125, Volumes 1-3) Washington,
D. C.: U. S. Nuclear Regulatory Commission.
[21] COOKE, N. J. Varieties of knowledge elicitation techniques. Int'l J Human-Computer Studies. 1994:41, pp.
801-849
[22] DRURY, C. G., PRABHU, P., and GRAMOPADHYE, A. (). Task analysis of aircraft inspection activities:
Methods and findings. Proceedings of the Human Factors Society 34th Annual Meeting. Santa Monica, CA:
Human Factors and Ergonomics Society. 1990, pp. 1181-1185.
[23] DUMAS, J. and REDISH, J., A Practical Guide to Usability Testing (Revised Edition), Exeter, UK, Intellect,
1999.
[24] ELLIS, S. R., BEGAULT, D. R., and WENZEL, E. M.. Virtual environments as human-computer interfaces. In
M. G. Helander, T. K. Landauer, and P. V. PRABHU (Eds.), Handbook of human-computer interaction.
Amsterdam: Elsevier. 1997, pp. 163-201
[25] FLEISHMAN, E. A., and QUAINTANCE, M. K. Taxonomies of human performance: The description of
human tasks. Orlando: Academic Press, 1984
[26] GUNDRY JW, COMESS KA, Derook FA, JORGENSON D, BRADY GH. Comparison of naïve sixth-grade
children with trained professionals in the use of an automated external defibrillator. Circulation. 2000 Nov
14;102(20):E166.
[27] KIRWAN, B. and AINSWORTH, L. K. A Guide to Task Analysis. London, UK: Taylor & Francis, 1992.
[28] HOLTZBLATT, K., and JONES, S. Contextual inquiry: Principles and practice. In D. Schuler and A. Namioka
(Eds.), Participatory Design: Principles and Practice. Hillsdale, NJ: Erlbaum(1993).
[29] JONASSEN, D. L., HANNUM, W. H., and TESSMER, M. Handbook of Task Analysis Procedures. Westport:
Greenwood Publishing Group, 1989
[30] KLEIN, G. A., ORASANU, J., CALDERWOOD, R., and ZSAMBOK, C. E. Decision Making in Action:
Models and Methods. Norwood, New Jersey: Ablex Publishing Corp, 1993
[31] LAUGHERY, K. R. Sr., and LAUGHERY, K. R. Jr. Analytic techniques for function analysis. In G. Salvendy
(Ed.), Handbook of Human Factors. New York: Wiley, 1987, pp. 330-354.
[32] LOEB, R., WEINGER, M. B., and ENGLUND, C. E. Ergonomics of the anesthesia workspace. Ehrenwerth, J.
and Eisenkraft J. B., editors. Anesthesia Medical device: Principles and Applications. Mosby Year Book,
Malvern, PA. 1993 pp. 385-404.
[33] MEISTER, D. Behavioral Analysis and Measurement Methods. New York: John Wiley & Sons,1985.
41
T 62366-1:2019 (IEC 62366-1:2015)
[34] NIELSEN J, Usability Engineering. San Diego: Academic Press, Inc, 1993
[35] REASON, J. Human Error. Cambridge, England: Cambridge University Press, 1990.
[36] REDMILL, F. and RAJAN, J. Human Factors in Safety-Critical Systems. Oxford: Butterworth-Heinemann,
1997.
[37] ROUSE, W. B. Designing for human error: Concepts for error tolerant systems. In H. R. Booher (Ed.),
MANPRINT: An approach to system integration. New York: Van Nostrand Reinhold, 1990.
[38] RUBIN, J., Handbook of Usability Testing: How to Plan, Design, and Conduct Effective Tests, New York, NY,
Wiley, 1994.
[39] SCHULER, D. and NAMIOKA, A. Participatory Design: Principles and Practices. HILLSDALE, NJ: Lawrence
Erlbaum Associates, 1993
[40] SHARIT, J. Allocation of functions. In G. Salvendy (Ed.), Handbook of Human Factors and Ergonomics, 2nd
edition, New York: Wiley, 1997, pp. 301-339.
[41] SINCLAIR, M. A. Subjective assessment. In J. R. Wilson and E. N. Corlett (Eds.), Evaluation of human work.
London: Taylor & Francis. 1990, pp. 58-88.
[42] WIENER, E. L., and NAGEL, D. C. (Eds.) Human factors in aviation. San Diego: Academic Press 1988
[43] WEINGER, M. B., HERNDON, O. W., and GABA, D. M. The effect of electronic record keeping and
transesophageal echocardiography on task distribution, workload, and vigilance during cardiac anesthesia.
Anesthesiology 1997, 87:144-155.
[44] WEINGER, M., WIKLUND, M. and GARDNER-BONNEAU, D. A Handbook of Human Factors in Medical
Device Design, Boca Raton, FL, CRC Press, 2011
[45] WIKLUND, M., KENDLER, J., and STROCHLIC, Usability testing of Medical devices, Boca Raton, FL, CRC
Press, 2010
[46] ZHANG, J., PATEL, V. L., JOHNSON, T. R., CHUNG, P., and TURLEY, J. P. Evaluating and predicting patient
safety for medical devices with integral information technology. In Advances in Patient Safety (vol. 2),
Washington, DC: AHRQ. 2005, p. 323.

42
T 62366-1:2019 (IEC 62366-1:2015)
用語索引(五十音順)
五十
音順
定義した用語
規格番号・細別番号
あ
安全(SAFETY)
JIS T 14971:2012,2.24
い
異常使用(ABNORMAL USE)
3.1
意図する使用(意図する目的)(INTENDED USE/INTENDED PURPOSE)
JIS T 14971:2012,2.5
医療機器(MEDICAL DEVICE)
JIS T 14971:2012,2.9
か
開発過程が不明なユーザインタフェース,UOUP(USER INTERFACE OF
UNKNOWN PROVENANCE,UOUP)
3.15
患者(PATIENT)
3.10
き
危害(HARM)
JIS T 14971:2012,2.2
危険状態(HAZARDOUS SITUATION)
JIS T 14971:2012,2.4
客観的証拠(OBJECTIVE EVIDENCE)
JIS T 14971:2012,2.10
記録(RECORD)
JIS T 14971:2012,2.14
け
形成的評価(FORMATIVE EVALUATION)
3.7
検証(VERIFICATION)
JIS T 14971:2012,2.28
こ
効率(EFFICIENCY)
3.5
さ
残留リスク(RESIDUAL RISK)
JIS T 14971:2012,2.15
し
重大さ(SEVERITY)
JIS T 14971:2012,2.25
主要操作機能(PRIMARY OPERATING FUNCTION)
3.11
使用エラー(USE ERROR)
3.21
使用環境(USE ENVIRONMENT)
3.20
使用関連仕様(USE SPECIFICATION)
3.23
使用シナリオ(USE SCENARIO)
3.22
せ
製造業者(MANUFACTURER)
JIS T 14971:2012,2.8
製造後(POST-PRODUCTION)
JIS T 14971:2012,2.11
責任部門(RESPONSIBLE ORGANIZATION)
3.12
そ
総括的評価(SUMMATIVE EVALUATION)
3.13
た
体外診断用医療機器(IN VITRO DIAGNOSTIC MEDICAL DEVICE/IVD MEDICAL
DEVICE)
JIS T 14971:2012,2.6
タスク(TASK)
3.14
正しい使用(CORRECT USE)
3.3
つ
通常使用(NORMAL USE)
3.9
て
手順(PROCEDURE)
JIS T 14971:2012,2.12
と
トップマネジメント(TOP MANAGEMENT)
JIS T 14971:2012,2.26
は
ハザード(HAZARD)
JIS T 14971:2012,2.3
ハザード関連使用シナリオ(HAZARD-RELATED USE SCENARIO)
3.8
ひ
ヒューマンファクタエンジニアリング(HUMAN FACTORS ENGINEERING)
3.17
ふ
附属資料(ACCOMPANYING DOCUMENTATION)
3.2
プロセス(PROCESS)
JIS T 14971:2012,2.13
ゆ
有効性(EFFECTIVENESS)
3.4
ユーザ(USER)
3.24
ユーザインタフェース(USER INTERFACE)
3.26
ユーザインタフェース仕様(USER INTERFACE SPECIFICATION)
3.28
ユーザインタフェース評価(USER INTERFACE EVALUATION)
3.27
ユーザグループ(USER GROUP)
3.25
ユーザビリティ(USABILITY)
3.16
ユーザビリティエンジニアリング(USABILITY ENGINEERING)
3.17
ユーザビリティエンジニアリングファイル(USABILITY ENGINEERING FILE)
3.18

43
T 62366-1:2019 (IEC 62366-1:2015)
五十
音順
定義した用語
規格番号・細別番号
ゆ
ユーザビリティ試験(USABILITY TEST)
3.19
ユーザプロファイル(USER PROFILE)
3.29
よ
予測耐用期間(EXPECTED SERVICE LIFE)
3.6
ら
ライフサイクル(LIFE-CYCLE)
JIS T 14971:2012,2.7
り
リスク(RISK)
JIS T 14971:2012,2.16
リスクアセスメント(RISK ASSESSMENT)
JIS T 14971:2012,2.18
リスクコントロール(RISK CONTROL)
JIS T 14971:2012,2.19
リスク推定(RISK ESTIMATION)
JIS T 14971:2012,2.20
リスク評価(RISK EVALUATION)
JIS T 14971:2012,2.21
リスク分析(RISK ANALYSIS)
JIS T 14971:2012,2.17
リスクマネジメント(RISK MANAGEMENT)
JIS T 14971:2012,2.22
リスクマネジメントファイル(RISK MANAGEMENT FILE)
JIS T 14971:2012,2.23









