T 5111:2018 (ISO 16954:2015)
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義··················································································································· 2
4 処理方法························································································································· 3
5 試験水及び細菌チャレンジ懸濁液 ························································································ 3
5.1 試験水 ························································································································· 3
5.2 細菌チャレンジ懸濁液 ···································································································· 4
5.3 接種済試験水 ················································································································ 4
6 試験装置························································································································· 4
6.1 試験装置の設計 ············································································································· 5
6.2 試験装置の操作 ············································································································· 6
7 試験方法························································································································· 7
7.1 試験手順 ······················································································································ 7
7.2 バイオフィルムの防止又は抑制 ························································································ 7
7.3 バイオフィルム除去 ······································································································· 8
8 微生物学的サンプリング及び試験 ······················································································· 10
8.1 処置水の細菌レベルの計数 ····························································································· 10
8.2 水管路表面のバイオフィルム ·························································································· 11
9 試験報告書····················································································································· 12
参考文献 ···························································································································· 13
T 5111:2018 (ISO 16954:2015)
(2)
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,日本歯科器械工業協同組合(JDMMA)及び
一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があ
り,日本工業標準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本工業規格 JIS
T 5111:2018
(ISO 16954:2015)
歯科−歯科用ユニット給水管路内バイオフィルム
処理の試験方法
Dentistry-Test methods for dental unit waterline biofilm treatment
序文
この規格は,2015年に第1版として発行されたISO 16954を基に,技術的内容及び構成を変更すること
なく作成した日本工業規格である。
なお,この規格で点線の下線を施してある参考事項は,対応国際規格にはない事項である。
1
適用範囲
この規格は,実験室条件下で歯科用ユニット処置水供給システムにおけるバイオフィルムの形成を防止
する若しくは抑制する,又は除去するための処理方法の有効性を評価する形式試験の方法を規定する。
この規格は,滅菌処置水又は滅菌溶液を供給することを意図した機構には適用しない。さらに,歯科用
ユニット内での圧縮空気を送る管路(チューブ又はホース)にも適用しない。
この規格は,細菌汚染に関する要求事項を規定せず,また,臨床環境下で実施する試験方法を規定しな
い。処理方法によって起こり得る有害な副作用を評価する試験方法も規定しない。
この規格で規定する試験方法は,口くう(腔)に非滅菌水を供給する他の歯科用器械に適用することが
できる。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 16954:2015,Dentistry−Test methods for dental unit waterline biofilm treatment(IDT)
なお,対応の程度を表す記号“IDT”は,ISO/IEC Guide 21-1に基づき,“一致している”こ
とを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0601-1 医用電気機器−第1部:基礎安全及び基本性能に関する一般要求事項
注記 対応国際規格:IEC 60601-1,Medical electrical equipment−Part 1:General requirements for basic
safety and essential performance
JIS T 5701 歯科用ユニット−一般要求事項及び試験方法
注記 対応国際規格:ISO 7494-1,Dentistry−Dental units−Part 1: General requirements and test methods
JIS T 5702 歯科−歯科用ユニット−エアー,水,吸引及び廃水のシステム
注記 対応国際規格:ISO 7494-2,Dentistry−Dental units−Part 2: Air, water, suction and wastewater
2
T 5111:2018 (ISO 16954:2015)
systems
ISO 1942,Dentistry−Vocabulary
ISO 3696:1987,Water for analytical laboratory use−Specification and test methods
ISO 10523,Water quality−Determination of pH
ISO 19458,Water quality−Sampling for microbiological analysis
3
用語及び定義
この規格で使用する主な用語及び定義は,JIS T 0601-1,JIS T 5701,JIS T 5702及びISO 1942によるほ
か,次による。
3.1
バイオフィルム(biofilm)
表面に付着して自己成長した細胞外生体高分子基質に存在する微生物の構造的共同体。
3.2
歯科用ユニット(dental unit)
歯科診療に使用するための機能アセンブリを構成する,相互接続された歯科用器械及び歯科器具を組み
合わせた装置。
ISO 1942:2009の2.86参照。
3.3
歯科用ユニット処置水供給システム(dental unit procedural water delivery system)
歯科用ユニットの構成要素で,歯科診療に使用するための処置水を供給源から1か所以上の出口に給水
する歯科用ユニット構成システム。
3.4
処置水(procedural water)
歯科用ユニットから供給する,口くう内で使用するための水。
例 ハンドピース冷却水,多機能ハンドピース(シリンジ)水,スケーラ冷却水又は口くう内すすぎ
水。
JIS T 5702:2018の3.18参照。
注記 対応国際規格では,ISO 7494-2:2003(対応JISは,JIS T 5702:2009)の3.1を引用しているが,
ISO 7494-2:2015に対応した最新版JISであるJIS T 5702:2018を出典とした。
3.5
模擬歯科用ユニット給水システム(surrogate dental unit water system)
水管路の要素である設計,構造,組合せ及び操作の全てを含む歯科用ユニットの処置水供給システムを
正確に再現した試験装置。ただし,処置水と接触しない又は処置水を制御しない歯科用ユニットの部品を
必ずしも含むものではない。
3.6
試験水(test water)
特定の細菌チャレンジ懸濁液を加える前の,特定の化学的,物理的特性をもつ水。
3.7
細菌チャレンジ懸濁液(bacterial challenge suspension)
試験水への接種のために使用する,栄養増殖培地又は緩衝液に懸濁した特定の細菌共同体。
3
T 5111:2018 (ISO 16954:2015)
3.8
接種済試験水(inoculated test water)
試験で使用する水性懸濁液で,一定の量の滅菌済試験水と1種以上の細菌チャレンジ懸濁液とを含んだ
試験水。
3.9
対照群の試験装置(test apparatus for the control group)
水管路への処理が施されておらず,また,抗菌材料が水管路の構成要素ではない試験装置。
3.10
試験群の試験装置(test apparatus for the test group)
試験の要求事項でほかに定めがない限り,歯科用ユニットの製造業者が指定した処理を水管路に施し,
かつ,製造業者が指定した抗菌材料が水管路の構成要素となる試験装置。
4
処理方法
処理方法における固有の技術的アプローチと意図する効能とによって,歯科用ユニット処置水供給シス
テムの処理方法の性能目標は,次のいずれか又は両方を含むことができる。
− 歯科用ユニット処置水供給システム内表面上のバイオフィルム形成の防止又は抑制
− 歯科用ユニット処置水供給システム内表面上のバイオフィルムの除去
この規格は,上記の各々の性能目標に基づいた試験方法を規定する。これらの要求事項は,例えば,追
加の再現試験及び試験計画へと展開することができる。試験方法への追加は,この規格の一般原則によっ
て,試験報告に詳しく記載しなければならない。
5
試験水及び細菌チャレンジ懸濁液
5.1
試験水
この細分箇条では,接種前の試験水の調製について規定する。
5.1.1
試薬
5.1.1.1
水は,ISO 3696:1987のグレード3に従う。
5.1.1.2
塩化カルシウム(CaCl2)又は同等モル量の塩化カルシウム水和物
5.1.1.3
塩化マグネシウム(MgCl2)又は同等モル量の塩化マグネシウム水和物
5.1.1.4
重炭酸ナトリウム(NaHCO3)
5.1.1.5
トリプチックソイブロス(TSB培地)は,1/3力価,すなわち,1 L当たり10.0 g
5.1.1.6
水酸化ナトリウム(NaOH)は,1 mol/L
5.1.1.7
塩酸(HCl)は,1 mol/L
5.1.2
硬度原液1の調製
塩化カルシウム(5.1.1.2)74.0 g及び塩化マグネシウム(5.1.1.3)31.7 gを,1.00 Lの水(5.1.1.1)に溶
解する。硬度原液1は,加熱滅菌又は0.2 µmマイクロフィルタを使用してろ過によって滅菌し,24時間
以内に使用するか又は(5±3)℃で保管し,その保管期間を最大6か月間としなければならない。
5.1.3
硬度原液2の調製
重炭酸ナトリウム(5.1.1.4)56.0 gを1.00 Lの水(5.1.1.1)に溶解する。硬度原液2は,0.2 μmマイクロ
フィルタを使用して滅菌し,24時間以内に使用するか又は(5±3)℃で保管し,その保管期間を最大6か
月間としなければならない。硬度原液2は,加熱滅菌しない。
4
T 5111:2018 (ISO 16954:2015)
5.1.4
接種前試験水の調製
1 Lごとの試験水として,1/3力価TSB(5.1.1.5)1.00 mL及び硬度原液1(5.1.2)1.80 mLを水1.00 L(5.1.1.1)
に加え,蒸気滅菌し,調製する。滅菌済溶液を冷却後,1 Lごとの試験水に0.2 μmマイクロフィルタを使
用して滅菌した硬度原液2を4.00 mL加え,調製する。水酸化ナトリウム(5.1.1.6)又は塩酸(5.1.1.7)を
加え,ISO 10523によってpHを測定し,pHを7.0〜8.0に調製する。試験水は,24時間以内に使用するか
又は(5±3)℃で保管し,その保管期間を最大1週間としなければならない。
注記1 調製済試験水の硬度は,カルシウムイオン濃度約1.8 mmol/L[CaCO3(炭酸カルシウム)約
180 mg/Lと同等]とする。この値は,硬水の一般的な許容範囲の上限に相当する [17]。
注記2 試験水の濃度は,TSB約10 mg/Lとし,全有機炭素(TOC)レベルは,約4 mg/Lとするが,
正確なTOCレベルは若干変動する。このTOC近似レベルは,塩素処理飲料水中のTOC推奨
上限値4 mg/Lと一致し [1],バイオフィルム形成時間を短縮する。
5.2
細菌チャレンジ懸濁液
試験水を接種するために使用する細菌チャレンジ懸濁液は,米国培養細胞系統保存機関(ATCC)又は
国際的に認可されたATCCの代理店から入手した次の菌を準備しなければならない。
a) Pseudomonas aeruginosa[ATCC番号700888,緑のう(膿)菌]
b) Klebsiella pneumoniae[ATCC番号13882,肺炎かん(桿)菌]
指定された菌株が入手不可能な場合,Pseudomonas aeruginosa[緑のう(膿)菌]及びKlebsiella pneumoniae
[肺炎かん(桿)菌]の代替株(すなわち,ATCC番号は異なるが同じ菌種)として,ATCCが指定した
分離源が水又は水系のものを使用することができる。
細菌種は,トリプチックソイブロス(TSB培地)で,濃度が0.3 g/Lになるように滅菌済TSBにて希釈
してそれぞれ再構成し,再構成した培養系は,8継代培養以内のものを使用しなければならない。接種済
試験水による細菌の繁殖は,5.3に従い,接触済試験水の準備よりも1日前に実施しなければならない。
上記の細菌を使用して作業する場合,及びこれらによって汚染されてもよい廃棄物を取り扱う場合は,
実験室の適切な安全性の実施要項の遵守は,大変重要である。
5.3
接種済試験水
接種済試験水は,試験期間中に滅菌済試験水(5.1)を再構成した細菌培養系(5.2)で接種し,6.2.2に
規定された作業フロー開始前の2時間以内に調製しなければならない。接種済試験水の各細菌濃度は,5
×101 CFU/mL〜5×102 CFU/mL,全細菌濃度は,102 CFU/mL〜103 CFU/mLにする。接種時の滅菌済み試験
水の温度は,(23±3)℃としなければならない。
接種済試験水中の各細菌濃度を確保するために,各再構成済細菌培養を遠心分離機にかけ,滅菌済りん
酸緩衝生理食塩水中に再分散させ,濁度測定によって,その推定細菌濃度を決定するのが実用的である。
この結果を使用すれば,試験水に添加する細菌懸濁液単一種の量を計測できる。また,濃度範囲を特定す
るための他の方法も使用可能である。
6
試験装置
試験装置は,歯科用ユニット一式又は歯科用ユニット給水システムを再現した模擬歯科用ユニット給水
システムで構成しなければならない。
処置水に接触する試験装置の全ての部品は,結果を再現することができるように,バイオフィルムの防
止試験若しくは抑制試験(7.2),又はバイオフィルムの防止試験若しくは抑制試験(7.2)とバイオフィル
ム除去(7.3)との連続試験ごとに新しいものを使用しなければならない。
5
T 5111:2018 (ISO 16954:2015)
注記 バイオフィルム除去(7.3)の試験手順は,7.3.1で示すように,バイオフィルムの防止試験又は
抑制試験(7.2)に使用した試験装置で最初のバイオフィルムを形成した後に実施する。
6.1
試験装置の設計
6.1.1
一般
歯科用ユニット一式の試験装置の場合は,最もバイオフィルムが形成しやすいと想定されるユニット(以
下,不利なモデルという。)又は構成(2種以上のモデル又は構成を製造業者から入手できる場合)を決定
する上で,要素として水管路の長さ,分岐数及び滞留の可能性を考慮しなければならない。
模擬歯科用ユニット給水システムの試験装置の場合は,6.2で示す内容を含んだ歯科用ユニット給水シス
テムの基本的な性能及び機能を模擬可能とする。模擬歯科用ユニット給水システムは,模擬しようとする
歯科用ユニットの最も不利なモデル又は構成(2種以上のモデル又は構成を製造業者から入手できる場合)
を模擬するものとする。
模擬歯科用ユニット給水システムは,設計,構造,構成及び処置水供給システムの水管路の操作を含ん
だ処置水供給システムを正確に再現しなければならない。処置水と直接接触しない,又は処置水を制御し
ないその他の構成品(例えば,構造的,装飾的部品など)を含む必要はない。模擬歯科用ユニット給水シ
ステムの構成品は,再現しようとしている歯科用ユニットの構成品と同じ環境条件(すなわち,照明及び
温度)でなければならない。
模擬歯科用給水システムは,処置水と流入水とを分離するため,JIS T 5702の逆流防止に関する要求事
項に適合するエアギャップシステム又は他の逆流防止機構を,試験装置に使用しなければならない。
模擬歯科用ユニット給水システムで再現する必要のある重要な要素は,次による。
− 水管路の構成(構成品の位置,分岐点の配置,滞留箇所など)
− 配管径
− 配管長
− 配管の材質
− 処置水に接触する,又は流れを制御する構成品(制御ブロック,バルブ,接合部品など)
− 水処理機構(フィルタ,自動又は受動処理システム)の位置
歯科用ユニット又は模擬歯科用ユニット給水システムは,歯科用ハンドピースに通常使用で処置水を供
給するホースを1本,及び多機能(空気又は水)シリンジに通常使用で処置水を供給するホースを最低限
1本含まなければならない。歯科用ユニットに取り付けているその他の器具に通常使用で処置水を供給す
るホースは,歯科用ユニット又は模擬歯科用ユニット給水システムに含むことができる。通常,患者ごと
に滅菌するために歯科用ユニットから取り外すことが可能な歯科用ハンドピース,歯科用器具又はその附
属品は,ホースから取り外して,この試験には使用しない。
例 JIS T 5912:2015の,図A.1のcの接続部
スピットンボウル用洗浄管路は,歯科用ユニットから分離するか,又は模擬歯科用ユニット給水システ
ムからは取り外さなければならない。スピットンボウルのコップ給水管路は,歯科用ユニット又は模擬歯
科用ユニット給水システムに含むことができる。
注記 バイオフィルムの除去,予防及び抑制の点から,他の水管路の方がより厳しい試験環境を形成
するとの推察に基づき,スピットンボウルの水管路は,除外可能である。
6.1.2
抗菌材及び細菌付着防止材特有の配慮
試験を実施する歯科用ユニット又は模擬歯科用ユニット給水システムが,処置水と接触する部分におい
て抗菌性をもった材料又は細菌付着防止材を使用する場合は,次の構造変更を試験装置に施さなければな
6
T 5111:2018 (ISO 16954:2015)
らない。
バイオフィルム形成の防止又は抑制評価用の試験装置は,次による。
− 対照群の試験装置:対照群の歯科用ユニット又は模擬歯科用ユニット給水システムの水管路に使用す
る構成品は,抗菌効果又は細菌付着防止効果のない同一基材に交換する。
− 試験群の試験装置:試験群の歯科用ユニット又は模擬歯科用ユニット給水システムの水管路に使用す
る構成品は,(該当する場合)抗菌材又は細菌付着防止材を含むものとする。
バイオフィルム除去評価用試験装置は,次による。
− 試験群の試験装置:試験群の歯科用ユニット又は模擬歯科用ユニット給水システムの水管路に使用す
る構成品は,抗菌効果又は細菌付着防止効果のない同一基材に交換する。これは,バイオフィルムの
除去能力を評価する上で不可欠である。
注記1 バイオフィルム形成の防止又は抑制試験に使用した対照群の試験装置は,この試験の試験群
として使用することが可能である。
注記2 バイオフィルム形成の防止又は抑制効果を評価する必要がない場合は,抗菌効果又は細菌付
着防止効果のない同一基材に交換することを必要としないが,バイオフィルム生成過程が必
要である。
6.2
試験装置の操作
6.2.1
流量
ハンドピース処置水の流量は,(30±3)mL/minに,多機能シリンジの水の流量は,(60±6)mL/minに
調整しなければならない。
試験装置に処置水管路から供給する水を使用する器具又は機器を含む場合,これらの流量を製造業者の
推奨に従って調整しなければならない。
全ての流量は,試験前に設定し,試験期間中,週に一度確認し,必要であれば調整しなければならない。
6.2.2
流れのパターン(オンオフサイクル)
試験装置水管路は,週に5日間連続で運転し,2日間連続で休止しなければならない。運転期間中は,
接種済試験水を5.3によって,新たに調製し,試験装置内水管路の水の流れは,次のプログラムに従い,
30サイクルによってなる日々の自動プログラムで制御しなければならない。
− ハンドピース処置水は,1サイクル当たり30秒間運転しなければならない。二つ以上のハンドピース
処置水給水管路がある場合,各サイクル中は一つの処置水管路だけを運転し,選択したハンドピース
処置水管路は,1日のフロープログラムを通してほぼ均等に運転するように,サイクルごとに順次入
れ替える。
− シリンジ水は,サイクルごとに30秒間運転しなければならない。二つ以上のシリンジがある場合は,
各サイクル中は1本のシリンジだけを運転し,選択したシリンジは,1日のフロープログラムを通し
てほぼ等しく運転するように,サイクルごとに順次入れ替える。
− サイクルごとに,9分間の水が流れない時間を設ける。
試験装置にその他のハンドピース及びシリンジが含まれる場合は,それぞれの目的とする臨床使用に見
合った方法で,1日のフロープログラムにその操作を含めなければならない。
6.2.3
試験の環境温度及び準備期間
環境温度は,(23±3)℃を維持し,全ての装置は,試験開始の少なくとも24時間前にこの温度範囲内に
て調整しなければならない。
7
T 5111:2018 (ISO 16954:2015)
7
試験方法
7.1
試験手順
試験は,次の手順による。
a) バイオフィルムの防止又は抑制の評価試験は,7.2による。
b) バイオフィルムの除去の評価試験は,7.3による。
注記 7.2の完了時に形成したバイオフィルム付き対照群の試験装置を,7.3において試験群の試験装
置として使用するこの手順によって,試験装置数及び試験工数を減らしている。
7.2
バイオフィルムの防止又は抑制
7.2.1
一般
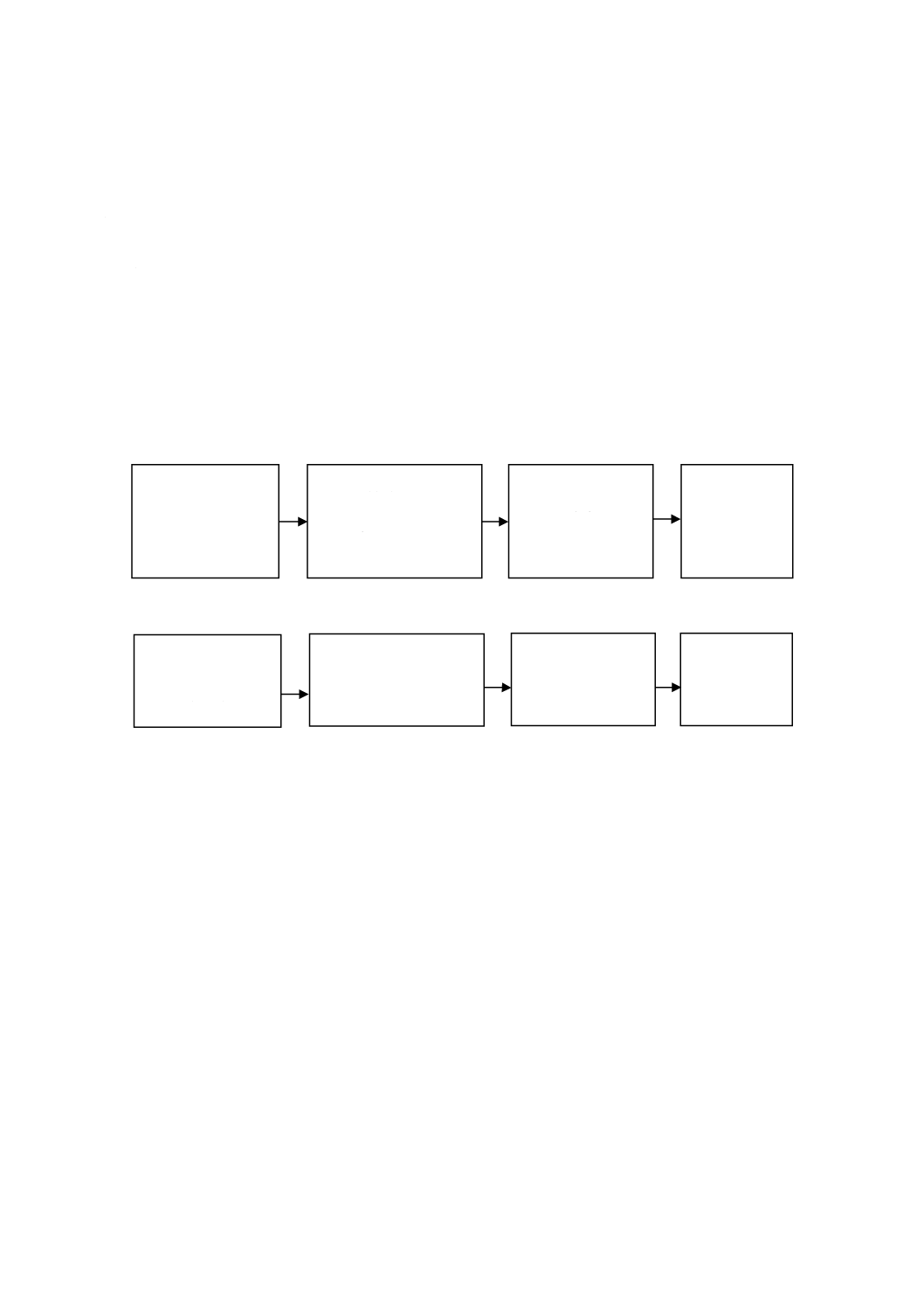
図1に,歯科用水管路内でのバイオフィルム形成を防止又は抑制することを意図した処理方法を評価す
る試験方法の手順を示す。
図1−バイオフィルム防止又は抑制の評価試験のフロー図
バイオフィルムの形成には固有の変動があるため,試験は,異なる歯科用ユニット又は模擬歯科用ユニ
ット給水システムで再現させなければならない。バイオフィルムの防止及び抑制の試験には,少なくとも
2台の歯科用ユニット又は模擬歯科用ユニット給水システムを,試験群,対照群それぞれに含まなければ
ならない。
7.2.2
試験装置の前処理
試験装置は,歯科用ユニットの製造業者の指示によって,試験前に前処理を実施しなければならない。
例 歯科用ユニットの設置後に使用開始前の消毒処置を製造業者が指定する場合は,この試験前に消
毒処置を実施する。
7.2.3
接種済試験水への同時暴露及びバイオフィルムの防止又は抑制のための処理
試験群には,5.3で指定した接種済試験水を供給するとともに,製造業者の指示に沿った処理方法を歯科
ユニット又は模擬歯科用ユニット給水システムに実施しなければならない。対照群には,接種済試験水を
歯科用ユニット又は模擬歯科用ユニット給水システムに供給しなければならないが,処理は実施しない。
全ての歯科用ユニット又は模擬歯科用ユニット給水システムは,6.2に従い,操作し,接種済試験水は,
自動化された1日のフロープログラムが始まる2時間前以内に準備しなければならない。試験装置に供給
する接種済試験水の微生物学的サンプリング及び試験は,8.1によって,少なくとも週1回,試験装置へ
製造業者の指示によ
る試験装置の前処理
(7.2.2)
接種済試験水への同時
暴露及び
バイオフィルム防止又は
抑制の処理
(7.2.3)
微生物学的
サンプリング及び
試験
(7.2.4)
結果の分析
(7.2.6)
製造業者の指示によ
る試験装置の前処理
(7.2.2)
接種済試験水への
暴露
(7.2.3)
微生物学的
サンプリング及び
試験
(7.2.4)
結果の分析
(7.2.6)
試験群
対照群
8
T 5111:2018 (ISO 16954:2015)
の供給前に実施しなければならない。
7.2.4
微生物学的サンプリング及び試験
試験群及び対照群両方の歯科用ユニット又は模擬歯科用ユニット給水システムでの微生物学的サンプリ
ングと試験とは,処理方法の効果を判断するために,8.1及び8.2によって実施しなければならない。8.1
による総生菌数カウントのサンプリング及び試験は,全ての歯科用ユニット又は模擬歯科用ユニット給水
システムにおいて,試験期間中に少なくとも週に一度実施しなければならない。微生物学的試験のための
サンプルを収集するときには,試験装置の全ての水管路を浄化するための十分な量の滅菌済試験水(接種
なし)を試験装置に供給し,サンプリングの前に5分間,水管路内に滞留させなければならない。8.2に
よる給水チューブのサンプリング及びバイオフィルム形成の特徴付けは,少なくとも一度,全ての歯科用
ユニット又は模擬歯科用ユニット給水システムにおいて,試験の最後に実施しなければならない。
7.2.5
試験期間
試験は,次の基準を満たすまで,7.2.3及び7.2.4によって継続しなければならない。
− 最低4週間,試験を実施する。
− 接種済試験水の代わりに滅菌済試験水を一時的に供給し,サンプリング前に5分間水管路内に滅菌済
試験水を滞留させた後に接種済試験水を使用して通常の試験方法を再開したときの,対照群の全ての
試験装置の処置排水で,総生菌数カウントが104 CFU/mL以上存在する。
− バイオフィルムの存在が,対照群の全ての歯科用ユニット又は模擬歯科用ユニット給水システムのチ
ューブサンプル数に,8.2による“相当量密集した微生物及び/又はバイオフィルムが存在する。”と
いう分類で確認できる。
上記基準を満たした後に,速やかに7.3に従い,バイオフィルム除去の評価試験を実施しなければなら
ない。この細分箇条に規定した,対照群の接種済試験水への暴露を行う日常手順は,7.3に従った試験を
実施するまで継続しなければならない。
7.2.6
結果の分析
バイオフィルムの防止又は抑制する処理方法の効果は,次の項目を報告し,特徴付けを実施しなければ
ならない。
− 8.1に従った,試験期間の週単位ごとの試験群及び対照群における処置水中の総生菌数カウントの対数
値(平均,標準偏差及び反復数)
− 試験期間中の,水管路出口の種類ごとの試験群及び対照群の総生菌数カウントの平均対数値の差
− 試験期間の最後に試験群及び対照群の総生菌数カウントの結果を対数変換し,有意確率P<0.05を使
用した両側検定の統計分析を実施して比較した結果
− 試験期間の最後に実施する8.2に従った試験群及び対照群でサンプル収集した各水管路のバイオフィ
ルム被覆率の比較
7.3
バイオフィルム除去
7.3.1
一般
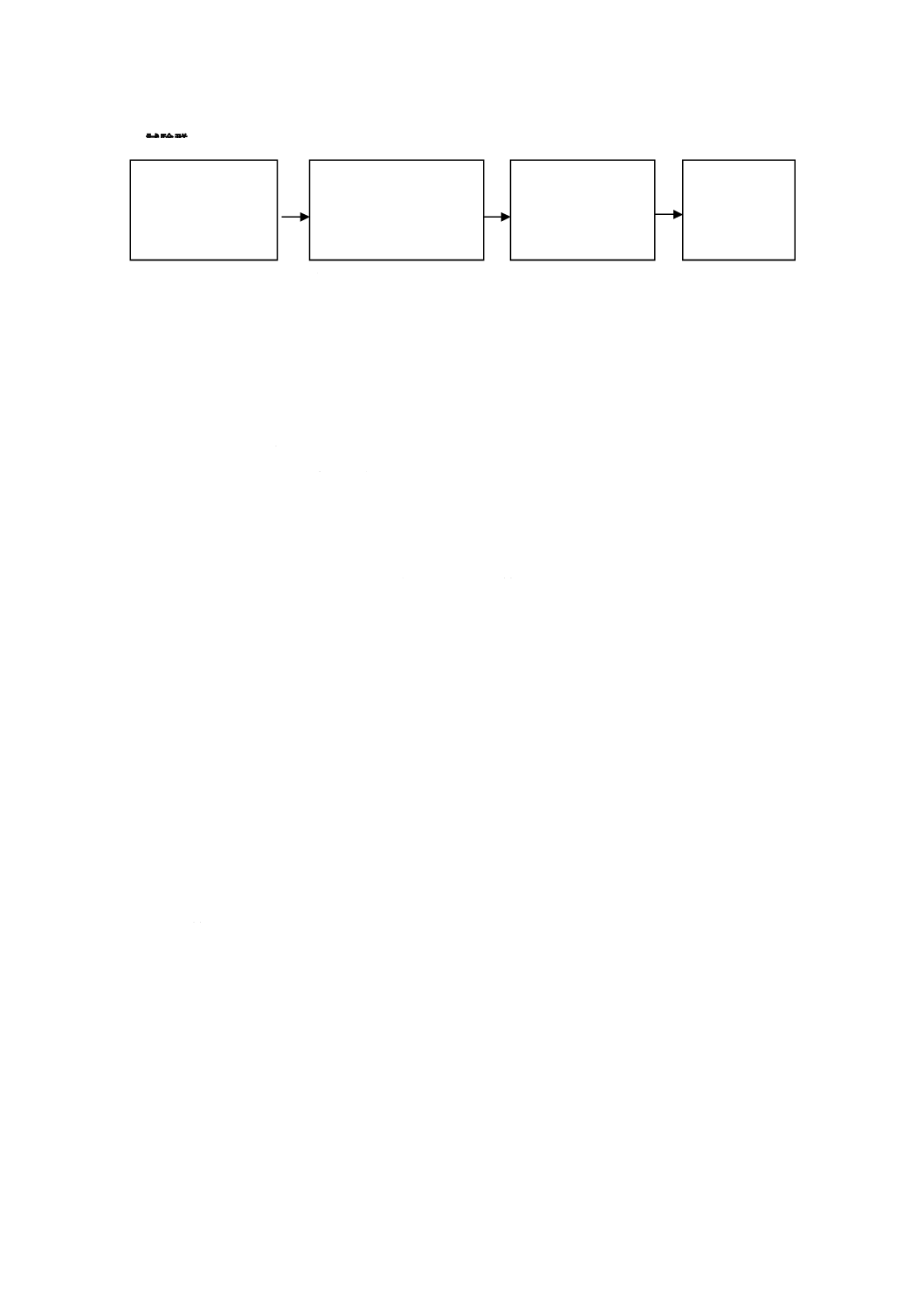
図2に,歯科用水管路内でのバイオフィルムの除去を意図した処理方法を評価する試験方法の手順を示
す。
9
T 5111:2018 (ISO 16954:2015)
図2−バイオフィルム除去を評価する試験方法のフロー図
バイオフィルム除去試験には,少なくとも2台の歯科用ユニット又は模擬歯科用ユニット給水システム
を試験群に含まなければならない。対照群として,歯科用ユニット又は模擬歯科用ユニット給水システム
は不要である。試験群の装置は,7.2の対照群の装置から構成され,7.2完了時に形成されたバイオフィル
ムを含むものでなければならない。
注記 この試験では,バイオフィルムを形成した試験群を使用し,バイオフィルム除去処理の前後の
比較評価を実施するため,対照群は不要である。
7.3.2
初回の微生物学的サンプリング及び試験
全ての歯科用ユニット又は模擬歯科用ユニット給水システムの微生物学的サンプリング及び試験は,8.1
によって,バイオフィルム除去の処理を実施直前に実施しなければならない。微生物学的試験のためのサ
ンプルを収集するときには,試験装置の全ての水管路を浄化するための十分な量の滅菌済試験水(接種な
し)を試験装置に供給し,サンプリングの前に5分間,水管路内で滞留させなければならない。
バイオフィルム除去の処理方法の実施直前に,全ての歯科用ユニット又は模擬歯科用ユニット給水シス
テムの給水チューブの一部をサンプルとして収集し,8.2によってバイオフィルムの特徴付けを実施しな
ければならない。
7.3.3
バイオフィルム除去の処理方法の実施
形成したバイオフィルムの除去の処理方法は,歯科用ユニット又は水管路処置製品の製造業者の指示に
よって実施し,処理方法の準備,実施において水が必要な場合は,接種済試験水を使用しなければならな
い。
7.3.4
最終微生物学的サンプリング及び試験
処理方法の有効性を判断するためには,全ての歯科用ユニット又は模擬歯科用ユニット給水システムの
微生物学的サンプリング及び試験を,8.1及び8.2によって,バイオフィルム除去の処理方法の実施後に実
施しなければならない。8.1によって総生菌数カウントのためのサンプルを収集するときには,試験装置
の全ての水管路を浄化するための十分な滅菌済試験水(接種なし)を試験装置に供給し,サンプリング前
に5分間,水管路内で滞留させなければならない。
バイオフィルム除去の処理方法を実施後,全ての歯科用ユニット又は模擬歯科用ユニット給水システム
の給水チューブの一部をサンプルとして収集し,8.2によってバイオフィルムの特徴付けを実施しなけれ
ばならない。
8.1及び8.2によって,処理を実施した後のサンプル収集の最も適切な時間に関する考察を実施しなけれ
ばならない。処置水又は別の溶液によるフラッシングが製造業者によって指示されている場合は,サンプ
リング及び試験の前にフラッシングを実施しなければならない。
7.3.5
結果の分析
バイオフィルム除去の処理方法の有効性は,次の項目を報告し,特徴付けを実施しなければならない。
− 8.1に従った,バイオフィルム除去の処理方法の実施前後の試験群及び対照群における処置水中の総生
初回の微生物学的
サンプリング及び
試験
(7.3.2)
接種済試験水を用いた
バイオフィルム除去の
処理の実施
(7.3.3)
最終微生物学的
サンプリング及び
試験
(7.3.4)
結果の分析
(7.3.5)
試験群
10
T 5111:2018 (ISO 16954:2015)
菌数カウントの対数値(平均,標準偏差及び反復数)
− 処置水中の総生菌数カウントの対数値の低下(すなわち,処理の実施前後の平均値の相違)
− 処理方法の実施前後で試験群及び対照群の総生菌数カウントの結果を対数変換し,有意確率P<0.05
を使用した両側検定の統計分析を実施して比較した結果
− 8.2に従ったバイオフィルム除去の処理方法の前後でサンプル収集した各水管路のバイオフィルム被
覆率の比較
8
微生物学的サンプリング及び試験
8.1
処置水の細菌レベルの計数
8.1.1
サンプリング
8.1.1.1
一般
サンプリングは,ISO 19458のガイダンスによる。計量は,サンプル収集後24時間以内に開始し,収集
したサンプルは,カウントがサンプリング時間から30分以内に開始できない場合,(4±2)℃環境下で保
管しなければならない。
全ての試験サンプルは,残留抗菌薬を含む場合,それを不活性化させるために速やかに処理しなければ
ならない。可能な方法として,中和剤の投与又は試験サンプルを0.2 μmの膜でろ過した後に,滅菌済りん
酸緩衝生理食塩水で洗浄する方法などがある。中和剤を使用する場合,その有効性及び菌との適合性を中
和試験で確認し,対照群及び試験群のサンプルは,同じように取り扱わなければならない。
8.1.1.2
試験装置に供給する水のサンプリング
指定したサンプリングの場合,試験装置に供給した接種済試験水の1サンプルに付き50 mL以上収集し,
分析しなければならない。
8.1.1.3
試験装置から排出する水のサンプリング
指定したサンプリングの場合,一つの複合試料の処置水が,その総量50 mL〜100 mLとなるよう,異な
った水の出口から,各々がほぼ同量になるように,他の菌の浸入に注意し,各歯科用ユニット又は模擬歯
科用ユニット給水システムから収集しなければならない。各歯科用ユニット又は模擬歯科用ユニット給水
システムの各水出口から個別のサンプルを回収し,個別に分析することができる。
8.1.2
総生菌数カウント試験法
総生菌数カウントは,平板培養法によって実施しなければならない [12]。
100(すなわち,未希釈)から10−3(滅菌済りん酸緩衝生理食塩水にて)の10倍連続希釈液の試験サン
プル各3セットを準備しなければならない。結果が特定の範囲に該当すると予想される場合,3セットの
準備では希釈液が少ない場合がある。
1.0 mL又は0.10 mLの各希釈液をR2A寒天に移し,倒置又は培養前にサンプルが培地に十分吸収するた
めの時間を与えて,(23±3)℃の環境温度で7日間好気的に培養しなければならない。
培養後は,コロニー数を数え,CFU/mL単位で報告し,各セットサンプルの総生菌数カウントの対数値
(すなわち,総生菌数カウントの常用対数)の平均及び標準偏差を報告しなければならない。
8.1.3
代替総生菌数カウント試験法
浮遊性細菌レベルは,代替的にメンブレンフィルタ法によってカウント計量することができる [12]。例え
ば,サンプル中の残存抗菌材を不活性化する実用的な方法が知られていない場合又は使用できない場合,
この方法は適切である。
100(すなわち,未希釈)から少なくとも10−4(滅菌済りん酸緩衝生理食塩水にて)の10倍連続希釈液
11
T 5111:2018 (ISO 16954:2015)
の試験サンプル各3セットを準備し,10 mLごとの希釈液の試験を実施しなければならない。結果が特定
の範囲に該当すると予想される場合,3セットの準備では希釈液が少ない場合がある。
サンプルのメンブレンフィルタ後又は希釈液サンプルは,抗菌材がサンプル内にある場合は,ろ過液と
膜とを10 mL分量の滅菌済りん酸緩衝生理食塩水で2回ろ過して洗浄しなければならない。膜は,気泡が
膜と培地との間に残留しないよう,R2A寒天に移し,(23±2)℃の環境温度で7日間好気的に培養しなけ
ればならない。
培養後,コロニー数を計量し,CFU/mL単位で報告し,各セットサンプルの総生菌数カウントの対数値
の平均及び標準偏差を報告しなければならない。
8.2
水管路表面のバイオフィルム
8.2.1
サンプリング
指定されたサンプリングの場合,少なくとも1 cmの水管路チューブのサンプルを,各々の水管路出口近
くで,他の菌が混入しないよう切り取られなければならない。適切な場合,試験装置に残ったチューブは,
滅菌した接続部品を使用して試験が再開できるように再接続しなければならない。
切断したチューブサンプルは,固定後の脱水前(8.2.2参照)に,縦方向にほぼ均等に二つに切断しなけ
ればならない。サンプルを縦方向に分割する場合,チューブ表面からバイオフィルムの剝がれを低減する
ため,切断方向はチューブ軸に平行としなければならない。
8.2.2
バイオフィルムの評価の試験手順
走査電子顕微鏡(SEM)法を使用して,各チューブサンプルの両半分の表面上のバイオフィルム被覆率
を評価し,チューブサンプルの表面上のバイオフィルムのSEM分析において,SEM分析用に適切な方法
で,固定,脱水,乾燥,取付け及び伝導性材料を使用したスパッタコーティングでサンプルを調製しなけ
ればならない。
例 SEM用サンプルの調製ステップの方法例を,次に示す。
− 2 %のグルタルアルデヒドを添加した0.1 mol/Lのカコジル酸ナトリウム緩衝溶液中に,チュ
ーブサンプルを室温で30分から4時間固定し,その後グルタルアルデヒド未添加カコジル酸
ナトリウム緩衝溶液で3回,洗浄する。
− エチルアルコールの濃度を30 %,50 %,70 %,90 %,95 %及び100 %へ増加し,各エチルア
ルコール水溶液でチューブサンプルを10分間,脱水する。
− チューブサンプルを臨界乾燥する。
− 両面伝導性テープを使用して,SEMスタブにチューブサンプルを取り付ける。
− 金パラジウムでチューブサンプルにスパッタコーティングを実施する。
チューブサンプルの表面上に特定の細菌が存在する場合,SEM装置及び操作パラメータの選択によって,
試験水接種用の細菌を特定するための画像を作成することができるようにしなければならない。
環境制御型SEM(ESEM)では,分析前に固定,脱水,乾燥,及びスパッタコーティングを実施せずに
使用することができる。
チューブサンプルは,1 000倍未満でスキャンする。半分に切断された各チューブサンプルを,サンプル
の典型的なバイオフィルム被覆率(未被覆)を示す部位を少なくとも3か所選択し,1 000から5 000倍で
観察する。選択した各部位の代表的な顕微鏡写真を取り込み,記録する。
各チューブサンプルのバイオフィルム被覆率は,次の分類に従い,定性的に評価しなければならない。
− 微生物又はバイオフィルムが存在しない。
− 微生物及び/又はバイオフィルムが点在する(密集被覆率は,チューブサンプルの全表面の10 %程度
12
T 5111:2018 (ISO 16954:2015)
よりも低い。)。
− 比較的密集した微生物及び/又はバイオフィルムが存在する(すなわち,密集被覆率は,チューブサ
ンプルの全表面の50 %程度を下回る。)。
− 相当量密集した微生物及び/又はバイオフィルムが存在する(すなわち,密集被覆率は,チューブサ
ンプルの全表面の50 %程度を上回る。)。
各チューブサンプルの最も密集した部位の代表的な画像を,試験報告書に含まなければならない。
9
試験報告書
試験報告書には,次の事項を含まなければならない。
a) 試験に使用した歯科用ユニット又は模擬歯科用ユニット給水システムの詳細
b) 実施した歯科用ユニット処置水供給システムの処理方法の詳細
c) 試験装置の設計及び操作方法の詳細
d) 特定の試験パラメータを含む,使用した試験方法の詳細
e) 試験に使用した細菌の詳細
f)
試験に使用した微生物学的サンプリング及び試験方法の詳細
g) 試験の結果,分析及び結論
h) 結果又はその妥当性に影響すると考えられる環境又は条件
i)
規定した試験方法に従わなかった事項
j)
この規格,すなわち,JIS T 5111の引用
k) 責任者名及び試験所の名称
l)
試験の実施者及び試験監督者
m) 試験期間の日付
n) 試験監督者の所見
o) 試験報告書の作成日付及び責任者の署名又は押印
13
T 5111:2018 (ISO 16954:2015)
参考文献
[1] Ainsworth R. ed. World Health Organization. Safe Piped Water: Managing Microbial Water Quality in Piped
Distribution Systems. IWA Publishing, 2004
[2] Brenner K.P., & Rankin C.C., New screening test to determine the acceptability of 0.45-micron membrane
filters for analysis of water. Appl. Environ. Microbiol. 1990, 56 (1) pp. 54-64
[3] Curtin J.J., & Donlan R.M. Using Bacteriophages To Reduce Formation of Catheter-Associated Biofilms by
Staphylococcus epidermidis. Antimicrob. Agents Chemother. 2006, 50 (4) pp. 1268-1275
[4] Hannig C., Follo M., Hellwig E., Al-Ahmad A. Visualization of adherent micro-organisms using different
techniques. J. Med. Microbiol. 2010, 59 pp. 1-7
[5] Walker J.T., Bradshaw D.J., Bennett A.M., Fulford M.R., Martin M.V., Marsh P.D. Microbial biofilm formation
and contamination of dental-unit water systems in general dental practice. Appl. Environ. Microbiol. 2000, 66
(8) pp. 3363-3367
[6] Walker J.T., Bradshaw D.J., Fulford M.R., Marsh P.D. Microbiological evaluation of a range of disinfectant
products to control mixed-species biofilm contamination in a laboratory model of a dental unit water system.
Appl. Environ. Microbiol. 2003, 69 (6) pp. 3327-3332
[7] Official Method A.O.A.C. 960.09, Germicidal and Detergent Sanitizing Action of Disinfectants. AOAC
International, 2000
[8] ASTM E 1427-00,Standard Guide for Selecting Test Methods to Determine the Effectiveness of Antimicrobial
Agents and Other Chemicals for the Prevention, Inactivation and Removal of Biofilm
[9] Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption.
Official Journal of the European Communities. L330:32-54
[10] DVGW W 270, Microbial Enhancement on Materials to Come into Contact with Drinking Water−Testing and
Assessment. German Association for Gas and Water Industry Association (DVGW), 2007
[11] ISO 2174,Surface active agents−Preparation of water with known calcium hardness
[12] ISO 8199:2005,Water quality−General guidance on the enumeration of micro-organisms by culture
[13] JIS T 5912:2015 歯科−ハンドピース及びモータ
注記 原国際規格では,ISO 14457:2012,Dentistry−Handpieces and motorsを記載している。
[14] ISO 16266,Water quality−Detection and enumeration of Pseudomonas aeruginosa−Method by membrane
filtration
[15] Method 9215 Heterotrophic Plate Count, Standard Methods for the Examination of Water and Wastewater,
American Public Health Association, American Water Works Association, Water Environment Federation, 2004
[16] Method 2340 Hardness (Methods 2340B and 2340C), Standard Methods for the Examination of Water and
Wastewater. American Public Health Association, American Water Works Association, Water Environment
Federation, 1997
[17] WHO/HSE/WSH. 10.01/10, Hardness in drinking-water: background document for development of WHO
guidelines for drinking-water quality. World Health Organization. WHO, 2011

