T 3263:2012
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 2
5 要求事項 ························································································································· 3
5.1 物理的要求事項 ············································································································· 3
5.2 生物学的安全性 ············································································································· 4
5.3 無菌性の保証 ················································································································ 4
6 包装······························································································································· 4
6.1 一次包装 ······················································································································ 4
6.2 二次包装 ······················································································································ 4
7 表示······························································································································· 4
7.1 一次包装 ······················································································································ 4
7.2 二次包装 ······················································································································ 4
7.3 図記号の使用 ················································································································ 5
T 3263:2012
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3263:2007は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3263:2012
血管カテーテル用Y−コネクタ
Y-connectors for intravascular catheters
序文
この規格は,2007年に制定されたJIS T 3263の見直しにおいて,使用者の利便性のため用語,文書構成
などの内容を変更して改正した日本工業規格である。
なお,対応国際規格は現時点で制定されていない。
1
適用範囲
この規格は,血管カテーテルを使用するときに,親カテーテル(ガイディングカテーテルなど)に接続
して用いる血管カテーテル用Y−コネクタ(以下,Y−コネクタという。)について規定する。
なお,平成27年9月30日までJIS T 3263:2007は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
血管カテーテル用Y−コネクタ
親カテーテル(ガイディングカテーテルなど)に接続され,血液の漏れを軽減し,子カテーテルの操作
をスムーズにし,サイドポートから造影剤・薬液・生理食塩液の注入,圧力監視などを行うコネクタ。
3.2
ローテータ
カテーテルなどの手元部にあるハブなどに接続する開口部。接続された状態でもY−コネクタ本体が回
転可能なルアーロック付きおす(雄)かん(嵌)合部で,ロテータともいう。
2
T 3263:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.3
サムホイール
血液の漏れを防止する止血機能をもつ開口部。Y−コネクタ内に挿入されるカテーテルの内くう(腔)
を,キンクさせることなく止血できる。締付け度合いが調節できるものをトイボースト・アダプタともい
う。
3.4
サイドポート
造影剤・薬液・生理食塩液の注入,圧力監視などを行う開口部。ルアーロック付きめす(雌)かん(嵌)
合部である。
3.5
接続チューブ
Y−コネクタ本体のサイドポートに接合された柔軟なチューブ。
3.6
親カテーテル
コアキシャルシステム(太いカテーテルに同軸で細いカテーテルを挿入させる方法)を用いる場合の外
側のカテーテル。
3.7
子カテーテル
コアキシャルシステム(太いカテーテルに同軸で細いカテーテルを挿入させる方法)を用いる場合の内
側のカテーテル。
4
構成及び各部の名称
Y−コネクタは,主にローテータ,サムホイール及びサイドポートからなる。組合せによって次の種類
のものがある。
− ローテータに,サムホイールとサイドポートとが各一つずつ付いたもの
− ローテータに,サムホイールと接続チューブ付きサイドポートとが各一つずつ付いたもの
− ローテータに,サムホイールが二つとサイドポートが一つ付いたもの
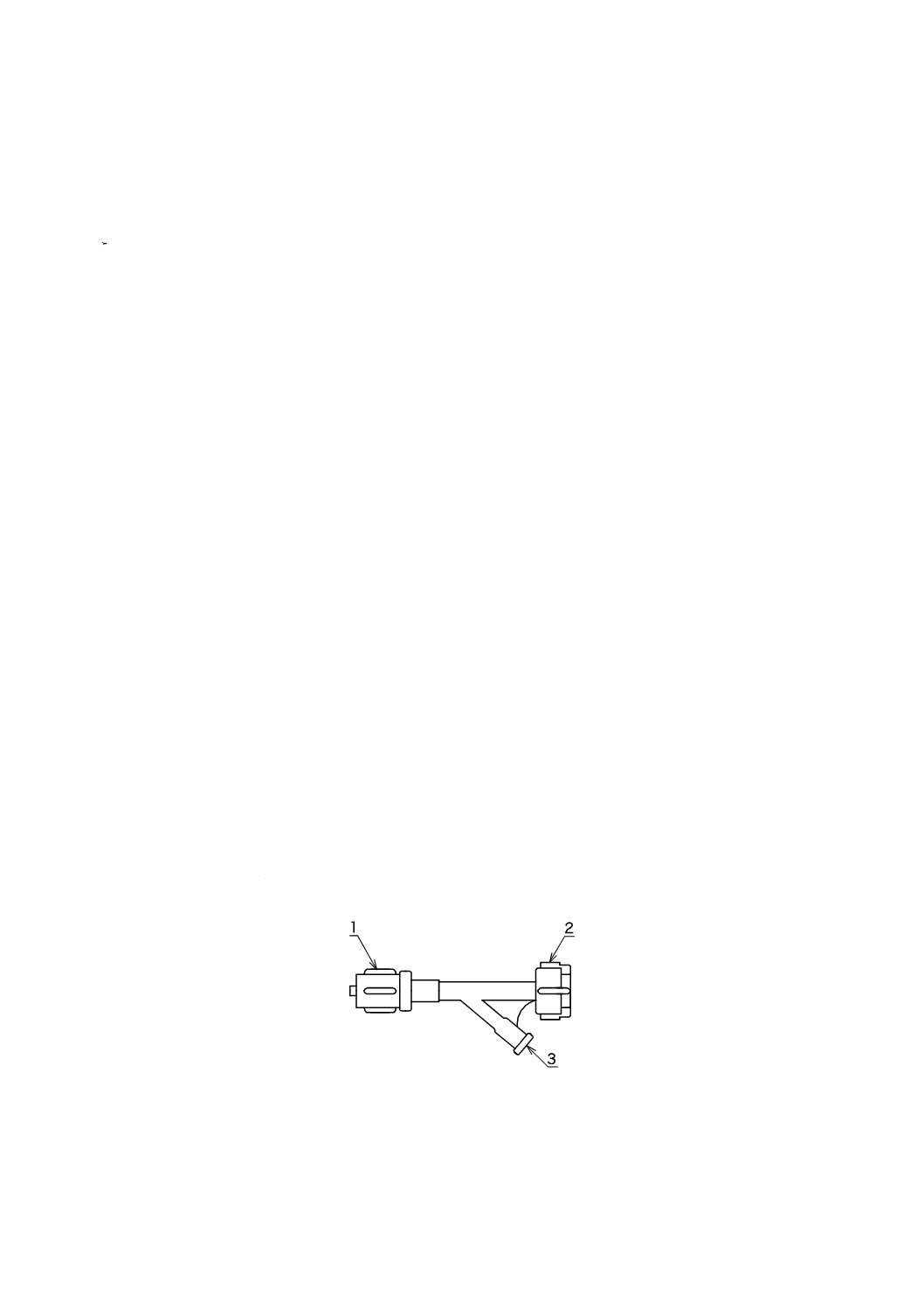
Y−コネクタの基本的な構造の例を,図1に示す。また,コアキシャルシステムにおけるY−コネクタ
との構成を,図2に参考として示す。
1 ローテータ
2 サムホイール
3 サイドポート
図1−基本的な構造図例
3
T 3263:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図2−コアキシャルシステム(親・子カテーテル)(参考)
5
要求事項
5.1
物理的要求事項
5.1.1
外観及び清浄度
目視で検査したとき,微粒子又は異物の付着があってはならない。
5.1.2
気密性
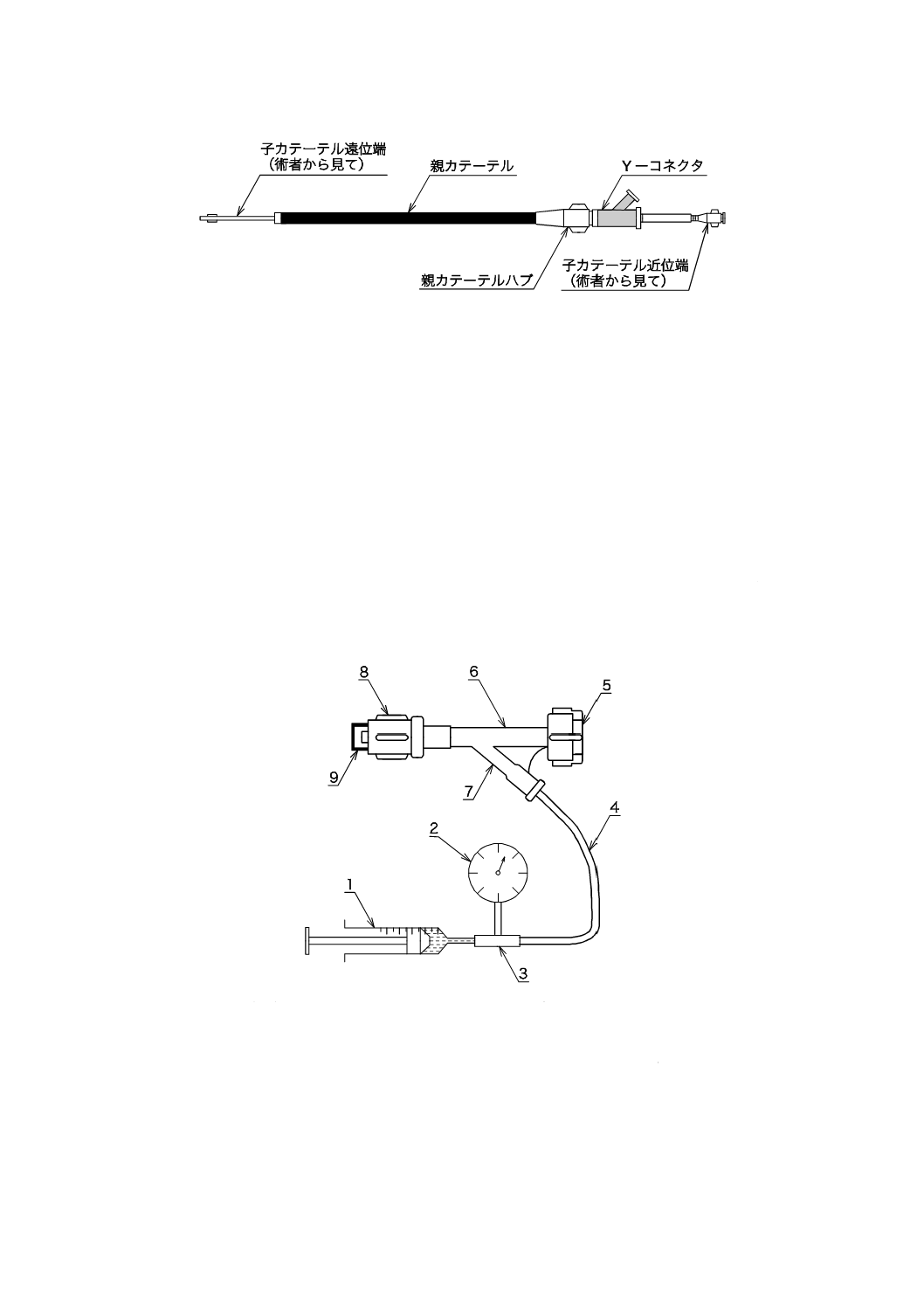
図3のように,リーク防止コネクタを用いてY−コネクタのサイドポートと注射筒とを接続する。Y−
コネクタの止血機能をもつサムホイールは,通常の止血状態(必要に応じて適切なカテーテルを挿入する。)
とし,その他の開口部は適切なコネクタによって閉鎖する。次に,蒸留水又は脱イオン水を用いてY−コ
ネクタへ注射筒から水圧を加え,止血部における漏れを検査する。圧力は40±2 kPaとし,止血部,かん
(嵌)合部を検査するときに液漏れしてはならない。
1 10 mL注射筒
6 Y−コネクタ
2 圧力計
7 サイドポート
3 リーク防止コネクタ
8 ローテータ
4 接続チューブ(延長チューブ)
9 ルアーキャップ
5 止血部(サムホイール)
注記 1,2,3は,インフレータを利用してもよい。また,ルアーキャップは,対応するコネクタ付きのカテーテルを
利用してもよい。
図3−Y−コネクタの気密試験装置(参考)
4
T 3263:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.1.3
おすめす(雄雌)かん(嵌)合部の合致
おすめす(雄雌)かん(嵌)合部は,ISO 594-1又はISO 594-2に適合したものでなければならない。
5.1.4
おすめす(雄雌)かん(嵌)合部の接続部
各接続部は,15 N以上の力で15秒以上引っ張ったとき,緩んだり,外れたりしてはならない。
5.1.5
接続チューブ
5.1.2に規定する気密性で用いた回路に含めて,止血部の気密性と同様の評価を行う。接続部は,15 N以
上の力で15秒以上引っ張ったとき,緩んだり,外れたりしてはならない。
5.1.6
ローテータ
ローテータとY−コネクタ本体との接続部は,いずれの位置においても15 N以上の力で15秒以上引っ
張ったとき,緩んだり外れたりしてはならない。
5.2
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
5.3
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省の定めた滅菌バリデーション基準がある。
6
包装
6.1
一次包装
一次包装は,微生物の侵入を防止することができ,通常の取扱い,輸送及び保管中に内容製品に損傷の
おそれがないようにする。一次包装は,一度開封したら,簡単に再シールできず,開封されたことが明確
に分からなければならない。
6.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもつものとする。
7
表示
7.1
一次包装
一次包装には,次の事項を表示する。
a) 製造番号又は製造記号
b) “滅菌済み”の旨
c) 再使用禁止の旨(“ディスポーザブル”の表現は,使用しない。)
7.2
二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合は,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示は必要としない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名
d) “滅菌済み”の旨。
e) 再使用禁止の旨(“ディスポーザブル”の表現は,使用しない。)

5
T 3263:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
f)
数量(入り数)
g) 製造番号又は製造記号
h) 滅菌年月
7.3
図記号の使用
7.1及び7.2の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な図記号の例を,表1に示す。
表1−JIS T 0307に規定する主な図記号の例


