T 3256:2013
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 物理的要求事項 ················································································································ 3
5.1 針部 ···························································································································· 3
5.2 導管 ···························································································································· 4
5.3 かん(嵌)合部 ············································································································· 4
5.4 針刺し事故防止装置 ······································································································· 4
5.5 分離装置 ······················································································································ 4
5.6 外観及び清浄度 ············································································································· 4
5.7 引張強さ ······················································································································ 4
5.8 気密性 ························································································································· 4
5.9 カラーコード ················································································································ 4
6 化学的要求事項 ················································································································ 4
7 生物学的安全性 ················································································································ 4
8 無菌性の保証 ··················································································································· 4
9 エンドトキシン ················································································································ 5
10 製造販売業者から提供する情報 ························································································· 5
11 包装 ····························································································································· 5
11.1 一次包装 ····················································································································· 5
11.2 二次包装 ····················································································································· 5
12 表示 ····························································································································· 5
12.1 一次包装 ····················································································································· 5
12.2 二次包装 ····················································································································· 6
12.3 図記号の使用 ··············································································································· 6
T 3256:2013
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。こ
れによって,JIS T 3256:2007は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格
JIS
T 3256:2013
インスリンポンプ用輸液セット
Infusion set for insulin pump
序文
この規格は,2007年に制定され今日に至っている。今回,使用者の利便性のため用語,文書構成などの
内容を変更して改正した日本工業規格である。
なお,対応国際規格は現時点で制定されていない。
1
適用範囲
この規格は,インスリンポンプに装着された注射筒内のインスリン製剤を注入するために使用し,かつ,
単回使用のインスリンポンプ用輸液セットについて規定する。
なお,平成28年8月31日までJIS T 3256:2007は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
JIS T 3221:2011 単回使用ポート用針
JIS T 3222:2011 滅菌済み翼付針
JIS T 3223:2011 末しょう(梢)血管用滅菌済み留置針
ISO 6009:1992,Hypodermic needles for single use−Colour coding for identification
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
針部
主に筒状の針管で構成する部分,又は主に柔軟性のあるカテーテル及びせん(穿)刺するための内針か
ら構成する部分。
3.2
針管
皮下又は血管にせん(穿)刺し薬剤を投与する一方の端が鋭利になっている硬質の針で,角度をつける
などの加工を施した管。
2
T 3256:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.3
カテーテル
皮下又は血管に留置し薬剤を投与する柔軟性のある管。
3.4
内針
一方の端が鋭利になっており,カテーテルを留置するためにせん(穿)刺する硬質の針。
3.5
固定部
針部を固定する部品。翼状の部品,装着テープなどで構成する場合がある。
3.6
導管
薬剤を体内に導く管。
3.7
かん(嵌)合部
器具と器具との接続及び離脱を可能にする部品。
3.8
公称外径
インスリンポンプ用輸液セットの被包又は容器に表示された針部の外径の寸法(図1のL1参照)。
3.9
公称長さ
インスリンポンプ用輸液セットの被包又は容器に表示された針管又はカテーテルの長さの寸法(図1の
L2参照)。
3.10
一次包装
インスリンポンプ用輸液セットを直接に覆う包装で,インスリンポンプ用輸液セットの無菌性を保持す
るためのもの。さらに,これを二次包装する場合には,いわゆる“内袋”に該当する。ただし,一次包装
で無菌性を保持しないものもあり,その場合は,保護キャップ及び針さや(鞘)によってインスリンポン
プ用輸液セットの内部の無菌性を保持している。
3.11
二次包装
一次包装を直接に覆う包装。通常,一次包装したインスリンポンプ用輸液セットを複数(例えば,50本)
入れた包装。
3.12
保護キャップ
接続を意図した部分を保護する蓋。
3.13
針さや(鞘)
針管やカテーテルなどを保護するためのもの。
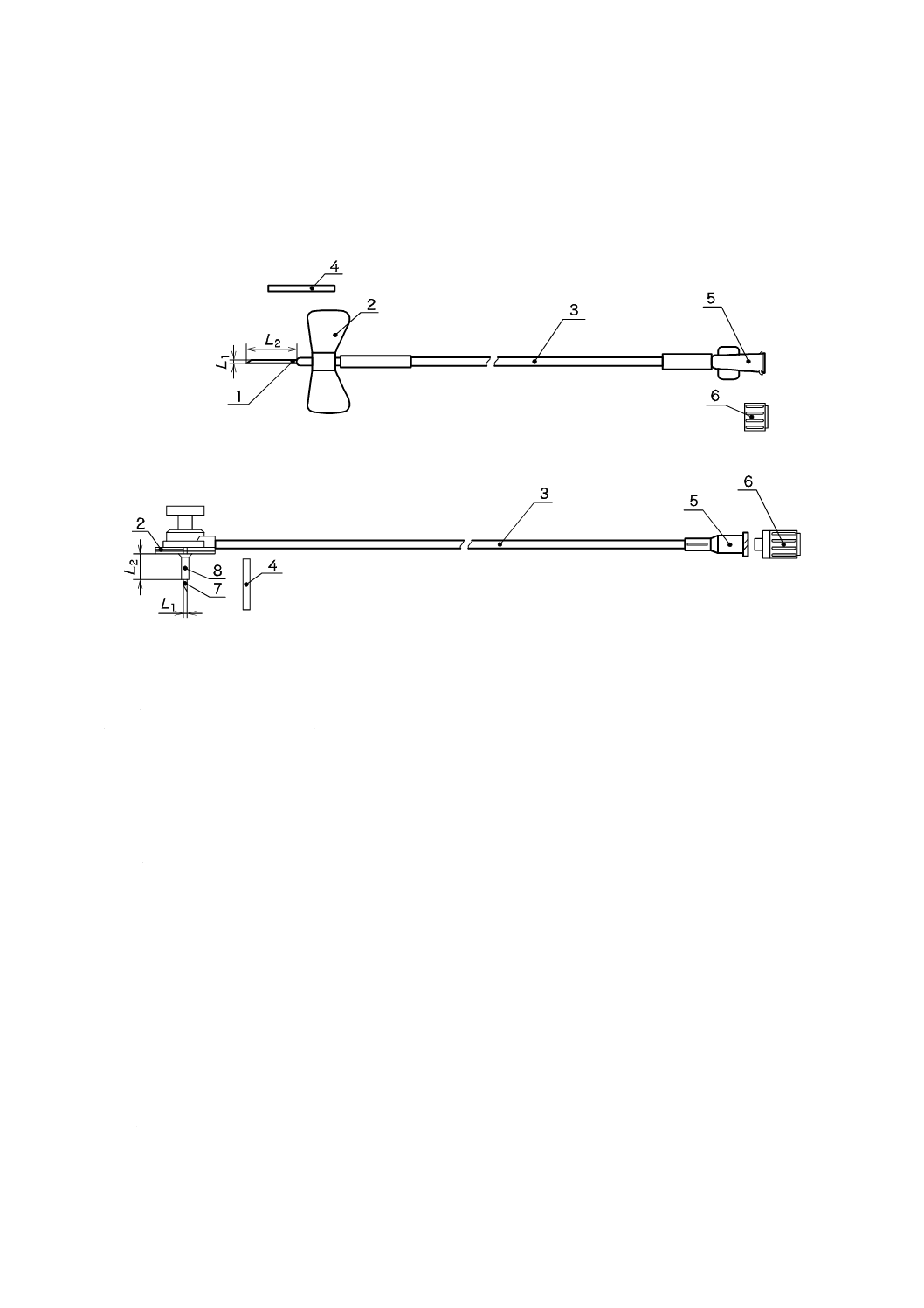
3
T 3256:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
構成及び各部の名称
インスリンポンプ用輸液セットは,主として針管又はカテーテル,固定部,導管及びかん(嵌)合部か
らなる。
図1に,一般的なインスリンポンプ用輸液セットの構成例及び各部の名称を示す。
1
針管
2
固定部
3
導管
4
針さや(鞘)
5
かん(嵌)合部
6
保護キャップ
7
内針
8
カテーテル
注記 上記のほかに,針刺し事故防止装置が付いているもの,分離装置(一時的に取り外すための接続部品)が付い
ているものなどがある。
図1−一般的なインスリンポンプ用輸液セットの構成及び各部の名称の例
5
物理的要求事項
5.1
針部
5.1.1
針管及び内針の材料
針管及び内針の材料は,JIS T 3222:2011の6.1.1に適合しなければならない。
5.1.2
寸法の許容差
針管又はカテーテルの寸法の許容差は,JIS T 3222:2011の11.1に適合しなければならない。
5.1.3
弾性
針管及び内針の弾性は,JIS T 3222:2011の5.2に適合しなければならない。
5.1.4
曲げ強さ
針管及び内針の曲げ強さは,次のいずれかに適合しなければならない。
a) 第1法 公称長さが12 mm以上の針管及び内針は,JIS T 3222:2011の5.3に適合しなければならない。
b) 第2法 折り曲げ加工部分が固定部の外にある針管及び内針は,JIS T 3221:2011の5.5に適合しなけ
ればならない。
4
T 3256:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.1.5
針先
針管及び内針の針先は,JIS T 3222:2011の6.4に適合しなければならない。
5.1.6
腐食抵抗性
固定部に金属材料を用いているものにあっては,JIS T 3223:2011の5.6に適合しなければならない。
5.1.7
潤滑剤の量
潤滑剤の量は,JIS T 3222:2011の6.5に適合しなければならない。
5.2
導管
導管は,JIS T 3222:2011の6.3に適合しなければならない。
5.3
かん(嵌)合部
かん(嵌)合部は,JIS T 3222:2011の11.3のa)に適合しなければならない。
5.4
針刺し事故防止装置
針刺し事故防止装置をもつものにあっては,添付文書の操作方法を行ったとき,意図した機能が有効に
作動しなければならない。
5.5
分離装置
分離装置をもつものにあっては,装置は分離する機能をもち,かつ,容易に接続できなければならない。
5.6
外観及び清浄度
導管及びかん(嵌)合部は,JIS T 3222:2011の6.2.1に適合しなければならない。また,針部は,次の
いずれかに適合しなければならない。
a) 第1法 針管は,JIS T 3222:2011の6.1.2に適合しなければならない。
b) 第2法 カテーテル及び内針は,JIS T 3223:2011の5.5及び5.13.2に適合しなければならない。
5.7
引張強さ
針部,導管,各接続部及び分離装置は,次のいずれかによる。
a) 第1法 針部が主に針管で構成されるものにあっては,JIS T 3222:2011の6.2.3に適合しなければな
らない。
b) 第2法 針部がカテーテル及び内針で構成されるものにあっては,カテーテルはJIS T 3223:2011の
5.7に,及びカテーテル以外はJIS T 3222:2011の6.2.3に適合しなければならない。
5.8
気密性
針部,導管,各接続部及び分離装置は,JIS T 3222:2011の5.1又は6.2.2に適合しなければならない。
5.9
カラーコード
カラーコードを用いる場合,ISO 6009:1992に規定するカラーコードとする。
6
化学的要求事項
JIS T 3222:2011の箇条7に適合しなければならない。
7
生物学的安全性
JIS T 0993-1:2012に規定する生物学的安全性の評価を行う。
8
無菌性の保証
無菌性を保証する場合は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保
を行う。
5
T 3256:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
9
エンドトキシン
インスリンポンプ用輸液セット10セットをとり,各セットの管内にエンドトキシン試験用水40 mLを1
分間約10 mLの速さで流し,その液で針管をよく洗い,洗液を合わせて試験液として,日本薬局方の一般
試験法のエンドトキシン試験法によって試験をしたとき,0.5 EU/mL未満でなければならない。
10 製造販売業者から提供する情報
製造販売業者は,添付文書に次の情報を提供しなければならない1)。
注1) 持続皮下インスリン注入療法では,流量が非常に少ないうえに,インスリンポンプ用輸液セッ
トにコンプライアンス(容積変化)があるため,万一針部又は導管内に閉塞が発生してもすぐ
に気付かない場合があり,またインスリンポンプの閉塞警報も直ちに閉塞を検知することがで
きないことによる情報である。
a) 使用中は,導管の折れ曲がり及び導管内に閉塞がないことを定期的に確認する旨
b) 使用中は,血糖値を定期的に測定し確認する旨
c) インスリンポンプ用輸液セットには,コンプライアンス(容積変化)があるため針部又は導管内で閉
塞してもインスリンポンプの閉塞警報が直ちに検知することができない旨
11 包装
11.1 一次包装
一次包装は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に製品を適切に保護できるものでなければならない。ただし,一次包装で無菌性を保持し
ないものは,保護キャップ及び針さや(鞘)でインスリンポンプ用輸液セット内部の無菌性を保持する。
また,一度開封したら,包装は簡単に再シールできず,開封したことが明確に分かるものでなければなら
ない。
無菌維持を目的としない場合には,通常の取扱い,輸送及び保管中に製品を適切に保護できる包装でな
ければならない。
11.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に,製品を保護できる強度をもたなければならない。
12 表示
12.1 一次包装
一次包装には,次の事項を表示する。
a) 針管又はカテーテルの公称外径(mm)及び公称長さ(mm)。また,公称外径表示に,ゲージを参考
で併記してもよい。
注記 ゲージは,Gなどで表記する。
b) “滅菌済み”の旨
c) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
d) 製造番号又は製造記号
e) 天然ゴムを原材料として用いているものは,その旨

6
T 3256:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
f)
一次包装で無菌性を保証していないものは,その旨
12.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合には,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者名の氏名又は名称及び住所
b) 販売名
c) 針管又はカテーテルの公称外径(mm)及び公称長さ(mm)。また,公称外径表示に,ゲージを参考
で併記してもよい。
注記 ゲージは,Gなどで表記する。
d) 数量(入り数)
e) “滅菌済み”の旨
f)
“再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
g) 製造番号又は製造記号
h) 滅菌年月
i)
他の法定表示事項
12.3 図記号の使用
12.1及び12.2は,JIS T 0307:2004に規定する適切な図記号を使用することによってこれに替えてもよい。
注記 JIS T 0307:2004に規定する主な図記号の例を,表1に示す。
表1−JIS T 0307に規定する主な図記号の例

