T 3230:2008
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 2
4 構成······························································································································· 3
5 要求事項 ························································································································· 3
5.1 生物学的特性 ················································································································ 3
5.2 物理的特性 ··················································································································· 4
5.3 性能特性 ······················································································································ 4
6 試験及び測定 ··················································································································· 4
6.1 一般事項 ······················································································································ 4
6.2 生物学的特性 ················································································································ 5
6.3 物理的特性 ··················································································································· 5
6.4 性能特性 ······················································································································ 5
7 表示······························································································································· 7
7.1 製品 ···························································································································· 7
7.2 包装に表示する情報 ······································································································· 7
7.3 添付文書に記載する情報 ································································································· 8
7.4 添付文書で目立つように提供しなければならない情報 ··························································· 9
8 包装······························································································································· 9
8.1 一次包装 ······················································································································ 9
8.2 二次包装 ······················································································································ 9
附属書JA(参考)JISと対応する国際規格との対比表 ································································ 10
T 3230:2008
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,日本医療器材工業会 (JMED) 及び財団法人
日本規格協会 (JSA) から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日本工業標
準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に
抵触する可能性があることに注意を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許
権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に係る確認について,責任は
もたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3230:2008
人工肺
Oxygenators
序文
この規格は,1996年に第1版として発行されたISO 7199,Cardiovascular implants and artificial organs−
Blood-gas exchangers (oxygenators) を基に作成した日本工業規格であるが,国内事情を考慮し,技術的内容
を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,滅菌済みで単回使用の,血液への酸素付加及び血液からの二酸化炭素除去を目的とする体
外循環用人工心肺用血液ガス交換器(以下,人工肺という。)の要求事項について規定する。ただし,この
規格は,次の機器には適用しない。
− 植込み形人工肺(血管内膜形人工肺)
− 液体人工肺
− 体外循環回路(血液チューブ)
− 個別の熱交換器(単回使用人工心肺用熱交換器)
− 個別の附属機器
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 7199 : 1996,Cardiovascular implants and artificial organs−Blood-gas exchangers (oxygenators)
(MOD)
なお,対応の程度を表す記号 (MOD) は,ISO/IEC Guide 21に基づき,修正していることを
示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0993-1 医療機器の生物学的評価−第1部:評価及び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1 : Evaluation and
testing (IDT)
ISO 10993-11,Biological evaluation of medical devices−Part 11 : Tests for systemic toxicity
2
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
人工肺
肺の呼吸機能の補助又は代用として設計された体外循環用機器。
3.2
血液経路
臨床で使用する間,人工肺の血液が通過する部分。
3.3
試験用血液
ウシ又はブタから採取してヘパリン処理した全血又は生理食塩液で希釈した血液。
3.4
ガス経路
臨床で使用する間,人工肺のガスが通過する部分。
3.5
熱交換器
循環中の血液又はプライミング液の温度を制御する部分。
3.6
熱交換性能係数,R
熱交換器の水流入口と人工肺の血液流入口との温度差に対する人工肺の血液流入口と血液流出口との血
液の温度差の比率。熱交換性能係数は,次の式によって算出する。
Ti
Ti
Ti
To
B
W
B
B
R
−
−
=
ここに,
R: 熱交換性能係数
To
B: 人工肺の血液流出口における血液の温度(℃)
Ti
B: 人工肺の血液流入口における血液の温度(℃)
Ti
W: 熱交換器の水流入口における水の温度(℃)
3.7
構成部品
人工肺に接続され,通常,使用者によって分離できない部品。
3.8
操作可変範囲
機器の機能に影響を及ぼす制御部分の設定。
3.9
血小板減少率
人工肺を組み込んでいる回路に含まれている血小板の減少率から,人工肺を使わない同様の対照回路で
の減少率を差し引いた数値の経時変化。
3
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.10
血しょう(漿)遊離ヘモグロビン生成
人工肺を組み込んでいる回路の血しょう遊離ヘモグロビン濃度と,人工肺を使用しない同様の対照回路
での濃度との差異の経時変化。
3.11
白血球減少率
人工肺を組み込んでいる回路の白血球の減少率から,人工肺を使用しない同様の対照回路での減少率を
差し引いた数値の経時変化。
4
構成
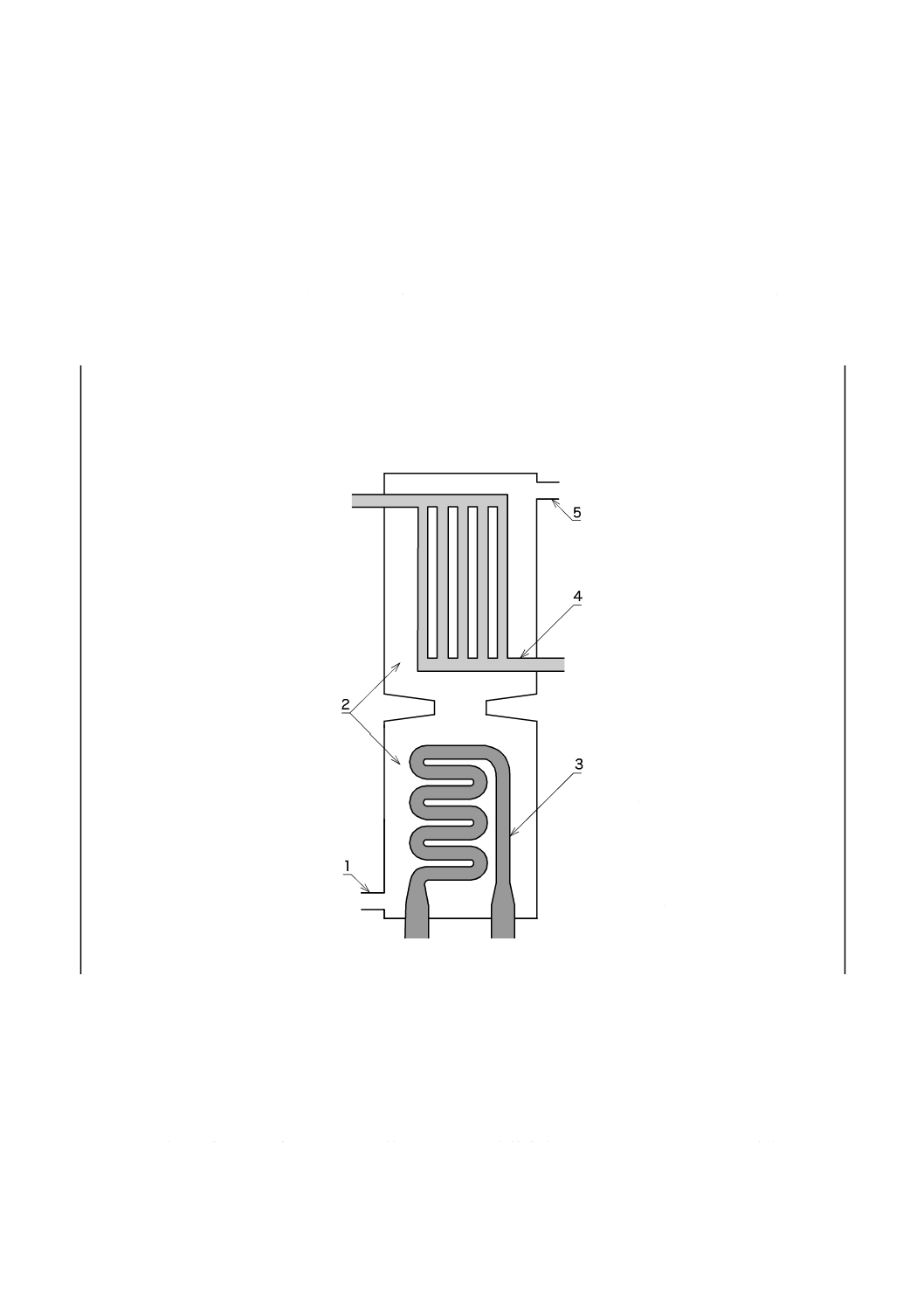
人工肺は,主として流入口,血液経路,熱交換器,ガス経路及び流出口からなる。図1は,一般的な人
工肺を図示した一例であり,構成要素などは要求事項ではない。
図1−人工肺概略
5
要求事項
5.1
生物学的特性
5.1.1
無菌性及び非発熱性
血液経路は滅菌済みで,非発熱性でなければならない。この適合性は,6.2.1によって確認する。
5.1.2
生物学的安全性
血液経路の構成部品は,意図した使用目的に対して生物学的安全性がなくてはならない。この適合性は,
1 流入口
2 血液経路
3 熱交換器
4 ガス経路
5 流出口
4
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
6.2.2によって確認する。
5.2
物理的特性
5.2.1
血液経路の耐圧性
血液経路の耐圧性は,6.3.1によって試験したとき,血液経路で漏れがあってはならない。
5.2.2
熱交換器の水路の耐圧性
熱交換器の水路の耐圧性は,6.3.2によって試験したとき,熱交換器の水路から漏れがあってはならない。
5.2.3
血液容量
6.3.3によって試験したとき,血液経路の容量は製造業者が指定する許容範囲内(7.3参照)でなければ
ならない。
5.2.4
コネクタ
血液経路に接続するコネクタは,6.3.4によって試験したとき,確実に接続されていなければならない。
注記 チューブ内径4.8 mm,6.3 mm,9.5 mm,若しくは12.7 mmに接続できるコネクタ,又はJIS T
3250の図1若しくはISO 594-2に対応するコネクタは適合するものとしてみなす。
6.3.4によって試験したとき,ガス経路へのガス流入口の接続が外れてはならない。
熱交換器の水路用のコネクタはファスト・カップリングを使用して接続が可能でなければならない。
注記 JIS T 3250の図2に対応するコネクタは,この要求事項に適合する方法の一つとして考えられ
る。
5.3
性能特性
5.3.1
ガス交換能
6.4.1によって測定したとき,ガス交換能は製造業者が指定する許容範囲内(7.3参照)でなければなら
ない。
5.3.2
熱交換性能係数
6.4.2によって測定したとき,熱交換性能係数は製造業者が指定する許容範囲内(7.3参照)でなければ
ならない。
5.3.3
血球損傷
6.4.3によって測定したとき,血しょう遊離ヘモグロビン濃度の上昇,血小板及び白血球比率の減少は製
造業者が指定する許容範囲内(7.3参照)でなければならない。
5.3.4
経時的性能変化
6.4.1によって測定したとき,ガス交換能は製造業者が指定する許容範囲内(7.3参照)でなければなら
ない。
6
試験及び測定
6.1
一般事項
一般的事項は,次による。
a) 臨床使用を目的として製造業者の指示に従い準備された人工肺を用いて試験を行い,測定する。
b) 特に指示がない場合,操作可変範囲は臨床使用を目的として製造業者が指定した使用条件とする。
c) 特に指示がない場合,試験液の温度は37±1 ℃とする。
d) 変数間の関係が非線形である場合には,測定点間の補間が可能となるように,十分な測定を行う。
e) この箇条に示す試験手順又は測定手順は,参照手順とみなす。精度及び再現性が現行手順と比較でき
ることが実証されている場合は,ほかの手順でもよい。
5
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
6.2
生物学的特性
6.2.1
無菌性及び非発熱性
滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。また,ISO 10993-11
に基づき,非発熱性の評価を行う。
注記 滅菌バリデーション基準は,薬食監麻発第0330001号,平成17年3月30日,“薬事法及び採血
及び供血あつせん業取締法の一部を改正する法律の施行に伴う医薬品,医療機器等の製造管理
及び品質管理 (GMP/QMS) に係る省令及び告示の制定及び改廃について 第四章 第4 滅菌バ
リデーション基準”による。
6.2.2
生物学的適合性
JIS T 0993-1に規定する生物学的安全性評価を行う。
6.3
物理的特性
6.3.1
血液経路の耐圧性の測定
6.3.1.1
試験液
試験液として,水を使用する。
6.3.1.2
手順
人工肺を適切な試験回路に組み込み,機器の血液経路に臨床使用を目的として製造業者が指定した最大
の圧又は流量(7.3参照)の1.5倍を,最大圧又は流量が指定されていない場合には40 kPaの圧をかける。
この圧を,6時間保持し,水漏れに関して目視で検査を行う。
6.3.2
熱交換器の水路の耐圧性
6.3.2.1
試験液
試験液として,水を使用する。
6.3.2.2
手順
人工肺を適切な試験回路に組み込み,熱交換器の水路に臨床使用を目的として製造業者が指定した最大
圧(7.3参照)の1.5倍を,最大圧が指定されていない場合には350 kPaの圧をかける。この圧を,6時間
保持し,水漏れに関して目視で検査を行う。
6.3.3
血液容量
6.3.3.1
試験液
試験液として,ウシ若しくはブタから採取してヘパリン処理した血液を使用する。
6.3.3.2
手順
血液容量は,臨床使用を目的として製造業者が指定した操作可変範囲(7.3参照)で測定する。
6.3.4
コネクタ
製造業者の指示に従って接続を行う。接続部は15 Nの引張り強度をかけたとき,15秒間外れてはなら
ない。
6.4
性能特性
6.4.1
ガス交換能
6.4.1.1
試験媒体
血液経路の試験液にはウシ又はブタから採取してヘパリン処理した血液を使用し,ガス経路の試験媒体
には血中濃度と同じ酸素,窒素及び二酸化炭素濃度のガスを使用する。
6.4.1.2
手順
人工肺を適切な試験回路に組み込み,血液流入口において次の条件で試験を行い,ガス交換能を測定
6
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
する。
− 酸化ヘモグロビンの比率:65±5 %
− ヘモグロビン濃度:12±1 g/dL
− 過剰塩基:0±5 mmol/L
− 二酸化炭素分圧:6.0±0.7 kPa
ガス交換能は,臨床使用を目的として製造業者が指定した操作可変範囲(7.3参照)で測定する。測定
中は,臨床使用を目的として製造業者が指定した血流量(7.3参照)を維持する。
酸素及び二酸化炭素交換能の測定は,試験開始時及び試験開始から1時間,3時間,6時間後に行う。
注記1 ウシを使用した試験及びインビトロ試験を行ってもよい。
注記2 酸素及び二酸化炭素交換能の測定中は,必要に応じて,血液を新鮮血と交換してもよい。
注記3 データ収集は,必ずしも指定された方法でなくてもよい。妥当な補間によって得られた近似
値も認められる。
6.4.2
熱交換性能係数
6.4.2.1
試験液
血液経路の試験液にはウシ若しくはブタから採取してヘパリン処理した血液,又は水を使用する。
6.4.2.2
手順
人工肺を適切な試験回路に組み込み,次の条件でインビトロ試験を行う。
− 血液流入口の温度,(BTi) : 30±1 ℃
− 水流入口の温度,(WTi) : 40±1 ℃
熱交換性能係数は,臨床使用を目的として製造業者が指定した操作可変範囲(7.3参照)で測定する。
6.4.3
血球損傷
6.4.3.1
試験媒体
血液経路の試験液にはウシ又はブタから採取してヘパリン処理した血液を使用し,ガス経路の試験媒体
には適切な酸素,窒素及び二酸化炭素濃度のガスを使用する。
6.4.3.2
手順
ポンプ,接続チューブ,貯血槽(製造業者によって指定され,当該人工肺に対して適切なサイズのもの)
及び熱交換器を含めた適切かつ同一の回路を2セット組み立て,いずれか1セットに人工肺を組み込む。
試験開始時,血液経路に両セット間の血液容量の差が1 %以内となるようにし,表1の条件下でインビト
ロ試験を行う。
7
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
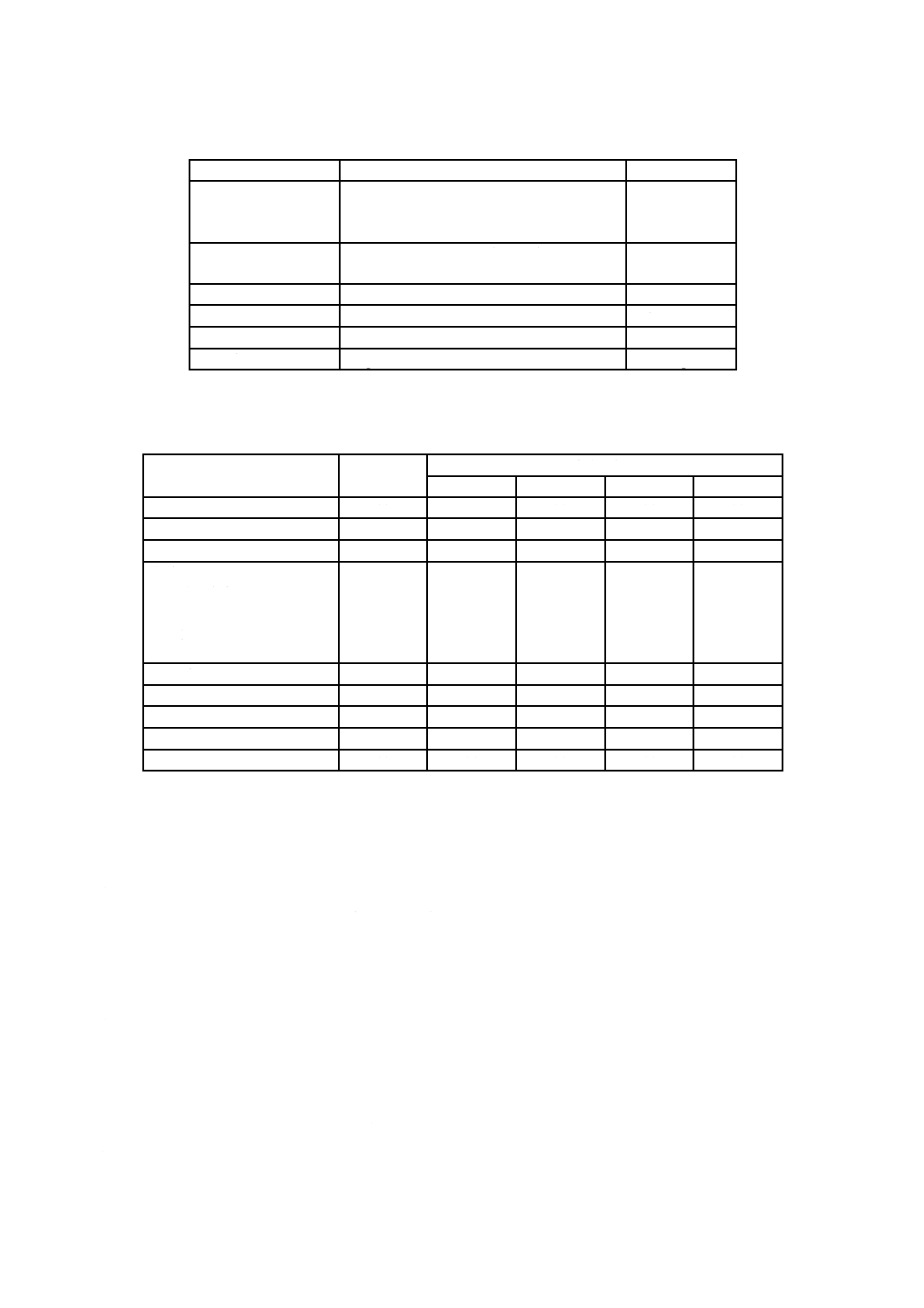
表1−血球損傷のインビトロ試験条件
項目
レベル
許容誤差
血液流量
臨床使用を目的として製造業者が指定した
最大流量(7.3参照),又は6 L/minのうち,
低い方のレベル
±5 %
ガス流量
臨床使用を目的として製造業者が指定した
最大流量(7.3参照)
±5 %
二酸化炭素分圧
5.3 kPa
±0.7 kPa
過剰塩基
0
±5 mmol/dL
血糖
10 mmol/dL
±5 mmol/dL
ヘモグロビン
12 g/dL
±1 g/dL
測定スケジュールは,表2による。
表2−測定スケジュール
パラメータ
試験前
試験開始後
10分
30分
180分
360分
血しょう遊離ヘモグロビン
×
−
×
×
×
白血球
×
−
×
×
×
血小板
×
−
×
×
×
血液ガス:
−
×
×
×
×
二酸化炭素分圧
酸素分圧
pH
過剰塩基
ヘモグロビン
×
×
×
×
×
血糖
×
−
−
−
−
ACT
×
−
−
−
−
温度
×
×
×
×
×
血流量
×
×
×
×
×
7
表示
7.1
製品
人工肺には,次の事項を表示する。
a) 血液,ガス,及び水の流れ方向(必要な場合)
b) 貯血槽の最小及び操作貯血量(該当する場合)
7.2
包装に表示する情報
7.2.1
一次包装
一次包装には,次の事項を表示する。
a) 内容物
b) 品番
c) 無菌性及び非発熱性に関する記載
d) 有効期限
e) バッチ,ロット,又はシリアル番号
f)
“使用前に取扱説明書をお読み下さい”の記載,又は同等の内容の記載
8
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
g) 特別な取扱い,又は保管条件
h) “再使用禁止”の旨
7.2.2
二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合は,一次包装に表示する。
a) 製造販売業者の氏名及び住所
b) 内容物(入数を含む)
c) 品番
d) 無菌性及び非発熱性に関する記載
e) 有効期限
f)
特別な取扱い,保管条件又は開こん(梱)に関する指示
7.3
添付文書に記載する情報
流通単位ごとに,次の情報を記載した“添付文書”を附属する。
a) 製造販売業者の氏名,住所及び電話番号又はファックス番号
b) 品番
c) 必要な附属機器
d) 必要な特別又は独自の手順に関する指示(該当する場合)
e) 補助又は操作用装置での人工肺の設置方向
f)
チューブ接続の設置,種類,及び締付け
g) 追加の入口ポート又は出口ポートの位置及び目的
h) 熱交換器のプライミング及び操作手順
i)
プライミング手順
j)
血液,ガス,水の流れ方向
k) 通常使用時の一般的な操作手順
l)
人工肺の術中交換に関する推奨手順
m) 最高推奨血液流量及び最低推奨血液流量
n) 一体型貯血槽を含む血液経路における最大及び使用時最小血液容量
o) 最大及び最小ガス流量
p) 熱交換性能係数
q) 残血量
r) ガス交換能
s)
血液経路,水経路,及びガス経路における圧力限度
t)
要求に応じて,次の事項を提供できるという記載
1) 滅菌方法
2) 血液経路に使用されている原材料リスト
3) 半透膜の血しょう漏れに関するデータ(該当する場合)
4) 臨床使用を目的として製造業者が指定した最大血液流量における血液経路の圧力損失
5) 臨床使用を目的として製造業者が指定した最大血液及びガス流量におけるガス経路の圧力損失
6) 血球損傷に関する情報
7) 人工肺からの微粒子放出に関する情報

9
T 3230:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
8) 提供されたデータの許容範囲
注記1 7.1〜7.3の要件は,JIS T 0307に指定する適切な記号を使用することによって,これに替え
てもよい。
注記2 JIS T 0307に規定する主な記号の例を参考表1に示す。
参考表1−JIS T 0307に規定する主な記号の例
7.4
添付文書で目立つように提供しなければならない情報
次の情報は,添付文書で,目立つように記載する。
a) 圧力限度
b) 流量限度
c) 血液量限度
d) 他の機器の制限
8
包装
8.1
一次包装
一次包装は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に内容製品を適切に保護できるものとする。一度開封したら包装は簡単に再シールできず,
開封されたことが容易に分からなければならない。
8.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもつものとする。
10
T 3230:2008
附属書JA
(参考)
JISと対応する国際規格との対比表
JIS T 3230 : 2008 人工肺
ISO 7199 : 1996 Cardiovascular implants and artificial organs−Blood-gas exchangers
(oxygenators)
(Ⅰ) JISの規定
(Ⅱ)
国際規格
番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
1適用範
囲
1
変更
植込み形人工肺及び個別の熱
交換器に理解しやすいように
括弧書きを入れた。
実質的な差異はない。
2 引用規
格
JIS T 0993-1
ISO 10993-11
JIS 1規格及び
ISO 1規格
2
ISO 10993-1
ISO 10993-7
ISO 10993-11
ISO 11134
ISO 11135
ISO 13485
ISO 13488
ISO 7規格
変更
国内基準と同等の引用規格は,
国内基準を優先させるため削
除した。
本文中に引用のない規格につ
いては削除し,引用している規
格を追加した。
実質的な差異はない。
3用語及
び定義
3.3 試験
用血液
3
3.3
ウシの血
変更
試験用血液と称した方がふさ
わしいため名称を変更した。
試験媒体について,ブタを追加
し血液として定義した。
実質的な差異はない。
4構成
追加
概略図を追加した。
実質的な差異はない。
4
T
3
2
3
0
:
2
0
0
8
4
T
3
2
3
0
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11
T 3230:2008
(Ⅰ) JISの規定
(Ⅱ)
国際規格
番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5要求事
項
5.2.4 コネ
クタ
JIS T 3250を引用
4
4.2.4
JISにほぼ同じ
変更
国内基準と同等の引用規格は
国内基準を優先した。
実質的な差異はない。
6試験及
び測定
6.2.1 無菌
性及び非
発熱性
無菌性については,
滅菌バリデーショ
ン基準を基とした
5
5.1.1
JISにほぼ同じ
変更
国内基準を優先し,同等の箇所
は削除して記載表現を整備し
た。
実質的な差異はない。
6.3 物理
的特性
6.3.1.2 手
順
5.2
5.2.1.2
JISにほぼ同じ
変更
試験時間を6時間のみとした。
実質的な差異はない。
6.3.3.1 試
験液
血液容量の測定に
用いる試験液
5.2.3.1
JISにほぼ同じ
追加
変更
ブタを追加した。
試験液を血液のみとした。
実質的な差異はない。
6.3.3.2 手
順
5.2.2.2
JISにほぼ同じ
変更
試験時間を6時間までとした。 実質的な差異はない。
6.4 性能
特性
6.4.1.1 試
験媒体
ガス交換の測定に
用いる試験媒体
5.3
5.3.1.1
JISにほぼ同じ
追加
変更
ブタを追加した。
試験液を血液だけとした。
実質的な差異はない。
6.4.2.1 試
験液
熱交換性能係数の
測定に用いる試験
液
5.3.1.1
JISにほぼ同じ
追加
ブタを追加した。
実質的な差異はない。
6.4.3.1 試
験媒体
血球損傷の測定に
用いる試験媒体
5.3.3.1
JISにほぼ同じ
追加
ブタを追加した。
実質的な差異はない。
7 表示
7.1 製品
6
6.1
削除
製造元,バッチ,ロット又はシ
リアル番号及び品番を削除し
た。
一次包装と重複するため。
実質的差異はない。
4
T
3
2
3
0
:
2
0
0
8
4
T
3
2
3
0
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
12
T 3230:2008
(Ⅰ) JISの規定
(Ⅱ)
国際規格
番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
条番号及
び名称
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
7.2.1 一次
包装
6.2.1
JISにほぼ同じ
削除
製造元の氏名及び住所を削除
した。
記号の使用についての記述を
削除した。
二次包装と重複するため。
実質的差異はない。
7.3 に注記として記載した。
7.2.2 二次
包装
6.2.3
JISにほぼ同じ
追加
二次包装を用いない場合の扱
いを追加した。
実質的差異はない。
7.3 添付
文書に記
載する情
報
7.1〜7.3における記
号の使用を規定
6.3
変更
7.1〜7.3における記号の使用
を規定した。
7.1〜7.3における記号の使用を規
定した。
8包装
7
JISにほぼ同じ
追加
一次包装と二次包装を区別し,
明確に規定した。
理解を容易にした。
実質的差異はない。
JISと国際規格との対応の程度の全体評価:ISO 7199 : 1996,MOD
被引用法規
薬事法
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
4
T
3
2
3
0
:
2
0
0
8
4
T
3
2
3
0
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。





