T 3219:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 2
5 物理的要求事項 ················································································································ 3
5.1 透明性 ························································································································· 3
5.2 清浄度 ························································································································· 3
5.3 引張強さ ······················································································································ 3
5.4 気密性 ························································································································· 3
5.5 おすめす(雄雌)かん(嵌)合部······················································································ 3
5.6 保護キャップ ················································································································ 3
5.7 輸液フィルタ ················································································································ 3
5.8 ベント ························································································································· 4
6 化学的要求事項 ················································································································ 4
7 生物学的安全性 ················································································································ 4
8 無菌性の保証 ··················································································································· 4
9 エンドトキシン ················································································································ 4
10 包装 ····························································································································· 4
11 表示 ····························································································································· 4
11.1 一次包装 ····················································································································· 4
11.2 二次包装 ····················································································································· 4
11.3 記号の使用 ·················································································································· 5
附属書A(規定)物理試験 ····································································································· 6
附属書B(規定)輸液フィルタ孔径の評価法 ·············································································· 7
附属書JA(参考)JISと対応国際規格との対比表 ······································································· 8
T 3219:2011
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべきと
の申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3219:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3219:2011
滅菌済み輸液フィルタ
Sterile infusion filter
序文
この規格は,2004年に第1版として発行されたISO 8536-11を基とし,我が国の実情に合わせるため,
一部の技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,輸液剤中の微小異物,細菌及び真菌を除去して輸注するもので,そのまま直ちに使用でき,
かつ,単回使用で使い捨ての滅菌済み輸液フィルタ(以下,輸液フィルタという。)について規定する。た
だし,除去できる微小異物,細菌,真菌の大きさ及び菌種は,輸液フィルタの孔径によって異なる。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 8536-11:2004,Infusion equipment for medical use−Part 11: Infusion filters for use with pressure
infusion equipment(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
なお,平成26年7月28日までJIS T 3219:2005は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
注記 対応国際規格:ISO 15223,Medical devices−Symbols to be used with medical device labels,
labelling and information to be supplied(IDT)
JIS T 3211:2011 滅菌済み輸液セット
注記 対応国際規格:ISO 8536-4,Infusion equipment for medical use−Part 4: Infusion sets for single use,
gravity feed及びISO 8536-8,Infusion equipment for medical use−Part 8: Infusion equipment for
use with pressure infusion apparatus(全体評価:MOD)
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes,needles and certain other medical
equipment−Part 2: Lock fittings
3
用語及び定義

2
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
この規格で用いる主な用語及び定義は,次による。
3.1
精製水
日本薬局方(以下,日局という。)の医薬品各条に規定する“精製水”,又はこれと同等以上の水。
3.2
エンドトキシン試験用水
日局の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキシン試
験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3.3
一次包装
輸液フィルタを直接に覆う包装で,輸液フィルタの無菌性を保持するためのもの。さらに,これが二次
包装される場合には,いわゆる“内袋”に該当する。ただし,無菌性を保持しないものもあり,その場合
には,保護キャップで輸液フィルタ内部の無菌性を保持する。
3.4
二次包装
一次包装を直接に覆う包装。通常,複数の一次包装された輸液フィルタ,例えば50セットを入れた包装。
3.5
おすめす(雄雌)かん(嵌)合部
おす(雄)又はめす(雌)のかん(嵌)合部が,テーパ及びはめ合い(ロック式)の構造によって,器
具と器具との接続及び離脱が可能な部分。
3.6
保護キャップ
おすめす(雄雌)かん(嵌)合部が直接外部に触れることを防ぐためのキャップ。
3.7
輸液フィルタ
輸液剤中の微小異物,細菌及び真菌を除去するフィルタ。
3.8
ベント
輸液フィルタの容器内から空気を排出する装置。
3.9
バクテリアチャレンジ試験
輸液フィルタ一次側から指標となる菌を含む試験液を注入し,二次側から出てきた試験液を培養するこ
とで,輸液フィルタの菌捕捉性能を評価し,指標菌の大きさから,輸液フィルタの孔径を確認する試験。
4
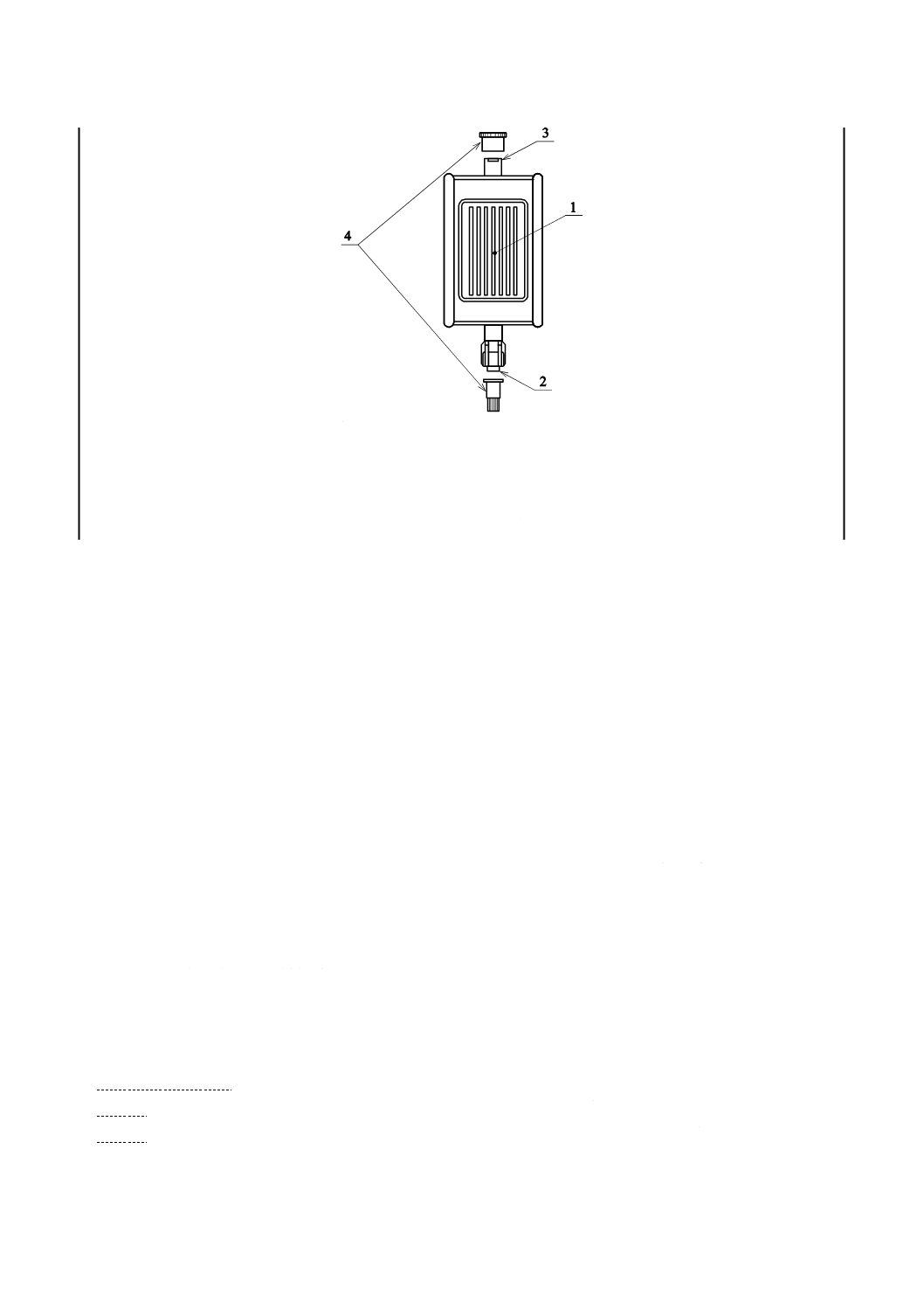
構成及び各部の名称
輸液フィルタは,輸液フィルタ及びおすめす(雄雌)かん(嵌)合部で構成する。また,これらに,保
護キャップを附属してもよい。
なお,輸液フィルタは,自然落下によって輸注を行うものと,ポンプによって輸注を行うものとがある。
一般的な輸液フィルタの例を,図1に示す。
3
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
輸液フィルタ
2
おす(雄)かん(嵌)合部
3
めす(雌)かん(嵌)合部
4
保護キャップ
図1−輸液フィルタの構成及び各部の名称例
5
物理的要求事項
5.1
透明性
輸液フィルタ容器は,透明でなければならない。A.1によって試験したとき,空気−水の界面が判別可
能でなければならない。
5.2
清浄度
清浄度は,目視で検査したとき,内面に微粒子又は異物の付着があってはならない。
5.3
引張強さ
輸液フィルタは,A.2によって試験したとき,15 Nの力で15秒間の引張りに耐える引張強さをもたなけ
ればならない。
5.4
気密性
輸液フィルタは,微生物の侵入を防止する気密性をもたなければならない。輸液フィルタの先端を閉じ
た後,20〜30 ℃の水中に入れ,輸液フィルタの先端から内圧50 kPaで15秒間空気を送り込んだとき,空
気漏れがあってはならない。また,ポンプ用輸液フィルタにおいては,A.3.1及びA.3.3によって試験した
とき,空気及び水漏れがなく,かつ,A.3.2によって試験したとき,空気が入ってはならない。
5.5
おすめす(雄雌)かん(嵌)合部
おすめす(雄雌)かん(嵌)合部は,ISO 594-2に適合しなければならない。また,ポンプ用輸液フィ
ルタは,A.4によって試験したとき,かん(嵌)合部から水漏れがあってはならない。
5.6
保護キャップ
保護キャップは,確実に装着でき,かつ,容易に外せるものでなければならない。
5.7
輸液フィルタ
5.7.1
輸液フィルタの孔径は,0.2 μm,0.45 μm又は0.8 μmでなければならない。
5.7.2
バクテリアチャレンジ試験を用いて,附属書Bによって適切な試験を行い,輸液フィルタの孔径
を確認する。
4
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.8
ベント
輸液フィルタ容器にベントをもつものは,次の規定に適合しなければならない。
a) ベントは,輸液フィルタ容器の一次側に位置しており,微生物の通過を防止するベントフィルタをも
つものとする。
b) ベントフィルタは,輸液フィルタ容器の一次側にある空気が通り,空気を外気へ排出するものとする。
6
化学的要求事項
輸液フィルタの化学的要求事項は,JIS T 3211の箇条6に適合しなければならない。
7
生物学的安全性
輸液フィルタの生物学的安全性は,JIS T 3211の箇条7に適合しなければならない。
8
無菌性の保証
輸液フィルタの無菌性の保証は,JIS T 3211の箇条8に適合しなければならない。
9
エンドトキシン
輸液フィルタのエンドトキシンは,JIS T 3211の箇条9に適合しなければならない。
10 包装
輸液フィルタの包装は,JIS T 3211の箇条10に適合しなければならない。
11 表示
11.1 一次包装
一次包装には,次の事項を表示する。
a) 輸液フィルタ孔径(μm)
b) “滅菌済み”の旨
c) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
d) ポンプ用輸液フィルタの試験に適合しない輸液フィルタは,“輸液ポンプに使用できない”旨,又は特
定の輸液ポンプと組合せ使用で安全が保証される場合には,その輸液ポンプの機種名
e) 製造番号又は製造記号
f)
天然ゴムを原材料として用いているものは,その旨
g) 一次包装で無菌性を保証しないものは,その旨
11.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合には,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名

5
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 輸液フィルタ孔径(μm)
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) ポンプ用輸液フィルタの試験に適合しない輸液フィルタは,“輸液ポンプに使用できない”旨,又は特
定の輸液ポンプと組合せ使用で安全が保証される場合には,その輸液ポンプの機種名
i)
製造番号又は製造記号
j)
滅菌年月
k) 使用方法及び使用上の注意
11.3 記号の使用
11.1及び11.2は,JIS T 0307に規定する適切な記号を使用することによって,これに替えてもよい。
注記 JIS T 0307に規定する主な記号の例を,表1に示す。
表1−JIS T 0307に規定する記号の例

6
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
物理試験
A.1 透明性試験
通常の条件下で輸液フィルタを蒸留水で充塡する。このとき,液相と気相との界面が目
視で判別できるかどうかを調べる。
A.2 引張強さ試験
長手方向に15秒間,15 Nの静的引張力を加える。接続部及び構成部品が適用された試
験の力に耐えるかどうかを調べる。
A.3 気密性試験
(ポンプ用)
A.3.1 輸液フィルタを圧縮空気供給装置に接続する。その後,他の開口部全てを閉じ,
23±1 ℃及び40±1 ℃で空気を輸液フィルタ内に送り,50 kPaの圧力を15秒間加え,
空気漏れがないかを調べる。
A.3.2 脱気した蒸留水を輸液フィルタ内に満たしてから,輸液フィルタを真空装置に接
続し,他の開口部全てを閉じ,23±1 ℃及び40±1 ℃で20 kPaで15秒間減圧し,輸液
フィルタ内に空気の侵入があるかを調べる(ベントからの侵入を除く。)。
A.3.3 蒸留水を輸液フィルタ内に満たしてから,輸液フィルタを圧縮空気供給装置に接
続し,他の開口部を全て閉じ,23±1 ℃及び40±1 ℃で150 kPaの圧力を15分間加え,
水漏れがないかを調べる。
A.4 おすめす(雄雌)か
ん(嵌)合部に関する気
密性試験
(ポンプ用)
おすめす(雄雌)かん(嵌)合部は,ISO 594-2の5.1に規定されたリファレンスコネク
タで密封し,そのかん(嵌)合部を蒸留水で満たして,23±1 ℃及び40±1 ℃で150 kPa
の圧力を15分間加え,かん(嵌)合部に水漏れがないかを調べる。

7
T 3219:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
輸液フィルタ孔径の評価法
(フィルタの孔径:0.2 μm)
試験液の調製:Brevundimonas diminuta ATCC 19146 a) を日局無菌試験用チオグリコール酸培地IIを用いて30〜32 ℃
で24時間培養後,この培養液2 mLをとり,滅菌した加乳糖ブイヨン1 000 mLに入れ,30〜32 ℃
で24時間培養するb)。この培養液を生理食塩水で希釈し試験液とする。最終の希釈は,同培地を用
いて希釈するc)。ただし,この試験液1 mLに含まれる菌数は,約106個とする。
操作及び培養:試験液15 mLを注射筒にとり,注射筒の先端に輸液フィルタを付け,試験液をゆっくりと,ほとん
ど全て押し出し,この流出液を試験管にとる。流出液の入った試験管を30〜32 ℃で少なくとも7日
間培養する。このとき,輸液フィルタ内に残った試験液は,注射筒を用いて空気圧で押し出す。
判 定:この培養液について,肉眼的に菌の発育を認めたときは,不適であると判定する。
(フィルタの孔径:0.45 μm)
試験液の調製:Serratia marcescens d) を日局無菌試験用チオグリコール酸培地IIを用いて30〜32 ℃で24時間培養
後,生理食塩水で希釈し試験液とする。最終の希釈は,同培地を用いて希釈するc)。ただし,この試
験液1 mLに含まれる菌数は,約104個とする。
操作及び培養:試験液15 mLを注射筒にとり,注射筒の先端に輸液フィルタを付け,試験液をゆっくりと,ほとん
ど全て押し出し,この流出液を試験管にとる。流出液の入った試験管を30〜32 ℃で少なくとも7日
間培養する。このとき,輸液フィルタ内に残った試験液は,注射筒を用いて空気圧で押し出す。
判 定:この培養液について,肉眼的に菌の発育を認めたときは,不適であると判定する。
(フィルタの孔径:0.8 μm)
試験液の調製:Sacharomyces cerevisiae e) を日局無菌試験用ブドウ糖・ペプトン培地を用いて20〜25 ℃で24時間培
養後,生理食塩水で希釈し試験液とする。最終の希釈は,同培地を用いて希釈するc)。ただし,この
試験液1 mLに含まれる菌数は,約103個とする。
操作及び培養:試験液15 mLを注射筒にとり,注射筒の先端に輸液フィルタを付け,試験液をゆっくりと,ほとん
ど全て押し出し,この流出液を試験管にとる。流出液の入った試験管を20〜25 ℃で少なくとも10
日間培養する。このとき,輸液フィルタ内に残った試験液は,注射筒を用いて空気圧で押し出す。
判 定:この培養液について,肉眼的に菌の発育を認めたときは,不適であると判定する。
注a) Brevundimonas diminuta ATCC 19146は,この種のメンブレンフィルタの菌捕捉性能評価試験に一般的に用い
られている細菌で,財団法人発酵研究所にも同じものがIFO14213として保存されている。
b) 加乳糖ブイヨンの調製法は,ASTM F 838-83に準じて行うことができる。
c) 最終の希釈を培地で行う理由は,試験液のろ過液をそのまま培養するため,ろ過液が菌の発育に十分な栄養
状態である必要からである。
d) Serratia marcescensは,無菌試験に用いられるメンブレンフィルタの菌捕捉性能評価試験に一般的に用いられ
ている細菌で,財団法人発酵研究所などの保存機関から入手できる。
e) Sacharomyces cerevisiaeは,発酵工業又は醸造工業に広く利用されている有胞子酵母で,財団法人発酵研究所
などの保存機関から入手できる。
8
T
3
2
1
9
:
2
0
11
8
T
3
2
1
9
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3219:2011 滅菌済み輸液フィルタ
ISO 8536-11:2004 Infusion equipment for medical use−Part 11: Infusion filters for use
with pressure infusion equipment
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの
評価及びその内容
(V)JISと国際規格との技術的
差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 滅菌済み輸液フィルタ
について規定。
1
200 kPaまで加圧される
単回使用滅菌済み輸液フ
ィルタについて規定。微
小異物,細菌及び真菌の
除去性能は含まない。
変更
JISは,150 kPaまで加圧される輸液フ
ィルタについて規定し,微小異物,細
菌及び真菌の除去性能を含む。
微小異物,細菌及び真菌の除
去を含めて,輸液フィルタの
性能を明確にした。
2 引用規格
2
3 用語及び
定義
9項目の用語及び定義
を規定。
3
加圧される輸液フィルタ
だけを定義。
追加
JISは,必要な用語及び定義を追加し
た。
使用者の利便性のため。
4 構成及び
各部の名称
輸液フィルタの構成を
規定。
4
ベントの具備について規
定。
追加
JISは,必要な構成及び各部の名称を
追加した。
使用者の利便性のため。
−
−
5
材料について規定。
削除
JISでは必要のない箇条である。
箇条の整理のため。実質的な
差異はない。
5 物理的要
求事項
5.1 透明性
6.1
一致
−
5.2 清浄度
6.2
JISとほぼ同じ。
変更
JISは,定性的規定であるが,ISO規
格は定量的に規定している。
JISの規定内容で十分に実績
がある。
5.3 引張強さ
6.3
一致
−
5.4 気密性
6.4
JISとほぼ同じ。
変更
JISは,自然落下によって輸注を行う
ものと,ポンプによって輸注を行うも
のとを明確にした。JISは試験圧力が
低い。
JISの規定試験圧力で十分に
実績がある。
5.5 おすめす(雄雌)
かん(嵌)合部
6.5
JISとほぼ同じ。
変更
JISは,試験圧力が低い。
JISの規定試験圧力で十分に
実績がある。
9
T
3
2
1
9
:
2
0
11
9
T
3
2
1
9
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの
評価及びその内容
(V)JISと国際規格との技術的
差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5 物理的要
求事項
(続き)
5.6 保護キャップ
6.6
ISO 8536-4による。
変更
JISは,表現が異なる。
実質的な差異はない。
5.7 輸液フィルタ
−
−
追加
JISは,輸液剤中の微小異物,細菌及
び真菌の除去性能について規定した。
JISの規定内容で十分に実績
がある。
5.8 ベント
−
−
追加
JISは,ベントの要求事項を追加した。 実質的な差異はない。
6 化学的要
求事項
JIS T 3211による。
7
ISO 8536-4による。
選択
JIS T 3211では,ISO 8536-4又は実績
のあるJIS独自の方法(溶出物試験第
一法)も選択可能とした。
JISの規定内容で十分に実績
があり,実質的な差異はない。
7 生物学的
安全性
JIS T 3211による。
8
ISO 8536-4による。
一致
JIS T 3211とISO 8536-4の該当事項は
一致する。
−
8 無菌性の
保証
JIS T 3211による。
8.1
妥当性を評価した滅菌プ
ロセスによる(参考文献
参照)。
変更
JIS T 3211では,ISO 8536-4又は実績
のあるJIS独自の方法も選択可能とし
た。
JISの規定内容で十分に実績
があり,実質的な差異はない。
9 エンドト
キシン
JIS T 3211による。
8.2
ISO 8536-4による。
選択
JIS T 3211では,ISO 8536-4又は実績
のあるJIS独自の方法も選択可能とし
た。
JISの規定内容で十分に実績
があり,実質的な差異はない。
−
−
8.3
溶血性について規定。
削除
−
JISの箇条7(生物学的安全性)
に包含される。実質的な差異
はない。
10 包装
JIS T 3211による。
9
ISO 8536-4による。
追加
JISは,ISO規格よりも細かく規定し
た。
JISの規定内容で十分に実績
があり,実質的な差異はない。
11 表示
一次包装及び二次包装
に表示すべき事項を規
定。
10
JISとほぼ同じ。
変更
JISは,独自の内容に一部変更した。 JISの規定内容で十分に実績
があり,実質的な差異はない。
附属書A
(規定)
A.1 透明性試験
Annex A
一致
−
−
ISO 8536-4による。
清浄度について規定。
削除
JISは,附属書ではなく,本文で規定
した。
JISの規定内容で十分実績が
ある。
A.2 引張強さ試験
一致
−
A.3 気密性試験
(ポンプ用)
JISとほぼ同じ。
追加
JISは,自然落下によって輸注を行う
ものと,ポンプによって輸注を行うも
のとを明確にした。JISは試験圧力が
低い。
JISの規定試験圧力で十分に
実績がある。
1
0
T
3
2
1
9
:
2
0
11
1
0
T
3
2
1
9
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの
評価及びその内容
(V)JISと国際規格との技術的
差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書A
(規定)
(続き)
A.4 おすめす(雄雌)
かん(嵌)合部に関す
る気密性試験
(ポンプ用)
JISとほぼ同じ。
変更
JISは,自然落下によって輸注を行う
ものと,ポンプによって輸注を行うも
のとを明確にした。JISは試験圧力が
低い。
JISの規定試験圧力で十分に
実績がある。
−
Annex B ISO 8536-4による。
化学的要求事項について
規定。
削除
JISは,附属書でなく,本体で規定し
た。
JISの規定内容で十分に実績
があり,実質的な差異はない。
附属書B
(規定)
輸液フィルタ孔径の評
価法
−
−
追加
JISは,輸液フィルタ孔径の評価法に
ついて規定した。
微小異物,細菌及び真菌の除
去を含めて,輸液フィルタの
性能を明確にした。
JISと国際規格との対応の程度の全体評価:ISO 8536-11:2004,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ················ 技術的差異がない。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。







