T 3211-8:2019
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 一般要求事項 ··················································································································· 2
5 材料······························································································································· 5
6 物理的要求事項 ················································································································ 5
6.1 微粒子汚染 ··················································································································· 5
6.2 引張強さ ······················································································································ 5
6.3 気密性 ························································································································· 5
6.4 おす(雄)かん(嵌)合部 ······························································································ 5
6.5 混注部 ························································································································· 5
6.6 通液フィルタ ················································································································ 6
6.7 流量(この規格では不採用とした。) ················································································· 6
6.8 びん針 ························································································································· 6
6.9 通気装置 ······················································································································ 6
6.10 点滴筒及び点滴口 ········································································································· 6
6.11 導管 ··························································································································· 6
6.12 流量調節器 ·················································································································· 6
6.13 保護キャップ ··············································································································· 6
6.14 ストレージボリューム(この規格では不採用とした。) ························································ 6
7 化学的要求事項 ················································································································ 6
8 生物学的安全性 ················································································································ 6
9 包装······························································································································· 6
10 表示 ····························································································································· 6
10.1 一般 ··························································································································· 6
10.2 一次包装 ····················································································································· 6
10.3 二次包装 ····················································································································· 7
附属書A(規定)物理的試験 ·································································································· 8
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 10
T 3211-8:2019
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,一般社団法人日本医療機器テクノロジー協会
(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定す
べきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
JIS T 3211の規格群には,次に示す部編成がある。
JIS T 3211-4 第4部:自然落下式単回使用滅菌済み輸液セット
JIS T 3211-5 第5部:単回使用滅菌済み定量筒輸液セット
JIS T 3211-8 第8部:ポンプ用単回使用滅菌済み輸液セット
JIS T 3211-9 第9部:単回使用滅菌済みチューブ
JIS T 3211-10 第10部:単回使用滅菌済み輸液チューブの附属品
JIS T 3211-11 第11部:単回使用滅菌済み輸液フィルタ
JIS T 3211-12 第12部:単回使用滅菌済み逆止弁
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3211-8:2019
滅菌済み輸液セット−
第8部:ポンプ用単回使用滅菌済み輸液セット
Sterile infusion administration set-
Part 8: Sterile infusion sets for single use with pressure infusion apparatus
序文
この規格は,2015年に第2版として発行されたISO 8536-8を基とし,我が国の実情に合わせるため,
技術的内容を変更して作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,最大200 kPa{2 bar}までの加圧式輸液装置で用いる単回使用のポンプ用滅菌済み輸液セ
ット(以下,輸液セットという。)について規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 8536-8:2015,Infusion equipment for medical use−Part 8: Infusion sets for single use with pressure
infusion apparatus(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 3211-4 滅菌済み輸液セット−第4部:自然落下式単回使用滅菌済み輸液セット
注記 対応国際規格:ISO 8536-4,Infusion equipment for medical use−Part 4: Infusion sets for single use,
gravity feed(MOD)
ISO 15223-1,Medical devices−Symbols to be used with medical device labels, labelling and information to be
supplied−Part 1: General requirements
ISO 80369-7:2016,Small-bore connectors for liquids and gases in healthcare applications−Part 7: Connectors
for intravascular or hypodermic applications
3
用語及び定義
この規格で用いる主な用語及び定義は,JIS T 3211-4による。
2
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
一般要求事項
4.1
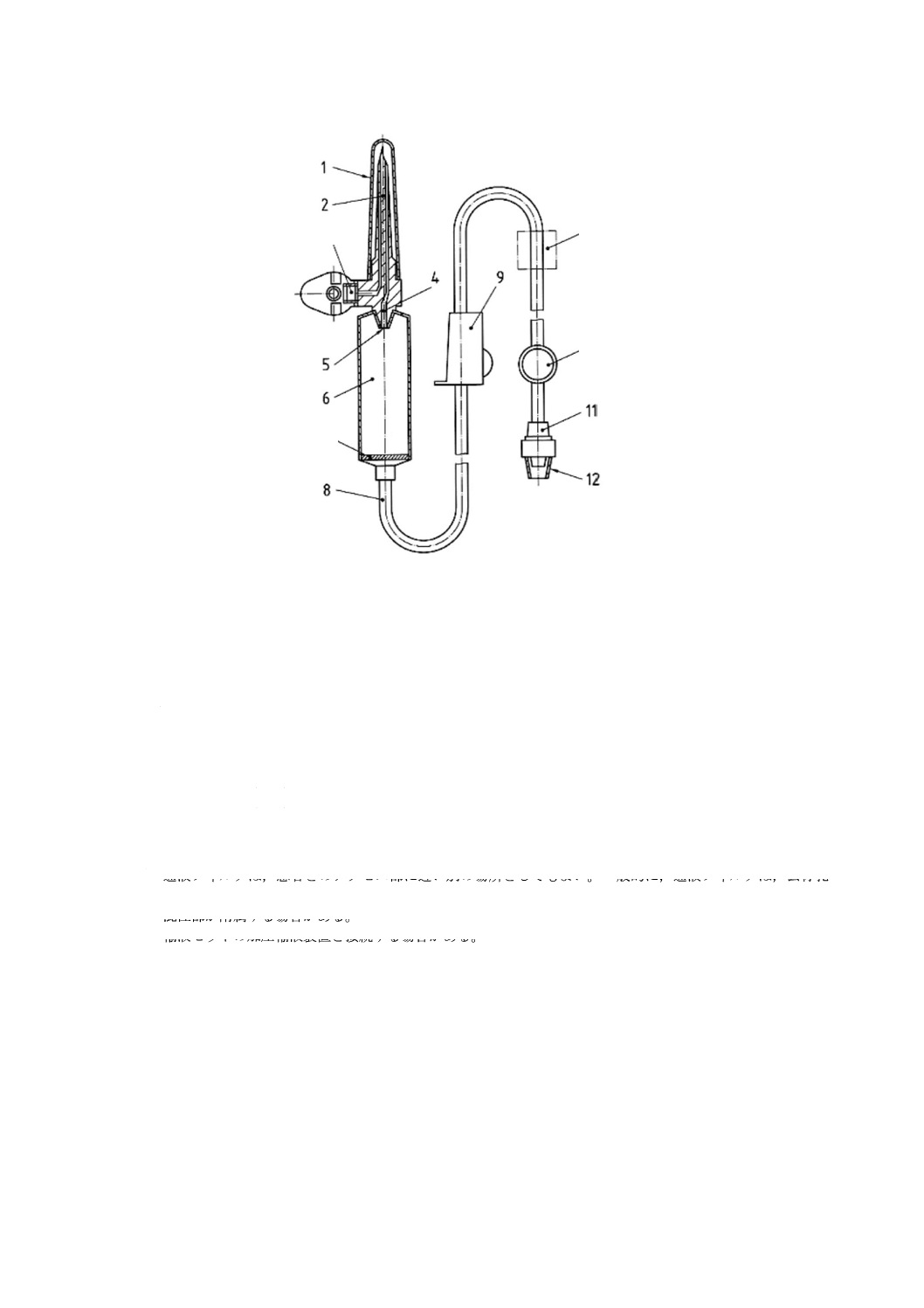
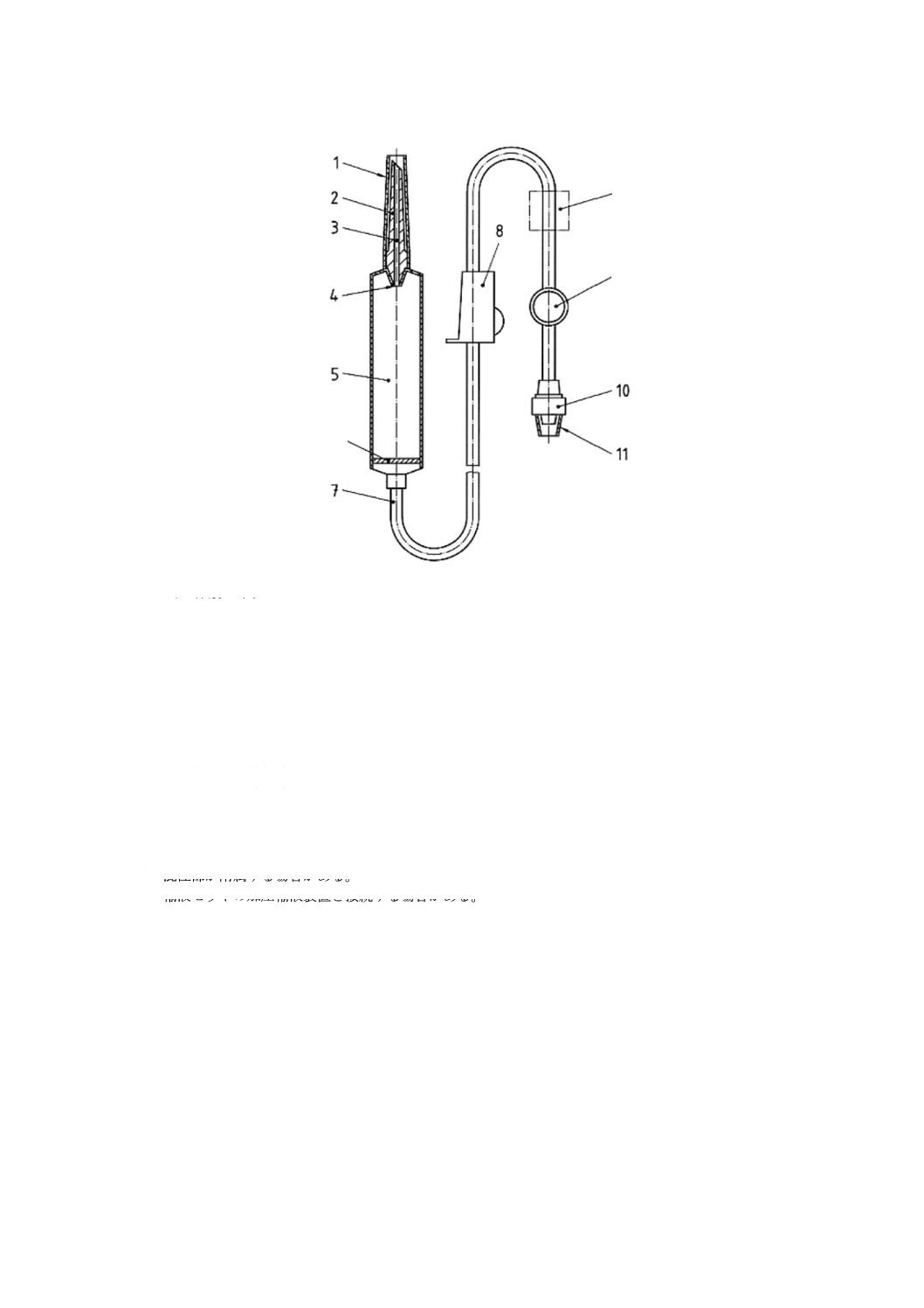
輸液セット及び分離した通気装置に使う部位の名称を,図1〜図3に示す。これらの図は,輸液セッ
ト及び通気装置の形状例の図示である。同様の結果を導くものであれば,他の形状を使用してもよい。図
2に図示したような輸液セットは,折りたたみ可能なプラスチック製の容器だけに使用するのが望ましい。
図1に図示したような輸液セット,又は図2に図示したような輸液セットを図3のような分離した通気装
置と一緒に使用する場合は,硬い容器を使用しなければならない。
4.2
輸液セットは,セットが使用されるまで,びん針,おす(雄)かん(嵌合部)又は針を覆う保護キ
ャップが付いていなければならない。通気装置は,針又はびん針を覆う保護キャップが付いていなければ
ならない。
3
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 びん針の保護キャップ
2 びん針
3 通気フィルタ
4 液体流路
5 点滴口
6 点滴筒
7 通液フィルタ
8 導管
9 流量調節器
10 混注部
11 おす(雄)かん(嵌)合部
12 おす(雄)かん(嵌)合部の保護キャップ
13 フローエレメント
注a) 空気注入孔の通気フィルタが附属する場合がある。
b) 通液フィルタは,患者とのアクセス部に近い別の場所としてもよい。一般的に,通液フィルタは,公称孔
径15 μmを使用する。
c) 混注部が附属する場合がある。
d) 輸液セットの加圧輸液装置と接続する場合がある。
図1−通気式輸液セットの例
3 a)
13 d)
10 c)
7 b)
4
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 びん針の保護キャップ
2 びん針
3 液体流路
4 点滴口
5 点滴筒
6 通液フィルタ
7 導管
8 流量調節器
9 混注部
10 おす(雄)かん(嵌)合部
11 おす(雄)かん(嵌)合部の保護キャップ
12 フローエレメント
注a) 通液フィルタは,患者とのアクセス部に近い別の場所としてもよい。一般的に,通液フィルタは,公称孔径
15 μmを使用する。
b) 混注部が附属する場合がある。
c) 輸液セットの加圧輸液装置と接続する場合がある。
図2−通気なし式輸液セットの例
12 c)
9 b)
6 a)

5
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 保護キャップ
2 針又はびん針
3 チューブ
4 クランプ
5 通気フィルタ付き吸気口
注a) 容器内に空気の供給を一時的に遮断するための部品。同様な安全性が保証されるのであれば,他の形状でも
よい。
図3−通気装置の例
5
材料
輸液セット及びその構成品の材料は,箇条6の規定に適合しなければならない。液体に接する部分の輸
液セットの構成品の材料は,更に箇条7及び箇条8の規定に適合しなければならない。
6
物理的要求事項
6.1
微粒子汚染
A.1に適合しなければならない。
6.2
引張強さ
A.2に規定する試験を行ったときに,輸液セットは,保護キャップを除き,15 N以上の引張力に15秒間
耐えなければならない。
6.3
気密性
輸液セットは,空気,微生物及び液体に対し不浸透性でなければならない。
A.3.1の条件下でA.3.2及びA.3.4に従い試験を行ったときに,空気及び水が漏れてはならない。A.3.3
に従い試験を行ったときに,空気の侵入があってはならない。
6.4
おす(雄)かん(嵌)合部
おす(雄)かん(嵌)合部は,ISO 80369-7に適合しなければならない。
6.5
混注部
混注部は,次の規定のいずれかに適合しなければならない。
a) 金属針を用いて混注し,再シール性をもつ混注部は,A.4に従い試験を行ったとき,再シールされな
ければならない。また,1滴を超える水滴が漏れてはならない。再シール性をもつ混注部を備えてい
るときは,混注部は,おす(雄)かん(嵌)合部の近くに配置するのがよい。
b) 針不使用式の混注部は,製造販売業者が指定するおす(雄)側器具を用いて10分間接続後,離脱する
3 a)
4 a)
6
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
操作を10回行った後に,水圧200 kPaを15秒間加えたとき,漏れがあってはならない。
6.6
通液フィルタ
JIS T 3211-4に適合しなければならない。
6.7
流量(この規格では不採用とした。)
6.8
びん針
JIS T 3211-4に適合しなければならない。
6.9
通気装置
JIS T 3211-4に適合しなければならない。
6.10
点滴筒及び点滴口
JIS T 3211-4に適合しなければならない。
6.11
導管
JIS T 3211-4に適合しなければならない。
6.12
流量調節器
JIS T 3211-4に適合しなければならない。
6.13
保護キャップ
JIS T 3211-4に適合しなければならない。
6.14
ストレージボリューム(この規格では不採用とした。)
7
化学的要求事項
JIS T 3211-4に適合しなければならない。
8
生物学的安全性
JIS T 3211-4に適合しなければならない。
9
包装
JIS T 3211-4に適合しなければならない。
10
表示
10.1
一般
表示には,10.2及び10.3に規定している要求事項を含まなければならない。図記号を使用する場合は,
ISO 15223-1による。
注記 影響ある物質の存在は,その物質の略語“XXX”を変更し,ISO 7000の図記号2725を使用し
て示すことができる。影響ある物質がないことを,個々の記号に斜線を入れることで示すこと
ができる。
10.2
一次包装
一次包装には,少なくとも次の情報を表示しなければならない。
a) 製造販売業者の氏名又は名称及び住所
b) 内容物の説明
c) 適切な文言,又はISO 15223-1に規定する図記号を用いた“滅菌済み”の表示
d) “LOT”の文字を前置きしたロット(バッチ)の表記,又はISO 15223-1に規定する図記号を用いた
7
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ロット(バッチ)の表記
e) 適切な用語,又はISO 15223-1に規定する図記号を用いた使用期限の年月
f)
輸液セットが単回使用であることの表示。同等の文言での表示,又はISO 15223-1に規定する図記号
を用いての表示でもよい。
g) 使用上の注意。添付文書でもよい。
h) 点滴筒から供給する蒸留水の滴数の20滴又は60滴の液量が1 mL±0.1 mL又は質量が1 g±0.1 gに相
当する旨
上記情報の判読可能な文字及び/又は記号を記載するために使用できる場所が小さい場合は,d) 及び
e) だけでもよい。この場合,この細分箇条で要求する情報は,二次包装に表示しなければならない。
10.3
二次包装
二次包装には,少なくとも次の情報を表示しなければならない。
a) 製造販売業者の氏名又は名称及び住所
b) 内容物の説明
c) 適切な文言,又はISO 15223-1に規定する図記号を用いた“滅菌済み”の表示
d) “LOT”の文字を前置きしたロット(バッチ)の表記,又はISO 15223-1に規定する図記号を用いた
ロット(バッチ)の表記
e) 適切な用語,又はISO 15223-1に規定する図記号を用いた使用期限の年月
f)
使用上の注意。添付文書でもよい。
g) 入り数
h) 保管条件
8
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
物理的試験
A.1 微粒子汚染試験
JIS T 3211-4のA.1に適合しなければならない。
A.2 引張強さ試験
輸液セットに対し,長手方向に引張力15 Nを15秒間加えて試験する。輸液セットが試験の力に耐える
かどうかを確認する。
A.3 気密性試験
A.3.1 試験開始時には,全ての試験システムの温度を試験温度と同じにしなければならない。
A.3.2 空気供給装置に輸液セットを接続し,開口部を閉じる。輸液セットの内部に50 kPaを15秒間加え
る。40 ℃±1 ℃の水中で空気漏れを試験する。
A.3.3 輸液セットを,40 ℃±1 ℃の蒸留水で満たす。開口部に封をして真空装置に接続する。15秒間内
部の−20 kPaの減圧を行う。輸液セットの上流部に空気が入るかどうかを試験する。
この試験は,輸液セットの上流側に適用する。
A.3.4 フローエレメントをもつ輸液セットの下流側の水を満たした部分について,200 kPaの圧力で15
分間試験する。専用セットの場合は,輸液ポンプの最大圧力を適用しなければならない。40 ℃±1 ℃で水
の漏れを試験する。
注記 フローエレメントがない輸液セットの場合,点滴筒下のチューブまでは,同一の条件で試験す
る。
A.4 混注部の試験
JIS T 3211-4のA.5に適合しなければならない。ただし,内部圧力は200 kPaとする。
A.5 フィルタの性能試験(この規格では不採用とした。)
9
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] JIS T 3211-9 滅菌済み輸液セット−第9部:単回使用滅菌済みチューブ
注記 原国際規格では,ISO 8536-9,Infusion equipment for medical use−Part 9: Fluid lines for single use
with pressure infusion equipmentを記載している。
[2] ISO 10993-4,Biological evaluation of medical devices−Part 4: Selection of tests for interactions with blood
[3] ISO 11135-1:2007,Sterilization of health care products−Ethylene oxide−Part 1: Requirements for
development, validation and routine control of a sterilization process for medical devices
[4] JIS T 0806-1 ヘルスケア製品の滅菌−放射線−第1部:医療機器の滅菌プロセスの開発,バリデーシ
ョン及び日常管理の要求事項
注記 原国際規格では,ISO 11137-1,Sterilization of health care products−Radiation−Part 1:
Requirements for development, validation and routine control of a sterilization process for medical
devicesを記載している。
[5] ISO 11137-2,Sterilization of health care products−Radiation−Part 2: Establishing the sterilization dose
[6] JIS T 0816-1 ヘルスケア製品の滅菌−湿熱−第1部:医療機器の滅菌プロセスの開発,バリデーショ
ン及び日常管理の要求事項
注記 原国際規格では,ISO 17665-1,Sterilization of health care products−Moist heat−Part 1:
Requirements for the development, validation and routine control of a sterilization process for
medical devicesを記載している。
[7] EN 15986,Symbol for use in the labelling of medical devices−Requirements for labelling of medical devices
containing phthalates
[8] European Pharmacopoeia
[9] United States Pharmacopeia
[10] 日本薬局方
[11] ISO 7000,Graphical symbols for use on equipment−Registered symbols
10
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
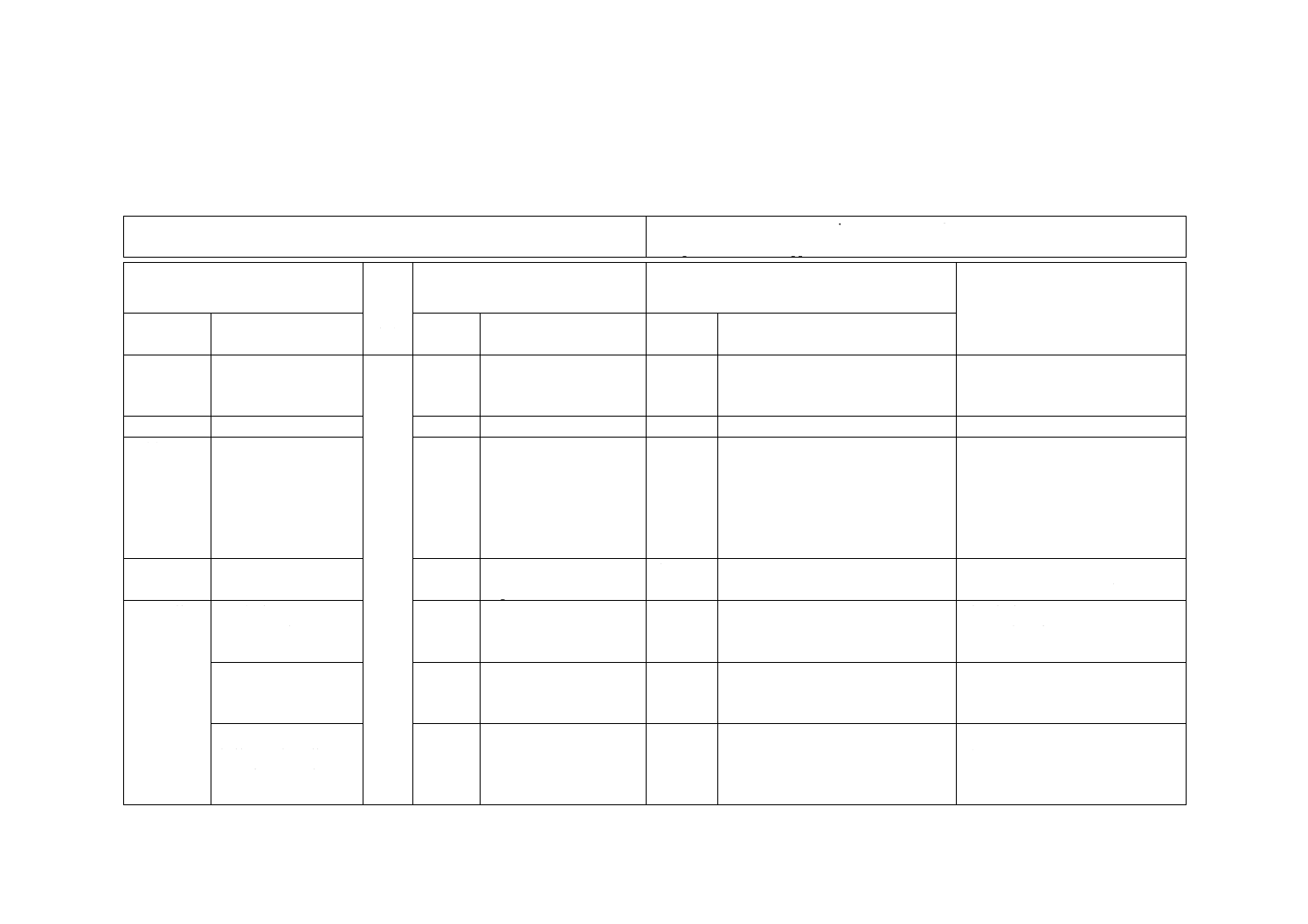
JISと対応国際規格との対比表
JIS T 3211-8:2019 滅菌済み輸液セット−第8部:ポンプ用単回使用滅菌済み輸
液セット
ISO 8536-8:2015,Infusion equipment for medical use−Part 8: Infusion sets for single use
with pressure infusion apparatus
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
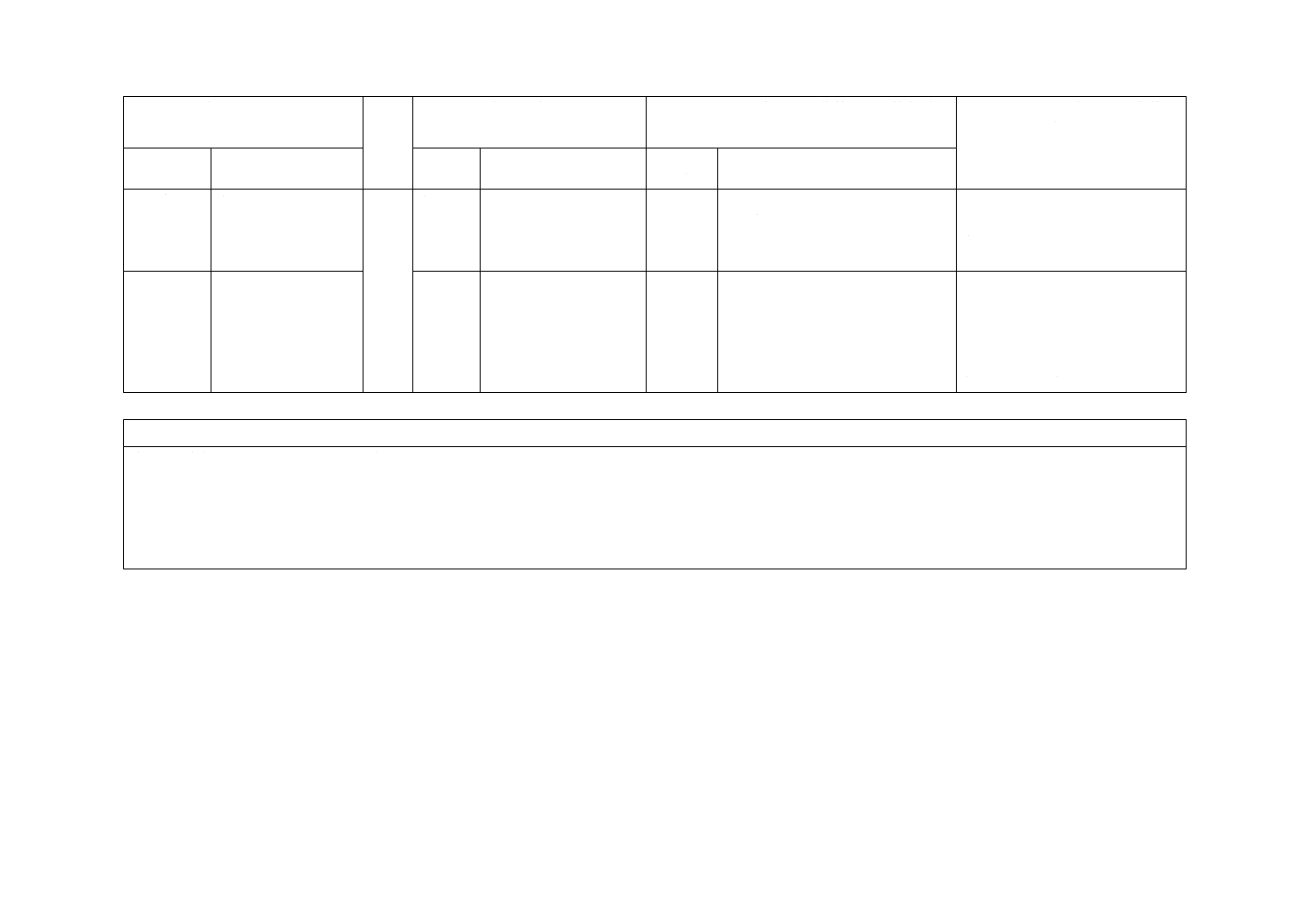
1 適用範囲
−
1
一部の国では,ISO
8536-8よりも法規が優
先される。
削除
この規格では,削除した。
各国の対応についての記載のた
め,削除した。
2 引用規格
3 用語及び
定義
JIS T 3211-4による。
3.1〜3.3 ストレージボリューム
の関連用語を定義
変更
この規格では,ストレージボリュー
ムを不採用とした。
ストレージボリュームの試験方法
が単一的であり,より複雑な導管
への対応が規定されていないた
め,不採用とした。次回改正時に
対応国際規格の動向などを考慮し
採用について検討する。
4 一般要求
事項
図1,図2,図3
4
Figure 2,Figure 3,
Figure 4
変更
この規格では,図1,図2,図3と
した。
ストレージボリュームを不採用と
したため,図の番号を修正した。
6 物理的要
求事項
6.3 気密性
“A.3.1の条件下で”
を追記
6.3
追加
この規格では,試験温度について追
記した。
試験条件をより明確にするため,
試験温度を追記した。
6.4 おす(雄)かん
(嵌)合部
ISO 80369-7を規定
6.4
ISO 594-2を規定
変更
この規格では,ISO 80369-7へ変更
した。
最新のISO 80369-7だけを適用す
るように変更した。
6.5 混注部
針使用と針不使用と
の場合の混注部を規
定
6.5
針使用の混注部につい
てだけ規定
追加
この規格では,針使用と針不使用と
の場合の混注部の規定とした。
JIS T 3211規格群として整合を図
る。
3
T
3
2
11
-8
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
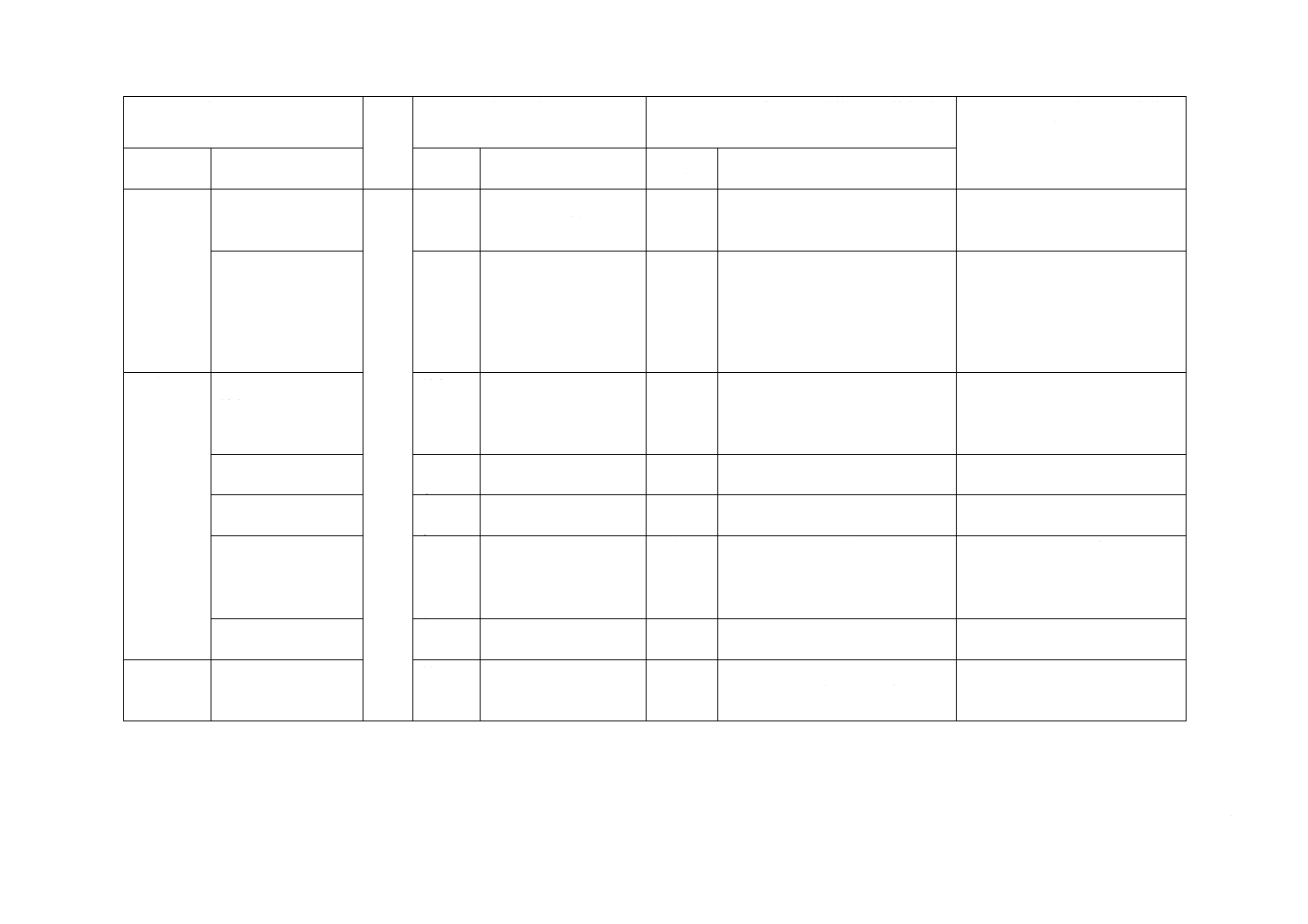
6 物理的要
求事項
(続き)
−
6.7
流量について規定
10分間に1 000 mL以上
と規定
削除
この規格では,流量規定を削除し
た。
国内流通品を考慮して不採用とし
た。
−
6.14
ストレージボリューム
について規定
削除
この規格では,ストレージボリュー
ムを不採用とした。
ストレージボリュームの試験方法
が単一的であり,より複雑な導管
への対応が規定されていないた
め,不採用とした。次回改正時に
対応国際規格の動向などを考慮し
採用について検討する。
10 表示
10.2 a)
10.3 a)
製造販売業者の氏名
又は名称及び住所
10.2 a),
10.3 a)
製造業者の名前及び住
所
変更
この規格では,医薬品医療機器等法
に従った記載とした。
技術的差異はない。
−
10.2
c)
発熱性及びエンドトキ
シンがないことの表示
削除
この規格では,削除した。
医薬品医療機器等法上も要求がな
いことから削除した。
−
10.2
i)
ストレージボリューム
の表示
削除
この規格では,削除した。
ストレージボリュームの規定を削
除したため,表示も削除した。
−
10.2
j)
10.3
f)
Pの表示
削除
この規格では,削除した。
PaediatricのPとの間違いの可能性
を考慮し,削除した。
10.3 g)
入り数
−
−
追加
この規格では,二次包装の表示とし
て“入り数”を追加した。
JIS T 3211-4と整合を図るため追
加した。
−
−
11
廃棄に関する規定
削除
廃棄物処理法で規定されているこ
とから,この規格では,不採用とし
た。
技術的差異はない。
3
T
3
2
11
-8
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
12
T 3211-8:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書A
(規定)
A.5 フィルタの性能
試験
(この規格では不採
用)
A.5
フィルタの性能試験
削除
この規格では,フィルタの性能試験
を不採用とした。
この規格では,通液フィルタは旧
規格を踏襲したため,不採用とし
た。
−
−
Annex B ストレージボリューム
についての試験方法
削除
この規格では,ストレージボリュー
ムを不採用とした。
ストレージボリュームの試験方法
が単一的であり,より複雑な導管
への対応が規定されていないた
め,不採用とした。次回改正時に
対応国際規格の動向などを考慮し
採用について検討する。
JISと国際規格との対応の程度の全体評価:ISO 8536-8:2015,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
T
3
2
11
-8
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。





