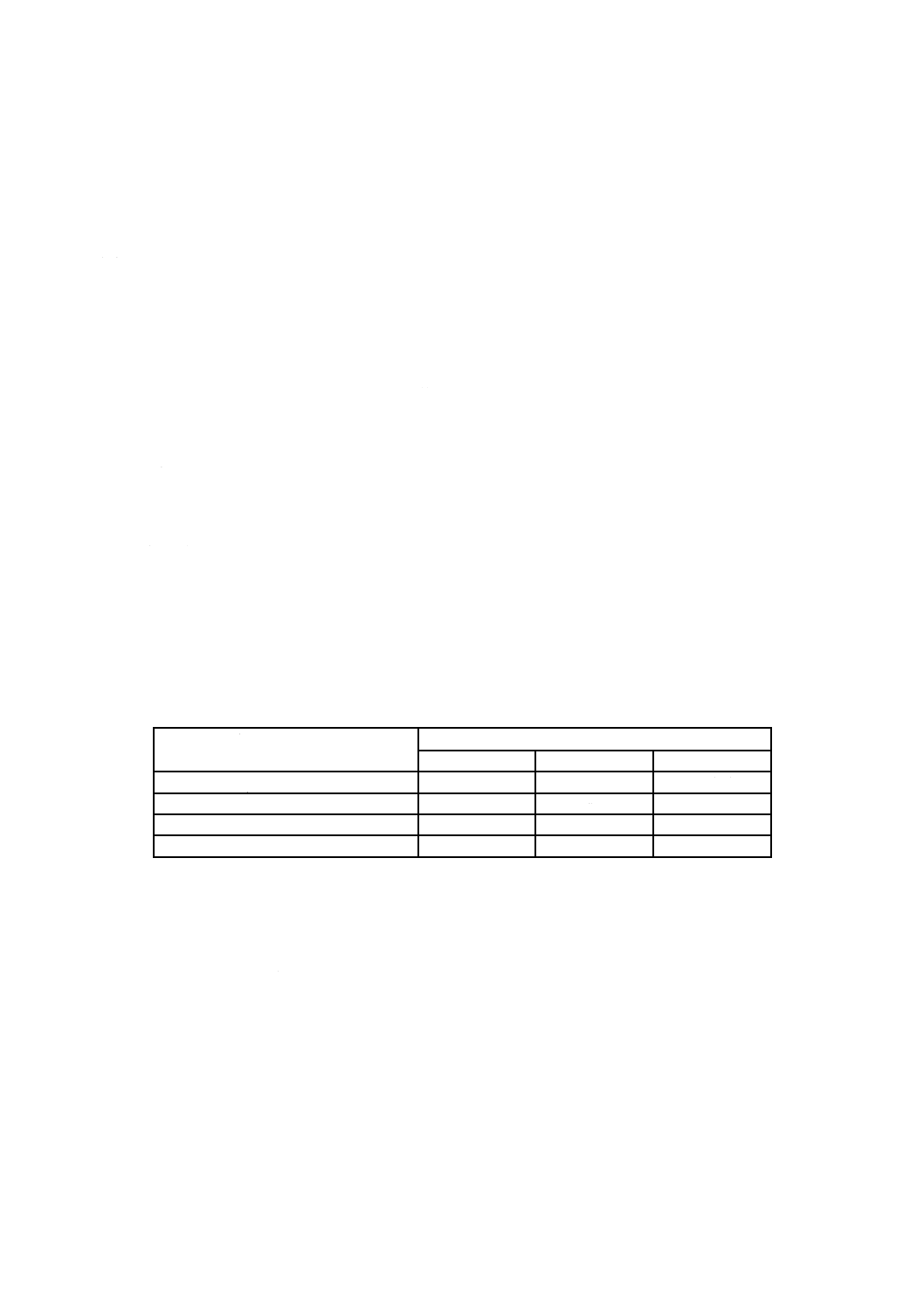T 3211-4:2019
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
2A 用語及び定義 ················································································································ 2
3 一般要求事項 ··················································································································· 3
4 指示(この規格では不採用とした。) ··················································································· 6
5 材料······························································································································· 6
6 物理的要求事項 ················································································································ 6
6.1 微粒子汚染 ··················································································································· 6
6.2 気密性 ························································································································· 6
6.3 引張強さ ······················································································································ 6
6.4 びん針 ························································································································· 6
6.5 通気装置 ······················································································································ 7
6.6 導管 ···························································································································· 7
6.7 通液フィルタ ················································································································ 7
6.8 点滴筒及び点滴口 ·········································································································· 7
6.9 流量調節器 ··················································································································· 7
6.10 流量(この規格では不採用とした。)················································································ 7
6.11 混注部 ························································································································ 7
6.12 おす(雄)かん(嵌)合部 ····························································································· 8
6.13 保護キャップ ··············································································································· 8
7 化学的要求事項 ················································································································ 8
7.1 溶出物 ························································································································· 8
8 生物学的安全性 ················································································································ 9
8.1 一般 ···························································································································· 9
8.2 無菌性 ························································································································· 9
8.3 発熱性 ························································································································· 9
8.4 溶血性 ························································································································· 9
8.5 毒性 ···························································································································· 9
9 表示······························································································································· 9
9.1 一般 ···························································································································· 9
9.2 一次包装 ······················································································································ 9
9.3 二次包装 ····················································································································· 10
10 包装 ···························································································································· 10
10.1 一次包装 ···················································································································· 10
T 3211-4:2019 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
10.2 二次包装 ···················································································································· 10
附属書A(規定)物理的試験 ································································································· 11
附属書B(規定)化学的試験 ································································································· 13
附属書C(規定)生物学的試験 ······························································································ 15
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 16
T 3211-4:2019
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,一般社団法人日本医療機器テクノロジー協会
(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定す
べきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
JIS T 3211の規格群には,次に示す部編成がある。
JIS T 3211-4 第4部:自然落下式単回使用滅菌済み輸液セット
JIS T 3211-5 第5部:単回使用滅菌済み定量筒輸液セット
JIS T 3211-8 第8部:ポンプ用単回使用滅菌済み輸液セット
JIS T 3211-9 第9部:単回使用滅菌済みチューブ
JIS T 3211-10 第10部:単回使用滅菌済み輸液チューブの附属品
JIS T 3211-11 第11部:単回使用滅菌済み輸液フィルタ
JIS T 3211-12 第12部:単回使用滅菌済み逆止弁
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3211-4:2019
滅菌済み輸液セット−
第4部:自然落下式単回使用滅菌済み輸液セット
Sterile infusion administration set-
Part 4: Sterile infusion sets for single use, gravity feed
序文
この規格は,2010年に第5版として発行されたISO 8536-4及びAmendment 1(2013)を基とし,我が国
の実情に合わせるため,技術的内容を変更して作成した日本工業規格である。ただし,追補(amendment)
については,編集し,一体とした。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,医療で使用する単回使用の自然落下式滅菌済み輸液セット(以下,輸液セットという。)に
ついて規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 8536-4:2010,Infusion equipment for medical use−Part 4: Infusion sets for single use, gravity feed
及びAmendment 1:2013(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and
testing within a risk management process(MOD)
JIS T 3209 滅菌済み注射針
注記 対応国際規格:ISO 7864,Sterile hypodermic needles for single use(MOD)
ISO 3696,Water for analytical laboratory use−Specification and test methods
ISO 14644-1,Cleanrooms and associated controlled environments−Part 1: Classification of air cleanliness by
particle concentration
2
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ISO 15223-1,Medical devices−Symbols to be used with medical device labels, labelling and information to be
supplied−Part 1: General requirements
ISO 80369-7:2016,Small-bore connectors for liquids and gases in healthcare applications−Part 7: Connectors
for intravascular or hypodermic applications
2A
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2A.1
公称滴数
輸液セットの被包又は容器に表示された1 mLに相当する滴数。
2A.2
再シール性
混注部に針を刺通し,その後,針を抜いたとき,液が漏れない性質。針不使用式混注部の場合は,製造
販売業者が定めるおす(雄)側器具を抜き去った後のシール性をいう。
2A.3
精製水
日本薬局方の第二部医薬品に規定する精製水又はこれと同等以上の精製水。
2A.4
一次包装
輸液セットを直接に覆う包装。輸液セットの無菌性を保持するためのもので,更にこれを二次包装する
場合には,いわゆる内袋に該当する。
2A.5
二次包装
一次包装を直接に覆う包装。通常,一次包装された輸液セットが複数個(例えば,50セット)入った包
装をいう。
2A.6
びん針
輸液容器に刺通する針。
2A.7
点滴筒
点滴を観察する筒。
2A.8
点滴口
点滴筒内に液滴が滴下する部分。
2A.9
定量筒
輸液剤を一定量計量・貯蔵できる無色透明の硬い又は硬めのプラスチック製の筒。
2A.10
導管
輸液剤を体内に導く管。
3
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2A.11
おすめす(雄雌)かん(嵌)合部
おす(雄)又はめす(雌)のかん(嵌)合部が,テーパ又は他の構造によって,器具と器具との接続及
び離脱が可能な部分。
2A.12
保護キャップ
びん針,おす(雄)かん(嵌)合部が直接外部に触れることを防ぐための蓋。
2A.13
通気装置
硬質容器の輸液剤の場合に,空気を輸液容器内に導入する装置。
2A.14
流量調節器
輸液速度を調節する部材。
2A.15
開閉器
導管内を開放又は閉塞状態にする部材。
2A.16
通液フィルタ
輸液剤中の固形物を捕捉する部材。
2A.17
混注部
輸液時に他の薬剤を投与するための部分。
2A.18
継ぎ管
導管,おすめす(雄雌)かん(嵌)合部などの部材をつなぐ部材。
2A.19
三方活栓
流路切替えが可能な混注部。輸液セットに,かん(嵌)合又はその他の方法で接続されているもの。
2A.20
多連活栓
流路切替えが可能な混注部を複数もつもの。輸液セットに,かん(嵌)合又はその他の方法で接続され
ているもの。
2A.21
静脈針
血管にせん(穿)刺し輸液剤を投与する針。
3
一般要求事項
3.1
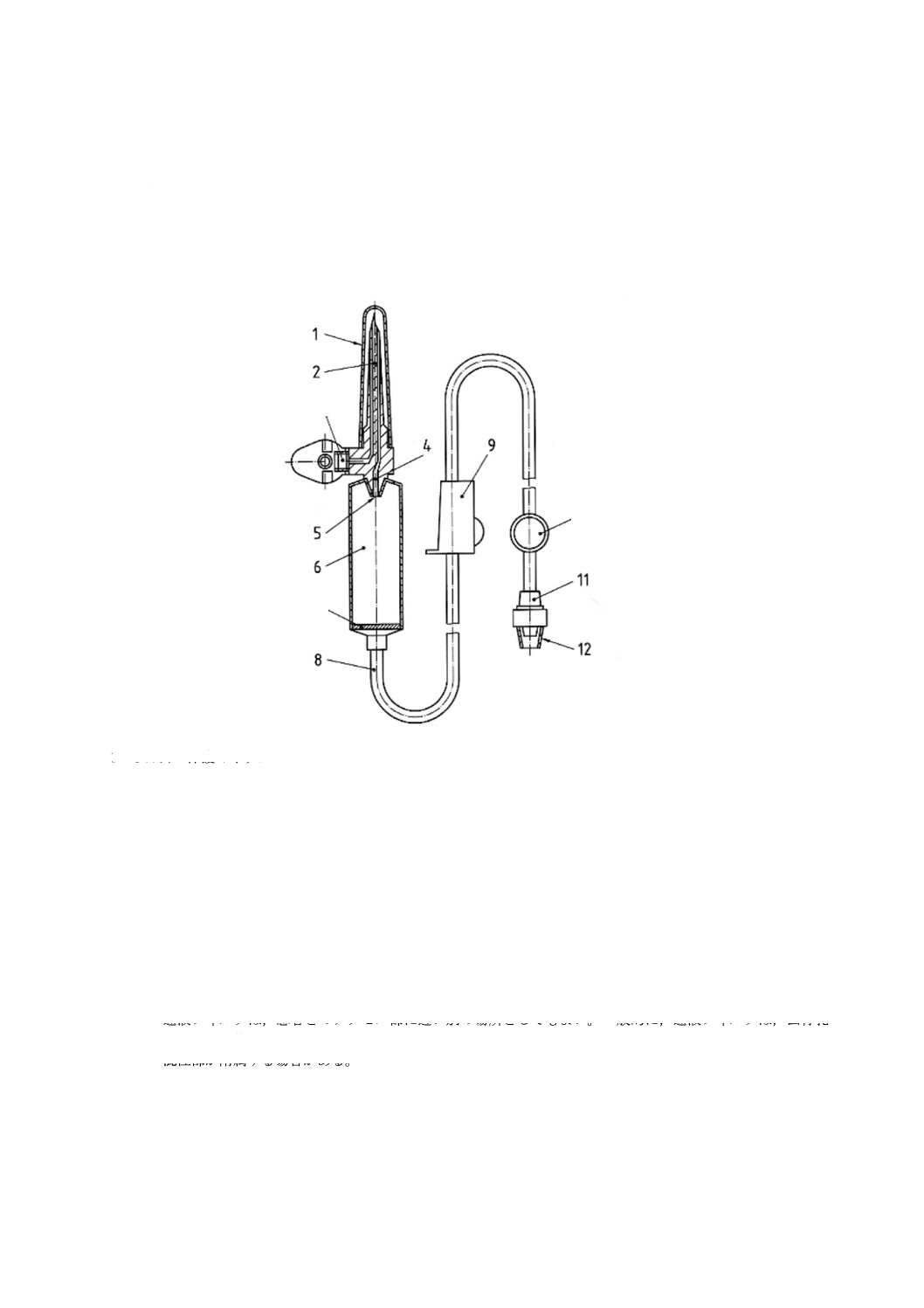
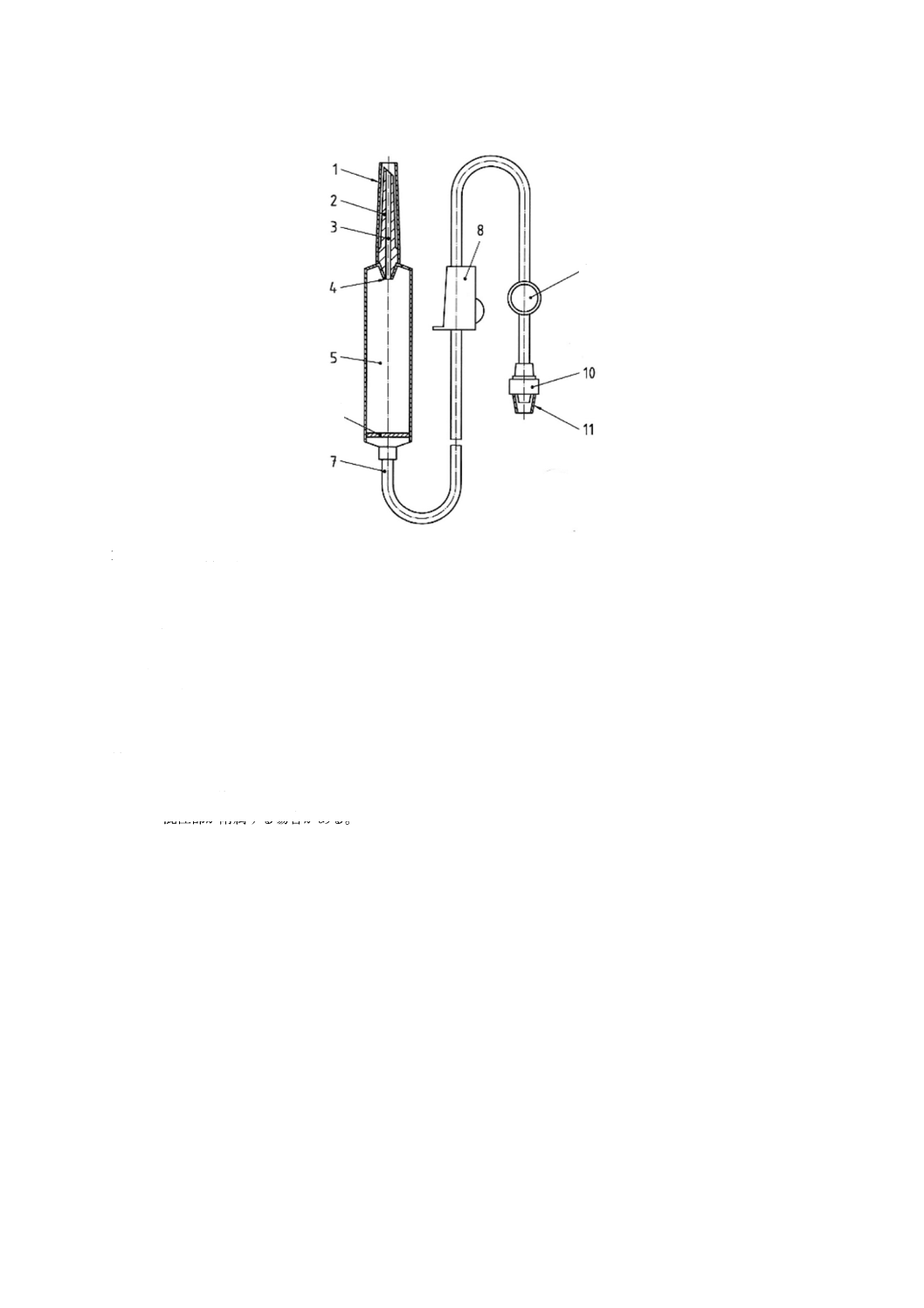
輸液セット及び分離した通気装置に使う部位の名称を,図1〜図3に示す。これらの図は,輸液セッ
ト及び通気装置の形状例の図示である。同様の結果を導くものであれば,他の形状を使用してもよい。図
2に図示したような輸液セットは,折りたたみ可能なプラスチック製の容器だけに使用するのが望ましい。
4
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図1に図示したような輸液セット,又は図2に図示したような輸液セットを図3のような分離した通気装
置と一緒に使用する場合は,硬い容器を使用しなければならない。
3.2
輸液セットは,セットが使用されるまで,びん針,おす(雄)かん(嵌)合部又は針を覆う保護キ
ャップが付いていなければならない。通気装置は,針又はびん針を覆う保護キャップが付いていなければ
ならない。
1 びん針の保護キャップ
2 びん針
3 通気フィルタ
4 液体流路
5 点滴口
6 点滴筒
7 通液フィルタ
8 導管
9 流量調節器
10 混注部
11 おす(雄)かん(嵌)合部
12 おす(雄)かん(嵌)合部の保護キャップ
注a) 空気注入孔の通気フィルタが附属する場合がある。
b) 通液フィルタは,患者とのアクセス部に近い別の場所としてもよい。一般的に,通液フィルタは,公称孔
径15 μmを使用する。
c) 混注部が附属する場合がある。
図1−通気式輸液セットの例
10 c)
7 b)
3 a)
5
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 びん針の保護キャップ
2 びん針
3 液体流路
4 点滴口
5 点滴筒
6 通液フィルタ
7 導管
8 流量調節器
9 混注部
10 おす(雄)かん(嵌)合部
11 おす(雄)かん(嵌)合部の保護キャップ
注a) 通液フィルタは,患者とのアクセス部に近い別の場所としてもよい。一般的に,通液フィルタは,公称孔径
15 μmを使用する。
b) 混注部が附属する場合がある。
図2−通気なし式輸液セットの例
9 b)
6 a)
6
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 保護キャップ
2 針又はびん針
3 チューブ
4 クランプ
5 通気フィルタ付き吸気口
注a) 容器内に空気の供給を一時的に遮断するための部品。同様な安全性が保証されるのであれば,他の形状でも
よい。
図3−通気装置の例
4
指示(この規格では不採用とした。)
5
材料
箇条3に記載した輸液セット及びその構成品の材料は,箇条6の規定に適合しなければならない。輸液
セットの液体に接する部分の材料は,更に箇条7及び箇条8の規定に適合しなければならない。
6
物理的要求事項
6.1
微粒子汚染
輸液セットは,微粒子汚染を最小限に抑えた環境下で製造しなければならない。全ての部品の液体が通
る部分の表面は,平滑で清浄でなければならない。A.1に規定する試験を行ったとき,微粒子の数は,汚
染指標を超えてはならない。
6.2
気密性
輸液セットは,A.2に規定する試験を行ったときに,空気の漏れがあってはならない。
6.3
引張強さ
輸液セットは,A.3に規定する試験を行ったときに,保護キャップを除き,15 N以上の引張力に15秒間
耐えなければならない。
6.4
びん針
びん針は,次による。
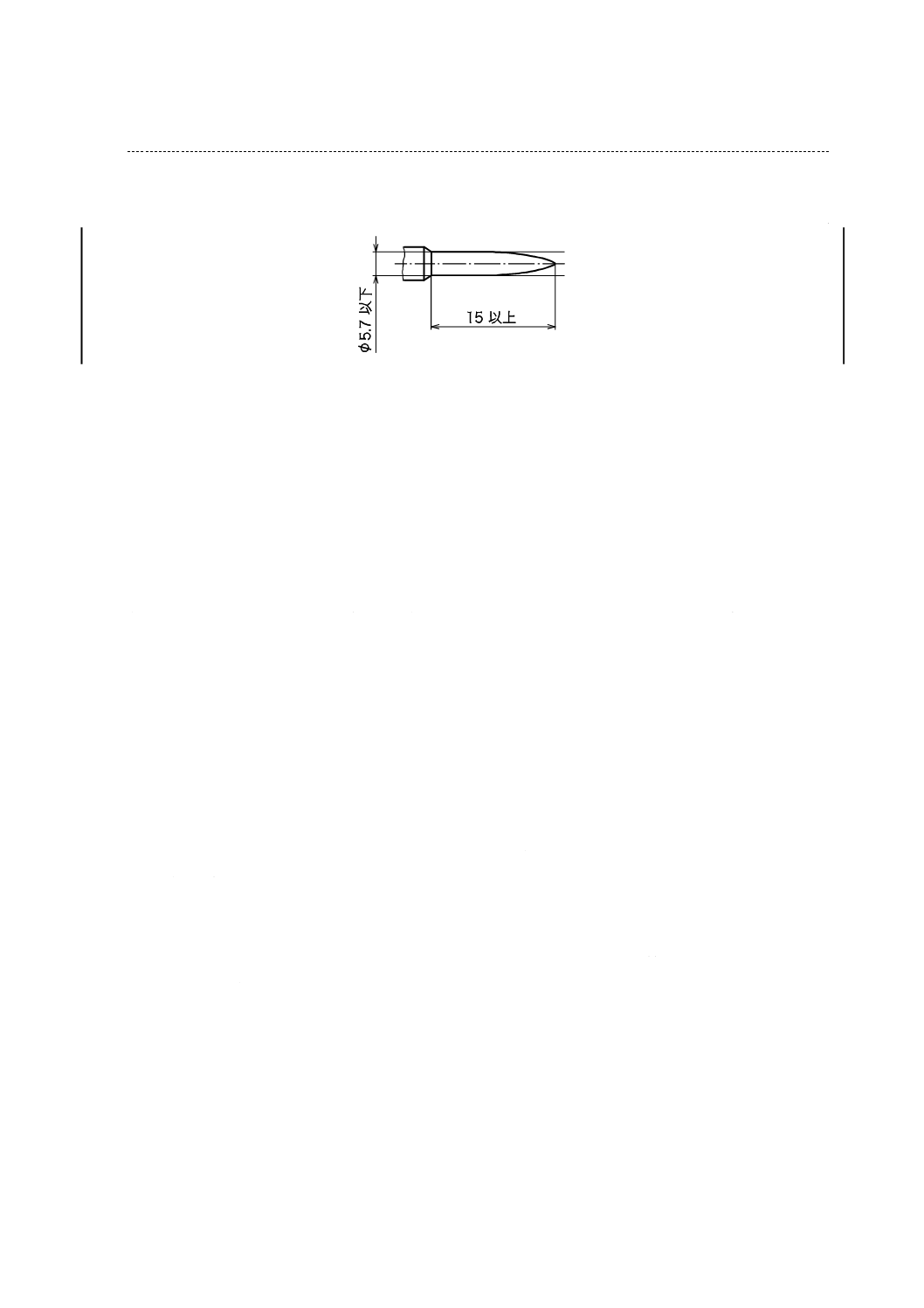
a) びん針の寸法は,図4に規定した寸法に適合しなければならない。
注記 びん針の断面は,円形である。
b) びん針は,予備せん(穿)通なしで輸液容器の栓をせん(刺)通できなければならない。この処置の
間コアリングが起きない。
4 a)
3 a)
7
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) びん針の金属製針管の外面には,凹凸及びきずがなく,仕上げ面は滑らかで,かつ,金属製以外の針
管の外面も,きずがなく,仕上げ面が滑らかでなければならない。
単位 mm
図4−びん針の寸法
6.5
通気装置
通気装置は,3.2及び8.2の規定に適合しなければならない。
通気装置は,その器具を刺し込む容器内へ微生物の進入を防止する通気フィルタが付いていなければな
らない。
通気装置は,びん針から分離されている又は一体でなければならない。
通気装置を硬い輸液容器へせん(穿)刺しているとき,容器に供給される空気が流出する液体の中に入
ってはならない。
通気フィルタは,硬い容器へ入る全ての空気がそれを通して入るように付いていなければならない。さ
らに,A.4に従って試験を行ったときに,液の流れは,自由に容器に空気を通すものに比べて20 %以上減
少してはならない。
6.6
導管
柔軟な材料で作られた導管は,透明,又は気泡の通過の間,空気と水との接触面が正常視力又は矯正視
力で観察できる程度の半透明でなければならない。
導管は,末端から点滴筒端までは,混注部及びおす(雄)かん(嵌)合部が付いている場合はこれらも
含めて,500 mm以上の長さでなければならない。
6.7
通液フィルタ
フィルタが附属する場合は,その公称孔径は,210 μmより細かくなければならない。
6.8
点滴筒及び点滴口
点滴筒は,液滴の落下の観察を連続的に可能としなければならない。液体は,点滴筒に突き出したチュ
ーブ(点滴口)を通して点滴筒に入らなければならない。点滴口は,蒸留水を23 ℃±2 ℃で50滴/分±
10滴/分で流したときに,蒸留水20滴又は60滴の液量を1 mL±0.1 mL又は質量を1 g±0.1 gとしなけ
ればならない。点滴筒は,プライミングの手順を容易にできるものであることが望ましい。
6.9
流量調節器
流量調節器は,輸液セットの流量をゼロから最大まで調節できなければならない。流量調節器は,導管
に破損を与えることなく,輸液をしている間,連続して使用できることが望ましい。流量調節器と導管と
を接触させたまま保管しても,有害反応が起きないことが望ましい。
6.10
流量(この規格では不採用とした。)
6.11
混注部
8
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
混注部は,次の規定に適合しなければならない。
a) 金属針を用いて混注する。再シール性をもつ混注部は,A.5に従って試験を行ったときに,再シール
しなければならない。また,1滴を超える水滴が漏れてはならない。再シール性をもつ混注部を備え
ているときは,混注部は,おす(雄)かん(嵌)合部の近くに配置するのが望ましい。
b) 針不使用式の混注部は,製造販売業者が指定するおす(雄)側器具を用いて10分間接続後,離脱する
操作を10回行った後に,水圧50 kPaを15秒間加えたとき,漏れがあってはならない。
6.12
おす(雄)かん(嵌)合部
導管の末端は,ISO 80369-7に適合したおす(雄)かん(嵌)合部でなければならない。ISO 80369-7に
従ったルアーロックかん(嵌)合部を使うことが望ましい。
6.13
保護キャップ
保護キャップは,確実に装着でき,かつ,容易に外せることが望ましい。
7
化学的要求事項
7.1
溶出物
溶出物は,7.1.1又は7.1.2のいずれかによって試験を行ったときに,それぞれの規定に適合しなければ
ならない(ただし,静脈針は除く。)。また,静脈針は,JIS T 3209の化学的要求事項に適合しなければな
らない。
7.1.1
溶出物試験第一法
溶出物試験第一法は,プラスチック製の材料10 gをとり,また,ゴム製の材料1.0 gをとり,細片とし,
精製水約100 mLで30分間煮沸した後,精製水を加えて正確に100 mLとする。この液を試験液として,
次の試験を行い,適合しなければならない。
なお,空試験液は,別に精製水を用いて同様の方法で操作して調製する。
a) pH 試験液及び空試験液20 mLずつをとり,これらに塩化カリウム1.0 gを精製水に溶かして1 000 mL
とした液を1.0 mLずつを加え,日本薬局方一般試験法のpH測定法によって試験を行ったときに,両
液のpHの差は,2.0以下でなければならない。
b) 重金属 試験液10 mLをとり,比較液に鉛標準液2.0 mLを加え,日本薬局方重金属試験法の第一法
によって試験を行ったときに,重金属は,2.0 ppm以下でなければならない。
c) 過マンガン酸カリウム還元性物質 試験液10 mLを共栓三角フラスコにとり,0.002 mol/L過マンガン
酸カリウム液20.0 mL及び日本薬局方一般試験法の試薬・試液で規定する希硫酸1 mLを加え,3分間
煮沸し,冷却する。これによう化カリウム0.10 gを加えて密栓し,振り混ぜて10分間放置した後,0.01
mol/Lチオ硫酸ナトリウム標準液で滴定する(指示薬:日本薬局方一般試験法の試薬・試液で規定す
るでんぷん試液5滴)。別に空試験液10 mLを用い,同様に操作する。試験液及び空試験液の0.002 mol/L
過マンガン酸カリウム液の消費量の差は,2.0 mL以下でなければならない。
d) 蒸発残留物 試験液10 mLを水浴上で蒸発乾固し,残留物を105 ℃で1時間乾燥させた後,その質量
は,1.0 mg以下でなければならない。
7.1.2
溶出物試験第二法
溶出物試験第二法は,次による。
a) 還元性(酸化性)物質 B.2に従って試験を行ったとき,B.1に規定した抽出液S1及び対照溶液S0の
チオ硫酸ナトリウム標準液(0.005 mol/L)の消費量の差は,2.0 mLを超えてはならない。
b) 金属イオン 抽出液は,原子吸光光度計(AAS)又は同等の方法で分析したときに,バリウム,クロ
9
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ム,銅,鉛及びすずの総量が1 μg/mL以下で,かつ,カドミウムが0.1 μg/mL以下でなければならな
い。
B.3に従って試験を行ったときに,試験液の色は,標準液β(Pb2+)=1 μg/mLの色より濃くなっては
ならない。
c) 酸性又はアルカリ性 B.4に従って試験を行ったときに,標準液が1 mL未満で色が灰色にならなけれ
ばならない。
d) 蒸発残留物 B.5に従って試験を行ったときに,残留物は,5 mg以下でなければならない。
e) 紫外線吸収度 B.6に従って試験を行ったときに,抽出液S1の吸光度は,0.1以下でなければならない。
8
生物学的安全性
8.1
一般
輸液セットは,C.2に従った生物学的適合性を評価しなければならない。
8.2
無菌性
“滅菌済み”を表示するものは,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性
の担保を行わなければならない。
注記 滅菌バリデーション基準には,厚生労働省が定めた“滅菌バリデーション基準”がある。
8.3
発熱性
輸液セット及び/又は同一包装に入っている通気装置は,適切な試験を用いて発熱性物質がないことを
評価しなければならない。その結果として,輸液セットは,発熱性物質がないことを示さなければならな
い。発熱性試験は,C.1による。
8.4
溶血性
輸液セットは,溶血因子がないことを評価しなければならない。その結果として,輸液セットには,溶
血反応がないことを示さなければならない。
注記 溶血因子に関する試験方法は,ISO 10993-4に規定されている。[7]を参照。
8.5
毒性
適切な試験法を実施して毒性に関する評価を行い,結果として,材料に毒性がないことを示さなければ
ならない。毒性の試験は,JIS T 0993-1による。
9
表示
9.1
一般
表示には,9.2及び9.3に規定している要求事項を含まなければならない。図記号を使用する場合は,ISO
15223-1による。
注記 影響ある物質の存在は,その物質の略語“XXX”を変更し,ISO 7000の図記号2725を使用し
て示すことができる。影響ある物質がないことを,個々の記号に斜線を入れることで示すこと
ができる。
9.2
一次包装
一次包装には,少なくとも次の情報を表示しなければならない。
a) 製造販売業者の氏名又は名称及び住所
b) “自然落下だけ”の用語を含む内容物の説明
c) 適切な文言,又はISO 15223-1に規定する図記号を用いた“滅菌済み”の表示
10
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) “LOT”の文字を前置きしたロット(バッチ)の表記,又はISO 15223-1に規定する図記号を用いた
ロット(バッチ)の表記
e) 適切な用語,又はISO 15223-1に規定する図記号を用いた使用期限の年月
f)
輸液セットが単回使用であることの表示。同等の文言での表示,又はISO 15223-1に規定する図記号
を用いての表示でもよい。
g) 使用上の注意。添付文書でもよい。
h) 点滴筒から供給する蒸留水の滴数の20滴又は60滴の液量が1 mL±0.1 mL又は質量が1 g±0.1 gに相
当する旨
i)
静脈針の外径(静脈針が附属の場合)
上記情報の判読可能な文字及び/又は記号を記載するために使用できる場所が小さい場合は,d) 及び
e) だけでもよい。この場合,この細分箇条で要求する情報は,二次包装に表示しなければならない。
9.3
二次包装
二次包装には,少なくとも次の情報を表示しなければならない。
a) 製造販売業者の氏名又は名称及び住所
b) “自然落下だけ”の用語を含む内容物の説明
c) 適切な文言,又はISO 15223-1に規定する図記号を用いた“滅菌済み”の表示
d) “LOT”の文字を前置きしたロット(バッチ)の表記,又はISO 15223-1に規定する図記号を用いた
ロット(バッチ)の表記
e) 適切な用語,又はISO 15223-1に規定する図記号を用いた使用期限の年月
f)
入り数
g) もしあれば,推奨する保管条件
10
包装
10.1
一次包装
一次包装は,微生物の侵入を防止することができ,かつ,通常の取扱い,輸送及び保管中に,内容製品
を適切に保護できるものでなければならない。また,一次包装は,一度開封したならば,簡単に再シール
できず,開封したことが明確に分からなければならない。
10.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもたなければならない。
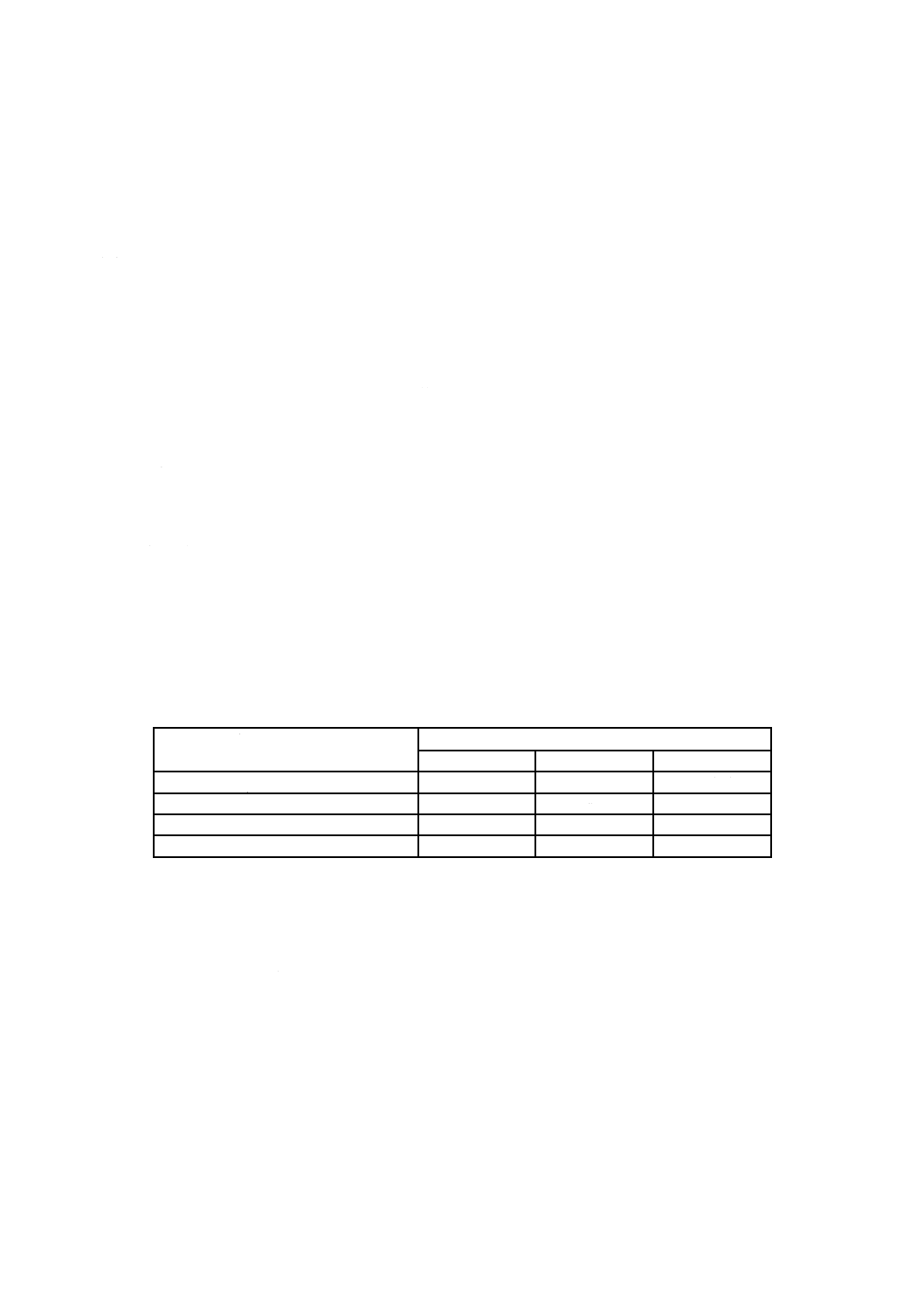
11
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
物理的試験
A.1 微粒子汚染試験
A.1.1 原理
輸液セットの内部の液体が通る表面から粒子を洗い落とし,メンブランフィルタ上に集め,顕微鏡下で
計数する。
A.1.2 試薬及び材料
A.1.2.1 蒸留水 孔径0.2 μmのフィルタでろ過したもの。
A.1.2.2 パウダーフリー手袋
A.1.2.3 吸引フィルタ 孔径0.45 μmの単膜タイプのもの。
A.1.3 手順
フィルタユニット,フィルタ及びその他の器具は,試験で使用する前にA.1.2.1の蒸留水で十分洗浄しな
ければならない。
層流条件(ISO 14644-1に従うクラスN5のクリーンエアー作業場所)で,すぐに使用可能な輸液セット
10本を500 mLのA.1.2.1の蒸留水を用いて流す。その後,全量を吸引しながらA.1.2.3の吸引フィルタに
通す。斜めから光を投射した50倍率顕微鏡の下で,メンブランスクリーンフィルタ上の粒子を,表A.1
に規定するサイズ分類に従って測定し,計数する,又は校正,精度の検証が行われた“光遮蔽式液中粒子
計数器”を用いて,表A.1に規定するサイズ分類に従って測定し,計数する。
表A.1−粒子による汚染の評価
粒子パラメータ
サイズ分類
1
2
3
粒子サイズ μm
25〜50
51〜100
100を超える
10セットの粒子の数
na1
na2
na3
ブランク対照サンプルの粒子の数
nb1
nb2
nb3
評価係数
0.1
0.2
5
A.1.4 結果判定
A.1.4.1 一般
適切な数の輸液セット(最低10本)を試験する。10本の輸液セットの粒子数を三つのサイズ分類に区
分した粒子の数が,分析結果となる。
A.1.4.2 粒子の計算
ブランクの対照サンプルから得た数値は,試験報告書に記録し,汚染指標限界を計算するときに参照し
なければならない。ブランクの対照サンプルは,同じ試験機器を用いるが,試験用輸液セットには通さず,
表A.1に規定された三つのサイズ分類に従って分類し,500 mLの水から採取された,数及びサイズである。
ブランク(Nb)の粒子の数は,9以下でなければならない。それ以外の場合,テスト装置を分解,再清掃
して,再度バックグラウンド・テストを行わなければならない。ブランク判定の数値は,試験報告書に記
載しなければならない。
12
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
汚染指標限界は,次のとおり計算する。三つのサイズ分類のそれぞれについて,10本の輸液セットの粒
子の数に評価係数を乗じ,輸液セット(供試体)(Na)中の粒子の数を得るために,結果を加算する。その
後,各サイズ分類についてブランクサンプル(Nb)の粒子の数に評価係数を乗じ,ブランクサンプル(Nb)
の粒子数を得るために,結果を加算する。
NaからNbを減算し,汚染指標限界を求める。
輸液セット(供試体)の粒子の数:
Na=na1×0.1+na2×0.2+na3×5
ブランクサンプルの粒子の数:
Nb=nb1×0.1+nb2×0.2+nb3×5
汚染指標限界:
N=Na−Nb≦90
A.2 気密性試験
A.2.1
試験開始時には,全ての試験システムの温度を試験温度と同じにしなければならない。
A.2.2
空気供給装置に輸液セットを接続し,他の全ての開口部を閉じる。50 kPaの内部過剰圧力で15秒
間空気を送る。40 ℃±1 ℃の水中で,輸液セットからの空気の漏れを点検する。
A.2.3
(この規格では不採用とした。)
A.3 引張強さ試験
輸液セットに対し,長手方向に引張力15 Nを15秒加えて試験する。輸液セットが,試験の力に耐える
かどうかを確認する。
A.4 通気装置を使用したときの流量の測定
A.4.1
輸液容器を23 ℃±2 ℃の蒸留水で満たし,栓をする。栓を通して,通気装置を容器の中へ刺し込
む。流量調節器を,液体の流れを止めた状態で付けた輸液セットに刺し込む。試験の間,水の落差が均等
に1 mの落差圧になるように容器を調節する。輸液セットからの水の流れが最大になるように流量調節器
を開き,輸液セットからの水の流量を試験する。通気装置からフィルタを取り除いたもので,この手順を
繰り返す。
A.4.2
輸液セットのびん針に付いた通気装置もA.4.1の試験手順に従う。ただし,分離した通気装置を刺
し込むことは除外する。
A.5 混注部の試験
応力がかからないように水平方向に混注部を置き,気泡が閉じ込められないように輸液セットを水で満
たし,大気圧より20 kPa高い圧力を加える。外径0.8 mmでJIS T 3209に従った皮下用注射針で,あらか
じめ決められたせん(穿)刺部位へせん(穿)刺する。注射針をその位置に15秒間とどめる。注射針を抜
き取り,すぐにせん(穿)刺部位を乾燥する。注入部位から漏れがないか1分間観察する。注射部位が別
の形状の場合には,製造販売業者が提供する指示書に従って,せん(穿)刺を行うことが望ましい。
13
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
化学的試験
B.1
抽出液S1及び対照溶液S0の調製
B.1.1 抽出液S1
滅菌済みの輸液セット3本と300 mLのほうけい酸ガラス製の煮沸フラスコで閉鎖循環系を作る。フラ
スコ内の溶液を,37 ℃±1 ℃に維持する恒温装置にフラスコを取り付ける。ISO 3696のグレード1又はグ
レード2に適合する水250 mLを,例えば,可能な限り短い適切なシリコンチューブをぜん(蠕)動ポン
プに取り付け使用して,1 L/hの速さで2時間循環させる。全ての溶液を集め,冷却する。
B.1.2 対照溶液S0
対照溶液S0は,抽出液S1に記載したのと同様に準備するが,循環回路から輸液セットを除く。抽出液
S1及び対照溶液S0は,化学的試験で使用しなければならない。
B.2
還元性(酸化性)物質試験
10 mLの抽出液S1に10 mLの過マンガン酸カリウム溶液(0.002 mol/L)及び1 mLの硫酸溶液(1 mol/L)
を加えてかくはん(撹拌)し,室温で15分間反応させる。
その後,よう化カリウム0.10 gを加え,チオ硫酸ナトリウム標準液(0.005 mol/L)で明るい茶色になる
まで滴定する。でんぷん溶液5滴を加え,青色が消えるまで滴定を続ける。
同時に対照試験を実施する。
抽出液S1のための0.005 mol/Lチオ硫酸ナトリウム標準液の容積と対照溶液S0のためのチオ硫酸ナトリ
ウム標準液の容積との差を,単位ミリリットルで計算する。
B.3
金属イオン試験
日本薬局方に記載されている手順で,10 mLの抽出液S1の金属イオンを試験する。発色の度合いを測定
する。
B.4
酸性又はアルカリ性の滴定試験
滴定フラスコに20 mLの抽出液S1をとり,タシロ(Tashiro)指示液を0.1 mL加える。
溶液の色が紫の場合は,水酸化ナトリウム溶液(0.01 mol/L)を用いて,緑の場合は,塩酸(0.01 mol/L)
を用いて,灰色が現れるまで滴定する。使用した水酸化ナトリウム溶液又は塩酸溶液は,ミリリットルで
表す。
B.5
蒸発残留物
50 mLの抽出液S1を蒸発皿に移す。沸点以下の温度で蒸発乾固する。一定質量になるまで105 ℃で乾燥
する。
50 mLの対照溶液S0も同様に処理する。
抽出液S1及び対照溶液S0の残留分質量の差を,ミリグラムで表す。
14
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.6
吸光度試験
迷光の干渉を防止するために,抽出液S1を0.45 μmの孔径のメンブランフィルタに通す。5時間以内に
1 cmの石英セルに溶液を入れ,走査紫外分光光度計で波長250 nm〜320 nmの間の波長でスペクトルを記
録する。対照セルには対照溶液S0を入れる。
結果の報告書は,各波長に対する吸光度を記録したチャートとする。
15
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(規定)
生物学的試験
C.1 発熱性試験
発熱性試験は,薬局方又は国家基準の記載に従って実施しなければならない。
注記 発熱性試験及びエンドトキシン試験は,欧州,米国及び日本の薬局方に記載されている。
C.2 生物学的評価
生物学的適合性を評価する際には,JIS T 0993-1に規定の生物学的評価試験方法を指標とすることが望
ましい。
参考文献
[1] ISO 291,Plastics−Standard atmospheres for conditioning and testing
[2] ISO 7000,Graphical symbols for use on equipment−Registered symbols
[3] JIS T 0801 ヘルスケア製品の滅菌−エチレンオキサイド−医療機器の滅菌プロセスの開発,バリデ
ーション及び日常管理の要求事項
注記 原国際規格では,ISO 11135,Sterilization of health care products−Ethylene oxideを記載してい
る。
[4] JIS T 0806(規格群) ヘルスケア製品の滅菌−放射線
注記 原国際規格では,ISO 11137 (all parts),Sterilization of health care products−Radiationを記載し
ている。
[5] ISO 17665 (all parts),Sterilization of health care products−Moist heat
注記 ISO 17665は,3部構成で,第1部のJIS T 0816-1(ヘルスケア製品の滅菌−湿熱−第1部:
医療機器の滅菌プロセスの開発,バリデーション及び日常管理の要求事項)だけが発行され
ている。ほかはISO/TSで,JISは未発行である。
[6] JIS Z 8000-4 量及び単位−第4部:力学
注記 原国際規格では,ISO 80000-4,Quantities and units−Part 4: Mechanicsを記載している。
[7] ISO 10993-4,Biological evaluation of medical devices−Part 4: Selection of tests for interactions with blood
[8] European Pharmacopoeia
[9] United States Pharmacopeia
[10] 日本薬局方
16
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3211-4:2019 滅菌済み輸液セット−第4部:自然落下式単回使用滅菌済み
輸液セット
ISO 8536-4:2010,Infusion equipment for medical use−Part 4: Infusion sets for single use,
gravity feed及びAmendment 1:2013
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
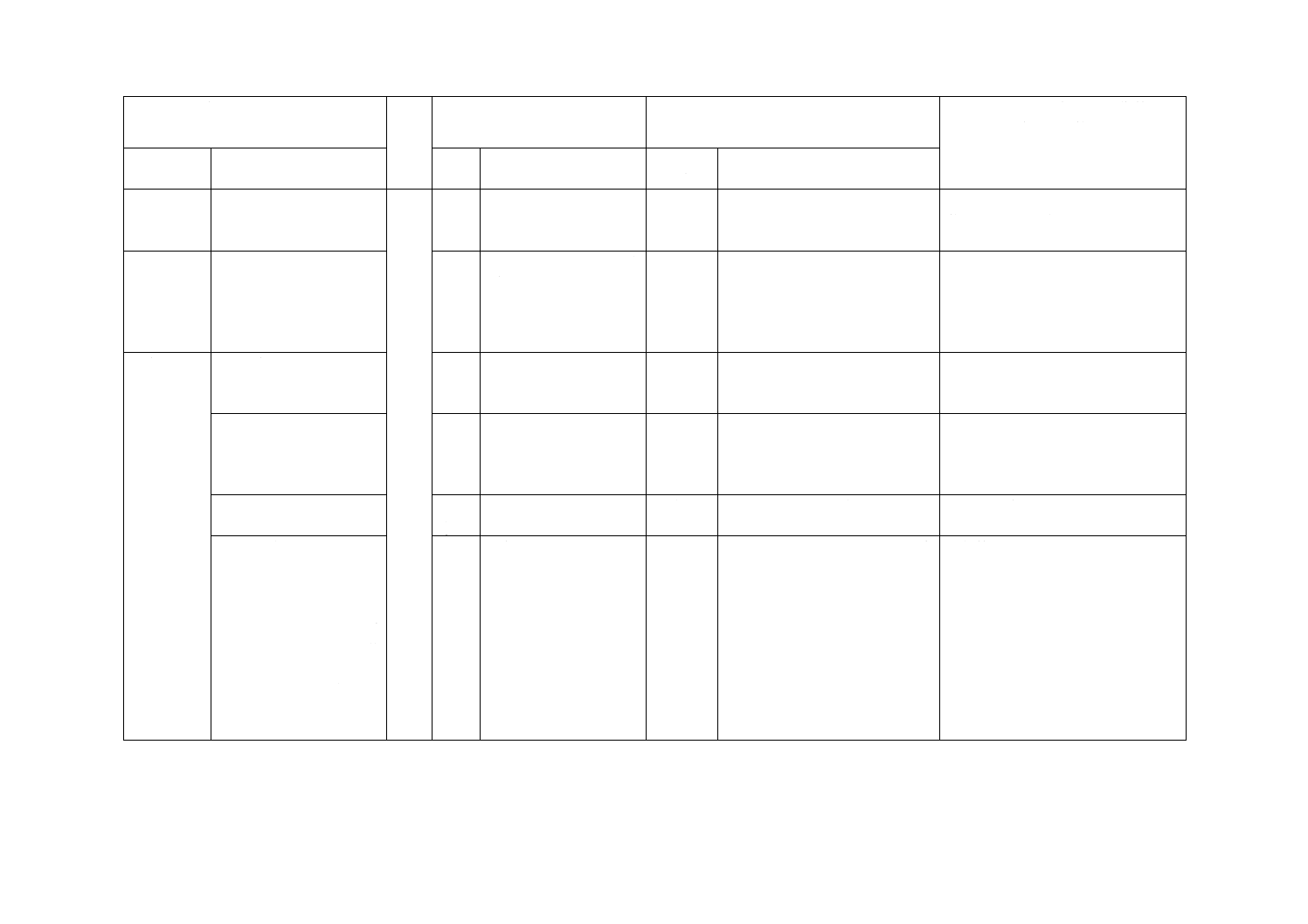
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 医療で使用する単回使用
の自然落下式滅菌済み輸
液セットを規定
1
一部の国では,ISO
8536-4よりも法規が優
先される。
削除
この規格では,削除した。
各国の対応についての記載のため,
削除した。
2 引用規格
2A 用語及
び定義
21項目の用語の定義を記
載
−
−
追加
この規格では,用語及び定義を
追加した。
利用者の利便性のため,実質的な差
異はない。
4 指示
−(この規格では不採用)
4
輸液セットへの記載事
項を規定
削除
この規格では,輸液セットへの
記載事項を不採用とした。
ISO 8536-8〜ISO 8536-11:2015で削
除されており,今後ISO 8536-4にお
いても削除が予想されるため,この
規格でもこの時点で削除した。
6 物理的要
求事項
6.4 びん針
寸法規定の修正
6.4
寸法及び公差を規定
変更
この規格では,ISO規格より細い
びん針も入るように規定した。
国内流通品を考慮し修正した。
6.6 導管
長さの規定を500 mm以
上とした。
6.6
1 500 mm以上
変更
この規格では,500 mm以上とし
た。
国内流通品を考慮し修正した。
4
T
3
2
11
-4
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
17
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 物理的要
求事項
(続き)
6.7 通液フィルタ
公称孔径は,210 μmより
細かくなければならな
い。
6.7
フィルタ装着を要求事
項として規定し,そのろ
過効率についても規定
変更
この規格では,フィルタの目の
大きさがISO規格と異なる。
現行規格を採用した。
“滅菌済み輸血セット基準等につい
て”平成10年12月11日医薬発第
1079号の“滅菌済み輸液セット基準”
の規定を踏襲した。フィルタは選択
で設定することが,国内ではJIS制
定以前より実施されていること,コ
アリングなどでフィルタを通過した
異物による不具合情報は過去4年間
確認したところないことから,現行
の規格とした。
6.8 点滴筒及び点滴口
寸法規定を削除
6.8
点滴口の末端と点滴筒
の出口との間隔は40
mm以上,又はフィルタ
と点滴口の末端が20
mm以上
変更
この規格では,寸法の規定を削
除した。
より性能の高い点滴筒の開発に制約
がかかる可能性を考慮して修正し
た。
対応国際規格の見直しの際,提案を
検討。
6.10 流量
(この規格では不採用)
6.10
流量について規定
10分間に1 000 mL以上
と規定
削除
この規格では,流量規定を削除
した。
国内流通品を考慮して不採用とし
た。
6.11 混注部
針使用と針不使用との混
注部を規定
6.11
針使用の混注部につい
てだけ規定
追加
この規格では,針不使用の混注
部も規定した。
国内流通品を考慮し修正した。
6.12 おす(雄)かん(嵌)
合部
ISO 80369-7を規定
6.12
ISO 594-1及びISO
594-2を規定
変更
この規格では,ISO 80369-7へ変
更した。
最新のISO 80369-7だけを適用する
ように変更した。
6.13 保護キャップ
確実に装着でき,かつ,
容易に外せることが望ま
しい。
6.13
無菌性維持も規定
変更
この規格では,無菌性維持の規
定を削除した。
一次包装での無菌性を確保してお
り,使用環境からも保護キャップで
の無菌性維持の必要性は低いと考え
られることから削除した。
4
T
3
2
11
-4
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
18
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
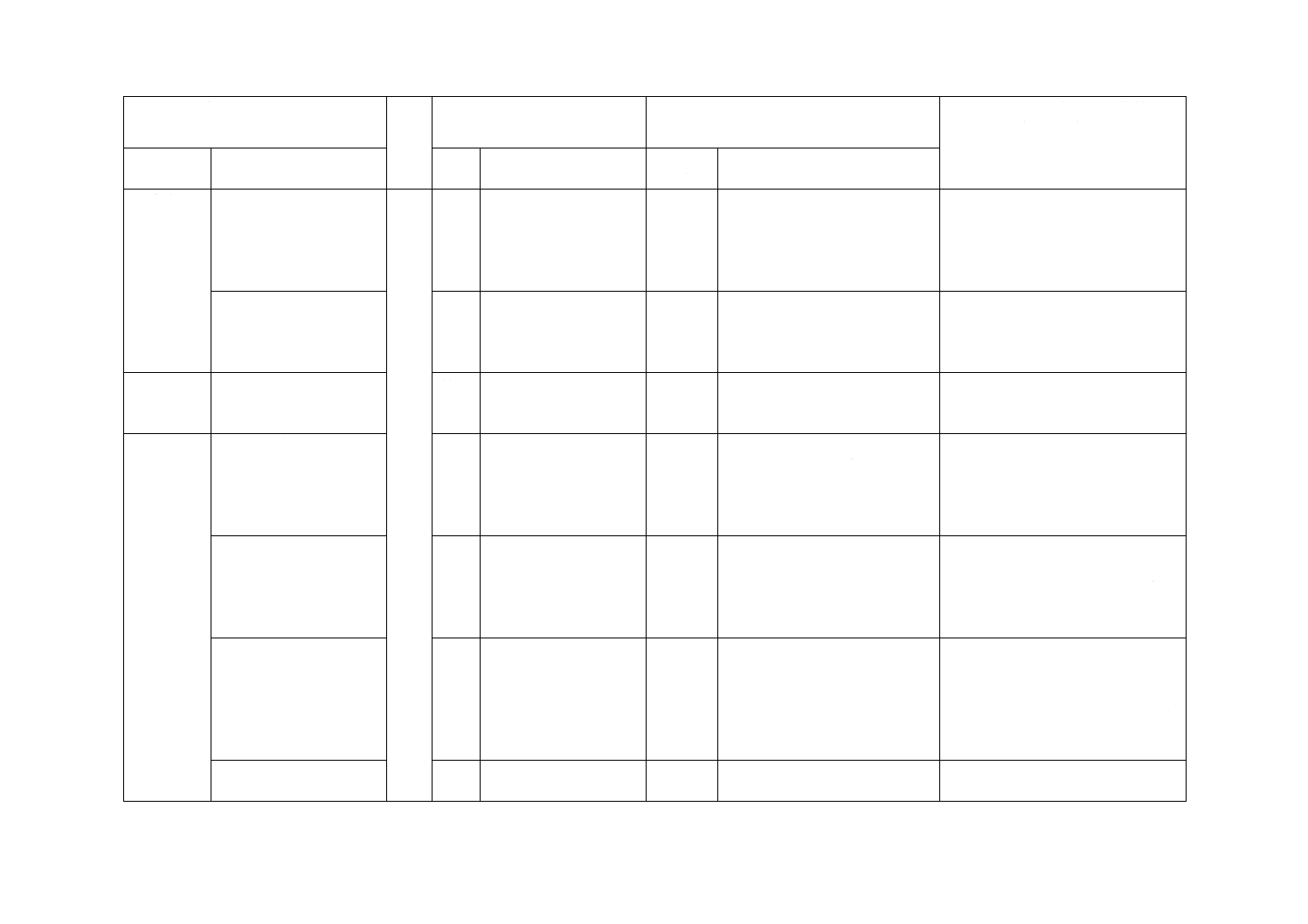
7 化学的要
求事項
溶出物試験第一法,第二
法を規定
7
JISの溶出物試験第二法
に該当する方法だけを
規定
選択
この規格では,溶出物試験第一
法を選択として追加。
これまでに採用している溶出物試験
第一法を選択可能とした。
8 生物学的
安全性
8.2 無菌性
滅菌バリデーション基準
又はこれと同等以上の基
準に基づく。
8.2
ISO 11135,ISO 11137及
びISO 17665による。
変更
この規格では,無菌性で滅菌バ
リデーション基準としたが,ISO
規格と同等の基準であり,我が
国で実績のある基準を記載し
た。
滅菌バリデーション基準について記
載。技術的差異はない。
9 表示
9.1 一般
−
−
追加
この規格では,表示に関する要
求を明確にするため,表示に関
する一般要求事項を追加した。
利用者の利便性のため,実質的な差
異はない。
9.2 a)
9.3 a)
製造販売業者の氏名又は
名称及び住所
9.1
9.2
製造業者及び/又は供
給者の名前及び住所
変更
この規格では,医薬品医療機器
等法に従った記載とした。
技術的差異はない。
−
9.1
c)
発熱性及びエンドトキ
シンがないことの表示
削除
この規格では,削除した。
医薬品医療機器等法上も要求がない
ことから削除した。
9.2 一次包装
上記情報の判読可能な文
字,記号を記載するため
に使用できる場所が小さ
い場合は,d) 及びe) だ
けにしてもよい。この場
合,この細分箇条で要求
する情報は,二次包装に
表示しなければならな
い。
9.1
記載なし
追加
JIS T 3211-8〜JIS T 3211-11に追
記した内容を,この規格におい
ても同様の場合があるため追記
した。
技術的差異はない。
4
T
3
2
11
-4
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
19
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
10 包装
10.1 一次包装
10.1
個包装であることの要
求,保管時の滅菌状態維
持の要求,及び開封した
ことが明確に分かるこ
との要求
変更
個包装であることの要求を削除
し,内容物の適切な保護に関す
る要求を追加。
技術的差異はない。
10.2 二次包装
10.2
包装による潰れ,キンク
がなく,すぐに使用可能
であることの要求
変更
潰れ,キンク,すぐに使用可能
状態であることの要求を削除
し,二次包装の強度に関する要
求を追加。
製品保護に関する要求は10.1(一次
包装)で規定。二次包装に関する強
度要求を明確に記載した。
−
−
11
廃棄に関する規定
削除
廃棄物処理法で規定されている
ことから,この規格では,不採
用とした。
技術的差異はない。
附属書A
(規定)
A.1.3 手順
光遮蔽式液中粒子計数器
での計測方法を追記
A.1.3 記載なし
追加
この規格では,日本薬局方で採
用されている“光遮蔽式液中粒
子計数器”での計測方法を,現
行の顕微鏡を用いて計測する方
法の代替法として追加した。
この規格では,ISO規格で規定する
方法に加え,精度の高い方法も記載
した。
A.2.2
40 ℃±1 ℃
A.2.2 40 ℃
変更
この規格では,40 ℃±1 ℃とし
た。
2015年に改訂したISO 8536-8〜ISO
8536-11では,40 ℃±1 ℃と修正され
ており,今後ISO 8536-4でも同様の
修正が予想されることからこの規格
でも現段階で修正した。
A.2.3
(この規格では不採用)
A.2.3 減圧時の気密性試験
削除
この規格では,減圧時の気密性
試験を不採用とした。
ポンプの使用によって減圧状態にな
った状況での規定と推測。2015年改
訂のISO 8536-9〜ISO 8536-11から
削除されており,今後ISO 8536-4で
も削除が予想されることからこの規
格でも現段階で削除した。
−
A.5
フィルタの性能試験
削除
この規格では,フィルタの性能
試験を不採用とした。
この規格では,通液フィルタは旧規
格を踏襲したため,不採用とした。
4
T
3
2
11
-4
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

20
T 3211-4:2019
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JISと国際規格との対応の程度の全体評価:(ISO 8536-4:2010,Amd.1:2013,MOD)
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
4
T
3
2
11
-4
:
2
0
1
9
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。