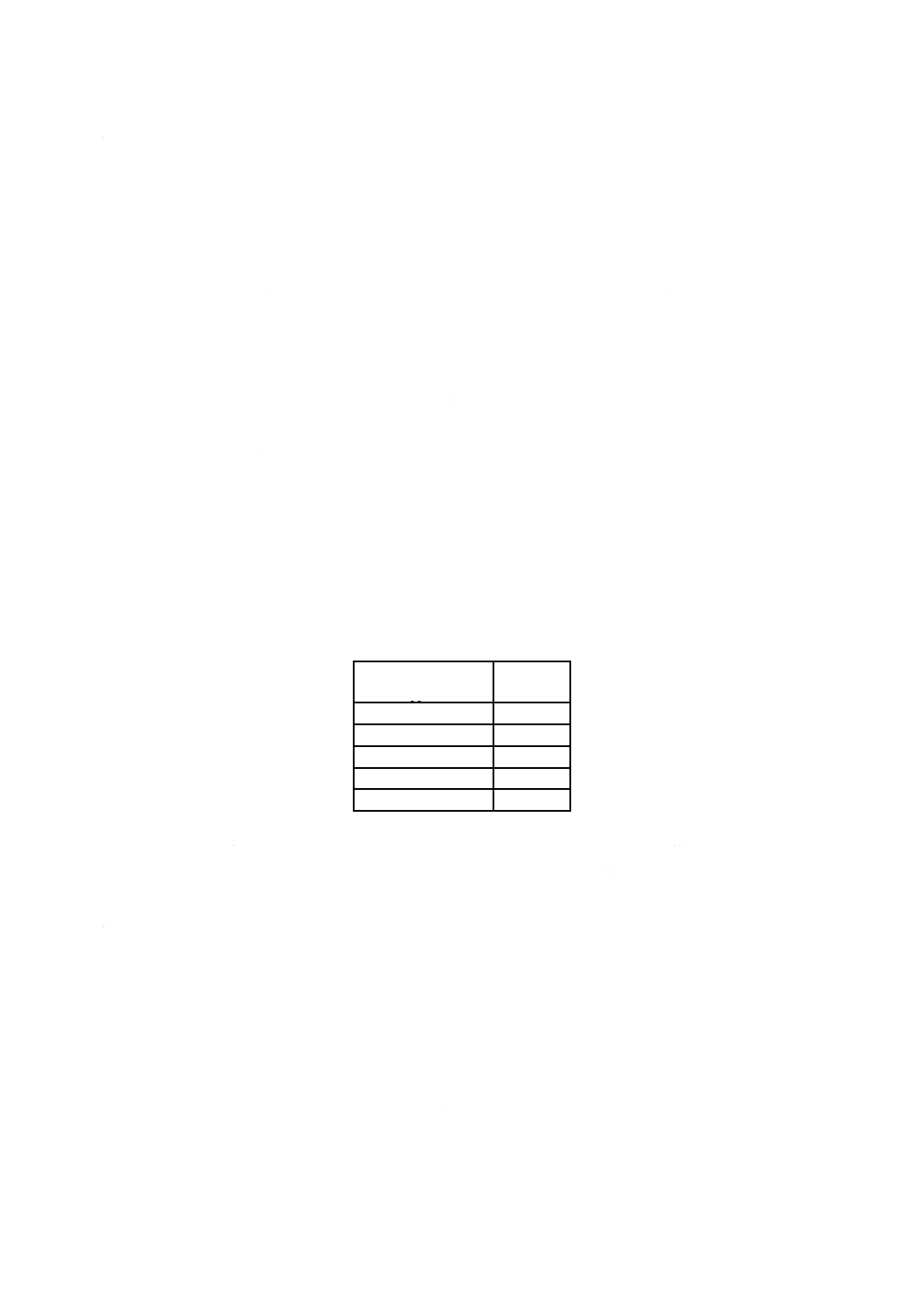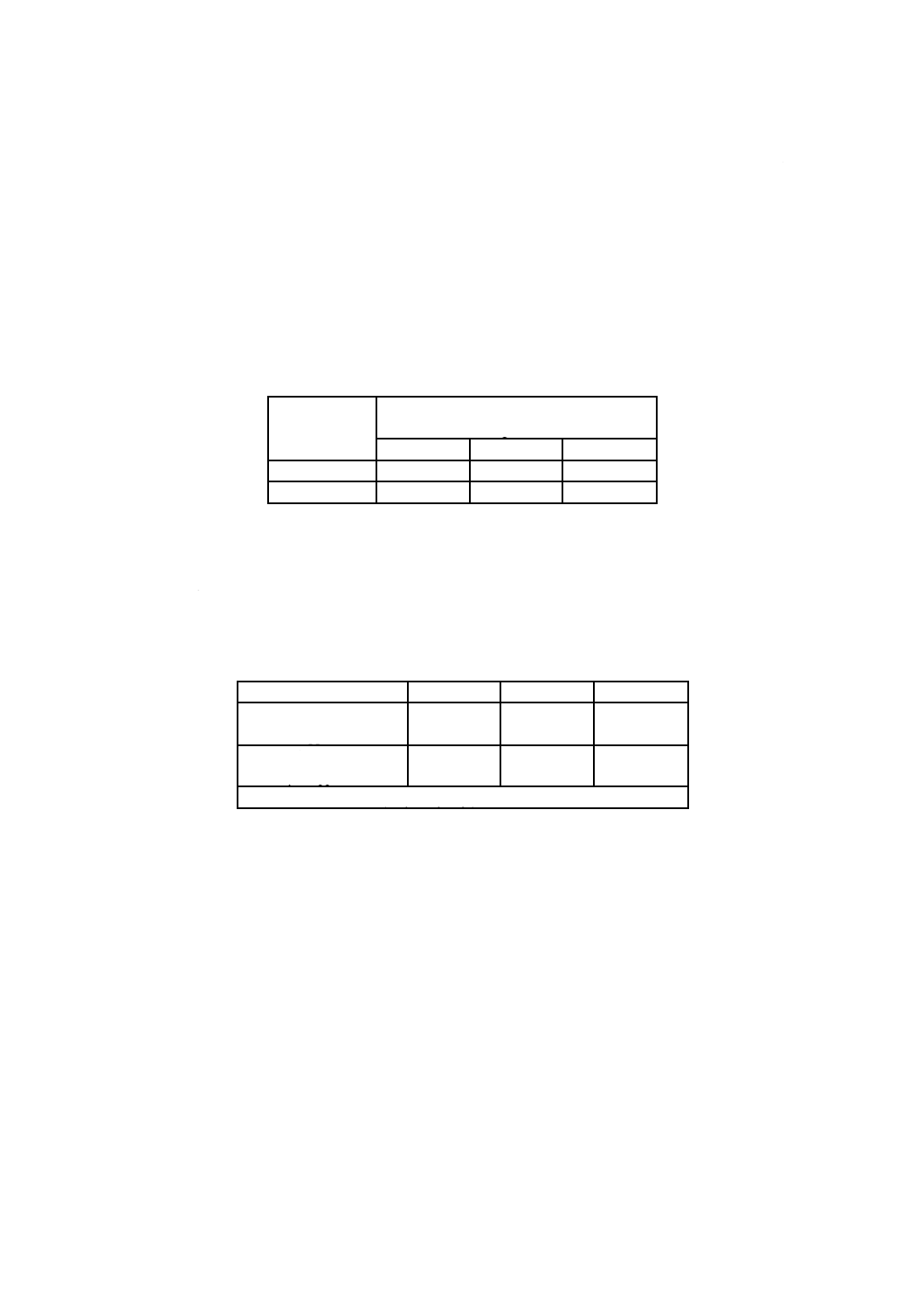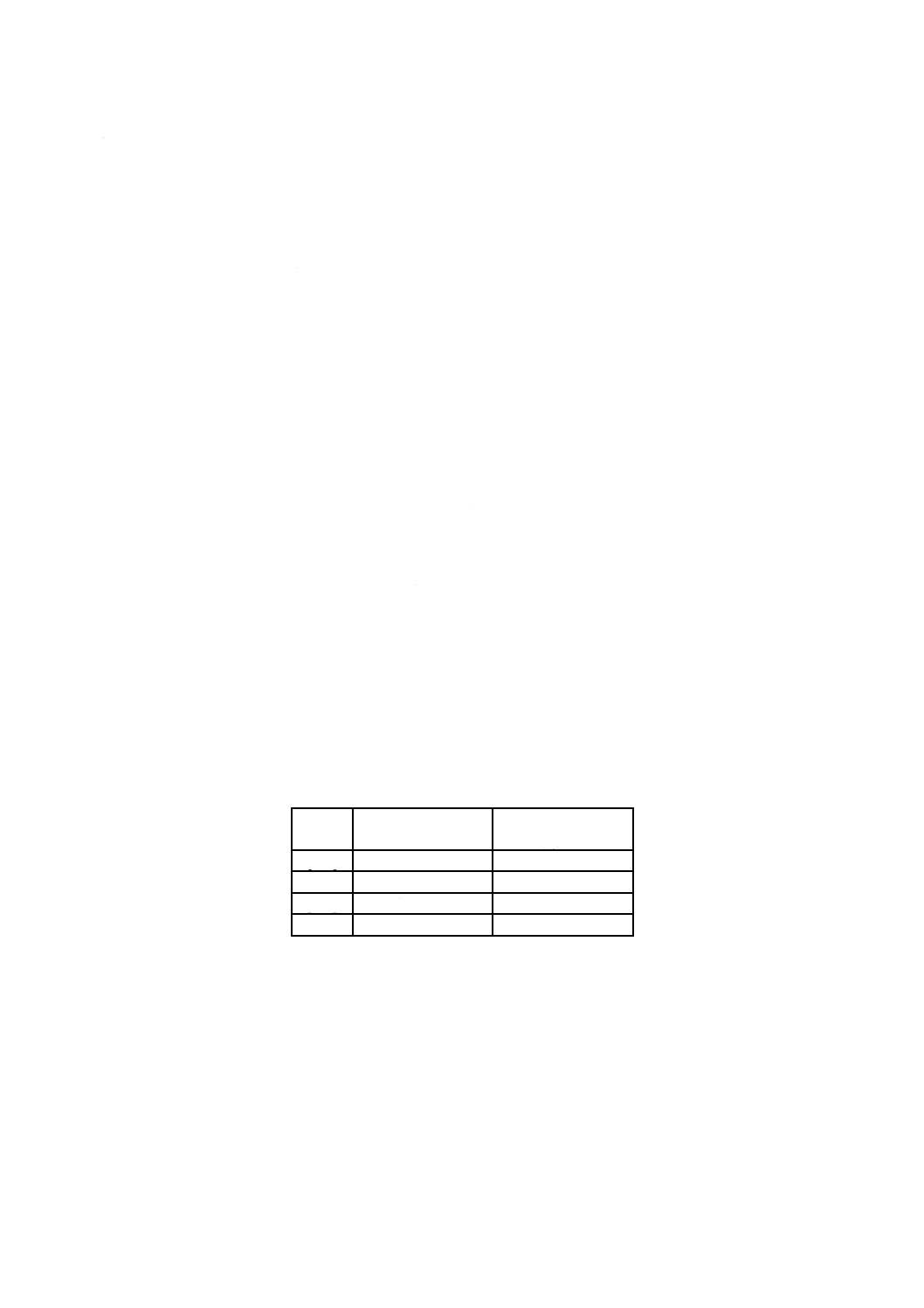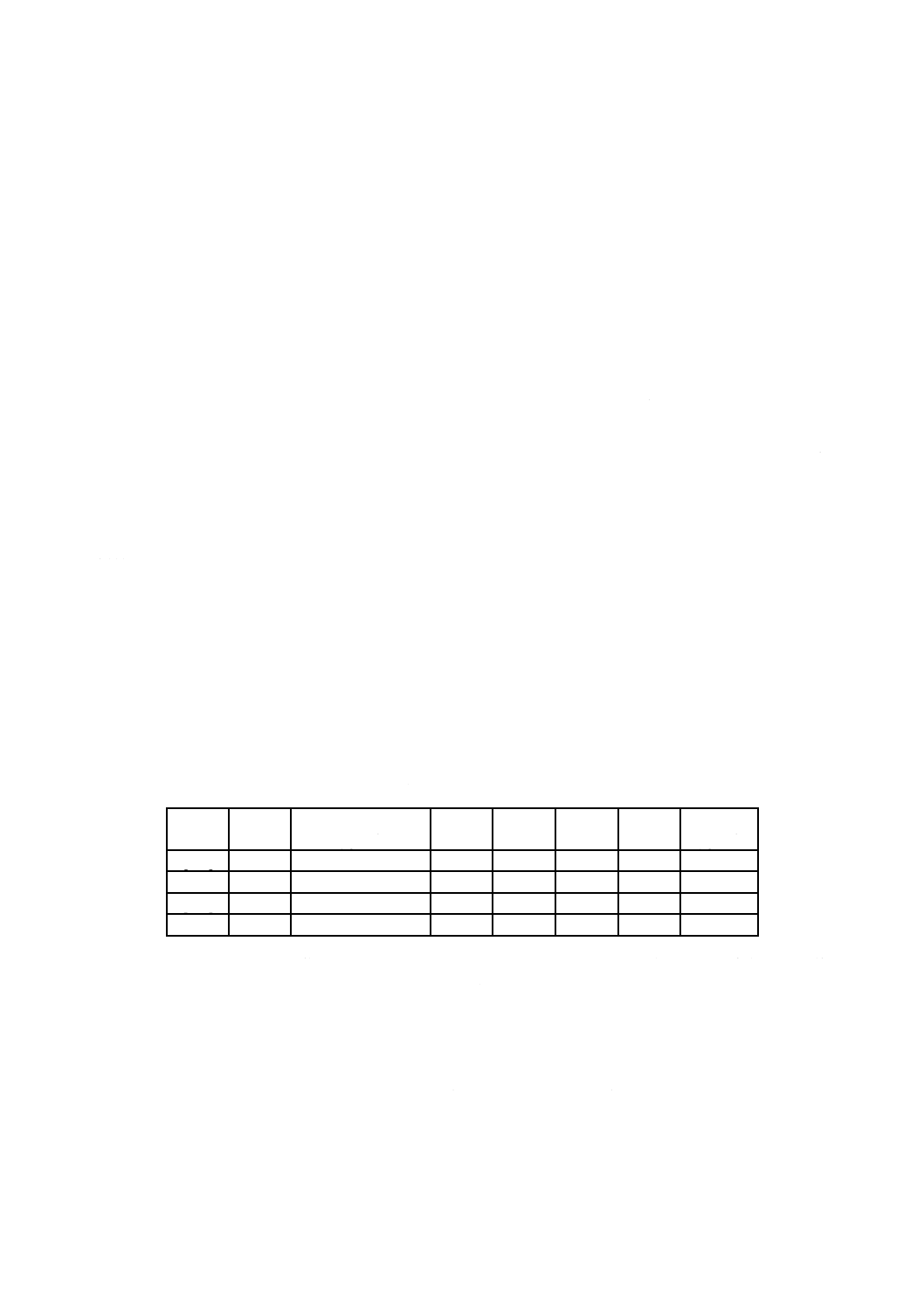T 0993-7:2012 (ISO 10993-7:2008)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 2
3 用語及び定義 ··················································································································· 2
4 要求事項························································································································· 2
4.1 一般 ···························································································································· 2
4.2 医療機器のカテゴリ分類 ································································································· 3
4.3 許容限度値 ··················································································································· 3
4.4 EO及びECH残留物の測定 ····························································································· 5
5 製品出荷························································································································ 10
5.1 一般 ··························································································································· 10
5.2 減衰曲線データが得られない場合の製品出荷 ······································································ 10
5.3 残留物減衰曲線を用いる製品出荷····················································································· 10
附属書A(規定)ガスクロマトグラムの評価 ············································································ 12
附属書B(参考)EO及びECHのガスクロマトグラフ測定·························································· 15
附属書C(参考)この規格を医療機器中の残留EO及びECHの定量に適用するための
フローチャート及び手引 ································································································· 18
附属書D(参考)製品残留物に影響する要因 ············································································ 26
附属書E(参考)残留EOを測定するための抽出条件 ································································· 28
附属書F(参考)この規格の理論的根拠 ··················································································· 29
附属書G(参考)EOの許容限度値の設定 ················································································ 33
附属書H(参考)ECHの許容限度値の設定 ·············································································· 50
附属書I(参考)EGの許容限度値の設定 ················································································· 58
附属書J(参考)EO及びECH標準液の調製 ············································································ 62
附属書K(参考)エチレンオキサイド残留物の測定方法 ····························································· 65
附属書L(参考)参考文献 ···································································································· 72
T 0993-7:2012 (ISO 10993-7:2008)
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,日本医療器材工業会(JMED)及び財団法人
日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日本工業
標準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
JIS T 0993の規格群には,次に示す部編成がある。
JIS T 0993-1 第1部:リスクマネジメントプロセスにおける評価及び試験
JIS T 0993-7 第7部:エチレンオキサイド滅菌残留物
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格
JIS
T 0993-7:2012
(ISO 10993-7:2008)
医療機器の生物学的評価−
第7部:エチレンオキサイド滅菌残留物
Biological evaluation of medical devices-
Part 7: Ethylene oxide sterilization residuals
序文
この規格は,2008年に第2版として発行されたISO 10993-7を基に,技術的内容及び構成を変更するこ
となく作成した日本工業規格である。
医療機器の滅菌にエチレンオキサイド(以下,EOという。)を用いることの妥当性を確認するためには,
残留EO,エチレンクロロヒドリン(以下,ECHという。)及びエチレングリコール(以下,EGという。)
のレベルが,製品を通常に使用する患者に対するリスクを最小限のものにしていることを確認することが
重要である。したがって,製品の設計・開発時に代替材料の使用又は代替滅菌法を考慮することが重要で
ある。EOは多くの生物学的影響を示すことが知られている。この規格を作成する段階では,刺激性,臓
器損傷,変異原性及びヒトと動物に対する発がん性,動物における生殖影響を含むこれらの影響を考慮し
た。ECH及びEGの有害な影響についても同様に考慮した。実際には,多くの医療機器において,EO及
びECHへのばく(曝)露はこの規格に規定する最大量よりもかなり少ない。
加えて,EO滅菌が選択された場合は,この規格の規定のいかんにかかわらず,EO残留物のばく露は,
最小限にするのが望ましい。ここに規定する要求事項は,JIS T 0993-1に規定するとおり個別に設計され
た医療機器それぞれの生物学的評価及び試験の要求事項に追加するものである。生物学的評価及び試験の
要求事項は,EO滅菌プロセス残留物限度と併せて,EO滅菌医療機器の使用を容認することを裏付けるも
のである。EO滅菌済み医療機器にECHが存在することが分かった場合は,ECHの最大許容残留量につい
ても規定している。局所影響(例えば,刺激性)を考慮しており,EOについては4.3.5.2及び附属書Gに,
ECHについては4.3.5.3及び附属書Hに記載しているように,耐容接触限度(TCL)として規定している。
1
適用範囲
この規格は,個々のエチレンオキサイド(EO)滅菌による医療機器の残留物としてのEO及びエチレン
クロロヒドリン(ECH)の許容限度値,EO及びECHの測定方法,並びに医療機器を出荷するための適合
性を判断する方法について規定する。追加的な背景として,この文書をどのように適用するかを示すガイ
ダンス及びフローチャートを参考としての附属書Cに記載している。
患者と接触のない医療機器(例えば,体外診断機器)でEO滅菌されているものについては,適用しな
い。
注記1 この規格は,エチレングリコール(EG)の限度値については規定しない。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 10993-7:2008,Biological evaluation of medical devices−Part 7: Ethylene oxide sterilization
2
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
residuals及びTechnical corrigendum 1:2009(IDT)
なお,対応の程度を表す記号“IDT”は,ISO/IEC Guide 21-1に基づき,“一致している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and
testing within a risk management process(MOD)
ISO 10993-3,Biological evaluation of medical devices−Part 3: Tests for genotoxicity, carcinogenicity and
reproductive toxicity
ISO 10993-10,Biological evaluation of medical devices−Part 10: Tests for irritation and skin sensitization
ISO 10993-12,Biological evaluation of medical devices−Part 12: Sample preparation and reference materials
ISO 10993-17:2002,Biological evaluation of medical devices−Part 17: Establishment of allowable limits for
leachable substances
3
用語及び定義
この規格で用いる主な用語及び定義は,JIS T 0993-1によるほか,次による。
3.1
模擬使用抽出(simulated-use extraction)
製品の使用を模した水抽出を用いて日常的な医療機器の使用中に医療機器から患者又は使用者に移行す
る可能性のある残留物のレベルを評価することで,この規格に適合していることを確認するための抽出。
3.2
徹底抽出(exhaustive extraction)
連続した抽出によってEO又はECHの量が最初の抽出で検出された量の10 %未満になるまで,又は繰
り返し残留物量を調べても分析的に有意な量の増加が検出できなくなるまで行った抽出。
注記 残留物回収の徹底性を明示することはできないので,徹底抽出の定義は上記のとおりとする。
4
要求事項
4.1
一般
この箇条は,EOで滅菌した個々の医療機器におけるEOの最大許容残留量を規定する。医療機器のEO
滅菌を行うことの妥当性を確認するためには,残留EO,ECH及びEGのレベルが,通常の製品使用条件
において患者に対するリスクを最小限のものにしていることを確認することが重要である。さらに,EO
滅菌を選択した場合は,この規格の規定にかかわらず,EO残留物のばく露を最小限にすることが望まし
い。EO滅菌した医療機器にECHが存在していることが明らかになったときは,ECHの最大許容残留量も
規定する。局所影響(例えば,刺激性)は考慮しており,EOについては4.3.5.2及び附属書G,ECHにつ
いては4.3.5.3及び附属書Hに記載しているように,耐容接触限度(Tolerable Contact Limit: TCL)として
規定している。EGの医療機器における限度値は規定していない。理由は,リスクアセスメントの結果,
3
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
計算によって求めた許容レベルは医療機器において起こり得るばく露レベルよりも高いことが示されたか
らである(附属書I)。しかし,EGのような高浸透圧性物質が静脈内に急速に注入された場合は,急性の
血液動態的影響及び溶血性の影響をもたらす可能性が存在する。医療機器のEO滅菌では高浸透圧性溶液
が生じるとは想定できない。EO及びECHの定量方法は4.4による。
この規格の要求事項は,JIS T 0993-1に規定されている生物学的試験に追加するものである。EOで滅菌
した医療機器においては,特にISO 10993-3及びISO 10993-10にも注意を払わなければならない。個別に
設計した個々の医療機器の出荷時には,JIS T 0993-1の適用可能な全ての要求事項に配慮しなければなら
ない。
医療機器の生物学的評価の結果によっては,全身影響を防ぐために4.3で規定された限度値よりも厳し
い限度値が必要になる場合がある。
注記 この規格の限度値算出についての情報は,この規格の使用に関わる他の重要な背景情報及び指
針とともに,附属書A〜附属書Kに記載している。
4.2
医療機器のカテゴリ分類
患者に移行することが許されるEO及びECHの1日最大用量を設定する際には,医療機器を接触時間に
応じてカテゴリ分けする必要がある。
医療機器をJIS T 0993-1の5.3(接触期間によるカテゴリ化)に従って,三つのばく露カテゴリの一つに
分類しなければならない。
a) 一時的接触 単回又は複数回使用され,その累積の接触期間が24時間以内の医療機器。
b) 短・中期的接触 単回又は複数回使用され,その累積の接触期間が24時間を超えるが,30日以内の
医療機器。
c) 長期的(永久)接触 単回又は複数回使用され,その累積の接触期間が30日を超える医療機器。
ある材料又は医療機器が一つ以上の期間カテゴリに属する場合は,より厳しい試験の要求事項を適用す
ることが望ましい。多数回ばく露の場合,ある医療機器がどのカテゴリに属するかの決定は,ばく露が起
きる時間の長さに留意して,潜在的な累積効果を考慮することが望ましい。
注記 この規格に用いられているように,“多数回使用”とは同じタイプの医療機器を繰り返し使用す
ることと定義する。例,ダイアライザーカートリッジ。
4.3
許容限度値
4.3.1
一般
それぞれの医療機器において,患者に移行する最大許容用量は,4.2によって決定したばく露カテゴリご
とに,次に示す値を超えてはならない。
長期的(永久)接触医療機器及び短・中期的接触医療機器の限度値は,1日平均最大用量として表現さ
れる。これらの限度値に加え,ばく露期間の最初の24時間及び長期的(永久)接触医療機器の場合は,最
初の30日間にも追加の制約がある。これらの制約は,これら初めの期間に患者に移行するEO及びECH
の量に限度を設けている。利用可能なデータがあるときは,残留物のある複数の医療機器を一度に使用す
る場合は限度値を引き下げて,医療機器がばく露期間の一部だけ使用される場合には限度値を引き上げて,
調整することを考慮することが望ましい。これらの同時使用係数[concomitant exposure factors (CEF)]及
びばく露均一化係数[proportional exposure factors (PEF)]についてはISO 10993-17に記載している。許容
限度値設定に使用された手法は,EOについては附属書Gに,ECHについては附属書Hに記載している。
そしてEGの許容限度値設定についての理論的根拠は,附属書Iに記載している。
4.3.2
長期的(永久)接触医療機器
4
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
最大EO用量は,次の値を超えてはならない。
− 最初の24時間で4 mg
− 最初の30日で60 mg
− 生涯で2.5 g すなわち,1日平均用量は0.1 mg
最大ECH用量は,次の値を超えてはならない。
− 最初の24時間で9 mg
− 最初の30日で60 mg
− 生涯で10 g すなわち,1日平均用量は0.4 mg
4.3.3
短・中期的接触医療機器
最大EO用量は,次の値を超えてはならない。
− 最初の24時間で4 mg
− 最初の30日で60 mg すなわち,1日平均用量は2 mg
最大ECH用量は,次の値を超えてはならない。
− 最初の24時間で9 mg
− 最初の30日で60 mg すなわち,1日平均用量は2 mg
4.3.4
一時的接触医療機器
患者へ移行するEOの1日平均用量は,4 mgを超えてはならない。
患者へ移行するECHの1日平均用量は,9 mgを超えてはならない。
4.3.5
表面接触医療機器及び埋植医療機器の耐容接触限度
4.3.5.1
概要
耐容接触限度(以下,TCLという。)は,EOについてはマイクログラム毎平方センチメートル(μg/cm2)
で,ECHについてはミリグラム毎平方センチメートル(mg/cm2)で表す。単位に使用している平方センチ
メートルは,患者と医療機器との接触面の表面積を表す。
注記 この細分箇条の目的は,医療機器から放出されるEO又はECHによる局所刺激を防ぐことにあ
る。
4.3.5.2
EOの耐容接触限度
表面接触医療機器及び埋植医療機器は,EOのTCL値10 μg/cm2を超えないか,又はISO 10993-10で規
定する低刺激性でなければならない。
4.3.5.3
ECHの耐容接触限度
表面接触医療機器及び埋植医療機器は,ECHのTCL値5 mg/cm2を超えないか,又はISO 10993-10で規
定する低刺激性でなければならない。
4.3.6
特別な場合
複数の医療機器からなるシステムにおいては,患者に接触する個々の医療機器ごとに限度値を適用しな
ければならない。
眼内レンズ中のEO残留物は,1日当たりレンズ1枚当たり0.5 μg,又はレンズ1枚当たり1.25 μgを超
えてはならない。他の眼内医療機器の限度値は,眼内レンズ質量を20 mgとして,医療機器質量に比例し
て設定する。塩素を含む粘弾性材料で作られた眼内医療機器のECHレベルが受け入れられるものかどうか
は,眼内毒性を示すECHレベルがEOの対応するレベルより約4倍高いことを考慮して評価することが必
要となる場合がある。
患者及びドナーの血液採取に使用する血球分離装置では,EOの最大許容用量は10 mgであり,ECHの
5
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
最大許容用量は22 mgを超えてはならない。
人工肺及び血液分離装置では,EOの最大許容用量は60 mgであり,ECHの最大許容用量は45 mgを超
えてはならない。
心肺バイパス術に用いる医療機器の最大許容用量は,EOは20 mg,ECHは9 mgとする。
体外循環血液浄化機器のEO及びECHの限度値は,それぞれ医療機器当たり4.6 mgとする。しかし,
生涯の許容EO用量については超えてもよい。
健常皮膚だけに接するドレープの最大許容限度値は,TCLでEOが10 μg/cm2及びECHが5 mg/cm2であ
るか,又はそのドレープがISO 10993-10で規定する低刺激性でなければならない。
注記 一般要求事項が当てはまらないある種の医療機器のEO限度値を決定する理論的根拠を,附属
書Fに記載している。
この規格を適用して医療機器中のEO残留物を測定するための指針となるフローチャートを,附属書C
に記載している。
4.4
EO及びECH残留物の測定
4.4.1
一般
4.4.1.1
手順
4.3に適合するか否かを決定する手順は,サンプルからの残留物の抽出,残留物量の測定,医療機器の接
触表面の測定,並びにデータの分析及び解釈で構成する。
警告 サンプルを取り扱う分析者及びその他の人は,ここで示されている測定手順に必要な化学物質及び
溶剤の使用を含む全ての作業を,適切な防護服を着て排気フードの中で行うことが望ましく,そし
て使用の前に製品安全データの情報を確認することが望ましい。EO滅菌済み医療機器を使う医療
従事者は,残留物のばく露を避けるために適切な予防措置を取らなければならない。それは各国の
労働安全衛生規則で規定されている場合がある。
我が国においては,労働安全衛生法,毒物及び劇物取締法等の関連法規を遵守して作業する必要
がある。
4.4.1.2
EO
EOは人体表面に対して刺激性があり,かつ,反応性が高い可燃性の気体である。それは様々な環境下
で変異原性があり,胎児毒性及び催奇形性をもち,精巣機能に有害な影響をもたらす可能性があり,人体
の多くの臓器系に障害を与える。動物による発がん実験において,吸入ばく露によって白血病,脳腫瘍及
び乳がんを含む幾つかの腫瘍性の変化が生じた。また,摂食及び皮下投与によって接触部位にだけ腫瘍が
生じた。ある研究者はばく露した労働者のある集団が高い発がん率及び死亡率を示すと報告した。しかし
幾つかの最近の労働者を対象とした研究の結果,関連性は薄いことが示された。参考文献 [177],[178] 及
び [181] 参照(以下,参考文献を文献という。)。1994年に国際がん研究機構(IARC)は,主として作用
機序に基づいて,EOをヒト発がん性物質(グループ1)に再分類した(文献 [75] 参照)。
4.4.1.3
ECH
ECHは人体表面に対して刺激性のある可燃性液体である。そして急性毒性を示し,有害性を示す量が容
易に皮膚を通過して吸収される。弱い変異原性があり,ある程度の胎児毒性及び催奇形性をもつ。肺,腎
臓,中枢神経系及び心臓血管系に障害をもたらす可能性があるが,動物のバイオアッセイによれば発がん
性は陰性である。
4.4.2
残留物の測定
適切な抽出方法及び測定方法を使用して患者へ移行するEOを,必要があればECHも,定量をしなけれ
6
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ばならない。
K.4.2又はK.4.7に示された方法で分析した結果,ECHが検出されなかった場合は,それ以上ECHを測
定する必要はない。
注記 パックドカラムの替わりにキャピラリーカラムを使用した多くのガスクロマトグラフ法で,
EO,ECH及びEGの定量結果が1回のサンプル測定で求められる。
EO及び必要がある場合のECHの定量における適切な抽出方法(4.4.6)の選択は,患者への用量が4.3
で規定した要求事項に適合していることを示すことができるかどうかによる。
残留物が徹底抽出によって試験した製品の要求事項の範囲内であることが示された場合は,4.3の全ての
該当する限度値に適合している場合は,更に模擬使用抽出による製品の試験を行う必要はない。徹底抽出
を使用するときは,4.3で最初の24時間及び最初の30日間で規定されている限度値に特に注意を払わなけ
ればならない。
これらのEO滅菌残留物の分析方法は参考文献に記載され,評価されている。しかし,滅菌医療機器に
は非常に様々な材料及び組立て方法が採用されているので,ある場合には,参考文献に記載されている方
法にも依然として残留EO及び残留ECHを定量するのに問題があることがある。したがって,分析方法と
して適正であることが示された(すなわち,真度,精度,直線性,感度,選択性が明示されている)どの
ような分析方法も,妥当性が検証されている場合は,使用することが可能である。附属書Aにはガスクロ
マトグラフ法の一般的な検証の要求事項を示す。
4.4.3
製品サンプル採取及び“空試験”サンプル
4.4.3.1
製品サンプル採取
残留物分析に用いるサンプルは,真に製品を代表するように選ばなければならない。サンプルを選ぶと
きには,附属書Dに記載する多くの要因に注意を払わなければならない。これらの要因は医療機器の構成
部品の残留物初期レベルだけでなく,残留物の減衰量にも影響するので,滅菌済み製品からテストサンプ
ルを抜き取って分析のために施設に送るときは,それらの要因を考慮しなければならない。滅菌サイクル
完了直後に製品サンプルの抜き取りを行うこと,滅菌事業所から遠く離れた施設へ送ること及び後で分析
するために保管することは,サンプル中の残留物レベルと残りの製品中の残留物レベルとの関係が損なわ
れる可能性がある。それにもまして,サンプルのエアレーション条件への影響が無視できるような抜き取
りができない又は取扱いができない場合は,滅菌済み製品のエアレーションとサンプルのエアレーション
との関係を明らかにする実験を様々な季節において行わなければならない。
出荷用製品から抜き取った試験サンプルのエアレーションの速度に対する施設条件の影響を最小にし,
管理するための予防措置を取られなければならない(D.1.5参照)。加えて,操作者及び分析者の安全が確
保されなければならない。サンプルは,分析当日まで滅菌済み製品と一緒に置くか,又は試験サンプルを
取り出した後は直ちに冷凍することが望ましい。管理されたエアレーションエリアからのサンプルの移動
から抽出の開始までの時間は,最小にすることが望ましい。分析が遅れたときは,冷凍状態で密封し,輸
送し,冷凍保存しなければならない。サンプルは,翌日配達便ではドライアイスとともに輸送しなければ
ならない。ドライアイスは,輸送の期間中及び施設で開けたときにも輸送容器の中に残っていなければな
らない。試験サンプルは,必要なエアレーション間隔で滅菌済み製品から直接抜き取られ,直ちにヘッド
スペースバイアルに保管され,分析のために施設に輸送されることが望ましい。代替手段として,サンプ
ルを抽出し,抽出液を分析のために施設まで輸送する方法もある。抽出液が水である場合は,液を到着ま
で氷冷温度(<10 ℃)に維持して輸送しなければならない。試験は,EOがEGに加水分解する量を測定
して行うことが望ましい。
7
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
分析サンプルは,排気フードの中に置いて包装から取り出さなければならない。サンプルは,製品ラベ
ル中の適切な使用前説明に従って準備しなければならない。抽出は,医療機器を包装から取り出した後,
又は必要な使用前準備を行った後,可能な限り速やかに始めなければならない。
4.4.3.2
“空試験”サンプル
測定する残留物と同じ保持時間に存在する共雑成分が存在しないことを確実にするために,EO滅菌さ
れたサンプルと同一の手順で未滅菌のサンプルを抽出することで,“空試験”サンプルの評価をしなければ
ならない。このような“空試験”サンプルから抽出された物質が,ガスクロマトグラフ分析において保持
時間が妨害される又は重なる場合は,ガスクロマトグラフ条件を変更して妨害ピークを分析対象ピークと
分離するか,又は代わりの分析方法を使用しなければならない。
4.4.4
サンプルと抽出液の比率
医療機器又はその代表的な部分の抽出に使用する液体の体積は,検出感度を維持しながら抽出効率を最
大化するのに十分でなければならない。医療機器サンプルの性質及び大きさが抽出に最適な液量の構成比
率を決定する。したがって,分析感度を最大化するために,抽出液の体積は,抽出方法及びサンプルの大
きさが求める中で最小化することが望ましい。吸収性の高い材料からなる医療機器,又は充填によって残
留物を抽出する医療機器では,液量の増加を反映したサンプルと抽出液との比率が必要になる可能性があ
る。いずれの場合も,サンプルと抽出液との比率は,検出感度を損なうものであってはならない。
4.4.5
抽出時間及び抽出条件
製品を抽出する目的は,医療機器を実際に使用した場合に患者に移行する最大量を明らかにすることで
ある。その使用は一時的接触医療機器の場合1日単位の使用,短・中期的接触医療機器の場合は1日から
1か月までの使用,長期的(永久)接触医療機器の場合は1日単位,月単位から生涯までの使用である。
附属書E及び附属書Fに記載するように,徹底抽出法は,次に規定するように長期的(永久)接触医療機
器に対して,その短期間の制約(1日及び1か月の限度値)を満たしている場合には,有益な代替方法で
ある。
4.4.6
製品の抽出
4.4.6.1
概要
医療機器のEO滅菌残留物を測定するには,二つの基本的な方法がある。基準抽出法である模擬使用抽
出,及び代替手法となる場合がある徹底抽出法である。抽出方法の選択は医療機器の使用目的に基づかな
ければならない。抽出方法の例を,附属書Kに記載する。
選択される抽出方法は,患者への移行量が最大になる製品の使用を表すものでなければならず,かつ,
単に分析を迅速にするだけのもの,又は残留物の見かけの濃度を小さくするものであってはならない。
抽出の温度及び時間は,患者のばく露の性質並びに4.2及び4.3で規定している患者の医療機器との接触
時間に基づいて決定しなければならない。抽出温度については,ISO 10993-12を参照。
分析者は,ある種の医療機器の模擬使用抽出では,抽出液の体積が比較的大きくなることに注意する。
このことが起こると,残留物質の検出限界が大きく上昇し,この規格に適合しているかどうかの判定が曖
昧になる。
小さな医療機器は,適切な容器に入れて抽出しなければならない。医療機器が大きすぎて全体から抽出
することができない場合は,データの信頼性を高めるために,幾つかの代表部分を抽出することが必要に
なる場合がある。
このような代表部分の選択は,二つの方法から一つを選ぶ。幾つかの異なる材料が用いられている場合
は,全体のサンプル質量を考慮して,それぞれの成分の構成割合は試験に用いる医療機器の総質量におけ
8
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る構成割合に比例することが望ましい。それに代わる方法として,一つの構成部材を選んで試験を行う方
法がある。これはその材料が残留物の含有量が最大となる場合を代表することを示した後に行う。選択し
た方法は,妥当性を検証しなければならない。
4.4.6.2
模擬使用抽出(基準抽出法)
模擬使用抽出は,4.3で規定した限度値及び直接比較することのできる結果を提供する唯一の方法である。
これらの限度値は,患者に移行するEO及びECHの用量として表している。
医療機器から患者又は他の使用者に日常的な使用中に移行する残留物レベルを評価する必要があるので,
使用状況を模した抽出方法を用いる。模擬使用抽出は,使用目的に照らして最も過酷な条件で行わなけれ
ばならない。
例えば,血液接触医療機器及び非経口医療機器の多くは,血液又は溶液(いずれか適切な方)の流路を
水で満たす,又は水を流して抽出することが可能である。サンプルは,単回の最長使用時間と同等又はそ
れ以上の時間,かつ,現実的で使用状況を模した最大の温度で,抽出しなればならない。
患者又は使用者へ移行するEO,及び必要な場合はECHの用量を決定するために,模擬使用水抽出を採
用する。
注記 通常の製品使用の模擬実験として抽出されたEO(又はECH)の量は,製品中の残留物総量に
必ずしも近いとは限らない。
水は,模擬使用抽出で残留EO,及びECH(またEOの加水分解の可能性がある場合にはEG)の回収に
一般に使用されている。水は残留EOをサンプルから溶かし出すのに使用し,サンプル材料自体は溶解し
にくい。医療機器に充填して使用を模擬実験することを意図する場合は,エアポケットを全て除去するよ
うに充填することが望ましい。使用中に全体又は一部が人体と接触する医療機器は,37 ℃(体温)で抽出
することが望ましい。使用中に人体と直接接触しない医療機器(例,皮下注射用シリンジ)は25 ℃(室
温)で抽出することが望ましい。ISO 10993-12も参照する。定量が直ちに行われない場合は,抽出液をサ
ンプルから静かに移し,ポリテトラフルオロエチレン(以下,PTFEという。)を貼ったセプタムキャップ
のバイアルに封入することが望ましい。標準溶液又は抽出液を入れたバイアル中の空隙(ヘッドスペース)
は総容積の10 %未満でなければならない。抽出液は,数日間冷蔵庫で保管することができる(附属書F
参照)。しかし,水抽出を行う場合は,EOは抽出液の保管中と同様に,抽出中にもEG又はECH(又は両
方)に変化する可能性があることに注意しなければならない(文献[35]参照)。分析者は,サンプルを水で
抽出する場合は,分析場所でのこのEG又はECHへの変化の可能性について評価しなければならない。
4.4.6.3
徹底抽出(可能な代替抽出法)
4.4.6.3.1
概要
徹底抽出は,可能な代替抽出法の代表であり,かつ,有益な情報を提供する。それは患者が受ける用量
より大きいか又は同等の用量を示すものである。このような抽出は,時間の関数としての用量測定ではな
いので,測定された残留物量が最初の1日又は最初の1か月のばく露で患者に移行することはないという
ことが確認できるものではない。しかし,徹底抽出による試験で4.3の全ての適用可能な限度値を満たし,
かつ,残留物が被験製品の要求事項の範囲内であることが示されれば,それ以上模擬使用抽出でその製品
の試験を行う必要はない。徹底抽出が行われた場合には,4.3で最初の24時間及び最初の30日について規
定した限度値に特に注意を払わなければならない。
徹底抽出は,医療機器中に残留物の総量を回収することを目的としている。EOを測定するための抽出
方法には,次のようなものがある。熱抽出を行った後にヘッドスペースガス分析を行う方法,溶媒抽出物
のヘッドスペースガス分析を行う溶媒抽出法,溶媒抽出物のクロマトグラフ分析を行う溶媒抽出法,又は
9
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
EOのブロモヒドリン誘導体化を行って電子捕獲検出器のような高感度GC検出器を用いて測定する溶媒
抽出法である。
4.4.6.3.2
残留EO
残留EOの徹底回収には様々な抽出液が使用されてきた。熱脱着後のヘッドスペースガス分析は,K.4.3
に記載するように抽出液を用いない手順の例である。K.4.3に記載のとおり操作した場合,ヘッドスペー
ス法は,サンプルから全ての残留EOを回収するように設計されているので,徹底抽出とみなすことがで
きる。しかしヘッドスペース法は,大形のサンプル及び複雑なサンプルをそのまま試験することは実行困
難か,又は好ましくない。ポリメチルメタクリレートのようなポリマー材料中の残留物レベルを評価する
ときには,ヘッドスペース法を実行する際,分析者はEOの総回収量を確認することに注意しなければな
らない。
溶媒抽出法では適切な抽出液の選択は,医療機器及びその部材の材料構成に依存している。サンプルか
らのEOの完全な回収を促進するため,そうすることで妨害物質が溶液中に入り込まない場合は,サンプ
ル材料を溶解する溶媒が徹底抽出には適している。ヘッドスペースガス分析と組み合わせた溶媒抽出法が
K.4.4に記載されている。このような方法は,EOとサンプルから同時に抽出された妨害化学物質とを分離
することができることがある。幾つかの抽出液が施設間比較試験で評価されている,文献[112],[113]及び
[114]参照。
慎重な分析手法を取る場合は,ある材料の最初の分析において,徹底抽出法を行うときはいつも,二つ
以上の方法で定量的回収量を検証しなければならない。比較的少量の残留EOを含む医療機器の場合は,
一般的に使用されている方法では,比較的長い抽出時間をかけても,このような少量を抽出することはで
きない場合がある。
4.4.6.3.3
残留ECH
水は,医療機器から残留ECHを抽出する場合に一般的に使用される。これには残留EOの測定について
記載したものと類似の方法が用いられる。
4.4.7
データの分析及び解釈
4.4.7.1
抽出残留物量の計算
抽出液中の残留物濃度Ceは,患者へ移行する量Md(mg)に次のように換算する。
模擬使用で抽出された残留物量は,式(1)によって求める。
(
)
∑
=
×
=
n
i
i
iV
C
M
1
e
e
d
······································································ (1)
ここに,
Md: 抽出残留物量(mg)
n: 抽出回数(回)
Cei: i回目の抽出において,検量線から求めた抽出液中のEO濃度
(mg/mL)
Vei: i回目の抽出における,抽出液量(mL)
徹底抽出で抽出された残留物量は,式(2)によって求める。
(
)
s
d
1
e
e
d
m
m
V
C
'
M
n
i
i
i
×
×
=∑
=
······························································· (2)
ここに, Md': 抽出残留物量(mg)
n: 抽出回数(回)
Cei: i回目の抽出において,検量線から求めた抽出液中のEO濃度
(mg/mL)
Vei: i回目の抽出における,抽出液量(mL)
10
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
md: 医療機器質量(g)
ms: サンプル質量(g)
注記 式(2)は医療機器の一部分が抽出された場合にも適用できる。
4.4.7.2
4.3の許容限度値と比較するための平均移行用量(Madd)の計算
長期的(永久)接触医療機器の平均移行用量,Madd(1日当たりのミリグラム)は,式(3)によって求め
る。
000
25
d
add
M
M
=
··········································································· (3)
ここに,
25 000: 生涯の日数
Md: 抽出残留物(mg)
長期的(永久)接触医療機器は式(4)及び式(5)によって求める値(Madd)が短・中期的接触及び一時的接触
の限度値をも超えてはならない。
短・中期的接触医療機器では,
30
d
add
M
M
=
··············································································· (4)
ここに,
30: 1か月の日数
Md: 抽出残留物(mg)
短・中期的接触医療機器は,式(5) によって求める値(Madd)が一時的接触の限度値をも超えてはならない。
一時的接触医療機器では,
Madd=Md ·················································································· (5)
5
製品出荷
5.1
一般
製品は,EO及び適用可能な場合ECHについての要求事項を満足したときは,この規格に適合する。残
留物の拡散速度論に関する十分な実験データが利用可能な場合は,材料,製造工程及び用途の類似性に基
づき医療機器を分類して品質保証試験を行うことが可能と考えられる(附属書D参照)。
EO滅菌済み製品バッチの出荷の場合は,5.2及び5.3の二つの方法の内の一つが用いられなければなら
ない。
5.2
減衰曲線データが得られない場合の製品出荷
製品の減衰曲線データが利用できない場合は,この規格に適合し,附属書Kに記載した適切な手順に従
って実施された試験からデータが得られ,かつ,4.3に規定したEO及び適用可能な場合はECHに関する
要求事項を満足したときは,当該製品を出荷してもよい。
5.3
残留物減衰曲線を用いる製品出荷
減衰曲線は,製品又は類似製品類が4.3に適合した主にEOについての残留限度値に到達する滅菌後時
間の推定に用いられる。4.3に規定した医療機器の目標EO残留レベルが確実にされるように,実験に基づ
く減衰曲線によって定義した所定の滅菌後時間及び条件に従って,製品は市場に出荷されなければならな
い。エアレーション温度が異なる場合は,1年の異なる時期のエアレーション又は荷置きでの滅菌負荷か
らのデータを蓄積することによって,附属書Dに記載した製品のエアレーション関連情報を検討しなけれ
ばならない。このような減衰曲線を作成するための実験データを得るときには,製品の再滅菌及び隣接領
域に他のEO滅菌医療機器が存在しているかどうかも考慮しなければならない。
管理された条件の下で製造し,滅菌された製品は,JIS T 0801:2010に規定しているように,異なる時期
11
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
に処理した少なくとも3滅菌ロットからデータが蓄積した場合は出荷してもよい。ほとんどの材料及び医
療機器からのEOの減衰は,一次速度式,すなわち(ln[EO])∝(滅菌の後の時間)である。実験的に決
定したEO濃度の自然対数値の滅菌後時間に対するプロットは,直線的である。その場合の製品出荷は,
平均回帰直線が最大許容残留量と交差するときの滅菌後時間に基づかなければならない。このアプローチ
は,次に規定する手順が適用できるほどの十分な量(滅菌回数)の滅菌が行われていない製品に用いるか,
又は減衰曲線データが集められている間用いてもよい。他にも多様な方法が使用可能である。例えば,残
留限度値を満足した後にサンプルを試験する減衰曲線が確立される場合,滅菌後の製品出荷の確立に減衰
曲線の内分法を用いることができる。
減衰曲線の特性を確立するために,同じ製品の少なくとも3ロットでの十分なエアレーション時間点か
らのプールしたデータの回帰分析が,当該製品の許容残留限度値に対する計算された上方95 %予測限界
Lpで製品が出荷されることを可能にする。異なる材料の組合せからなる医療機器の時間−濃度曲線は,全
範囲にわたってこの単純なパターンに当てはまらない場合があり,また,異なる扱いが必要となる場合も
ある。
予測限界Lpを計算する式
b
a
y
x
−
=
o
o
··············································································· (6)
()
(
)
(
)
−
×
−
+
+
×
×
+
=
∑
2
μ
i
2
2
μ
o
2
2
o
p
1
1
x
x
b
y
y
n
b
S
t
x
L
α
α
································ (7)
ここに,
xo: EO限度値に対応した出荷までの経過時間の算術平均値
yo: EO限度値の自然対数値
a: ln[EO]∝時間プロットから得られた回帰直線の切片
b: 回帰直線の傾き
Lp: 製品の単一個体の予測限界
tα: 自由度n-2,有意水準αでのスチューデントt値
(Sα)2: 回帰直線からの残差分散
yμ: ln[EO]値の平均
n: 測定値の数
xi: 測定が行われた滅菌後の個々の時間
xμ: 滅菌後時間の平均値
∑(xi−xμ)2: (時間)の(偏差)平方和
この規格に適合した医療機器の出荷のために得る全てのデータは,妥当な標準作業手順書に従って実施
した実験及びデータ解析から得られたものでなければならない。
附属書Dに記載された滅菌工程パラメータを変更するときは,製品残留物の監査を行わなければならな
い。この監査が残留EOのレベルの増加を示すときは,製品許容性を確実にするために新しい残留減衰曲
線を作成しなければならない。この監査が残留EOのレベルの減少を示すときは,新しい減衰曲線の作成
を考慮することが望ましい。
注記 減衰曲線の検証は,通常,JIS T 0801:2010に従った日常の滅菌再バリデーションの中で行われ
る。

12
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
ガスクロマトグラムの評価
A.1 一般
この附属書は,EO及びECH測定に用いられる分析手順の最小限の要求事項について規定する。ここで,
の要求事項はパックド及びキャピラリーガスクロマトグラフ法カラムシステムの両方に適用する。
A.2 背景
これらの要求事項は,ガスクロマトグラフ法の文献に記載されており,いずれの手順でも用いられる前
に分析者によって評価されることが望ましい。また,検出限界に関する論文の評価も推奨される(文献 [15],
[35] 及び [74] 参照)。
A.3 記号
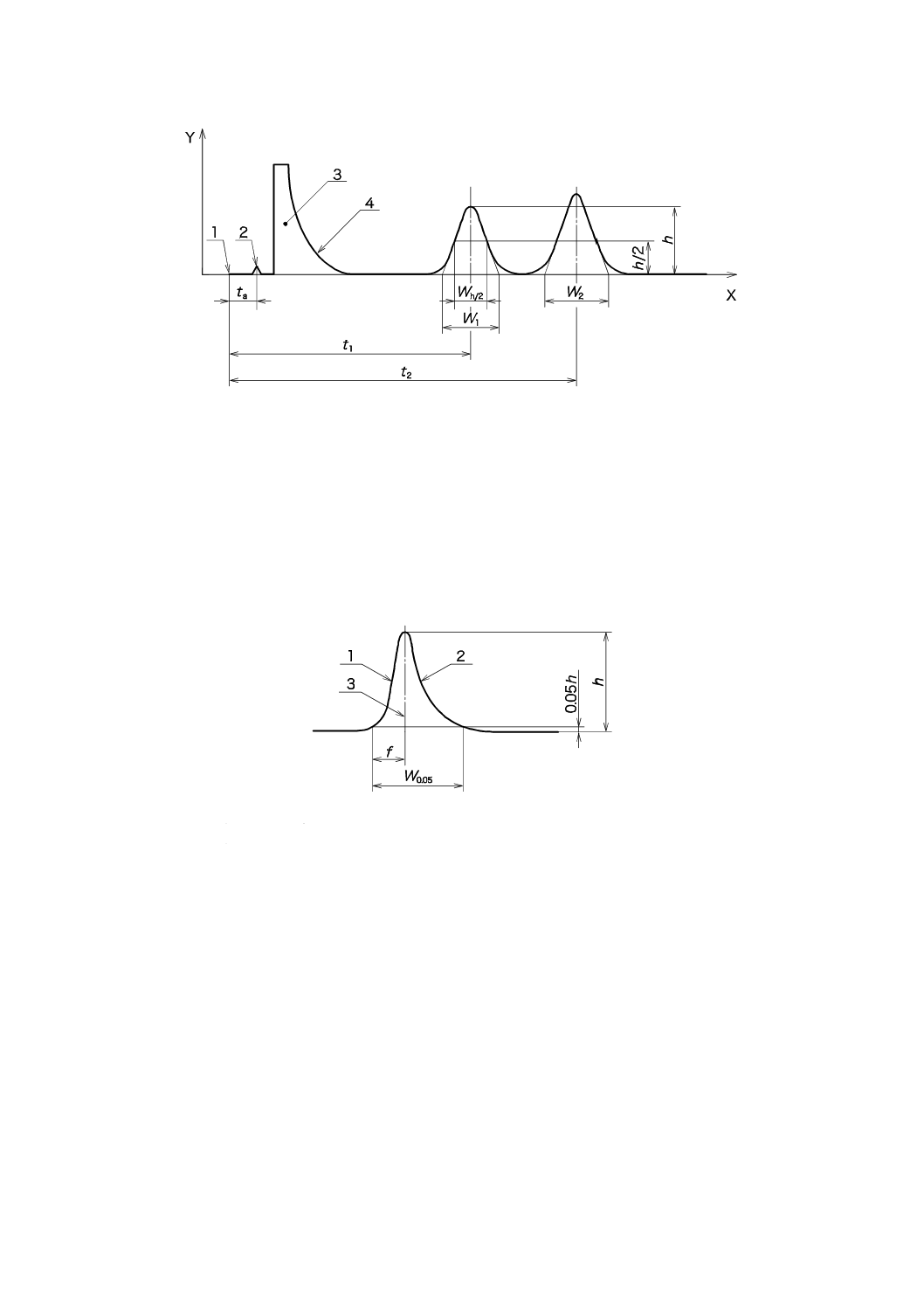
図A.1及び図A.2で用いる記号を,表A.1に示す。
表A.1−記号
記号
説明
f
ピークの頂点からピークの開始位置までの距離
h
ピークの頂点からベースラインまでの距離,及びピーク高さ
k'
容量係数
R
分解能
T
テーリングファクター
t
該当する残留物ピーク(EO又はECH)の保持時間
ta
空気などのカラムを通過するときに遅延しない非残留構成要素の保持時間
t1,t2
クロマトグラムピーク1及び2の保持時間で,t1はEO(又はECH)であり,
t2はすぐ隣接したピーク
W1,W2 保持時間と同じ単位でピーク1及び2のベースラインに外挿したそれぞれ
の幅
W0.05
高さ5 %におけるピーク幅
A.4 最低限の要求事項
A.4.1 クロマトグラムの評価の手順について,次の最低限の要求事項が次のパラメータについて満足する
ことを推奨する(図A.1及び図A.2参照)。
式(A.1)のように計算される分解能Rは,
(
)
(
)
1
2
1
2
2
W
W
t
t
R
+
−
=
······································································· (A.1)
ピーク面積又はピーク高さの定量について,2.0以上であるものとする。
代替方法として,式(A.2)が容量係数k' の計算に有用である。その値はよく分離されたピークに対して
1.5より大きいとする
1
a
−
=tt
k'
·············································································· (A.2)
13
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
式(A.3)で与えられるテーリングファクターTは,EO及びECHピークに対して1.8以下とする。
f
W
T
2
05
.0
=
·············································································· (A.3)
A.4.2 検量線の相対偏差(RSD)は,EO及びECHについて,用いた標準の範囲に対して5 %を超えない
ことが望ましい(文献[13]及び[14]参照)。検量線の相対偏差(RSD)は,式(A.4)によって求める。
100
×
=λ
σ
RSD
····································································· (A.4)
()
2
2
2
2
−
Σ
Σ
−
Σ
×
−
Σ
−
Σ
=
n
n
y
x
xy
S
n
y
y
σ
········································· (A.5)
n
y
Σ
=
λ
················································································· (A.6)
ここに,
n: 評価されたサンプルの合計数量
y: クロマトグラムピーク面積又はピーク高さ
λ: 平均値
x: 標準の濃度
σ: 標準偏差
σ2: 分散
S: 検量線の最小二乗回帰直線の傾き
これらの判定基準は,EO及びECHの分析で用いられる検量線のそれぞれの予測線形ダイナミックレン
ジを包含するように作成した少なくとも三つの標準の3回分析に対し計算される。
A.5 クロマトグラフのベースライン
その他に,クロマトグラフベースラインが,クロマトグラフ測定の間に初期のベースラインの5 %以内
に戻ることを推奨する。
A.6 情報源
これらの分析手順に変更が生じた場合は,次の情報源を参照するとよい。
− ガスクロマトグラフの製造業者の取扱説明書
− ガスクロマトグラフ分析法に関する各種の教科書
14
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
記号
X 時間
Y 検出器応答
1
注入
2
空気ピーク
3
溶媒ピーク
4
溶媒テール
図A.1−二つの物質のクロマトグラム分離
記号
1
ピークフロント
2
ピークテール
3
ピーク頂点
図A.2−非対称クロマトグラムピーク
15
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(参考)
EO及びECHのガスクロマトグラフ測定
B.1
ガスクロマトグラフ法の手順
B.1.1 標準液の調製
分析者は,クロマトグラフ手順を校正するのに使用する標準液の安定性を確認し,標準液が,その確認
された使用期限の後に使用されないことを保証することが望ましい。
B.1.2 一般
GC標準の調製のための手順を概説する。次の二つの方法が,一般に利用できる。
a) 市販の調製された標準液の使用
b) EOガスの既知の容量を希釈することによる容量的,又は既知の重さの液体のEOを希釈することによ
る重量的のいずれかによる標準液の調製。全ての場合において,ピーク高さ又はピーク面積応答対EO
濃度で検量線を作成する。
注記 コンピュータ制御GC装置のソフトウェアによるピーク面積応答は,EO濃度を求める場合に
ピーク高さよりも精度が高い。
EO及びECH標準液の調製に用いる手順の例は,附属書Jに記載している。
B.2
ガスクロマトグラフ法のバリデーションの判定基準
B.2.1 一般
多くの方法が,EOの抽出物を定量的に分析するのに適している。EO測定のガスクロマトグラフ法(GC)
が行われる徹底抽出法について,多くの手順が,述べられてきている。残留EOレベルを測定するのに,
おそらく多くの未公表の方法がある。医療機器には様々なものがあるので,公表された方法が全ての医療
機器に適しているとは限らない。したがって,分析的に妥当であり,かつ,この規格に規定している性能
判定基準に適合するいずれの方法も用いることができる。
分析的に妥当であるとは,その方法が,4.3の残留物限度値に対して分析する医療機器における規定レベ
ルのEOを測定するのに十分な真度,精度,選択性,直線性,堅ろう(牢)性及び感度を示し,また,分
析する当該医療機器に適用できるということである。
EO及びECH残留物のレベルを評価する多くの分析方法が,文献から再評価されている(参考文献参照)。
各方法のより詳細な議論に関して,原本を参考にすることが望ましい。分析法をバリデーションするため
の推奨要件は,次のとおりである。
B.2.2 真度(Accuracy)
真度は,その試験方法によって得られた試験結果の真値に対する近さの尺度である。
真度は回収率,すなわち認められた又は真の値に対する百分率として表される測定値で表現できる。そ
の試験方法の測定結果と既知の値との比較が要求される。既知の値は,既知の純度の被分析物又はスパイ
クサンプルから準備することができる。
真度を求める意味でのスパイクサンプルは,サンプルに既知の添加された被分析物量の回収率として報
告することができる。しかしEOについて,真度を求めるためのこの方法は,この化合物の揮発性のため
に成功することが極めて難しい。一つの代替法として,市販の利用可能な認証された標準液の使用を推奨
16
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
する。このようにして,真度の測定は,信頼区間を伴った認められた真値で除した平均測定結果となる。
いずれのケースにおいても,回収率(%)は,次のように計算することができる。
v
o100
t
a
R
R
又は
×
=
·········································································· (B.1)
ここに,
R: パーセントで表す回収率
Ro: 得られた結果
a又はtv: 認められた又は真の値
真度は,規定の範囲にわたる最低3濃度について,最低9回の測定を用いて評価することが望ましい(す
なわち,三つの異なる濃度でそれぞれ3回)。
B.2.3 精度(Precision)
B.2.3.1 概要
精度は,同じ分析条件下での多くの測定に対して測定値が互いにどのくらい近いかの尺度である。精度
は次の三つの構成要素を含む。併行精度(Repeatability),室内再現精度(Intermediate precision)及び室間
再現精度(Reproducibility)。
B.2.3.2 併行精度(Repeatability)
併行精度は,用いられる標準液の規定の範囲にわたって,最低9回の測定を用いて評価されることが望
ましい(すなわち,三つの異なる濃度でそれぞれ3回)。上記B.2.2にある方法の真度から作成したデータ
を並行精度評価に用いることができる。
併行精度は,式(A.4)で規定されたピーク面積の相対標準偏差(変動係数)として計算することができる。
EO及びECHの%RSDは,用いられる標準液の範囲に対し5 %を超えないことが望ましい。%RSDは,
A.4.2に規定しているように計算する。
B.2.3.3 室内再現精度(Intermediate precision)
室内再現精度は,分析手順の精度に対するランダムな事象の影響を確認することによって評価すること
ができる。ランダムな影響の例は,測定日,分析者,器具などを含む。これらの事象を個々に検討する必
要はない。実験計画法(マトリクス)の使用を奨励する。
試験方法の室内再現精度を示すには,最低限二つの別々の事象に対して,B.2.2の真度に記載しているよ
うにデータを作成することを推奨する。標準偏差,相対標準偏差(変動係数)及び信頼区間が報告される
ことが望ましい。
B.2.3.4 堅ろう(牢)性(Ruggedness)/室間再現精度(Reproducibility)
分析手法の堅ろう(牢)性は,異なる施設,異なる分析者,異なる装置,異なる試薬ロット,異なる経
過分析時間,異なる分析温度,異なる分析日など様々な条件の下での同じサンプルの分析によって得られ
る試験結果の室間再現性の程度である。堅ろう(牢)性は,通常,分析法の操作上及び環境上の変数によ
って,試験結果への影響がないことを表す。堅ろう(牢)性は,施設から施設及び分析者から分析者のよ
うな,普通に予想される条件における変化の下での試験結果の室間再現精度の尺度である。
バリデーションの手法は,新しいカラム又は新しい方法を導入するために個々の施設で行われるので,
バリデーションのこの部分は,異なる分析者,異なる分析日,異なる装置などの組合せで行うことができ
る。室内再現精度の確認が完了した場合,室間再現精度は,通常,行う必要がない。この部分では,施設
間の検討は重要ではない。
B.2.4 直線性(Linearity)
直線性は,手法の応答と被分析物の濃度との間の相関関係の尺度である。直線性は,用いられた標準液
17
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
の範囲にわたって確立することが望ましい。標準液濃度対ピーク面積又はピーク高さの回帰分析は,少な
くとも五つの濃度を用いて行うことが望ましい。
分析者は,傾き及び切片の室間再現精度のほかに,キャリブレーションデータの直線性を求めることが
望ましい。検量線の最小の相関係数は0.95であることが望ましい。
B.2.5 検出限界(MDL)(Method detection limit)
B.2.5.1 概要
検出限界(以下,MDLという。)は,妥当な信頼性で検出され得る最小の量である。MDLは,被分析物
の既知濃度サンプルを分析し,そして被分析物が確実に検出できる最小レベルを確認することによって,
求めることができる。
MDLを求めるには,多くの方法がある。B.2.5.2及びB.2.5.3に挙げたもの以外のアプローチも受け入れ
られる場合がある。
B.2.5.2 SN比に基づくMDL
被分析物の既知の低濃度サンプルの測定信号を,ブランクサンプル信号で比較すること,及び被分析物
が確実に検出できる最小濃度を確立することによって,SN比の決定が行われる。3:1のSN比は一般的
に受け入れられる。
B.2.5.3 応答の標準偏差に基づくMDL
MDLを求めるために,推定されるMDL近傍の被分析物の既知標準液を調製し,その標準液の7回の注
入の標準偏差を求める。
MDL=s×t ············································································ (B.2)
ここに,
s: 注入の標準偏差
t: 自由度n−1,99 %信頼水準におけるスチューデントt値
B.2.6 定量限界(QL)(Quantitation limit)
B.2.6.1 概要
QLは,一般的に,被分析物の既知濃度サンプルの分析,及び被分析物が受容可能な真度及び精度で定
量できる最小レベルを確立することによって,求めることができる。
QLを求めるには,多くの方法がある。B.2.6.2及びB.2.6.3に挙げたもの以外のアプローチも受け入れら
れる場合がある。
B.2.6.2 SN比に基づくQL
被分析物の既知の低濃度サンプルの測定信号を,ブランクサンプル信号で比較すること,及び被分析物
が確実に定量できる最小濃度を確立することによって,SN比の決定を行う。10:1のSN比は,一般的に
受け入れられる。
B.2.6.3 応答の標準偏差に基づくQL
QLは,式(B.3)で表すことができる。
QL=5×MDL ········································································ (B.3)
18
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(参考)
この規格を医療機器中の残留EO及びECHの定量に適用するための
フローチャート及び手引
C.1 背景
この附属書は,ISO 10993シリーズのある部を,EOで滅菌された医療機器の生物学的評価に適用するた
めの手引きを示すものである。この附属書は,主にこの規格の適用について述べているが,限定的ではあ
るものの,ISO 10993シリーズの他の部に関しても手引きを提示している。
この規格は,残留EOに対する許容限度値の設定のための要求事項,及びEO滅菌された医療機器が許
容限度に適合していることを示す分析的手順を規定する。ECH残留物がEO滅菌された医療機器に存在す
ることが判明した場合の,ECHの最大許容限度値も同様に規定する。EGのばく露限度値は,設定されて
いない。なぜならば,EO残留物が管理されている場合,生物学的に重大なEG残留物が存在するとは考え
にくいとリスクアセスメントが明示しているためである。この規格に適合することを示すためには,患者
への用量が許容限度値及び基準抽出法の設定の基礎となる。序文の第2段落では,残留EOへのばく露を
最小限に抑えるために,製品開発及び設計段階において代替材料及び滅菌方法を検討することが望ましい
ことを述べている。
EO滅菌された医療機器は,この規格の要求事項への適合に加えて,ISO 10993シリーズ中の,他の部に
ある生物学的試験の要求事項にも適合しなければならない。ISO 10993シリーズ中のその他の要求事項も
同様に考慮する。
治療には人命を救う性質があるため,EO滅菌された医療機器を使用することのリスク便益分析に大き
な影響を与える特殊な場合がある(大手術など)。4.3に規定するばく露限度値は,さほど危機的ではない
状況におけるリスク及び便益に基づいている。したがって,生命が脅かされるような状況下では,規定の
限度値を満たすことが不可能な場合は,想定される限度値を緩和する場合がある。
この附属書には,使用者がこの規格を適用するために必要な手順の理解促進のために,フローチャート
を盛り込んでいる。フローチャートは判断ポイントを示し,代替案がこの規格で提示された場合の適切な
行動選択の手引きを示している。この手引きの幾つかは,次のような要因に基づき,規格が異なる製品に
適用する実用的手段を示している。
− ばく露の性質
− ばく露期間
− 使用頻度
− 特殊な場合の使用(4.3.6参照)
− 製品サイズ
フローチャートでは,更に詳細な文で補足する。さらに,表C.1では,様々な種類の医療機器に対する
許容限度値の簡潔な概要を示す。
4.4は残留EO及びECHの測定に必要な条件を明記し,分析手順を附属書Bで説明する。残留EOを判
定する抽出条件を附属書Eに記載する。適切な模擬使用抽出手順を策定するための手引きはC.3による。
これによって使用者がEO滅菌された製品に対して,適切な模擬使用抽出手順の根拠を作成し,文書化す
ることができる。

19
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
分析施設は医療機器製造業者と共同で,意図する使用方法の中で最も苛酷な条件で模擬使用抽出を行う
ことが望ましい。製品使用の模擬実験は,医療機器を最も厳しいばく露期間カテゴリに位置付けて実施し,
ばく露組織及びばく露温度の両方を考慮することが望ましい。
本文は,附属フローチャート(図C.1参照)と一緒に使用する必要がある。
表C.1−EO及びECHに対する許容限度値の概要(医療機器当たりの限度値)
医療機器の種類
EO
ECH
一時的接触医療機器(≦24時間)
4 mg
9 mg
短・中期的接触医療機器
(>24時間,≦30日)
4 mg/24時間
かつ60 mg/30日
9 mg/24時間
かつ60 mg/30日
長期的(永久)接触医療機器
(>30日)
4 mg/24時間
かつ60 mg/30日
かつ2.5 g/生涯
9 mg/24時間
かつ60 mg/30日
かつ10 g/生涯
表面接触医療機器及び埋植医療機器
耐容接触限度(TCL)
10 μg/cm2又は低刺激性
5 mg/cm2又は低刺激性
眼内レンズ
0.5 μg/レンズ/日
又は1.25 μg/レンズ
EO限度値の4倍
血球分離装置(アフェレーシス)
10 mg
22 mg
人工肺
60 mg
45 mg
心肺バイパス機器
20 mg
9 mg
血液浄化機器(血液透析器)
4.6 mg
4.6 mg
健常皮膚に接するドレープ
10 μg/cm2又は低刺激性
5 mg/cm2又は低刺激性
C.2 手引
C.2.1 残留物へのばく露を最小限にとどめる目的から,代替原料及び代替滅菌方法の使用は,製品開発及
び設計段階において考慮することが望ましい。この判断の根拠及び基準(rationale and basis)を文書化する
ことが望ましい。
C.2.2 医療機器に患者接触がない場合1),この規格は適用しない2)。
注1) 体外診断機器,バックテーブルカバー,メイヨースタンドカバー,ライトハンドルなど。
2) その地域の労働衛生規則によって,職員へのばく露限度値を満たさなければならない場合があ
る。我が国においては,労働安全衛生法,毒物及び劇物取締法等の関連法規を遵守して作業す
る必要がある。
C.2.3 複数の医療機器からなるシステムの場合,限度値は個別の患者接触医療機器それぞれに適用する。
C.2.4 医療機器が特別な分類の場合,次を適用する。
a) 医療機器が眼内レンズの場合,限度値は0.5 μg/レンズ/日となり,総EO量は1.25 μgを超えてはなら
ない3)。他の眼内医療機器に対する限度値は,眼内レンズ1個を20 mgであるとして,医療機器の重
量を基礎として割り当てる。残留EOが眼内医療機器に対する指示どおりに管理されている場合には,
重大な量のECHが存在することは考えにくい。しかし,このことは,塩素を含有する粘弾性原料から
作られた眼内医療機器には当てはまらない場合がある。このような場合,眼毒性原因となるECHレベ
ルは,対応するEOレベルより約4倍大きくなると文献[44],[118],[119]及び[120]は指摘している。
このような医療機器におけるECHレベルの適合性を評価する場合には,このことを考慮する必要があ
る。
注3) 残留EOを判定するため,表E.1及び3.2で規定されている徹底抽出手順を行う必要がある。
20
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
分析者は,使用手順を検証し,文書化しなければならない。
b) 医療機器がドナー及び患者の血液採取に使用される血球分離装置の場合は,残留EO及びECHを判定
する3)。EO及びECHに対する最大許容限度値は,1医療機器当たりそれぞれ10 mg及び22 mgを超
えてはならない。この限度を超える場合には,製品使用の模擬試験を行い,37 ℃で1時間以上最大
24時間,医療機器を抽出して,残留EOを判定する(C.3.2及びC.3.3参照)。模擬使用によるEOが
10 mgを超える場合,及び/又は模擬使用によるECHが22 mgを超える場合,EO又はECHを削減す
る。そうでない場合,C.2.9の注6)に記載している要求事項が満たされたとき,この医療機器に対する
残留EO及び残留ECHの要求事項は適合となる。
c) 医療機器が人工肺又は血液分離装置の場合,残留EO及びECHを測定する4)。患者に対するEOの最
大許容用量は60 mgを超えてはならず,ECHの最大許容用量は45 mgを超えてはならない。超える場
合には,製品の模擬使用試験で医療機器を37 ℃で1時間以上最長24時間抽出することによってEO
残留物を測定する(C.3.2及びC.3.3参照)。製品の模擬使用試験によるEO及び/又はECHの1日当
たりの用量が,それぞれ60 mg及び/又は45 mgを超える場合には,EO及び/又はECHを減らす。
さもなければ,一日当たりの用量がEOでは60 mgを超えず,ECHでは45 mgより少ない場合は,こ
の医療機器はEO及びECHに関する要求事項に適合とする。
注4) 徹底抽出法は,このような製品に対しては行えない場合があるので,その際には直接模擬使
用抽出法に進む。
d) 医療機器が心肺バイパス術に使用される場合,残留EO及び残留ECHを測定する。患者に対する1日
当たりのEOの最大許容用量は,20 mgを超えてはならず,ECHの最大許容用量は9 mgを超えてはな
らない。
e) 医療機器が血液浄化機器である場合,EO及びECHの限度値は,1医療機器当たり4.6 mgを超えては
ならないが,生涯におけるEO及びECHの許容用量はこれを超えてもよい。
f)
医療機器が健常皮膚に接するドレープの場合は,TCLはEOについて10 μg/cm2及びECHについては
5 mg/cm2であるか,又はISO 10993-10に規定される低刺激性でなければならない。
C.2.5 医療機器がC.2.4に記載した特別なカテゴリに当てはまらない場合,残留EO及びECHを測定する
5)。
注5) 表E.1に記載され,3.1及び3.2に定義されている模擬使用抽出及び徹底抽出は,EO残留物の
測定を必要とする。分析者は使用手順を立証し,文書化する。非常に大きい製品については,
徹底抽出法が行えない場合があるので,その際には,C.2.6に進み,適切な期間のカテゴリにつ
いて模擬使用抽出を用いるための要求事項を満たす。
C.2.6 長期的(永久)接触医療機器の場合(患者との接触が30日より長く生涯までのもの)は,次のと
おりとする。
a) 測定したEO及びECHがそれぞれ2.5 g及び10 gを超えない場合は,C.2.6のb)へ行く。そうでない
ときは,適切な温度(37 ℃又は25 ℃のどちらか)及び時間(予想される使用時間に基づく)で抽出
液として水を用いて模擬使用抽出(C.3参照)を行う。測定したEOの用量が2.5 gを超えず,ECHが
検出された場合,測定されたECHの用量が10 gを超えない場合はC.2.6のb)へ行く。そうでないと
きは,EO及び/又はECHを削減する。
b) 測定したEO及びECHが60 mgを超えない場合,C.2.6のc)へ行く。そうでないときは,適切な温度
(37 ℃又は25 ℃のどちらか)で30日間,抽出液として水を用いて模擬使用抽出(C.3参照)を行う。
測定したEO及びECHが検出された場合のECHの用量が,60 mgを超えない場合は,C.2.6のc)へ行
21
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
く。そうでないときは,EO及び/又はECHを削減する。
c) 測定したEO及びECHが,それぞれ4 mg及び9 mgを超えない場合C.2.9へ行く。そうでないときは,
適切な温度(37 ℃又は25 ℃のどちらか)で24時間,抽出液として水を用いて模擬使用抽出(C.3
参照)を行う。測定したEO及びECHの用量が,それぞれ4 mg又は9 mgを超えない場合は,C.2.9
へ行く。そうでないときは,EO及び/又はECHを削減する。
C.2.7 短・中期的接触医療機器の場合(患者との接触が24時間より長く30日までのもの)は,次のとお
りとする。
測定したEO及びECHが60 mgを超えない場合,C.2.6のc)へ行く。そうでないときは,適切な温度(37 ℃
又は25 ℃のどちらか)及び時間(予想される使用時間に基づく)で抽出液として水を用いて模擬使用抽
出(C.3参照)を行う。測定したEO及びECHが検出された場合のECHの用量が,60 mgを超えない場合
は,C.2.6のc)へ行く。そうでないときは,EO及び/又はECHを削減する。
C.2.8 一時的接触医療機器の場合(患者に対し,最長24時間接触するもの)は,次のとおりとする。
測定したEO及びECHが,それぞれ4 mg及び9 mgを超えない場合は,C.2.9へ行く。そうでないとき
は,適切な温度(37 ℃又は25 ℃のどちらか)及び時間(予想される使用時間に基づく)で抽出液として
水を用いて模擬使用抽出(C.3参照)を行う。測定したEO及びECHの用量が,それぞれ4 mg及び9 mg
を超えない場合は,C.2.9へ行く。そうでないときは,EO及び/又はECHを削減する。
C.2.9 医療機器は,出荷時の許容EO及びECH量において刺激を与えるものであってはならない。医療
機器が表面接触医療機器か又は埋植医療機器の場合,EO及びECHに対するいずれの耐容接触限度(TCL)
も,それぞれ10 μg/cm2及び5 mg/cm2を超えないか,又はISO 10993-10に規定する低刺激性でなければな
らない。そうでない場合は(表面接触医療機器でも,埋植医療機器でもなければ),この規格による医療機
器の評価は完了する6)。
注6) JIS T 0993-1で示される個別に設計された医療機器に対する生物学的試験の要求事項と,EO滅
菌残留物限度値との両方に適合することによって,生物学的評価の観点からEO滅菌医療機器
が使用可能であることが正当化される。
C.3 模擬使用抽出手順
C.3.1 抽出液
EO残留物の模擬使用抽出においては,水を使用することが望ましい(文献[92]参照)。
C.3.2 抽出温度
使用時に全て又は一部が体と接触する医療機器は,37 ℃で抽出する。使用時に体との即時接触がない医
療機器(皮下用注射筒など)は25 ℃で抽出する。医療機器を37 ℃で抽出する場合は,EOからEGへの
変換を評価する。
C.3.3 抽出時間
抽出時間の設定時には,医療機器使用が推奨又は予想される様々な時間範囲における,予測される最悪
の状況を考慮する。さらに,C.3.2(4.4.6.2)で設定した使用温度でのデータ収集は,医療機器からのEO
及びECHの抽出率を設定するのに有益な場合がある。そのようなデータ,又は他の患者の情報を評価して,
入手可能なデータを考慮した,その医療機器に適した抽出時間を決定する。最短抽出時間は,1時間であ
る。
C.3.4 医療機器の抽出
使用に先立ち医療機器の前処理が必要な場合,医療機器を抽出する前にこの前処理を行う。抽出するた
22
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
めに医療機器を充填する場合には,混入空気によるエアポケットを排除する方法で行う。水を使用し,設
定された温度及び時間で医療機器を抽出する。医療機器使用が液体の循環を伴う場合(血液,透析液など)
は,水を使って液体循環に見立てて,製品の使用と同じ方法で医療機器を抽出する。血液が医療機器から
患者に戻る場合,全てのEO残留物が体内に留まることを想定しなければならない。したがって,医療機
器から患者へ流れる血液の代用である水を再循環しないことが望ましい。設定条件の根拠を文書化する。
C.3.5 医療機器の類別
設計が類似しているがサイズが異なる医療機器をグループ化し,グループの代表としてワーストケース
を選択して試験してもよい。この決定の根拠を文書化する。
C.3.6 キット品及びトレイ
キット品及びトレイ中で,EO及びECHを吸収している患者接触医療機器の残留量を初めに測定し,ワ
ーストケースの医療機器を設定する。その後,そのワーストケースを用いて追加データを収集することも
できる。この決定の根拠を文書化する。
23
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
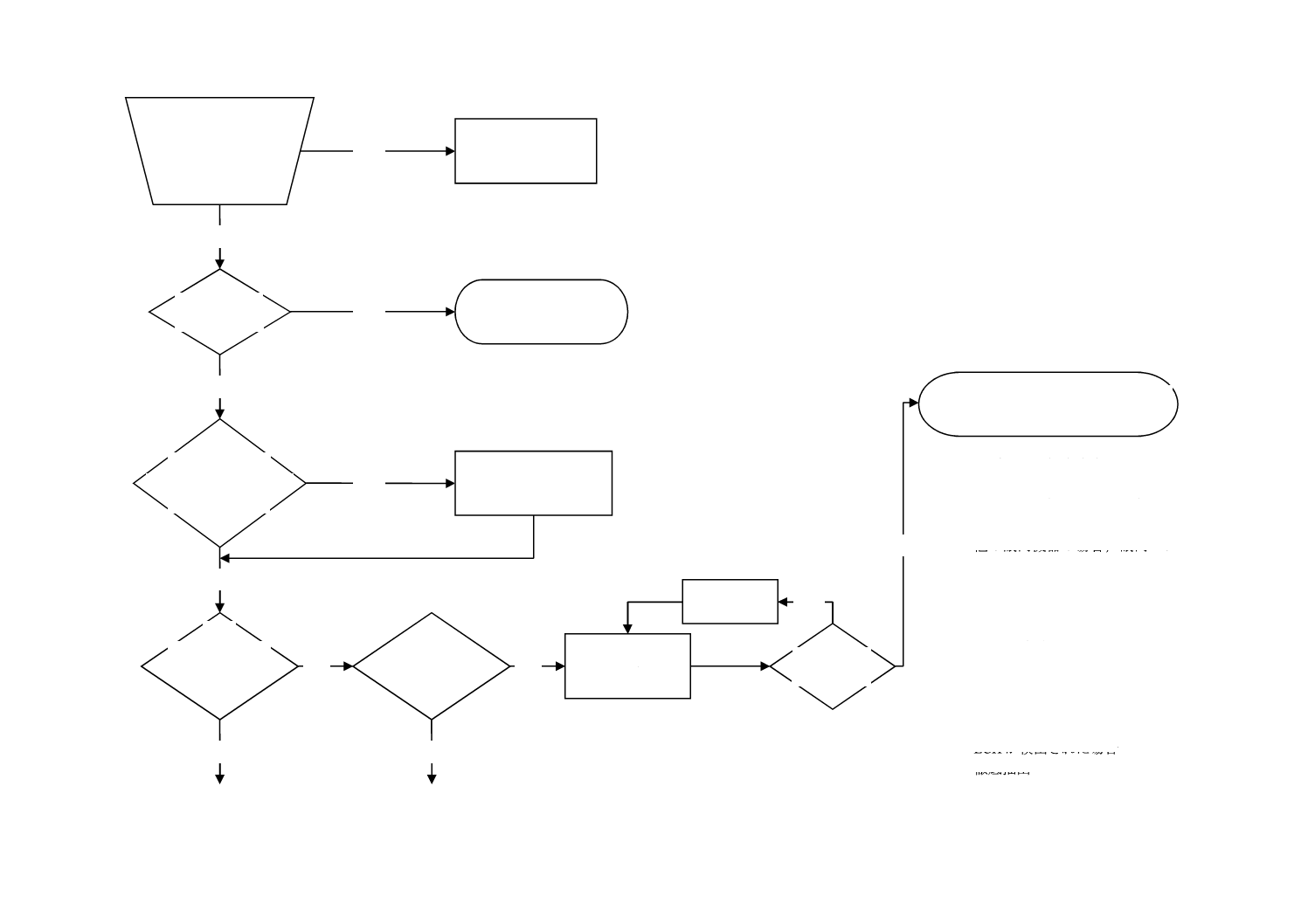
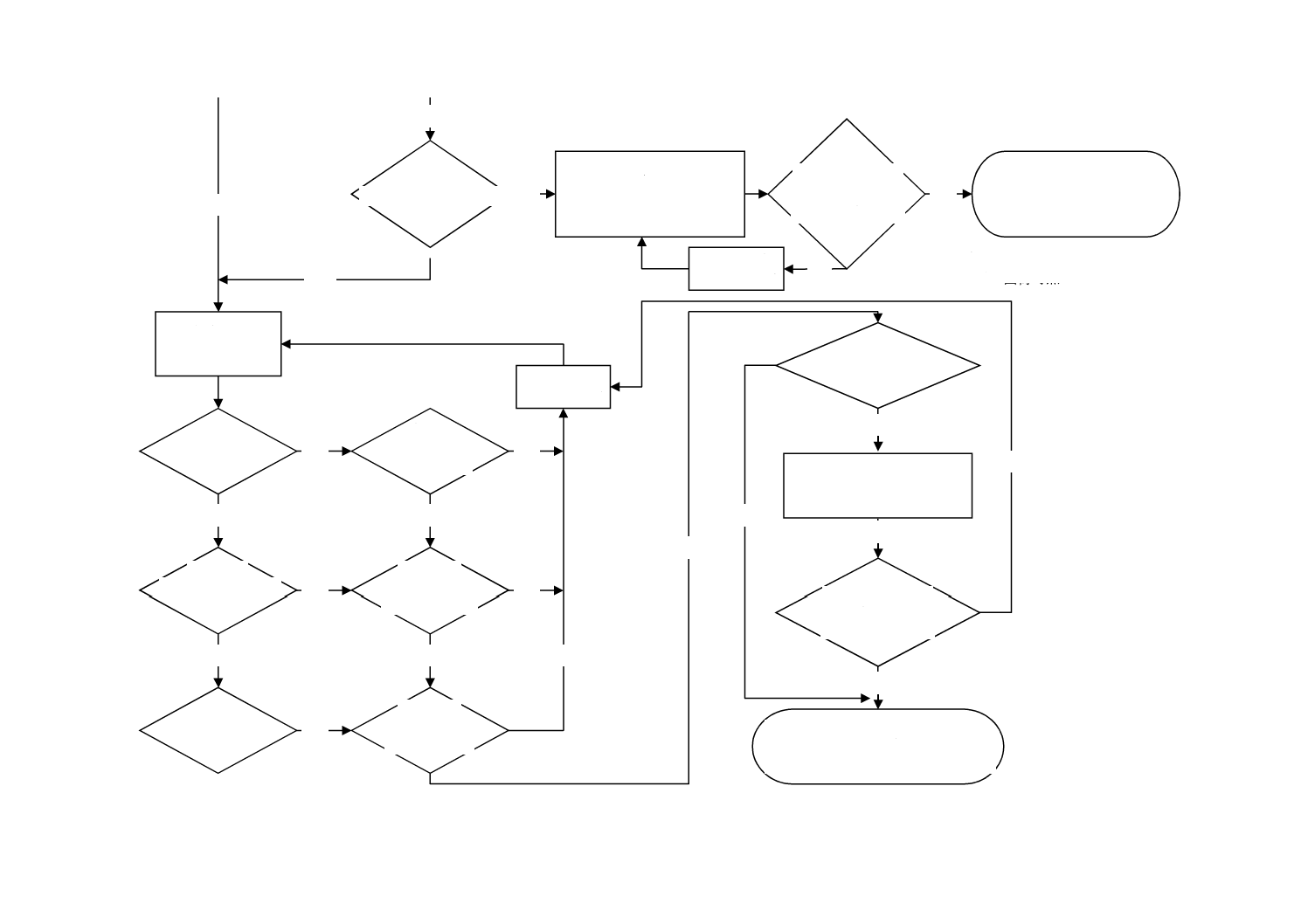
図C.1−この規格の適用に必要な手順を理解するためのフローチャート
(序文)
残留物のばく露量を低
減するため,代替滅菌方
法及び代替材料を検討
したか?
No
Yes
1
(適用範囲)
患者接触か?
No
Yes
4.3.6
(特別な場合)
複数の医療機器からな
るシステムか?
Yes
No
4.3.6
(特別な場合)
特別なカテゴ
リか?
No
Yes
眼内レンズか?
Yes
No
EO d) 及びECH c)
残留物の定量
EOの削減
ECH c) の削減
EO≦0.5 μg/
レンズ/日?
No
この規格は適用しない。
患者接触なしa)
限度値は個々の患者
接触機器に適用する。
代替滅菌方法及び
代替材料の検討
EO限度値は0.5 μg/レンズ/日,又は,
1.25 μg/レンズを超えないことb)
Yes
注a) 国ごとの労働安全衛生規則によ
って作業者のばく露限度を満た
さなければならない場合があ
る。
b) 他の眼内機器の場合,眼内レン
ズ質量=20 mgとして,質量に比
例して限度値が設定される。塩
素を含有する粘弾性材料からな
る眼内機器の場合は,ECHのレ
ベルを考慮しなければならな
い。このような材料を用いた機
器はEOの4倍のECHによって
眼毒性がもたらされる場合があ
る。
c) ECHが検出された場合
d) 徹底抽出
11
T
0
9
9
3
-7
:
2
0
11
(I
S
O
1
0
9
9
3
-7
:
2
0
0
8
)
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
24
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
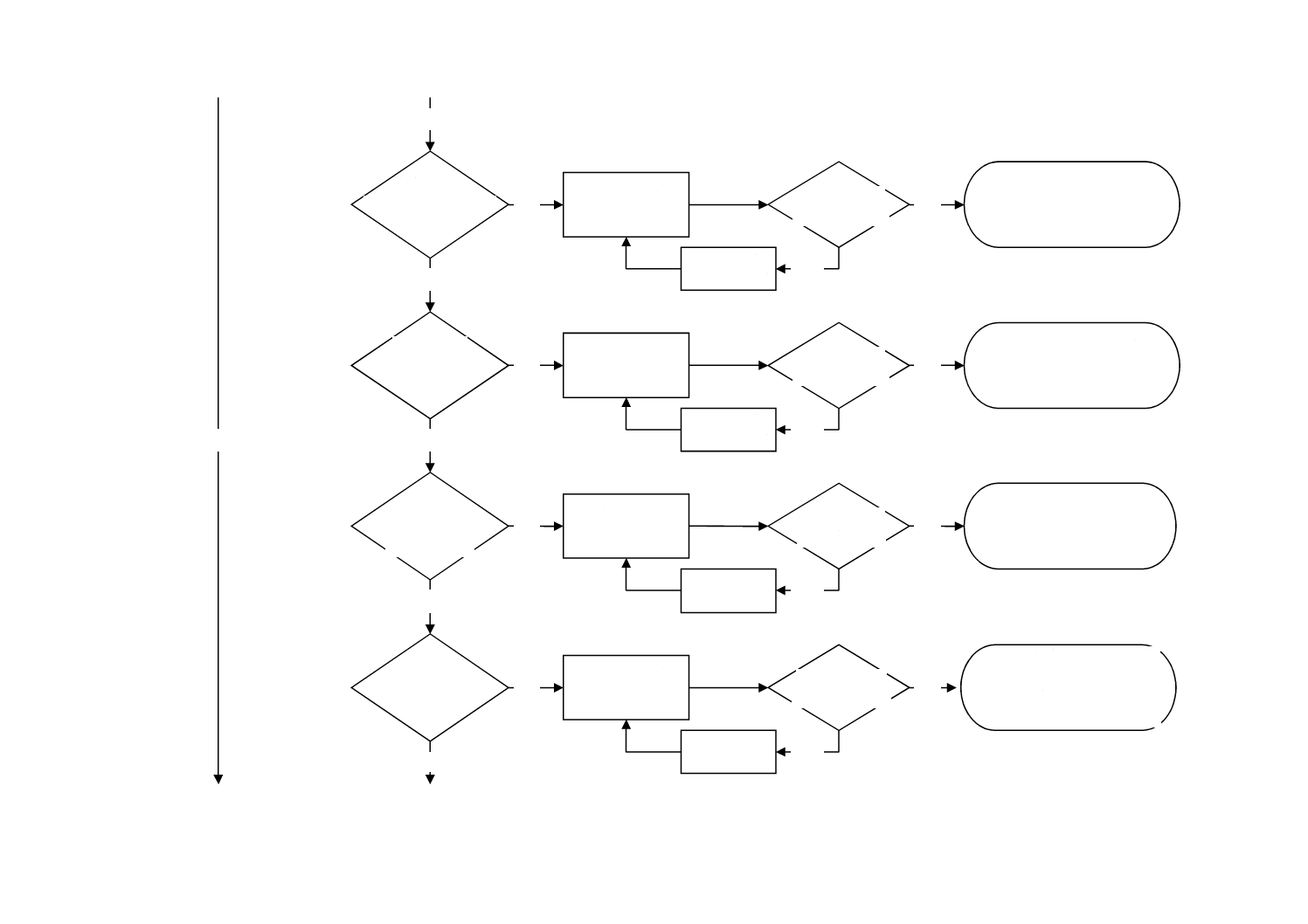
図C.1−この規格の適用に必要な手順を理解するためのフローチャート(続き)
No
体外循環
血液浄化機器
か?
Yes
No
注e) EOとECHの生涯合計ばく露量
は,超過することが許容される。
No
ドナー又は
患者用血球分離装置
か?
Yes
No
人工肺又は
血液分離装置
か?
Yes
No
人工心肺
バイパス術に使用
する機器か?
Yes
No
EO及びECH c)
残留物の定量
EOの削減
ECH c) の削減
EO≦10 mg?
ECH≦22 mg?
No
Yes
最大許容EO残留物限度値
EOにつき≦10 mg,かつ,
ECHにつき≦22 mgに適合
EO及びECH c)
残留物の定量
EOの削減
ECH c) の削減
EO≦60 mg?
ECH≦45 mg?
No
Yes
最大許容EO残留物限度値
EOにつき≦60 mg,かつ,
ECHにつき≦45 mgに適合
EO及びECH c)
残留物の定量
EOの削減
ECH c) の削減
EO≦20 mg?
ECH≦9 mg?
No
Yes
最大許容EO残留物限度値
EOにつき≦20 mg,かつ,
ECHにつき≦9 mgに適合
EO及びECH c)
残留物の定量
EOの削減
ECH c) の削減
EO≦4.6 mg?
ECH≦4.6 mg?
No
Yes
個々の血液浄化機器e) につ
き,最大許容EO残留物限度値
EOにつき≦4.6 mg,かつ,
ECHにつき≦4.6 mgに適合
11
T
0
9
9
3
-7
:
2
0
11
(I
S
O
1
0
9
9
3
-7
:
2
0
0
8
)
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
25
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図C.1−この規格の適用に必要な手順を理解するためのフローチャート(続き)
No
No
健常皮膚に
接するドレープ類か? Yes
患者接触
>30日?
Yes
No
生涯で
EO≦2.5 g?
ECH≦10 g?
No
Yes
EO及びECH c) のTCL測定
又は接触刺激性試験の実
施(ISO 10993-10参照)
EOの削減
ECH c) の削減
TCL
EO≦10 μg/cm2?
ECH≦5 mg/cm2?
又は低刺激性g)?
Yes
EO及びECH c)
残留物f) の定量
EOの削減
ECH c) の削減
TCL要求事項に適合
EO≦10 μg/cm2
ECH≦5 mg/cm2
又は低刺激性g)
No
No
Yes
No
30日間で
EO≦60 mg?
ECH≦60 mg?
No
Yes
患者接触
>24時間,かつ,
≦30日?
Yes
24時間で
EO≦4 mg?
ECH≦9 mg?
患者接触
≦24時間?
No
Yes
TCL
EO≦10 μg/cm2?
ECH≦5 mg/cm2?
又は低刺激性g)?
Yes
EO及びECH c) のTCL測定
又は接触刺激性試験の実施
(ISO 10993-10参照)
表面接触機器
又は埋植機器か?
Yes
この規格に基づく医療機器の評価
は完了し,ここに規定されている要
求事項に適合することが示された。
No
No
Yes
注f) 模擬使用抽出又は徹底抽出
g) 出荷時点
11
T
0
9
9
3
-7
:
2
0
11
(I
S
O
1
0
9
9
3
-7
:
2
0
0
8
)
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
26
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(参考)
製品残留物に影響する要因
D.1 滅菌工程パラメータ
D.1.1 一般
滅菌工程パラメータは,JIS T 0801:2010に定義されている。しかし,EOばく露された医療機器の残留
物を適切に分析するためには,残留物含量に影響をもつそれらのパラメータを認識することが必要である。
EO拡散速度論を理解することによって,代表的“ワ−ストケース”の分析を通して類似製品をグループ
として取り扱うことが可能となる。類似製品(すなわち,サイズ及び用途,材料構成,包装,EOばく露,
水分量及び環境条件へのばく露の類似)をグループとして認識することによって,製品系列の各品目をそ
れぞれ分析する必要性を除外することが可能になる。次に示したパラメータは,残留物含量に影響を及ぼ
すもので,一つ又はそれ以上の“ワ−ストケース”の代表として分析を可能とするものである。
D.1.2 材料構成
材料は,EOを吸収,保持及び放出する能力において,相当に異なる。EOがECHに転換可能な場合,
異なる材料から成る二つの類似医療機器は,大きく異なった残留物プロフィールをもつ可能性がある。例
えば,フリー塩素イオンの発生源を含む材料は,生成するECHの濃度に大きな変動幅を示す。
同様に,二つの類似しない材料から成る一つの医療機器は,正確な分析を確実にするために両方の材料
を代表するサンプルを必要とする場合がある。通常の製品使用の模擬実験を検討する場合に,組成及びサ
イズは特に重要である場合がある。
D.1.3 包装
包装材料は,EOガス及び他の考えられる残留物の両方を透過させ,かつ,減衰させる能力が大きく相
違するが,言い換えるとECH残留レベルにも影響する場合がある。梱包密度及び出荷容器の密度は,別の
変動要因である。
D.1.4 EO滅菌サイクル
医療機器がEOにばく露されるときの工程条件は,残留レベルに影響する。これらの条件には,ガス濃
度,作用時間,温度,サイクルのタイプ(すなわち,純EO又はEO混合物),湿度(水分供給源の品質を
含む),再真空及び空気洗浄,並びに製品及び滅菌負荷密度又は滅菌機内での製品負荷の形態が含まれる。
D.1.5 エアレーション
エアレーション温度,負荷密度及び形態,空気の流れ,負荷パターン,エアレーションされる製品の表
面積及びエアレーション時間の関数として,医療機器における残留EOは,変動する場合がある。幾つか
の材料は,エアレーション温度が10 ℃上昇するごとにおおよそ2倍(エアレーション時間が半分)とな
るエアレーション速度を示す。
湿度,温度,及び空気の流れのような要因は,滅菌機から取り出した後の製品におけるEO含量に応じ
て生成するECHにも影響する場合がある。
分析者は,倉庫条件と異なる施設条件の下にサンプルを保管する場合,エアレーション速度の季節変動
に気をつけなければならない。ある特定の環境下では,どのような環境かは経験に基づくしかないが,製
品がエアレーション中保管される可能性がある最低温度に近い条件の下で分析前のサンプルを保管するこ
とが必要な場合がある。
27
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
D.1.6 サンプル採取
滅菌工程完了後直ちに,滅菌済み製品から日常的に分析用の製品サンプルを採る場合は,滅菌工程が完
了した後すぐに滅菌負荷から分析のために,製品サンプルを日常的に採る場合は,注意を払うことが望ま
しい。滅菌所から遠く離れた施設に製品サンプル又はその抽出物を送る場合もまた注意を払うことが望ま
しい。そのような場合,サンプルにおける残留量と残りの製品における残留量とを相関させようとすると
きに生じる誤差が認識され,これらの条件間の関係を確立する実験が行われることが望ましい。
D.2 変数の管理
残留物拡散速度論(例えば,一連の製品に対する包装からのEOガス散逸速度)に基づく十分な実験的
証拠があるとすれば,材料,製造工程及び用途の類似性に基づいて,品質保証試験のために製品を分類す
ることができる場合がある。そのような分類システムが機能するためには,上記で論じた変数が管理され
なければならない。管理が欠如した場合は,分析されたサンプルだけに適用可能な残留レベルデータしか
得られない場合がある。
28
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E
(参考)
残留EOを測定するための抽出条件
この規格への適合を立証するための残留EOの測定の抽出条件は,4.4に規定されている。
表E.1は,試験施設での作業を容易にするように提案された抽出条件を表している。
模擬使用抽出及び徹底抽出についての固有の手技は,4.4.6.2及び4.4.6.3に規定されている。
EOの測定ために適切な抽出方法を選択する際の指針の原則は,この規格に規定された要求事項に対す
る適合性を可能であれば模擬使用抽出を用いて示すために,患者への用量を評価することである。短・中
期的接触のカテゴリの医療機器について,医療機器が一時的接触のカテゴリの残留要件をも満足しなけれ
ばならないこと,そして,長期的(永久)接触のカテゴリの医療機器もまた短・中期的接触及び一時的接
触のカテゴリの残留要件を満足しなければならないことに注意することが重要である。これらは,いずれ
かの抽出条件を用いて満足しなければならない。徹底抽出によって試験された製品について,残留量がこ
れらの要求条件内であることが示される場合,模擬使用抽出によって更に医療機器を試す必要はない。
表E.1−抽出条件の例
医療機器の接触時間
(4.3参照)
長期的(永久)接触
(>30日)
短・中期的接触
(>24時間,≦30日)
一時的接触
(≦24時間)
抽出条件
徹底抽出
模擬使用抽出
模擬使用抽出
3.2に定義されている徹底抽出が規定されている場合,大きな医療機器及び/又は複雑な医療機器では実
施困難な場合がある。そのような場合,医療機器の代表的部分を抽出し,結果を医療機器全体に外挿する
ことが必要な場合がある。4.4.6も参照。
特定の例外的状況において,模擬使用抽出は便利でも実用的でもない場合(例えば,ガウン,ドレープ
のような大きく,表面接触の医療機器)では,患者に移行するEO量は,重量との比例又は表面積との比
例に基づいて,例えば文献[154]の“使用ごとのばく露”の項に記載された移動減少因子アプローチを用い
て,推定することができる。
29
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書F
(参考)
この規格の理論的根拠
F.1
一般
この附属書は,接触期間に基づいて,医療機器中のEO滅菌残留物の許容限度値設定における理論的根
拠を記載する。EO,ECH及びEGの限度値を設定するための根拠が含まれている。
F.2
特別な場合の理論的根拠
F.2.1
一般
ある種の状況下では,例えば大きな手術のような,生命に関わるような治療の特性は,リスク便益分析
の結果に大きな影響を与える。ばく露限度値は,深刻ではない状況のリスクと便益に基づいている。それ
ゆえ,ISO 10993-17ではケースによっては,医療機器の便益によって許容限度値を変更することを許して
いる。したがって,生命が脅かされるような状況下で,規定の限度値を満たすことが不可能な場合には,
限度値を緩和することがある。同様に,特殊な状況下のリスクがあることが確実な場合は,限度値を厳し
くすることも必要になることがある。
この規格の作成中において,医療機器自体の制限から4.3の限度値を適用することが現実的でない,又
は4.3で示される用量レベルが適用できないことを示すヒトのデータが存在するなどから,六つの特殊な
ケースが認知された。眼内レンズの場合は,この医療機器の残留物の要求事項を変更して対処しなければ
ならないような,患者の眼内レンズへのばく露からヒトのデータが入手可能であった。ドナー又は患者の
採血において使用される血球分離装置は複数回使用されることがあり,ドナー又は患者は,EOに感作さ
れることが示されている。これらの医療機器に対するEOの許容限度値は,感作の可能性を最小化するた
めに引き下げられなければならない。人工肺又は血液分離装置を用いて血液の処置を行う場合は,医療の
便益はリスクよりも重要であるとみなされ,これらの医療機器の許容短期限度値を検討するときの課題に
なった。体外循環血液浄化機器においては,長期間の使用によって最大生涯用量の要求事項を超える可能
性があり,このことも課題となった。健常皮膚に接するドレープの場合は,全身性の影響は予想できず,
TCLを満たすか,又は刺激性試験の要求事項を満たすことで,患者の安全は十分に守られる。
F.2.2
眼内レンズの限度値
眼内レンズ(目の中への埋植医療機器)の残留限度値は,レンズ1枚当たり,1日当たりEO 0.5 μgであ
る。この限度値は,平均1日用量が生涯を通じて1日当たり0.1 mg(100 μg)という長期的(永久)接触
限度値には基づいていない。むしろ,これは特殊なケースで,最大移行用量は,上限値であるレンズ1枚
当たり,1日当たり0.5 μgを超えることはできない。これは,文献として報告されている眼内組織に対す
るEOの刺激反応を防ぐために必要である(文献[44],[117],[118],[119]及び[167]参照)。他の眼内医療
機器には,眼内レンズの質量を20 mgとして,その医療機器の質量に基づいて比例配分した限度値が用い
られている。
眼内医療機器のEO残留物がここで規定された量に管理されていれば,深刻な量のECHが存在する可能
性はほとんどない。このことは,塩素を含む粘弾性材料でできた眼内医療機器には当てはまらないことが
ある。このようなケースでは,文献[44],[117],[118]及び[119]が示すところによれば,眼内毒性をもたら
すECHのレベルは対応するEOのレベルより4倍大きい。このことを,このような医療機器でのECHの
30
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
レベルが受け入れられるかどうかを評価する場合に考慮するものとする。
F.2.3
ドナー及び患者の採血に使用される血球分離装置
EOの最大許容限度値は,医療機器1個当たり10 mgを超えてはならない。ECHの最大許容限度は,医
療機器1個当たり22 mgを超えてはならない。これらの医療機器は,成分採血に使用される。この限度値
は,ドナー又は患者個人がこのような医療機器を複数回使用することを考慮している。
このケースでは,“五つの医療機器が同時に使用される”というデフォルト仮定はやや厳しすぎる
(conservative)と思われる。同時使用が2個であるというのが合理的なワーストケースと仮定すると,UTF
は0.2から0.5へ増加する。これは,許容限度値をEOについて10 mg(10.5 mgを切り下げ)に増加させ
ることになる[式(F.1)及び式(F.2)を参照]。
EOについて,
TE=TI×MB×UTF=0.3 mg/kg/d×70 kg×0.5=10.5 mg/d ·················· (F.1)
ECHについて,
TE=TI×MB×UTF=0.64 mg/kg/d×70 kg×0.5=22.4 mg/d ················ (F.2)
注記 dは,day(日)を略した記号である。
F.2.4
人工肺及び血液分離装置
このような医療機器の一時的接触限度値は,24時間にEOで60 mg及びECHが45 mgである。これら
の医療機器は開心術などの難しい手術で使用される。このような操作は,一人の患者の生涯において1回
又は2回より多く行われない。これらの医療機器は,1日又はそれ未満の使用なので,UTFの0.2は過剰
に厳しすぎると思われる。UTFは,1.0がより合理的と思われる。このUTFを用いると,許容限度値がEO
は21 mg,ECHは45 mgに増加する[式(F.3)及び式(F.4)を参照]。EOの限度値については,更に製造業者
において,これらのかなり大きい医療機器からEOを除去する能力の現状が勘案されている。このような
状況下で,EO限度値を更に3倍に緩和することが正当化される。
EOについて,
TE=TI×MB×UTF=0.3 mg/kg/d×70 kg×1=21 mg/d ······················ (F.3)
1日以下の使用においては:21 mg/d×1d=21 mg/医療機器
ECHについて,
TE=TI×MB×UTF=0.64 mg/kg/d×70 kg×1=44.8 mg/d ··················· (F.4)
1日以下の使用においては:44.8 mg/d×1d=44.8 mg/医療機器
F.2.5
人工心肺バイパス術に使用する医療機器
このような医療機器の一時的接触限度値は,24時間にEOで20 mgである。これらの医療機器は,開心
術などの難しい手術で使用される。このような操作は,一人の患者の生涯において1回又は2回よりは多
く行われない。これらの医療機器は,1日又はそれ未満の使用なのでUTFの0.2は過剰に厳しすぎると思
われる。UTFは,1.0がより合理的と思われる。ECHの限度値は,一時的接触の場合を適用する。
EOについて,
TE=TI×MB×UTF=0.3 mg/kg/d×70 kg×1=21 mg/d ······················ (F.5)
注記 これらの医療機器では,この値は四捨五入によって20 mg/dとなる。
1日以下の使用においては:20 mg/d×1 d=20 mg/医療機器
F.2.6
体外循環血液浄化機器
これらの医療機器は,しばしば何年もの期間にわたって患者に複数回使用されことがある。これらの医
療機器の許容限度値設定においては,血液浄化によってもたらされる便益が考慮されている。一人の患者
31
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
に使用される個々の医療機器の最大許容限度値は,毎月13回このような医療機器が使用されることを考慮
した。そして30日間の最大許容限度値の13分の1を最大許容限度値として設定した。これがEOについ
ての4.6 mg,ECHについての4.6 mgである。毎回の使用でEOの許容限度値4.6 mgが満たされた場合は,
最大許容EO用量である生涯で2.5 gは超えてもよいとした。さらに,毎回の使用でECHの許容限度値4.6
mgが満たされていれば,最大許容ECH用量である生涯で10 gは超えてもよいとした。EOの生涯用量2.5
gを超えるには,患者は1か月に13回4.6 mgのEOばく露を受ける血液浄化を行い,このようなばく露を
3.5年続ける必要がある。同様に,末期腎疾患患者のECH生涯ばく露量が超過するには14年間使用する必
要がある。
EOについて
− 生涯用量の2.5 g=2 500 mg
− 1か月に13回の体外循環血液浄化機器使用による最大許容用量は60 mgである。
− したがって,このような医療機器の使用によって最大許容生涯ECH用量に達するには,2 500 mg/(60
mg/月)=42か月又は約3.5年を要する。
ECHについて
− 生涯用量の10 g=10 000 mg
− 1か月に13回の体外循環血液浄化機器使用による最大許容用量は60 mgである。
− したがって,このような医療機器の使用によって最大許容生涯ECH用量に達するには,10 000 mg/(60
mg/月)=167か月又は約14年を要する。
F.2.7
健常皮膚に接触するドレープ
健常皮膚に接するドレープは,最小限のリスクで患者に便益をもたらす。サージカルドレープは,患者
への感染体の伝播及び患者からの感染体の伝播を抑制し,これによって,術後感染の低減に貢献する。健
常皮膚に接する医療機器が全身毒性の原因となる例はない。EO及びECHの耐容接触限度(TCL)は,局
所影響に基づいている。したがって,EOについて10 μg/cm2及びECHについて5 mg/cm2というTCLの値
(又はISO 10993-10に従って試験を行った場合に低刺激性であること)は,健常皮膚に接するドレープに
とって適切な複合的限度値である。
F.3
4.4に対する理論的根拠
F.3.1
一般
この箇条は4.4の各主要部分についての一般的根拠を示す。
F.3.2
製品抽出
EO滅菌残留物の規制において重要な因子は,患者又はユーザーが滅菌済み医療機器の使用によって受
ける用量(dose)である。この患者又はユーザーの用量を評価するために,通常の製品使用を模した抽出
方法が必要になる。ある場合には,これは単に製品を水で満たすことで行われ,また,ある場合には液を
連続的に流すなどのより複雑な模擬実験が必要となる。徹底抽出によって製品中に存在する残留物の総量
を測定することで,要求事項が満たされるならば,製品使用を模した抽出を行う必要はないと認識してよ
い。
徹底抽出の定義には,最終段階の抽出量が最初の抽出量の10 %未満になるまで繰返し抽出を続けなけれ
ばならないという概念が含まれている。この概念は,最初の抽出量が非常に少ないときには適用できない。
例えば,残留物がほとんどない医療機器及び溶質の溶出速度が非常に遅いようなサンプルの場合である。
このような場合には,複数回の繰返し抽出によって得られる累積分析物量の増加が,分析の不確実さ
32
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(analytical uncertainty)よりも小さくなるまで抽出を続けなければならない。
F.3.3
分析手法
F.3.3.1
溶液中のEOの安定性
それぞれの施設では,EO残留物標準液の保存期間を決定するために独自に安定性確認を実施する。有
効な標準液は,検証された安定性の保証期間の最終日において,規定の濃度以下であってはならない。そ
うでない場合は,全ての標準溶液は,毎日調製することが望ましい。
K.4.4(文献[140]参照)で述べられているEO測定法の施設間比較研究において,エタノール中のEO標
準溶液の安定性についての研究がある。濃度25 μg/mL,50 μg/mL及び100 μg/mLのEO溶液を調製し,冷
蔵庫温度及び40 ℃の両方に保存した。これらの溶液は,6週間までの異なる時間ごとに分析された。この
研究によると,40 ℃保存で2週間後には,50 μg/mL及び100 μg/mLの標準溶液は,はじめの濃度の70 %
に減少することが示された。一方,全ての標準溶液は,冷蔵庫温度(5 ℃)で60日まで初期濃度の10 %
以内にあり,安定であることが示された。
F.3.3.2
溶液中のECHの安定性
ECHの施設間比較実験に先立って,11の施設がECH標準溶液の安定性研究に参加した。ECHの水溶液
が,一つの施設で調製され,全ての参加者に送られた。溶液は,到着まで冷蔵庫温度に保存された。これ
らの溶液は,例えば到着直後,到着1週間後,2週間後,3週間後,4週間後,8週間後及び12週間後とい
う様々な時間に,様々な種類のカラムで分析された。この研究では,最初の2週間では濃度の目立った変
化は見られなかった。ECH標準溶液が冷蔵庫で貯蔵されるときは,少なくとも14日間は安定であると結
論付けることができる。
F.3.3.3
検量線の直線性
概念的には,この規格で規定した手順は,4.3で規定されている限度値に適合することが必要な濃度範囲
に適用可能である。試験方法の精度(precision),検出限界(MDL),定量限界及び検量線の直線性につい
て,妥当性を検証しなければならない。
F.3.4
データの分析及び解釈(4.4.7参照)の理論的根拠
データの適正な取扱いによって,はじめて分析者は製品中の残留物レベル,更にそれを基に患者へ移行
する潜在的な用量を計算することができるようになる。これによって,4.3に掲げる要求事項に適合するこ
とになり,製品の出荷が可能になる。
33
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書G
(参考)
EOの許容限度値の設定
G.1
一般
一時的接触(limited exposure),短・中期的接触(prolonged exposure)及び長期的(永久)接触(permanent
contact)での耐容摂取量(tolerable intake: TI)を導き出すために,ISO 10993-17に記載されたアプローチ
を採用した。様々なばく露経路ごとに,別々のTIを計算することはしなかった。算出したEOのTI値を
許容限度値(allowable limit)に換算し,更に医療機器の限度値を決め,ISO 10993-7:1995(以下,1995年
版という。)での限度値と比較した。一時的接触カテゴリにおいては,この規格での評価から算出された
TI値及び医療機器での限度値を採用した。短・中期的接触カテゴリ及び長期的(永久)接触カテゴリにお
いては,この規格での評価によると,TI及び医療機器での限度値は1995年版で設定したより高い値にな
ったが,1995年版の数値を維持することにした。その理由は,1995年版の基準値を採用して以来,臨床経
験上に問題がなかったからであり,製造業者が,これらの限度値を遵守してきたからである。したがって,
短・中期及び長期的(永久)接触に対する現行の限度値を,この規格での評価でサポートされた数値まで
高める現実的な臨床上及び製造上の理由は,存在しない。
一時的接触及び短・中期的接触カテゴリのTI値(0.3 mg/kg/d)は,文献[82],[83],[84],[169],[170]
及び[171]のデータに基づいている。これらのデータは,1995年版では短・中期的接触カテゴリのサポート
データとして使用している。修飾係数(modifying factor: MF)は,30を採用した。すなわち,個体差に対
する不確実性係数UF1は30,種差に対するUF2は1としたものである。これらのUF1及びUF2の数値の
妥当性は,後述する。
長期的(永久)接触カテゴリのTI値(0.02 mg/kg/d)は,発がん作用から誘導したもので,ヒトの疫学
データの用量・作用関係モデルによった。発がん性TI値(cancer-based TI)を,発がんリスクアセスメン
ト手法によるアプローチで算出することも試みた。カニクイザルでの吸入ばく露実験(文献[107],[108]
及び[109]参照。)で見られた精子形成の副作用及びMF(60)に基づいて,長期的(永久)接触の非発がん
性TI値(0.03 mg/kg/d)を得ることもできる。このMF値には,LOAELをNOAELに外挿することの不確
実性係数(UF3)が含まれている。
注記 LOAELは最小毒性量及びNOAELは無毒性量を表す。
G.2
緒言
ISO 10993-7が1995年に発行されて以来,今日までに,EOのヒト及び実験動物における副作用に関す
る新しいデータが得られた。さらに,この化合物に対するヒト及び実験動物間の相対感受性を評価するた
めの不確実性を減少させるようなデータが得られるようになり,EOに対するヒトポピュレーションでの
感受性の変動に関するデータも得られるようになった。さらに,EOばく露によるリスクを正確に評価す
ることを助けるための新しい手段(例,ベンチマーク用量及び生理学的速度論モデル−physiologically based
pharmacokinetics model)が使えることになった。このリスクアセスメントは,この規格のTI値選択の基礎
となった。
34
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
G.3
方法
G.3.1 一般
EOの種々のばく露期間におけるTI値を決定するために,ISO 10993-17に記載されたアプローチを用い
た。
医療機器から放出されるEOに,患者が短期的又は長期的にばく露される可能性がある。そのため,こ
の化合物に対する一時的,短・中期的及び長期的なTI値を設定する必要がある。さらに,患者のEOばく
露については,様々なばく露ルートをとる可能性がある。臨床状況におけるEOばく露の主ルートは,非
経口ルート(parenteral:静脈,皮下,筋肉,髄内)であるが,これらのルートによるTI値を導くことが可
能な動物実験データは,ほとんどない。対照的に,多数の吸入ばく露によるヒト及び動物のデータが入手
可能である。これらの豊富な吸入ばく露毒性データをEOの非経口のTI値に利用するために,吸入ばく露
での体内EO量を見積もるための投与ルート間外挿手法(route-to-route extrapolation)を開発した。
G.3.2 用量に関する投与ルート間の外挿
EOについて非常に多くの毒性試験が実施されているにもかかわらず,非経口ルートで試験が行われた
ことはほとんどない。しかし,吸入試験においてのEOの体内吸収は分かっているので,吸入試験でのば
く露濃度(気中濃度)及び呼吸器系からの吸収率より実際の体内EO濃度を見積もることは可能である。
このような吸収量は,ばく露濃度,実験動物の呼吸量,ばく露期間及び呼吸器系からの吸収率を用いて
見積もることができる。文献[186]と[22]のデータを用いて,様々な気中EO濃度における相対吸収率を表
G.1のように計算した。
表G.1−様々な気中EO濃度にばく露されたラットのEO吸収率
ばく露気中濃度
ppm
吸収率
%
10
94
33
74
50
68
100
61
1000
36
サル(カニクイザル)での吸収用量は,サルの平均呼吸量(0.83 m3/d)として計算したものである。
なお,この平均呼吸量は,Fisher [52] の同じ系統のサルでのメタノールばく露試験で報告された値を用い
た。
G.3.3 非発がんリスクアセスメント・アプローチ
EOの非発がん性の毒性影響についてのTI値の計算は,重要な試験から得られた最も確からしいNOAEL
値又はLOAEL値を不確実性係数(UF)で除すことで算出する。UFは,ヒトでの反応の変動(UF1),種
差(UF2),データ欠落による不確実性(UF3)を勘案して決めることができる。ISO 10993-17は,TI計算
のために鍵となる毒性研究から得られたデータにUFを適用するに当たって,科学的なデータを用いるべ
きことを強調している。この方針に従って,EOへの反応についてのヒトでの多様性に関するデータ,及
びEOの毒性強度(potency)の種差のデータをUF1及びUF2として用いた。UF1を決めるためのファク
ターとしては,ヒトのEO代謝に関与する酵素の多型発現(polymorphic expression),これらの酵素群を阻
害する各種の疾病状況の可能性及びDNAダメージの修復可能性の多様性を考慮した。こうして計算した
UF1の値は,通常用いられる個体差に関するUFのデフォルト値(10)より大きい値になった。反対に,

35
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
科学的データ及び生理速度論的モデルの結果から,EOの活性についての種差はほとんどなく,UF2値は,
通常用いられるデフォルト値(10)よりずっと小さくてよいことが分かった。
G.3.4 発がんリスクアセスメント・アプローチ
科学的証拠の重さに関するテスト(weight-of-evidence test)を適用した結果,EOは,遺伝毒性のある発
がん物質(genotoxic carcinogen)であり,動物でみられる腫瘍はヒトにもみられることがはっきりした。ISO
10993-17は,遺伝毒性のある発がん物質について,発がん性に基づいたTI値を算出するための様々なア
プローチを提供している。それに従って,多様なアプローチで発がんに対するTI値を求めた。
なお,そのアプローチは,LOAELからの単純な直線外挿,LOAELにUFsを適用するもの及び用量反応
モデルによるものである。
G.3.5 EOのTI値算出で考慮しない影響
発がん性又は非発がん性影響に基づくTI値は,過敏症及びアナフィラキシーに対して必ずしも十分安全
なものとはいえない。また,溶血の影響に対しても十分安全なものとはいえない。EOのばく露によるこ
のような影響に対して患者を守るためには,他のアプローチが必要な場合がある。
G.4
EOの非発がん性のTI(Noncancer-based TI)値
G.4.1 概要
非発がん性のTI値の計算は,次のステップによった。
− 文献から適切なNOAEL及びLOAELの選択
− ヒトでの個体差に関する不確実性係数,活性の種差に関する不確実性係数,及びデータ欠落に関する
不確実性係数の選択
これらのステップの詳細は,G.4.2及びG.4.3に記載した。
G.4.2 重要な論文の選択
G.4.2.1 一時的又は短・中期的接触カテゴリの場合
EOの一時的接触カテゴリについてのTI値を算出するために十分な,単回投与毒性データは見つからな
かった。しかし,ISO 10993-17では,次のように記載されている(当該物質の総合的な毒性プロファイル
を理解するという観点から,あらゆる入手可能なデータを考慮すべきである。)。基本的なアプローチとし
ては,急性毒性データ(例,14日間より短期間の試験データ)を一時的接触又は短・中期的接触における
限度値の設定に用いるべきである。
したがって,長期間の試験データを一時的接触カテゴリのTI確立に用いることにした。
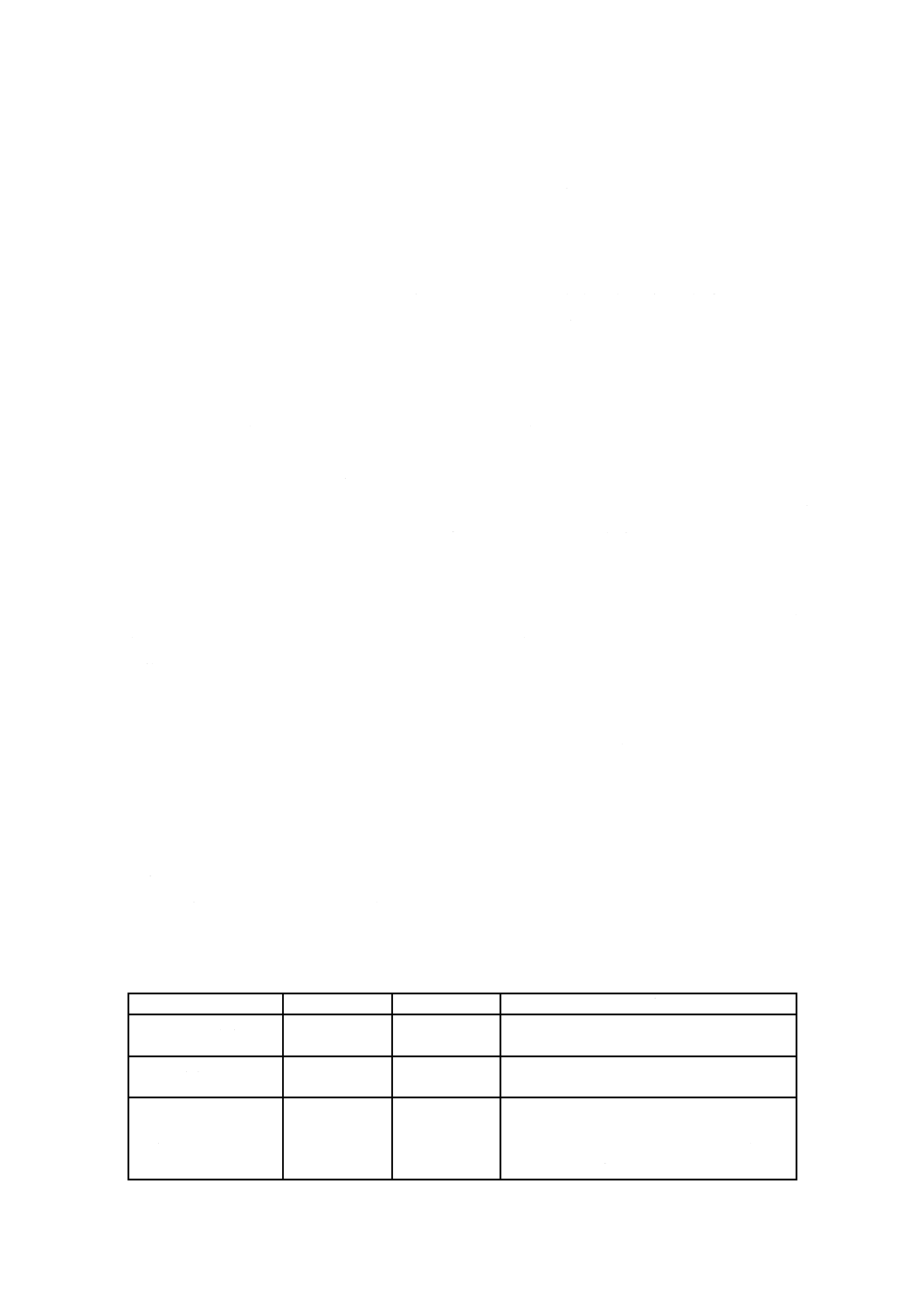
表G.2には,EOの一時的及び短・中期的接触カテゴリのTIを算出するのに最も関連すると思われるデ
ータを示した。
表G.2−EOの一時的及び短・中期的接触カテゴリのTI値決定に用いた文献
動物種
投与経路
ばく露
NOAEL
mg/kg/d
LOAEL
mg/kg/d
LOAELでの作用
文献
イヌ
皮下
6,18又は54 mg/kg/d,
30 d
6
18
体重減少,
凝固能変化,
肝臓,腎臓,ひ(脾)臓重量増加
[203]
ウサギ
静注
9,18及び36 mg/kg
妊娠4〜16日に毎日
9
18
母獣体重増加抑制
[82]
ラット
吸入
10,33又は100 ppm,6 h/d
妊娠6〜15日に毎日
9
27.5
胎じ(仔)体重減少
[169]
36
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
なお,EOのTI値を設定する過程では,次に示した文献以外の多数の論文をレビューしたことを付け加
えておく。
Woodard and Woodard [203] は,イヌにEO溶液を連続30日間皮下注射する実験を行った。用量は6 mg/kg,
18 mg/kg,54 mg/kg(後に36 mg/kgに補正)であった。しかし,この実験の動物数が少なすぎるので,信
頼性のあるTI値決定に用いることはできない。
同様なNOAEL値が,Snellings [169] らの吸入実験からも得られた。妊娠Fisher344ラットを妊娠6〜15日
の間,毎日6時間気中濃度100 ppmのEOにばく露したとき,胎じ(仔)の体重減少が観察された。33 ppm
ばく露群では,影響は認められなかった。文献[22]の吸収に関するデータを用いれば,33 ppmの気中濃度
ばく露の体内吸収EO量は,
33 ppm×1.8 mg/m3/ppm×0.29 m3/d×6/24×0.74÷0.35 kg=9.1 mg/kg/d
となる。
文献[82]をもとに計算したNOAEL値と文献[169]をもとに計算したNOAEL値が一致したことによって,
それを一時的又は短・中期的接触カテゴリのTI値の根拠として用いることの信頼性が高まった。
G.4.2.2 長期的(永久)接触カテゴリ
長期吸入ばく露による動物実験での非発がん性毒性作用での最も低い吸収用量は,Lynch [107] 論文に基づ
いて,2.0 mg/kg/dである。この実験は,カニクイザルを0 ppm,50 ppm及び100 ppm濃度のEOガスに週
5日間,毎日7時間,24か月ばく露したものである。50 ppm及び100 ppmのEOばく露群において,対照
群に比較して統計的に有意に低い精子数,精子運動性が見られた。
Fisher[52]らが,メタノールをばく露した同じサルで測定した平均呼吸量に基づいて,また,EO濃度50 ppm
の空気からのEO吸収率はラットもサルも同じであるという前提に基づいて,50 ppmのEO吸収量は次の
ように算出した。
50 ppm×1.8 mg/m3/ppm×0.83 m3/d×7/24×5/7×0.68÷5.3 kg=2.0 mg/kg/d
Lynch論文で見られた精子数及び精子運動性への影響は,EOにばく露されたヒトでの現象[5]と一致して
おり,他の実験動物で報告された(例,文献[128])精子パラメータとも一致している。さらに,統計的に
有意な精子数減少,精子運動性低下及び形態変化は,化学物質のばく露基準設定目的において化学物質の
毒性影響としてみなされている(文献[126]及び[188]参照)。また,このようなカニクイザルでみられた結
果が,ヒトとは関係がないことを示唆するような毒性上メカニズム上の理由は存在しない。したがって,
文献[107]の実験結果は,長期的非経口ばく露でのEOの非発がん性影響のTI値算出に用いることが妥当で
あると考えられる。
G.4.3 非発がん性毒性作用に関する不確実性係数の選択
表G.3参照。
表G.3−TI値算出のための不確実性係数
不確実性係数の意味
範囲
デフォルト値
備考
UF1:ヒトの個体差
1〜10
10
健康な人の平均の反応と感受性の高い人の一
部の反応との違いを勘案する。
UF2:種差
1〜10
10
化学物質の毒性影響については,ヒトは実験
動物より感受性が高いことを勘案する。
UF3:実験データの質
と適切性
1〜100
なし
TI値算出に使える毒性データの制限を考慮
する。NOAEL値が得られない(長期試験で
のNOAEL値がない又は実際のばく露経路と
同様のばく露データがない。)。
37
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
G.4.3.1 個体差(UF1)
G.4.3.1.1 概要
ISO 10993-17では,UF1の値を規定するヒト間の変動を評価するに当たっては,実際のデータを使うの
が望ましいとされている。幸いにして,EOに対する様々なバイオマーカのヒトでの変動を特定すること
が,主に職業コホートでのデータから算出可能である。例えば,Fuchs [54] は,EOにばく露された労働者
の末しょう(梢)血単核赤血球におけるDNA単鎖切断(DNA single strand break)への感受性に個人間の
顕著な差があることを見つけた。彼らは,これらの職業的にEOにばく露された労働者には,高感受性グ
ループと低感受性グループとの二つのサブグループに分けられるとした。低感受性グループの非喫煙者に
おいては,DNA切断を伴う最低気中EO濃度(4時間の時間加重平均値)は,3.5 mg/m3であった。高感受
性グループの非喫煙者においては,その値は,0.6 mg/m3であった。したがって,この遺伝毒性作用から高
感受性グループに属する個人を守るためには,少なくともUF1として6 (3.6/0.6)が必要とされる。他にも
EOに対する反応の変動に関わるファクターがある,すなわち,EOの代謝に関わる酵素(グルタチオン転
移酵素のtheta1アイソフォーム,エポキサイド加水分解酵素)の多型発現及びDNA修復機構での変動で
ある。さらに,EOの毒性作用は重篤な病気及び傷害をもつ患者においては,一般の人に比べて高まる可
能性を示唆するファクター(補酵素)もある。例えば,EOの解毒に中心的な役割をもつ代謝酵素の阻害
とか,グルタチオンのような酵素反応に必要なコファクターの減少といったものである。すなわち,一般
の人におけるEOに対する反応の変動は必ずしも患者での変動を反映しているわけではない。したがって,
健康な成人労働者で見られたEOに対する反応の変動幅(文献[54]参照)では,患者での変動を小さめに表
現してしまう可能性がある。
この細分箇条では,高感受性グループを適切に保護するためのUF1値を見つけるため,EOばく露に伴
う毒性作用のヒトでの変動に寄与する種々の主要ファクターについて調べることにする。
G.4.3.1.2 EO解毒酵素の多型
G.4.3.1.2.1 一般的考察
EOは,動物でもヒトでも,二つの酵素によって代謝・解毒される。すなわち,グルタチオン転移酵素
のtheta1アイソフォーム(以下,GSTT1という。)及びエポキサイド加水分解酵素(以下,EHという。)
である。これらの二つの酵素ともヒトでは表現型に多型がある(例,文献[182],[183]及び[184])。このこ
とは,人々の数パーセントは,その他の人々に比べて,相対的にEOの代謝能が低いと予想されることを
示唆している。EOはこれらの酵素によって解毒作用を受けるので,EOの代謝能力が乏しいということは,
他の集団と比べて毒性作用のリスクが増大するものと予想される。EOに対するヒトの反応の変動に及ぼ
すGSTT1の多型の役割には,少なからぬ注意が払われてきた(例,文献[50])。しかし,ヒトでは,EOは
主にEHによって代謝されるので,GSTT1の多型がヒトでのEOに対する反応の変動に大きな影響を与え
るとは考えられない。ヒトでのEO代謝に対してEHが主な役割を果たすと考えられているにもかかわら
ず,EHの多型の潜在的な役割及びEO代謝の阻害,ひいてはEOばく露のリスクについては,ほとんど注
目されてこなかった。ヒトのEOに対する反応に与えるGSTT1及びEHの多型のインパクトについては,
G.4.3.1.2.2及びG.4.3.1.2.3で論じる。
G.4.3.1.2.2 EOに対するヒトの反応の変動におけるGSTT1の多型の役割
調査したある集団での非GSTT1(GSTT1 null)遺伝子型の頻度は,54 %になる(文献[6]参照)と報告さ
れたが,ほとんどの論文では,それは調査対象によって異なるとされており,17 %〜25 %の範囲(例,文
献[158])に入ると報告されている。非GSTT1遺伝子型では,GSTT1酵素活性の減少を伴うので,一部の
母集団では明らかにEOのリスクは増大する。

38
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
非GSTT1遺伝子型では,EOにばく露された個体におけるEO・ヘモグロビン付加体のレベルに明らか
な影響が見られる(表G.4参照)。
表G.4−EO・ヘモグロビン付加体レベルに与えるGSTT1多型の影響(GS抱合対非抱合・母集団)
文献
GSTT1+型母集団と非GSTT1型母集団との平均値の差
[53]
3
[130]
2
[182]
1.5
[50]
1.5
[205]
2.1
表G.4の結果は,非GSTT1型母集団においては,体内EO用量はGSTT1型母集団に比べて1.5〜3倍に
なることを示唆している。しかし,このような平均値の差の比較では,GSTT1型群での作用量及び非GSTT1
型母集団の下限パーセント点群での作用量の差を過小評価することになる。
論文データから,EOにばく露されたヒトにおけるEO・ヘモグロビン付加体のレベルとGSTT1発現と
の間の関連性は明らかであるが,GSTT1多型のSCE(姉妹染色分体交換)誘導への影響についての評価は,
分かれる。Hallier [64] は,非GSTT1型の末しょう(梢)血リンパ球でのSCE誘導はGSTT1型母集団のそ
れより随分高いとしているが,Schroder [163] 及びWiencke [202] では,非GSTT1型群におけるSCEのバック
グラウンドレベルはGSTT1型群のそれと比較してほんの少しの増加しかない(very modest increase)とし
ている。これらを総合すると,GSTT1の多型は,EO・ヘモグロビン付加体のレベルの増加に影響を与え
るが,GS非抱合母集団におけるEOの遺伝毒性影響には,ごく僅かな増加影響しか与えないものと推察で
きる。
非GSTT1型母集団ではある種のがんのリスクは増加する(例,文献[48]及び[207])が,EOによる発が
んリスクは,必ずしも増加しないということは念頭におく必要がある。
G.4.3.1.2.3 ヒトのEOに対する作用の変動に与えるEH酵素の多型の役割
GSTT1と同様に,ヒトでのEHの発現型には多型がある(文献[69]及び[144]参照)。その結果,EHの活
性にはヒトの間で大きな変動があり得る。例えば,Mertes [123] は,ヒトの肝臓におけるEH基質の代謝に
は63倍もの開きがあることを見いだした。しかし,それらの肝臓サンプルの90 %は中心値から3倍未満
の範囲に分布していた。Kitteringhamら[90] は,EH多型がヒトでのEHの活性に与える影響を概括し,次の
ように述べている。
“これらの研究を一般化すれば,HYL1(microsomal epoxide hydrolase:ミクロソームエポキサイド
加水分解酵素)が完全に欠損した個体はいないが,ある程度の肝機能の個人差は存在することがは
っきりしている。
なお,全人口の大半は,10倍の範囲内に収まるであろう。”
ヒトでのEH活性の全体幅が,低代謝能も迅速代謝能も含めて,10倍の範囲に収まる場合は,平均的な
ヒトと最も代謝能の低いヒトとの間の活性の違いは,変動の分布の形にもよるが,5倍程度の差で表現で
きるだろう。
このようなヒトにおけるEH活性の変動は,ある種のがんのリスクの増大につながることが分かってい
るが,それは必ずしもEOばく露による発がんの増大を伴わない。例えば,McGlynnら[121] は,EH低活性
の多型をもつ中国人では,肝細胞がん(hepatocellular carcinoma)が2倍に増加することを見いだした。さ
らに,EHによるエポキサイド代謝の活性が低いと,胎児ヒダントイン症候群(fetal hydantoin syndrome)
39
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
及び抗けいれん(痙攣)薬の使用に伴う毒性作用のリスクが増加する(文献[93]参照)。EOはEH経路で
解毒されるので,おそらく,EH酵素の発現が低下している多型の結果として,EH活性が低い個人は,エ
ポキサイドを効率的に代謝できる母集団に比較して,EOによる毒性作用のリスクが増加するものと考え
られる。
G.4.3.1.3 EO解毒酵素の阻害
G.4.3.1.3.1 疾病状態での阻害
ある種の疾病状態,例えば,内毒素血症及び外傷性ショックでは,EH活性は阻害される。ラットに細
菌性エンドトキシンを与えると,EH活性(文献[49]参照)もEH遺伝子発現(文献[36]参照)も阻害され
た。外傷性ショックの動物モデルにおいては,ミクロソームEHはおよそ50 %阻害された(文献[60]参照)。
おそらく,EH活性低下を伴う疾病状況では,EOの代謝は減損するものと考えられる。
G.4.3.1.3.2 医薬品及びその他の化学物質による阻害
抗けいれん薬(バルプロ酸及びバルプロミド)は,ヒトでの臨床投与量でEH活性を阻害することが示
された[88]。この阻害作用は,てんかん患者がバルプロ酸及び他の抗けいれん薬を併用した場合に催奇形性
が増すことの一因となっていると思われる。
酵素阻害の重要性
Fennell及びBrown [51] によって開発されたEOに関する生理学的速度論モデルは,EOの体内用量に与え
るGSTT1及びEHの阻害の影響を評価するために用いることができる。これらの研究者の報告は,それぞ
れのパラメータがEOのモデル静脈血中濃度に与える影響の度合いに関する分析によって,マウス及びラ
ットでは,このモデルにおけるGST VmaxパラメータはEOの静脈血中濃度に明らかな影響を与えるが,
ヒトでは影響しないことを示している。反対に,EH Vmaxパラメータ値の変化はヒトでのEO静脈血中濃
度に明らかな影響を及ぼすが,マウス及びラットでは影響を及ぼさない。EH Vmaxパラメータのヒトでの
感度定数(sensitivity coefficient)は,約−0.4 %であった。したがって,EH Vmaxパラメータの値が1 %減
少するごとに,静脈血中のEO濃度は0.4 %増加すると考えられる。結局,ある種の疾病状況(例 外傷,
敗血症)において起こり得るEHの50 %阻害は,EOの静脈血中濃度を20 %上昇させると考えられる。ヒ
トでは,GSTT1の阻害はEOの静脈血中濃度にほとんど影響を与えないものと思われる。したがって,EH
阻害は薬品の相互作用のような臨床上の重要性があるとはいえ,以上のような生理学的速度論モデルによ
る計算結果によれば,そのヒトでのEO体内濃度に与える影響は,せいぜい2倍以下と評価することがで
きる。
G.4.3.1.4 グルタチオンのレベル
EOのGSTT1経路による解毒には,コファクター(補酵素)として組織内で利用できる十分量の内因性
のグルタチオンが必要である。多数の論文において,重篤な疾病及び術後の患者においては,健康な人に
比べてグルタチオンの組織中レベルが下がることが示された。例えば,Wernerman [197] は,手術及び重篤
な疾病によって,グルタチオン・レベルは40 %にまで低下することを見いだした。結果として,重篤な疾
病をもっている患者は,健康な人と比べてEOによる毒性影響を発現するリスクが増すと考えられる。
G.4.3.1.5 DNA修復能に関する多型
発がん物質の代謝と同様に,DNA修復に関連する遺伝子の多型というもう一つの生理学的速度論的ファ
クターが,がんリスクに対して影響を及ぼす可能性がある(文献[73]参照)。DNA修復機構に障害をもつ
人達では,一般の人の大多数よりもEOによる毒性影響のリスクは増すと思われる。この説を支持する実
験データがある。Nivard [138] は,高濃度のEOにばく露されたショウジョウバエにおいて,母体ヌクレオ
チド除去修復(NER)のない場合は,それがうまく働く場合に比べて,変異率が最大20倍まで高くなるこ
40
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
とを見いだした。しかし,このような変異率の増加は,より低いEOばく露レベルでは見られなかった。
したがって,不十分なDNA修復能は,EOの毒性を増強させるかもしれないが,DNA修復に関する多型
のデータを定量的にUF1の値に反映するように評価することはできない。
全体的な変動
前述のように,ある種の患者においては,EOを代謝し解毒する能力を減少させる様々な生理学的速度
論的ファクターがある可能性がある。これらの要因とは,GSTT1及びEHの発現の多型,薬品及びその他
の物質によるEHの阻害,ある種の疾病状況におけるEH活性の低下である。また,重篤な患者の組織に
おけるグルタチオン・レベルの低下又はDNA修復能における多型のような多様な生理学的速度論的要因
によっても,ある人達の標的組織がEOによって障害されやすくなる。これらのデータをUF1の選択に定
量的に生かすことはできないが,総体的に評価しようとする場合には,EOに対する反応の個体差を特定
するためのUF選択の過程では,これらの要因は役立つと考えられる。
Fuchs [54] によって報告されたヘモグロビンのバイオマーカーに関するデータに現れた変動によって,
UF1の値を少なくとも6とすることが可能である。しかし,この値では,健康な人の平均値と重症な患者
の集団で感受性の高い人との間の感受性の差を低めに見積もることになる。
Knudsen [91] は,個人差を表すUFの大きさに代謝能が影響を与える複数の因子の影響を考慮し,次のよ
うに述べている。
“リスクアセスメントにおいては,個体差の変動として一般的に安全係数10が受け入れられてい
る。文献を調査すると,単一な多型だけを考慮する場合には,安全係数10は妥当だといえる。し
かし,幾つかの代謝に関する遺伝子型と,DNA修復の欠損及び貧栄養状態といったその他の感受性
決定因子をもつグループでは,リスクは安全係数10をはるかに上回るであろう。”
これらのファクターの複合効果は,不明である。しかし,データを総合すれば,UF1の値はデフォルト
値の10より大きいとすることは,妥当であると考えられる。結論的には,個人差のUF1の値を30と見積
もることで最も感受性の高い母集団を保護することができるものと考えられる。
G.4.3.2 種差(UF2)
G.4.3.2.1 概要
UF2の値を導くに当たっての種差を考慮する前に,EOばく露の動物実験結果は,ヒトに関連性がある
かを考察することは重要である。G.4.2.1及びG.4.2.2において記載したように,EOのTI値の決定におけ
る重要なエンドポイントはウサギの体重減少(一時的又は短・中期的接触カテゴリでのLOAELの根拠)
であり,カニクイザルでの精子形成の変化及び精巣への作用(短・中期的接触カテゴリでの非発がん性影
響の根拠)であった。実験動物での体重減少は,一般的な毒性作用でTI値設定の根拠として認められてい
る。ヒト以外の霊長類における精子形成は,精子形成サイクルの長さ,その期間,有糸分裂数において,
ヒトで起こるものと組織学的に類似している(文献[124]及び[195]参照)。したがって,ヒト以外の霊長類
はヒトでの精子形成の実験学的研究の適切な実験モデルとされてきた。同じように,カニクイザルで見ら
れたEOによって誘導されたこの効果は,ヒトにも適用できると考えられる。また,EOは直接に作用する
genotoxic carcinogenとして発がん作用を発現すると考えられるので,実験動物でみられた発がん性作用は
直接にヒトへも適用できる。
相対成長の原理によれば,ヒトは,化学物質の毒性作用に対して実験動物より感受性が高いとみなされ
る(文献[127]参照)。そこで,ISO 10993-17では,実験動物とヒトとの間の化学物質の作用の強さの違い
として,デフォルト値10を見積もることを推奨している。しかし,幾つかの研究結果は,EOの毒性の強
さ(potency)は種間で同等であることを示唆している。次に詳しく記載するように,生理学的速度論的モ
41
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
デルの結果では,一定の気中EO濃度にばく露されたマウス,ラット,ヒトでは同じ体内EO用量が期待
されている。この生理学的速度論的モデル実験結果は,類似化合物(propylene oxide,styrene oxide)の吸
入実験における体内濃度が種間で同等であることからも裏付けられる。これらのファクター全てが,EO
のTI値を決定するに用いるUF2を1とすることを支持している。
G.4.3.2.2 生理学的速度論的モデルの結果(Results of PBPK modeling)
先に述べた生理学的速度論的モデルを使って,Fennell及びBrown [51] は,低濃度のEOの6時間吸入後
のEOの体内用量[血中での曲線下面積(area under the curve: AUC)]計算値は,マウス,ラット,ヒトで
同等であることを見いだした(表G.5参照)。
表G.5−EO吸入後の体内用量計算値
EO 気中濃度
ppm
AUC
mg×h/L
マウス
ラット
ヒト
1
0.044
0.059
0.056
10
0.44
0.59
0.57
作用に関する動物種の類似性
体内用量の指標としてヘモグロビン結合体のレベルを用いることで,Ehrenberg及びTornqvist[45]は,同
じEO気中濃度にさらされたときの結合体レベルの増加は,種間で変わらなかったことを報告している。
同様に,同じ濃度のEOにさらされたときの体内EO用量は,種間で類似している(表G.6参照)。
表G.6−EO体内用量の種間比較[45]
動物種
マウス
ラット
ヒト
HOEtVal付加体
増加分(1 ppm・h当たり)
12
16
12
血中用量
(μMh ppm−1)
0.5
0.35
0.3
注記 HOEtValは,N-(2-hydroxyethyl) valineを表す。
類似のエポキサイド類の種間活性比較
Segerback [165] は,プロピレンオキサイドの吸入ばく露後のin vivo DNA結合体のレベルが種間で同等で
あったと報告している。生理学的速度論の観点から,Bjorgeら[23] は,分離されたヒト及びラット精巣細胞
をin vitroでスチレンオキサイドにばく露した時の単鎖DNA切断のレベルはほぼ同一であることを見いだ
した。プロピレンオキサイド,スチレンオキサイド及びEOの化学構造及び作用機構の類似性から,以上
の知見はEOの作用強度は種間で同等であるとの結論を支持するものとなろう。
G.4.3.2.3 DNA修復速度の種差
DNA修復は,動物種によらず同様の速度で進行することが分かっている。これは,UF2の値を1とする
ことを補助するものである。例えば,メチルメタンスルフォネート(MMS)によるDNA傷害をヒト細胞
もラット細胞も同じ速度で修復する(文献[142]参照)。EOもMMSも生殖細胞に対して同じ機構で作用す
る(文献[192]参照)ので,EOに関するDNA修復速度も種間で同様であると考えることができる。
同じ濃度のEOにばく露されたときの,体内EO用量のモデル値及び実測値は,種間で類似しているこ
と,及びDNA修復速度も種間で同じであることによれば,UF2値を1とすることは科学的妥当性がある

42
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
と考えられる。
G.4.3.3 実験データの質と関連性(UF3)
UF3は,TI値を求める際に用いた毒性データにおける制限を考慮するためのものである。例えば,NOAEL
値の欠落,長期的(永久)接触に関するNOAEL値の欠落,臨床使用状況と関連したばく露経路による実
験データの欠落などに対する考慮である。
臨床使用状況と関連したばく露経路による実験データが欠落している場合に用いる別投与ルートからの
外挿(route-to-route extrapolation)アプローチは,G.3で既にカバーされているので,UF3算定にあえて使
う必要はない。しかし,文献[107]でNOAEL値が得られないことに関しては,UF3を勘案する必要がある。
カニクイザルでのNOAEL値を決めるための実験データが欠けている場合は,次のようなアプローチを
採り得よう。
− マウスでのNOAEL値における体内EO用量を計算する。
− この用量をカニクイザルのNOAELでの体内用量と同等と考える。
− 二つの値を比較する。
文献[186]の研究結果に基づいて,10 ppmのEOにラットが6時間ばく露された時の体内用量は2.7 mg/kg
である。文献[107]でのLOAELレベルのEOに6時間ばく露した時のカニクイザルの体内EO用量の計算
値は,3.3 mg/kg(5日間ばく露を一週間に平準化した値ではない)である。EOの用量を種間で比較する場
合は,体重換算で行うので,サルでの体内用量とラットでのそれとの比は,3.3/2.7=1.2となる。精子への
EOの作用における種間での生理学的速度論的な同等性を仮定すれば,この比は,妥当である。
したがって,文献[107]におけるNOAELを見積もるためには,UFの値として3をLOAELに適用するの
は妥当であると考えられる。このようなLOAEL-to-NOAELのUFの3という値は,DEHPの非経口ルート
のTIを導くために,US FDA(2000)が採用したものと同じである。さらに,Abdel-Rahman及びKardy [3]
は,24種類の化学物質の経口投与でのLOAEL-to-NOAELの比の中央値は,3.5であり,その比の96 %は
10未満であったと報告している。結論として,文献[107]で報告されたLOAEL値からEOのTI値を算出す
るに当たって適用するUFの値3には,直接的な科学的裏付けがあり,この値を選択した複数の前例があ
る。
G.4.4 EOの非発がん性のTI値の算出
上記のような妥当性検討に基づいて,EOの非発がん性の毒性についてのTI値を算出するために適用す
る不確実性係数UFとして,次の値を選んだ。
− UF1 個人差
30
− UF2 種差
1
− UF3 データ欠落
3 (ただし,この場合はNOAEL値の欠落の場合)
すなわち,NOAELが得られる場合の修飾係数(MF)は30,LOAELが得られる場合のMFは90を用い
る。
このようなMFをNOAEL又はLOAEL値に適用して得たTI値を,表G.7に示した。
表G.7−非発がん性のTI値(一時的接触/短・中期的接触カテゴリ)
文献
NOAEL/LOAEL
mg/kg/d
UF
TI
mg/kg/d
[169]
9(NOAEL)
30
0.3
[82]
9(NOAEL)
30
0.3
[107]
2(LOAEL)
90
0.02
43
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
G.5
EOの発がん性に基づくTI値
G.5.1 一般
ISO 10993-17には,入手可能なデータ及び規制上の基準に応じて,発がん性に基づくTI値を設定するた
めの最も適切なアプローチを選択できるような柔軟性をもたせてある。EOは遺伝毒性の機構によって発
がん作用をあらわすので,直線外挿アプローチ(linear extrapolation approach)が,低用量領域のリスクを
評価するために最も適切な方法と一般的に認識されている。この直線外挿アプローチでは,低濃度域での
ヒトに一定のリスクをもたらす用量を評価するための統計的,用量・反応モデルを採用するか,ヒト又は
実験動物において発がんリスクの増加をもたらす最低用量から,ゼロリスクの用量へと単純な直線をひく
外挿法を採用する。これらに代わって,非発がん性リスクアセスメントにおいて用いられるような
LOAEL/UF又はNOAEL/UFによるアプローチが,ある規制当局,特にヨーロッパにおいて支持されてい
る。最後に,非直線的な生物学的な基礎に基づくアプローチが,EOのリスクアセスメントに提唱されて
いるが,このアプローチは完全には検証されておらず,受け入れられていない。
ここでは,発がん性に基づくEOのTI値決定は,次のようなアプローチで行われた。
− ヒトのデータからの直線外挿法
− 動物実験データからの直線外挿法
− UF値のLOAELへの適用
− 用量・反応関係モデル
G.5.2 アプローチ1:ヒトのデータからの直線外挿法
Gaylor [56] は,20 ppmのEOに平均3.9年ばく露された労働者(文献[71]参照)における白血病発症率の
増加を0.043と計算した。
0.043の過剰がんリスクを誘発する体内吸収EO用量は,
20 ppm×1.8 mg/m3/ppm×10 m3/d×0.8 (吸収係数)×5/7÷70 kg=2.94 mg/kg/d
単位発がんリスクは,
0.043/2.94 mg/kg/d=0.015 (mg/kg/d)−1
10−4の過剰がんリスクをもたらす用量は,
10−4/0.015 (mg/kg/d)−1=0.006 7 mg/kg/d
G.5.3 アプローチ2:動物実験データからの直線外挿法
文献[108]において,二つのばく露用量において雄ラットで白血病のり(罹)患率の増加が認められた。
低用量群(50 ppm)における白血病のり(罹)患率の増加は,0.072(ばく露群0.11に対して対照群0.038)
であった。その用量での体内吸収用量は,
50 ppm×1.8 mg/m3/ppm×0.29 m3/d×0.68 (吸収係数)×5/7×7/24÷0.35 kg=10.56 mg/kg/d
単位発がんリスクは,
0.072/(10.56 mg/kg/d)=0.006 8 (mg/kg/d)−1
10−4の過剰がんリスクをもたらす用量は,
10−4/[0.006 8 (mg/kg/d)−1]=0.015 mg/kg/d
G.5.4 アプローチ3:不確実性係数アプローチ
文献[172]及び[173]によれば,33 ppmのEOに2年間ばく露されたラットにおいて,白血病,脳腫瘍,中
皮腫の増加が認められた。このばく露気中濃度は,以下の体内濃度と同等である。
33 ppm×1.8 mg/m3/ppm×0.29 m3/d×0.68 (吸収係数)×5/7×6/24÷0.35 kg=
6.0 mg/kg/d
44
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
このLOAEL値にMFとして90を適用すれば,発がん性に基づくTI値は,0.07 mg/kg/dとなる。
G.5.5 アプローチ4:ヒトのデータへの直線的用量・反応モデルの適用
ISO 10993-17では,発がん性物質に患者がばく露された際のリスクを評価するために,ヒトでのデータ
が使える場合は,これらは動物データを使用するより勝る,としている。Seilken及びFlores [166] は,Union
Carbide社(UCC)[181] 及び米国国立労働安全衛生研究所(NIOSH)[176] のデータシートにおける用量・反応
データに,モデルアプローチを適用して,吸入における単位リスク(1 μg/m3 EOばく露に伴うリスク)を
計算した(表G.8参照)。
表G.8−単位リスクの値に基づいて文献[166]で計算された10−4のリスクに相当する用量
データ
単位リスク
(μg/m3)−1
10−4のリスクをもたらす用量a)
mg/kg/d
UCC
5.1×10−7
0.020
NIOSH
5.8×10−7
0.019
注a) 気中濃度をmg/kg/dに換算するのに,ヒトの呼吸量を10
m3/dとし,週5日ばく露,体重を70 kgとした。
G.5.6 発がん性に基づくTI値の比較
表G.9を参照。
表G.9−EOの発がん性に基づくTI値の比較
アプローチ
発がん性に基づくTI値
mg/kg/d
アプローチ1:直線外挿法(ヒトデータ)a)
0.007
アプローチ2:直線外挿法(動物データ)a)
0.015
アプローチ3:不確実性係数(動物データ)b)
0.07
アプローチ4:直線的用量・反応モデル(ヒトデータ)a)
0.020
注a) 10−4過剰発がんリスクに相当
b) MF=90とした。
アプローチ1,2及び4によって算出した発がん性によるTI値は,0.007〜0.02 mg/kg/dであった。アプ
ローチ4によって算出された発がん性に基づくTI値は,用量反応モデルで計算されたので,ヒトでの用量
反応関係をより正確に表していると考えられる。アプローチ4を用いて算出したTI値を発がん性に基づく
TIの基礎とした。
この発がん性に基づくTI値を選択することは,文献[54]のデータによっても支持される。この文献では,
高感受性グループに属する労働者において,DNA単鎖切断がみられる最低EO濃度は,0.6 mg/m3であっ
た。この気中濃度を体内吸収量に換算すると,
0.6 mg/m3×10 m3/d÷70 kg=0.085 mg/kg/dとなる。
すなわち,発がん性に基づくTI値として0.02 mg/kg/dをとることは,高感受性グループに属するヒトを
遺伝毒性作用から守るためにも適切であると考えられる。
G.5.7 TI値の比較
ISO 10993-17では,非発がん性TI値と発がん性に基づくTI値とを比較して小さい方の値を,長期的(永
久)接触カテゴリのTI値とするよう指導している(表G.10参照)。

45
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表G.10−EOの非発がん性TI値と発がん性TI値との比較
アプローチ
TI値
(mg/kg/d)
発がん性に基づくTI値
直線的用量・反応モデル(ヒトデータ)
0.020
非発がん性TI値
不確実性係数(Lynch et al., 1982 [107])
0.022
表G.10に示したように,長期的(永久)接触カテゴリにおいて,非発がん性TI値も発がん性に基づく
TI値もほぼ同程度である。
G.6
耐容ばく露レベル[Tolerable Exposure (TE) level]の計算
G.6.1 耐容ばく露量TE
特定の医療機器の使い方を反映し,個別医療機器においての限度値の計算を可能にするために,TI値を
修飾する。耐容ばく露限度値(TE)は,TI値,体重(mb)及び使用係数(UTF: utilization factor)の積で
ある。
TE=TI×mb×UTF
特別の患者人口情報がない場合は,体重は一般的には70 kgとしている。
使用係数UTFは,多数の医療機器からのEOばく露のファクター,すなわち同時使用のファクター
(concomitant exposure factor: 同時使用係数,CEF),及び全く医療機器を使用しない期間を全体にならすフ
ァクター(proportional exposure factor: ばく露均一化係数,PEF)の積である。
UTF=CEF×PEF
特別な情報が得られない場合は,CEF=0.2,PEF=1.0をデフォルト値として用いる。
G.6.2 一時的接触のTE
TE=0.30 mg/kg/d×70 kg×0.2
TE=4.2 mg/d,個々の医療機器に適用する便宜上から,数字を丸めて,4 mg/dとする。
すなわち,EOの平均一日用量(average daily dose of EO)は4 mg/dを超えてはならない(G.1参照)。
G.6.3 短・中期的接触のTE
TE=0.30 mg/kg/d×70 kg×0.2
TE=4.2 mg/d,個々の医療機器に適用する便宜上から,数字を丸めて,4 mg/dとする。
したがって,EOの平均一日用量(average daily dose of EO)は,4 mg/dを超えてはならないことになる
が,現行の値(2.0 mg/d)を維持する。
G.6.4 長期的(永久)接触のTE
TE=0.02 mg/kg/d×70 kg×0.2
TEは,0.28 mg/d,個々の医療機器に適用する便宜上から,数字を丸めて,0.3 mg/dとする。
したがって,EOの平均一日用量(average daily dose of EO)は0.3 mg/dを超えてはならないことになる
が,4.3.2で述べた理由で,現行の値(0.1 mg/d)を維持する。
G.6.5 耐容接触限度(Tolerable Contact Limit: TCL)の計算
G.6.5.1 理論的根拠
EOは刺激性があるので,TCLを求めることが望ましい。TCLは,EO滅菌された表面接触医療機器及び
埋植医療機器で必要である。TCLは,ISO 10993-17に記述されたアプローチによって求めた。
46
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
G.6.5.2 重要な論文の選択
EOのTCLを求めるのに使用できる用量・反応関係データを含む幾つかの論文(文献[12],[117],[168]
及び[179])がある。
Matsumoto[117]は,心臓カテーテル及び尿道カテーテルの断片をEO滅菌し,6時間,24時間,48時間,
72時間,96時間,168時間エアレーションした。それぞれのエアレーション時間でのカテーテルサンプル
中のEO残留量は水で3日間抽出後に定量した。また,カテーテル2 cmの断片をラット皮下に埋植した後,
動物を24時間,48時間,72時間及び1週間後にと(屠)殺した。心臓カテーテルのNIL(non irritating level,
無刺激量)及びMIL(minimum irritating level,最小刺激量)は,それぞれ0.46及び1.02 mg EO/gカテーテ
ルであった。
Andersen [12] も埋植材料によるEO刺激の研究を行っているが,材料中の残留EO量は滅菌前後の重量差
から決めている。EO定量法の精度を理由に,TCLを求めるためにこのデータを用いることはしなかった。
Shupack [168] は,EO滅菌したパッチをヒトボランティアの背中に貼って,その局所刺激を調べた。最も
低レベルのEOによって刺激作用をもたらした材料は,PVCのブロックであった。893 ppmのEOを含有
するPVCブロックによって刺激作用が観察されたものである。NILに関する報告はない。このブロックの
重量は,719 mgであったので,MILは0.642 mg EO(0.893 mg EO/g 材料×0.719 g PVC)となる。皮膚に
接触する面積は2 cm2であったので,MILを接触面積で表せば,0.32 mg/cm2(321 μg/cm2)となる。
Tanaka [179] は,EOを含浸したガーゼをウサギに貼って,皮膚刺激試験を行った。刺激性を示さない最高
濃度は0.75 mg/patchであった。パッチの表面積は1.77 cm2であったので,NILは0.424 mg/cm2(424 μg/cm2)
となる。
Anand [11] は,0.5 mLのEO水溶液をコットンペレットに含浸させ,これをチャイニーズハムスターの頬
袋に留置した。4時間後にペレットを除去した後,14日後まで組織反応を観察した。14日後において刺激
作用が見られなかったEOの最高濃度は,2 500 μg/mLであった。頬袋の有効面積は約1.5 cm2であるので,
NILは833 μg/cm2である。
このようにして得たNIL値又はMIL値を,表G.11にまとめた。
表G.11−EOの刺激作用論文の比較
文献
医療機器/材料
NIL値又はMIL値
(μg/cm2)
[117]
心臓カテーテル
103
[168]
PVCブロック
321
[179]
ガーゼパッチ
424
[11]
コットンペレット
833
G.6.5.3 TCL決定における不確実性係数の選択
EOに対するTCLの決定において考慮すべき不確実性係数は,刺激物質への反応の個体差(UF4),刺激
作用の種差(UF5),及びデータ欠落に関するもの(UF6)である。
G.6.5.4 個体間変動(UF4)
EOに関する物質特異的なUF4設定に使えるようなデータは,存在しない。各種の接触刺激物質の一定
用量に対するヒトの多様性については分かっているが(例,文献[21]),これらのデータはUF4のデフォル
ト値を導くには十分ではない。しかし,EO滅菌材料を埋植した時にみられる作用の個体差は,ごく小さ
いと評価される。皮膚接触材料の場合の個人差は,もっと大きいものと思われる(特に,健常皮膚でない
47
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
場合はなおさら)。したがって,刺激作用データが埋植実験あるいは粘膜刺激試験で得られた場合には,
UF4として3を,皮膚刺激性試験の場合にはUF4として5を使うことにした。
G.6.5.5 種間変動(UF5)
EOに関する物質特異的なUF5設定に使えるようなデータはない。しかし,EOによって起こされる局所
作用では,種特異的な反応はないものと思われる(特に,埋植材料において)。したがって,UF5として1
を用いることにした。
G.6.5.6 データ欠落について(UF6)
様々な組織の局所刺激に対する相対的感受性は異なる。したがって,TCL決定の根拠とした論文におけ
る接触組織より,実際の接触組織(例えば,脳実質)の方が,EO滅菌医療機器に対して鋭敏な場合もあ
り得る。このような,より鋭敏な組織に接触するという可能性を考慮して,係数3を採用した。
文献[168]からは,NILは得られなかったので,NILが欠落していることを勘案して係数2を採用した。
ISO 10993-17にあるように,ある物質のTI値又はTCL値を導くための重要なコンセプトは,“患者での
用量(dose-to-patient)”すなわち生体に作用する量(bio-available dose)である。局所刺激性試験は,皮膚
及び粘膜に材料を接触させて行われるが,ある量は材料中に留まったままであり,又はある量は揮散して
しまう。どちらの場合も,標的組織での刺激作用をじゃっ(惹)起するに必要なEO量が減ることになる。
文献[11],[168]又は[179]のいずれにおいても,実際に生体に作用したEO用量は得られていないが,表示
用量の50 %が標的組織に到達したと考えることにする。すなわち,これらの論文においての生体に作用す
る量(bio-available dose)に関する疑問を考慮して,係数2を採用する。
文献[11]でのばく露時間は,4時間にすぎなかった。しかし,EO滅菌医療機器が4時間以上組織に接触
する可能性がある。より長時間より低濃度のEOが組織に接触して作用を発現する可能性を勘案して,係
数2を用いることにした。
それぞれの論文データに適用したUF4,UF5,UF6,それらの全体としての修飾係数(MF),及び結果
として算出されたTCL値を,表G.12に示した。
表G.12−EOの刺激に関する論文に対して用いた不確実性係数,
修飾係数,及びその結果から得られたTCL値
文献
部位
NIL値又はMIL値
μg/cm2
UF4
UF5
UF6
MF
TCL値
μg/cm2
[117]
埋植
103
3
1
3
10
10.3
[168]
皮膚
321
5
1
12
60
5.4
[179]
皮膚
424
5
1
6
30
14.1
[11]
粘膜
833
3
1
12
36
23.1
このような異なる研究から導き出された値に基づいており,また,接触組織(粘膜及び埋植)の臨床的
な意味を考慮すれば,10 μg/cm2という低いTCL値は,多様な組織に対するEOによる局所作用に対して適
切な保護を提供すると考えられる。
G.7
許容限度値の算出
許容限度値(allowable limit: AL)とは,一つの医療機器にばく露された結果として許容される最大のEO
量のことで,mg/日で表される。AL値は,容易に個々の医療機器における限度値に変換できる。これらの
計算については,G.8で詳しく説明する。AL値は,TEと便益ファクター(benefit factor: BF)の積である。
48
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
AL=TE×BF
ある特定の医療機器を使用するときに,特定の溶出物質又は残留物質へのばく露が避けられず,また,
その特定の医療機器を使用することに保健衛生上の便益がある場合には,便益ファクター(BF)を勘案す
ることが妥当である。(他の滅菌方法で滅菌した医療機器に対して)EO滅菌医療機器を使用することによ
る生じる定量的あるいは有意な保健衛生上の便益はない場合は,附属書Fにおいて別途に論じたある種の
特殊な医療機器カテゴリを除いて,BFは1である。したがって,附属書Fで特に規定した医療機器カテ
ゴリ以外は,全てのばく露期間カテゴリにおいて,許容限度値は,耐容ばく露量に一致する。
G.8
医療機器の限度値(device limit)の計算
G.8.1 一般的考察
一つの医療機器からのばく露量として示されるEOの最大量(mdev, cat)は,許容限度(AL)と該当する
ばく露期間カテゴリ(医療機器使用日数)との積である。
mdev, cat=AL×カテゴリの日数
G.8.2 一時的接触医療機器
一時的接触医療機器の許容量(mdev, lmt)は,1日以内の使用であることから,
mdev, lmt=4.0 mg/d×1 d=4 mg
である。
G.8.3 短・中期的接触医療機器
短・中期的接触医療機器は,2日から30日まで使用されることから,ここで導き出された短・中期的接
触のAL値を使えば,医療機器の許容量(mdev, prol)は,
mdev, prol=4.0 mg/d×30 d=120 mg
である。
しかし,現行のAL値(2.0 mg/d)を維持することとして,短・中期的接触の医療機器の許容量(mdev, prol)
は,
mdev, prol=2.0 mg/d×30 d=60 mg
とする。
なお,どの1日においても,EOの最大用量は,4.0 mgを超えてはならない。
G.8.4 長期的(永久)接触医療機器
長期的(永久)接触医療機器は,31日〜25 000日まで使用される。この文書中で計算した長期的(永久)
接触カテゴリのAL値を使う場合,医療機器の許容量(mdev, perm)は,
mdev, perm=0.28 mg/d×25 000 d=7.0 g
となるが,現行のAL値の0.1 mg/dを維持することとして,長期的(永久)接触医療機器の許容量(mdev, perm)
は,
mdev, perm=0.1 mg/d×25 000 d=2.5 g
とする。
なお,最初の1か月ではEOの最大用量は,60 mgを超えてはならず,いかなる1日においても4 mgを
超えてはならない。
G.8.5 TCLに基づく許容量
表面接触医療機器に対しては,TCLに基づく許容量が関係する。TCLに基づく許容量の計算式は,次の
とおりである。
49
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
mdev, BSC=TCL×A
ここに,
mdev, BSC: 医療機器当たりのEO量,すなわち,患者への最大用量
(mg)
TCL: 耐容接触限度(mg/cm2)
A: 身体に接触する医療機器の表面積(cm2)
したがって,個々の医療機器については,そのおよその表面積をcm2で表したものに,TCL(10 μg/cm2)
を乗じることで,個別医療機器の許容量を計算できる。
例えば,医療機器の身体接触表面積=100 cm2の場合
mdev, BSC=10 μg/cm2×100 cm2=1 mg
50
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書H
(参考)
ECHの許容限度値の設定
H.1 一般
急性毒性データ及び反復投与データによれば,経皮,経口又は非経口摂取によってECHは速やかに全身
の循環系に到達する。半数致死量(LD50)及び無毒性量(NOAEL)の調査によれば,一定時間間隔での
ECHの投与の影響は,一時的,短・中期的及び長期的のそれぞれにおいて,経口及び非経口ばく露ルート
ともに類似のものとなっている。慢性及び亜慢性毒性研究によってもたらされるデータによれば,ECHは
ばく露期間が長くなっても影響が大きくなるとは思われない。ECHは,標的臓器への毒性という点からは
注目すべきものではないが,特定の臓器への影響は,投与ルートとばく露期間によって変化する。起こり
得る反応について議論された1日当たりの許容限度値は,これらの一般的な知見を反映している。短・中
期及び長期的(永久)接触カテゴリにおいては,この規格での評価によると,TI値及び医療機器での限度
値は,ISO 10993-7:1995で設定した値より高い値になったが,1995年版の数値を維持することにした。現
行の限度値を維持する理由は,1995年版の基準値を採用して以来,臨床経験上に問題がなかったからであ
り,製造業者でこれらの限度値を遵守してきたからである。と同時に,短・中期及び長期的(永久)接触
に対する現行の限度値を,この改正案での評価でサポートされた数値まで高める現実的な臨床上及び製造
上の理由はないからである。
H.2 緒言
この附属書における医療機器中のECH残留限度値は,ISO 10993-17:2002の箇条4の耐容摂取量(TI)
を設定する手法に従った。医療機器中のECHの限度値は,多くの文献報告の評価に基づいて設定されてい
る。急性毒性データ,標的臓器への影響のデータ及び動物への慢性毒性が,H.4に記載したとおり,それ
ぞれの限度値の算出に最も適切であると思われた。
H.3 方法
H.3.1 概要
ISO 10993-17に規定している手法が,様々なばく露期間におけるECHのTI値の算出に使用されている。
医療機器から溶出するECHには,医療機器の使用期間に応じて一時的又は長期の期間でばく露する潜在
的な可能性が存在する。結果として,一時的,短・中期的並びに長期的なTI値を,この化学物質ではそれ
ぞれ別々に設定する必要がある。患者は,臨床機器に含まれるECHを非経口のルートでばく露される可能
性が特に高いが,このようなルートでのばく露におけるTI値の算出に利用可能な毒性データは,ほとんど
ない。それに対して,実験動物に対するECHの影響については,利用可能なデータベースがある。
H.3.2 用量に関する投与ルート間の外挿
患者の吸引によるECHのばく露を対象としたデータは,限られたものしかない。ECHのばく露は,塩
素分子の付加によるEOからECHへの変化によって起こるので,環境因子の影響を受ける。用量を異なる
ルートに外挿することは,ECHのリスク評価において重要な役割を果たしてはいない。
H.3.3 非発がんリスクアセスメント・アプローチ
ECHの非発がん性影響によるTI値は,対象研究の最も関連のあるNOAEL又はLOAELを,EOに対す
51
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
るヒトの感受性のばらつき(UF1),感受性の種差(UF2),データの欠陥(UF3)という不確実性係数で除
して求めた。ISO 10993-17は,TI値を求めるときに重要な毒性研究のデータに適用する不確実性係数を算
出することに利用可能な場合は,科学的データの利用を強く求めている。この考え方によって,ECHに対
するヒトの個体差,ECHの種差のデータを,それぞれUF1とUF2の値を求める場合に使用した。
H.3.4 発がんリスクアセスメント・アプローチ
ECHは,動物を用いたバイオアッセイにおいて発がん性を示さず,規制当局又は検討グループによって
ヒトに対する発がんの可能性がある物質とはみなされていない。ECHの発がん性に基づくTI値は,この
アセスメントとしては,計算されていない。
H.3.5 ECHのTI値算出で考慮しない影響
非発がん性影響に基づくTI値は,過敏症反応及びアナフィラキシーのような免疫反応を防ぐものである
必要は無く,さらには,溶血のような影響を防ぐことも考慮する必要は無いことに注意しておく必要があ
る。他の研究方法では,ECHのばく露によるこれらの影響から患者を守る必要が生じる可能性があること
を示唆している。
H.4 ECHの非発がん性のTI(noncancer-based TI)値
H.4.1 重要な論文の選択
H.4.1.1 一時的接触の限度値
24時間以下の期間におけるECHの一時的接触の許容限度値(AL)は,9 mg/dである。この限度値は,
ラットにおけるECHの30日間6.4 mg/kgの腹こう(腔)内注入による亜慢性毒性試験で,無毒性量(NOAEL)
であったこと(文献[103]参照)に基づいている。この用量は,以前同じ研究者によって行われ,LD50の値
として64 mg/kgを算出した研究(文献[102]参照)の10分の1の用量から算出した。類似の急性毒性試験
によるLD50の値が何人かの研究者によって報告されている(文献[104],[116],[159],[162],[194]及び[203]
参照)。これらの研究は,幾つかの動物種を用いて様々な投与ルートで行われている。半数致死量(LD50)
を含む急性毒性データは,このアセスメントには適切ではなかったが,入手して評価を行った。LD50のデ
ータは表H.1にまとめた。
表H.1のデータを精査すると,一時的接触,すなわち24時間未満のECHの毒性はばく露ルートにかか
わらずほぼ同等であり,動物種にかかわらず似たような毒性を示すことを示唆している。
表H.1のデータはNOAEL又はLOAELではなくLD50の値を反映したものなので,先に述べたように,
文献[103]で算出される無毒性量(NOAEL)の値を用いた。この文献では,研究者は急性毒性試験におけ
るLD50の10分の1の値である6.4 mg/kg/dを用量として用いた。この亜慢性試験では無作用レベルをはっ
きりさせることができた。そして,その6.4 mg/kg/dという値を用い,ISO 10993-17をガイドラインとして
活用し,適切な不確実性係数及び修飾係数を使用してECHの許容限度値(AL)を算出した。
NOAEL=6.4 mg/kg/d

52
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表H.1−ECHの一時的接触許容限度に用いる半数致死量(LD50)
経口LD50
mg/kg
経静脈LD50
mg/kg
腹こう(腔)内投与
LD50
mg/kg
皮下投与LD50
mg/kg
その他LD50
mg/kg
ラット:50
ラット:60
ウサギ:60
ラット:70
ラット:71.3
ラット:72
マウス:80
マウス:81.4
マウス:91
マウス:95
モルモット:110
マウス:150
マウス:180
ラット:67
ウサギ:80
ラット:84
ラット:100
ラット:110
マウス:120
ラット:44
ラット:58
ラット:60
ラット:63
ラット:64
ラット:70
ウサギ:80
ウサギ:84.6
モルモット:85
モルモット:85.5
ウサギ:90
マウス:97
マウス:98.4
マウス:120
マウス:130
ラット:60
ラット:72
ウサギ:100
マウス:120
マウス:150
皮膚
ウサギ:67.8
モルモット:84
不確実性係数(UFs)
− UF1(ヒトの個体差)=
10
− UF2(種差)=
1
− UF3(データの質/関連性)= 1
ヒトの個体差に対するデフォルト値のUF1=10は,その値が動物の中央値から導かれたものであること,
また,類似した変動がヒトにも存在するという仮定が成り立つことに基づいて使用された。
種差に基づくUF2=1という値は,低濃度のECHは,グルタチオン抱合によってS-カルボキシメチルグ
ルタチオンに解毒されるという文献[80]及び[81]の知見に基づいている。解毒作用は,十分な濃度のグルタ
チオンが存在する限り維持される。ECHのより高いばく露においては,グルタチオン濃度が不足し,明ら
かに毒性が発現する。動物とヒトは,同じ解毒機構をもっており,6.4 mg/kg/dという濃度は,NOAELと
結論付けられ,UF2は1とすることが適切である。
UF3=1という値は,データの関連性及び信頼性において適切に設定されている。
a) 修飾係数(MF)
− MF=UF1×UF2×UF3=10×1×1=10
− TI=NOAEL/MF=6.4 mg/kg/d/10=0.64 mg/kg/d
b) 利用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2
− PEF=1
− UTF=0.2×1=0.2
c) 耐容ばく露量(TE)
− TE=TI×BW×UTF
− TE=0.64 mg/kg/d×70 kg×0.2=9 mg/d
d) 許容限度値(AL) この段落は,便益ファクター(BF)の使用を含んでいる。BFは,ISO 10993-17

53
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
を適用する場合にケース・バイ・ケースで使われる。このケースでは,ECHに関するTEの値を達成
することは実現可能なので,BFはデフォルト値の1である。許容限度値の計算は,次のとおりである。
− 許容限度値=TE×BF
− AL=9×1=9 mg/d 24時間以下のばく露
この限度値は,ECHの亜慢性/生殖毒性試験での低いレベルのNOAEL(6.4 mg/kg/d)に基づいて算出
したものであることから,体重70 kgの成人への反復ばく露でも受け入れられるものである。
H.4.1.2 短・中期的接触限度値
24時間を超え,30日までのばく露によるAL値は,3.8 mg/dで,任意の1日に9 mg/d及び30日間に114
mg(3.8 mg/d×30 d)を超えないことである。この限度値は,亜慢性毒性と幾つかの動物種に見られる生
殖影響データ(催奇形性)によっている。これらのデータは,何人かの研究者によって報告されている(文
献[8],[10],[18],[38],[83],[85],[103],[145]及び[203]参照)。最大403日間の様々な期間で継続された
反復投与の経口及び非経口の研究において,ECHは,死を含む様々な毒性影響[これらはある研究におい
て,相対臓器重量の増加,肝臓のまだらな黒変,副腎出血,脳下垂体出血,消化管出血,心筋炎,甲状腺
鬱血,鬱血性肺変異]を伴うものであった。さらにECHは,体重及び体長の減少,脳・副腎・腎臓・肺・
甲状腺の重量増加,精巣萎縮又は精巣障害,おう(嘔)吐,ヘモグロビン・赤血球沈層容積(CPV)・ヘマ
トクリット減少,肝臓障害,異所性造血,骨髄富核及び白血球のリンパ球変異をもたらした。用量は,約
2.7 mg/kg/d〜93 mg/kg/dの範囲かそれ以上であった。生殖影響の研究は,ECHが様々な妊娠期間で投与さ
れる奇形学の研究だけであった。これらの研究において,ECHは,母体に対する毒性,胎児に対する毒性,
そして一つの論文では,奇形胎じ(仔)の増加をもたらした。この後者の影響は,ECHを静脈投与で120
mg/kg/dの用量で与えられたマウスのこ(仔)にだけ見られた。この用量は,急性致死量の範囲に十分入
るものである(文献[80]参照)。短・中期的接触に対する限度値計算の基礎となったデータが表H.2にまと
められている。
表H.2−ECHの短・中期的接触限度値設定に使用されたデータ
毒性研究
経口NOAEL
mg/kg/d
[文献]
非経口NOAEL
mg/kg/d
[文献]
亜慢性
13
[145]
2.7(週3回,6.4 mg/kg/dを7日に比例配分)
[103]
生殖影響
50
[38]
9
[83]
これらのデータを見ると,短・中期的接触期間,すなわち1〜30日までのばく露におけるECHのNOAEL
は,投与ルート及び特定の標的臓器あるいは生殖影響にかかわりなく,近い値になっている。動物は,ECH
の一般的な全身毒性に対して,生殖毒性に対するよりも高い感受性をもつ可能性がある。Lawrenceら[103]
によって行われた亜慢性毒性研究では,彼らの以前の研究で64 mg/kgと報告されたLD50の10分の1,す
なわち6.4 mg/kg/d,が用量として使用された。この研究では6.4 mg/kg/dのECHが1週間に3日,30日間
投与され,その結果,非経口投与NOAELは2.7 mg/kg/dと計算された。ラットにおけるこの用量は,短・
中期的接触の許容限度値(AL)を計算する根拠として次のように使用された。
NOAEL=6.4 mg/kg/d×3d/7d=2.7 mg/kg/d
不確実性係数(UFs)
− UF1(ヒトの個体差)=
10
54
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− UF2(種差)=
1
− UF3(データの質/関連性)= 1
この細分箇条で使用される不確実性係数は,データの質と理論的根拠とが同じなので,一時的接触の
H.4.1.1で使用したものと同じである。
a) 修飾係数(MF)
− MF=UF1×UF2×UF3=10×1×1=10
− TI=NOAEL/MF=2.7 mg/kg/d/10=0.27 mg/kg/d
b) 利用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2
− PEF=1
− UTF=0.2×1=0.2
c) 耐容ばく露量(TE)
− TE=TI×BW×UTF
− TE=0.27 mg/kg/d×70 kg×0.2=3.8 mg/d
d) 許容限度値(AL) この段落は,便益ファクター(BF)の使用を含む,これはケースごとにISO 10993-17
を適用して行われる。このケースでは,TEの値を達成することはECHの場合現実性があるので,BF
はデフォルト値の1になる。許容限度値の計算は,次のとおりである。
− 許容限度=TE×BF
− AL=3.8×1=3.8 mg/d 30日以内のばく露
この限度値は,ECHが慢性及び短・中期ばく露によって毒性の増加が見られなかったことに照らして,
体重 70 kgのヒトにとって十分に安全な値と考えられる。この限度値は動物のデータに基づいている。
H.4.1.3 長期的(永久)接触限度値
30日を超え,生涯にわたる長期的(永久)接触の許容限度値(AL)は10 gで,かつ,どの一日におい
ても9 mg/dを超えないこと,そして1か月に114 mgを超えないことである。この限度値は,文献[81],[116]
及び[133]で報告された慢性毒性,遺伝毒性及び発がん性のデータに基づいている。これらの研究では,飲
み水に入ったECHを24月齢までのラットに投与したり,経皮注射でラットに週2回少なくとも1年ECH
を投与したり,ラットとマウスに103〜104週間ECHの皮下投与を行った。用量は0.086 mg/kg/d〜71
mg/kg/dの範囲かそれ以上であった。これらの研究では,ラット生存率の減少以外に,ECHの投与に関係
する腫瘍発生率の増加又は慢性毒性の証拠は見られなかった(文献[81]参照)。長期的(永久)接触限度値
の計算の根拠となる重要なデータは,表H.3にまとめてある。
これらのデータをみると,ECHの長期的(永久)接触期間すなわち30日以上一生までのNOAELは,
経口と非経口のルートとはほぼ同じものであることが分かる。これらのデータは,亜慢性及び生殖毒性の
研究によるものともほぼ同じである。動物のECHの一般的な全身毒性影響への感受性は,発がん性影響(そ
れがあったとしても)への感受性より高い。
注記 慢性毒性でのNOAEL値の方が,発がん性でのNOAEL値より小さいことを指している。

55
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表H.3−ECHの長期的(永久)接触限度値の設定に使われたデータ
毒性研究
経口NOAEL
mg/kg/d
[文献]
非経口NOAEL
mg/kg/d
[文献]
皮膚NOAEL
mg/kg/d
[文献]
慢性毒性
4×LOAEL
[81]
2.9 毎週2回10 mg/kg投与から算出
[116]
データなし
発がん性
16
[81]
データなし
71 毎週5回100 mg/kg投与から算出a)
[133]
注a) ECHは最も高い用量の試験において腫瘍発生を増加させなかった。
長期的(永久)接触の許容限度値(AL)10 gの計算には,ラットへの少なくとも1年の経皮的投与によ
る慢性毒性に対する最低毒性量(LOAEL)の2.9 mg/kg/dと,腫瘍形成については,16 mg/kg/dを経口で
24月齢までのラットに投与したデータとを,次のように用いた。
LOAEL=2.9 mg/kg/d
不確実性係数(UFs)
− UF1(ヒトの個体差)=
10
− UF2(種差)=
10
− UF3(データの質/関連性)= 1
ヒトの個体差に対するデフォルト値のUF1=10は,その値が動物の中央値として分布しており,ヒトに
も類似した変動が存在するという仮定が成り立つことから使用した。
種差に対するデフォルト値UF2=10は,ヒトがECHをばく露された後の代謝活性に対する長期的影響
が不明確であることから用いた。低濃度のECHは,肝臓でグルクロン酸抱合によってS-カルボキシメチ
ルグルタチオンに解毒される(文献[81]参照)。しかし,これは生涯のばく露に外挿するには十分ではない。
UF3=1という値は,元データの評価目的への関連性(relevance)及び信頼性(strength)に基づいて,
適切に設定された。
a) 修飾係数(MF)
− MF=UF1×UF2×UF3=10×10×1=100
− TI=LOAEL /MF=2.9 mg/kg/d/100=0.029 mg/kg/d
b) 利用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2
− PEF=1
− UTF=0.2
c) 耐容ばく露量(TE)
− TE=TI×BW×UTF
− TE=0.029 mg/kg/d×70 kg×0.2=0.4 mg/d
d) 許容限度値(AL) この段落は,便益ファクター(BF)の使用を含む。ISO 10993-17を適用する場合,
BFはケース・バイ・ケースで使われる。このケースでTEの値を達成することは,ECHの場合に現実
性があるので,BFはデフォルト値の1である。許容限度値の計算は,次のとおりである。
− 許容限度=TE×BF

56
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− AL=9×1=9 mg(任意の一日において),かつ,
− AL=0.4 mg/d×25 000 d=10 g(生涯で)
これらの予測的な限度値である9 mg/dと10 g/lifetimeの検証において,9 mg/dは,ECHの長期的(永久)
接触による毒性作用に対して十分に安全である。この限度値は,70 kgの成人がECHの長期的(永久)接
触によって起こる副作用に対して少なくとも100倍の安全マージンを提供する。
H.4.2 非発がん性影響に対する不確実性係数の選択
非発がん性影響に対するTI値に用いた不確実性係数を表H.4に示す。
表H.4−TI値算出のための不確実性係数
不確実性係数の意味
範囲
デフォルト値
説明
UF1:ヒトの個体差
1〜10
10
健康な人の平均の反応と感受性の高い人の一部の反応と
の違いを勘案する。
UF2:種差
1〜10
1
化学物質の毒性影響については,ヒトは実験動物より感受
性が高いことを勘案する。
UF3:実験データの
質と適切性
1〜100
1
TI値算出に使える毒性データの制限を考慮する。NOAEL
値が得られない(長期試験でのNOAEL値がない又は実際
のばく露経路と同様のばく露データがない。)。
H.5 耐容接触限度(TCL)の計算
ECHの刺激性に関するデータは,限られたものしか公表されていない。TCLを計算する必要がある。TCL
から算出した限度値は,表面接触医療機器及び埋植医療機器に適用されることが想定される。
Guess [61] によって行われた実験では,希釈しないECHをウサギの皮膚上に投与したが,意味のある刺
激反応は起きなかった。しかし,ECHの皮内及び筋肉内注射では,注射部位に強い刺激反応が現れた。ECH
希釈液を皮内組織とペニス粘膜に投与した場合は,中程度の反応が見られた。80 %までの希釈率では刺激
反応が見られないことが,何人かの研究者(文献[59],[61],[102]及び[103]参照)によって報告されてい
る。他方彼らは,ECHを平均濃度68 mg/kgでウサギに経皮投与したとき,他の投与経路でのLD50値(表
H.1参照)とほとんど変わらないが,局所刺激影響は,観察されないことを示した。これは,この物質が
きわめて速く吸収され,その後,肝臓で毒性の高い代謝物に直ちに変換されることによるものと示唆され
る。追加の皮内投与試験とDraze眼刺激性試験が同じ研究者によって行われ,未希釈のECHは,高い刺激
性スコアを示した。しかし,5 %及び1 %(v/v)の希釈ECHは,それぞれ,ほとんど及び全く刺激性を示
さなかった。このデータは,ECHが皮内組織と眼球組織には高い刺激性があることを示している。結論と
して,耐容接触限度(TCL)と皮内のTCLのどちらも無刺激量(NIL)又は最小刺激量(MIL)から算出
される。
ECHのTCLは,次のようにして算出される。修飾係数法が,TCLの計算に使用される。この計算方法
では,刺激に対する十分な安全性のマージを得るため不確実性係数(H.4.2参照)も合わせて使用する。
TCL(mg/cm2)の計算式は,次のとおり。
(
)
(
)
A
×
=MFTCLMIL
NIL
TCL
又は
ここに, MFTCL: 修飾係数(UF4×UF5×UF6)
NIL: 無刺激量(mg)
MIL: 最小刺激量(mg)
57
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
A: 人体接触面積(cm2)
TCLを算出するために必要なそれぞれの不確実性係数として下記の数値を選んだ理由付けは,上記のと
おりである。
− UF4 個体差=
10
− UF5 種差=
1
− UF6 データの欠陥=
1
MFTCL=10×1×1=10
Lawrenceら [103] は,表面積3.27 cm2(0.5 in2)当たり最大80 %のECH溶液0.2 mLをウサギへ経皮的に
投与した。これは3.27 cm2当たり160 mgの計算になるが,刺激性は観察されなかった。したがって,無刺
激量(NIL)が観察されたことになる。
NIL=80 %溶液=0.2 mL×80 g/100 mL=160 mg用量
したがって,TCLは次のとおりである。
TCL=160 mg/(10×3.27 cm2)=4.89 mg/cm2
このようにして,TCLは5 mg/cm2と考えられる。
58
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書I
(参考)
EGの許容限度値の設定7)
注7) EOの限度値がこの規格に規定されたレベルに管理されていれば,EGの許容限度値を設ける必
要はないが,完全を期すためにこの附属書を添付した。
I.1
背景
医療機器におけるEGの残留限度値は,EO及びECHの非発がん性の(non-cancer)エンドポイントにつ
いて,先に記述した方法論を用いて決定された。EGは,遺伝毒性物質ではなく(文献[17],[135]及び[136]
参照),動物のバイオアッセイでは,がんを発生させるいかなる可能性も示さず(文献[41]参照),発がん
物質とは考えられていない(文献[135]及び[136]参照)。これらの理由と,EO滅菌される医療機器の製造に
用いられるほとんどの材料でのEOからEGへの変換は,とるに足らないものと考えられることから,EG
の許容値を決定することが必要とは考えられなかった。EGの許容値がEO及びECHのそれより十分に高
く,ほとんどの医療機器材料で到達し得ないことを示すために,この附属書は,EO及びECHで許容値を
決定するために用いたのと同じ方法を用いている。
特定の天然物質(例えば,コラーゲン,綿など)がEOで滅菌される医療機器に組み込まれる場合,比
較的高いレベルのEGが認められる可能性がある。そのような高レベルのEGが認められた場合,製造業
者は,それが患者にハザードを与えないこと,医療機器の性能を損なわないことを立証するよう,強く求
められる。
I.2 一般的考察
I.2.1
概要
急性毒性データ及び反復投与データは,EGは毒性が高くはないものの,経口又は非経口のばく露によ
って全身循環に到達し得ることを示している。半数致死量(LD50)と無毒性量(NOAEL)の調査もまた,
特定の時間間隔,限定的ばく露などでのEGの活性は,経口と非経口経路とで似ていることを示唆してい
る。亜慢性と慢性毒性試験によってもたらされたデータによれば,EGは,ばく露期間の増加につれて毒
性が増すとは思われない。腎臓は,EGの主要な標的臓器である。
I.2.2
一時的接触
24時間未満のばく露においては,医療機器へのばく露によってEGが実質的な健康被害を示すことはな
い。この結論は,幾つかの動物種においてもたらされた急性毒性のデータと,EG又はEGを含んだ製品の
摂取に起因したヒトの中毒に関する文献報告に基づいている(文献[85],[101],[116],[160],[162],[203]
及び[204]参照)。EG摂取によるヒトの死亡に関する報告もまた多数ある。これらのデータに基づけば,ヒ
トにおけるEGの推定致死量は,1.4 ml/kg(文献[160]参照)か,大人で約111 gである。しかし,ヒトに
おけるEG代謝の飽和は,125 mg/kgで起こることが知られており(文献[20]及び[148]参照),安全なレベ
ルを設定するという点でヒトのデータは常により説得力があるので,次に示すとおり一時的接触のための
許容限度値の計算にこの用量が根拠として使用された。
NOAEL=125 mg/kg/d
59
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
不確実性係数(UFs)
− UF1(ヒトでの個人間変動)=10(デフォルト値)
− UF2(種差)=1(ヒトのデータが利用可能)
− UF(3データの質/関連性)=1(関連性のあるデータ)
修飾係数(MF)
− MF=UF1×UF2×UF3=10×1×1=10
− TI=NOAEL/MF=125 mg/kg/d/10=12.5 mg/kg/d
使用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2(デフォルト値)
− PEF=1(一日ばく露)
− UTF=0.2
耐容ばく露量(TE)
− TE=TI×BW×UTF=12.5 mg/kg/d×70 kg×0.2=175 mg/d
許容限度値(AL)
− 便益ファクター(BF)=1(デフォルト値)
− AL=TE×BF=175 mg/d×1=175 mg/dすなわち175 mg/医療機器
この許容限度値の考察によって,医療機器への一時的接触からヒトがこのような多大なEGにさらされ
ることはあり得ないと結論した。
I.2.3
短・中期的接触
EGへの短・中期的接触の限度値は,亜慢性毒性のレビュー及び動物における生殖への影響に関するデ
ータ(催奇形性,優性致死率及び生殖毒性)に基づいている(文献[42],[55],[67],[115],[122],[137],
[149],[150],[152],[153],[164],[185],[203]及び[204]参照)。
157日間までの様々な期間で継続された経口及び非経口の反復投与試験において,EGは,主にしゅう酸
塩への代謝によって種々の毒性作用を発生したが,それは,しゅう酸塩尿,腎障害(ネフローゼ,尿細管
拡張,炎症),尿素窒素とクレアチニンの上昇,腎臓結石,脳内結石,成長抑制(鈍化),肝臓小葉中心の
変性,白血球中の好中球増加,骨髄細胞過多及び異所性造血であった。投与量は,50 mg/kg〜2 200 mg/kg
の範囲かそれ以上であった。生殖試験は,妊娠期間の様々な時期にEGを投与した催奇形性試験を含み,
また,受精能,生殖行動(reproduction performance),奇形遺伝性及び胎じ(仔)の発育に対するEGの影
響及び優性致死効果をもたらすEGの潜在力を評価した一般試験を含んでいた。後者のこれら試験は,多
世代にわたり行われた。
投与量は,40 mg/kg〜5 000 mg/kgの範囲かそれ以上であった。催奇形性試験(全て経口投与で行われた)
では,EGは150 mg/kg以上の投与で,母体毒性,はい(胚)毒性,胎じ(仔)毒性,骨及び血管組織の異
常を生じた。多世代の試験では(やはり経口投与だけで行われた),1 840 mg/kgの投与量[EGが飲料水中
に0.5 %の濃度で与えられた研究によって評価された(文献[97]参照)]は,毒性作用を発生しなかった。
一方,胎じ(仔)毒性[こ(仔)イヌ体重の減少]の兆候,はい(胚)毒性[同腹し(仔)サイズの減少]
及び奇形遺伝性が発生するには,1 000 mg/kg以上の投与が必要であった。
データの調査による,短・中期的接触(すなわち1日〜30日)のEG無影響量は,特定の標的臓器及び
生殖への影響において,ばく露経路によらず近い値であることを示唆した。動物は,生殖による有害な変
化をもたらす作用よりも,一般的な全身毒性に対して幾分感受性が高いものと思われた。次に示す短・中
60
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
期的接触の許容限度値を計算するための根拠として,患者を最大限保護するために,最も低い無影響量
(NOEL)として,イヌの皮下投与毒性試験(文献[203]参照)による50 mg/kgが使用された。
NOAEL=50 mg/kg/d
不確実性係数(UFs)
− UF1(ヒトでの個人間変動)=10(デフォルト値)
− UF2(種差)=5(類似の反応)
− UF3(データの質/関連性)=1(関連性のあるデータ)
修飾係数(MF)
− MF=UF1×UF2×UF3=10×5×1=50
− TI=NOAEL/MF=50 mg/kg/d/50=1.0 mg/kg/d
使用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2(デフォルト値)
− PEF=1(デフォルト値)
− UTF=0.2
耐容ばく露量(TE)
− TE=TI×BW×UTF=1.0 mg/kg/d×70 kg×0.2=14 mg/d
許容限度値(AL)
− 便益ファクター(BF)=1(デフォルト値)
− AL=TE×BF=14 mg/d×1=14 mg/dすなわち420 mg/医療機器
I.2.4
長期的(永久)接触
長期的(永久)接触の限度値は,慢性毒性のレビュー及び発がん性のデータ(文献[24],[25],[41],[116]
及び[129]参照)に基づいた。これらの研究では,ラット,マウス及びサルが2〜3年にわたり食餌でEG
を摂取し,ラットは少なくとも1年間の間,週2回の皮下注射によってEGを投与された。経口投与の研
究において,動物は,腎臓の変化(硬化,石灰化,腎炎,尿細管細胞の過形成),しゅう酸塩の沈澱,尿素
窒素及びクレアチニンの上昇,血液学的指標の減少(ヘマトクリット,ヘモグロビン及び赤血球数),軟組
織のミネラル化(mineralization),副甲状腺の過形成及び肝臓障害(脂肪過多への変化)を呈した。これら
の変化は,皮下投与では報告がなく,腫瘍形成の発生においても,これらの研究では,いかなる増加も認
められなかった。投与量は,8.6 mg/kg〜800 mg/kgの範囲かそれ以上であった。
これらのデータの調査によって,EGの長期的(永久)接触(すなわち30日から生涯)による無影響量
に,幾らか投与経路依存性があることが明らかとなったが,それら無影響量は,亜慢性及び生殖毒性試験
で認められたものに似ている。長期的(永久)接触の許容限度値を計算するための根拠として,患者を最
大限保護するために,最も低い慢性毒性の無影響量として,2年間ラットに食餌として投与した40 mg/kg/d
が,以下に示すとおり使用された。
NOAEL=40 mg/kg/d
不確実性係数[Uncertainty Factors (Ufs)]
− UF1(ヒトでの個体差)=10(デフォルト値)
− UF2(種差)=5(類似の反応)
− UF3(データの質/関連性)=1(関連性のあるデータ)
修飾係数(MF)
61
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− MF=UF1×UF2×UF3=10×5×1=50
− TI=NOAEL/MF=40 mg/kg/d/50=0.8 mg/kg/d
使用係数(UTF)
− UTF=CEF(同時使用係数)×PEF(ばく露均一化係数)
− CEF=0.2(デフォルト値)
− PEF=1(デフォルト値)
− UTF=0.2
耐容ばく露量(TE)
− TE=TI×BW×UTF=0.8 mg/kg/d×70 kg×0.2=11.2 mg/d
許容限度値(AL)
− 便益ファクター(BF)=1
− AL=TE×BF=5.6 mg×1=11.2 mg/dすなわち280 g/医療機器
I.2.5
耐容接触限度(TCL)
局所刺激性の有無には,局所濃度と固有のばく露ルートが重要な役割を果たしているので,EGの一般
的な耐容接触限度値は,設定されていない。EGの局所刺激性は,ISO 10993-4及びISO 10993-10を適用す
ることを推奨する。文献のレビューによって,EGは,全般的に皮膚刺激性が弱いことが示された。10 %EG
での単回ばく露では,ヒトのパッチテストで陰性だった(文献[96]参照)が,一方ほかのヒトにおける研
究では,繰返しばく露でEGは皮膚刺激性が極めて弱いのもであることが示された(文献[168]参照)。急性
の眼刺激性における非刺激濃度は,0.4 %〜5 %の範囲であったが(文献[118],[119]及び[120]参照),眼の
繰返しばく露における無刺激濃度は20 %であった(文献[120]参照)。
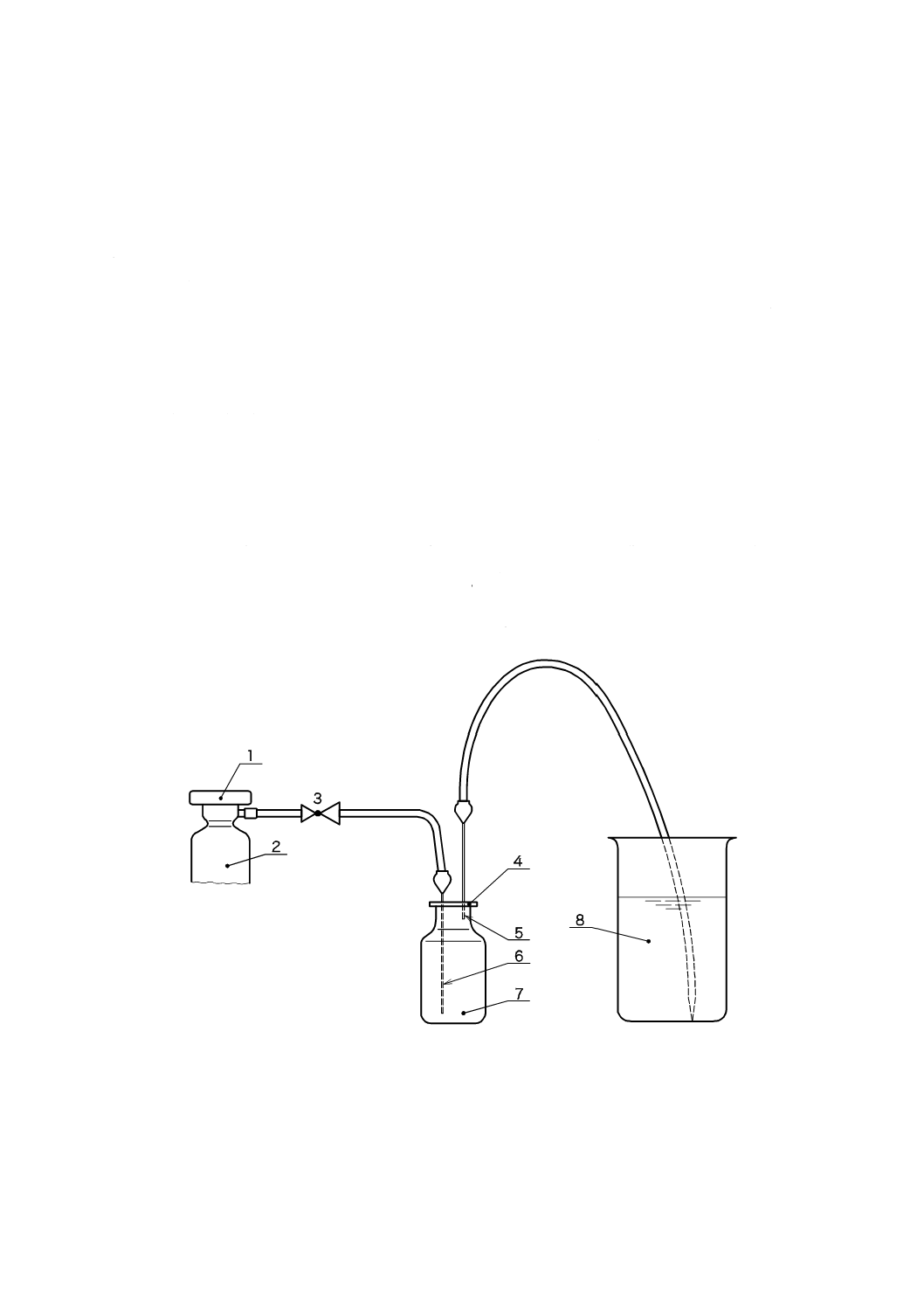
62
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書J
(参考)
EO及びECH標準液の調製
J.1
EO標準液の調製
J.1.1
EOガスの捕集
図J.1に示すように,EO標準ガスボンベを血清バイアル(容量約30 mL)に接続する。皮下注射針をセ
プタムに通し,針の先端をバイアルの上方近くに固定してバイアルを通気する。一定長さの塩化ビニルチ
ューブを導出針2に接続し,水を入れたビーカー内にチューブの端を沈める。
警告 分析者を保護するため,この手順を排気フード(fume cupboard)の下で行うことが極めて重要であ
る(4.4.1.1参照)。
別の一定長さのチューブを,EOガスボンベの制御弁に付けて皮下注射針に接続する。第二の針すなわ
ち導入針1をバイアルのセプタムに通して挿入し,その先端を底部まで押し下げる。通気チューブから泡
が毎秒1個の割合で排出されるように,EOを系内に流し始める。約15分間バイアルから空気を追い出す。
バイアルから注入針を取り除いて,排気チューブから最後の泡がビーカー内に排出されたときに,通気針
をバイアルから取り除くことによってバイアル内のEOガスを大気圧力と平衡させる。理想気体の法則を
近似的に用いると,バイアル内のEO濃度は760 mmHg 8) 及び20 ℃において1.83 μg/μLとみなすことがで
きる。
注8) 1 mmHg=133.322 Pa,又は760 mmHg=101.325 kPa
構成
1
主弁
2
EOガス保存瓶
3
二次圧調整弁
4
PTFEセプタムの付いたクリンプキャップ
5
EO導出針2
6
EO導入針1
7
血清バイアル瓶(30 mL)
8
水の入ったビーカー(300 mL)
図J.1−EO標準液の調製のための装置
63
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
理想気体の法則に従いEO濃度(μg/μL)は,次の式を用いて任意の所定温度T(℃)と圧力p(mmHg)
に対して計算することができる。
(
)
T
p
C
+
=
273
706
.0
EO
ここで0.706は,gK/(mmHg・L)で表したEOの気体定数Rの逆数である。
J.1.2
ヘッドスペース法に用いるEO標準希釈液
あらかじめ0.01 mL単位まで容積を測定し(サンプル分析に使用されるものと同じサイズ),最初に乾燥
窒素で1分間空気を追い出したバイアル(公称15 mL)の中で,J.1.1で得た標準液を希釈する。第一のバ
イアルから約10 μLのEOガスをガスタイトシリンジで取り出す。シリンジをバイアルから外し,針先を
上に向けた状態で必要体積の10 μLまでプランジャーを押す。
窒素で洗浄したバイアルに上向きにシリンジの針を入れ,10 μLのEOをバイアルに注入する。シリンジ
を吸引させずに,直ちにバイアルから外す。このときのバイアルには20 ℃,760 mmHgで18.3 μgのEO
が含まれている。EO濃度を,J.1.1に記載のように大気状態に合わせる。
第二の標準液バイアルからガス100 μLをガスクロマトグラフに注入して,医療機器からの応答を得る。
第一のバイアルからより多量の純粋EOガスを希釈して,より高濃度の標準液を調製する。バイアルには
大量に使用できるEOガスが含まれているため,サンプルに要求されるように標準液を加熱する必要はな
い。
保管標準液は,使用しないとき又は購入した場合には,製品によって明記されている条件で冷蔵保管す
る(附属書F参照)。EO貯蔵の安定性及び有効期限を確認する。検量線用の標準液は,用時調製とする。
使用後は廃棄する。
J.1.3
溶液法に用いるEO標準希釈液9), 10)
安全性及び真度を増すために,濃度が既知で認証されたEO及びECH標準液の市販品を購入することを
推奨する。これが不可能な場合は,保管EO標準液を次に示すように純粋な化合物から調製してもよいこ
ととする。
あらかじめ空気を追い出したメスフラスコを,ドライアイス/イソプロパノール浴又は同等のものの中
に置いた状態で,J.1.1で説明したようにEO標準ガスボンベを設置して,EOガスを凝縮して液体とする。
ガスボンベからEOを供給するポリ塩化ビニルチューブ及び装着した皮下注射針だけが,バイアルに接続
される。EOは,液体として捕集されるため,バイアルを第二の皮下注射針で通気する必要はない。
バイアルに適切な容積の液体EOを充填し,ガスボンベの弁を閉じ,ポリ塩化ビニルチューブに装着し
た皮下注射針を取り外す。氷浴からバイアルを取り出す。
約60 mLの溶媒を入れて密栓した100 mLのメスフラスコ(PTFE-シール弁付)を0.1 mg単位まで量る。
フラスコに液体EOを5滴加え,再度質量を量る。フラスコの100 mLの線まで溶媒を満たし,逆さにして
断続的に振り混ぜる11)。
適切な容量の溶媒で希釈することによって,溶液の希釈液を調製する。例えば,正確に100 mgのEOを
100 mLの溶媒に加えるならば,その結果の濃度は1 mg/mLとなる。この溶液の1 mLを10 mLまで希釈す
るならば,100 μg/mLのEO標準液が得られる。同様な方法で,高濃度又は低濃度EO標準液を調製する。
試験サンプルにおいて,予測されるEOレベルの限界値を定めながら,GC検出を最大にする標準液を調製
する。
各標準液の1 μL〜5 μLをガスクロマトグラフのカラムに注入して,ピーク面積又はピーク高さの応答を
得る。
64
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
保管標準液は,使用しないとき又は購入した場合には,製造業者が規定する条件で冷蔵保管する(附属
書F参照)。検量線用の標準液は,用時調製とする。使用後は廃棄する。
注9) あらかじめシリンジを冷却すれば,液体EOの移動を容易にする。シリンジの針が溶媒に接触
しないように注意する。
10) 保管標準液の調製に関連する測定誤差が,調製する容積とは関係なく一定であることは経験か
ら分かっている。大量に調製してから必要に応じて使用すれば,誤差(%)は低減する。
11) 一時的にメスフラスコに保存する必要が生じた場合,メスフラスコに入れた標準液は,逆さま
にして保管したときが最も安定であることが知られている。
実際のガスクロマトグラフ分析においては,サンプルをGCカラムに注入するときの注入精度が,注入
量を増やすに従って向上することは経験から分かっている。シリンジ目盛の不確さに関連した一定誤差は,
吸引量が増加するに従い,吸引量に占める割合は小さくなる。精度を高めるために,吸引量がシリンジ容
量の10 %未満になるシリンジを選択してはならない。
実際の注入量を増加することによって注入精度を高めようとするときには,ガスクロマトグラフのカラ
ムへの過負荷に注意しなければならない。最近のオートサンプラー法では,注入量の真度及び精度の結果
は気にしなくてもよい。
J.2
ECH標準液の調製
約60 mLの水を入れた100 mLのメスフラスコを,0.1 mg単位まで正確に量る。ECH(約100 mg)をフ
ラスコに滴下して加える。再びフラスコの質量を量り,二つの質量間の差を計算してから水で一定容量ま
で希釈し,振り混ぜる。保管用標準溶液は,使用しない場合,冷蔵保管する(附属書F参照)。ECH貯蔵
中の安定性及び有効期限を確認する。検量線用の標準液は,用時調製とし,使用後は廃棄する。
ECH標準液を室温と平衡させる。3濃度以上の検量線用標準液を調製する。検量線として使用する前に,
これら濃度範囲においてGC応答の直線性を試験する。試験サンプルにおいて予想されるECHレベルの限
界値を定めながら,GC検出を最大にする標準液を調製する。各標準液の1 μL〜5 μLをガスクロマトグラ
フのカラムに注入して,ピーク面積又はピーク高さの応答を得る。
注記 この手順は,EG標準液の調製にも使用することができる。
65
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書K
(参考)
エチレンオキサイド残留物の測定方法
注記 この附属書で詳細に記述した試験方法は,ISO 10993-7第1版(1995)制定時に主に日米両国
で用いられていた方法についてのものであって,他の試験に同様の試験条件を強制するもので
はない。個々の試験方法は,附属書A及び附属書Bに従ってその妥当性を検証するものとする。
K.1 試験法の施設間評価
K.1.1 EO測定法
分析値が約40 ppm〜約350 ppmの範囲の試料に対し,幾つかのEO測定法(文献[112],[113]及び[114]
参照)を用いて,13の施設における施設間評価を行った。これらの方法で求めた全体変動係数を,表K.1
に示す。
表K.1−施設内及び施設間の変動の比較
単位 %
EO測定法
施設内
施設間
ヘッドスペース法
3.7
21.3
アセトン法
4.1
16.3
DMF法
2.9
8.3
水抽出法
2.7
17.0
別の施設間評価を行った。これは,それぞれの施設において,同じ試験方法(文献[89]参照)で行うも
のである。分析値が3.6 ppm〜26 ppmの範囲に分布した一連の試料に対して,二つの施設で得た結果を比
較することによって,線形回帰データを得た。
計算された回帰方程式は,y=0.04+0.904 x,相関係数r=0.974(p<0.000 01)であった。この方法の施
設内変動係数は,EO濃度が14 ppmのときで4.0 %,EO濃度が30 ppmのときで8.3 %と推定した
(A.Nakamura,H.Kikuchi及びK.Tsuji,未発表データ)。
EOレベルの異なる三つの試料に対し,溶媒抽出後ヘッドスペースガスの分析方法(文献[136]参照)と
臭素化法(文献[89]参照)との両方法にて,二つの施設で実施した。
その結果を直線回帰分析を用いて比較し,y=−0.03+1.07x,相関係数r=0.999の回帰データを得た。
K.4.4の手順における施設間変動係数は,試験検体中のEO濃度が12 ppm,25 ppm,56 ppmのときに,そ
れぞれ4.7 %,1.8 %及び2.7 %と推定した(文献[132]参照)。
K.1.2 ECH測定法
施設間評価は,ECHに対しても実施した(文献[14]参照)。この方法の総変動係数は,次のように求めた。
− 施設内
7.46 %
− 施設間
10.99 %
これらのデータは,約3.0 ppm〜100 ppmのECH濃度に対してのものである。
K.2 装置及び試薬
K.2.1 装置
66
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
K.2.1.1 ガスクロマトグラフ 水素炎イオン化検出器(FID)又は電子捕獲検出器(ECD),及びチャート
レコーダーを装備したガスクロマトグラフ。
注記1 電子捕獲検出器では,はじめに臭化水素で誘導体化しない限りEOを検出できない。
注記2 インテグレーター(電子積算計)は,再現性のある結果を得るのに有用である。
K.2.1.2 皮下注射針及びポリ塩化ビニルチューブ 標準液の調製に必要なもの。
K.2.1.3 目盛付きガラス容器 PTFEの付いたセプタム又はPTFEでシールされた弁のあるもの。
抽出液又は標準液のヘッドスペースを最小にするために,適切な容量のガラス器具を選定するよう注意
する。標準液又は抽出液を調製する際,ヘッドスペース容量は,標準液又は抽出液の容積の10 %を超えな
いことが望ましい。
K.2.1.4 マイクロシリンジ(5 μL又は10 μL容量) 抽出液をガスクロマトグラフに注入する。
K.2.1.5 フュームフード 標準液及び試料の調製をする間に十分な換気ができるもの。
K.2.1.6 化学天びん(秤) 0.1 mgまで測定可能なもの。
K.2.1.7 ガス制御弁 EOが入っている保存容器のガス制御弁。
K.2.1.8 ガスタイトシリンジ 標準液の調製,及びガスクロマトグラフのカラムにヘッドスペースガスを
注入するための容量5 μL,10 μL,100 μL及び1 000 μLのガスタイトシリンジ。
K.2.1.9 実験室用オーブン 試料を100±2 ℃に加熱可能なもの。
K.2.1.10 実験室用オーブン 試料を37±1 ℃に加熱可能なもの。
K.2.1.11 水浴 試料を70±2 ℃で保持できる水浴。
K.2.1.12 機械式振とう(盪)器
K.2.1.13 PTFEの付いたセプタム付ガラス製ヘッドスペースボトル 校正用標準液調製のための20 mL容
量ガラス製ヘッドスペースボトル。
K.2.1.14 平底ねじ口バイアル PTFEの付いたシリコンセプタム及び薄いPTFEフィルムを備えた,試料
及び抽出流体に適合するサイズ。EOの抽出,及びブロモヒドリンとEOを反応させるときに使用される。
K.2.1.15 注入針 寸法0.65 mm×25 mmの臭化水素の添加用注入針。
K.2.1.16 ミリポアフィルタ 孔径0.45 μm,クロマトグラフ分析前に反応混合物をろ過するために使用。
K.2.1.17 冷蔵庫 試料を2 ℃〜8 ℃に保持できる冷蔵庫。
K.2.2 試薬
K.2.2.1 1, 2-エポキシエタン(EO) 適切なガスボンベに入ったもの,純度99.7 %。
K.2.2.2 2-クロロエタノール(ECH) 純度99 %以上のもの。
K.2.2.3 1, 2-エポキシプロパン(プロピレンオキサイド) 試薬用。
K.2.2.4 新たに2回蒸留した臭化水素 次のように調製されたもの。
100 mgの塩化すず(II)の存在下で47 %臭化水素100 mLを蒸留する。初留分25 mLを捨て,本留分50
mLを回収する。50 mgの塩化すず(II)の存在下で留出物50 mLを再蒸留し,初留分15 mLを捨て,無色
の液体(沸点125 ℃〜126 ℃)の本留分20 mLを回収する。ガラス栓の付いたガラス容器に保存し,1週
間以内に使用する。
K.2.2.5 塩化すず(II) 塩化第一すず,試薬グレード。
K.2.2.6 水 ガスクロマトグラフ分析に適した純度のもの。
K.2.2.7 エタノール ガスクロマトグラフ分析に適した純度のもの。
K.2.2.8 2-プロパノン(アセトン) ガスクロマトグラフ分析に適した純度のもの。
K.2.2.9 N, N-ジメチルホルムアミド(DMF) ガスクロマトグラフ分析に適した純度のもの。
67
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
K.3 標準液の調製
K.3.1 EO標準液の調製
必要であれば,J.1に記載しているとおりに,適切な標準液を調製する。
K.3.2 ECH標準液の調製
必要であれば,J.2に記載しているとおりに,ECH標準液を調製する。
K.3.3 プロピレンオキサイド(PO)標準液の調製
プロピレンオキサイド(以下,POという。)濃度が,0.5 μg/mLとなるようにPOをエタノールで希釈し,
PO標準液を調製する。
K.4 製品の抽出
K.4.1 一般
4.4に記載した原則に従って,抽出液を調製する。
K.4.2 模擬使用抽出
製品使用の模擬実験には,水を用いる。意図する使用方法の中で最大負荷となるような条件で模擬使用
抽出を行う。
例えば,血液接触及び非経口医療機器は水で完全に充填するか,若しくは血液又は流体の経路を流すこ
とによって抽出を行う(いずれか適切な方)。
注記 完全充填を行う場合は,空間部がないことを確認する。
患者と接触する医療機器構成部材に充填不可能な場合は,医療機器全体又は医療機器の重要かつ代表的
な部分を,適切な容器に入れ,適切な試料/抽出液比になる量の水を加える。(注意 大形医療機器の小
さな試料から得られたデータの信頼性を確認するために,その医療機器の幾つかの代表的な部分を取る。)
一回の使用時間に相当又はそれを超える時間で,かつ,4.4.6.2に規定しているような使用状況を模した
最大の温度で試料を抽出する。代替方法として,一回の使用時間よりも短いが,異なる抽出時間で一連の
抽出液(最低3ポイントを推奨)を調製し,これらの抽出液中の濃度から,より長時間のばく露又は毎日
の反復ばく露の効果を計算する。
分析が直ちに行われない場合,試料抽出液をPTFEで裏打ちされたセプタムの付いたバイアルに静かに
注ぎ,密閉する。標準液及び抽出液のいずれのバイアルも,ヘッドスペースが総容積の10 %未満でなけれ
ばならない。抽出液は5±3 ℃の冷蔵庫で保管することができる。分析者は有効期間及び保管期限を規定
することが望ましい。EO分析に水抽出物を使用する際は,水抽出液の保管中にEOがEG又はECHに変
化することに注意する(文献[35]参照)。
K.4.3 加熱抽出を用いた徹底抽出手順
1 gの試料を0.1 mg単位まで量り,セプタム付きの蓋があるバイアルに入れ,適切な温度で適切な時間
オーブンで加熱する。時間及び温度管理は,必要に応じて変える。ヘッドスペース中のEO分圧が平衡に
達するよう,抽出時間を変える。
バイアルをオーブンから取り出す。ヘッドスペースガスの100 μLをガスクロマトグラフのカラムに2
回注入し,それぞれのEOピークの高さ又は面積を測定する。2回測定の平均値を計算する。
注記 注入時にカラムパッキンが,針で取られないように注意する。オーブンから取り出された直後
の高温試料を試験することは,バイアルから試料を取り出した際,シリンジ内圧力と室内圧力
とが平衡になるときに,シリンジ内から物質が失われるため,多くの場合で20 %以上の誤差が
68
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
生じることが経験から示されている。ある物質は温度が室温と平衡になるとEOを再吸収する。
また,ある物質は,冷却させるとバイアル中でEOを完全に再吸収する可能性がある。これら
の物質を分析する際には,試料及び標準液が高温又は温かいうちに,カラムに注入し,それ以
上冷却させることなくパージする(上記のとおり)ことが必要である。
自動ヘッドスペース分析機は,市販されている。しかし,操作は手動で行ってもよい。
フード下でバイアルから蓋を外し,乾燥窒素で30秒間バイアルをパージする。新しいセプタムの付いた
蓋に交換し,抽出できなくなるまで加熱,注入を繰り返す。徹底抽出は,EO量が最初の抽出の10 %未満
になるか,検出された残留レベルの積算値に有為な増加がないときに達成される。検量線より各加熱ごと
のピーク面積又はピーク高さの平均値からEO値を得,それを合計することで,サンプル中のEO量を計
算する。
K.4.4 エタノールによる徹底抽出及びエタノール抽出液のヘッドスペースガス分析
K.4.4.1 検量用標準液
EOをエタノールで希釈し,0.4 μg/mL,0.8 μg/mL,1.2 μg/mL,1.6 μg/mL及び2.0 μg/mL濃度のEO溶液
を調製する。K.3.3に記載したように,0.5 μg/mLの濃度でエタノール中にPOを含む標準液を調製する。
ドライアイス/イソプロパノール浴中,又はそれと同等なもので,これらの標準液及び必要な数の専用ヘ
ッドスペースボトル(図K.1参照)を冷却する。適切な量の各EO標準液と,それと同容量のPO標準液
とを,ヘッドスペースボトルに移す。ヘッドスペースボトルを70 ℃で30分間加熱し,各ボトルのヘッド
スペースガスの100 μL〜1 mLを2回,ガスクロマトグラフのカラムに注入する。EOとPOのそれぞれの
ピーク高さ又はピーク面積を測定し,EO濃度(Y軸)に対して,ピーク高さ又はピーク面積の比(X軸)
をプロットし,検量線を得る。
EO標準液へのPOの添加は,EO標準液の調製における真度を評価するために内部標準物質として用い
られる。標準液の目標となるEO濃度に対するEO/PO比のプロットは,理想的にはy=0.5x+0の一次方
程式で,かつ,線形相関係数rが1 000という結果になると考えられる。これらのパラメータは,傾きが
0.5でy切片がゼロの完全な一直線の検量線であることを示している。相関係数は0.999かそれ以上を示す
標準液を用いるべきである。y切片がゼロで傾きが0.5以上の場合は,全てのEO標準液が目標となる濃度
よりも低いことを示す。y切片がゼロで傾きが0.5未満の場合は,全てのEO標準液が目標よりも高いこと
を示す。特に試料中のEO濃度が低いものにおいて,y切片がゼロよりも大きい検量線では実際の濃度よ
りも高い結果に,y切片がゼロよりも小さい検量線では実際の濃度よりも低い結果となることに注意する。
不精確さの度合いはy切片のゼロからの距離による。最後に,POピーク高さ又はピーク面積は,それ自
体は比較的一定であることが望ましい。POピーク高さ又はピーク面積における変動は,GCへの試料導入
量のばらつきを示している。しかし,現在のGC技術の水準では,問題にならないと考えられる。
K.4.4.2 分析手順
細断(チューブは5 mm長,シートは10 mm四方)した試料5 g(又は0.5 g)を0.1 mgの単位まで量り,
100 mL(又は10 mL)容量のヘッドスペースボトルに入れる。50 mL(又は5 mL)のPO標準液(0.25 μg/mL)
をボトルに加える。ボトルに蓋をかぶせて圧着し,密封したボトルを緩やかに振とう(盪)しながら70 ℃
で3時間加熱する。ガスクロマトグラフのカラムにヘッドスペースのガスの100 μL〜1 mLを2回注入し,
EO/POのピーク比を測定する。K.4.4.1に記載した検量線からそれぞれの試料に対するEO含有量を得て,
それらの平均を計算する。
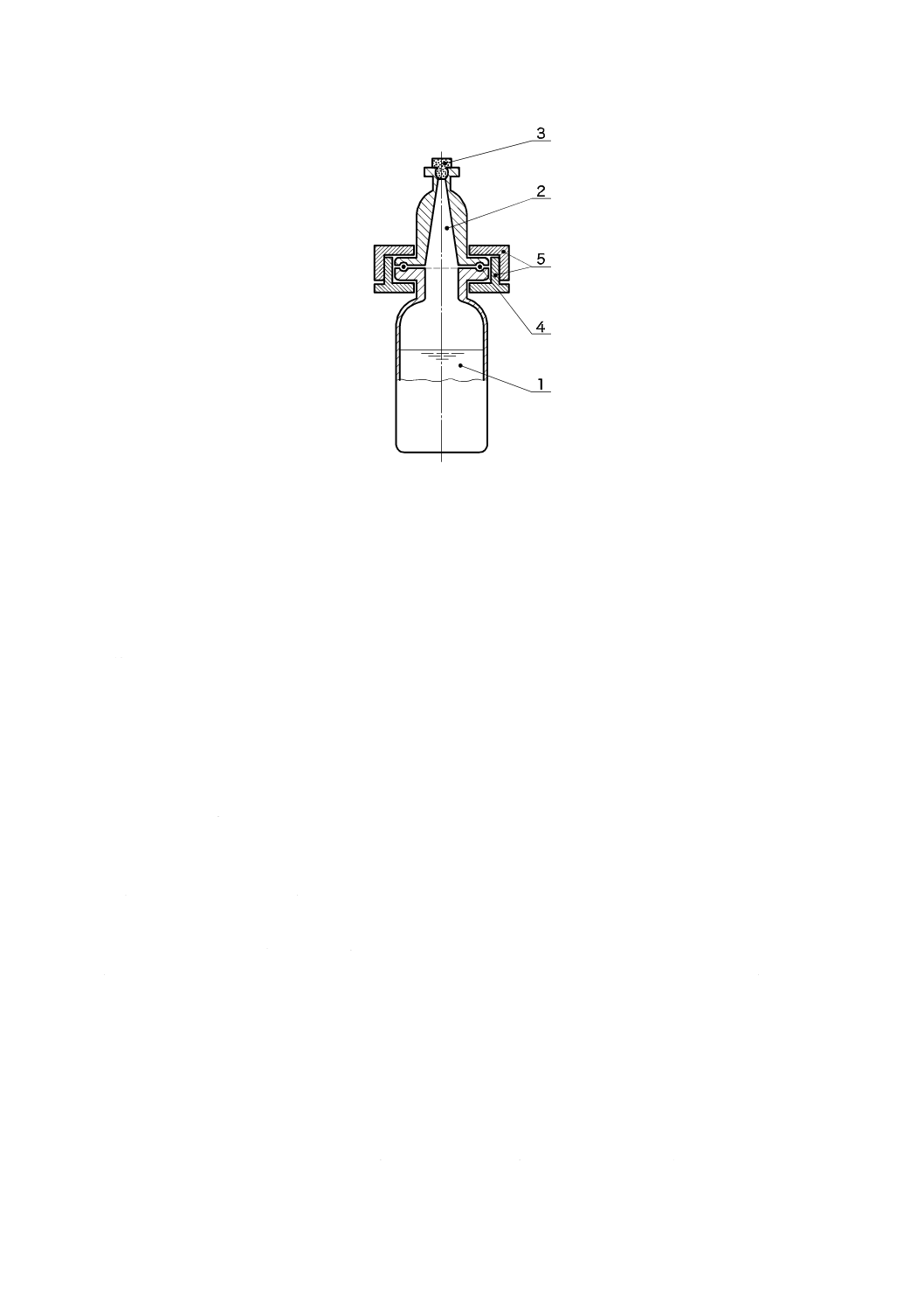
69
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
液体
2
ヘッドスペース
3
セプタム
4
Oリング
5
クランプ
図K.1−専用ヘッドスペースボトル
K.4.5 溶媒による徹底抽出
約1 gの製品試料を正確に量りとり,ヘッドスペースが最小になるような適切な容量の蓋付き定量ガラ
ス器具に入れる。選択された溶媒10 mLを,ピペットで定量ガラス器具に入れる。定量ガラス器具に蓋を
し,25±2 ℃で24時間放置する。
これらの温度及び時間は,Marlowe [112], [113], [114]によって報告された研究で用いられたものである。徹底
抽出(K.4.3参照)のためには,異なる温度と時間での検証を行った上で試験することが,必要になる場
合がある。
ガスクロマトグラフのカラムに1 μL〜5 μLを2回注入する。検量線を参照に試料中のEO量を求め,そ
れらの平均値を計算する。
K.4.6 エタノールによる徹底抽出及びブロモヒドリン誘導体の調製,並びにECDを装備したガスクロマ
トグラフを用いたクロマトグラフ分析法
K.4.6.1 検量用標準液
EOをエタノールで希釈し,0.4 μg/mL,0.8 μg/mL,1.2 μg/mL,1.6 μg/mL及び2.0 μg/mLの濃度でEOを
含むEO溶液を調製する。K.3.3に記載したように,0.5 μg/mLの濃度でエタノール中にPOを含む標準液
を調製する。EO及びPOの標準液をそれぞれ同量ずつ混ぜ合わせ,標準液の混合物を調製する。このプロ
ットは,K.4.4.1で記載したようにEO/PO比に対するEO標準液濃度のプロットと同様の理由のために行
われる。
ねじ口バイアルに標準液の混合物を1 mL移す。臭化水素2滴(約0.015 g)を注入針でセプタムを通し
て混合物に加える。バイアルを立てて室温にて1時間放置する。緩やかに振とうしながら50 ℃の水浴で1
時間加熱し,その後室温まで冷却する。
重炭酸ナトリウム0.02 gをバイアルに加え,バイアルを縦方向に30分間振り混ぜる。バイアルを立てて
70
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
10分間放置する。再び水平に30分間振り混ぜる。バイアルを立てて10分間放置し,3 000 rpm(50s−1)
で5分間遠心分離する。混合物を小さなミリポアフィルタを通して,ろ過する12)。
注12) 底面がU形又はV形のバイアルを用いると中和が不十分になり,よいクロマトグラムが得られ
ないことがある。
各ろ液の1 μL〜5 μLを2回ガスクロマトグラフのカラムに注入して,エチレンブロモヒドリン(EBH)
とプロピレンブロモヒドリン(PBH)のピークの高さ比に対するレスポンスを得る。EBH/PBHのピーク
高さ比に対する,EO含有量をプロットし,検量線を作成する。これは,EO及びPOのピークに対してK.4.4.1
で記載した方法と類似の方法で行われている。
K.4.6.2 分析手順
K.4.4.1に従って調製された標準液に対してこの方法を使用する。
PO標準液(0.25 μg/mL)及びねじ口バイアルを,ドライアイス/イソプロパノール浴,又はそれと同等
のものに入れ冷却する。バイアルにPO標準液1 mLを加える。
サンプルの一部分10 mg〜30 mgを0.1 mgの単位まで量り,バイアルに入れる。
臭化水素2滴(約0.015 g)を,注入針でセプタムを通してバイアルに入れる。バイアルを立てて室温に
て1時間放置し,その後,バイアルを緩やかに振とうしながら50 ℃の水浴で8時間加熱する。実験室用
オーブンで更に16時間50 ℃で加熱し,その後室温まで冷却する。
重炭酸ナトリウム0.02 gをバイアルに加え,バイアルを縦方向に30分間振り混ぜる。バイアルを立てて
10分間放置する。再び水平に30分間振り混ぜる。バイアルを立てて10分間放置し,3 000 rpm,5分で遠
心分離機にかける。小さなミリポアフィルタを通して,ろ過する12)。
各ろ液の1 μL〜5 μLを2回ガスクロマトグラフのカラムに注入して,エチレンブロモヒドリン(EBH)
及びプロピレンブロモヒドリン(PBH)のピークの高さ比を得る。
それぞれの試料の平均値を計算し,K.4.4.1で述べた検量線を参照して試料中のEO量を決定する。
医療機器材料が,臭化物イオン(例えば,ブチル化ゴム)を含んでいると,塩化物イオンの存在による
ECH生成と同様,EOの分解産物としてEBHが生成することがある。したがって,ブロモヒドリン誘導体
調製の前に,試料の一部を,滅菌残留物としてのEBHの存在を分析することが望ましい。
K.4.7 水を用いたECHの模擬使用抽出
K.4.2に記載した手順を用いる。
K.4.8 水を用いたECHの徹底抽出
約1 g〜50 gの試料の一部(又は全試料)を正確に量りとり,ヘッドスペース容量が最小限になるような
適切な容量の蓋付きガラス容器に入れる。容器が確実に満たされるよう,試料を覆うのに十分な水を加え,
蓋をする。25±2 ℃で24時間立てて放置する。容器と内容物を振とう装置で約10分間激しくかくはん(撹
拌)する13)。
1 μL〜5 μLを2回ガスクロマトグラフのカラムに注入する。あらかじめ作成された標準応答曲線を参照
に相対ピーク面積,又はピーク高さのいずれかから,試料中のECH濃度を計算する。
注13) これらの温度及び時間は,レフリー評価(AAMI,1989[14])で用いられたものである。徹底抽
出を実現するには,その他の適切な温度及び時間が要求される場合がある(K.4.3参照)。必要
に応じて,抽出中の全時間をかくはんする方が適切な場合がある。かくはんを必要としない材
料の場合もある。
71
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
K.5 ガスクロマトグラフ分析法
K.5.1 一般
最も適切な方法及び手順を,選定する。附属書Aに規定した要求事項を満たす適切なクロマトグラフ法
を用いる。
条件の最適化が要求される。
注記 測定の精度を改善するため,かつ,注入に伴う問題を検知するために,多くのクロマトグラフ
担当者は内部標準物質を用いる。
K.5.2 EO又はECH測定のための模擬使用抽出
K.4.2又はK.4.7における水抽出物の1 μL〜5 μLを注入する。
K.5.3 加熱抽出を用いた徹底的な手順
ヘッドスペースガスの100 μL〜1 mLを注入する。
K.5.4 エタノールによる徹底抽出及びエタノール抽出液のヘッドスペース分析
K.4.4における水抽出物の100 μL〜1 mLを注入する。
K.5.5 エタノールによる徹底抽出及びブロモヒドリン誘導体の調製,並びにECDを装備したガスクロマ
トグラフを用いたクロマトグラフ分析法
K.4.6における水抽出物の1 μL〜5 μLを注入する。
72
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書L
(参考)
参考文献
[1]
JIS T 0801-1:2010 ヘルスケア製品の滅菌−エチレンオキサイド−第1部:医療機器の滅菌プロセ
スの開発,バリデーション及び日常管理の要求事項
注記 対応国際規格:ISO 11135-1:2007,Sterilization of health care products−Ethylene oxide−Part 1:
Requirements for development, validation and routine control of a sterilization process for medical
devices(IDT)
[2]
AAMI EO-VRSU 3/81; superseded by AAMI GVR-1987, Good hospital practice: Ethylene oxide gas−
Ventilation recommendations and safe use, Arlington, VA, 1981
[3]
ABDEL-RAHMAN, M.S. and KADRY, A.M. Studies on the use of uncertainty factors in deriving RfDs, Hum.
Ecolog. Risk Assess., 1, pp. 614-624, 1995
[4]
ABDEL-RAHMAN, S.Z., EL-ZEIN, R.A., AMMENHEUSE, M.M., YANG, Z., STOCK, T.H., MORANDI, M. and
WARD, J.B. Jr. Variability in human sensitivity to 1,3-butadiene: Influence of the allelic variants of the
microsomal epoxide hydrolase gene, Environ. Mol. Mutagen., 41(2), pp. 140-6
[5]
ABRAHAMS, R.H. Recent studies with workers exposed to ethylene oxide, in: Jorkasky J.F., ed., Safe use of
ethylene oxide, Proceedings of the Educational Seminar, Washington DC, Health Industries Manufacturers
Association, 27-38, pp. 211-220, HIMA Report No. 80-4, 1980
[6]
ADAMS, C.H., WERELY, C.J., VICTOR, T.C., HOAL, E.G., ROSSOUW, G., VAN HELDEN, P.D. Allele frequencies
for glutathione S-transferase and N-acetyltransferase 2 differ in African population groups and may be
associated with oesophageal cancer or tuberculosis incidence, Clin. Chem. Lab. Med. 41(4), pp. 600-605,
2003
[7]
ADLER, N. Residual ethylene oxide and ethylene glycol in ethylene oxide sterilized pharmaceuticals, J. Pharm.
Sci. 1965; 54(5), pp. 735-742
[8]
ALLEVA, F. (Cited in BALAZS[18], 1976)
[9]
ALOMAR, A., CAMARASA, J.M. and NOGUERA, J.E.A. Ethylene oxide dermatitis, Contact Dermatitis, 7, pp.
205-207, 1981
[10]
AMBROSE, A. Toxicological studies of compounds investigated for use as inhibitors of biological processes. II
Toxicity of ethylene chlorohydrin. Arch. Ind. Hyg. Occup. Med. 1950; 2:582-597
[11]
ANAND, V.P., COGDILL, C.P., KLAUSNER, K.A., LISTER, L., BARBOLT, T., PAGE, B.F.J., URBANSKI, P., WOSS
CASIMIR, J., BOYCE, J. Reevaluation of ethylene oxide hemolysis and irritation potential, J. Biomed. Mater.
Res. 64A, pp. 648-654, 2003
[12]
ANDERSEN, S. Ethylene oxide toxicity, J. Lab. Clin. Med., 77(2), pp. 346-356, 1971
[13]
AAMI ST29-1988, Recommended practice for determining residual ethylene oxide in medical devices,
Association for the Advancement of Medical Instrumentation, American National Standard. Arlington, VA,
AAMI, 1988
[14]
AAMI ST30-1989, Determining residual ethylene chlorohydrin and ethylene glycol in medical devices,
Association for the Advancement of Medical Instrumentation, American National Standard. Arlington, VA,
73
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
AAMI, 1989
[15]
ASTM E691-05, Standard practice for conducting an interlaboratory study to determine the precision of a
test method
[16]
ATSDR Tp-90-16:1990, Toxicological profile for ethylene oxide. Atlanta, GA, US Department of Health and
Human Services, Public Health Service
[17]
ATSDR (1997), Toxicological profile for ethylene glycol and propylene glycol, Atlanta, GA
[18]
BALAZS, T. Toxicity of ethylene oxide and chloroethanol, FDA By-lines No. 3, pp. 150-155, 1976
[19]
BALL, N.A. Determination of ethylene chlorohydrin and ethylene glycol in aqueous solutions and ethylene
oxide in associated plastics, J. Pharm. Sci., 73(9), pp. 1305-1307, 1984
[20]
BARTELS, M.J. Comparison of in vitro metabolism of ethylene glycol in rat and human liver S-9 homogenate,
Midland MI, R&D Report of the Dow Chemical Company, 2001
[21]
BASKETTER, D.A., GRIFFITHS, H.A., WANG, X.M., WILHELM, K.P. and MCFADDEN, J. Individual, ethnic and
seasonal variability in irritant susceptibility of the skin: the implications for a predictive human patch test,
Contact Dermatitis, 35(4), pp. 208-213, 1996
[22]
Beliles, R.P., Parker, J.C. Risk assessment and oncodynamics of ethylene oxide as related to occupational
exposure, Toxicol Ind Health 3(3), pp. 371-82, 1987
[23]
BJORGE, C., BRUNBORG, G., WIGER, R., HOLME, J.A., SCHOLZ, T., DYBING, E. and SODERLUND, E.J. A
comparative study of chemically induced DNA damage in isolated human and rat testicular cells, Reprod
Toxicol. 10(6), pp. 509-519, 1996
[24]
BLOOD, F. Chronic toxicity of ethylene glycol in the rat, Fd. Cosmet. Tox., 3, pp. 229-234, 1965
[25]
BLOOD, F., ELLIOTT, G. and WRIGHT, M. Chronic toxicity of ethylene glycol in the monkey, Tox. Appl. Pharm.
4, pp. 489-491, 1962
[26]
BOMMER, J. and RITZ, E. Ethylene oxide as a major cause of anaphylactoid reactions in dialysis (a review).
Artif. Organs, 11, pp. 111-117, 1987
[27]
BOUSQUET, J. and MICHEL, F.B. Allergy to formaldehyde and ethylene-oxide, Clin. Rev. Allergy 9, pp.
357-370, 1991
[28]
BROBST, K.M. and HAN, T. Determination of chlorohydrins in hydroxypropyl starch ethers, J. Assoc. Off.
Anal. Chem., 54(5), pp. 1093-1094, 1971
[29]
BROWN, D.J. Determination of ethylene oxide and ethylene chlorohydrin in plastic and rubber surgical
equipment sterilized with ethylene oxide, J. Assoc. Off. Anal. Chem., 53(2), pp. 263-267, 1970
[30]
BRUCH, C.W. Industrial Sterilization, eds. Phillips, G.B., Miller, W.S., Duke University Press, Durham, NC,
pp. 49-77, 1973
[31]
BUA, Ethylene oxide, German Chemical Society (GDCh) Advisory Committee on Existing Chemicals of
Environmental Relevance (Beratergremium für Umweltrelevante Altstoffe). Stuttgart, Hirzel Verlag (BUA
Report 141), 1995
[32]
BUEHLER, B.A., RAO, V., FINNELL, R.H. Biochemical and molecular teratology of fetal hydantoin syndrome,
Neurol Clin., 12(4), pp. 741-748, 1994
[33]
CARPENTER, C., SMYTH, H. and POZZANI, U. The assay of acute vapor toxicity, and the grading and
interpretation of results on 96 chemical compounds, J. Ind. Hyg. Toxicol. 31, pp. 343-349, 1949 (cited in
EPA, 1985)
74
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[34]
Center for Drug Evaluation and Research (CDER), Review Guidance, Validation of Chromatographic
Methods, November 1994
[35]
CHESLER, S.N., REBBERT, R.E. and ENAGONIO, D.P. Evaluation of AAMI EO residues recommended practice
and a determination of EO kinetics in water, National Bureau of Standards, Department of Commerce,
Washington, DC, October 1985
[36]
CHOI, S. and KIM, S. Lipopolysaccharide inhibition of rat hepatic microsomal epoxide hydrolase and
glutathione S-transferase gene expression irrespective of nuclear factor-kappaB activation, Biochem.
Pharmacol., 56(11), pp. 1427-1436, 1988
[37]
CONINE, D., NAUMANN, B. and HECKER, L. Setting health-based residue limits for contaminants in
pharmaceuticals and medical devices, Quality Assurance: Good Practice, Regulation, and Law, 1, pp.
171-180, 1992
[38]
COURTNEY, K., ANDREWS, J. and GRADY, M. Teratogenic evaluation of ethylene chlorohydrin (Ech,
2-chloroethanol) in mice, J. Environ. Sci. Health, B17(4), pp. 381-391, 1982
[39]
CYR, W.H., GLASER, Z.R. and JACOBS, M.E. CDRH risk assessment of EO residues on sterilized medical
devices, in: Jorkasky, J.; ed. Sterilization in the 1990s (Health Industry Manufacturers Association Report No.
HIMA 89-1). Washington, DC: HIMA, pp. 269-285, 1989
[40]
DANIELSON, J.W., SNELL, R.P. and OXBORROW, G.S. Detection and quantitation of ethylene oxide,
2-chloroethanol, and ethylene glycol with capillary gas chromatography, J. Chromatogr., 28, pp. 97-101,
1990
[41]
DEPASS, L., GARMAN, R., WOODSIDE, M., GIDDENS, W., MARONPOT, R. and WEIL, C. Chronic toxicity and
carcinogenicity studies of ethylene glycol in rats and mice, Fund. Appl. Tox., 7, pp. 547-565, 1986
[42]
DEPASS, L., WOODSIDE, M., MARONPOT, R. and WEIL, C. (1986b) Three-generation reproduction
anddominant lethal mutagenesis studies of ethylene glycol in the rat, Fund. Appl. Tox., 7, pp. 566-572, 1986
[43]
DUNKELBERG, H. Carcinogenicity of ethylene oxide and 1,2-propylene oxide upon intragastric administration
to rats, Br. J. Cancer, 46, pp. 924-933, 1982
[44]
EDELHAUSER, H., ANTOINE, M., PEDERSON, H., HIDDEMAN, J. and Harris, R. Intraocular safety evaluation of
ethylene oxide and sterilant residues, J. Toxicol. Cut. Ocular Toxicol., 2, pp. 7-39, 1983
[45]
EHRENBERG, L., TORNQVIST, M. The research background for risk assessment of ethylene oxide: aspects of
dose, Mutat. Res., 330(1-2), pp. 41-54, 1995
[46] Ethylene Oxide Residues on Sterilized Medical Devices, Environ Corporation,Washington, DC, 1987 (also in:
Health Industry Manufacturers Association, HIMA Report 88-6. Washington, DC, 1988)
[47]
ETTRE, LS. and JONES, E. Quantitative analysis with headspace gas chromatography using multiple
headspace extraction, Chromatography Newsletter, 12(1), July 1984
[48]
EVANS, A.J., HENNER, W.D., EILERS, K.M., MONTALTO, M.A., WERSINGER, E.M., ANDERSEN, P.E., COHEN,
J.I., EVERTS, E.C., MCWILLIAMS, J.E. and BEER, T.M. Polymorphisms of GSTT1 and related genes in head
and neck cancer risk. Head Neck, 26(1), pp. 63-70, 2004
[49]
FALZON, M., MILTON, A.S., BURKE, M.D. Are the decreases in hepatic cytochrome P-450 and other
drug-metabolising enzymes caused by indomethacin in vivo mediated by intestinal bacterial endotoxins?
16,16-Dimethylprostaglandin F2 alpha prevents decreases in hepatic drug-metabolising enzymes due to
exogenous endotoxin, Biochem. Pharmacol., 33(8), pp. 1285-1292, April 15, 1984
75
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[50]
FENNELL, T.R., MACNEELA, J.P., MORRIS, R.W., WATSON, M., THOMPSON, C.L., BELL, D.A. Hemoglobin
adducts from acrylonitrile and ethylene oxide in cigarette smokers: effects of glutathione S-transferase
T1-null and M1-null genotypes, Cancer Epidemiol Biomarkers Prev., 9(7), pp. 705-712, 2000
[51] FENNELL, T.R. and BROWN, C.D. A physiologically based pharmacokinetic model for ethylene oxide in mouse,
rat, and human, Toxicol. Appl. Pharmacol., 173(3), pp. 161-75, 2001
[52]
FISHER, J.W., DORMAN, D.C., MEDINSKY, M.A., WELSCH, F., CONOLLY, R.B. Analysis of respiratory
exchange of methanol in the lung of the monkey using a physiological model, Toxicol. Sci., 53(2), pp.
185-193, 2000
[53]
FOST, U., TORNQVIST, M., LEUTBECHER, M., GRANATH, F., HALLIER, E., EHRENBERG, L. Effects of variation
in detoxification rate on dose monitoring through adducts, Hum. Exp. Toxicol., 14(2), pp. 201-3, 1995
[54]
FUCHS, J., WULLENWEBER, U., HENGSTLER, J.G., BIENFAIT, H.G., HILTL, G., OESCH, F. Genotoxic risk for
humans due to work place exposure to ethylene oxide: remarkable individual differences in susceptibility,
Arch Toxicol., 68(6), pp. 343-8, 1994
[55]
GAUNT, J., HARDY, J., GANGOLLI, S., BUTTERWORTH, K. and LLOYD, A. Bibra, 14, p. 109, 1975 (cited in
Rowe and Wolf, 1982 and Environ, 1987)
[56]
GAYLOR, D.W. Quantitative Cancer Risk Assessment for Exposure to Ethylene Oxide from Medical Devices,
submitted to the CDRH Toxicology Risk Assessment Committee, June 29, 1993
[57]
GLASER, Z.R. Ethylene oxide: Toxicology review and field study results of hospital use, J. Environ. Path. Tox.,
2, pp. 173-208, 1979
[58]
GOLBERG, L. Hazard Assessment of Ethylene Oxide, CRC Press, Boca Raton, FL, 1986
[59]
GOLDBLATT, M.W. Brit. J. Ind. Med., 1, p. 213, 1944
[60]
GRIFFETH, L.K., Rosen, G.M. and Rauchman, E.J. Effects of model traumatic injury on hepatic drug
metabolism in the rat. VI. Major detoxification/toxification pathways, Drug Metab. Dispos., 15(6), pp. 749-59,
1987
[61]
GUESS, W. Tissue reactions to 2-chloroethanol in rabbits, Tox. Appl. Pharm., 16, pp. 382-390, 1970
[62]
Guidelines for data acquisition and data quality evaluation in environmental chemistry. Anal. Chem., 52(14),
1980
[63]
HACKETT, P., BROWN, R., BUSCHBOOM, R., CLARK, M., MILLER, R., MUSIC, R., ROWE, S., SCHIRMER, R. and
SIKOV, M. Teratogenic Study of Ethylene Oxide and Propylene Oxide and n-Butyl Acetate (NIOSH Contract
No. 210-80-0013), Battelle Pacific Northwest Laboratories, Richland, WA, 1982 (cited in EPA, 1985)
[64] HALLIER, E., LANGHOF, T., DANNAPPEL, D., LEUTBECHER, M., SCHRODER, K., GOERGENS, H.W., MULLER, A.
and BOLT, H.M. Polymorphism of glutathione conjugation of methyl bromide, ethylene oxide and
dichloromethane in human blood: influence on the induction of sister chromatid exchanges (SCE) in
lymphocytes, Arch. Toxicol., 67(3), pp. 173-178, 1993
[65]
HANDLOS, V. Determination of gas residuals in ethylene oxide sterilized materials−A literature survey.
Archiv. Pharm. Chemi. Sci., 4, pp. 73-80, 1976
[66]
HANDLOS, V. The hazards of ethylene oxide sterilization. Arch. Pharm. Chemi. Sci., 7, pp. 939-949, 1979
[67]
HANZLIK, P., SEIDENFELD, M. and JOHNSON, C. General properties, irritant and toxic actions of ethylene
glycol, J. Pharm. Exp. Ther., 41(4) pp. 387-406, 1931
[68]
HARTMAN, P.A. and BOWMAN, P.B. Simple GLC determination of ethylene oxide and its reaction products in
76
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
drug and formulations, J. Pharm. Sci., 66(6), pp. 789-792, 1977
[69]
HASSETT, C., LIN, J., CARTY, C.L., LAURENZANA, E.M. and OMIECINSKI, C.J. Human hepatic microsomal
epoxide hydrolase: comparative analysis of polymorphic expression, Arch. Biochem. Biophys., 337(2), pp.
275-283, 1997
[70]
Health Industry Manufacturers Association. Guidelines for the Analysis of Ethylene Oxide Residues in
Medical Devices (HIMA Document No. 1, Vol. 2). Washington, DC: HIMA, 1980
[71]
HOGSTEDT, C., ROHLEN, O., BERNDTSSON, B.S., AXELSON, O. and EHRENBERG, L. A cohort study of
mortality and cancer incidence in ethylene oxide production workers, Br. J. Ind. Med., 36(4), pp. 276-80,
1979
[72]
HOLLINGSWORTH, R., ROWE, V., OYEN, F., MCCALLISTER, D. and SPENCER, H. Toxicity of ethylene oxide
determined on experimental animals. AMA Arch. Ind. Health., 13, pp. 217-227, 1956
[73]
HU, J.J., MOHRENWEISER, H.W., BELL, D.A., LEADON, S.A. and MILLER, M.S. Symposium overview: genetic
polymorphisms in DNA repair and cancer risk, Toxicol. Appl. Pharmacol., 185(1), pp. 64-73, 2002
[74]
HUBAUX, A. and GILBERT, V. Decision and detection limits for linear calibration curves, Anal. Chem., 42(8),
pp. 849-855, 1970
[75]
IARC (1994) Some industrial chemicals. Ethylene oxide, Lyons, pp. 73-159 (IARC Monographs on the
Evaluation of Carcinogenic Risks to Humans, Vol. 60)
[76] Improved detection and separation of glycols and ethylene oxide residues using GC (Bulletin 789), Supelco,
Inc., 1980
[77]
International Conference On Harmonization; ICH Harmonised Tripartite Guideline; Text on the Validation of
Analytical Procedures: Recommended for adoption at step 4 of the ICH process on 27 October 1994
[78]
JACOBSON, K., HACKLEY, E. and FEINSILVER, L. The toxicity of inhaled ethylene oxide and propylene oxide
vapors, AMA Arch. Ind. Health., 13, pp. 237-244, 1956
[79]
Japan Association of Disposable Medical Device Industries, Guideline for ethylene oxide sterilization of
disposable medical devices (second edition), December 1989
[80]
JOHNSON, M. Metabolism of chloroethanol in the rat, Biochem. Pharmacol., 16, pp. 185-199, 1967
[81]
JOHNSON, M. Detoxication of ethylene chlorohydrin, Fd. Cosmet. Tox., 5, p. 449, 1967
[82]
JONES-PRICE, C., KIMMEL, T., MARKS, T., LEDOUX, T., REEL, J., FISHER, P., LANGHOFF-PASCHKE, L. and
MARR, M. Teratologic Evaluation of Ethylene Oxide (CAS No. 75-78-8) in New Zealand White Rabbits (Final
report RB80-EO, NIEHS Contract No. 1-ES-2127). Research Triangle Park, NC, National Institute of
Environmental Health Sciences, 1982 (cited in EPA, 1985)
[83]
JONES-PRICE, C., MARKS, T., LEDOUX, T., REEL, J., FISCHER, P., LANGHOFF-PASCHKE, L., MARR, M. and
KIMMEL, C. Teratologic Evaluation of Ethylene Chlorohydrin (CAS No. 107-07-3) in New Zealand White
Rabbits (PB85-170959). Research Triangle Park, NC, National Institute of Environmental Health Sciences,
1985a
[84]
JONES-PRICE, C., MARKS, T., LEDOUX, T., REEL, J., FISCHER, P., LANGHOFF-PASCHKE, L., MARR, M. and
KIMMEL, C. Teratologic Evaluation of Ethylene Chlorohydrin (CAS No. 107-07-3) in CD-1 mice
(PB85-172104). Research Triangle Park, NC, National Institute of Environmental Health Sciences, 1985b
[85]
KAREL, L., LANDING, B. and HARVEY, T. The intraperitoneal toxicity of some glycols, glycol ethers, glycol
esters and phthalates in mice. Fed. Proceedings, 1947; 6:342
77
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[86]
KASHTOCK, M. Use of specific retention volumes in evaluation of various types of columns for use in the
trace determination of ethylene glycol by gas chromatography, J. Chromatogr., 176, pp. 25-35, 1979
[87]
KAYE, M.M. and NEVELL, T.G. Statistical evaluation of methods using headspace gas chromatography for the
determination of ethylene oxide. Analyst., 110, pp. 1067-1071, 1985
[88]
KERR, B.M., RETTIE, A.E., EDDY, A.C., LOISEAU, P., GUYOT, M., WILENSKY, A.J., LEVY, R.H. Inhibition of
human liver microsomal epoxide hydrolase by valproate and valpromide: in vitro/in vivo correlation, Clin.
Pharmacol. Ther., 46(1), pp. 82-93, 1989
[89]
KIKUCHI, H., NAKAMURA, A. and TSUJI, K. Gas chromatographic determination with electron capture
detection of residual ethylene oxide in intraocular lenses, J. Assoc. Off. Anal. Chem., 71, pp. 1057-1062,
1988
[90]
KITTERINGHAM, N.R., DAVIS, C., HOWARD, N., PIRMOHAMED, M., PARK, B.K. Interindividual and
interspecies variation in hepatic microsomal epoxide hydrolase activity: studies with cis-stilbene oxide,
carbamazepine 10, 11-epoxide and naphthalene, J. Pharmacol. Exp. Ther., 278(3), pp. 1018-1027
[91]
KNUDSEN, L.E., LOFT, S.H., AUTRUP, H. Risk assessment: the importance of genetic polymorphisms in man,
Mutat. Res., 482(1-2), pp. 83-88, 2001
[92]
KROES, R., BOCK, B. and MARTIS, L. Ethylene oxide extraction and stability in water and blood, Personal
communication to the AAMI committee, January 1985
[93]
KROETZ, D.L., KERR, B.M., MCFARLAND, L.V., LOISEAU, P., WILENSKY, A.J. and LEVY, R.H. Measurement
of in vivo microsomal epoxide hydrolase activity in white subjects, Clin. Pharmacol. Ther., 53(3), pp. 306-315,
March 1993
[94]
KULKARNI, R.K., BARTAK, D., OUSTERHOUT, D.K. and LEONARD, F. Determination of residual ethylene
oxide in catheters by gas-liquid chromatography, J. Biomed. Mat. Res., 2, pp. 165-171, 1968
[95]
LABORDE, J. and KIMMEL, C. The teratogenicity of ethylene oxide administered intravenously to mice. Tox.
Appl. Pharm., 56, pp. 16-22, 1980
[96]
LAKIND, J.S., MCKENNA, E.A., HUBNER, R.P. and TARDIFF, R.G. A review of the comparative mammalian
toxicity of ethylene glycol and propylene glycol, Crit. Rev. Toxicol., 29(4), pp. 331-365, 1999
[97]
LAMB, J. IV, MARONPOT, R., GULATI, D., RUSSELL, V., HOMMEL-BARNES, L. and SABHARWAL, P. (1985).
Reproductive and developmental toxicity of ethylene glycol in the mouse, Tox. Appl. Pharm. 81, pp. 100-112,
1985
[98]
LANDEN, W.O., THOMPSON, D.W. and FLOYD, K.M. Determination of ethylene oxide and ethylene glycol in
wet surgical dressings, FDA By-Lines, No. 2, 1971
[99]
LANDIN, H.H., GOLKAR, S.O., ZORCEC, V., TORNQVIST, M. Biomonitoring of Epicholorhydrin by
Hemoglobin Adducts, Anal. Biochem., 240, pp. 1-6, 1996
[100] LANDIN, H.H., GRUMMT, T., LAURENT, C. and TATES, A. Monitoring of occupational exposure to
epichlorohydrin by genetic effects and hemoglobin adduct, Mut. Res., 381, pp. 217-226, 1997
[101] LATVEN, A. and MOLITOR, H. Comparison of the toxic, hypnotic and irritating properties of eight organic
solvents, J. Pharm. Exp. Ther., 65, pp. 89-94, 1939
[102] LAWRENCE, W., TURNER, J. and AUTIAN, J. Toxicity of ethylene chlorohydrin I: Acute toxicity studies, J.
Pharm. Sci., 60(4), pp. 568-571, 1971
[103] LAWRENCE, W., ITOH, K., TURNER, J. and AUTIAN, J. Toxicity of ethylene chlorohydrin II: Subchronic toxicity
78
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
and special tests, J. Pharm. Sci., 60(8), pp. 1163-1168, 1971
[104] LAWRENCE, W., DILLINGHAM, E., TURNER, J. and AUTIAN, J. Toxicity profile of chloroacetaldehyde, J. Pharm.
Sci., 61(1), pp. 19-25, 1972
[105] LEE, HT., DANIEL, A. and WALKER, C. Conformance test procedures (CTP) for verifying the labeling claims
for precision, bias, and interferences in in-vitro diagnostic devices used for the quantitative measurement of
analytes in human body fluids, in Bureau of Medical Devices Biometrics Report 8202, Food and Drug
Administration, Silver Spring, MD, April 1982
[106] LONG, G.L. and WINEFORDNER, J.D. Limit of detection−A closer look at the IUPAC definition, Anal. Chem.,
55(7), pp. 712A-724A, 1983
[107] LYNCH, D., LEWIS, T., MOORMAN, W., SABHARWAL, P. and BURG, J. Toxic and mutagenic effects of ethylene
oxide and propylene oxide on spermatogenic functions in Cynomolgus monkeys, Toxicologist., 3, p. 60, 1982
[108] LYNCH, D., LEWIS, T., MOORMAN, W., BURG, J., GROTH, D., KHAN, A., ACKERMAN, L. and COCKERELL, B.
Carcinogenic and toxicologic effects of inhaled ethylene oxide and propylene oxide in F 344 rats, Tox. Appl.
Pharm., 76, pp. 69-84, 1984
[109] LYNCH, D., LEWIS, T., MOORMAN, W. et al., Effects on monkeys and rats of long-term inhalation exposure to
ethylene oxide: Major findings of the NIOSH study, in In-hospital ethylene sterilization, Current issues in
ET0 toxicity and occupational exposure, AAMI Technology Assessment Report No. 8-84, Association for the
Advancement of Medical Instrumentation, Arlington, VA, pp. 7-10, 1984
[110] MALANOSKI, A.J. Analyst performance standards: Determination for and from collaborative studies, J. Assoc.
Off. Anal. Chem., 65(6), pp. 1333-1338, 1982
[111] MANIUS, G.J. Determination of ethylene oxide, ethylene chlorohydrin, and ethylene glycol residues in
ophthalmic solution at proposed concentration limits, J. Pharm. Sci., 68(12), pp. 1547-1549, 1979
[112] MARLOWE, D.E., LAO, N.T., LAO, C.S., EATON, A.R. and PAGE, B.F.J. Interlaboratory Comparison of
Ethylene Oxide Residue Analysis Test Methods (HHS Publication FDA 86-4204), March 1986
[113] MARLOWE, D.E. Summary of results from interlaboratory comparison of ethylene oxide residue analysis test
methods, Paper presented at AAMI Conference on In-hospital EO sterilization, Arlington, VA, November
1983
[114] MARLOWE, D.E., LAO, N.T., EATON, A.R., PAGE, B.F.J. and LAO, C.S. An interlaboratory comparison of
analytical methods for ethylene oxide, J. Pharm. Sci., 76, pp. 333-337, 1986
[115] MARONPOT, R., ZELENAK, J., WEAVER, E. and SMITH, N. Teratogenicity study of ethylene glycol in rats, Drug
Chem. Tox., 6(6), pp. 579-594, 1983
[116] MASON, M., CATE, C. and BAKER, J. Toxicology and carcinogenesis of various chemicals used in the
preparation of vaccines, Clin. Toxicol., 4(2):185-204, 1971
[117] MATSUMOTO, T., HARDAWAY, R.M., PANI, K.C., SATER, C.M., BARTAK, D.E. and MARGETIS, P.M. Safe
standard of aeration for ethylene oxide sterilized supplies, Arch. Surg., 96, pp. 464-470, 1968
[118] MCDONALD, T., ROBERTS, M. and BORGMANN, A. Ocular toxicity of ethylene chlorohydrin and ethylene
glycol in rabbit eyes, Tox. Appl. Pharm., 21, pp. 143-150, 1972
[119] MCDONALD, T., KASTEN, K., HERVEY, R., GREGG, S., BORGMANN, A. and MURCHESON, T. Acute ocular
toxicity of ethylene oxide, ethylene glycol and ethylene chlorohydrin, Bull. Parent. Drug Assoc., 27(4), pp.
153-164, 1973
79
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[120] MCDONALD, T., KASTEN, K., HERVEY, R., GREGG, S. and BUTTON, B. Acute ocular toxicity for normal and
irritated rabbit eyes and subacute ocular toxicity for ethylene oxide, ethylene chlorohydrin and ethylene
glycol, Bull. Parent. Drug Assoc., 31(1), pp. 25-32, 1977
[121] MCGLYNN, K.A., HUNTER, K., LEVOYER, T., ROUSH, J., WISE, P., MICHIELLI, R.A., SHEN, F.M., EVANS, A.A.,
LONDON, W.T., BUETOW, K.H. Susceptibility to a flatoxin B1-related primary hepatocellular carcinoma in
mice and humans, Cancer Res., 63(15), pp. 4594-4601, 2003
[122] MELNICK, R. (1984). Toxicities of ethylene glycol and ethylene glycol monoethyl ether in Fischer 344/N rats
and B6C3F1 mice, Env. Hlth. Perspect., 57, pp. 147-155, 1984
[123] MERTES, I., FLEISCHMANN, R., GLATT, H.R. and OESCH, F. Interindividual variations in the activities of
cytosolic and microsomal epoxide hydrolase in human liver, Carcinogenesis, 6(2) pp. 219-223, February
1985
[124] MILLAR, M.R., SHARPE, R.M., WEINBAUER, G.F., FRASER, H.M., SAUNDERS, P.T. Marmoset
spermatogenesis: organizational similarities to the human, Int. J. Androl., 23(5) pp. 266-77, October 2000
[125] MOGENHAN, J.A., WHITBOURNE, J.E. and ERNST, R.R. Determination of ethylene oxide in surgical materials
by vacuum extraction and gas chromatography, J. Pharm. Sci., 60(2), pp. 222-224, 1971
[126] MOORE, J.A., DASTON, G.P., FAUSTMAN, E., GOLUB, M.S., HART, W.L., HUGHES, C. Jr, KIMMEL, C.A., LAMB,
J.C., SCHWETZ, B.A. and SCIALLI, A.R. An evaluative process for assessing human reproductive and
developmental toxicity of agents, Reprod. Toxicol., 9(1), pp. 61-95, 1995
[127] MORDENTI, J. Man versus beast: pharmacokinetic scaling in mammals, J. Pharm. Sci., 75(11), pp. 1028-1040,
1986
[128] MORI, K., KAIDO, M., FUJISHIRO, K., INOUE, N., KOIDE, O., HORI, H. and TANAKA, I. Dose dependent effects
of inhaled ethylene oxide on spermatogenesis in rats, Br. J. Ind. Med., 48(4), pp. 270-274, April 1991
[129] MORRIS, T., NELSON, M. and CALVERY, A. Observations on the chronic toxicities of propylene glycol,
ethylene glycol, diethylene glycol, ethylene glycol mono-ethyl-ether, and diethylene glycol mono-methyl-ether,
J. Pharm. Exp. Ther., 74, pp. 266-273, 1942
[130] MULLER, M., KRAMER, A., ANGERER, J. and HALLIER, E. Ethylene oxide-protein adduct formation in
humans: influence of glutathione-S-transferase polymorphisms, Int. Arch. Occup. Environ. Health., 71(7), pp.
499-502, 1998
[131] MUZENI, R.J. Rapid gas chromatographic determination of ethylene oxide, ethylene chlorohydrin, and
ethylene glycol residues in rubber catheters, J. Assoc. Off. Anal. Chem., 68(3), pp. 506-508, 1985
[132] NAKAMURA, A., KIKUCHI, H. and TSUJI, K. Determination of ethylene oxide residue in commercially
available intraocular lenses by new sensitive method (Electron capture detection/gas chromatography), IOL,
3, pp. 4-8, 1989
[133] National Toxicology Program, Toxicology and Carcinogenicity Studies of 2-Chloroethanol (Ethylene
Chlorohydrin) (CAS. No 107-07-3) in F344/N Rats and Swiss CD-1 Mice (Dermal Studies) (NTP TR275,
NIH Publication 86-2531). Research Triangle Park, NC, NTP, 1985
[134] National Toxicology Program, Toxicology and Carcinogenicity Studies of Ethylene Oxide (CAS No. 75-21-8)
in B6C3F1 Mice (Inhalation Studies) (NTP Technical Report 326, U.S. Department of Health and Human
Services, Public Health Services, National Institute of Health). Research Triangle Park, NC, NTP, 1987
[135] National Toxicology Program, Toxicology and Carcinogenesis Studies of Ethylene Glycol (CAS No.
80
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
107-21-1) in B6C3F1 mice (feed studies) (NTP Technical Report 413, U.S. Department of Health and Human
Services). Research Triangle Park, NC, NTP, 1993
[136] National Toxicology Program−Center for the Evaluation of Risks to Human Reproduction Expert Panel,
Report on the Reproductive and Developmental Toxicity of Ethylene Glycol. NTP-CERHR-EG-03, 2003
[137] NEEPER-BRADLEY, T. Developmental Toxicity Evaluation of Ethylene Glycol Administrated by Gavage to
CD(R) (Sprague-Dawley) Rats: Determination of a “No Observable Effect Level” (NOEL), Report 52-656,
Bushy Run Research Center, Union Carbide Corporation, Export, PA (Study sponsored by Ethylene Glycol
Panel, Chemical Manufacturers Association. Washington, D.C.), 1990
[138] NIVARD, M.J., CZENE, K., SEGERBACK, D. and VOGEL, E.W. Mutagenic activity of ethylene oxide and
propylene oxide under XPG proficient and deficient conditions in relation to N-7-(2-hydroxyalkyl)guanine
levels in Drosophila, Mutat. Res., 529(1-2), pp. 95-107, 2003
[139] NORTHUP, S., WEINCKOWSKI, D., MARTIS, L. and DARBY, T. Toxicity caused by acute and subacute
intravenous administration of ethylene oxide in the rat, J. Environ. Pathol. Toxicol., 5, pp. 617-623, 1981
[140] OBA, T., TSUJI, K., MIZUMACHI, S., KIKUCHI, H., SHINTANI, H., IIDA, K. and MEGURO, K. Studies on residual
ethylene oxide in medical devices (I)−Gas chromatographic determination of ethylene oxide in plastics.
Ikakikai-gaku, 52(3), pp. 134-139, 1982
[141] OHBA, T. Safety of residual ethylene oxide and ethylene oxide concentrations in the working environment of
sterilization facilities, in Gaughren, E.; Morrissey, R.; You-sen, W.; eds., Sterilization of Medical Products
Volume IV, Polyscience Publications, Montreal, pp. 172-177, 1986
[142] OLSEN, A.K., BJORTUFT, H., WIGER, R., HOLME, J., SEEBERG, E., BJORAS, M. and BRUNBORG, G. Highly
efficient base excision repair (BER) in human and rat male germ cells, Nucleic Acids Res. 29(8), pp. 1781-90,
2001
[143] OMIECINSKI, C.J., AICHER, L. and SWENSON, L. Developmental expression of human microsomal epoxide
hydrolase, J. Pharmacol. Exp. Ther. 269(1), pp. 417-23, 1994
[144] OMIECINSKI, C.J., HASSETT, C. and HOSAGRAHARA, V. Epoxide hydrolase-polymorphism and role in
toxicology. Toxicol. Lett., 112-113, pp. 365-70, 2000
[145] OSER, B., MORGAREIDGE, K., COX, G. and CARSON, J. Short-term toxicity of ethylene chlorohydrin (ECH) in
rats, dogs and monkeys, Fd. Cosmet. Tox., 13, pp. 313-315, 1975
[146] Pharmaceutical Manufacturers Association. Procedures for setting limits for volatile organic solvents with
methylene chloride as an example of the process. Committee on Rational Specifications for Impurities in
Bulk Drug Substances−Pharmaceutical Manufacturers Association. In: Pharmacopeial Forum. Washington,
DC: PMA, 1989; November-December, pp. 5748-5759
[147] Pharmaceutical Manufacturers Association. Application of the PMA procedure for setting residue limits for
organic volatile solvents in pharmaceuticals to ethylene oxide. Prepared by D.L. Conine and the PMA
subcommittee of Industrial Toxicologists. Procedures for setting limits for organic volatile solvents with
chloroform, 1,4-dioxane, ethylene oxide, and trichloroethylene as examples of the process. Committee on
Rational Specifications for Impurities in Bulk Drug Substances−Pharmaceutical Manufacturers Association.
In: Pharmacopeial Forum. Washington, DC: PMA, May-June:557-572, 1990
[148] POTTENGER, L.H., CARNEY, E.W. and BARTELS, M.J. Dose-dependent nonlinear pharmacokinetics of
ethylene glycol metabolites in pregnant (GD 10) and nonpregnant Sprague-Dawley rats following oral
81
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
administration of ethylene glycol, Toxicol. Sci. 62, pp. 10-19, 2001
[149] PRICE, C., KIMMEL, C., TYL, R. and MARR, M. The developmental toxicity of ethylene glycol in rats and mice,
Tox. Appl. Pharm., 81, pp. 113-127, 1985
[150] PRICE, C., TYL, R., MARR, M. and KIMMEL, C. Teratologic evaluation of ethylene glycol (EG) in CD rats and
CD-1 mice, Teratology, 29(2): 52A, 1984
[151] RAGELIS, E.P., FISHER, B.S., KIMECK, B.A. and JOHNSON, C. Isolation and determination of chlorohydrins in
foods fumigated with ethylene oxide or propylene oxide. J. Assoc. Off. Anal. Chem., 51(3), pp. 709-717, 1968
[152] ROBERTS, J. and SEIBOLD, H. Ethylene glycol toxicity in the monkey, Tox. Appl. Pharm. 15, pp. 624-631,
1969
[153] ROBINSON, M., POND, C., LAURIE, R., BERCZ, J., HENNINGSEN, G. and CONDIE, L. Subacute and subchronic
toxicity of ethylene glycol administered in drinking water to Sprague-Dawley rats, Drug Chem. Tox., 13(1),
pp. 43-70, 1990
[154] RODRICKS, J.V. and BROWN, S.L. Data requirements for assessment of device risks, J. Am. Coll. Toxicol., 7,
pp. 509-518, 1988
[155] ROMANO, S.J. and RENNER, J.A. Comparison of analytical methods for residual ethylene oxide analysis, J.
Pharm. Sci., 64(8), pp. 1412-1417, 1975
[156] ROMANO, S.J., RENNER, J.A. and LEITNER, P.M. Gas chromatography determination of residual ethylene
oxide by head space analysis, Anal. Chem., 45(14), pp. 2327-2330, 1973
[157] ROMAGUERA, C. and VILAPLANA, J. Airborne occupational contact dermatitis from ethylene oxide, Contact
Dermatitis, 39, p. 85, 1997
[158] ROSSINI, A., RAPOZO, D.C., AMORIM, L.M., MACEDO, J.M., MEDINA, R., NETO, J.F., GALLO, C.V. and PINTO,
L.F. Frequencies of GSTM1, GSTT1, and GSTP1 polymorphisms in a Brazilian population, Genet. Mol. Res.,
1(3), pp. 233-40, 2002
[159] ROWE, V. and MCCOLLISTER, S. Alcohols. Chapter Fifty-Five, in: Clayton, G., Clayton, F., eds. Patty's
Industrial Hygiene and Toxicology (3rd ed. Vol. 2C Toxicology), John Wiley & Sons, New York, pp.
4675-4684, 1982
[160] ROWE, V. and WOLF, M. GLYCOLS. Alcohols. Chapter Fifty, in: Clayton, G.; Clayton, F.; eds. Patty's Industrial
Hygiene and Toxicology (3rd ed. Vol. 2C Toxicology). John Wiley & Sons, New York, pp. 3817-3832, 1982
[161] RTECS, Registry of Toxic Effects of Chemical Substances 1985-1986, National Institute for Occupational
Safety and Health, DHHS (NIOSH) Publication No. 87-114, Rockville, MD, pp. 2361-2362, 1987
[162] RTECS, Registry of Toxic Effects of Chemical Substances. National Institute for Occupational Safety and
Health, On-line, Rockville, MD, 2006
[163] SCHRODER, K.R., WIEBEL, F.A., REICH, S., DANNAPPEL, D., BOLT, H.M. and HALLIER, E.
Glutathione-S-transferase (GST) theta polymorphism influences background SCE rate, Arch. Toxicol., 69(7),
pp. 505-507, 1995
[164] SCHULER, R., HARDIN, B., NIEMEIER, R., BOOTH, G., HAZELDEN, K., PICCIRILLO, V. and SMITH, K. Results of
testing fifteen glycol ethers in a short-term in vivo reproductive toxicity assay, Env. Hlth. Perspect. 57, pp.
141-146, 1984
[165] SEGERBACK, D., OSTERMAN-GOLKAR, S., MOLHOLT, B. and NILSSON, R. In vivo tissue dosimetry as a basis
for cross-species extrapolation in cancer risk assessment of propylene oxide, Regul. Toxicol. Pharmacol. 20(1
82
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
Pt 1), pp. 1-14
[166] SEILKEN, R. and VALDEZ-FLORES, C. Cancer Dose-Response Modeling and Risk Characterizations Based on
Animals Exposed to Ethylene Oxide FINAL REPORT, Submitted to Ethylene Oxide Industry Council, 2000
[167] SHIMIZU, H., OHARA, K. and SAWA, M. Sterile anterior segment inflammation presumably due to absorbed
ethylene oxide to the implanted intraocular lens, Rinsho Ganka (Japanese J. Clin. Ophthalmol.), 40(11), pp.
1219-1225, 1986
[168] SHUPACK, J.L., ANDERSEN, S.R. and ROMANO, S.J. Human skin reactions to ethylene oxide. J. Lab. Clin.
Med., 98, pp. 723-729, 1981
[169] SNELLINGS, W.M., MARONPOT, R.R., ZELENAK, J.P. et al. Teratology study in Fischer 344 rats exposed to
ethylene oxide by inhalation, Toxicol. Appl. Pharmacol., 64, 476-481, 1982
[170] SNELLINGS, W., MARONPOT, R., ZELENAK, J. and LAFFOON, C. Teratology study in Fischer 344 rats exposed
to ethylene oxide by inhalation, Tox. Appl. Pharm., 64, pp. 476-481, 1982a
[171] SNELLINGS, W., ZELENAK, J. and WEIL, C. Effects on reproduction in Fischer rats exposed to ethylene oxide
by inhalation for one generation, Tox. Appl. Pharm., 63, pp. 382-388, 1982b
[172] SNELLINGS, W., WEIL, C. and MARONPOT, R. A subchronic inhalation study on the toxicologic potential of
ethylene oxide in B6C3F1 mice, Tox. Appl. Pharm., 76, pp. 510-518, 1984a
[173] SNELLINGS, W., WEIL, C. and MARONPOT, R. A two-year inhalation study of the carcinogenic potential of
ethylene oxide in Fischer 344 rats, Tox. Appl. Pharm., 75, pp. 105-117, 1984b
[174] SNYDER, L.R. A rapid approach to selecting the best experimental conditions for high-speed liquid column
chromatography−Part 1−Estimating initial sample resolution and the final resolution required by a given
problem, J. Chromatogr. Sci.; 10, pp. 201-212, 1972
[175] SPITZ, H.D. and WEINBERGER, J. Determination of ethylene oxide, ethylene chlorohydrin and ethylene glycol
by gas chromatography, J. Pharm. Sci., 60(2), pp. 271-274, 1971
[176] STAYNER, L., STEENLAND, K., GREIFE, A., HORNUNG, R., HAYES, R.B., NOWLIN, S., MORAWETZ, J.,
RINGENBURG, V., ELLIOT, L. and HALPERIN, W. Exposure-response analysis of cancer mortality in a cohort of
workers exposed to ethylene oxide, Am. J. Epidemiol., 138(10), pp. 787-98, 1993
[177] STEENLAND, K., STAYNER, L., GREIFE, A. et al. A cohort mortality study of workers exposed to ethylene oxide,
N. Engl. J. Med., 324, pp. 402-407, 1991
[178] STEENLAND, K., STAYNER, L. and DEDDENS, J. Mortality analysis in a cohort of 18235 ethylene oxide
exposed workers: follow up extended from 1987 to 1998, Occup. Environ. Med., 61, pp. 2-7, 2004
[179] TANAKA, S., NAKAURA, S., KAWASHIMA, K., KASUYA, Y. and OMORI, Y. Studies on the hemolytic activity and
dermal irritability of ethylene oxide and its reaction products. Jap. J. Med. Instrum. 52(1), pp. 21-28, 1982
[180] TAYLOR, J.S. Dermatologic hazards from ethylene oxide, Cutis, 19, pp. 189-192, 1977
[181] TETA, M.J., SIELKEN, R.L. jr.m and VALDEZ-FLORES, C. Ethylene oxide cancer risk assessment based on
epidemiological data: application of revised regulatory guidelines, Risk Anal. 19(6), pp. 1135-55, 1999
[182] THIER, R., LEWALTER, J., KEMPKES, M., SELINSKI, S., BRUNING, T. and Bolt, H.M. Haemoglobin adducts of
acrylonitrile and ethylene oxide in acrylonitrile workers, dependent on polymorphisms of the glutathione
transferases GSTT1 and GSTM1, Arch. Toxicol., 73(4-5), pp. 197-202, 1999
[183] THIER, R., BRUNING, T., ROOS, P.H., RIHS, H.P., GOLKA, K., KO, Y. and BOLT, H.M. Markers of genetic
susceptibility in human environmental hygiene and toxicology: the role of selected CYP, NAT and GST genes,
83
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
Int. J. Hyg. Environ. Health., 206(3), pp. 149-71, 2003
[184] THIER, R., BALKENHOL, H., LEWALTER, J., SELINSKI, S., DOMMERMUTH, A. and BOLT, H.M. Influence of
polymorphisms of the human glutathione transferases and cytochrome P450 2E1 enzyme on the metabolism
and toxicity of ethylene oxide and acrylonitrile, Mutat. Res., 482(1-2), pp. 41-46, 2001
[185] TYL, R. Developmental Toxicity Evaluation of Ethylene Glycol Administrated by Gavage to DC(R)-1 Mice:
Determination of a “No-Observable-Effect Level” (NOEL), Report 51-591, Bushy Run Research Center.
Union Carbide Corporation, Export, PA. (Study sponsored by Ethylene Glycol Panel.) Washington, DC,
Chemical Manufacturers Association, 1988
[186] TYLER, T.R., MCKELVEY, J.A. Dose dependent disposition of 14C labelled ethylene oxide in rats, Export, PA,
Bushy Run Research Center (TSCATS/017061; EPA/OTS Document No. 878212056),1982
[187] U.S. ENVIRONMENTAL PROTECTION AGENCY. Health Assessment Document for Ethylene Oxide (EPA
600/8-84-009F). Research Triangle Park, NC, EPA, 1985
[188] U.S. ENVIRONMENTAL PROTECTION AGENCY (1996) Guidelines for Reproductive Toxicity Risk
Assessment EPA/630/R-96/009 http://www.epa.gov/ncea/raf/pdfs/repro51.pdf
[189] U.S. FOOD AND DRUG ADMINISTRATION. EO, ECH & EG, Proposed maximum residue limits and
maximum levels of exposure (HEW/FDA), Federal Register. Washington, DC, June 23, 1978; 43(122)
[190] USP Chromatography (section 621) in: United States Pharmacopeia 29th Edition, United States
Pharmacopeial Convention, 2006
[191] USP Validation of Compendial Methods (section 1225) in: United States Pharmacopeia 29th Edition, United
States Pharmacopeial Convention, 2006
[192] VOGEL, E.W. and NATARAJAN, A.T. DNA damage and repair in somatic and germ cells in vivo, Mutat. Res.,
330(1-2), pp. 183-208, 1995
[193] WARREN, B. The determination of residual ethylene oxide and halogenated hydrocarbon propellants in
sterilized plastics, J. Pharm. Pharmacol., 23(suppl.), pp. 170S-175S, 1971
[194] WEIL, C. Statistics vs. safety factors and scientific judgement in the evaluation of safety for man, Tox. Appl.
Pharm., 21, pp. 454-463, 1972
[195] WEINBAUER, G.F., ASLAM, H., KRISHNAMURTHY, H., BRINKWORTH, M.H., EINSPANIER, A. And HODGES, J.K.
Quantitative analysis of spermatogenesis and apoptosis in the common marmoset (Callithrix jacchus) reveals
high rates of spermatogonial turnover and high spermatogenic efficiency, Biol. Reprod. 64(1), pp. 120-126,
2001
[196] WEINBERGER, J. GLC Determination of ethylene chlorohydrin following co-sweep extraction, J. Pharm. Sci.,
60(4), pp. 545-547, 1971
[197] WERNERMAN, J., LUO, J.L. and HAMMARQVIST, F. Glutathione status in critically-ill patients: possibility of
modulation by antioxidants, Proc. Nutr. Soc., 58(3), pp. 677-680, 1999
[198] WESLEY, F., ROURKE, B. and DARBISHIRE, O. The formation of persistent toxic chlorohydrins in foodstuffs by
fumigating with ethylene oxide and propylene oxide, J. Food Sci., 30, pp. 1037-1042, 1965
[199] WHITBOURNE, J.E., MOGENHAN, J.A. and ERNST, R.R. Determination of 2-chloroethanol in surgical
materials by extraction and gas chromatography, J. Pharm. Sci., 58(3), pp. 1024-1025, August 1969
[200] WHITE, J.D. and BRADLEY, T.J. Residual ethylene oxide in methyl methacrylate polymer powders by GLC, J.
Pharm. Sci., 62(10), pp. 1623-1637, 1973
84
T 0993-7:2012 (ISO 10993-7:2008)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[201] WHO, Ethylene Oxide. Concise International Chemical Assessment Document 54, World Health
Organization, Geneva, 2003 http://www.who.int/pcs/cicad/full̲text/cicad54.pdf
[202] WIENCKE, J.K., PREMBLE, S., KETTERE, B. and KELSEY, K.T. Gene deletion of Glutathione-S-transferase
theta: correlation with induced genetic damage and potential role in endogenous mutagenesis, Cancer
Epidemiol. Biomarkers Prev., 4(3), pp. 253-259, 1995
[203] WOODARD, G. and WOODARD, M. Toxicity of residuals from ethylene oxide gas sterilization. Proceedings of
the Health Industry Association Technical Symposium, Washington, DC, pp. 140-161, 1971
[204] YIN, L., LIU, C., SHIH, L. and PO, K. A study of the teratogenic action of ethylene glycol in rats, Zhonghua
Yugangyixue Zazhi, 20(5), 289-290, 1986
[205] YONG, L.C., SCHULTE, P.A., WIENCKE, J.K., BOENIGER, M.F., CONNALLY, L.B., WALKER, J.T., WHELAN, E.A.
and WARD, E.M. Hemoglobin adducts and sister chromatid exchanges in hospital workers exposed to
ethylene oxide: effects of glutathione S-transferase T1 and M1 genotypes, Cancer Epidemiol. Biomarkers
Prev., 10(5), pp. 539-550, 2001
[206] ZAGAR, L.A. Determination of residual ethylene oxide in methyl methacrylate polymer powders by GLC, J.
Pharm. Sci., 61(11), pp. 1801-1803, 1972
[207] ZHENG, W., WEN, W.Q., GUSTAFSON, D.R., GROSS, M., CERHAN, J.R. and FOLSOM, A.R. GSTM1 and GSTT1
polymorphisms and postmenopausal breast cancer risk, Breast Cancer Res. Treat., 74(1), p. 9, 2002
ISO 10993-4:2002 Biological evaluation of medical devices−Part 4: Selection of tests for interactions with blood