R 1706:2020
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 2
3 用語及び定義 ··················································································································· 2
4 記号及び単位 ··················································································································· 4
5 測定原理 ························································································································· 4
6 材料······························································································································· 5
6.1 試験に用いるバクテリオファージ,細菌株及び試験の準備 ····················································· 5
6.2 試薬及び材料 ················································································································ 6
6.3 殺菌方法 ······················································································································ 8
7 装置及び機器 ··················································································································· 8
8 試験片···························································································································· 8
8.1 フィルム密着法 ············································································································· 8
8.2 ガラス密着法 ················································································································ 9
9 試験方法 ························································································································· 9
9.1 一般事項 ······················································································································ 9
9.2 宿主菌液の調製方法 ······································································································ 10
9.3 試験バクテリオファージ液の調製方法 ··············································································· 10
9.4 フィルム密着法 ············································································································ 10
9.5 ガラス密着法 ··············································································································· 12
9.6 紫外光照射条件 ············································································································ 14
9.7 バクテリオファージ感染価の測定 ····················································································· 15
10 試験結果の計算 ············································································································· 15
10.1 一般事項 ···················································································································· 15
10.2 感染価の計算 ·············································································································· 15
10.3 試験成立条件 ·············································································································· 16
10.4 抗ウイルス活性値の計算 ······························································································· 16
10.5 光照射による抗ウイルス活性値の計算 ············································································· 16
10.6 暗所における抗ウイルス活性値の計算 ············································································· 16
11 試験結果の報告 ············································································································· 17
附属書A(参考)インフルエンザウイルス及びバクテリオファージQβに対する
光触媒の効果比較結果 ···································································································· 18
附属書B(参考)ATCC 23631-B1及びNBRC 20012株を用いた光触媒による
抗バクテリオファージQβの効果比較結果 ·········································································· 19
附属書JA(参考)カルシウム添加LB寒天平板培地を用いたバクテリオファージの調製方法 ············· 21
R 1706:2020 目次
(2)
ページ
附属書JB(参考)JISと対応国際規格との対比表 ······································································ 24
R 1706:2020
(3)
まえがき
この規格は,産業標準化法第16条において準用する同法第12条第1項の規定に基づき,一般社団法人
日本ファインセラミックス協会(JFCA)及び一般財団法人日本規格協会(JSA)から,産業標準原案を添
えて日本産業規格を改正すべきとの申出があり,日本産業標準調査会の審議を経て,経済産業大臣が改正
した日本産業規格である。これによって,JIS R 1706:2013は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
R 1706:2020
ファインセラミックス−
光触媒材料の抗ウイルス性試験方法−
バクテリオファージQβを用いる方法
Fine ceramics (advanced ceramics, advanced technical ceramics)-
Determination of antiviral activity of photocatalytic materials-
Test method using bacteriophage Q-beta
序文
この規格は,2014年に第1版として発行されたISO 18061を基とし,技術的内容を変更して作成した日
本産業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JBに示す。
1
適用範囲
この規格は,紫外光照射後のバクテリオファージQβの不活化によって,光触媒を含有する加工材料及
び表面に光触媒加工フィルムを含む材料(以下,光触媒抗ウイルス加工材料という。)の抗ウイルス性試験
方法及び活性値の求め方について規定する。
この規格は,抗ウイルス用途をもつ光触媒材料に適用する。光触媒材料の他の種類の機能,例えば,抗
菌性,抗かび性,水浄化,セルフクリーニング,防曇及び空気浄化には適用できない。
この規格は,粉体,粒状及び多孔質な光触媒材料は含まないが,主に塗布作業するなどの作業によって,
平板状又は繊維状に加工した光触媒材料に対しては適用できる。
可視光領域での抗ウイルス性能を試験する場合は,この規格ではなく,JIS R 1756を適用する。
警告 この規格に基づいて試験を行う者は,微生物学的技術を習得していることを前提とする。
注記1 この規格では,インフルエンザウイルスの代替モデルとして,バクテリオファージQβを用
いている。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 18061:2014,Fine Ceramics (Advanced Ceramics, Advanced Technical Ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials−Test method
using bacteriophage Q-beta(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。

2
R 1706:2020
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0050 化学分析方法通則
JIS K 0557 用水・排水の試験に用いる水
JIS K 0950 プラスチック製滅菌シャーレ
JIS K 0970 ピストン式ピペット
JIS K 3800 バイオハザード対策用クラスIIキャビネット
JIS K 8101 エタノール(99.5)(試薬)
JIS K 8122 塩化カルシウム二水和物(試薬)
JIS K 8150 塩化ナトリウム(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8263 寒天(試薬)
JIS K 8576 水酸化ナトリウム(試薬)
JIS L 0803 染色堅ろう度試験用添付白布
JIS L 1902 繊維製品の抗菌性試験方法及び抗菌効果
JIS P 3801 ろ紙(化学分析用)
JIS R 1600 ファインセラミックス関連用語
JIS R 1702 ファインセラミックス−光触媒抗菌加工材料の抗菌性試験方法及び抗菌効果
注記 対応国際規格:ISO 27447:2009,Fine ceramics (advanced ceramics, advanced technical ceramics)
−Test method for antibacterial activity of semiconducting photocatalytic materials
JIS R 1709 ファインセラミックス−紫外線励起形光触媒試験用光源
注記 対応国際規格:ISO 10677:2011,Fine ceramics (advanced ceramics, advanced technical ceramics)
−Ultraviolet light source for testing semiconducting photocatalytic materials
JIS R 3505 ガラス製体積計
JIS R 3644 ガラス管類
JIS R 3645 ガラス棒
JIS Z 2801 抗菌加工製品−抗菌性試験方法・抗菌効果
JIS Z 8802 pH測定方法
3
用語及び定義
この規格で用いる主な用語及び定義は,次によるほか,JIS R 1600及びJIS R 1702による。
3.1
抗ウイルス(antiviral)
材料の表面におけるウイルスの感染性(感染能)を抑制する状態。
3.2
バクテリオファージ(bacteriophage)
細菌に感染するウイルスの一種。
注記1 この規格で用いるバクテリオファージは,大腸菌のF繊毛に特異的に感染するRNAファー
ジQβである。バクテリオファージQβは,ヒト及び動物への病原性をもたないが,ヒトに感
3
R 1706:2020
染するインフルエンザウイルス代用として用いる。
注記2 インフルエンザウイルス及びバクテリオファージQβに対する試験結果比較例を,附属書A
に示す。
3.3
プラーク(plaque)
理論上,感染性をもつ単一のバクテリオファージが宿主菌に感染し溶菌した結果,目視することができ
る透明な範囲。
3.4
感染価(infectivity)
細菌に感染して増殖可能なバクテリオファージ粒子の数。細菌に感染して形成するプラークの数と同じ
であり,プラーク形成単位(plaque forming unit,pfu)を単位として表す。
3.5
光触媒抗ウイルス加工(photocatalytic antiviral treatment)
光触媒の抗ウイルス機能を利用するために,光触媒で抗ウイルス加工すること。単味光触媒抗ウイルス
加工及びハイブリッド光触媒抗ウイルス加工に分類される。
3.6
単味光触媒抗ウイルス加工(simplex photocatalytic antiviral treatment)
光触媒抗ウイルス加工のうち,塗布,含浸,練り込みなど種々の方法によって光触媒を担持すること。
また,光照射下での光触媒の抗ウイルス性を増強するために,光触媒と抗ウイルス性のない他の機能性物
質とを組み合わせた材料とを担持することも含む。
3.7
ハイブリッド光触媒抗ウイルス加工(hybrid photocatalytic antiviral treatment)
光触媒抗ウイルス加工のうち,光が当たらない環境においても抗ウイルス機能を発現させるために,光
触媒と抗ウイルス性のある他の機能性物質とを組み合わせた材料を塗布,含浸,練り込みなど種々の方法
によって担持すること。
3.8
光触媒抗ウイルス加工材料(photocatalytic antiviral treated material)
光触媒抗ウイルス加工した膜状,平板状,繊維状などの材料。単味光触媒抗ウイルス加工,ハイブリッ
ド光触媒抗ウイルス加工及び光触媒抗ウイルス加工した製品を含む。
3.9
フィルム密着法(film cover method)
光触媒抗ウイルス加工した平板状材料の光照射条件下又は暗所条件下での抗ウイルス性を評価する試験
方法。
3.10
ガラス密着法(glass cover method)
光触媒抗ウイルス加工した繊維状材料の光照射条件下又は暗所条件下での抗ウイルス性を評価する試験
方法。
3.11
光触媒抗ウイルス加工材料の抗ウイルス活性値(photocatalyst antiviral activity value)
紫外光照射後の光触媒抗ウイルス加工した材料と無加工材料との感染価の対数値の差。
4
R 1706:2020
注記 この値には,紫外光照射しない条件で得られるプラーク数の減少分も含まれる。
3.12
光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値(photocatalyst antiviral activity value with UV
irradiation)
紫外光照射後と暗所に保存した後との光触媒抗ウイルス加工した材料の感染価の対数値の差。
3.13
光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値(photocatalyst antiviral activity value without
UV irradiation)
光触媒抗ウイルス加工した材料と無加工材料を暗所に保存した後との感染価の対数値の差。
4
記号及び単位
この規格で用いる主な記号及び単位は,次による。
A:
無加工試験片の接種直後の3個の試験片の感染価の平均値(pfu)
BD:
無加工試験片を暗所に保存した後の3個の試験片の感染価の平均値(pfu)
BL:
無加工試験片を紫外放射照度Lで光照射した後の3個の試験片の感染価の平均値(pfu)
CD:
光触媒抗ウイルス加工した試験片を暗所に保存した後の3個の試験片の感染価の平均値(pfu)
CL:
光触媒抗ウイルス加工した試験片を紫外放射照度Lで光照射した後の3個の試験片の感染価の
平均値(pfu)
DF:
希釈倍率
L:
紫外放射照度(mW/cm2)
Logmax: 3個の試験片の感染価の常用対数値の最大値
Logmean: 無加工試験片の3個の試験片の感染価の常用対数値の平均値
Logmin: 3個の試験片の感染価の常用対数値の最小値
N:
感染価(pfu)
VD:
光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値
VL:
紫外放射照度Lで光照射した光触媒抗ウイルス加工材料による抗ウイルス活性値
ΔV:
光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値
W:
洗い出しに用いたSCDLP培地の液量(ml)
Z:
2枚のシャーレのプラーク数の平均値(pfu)
5
測定原理
この試験方法は,光触媒材料の開発,性能比較,品質管理,特徴付け,信頼性及び設計データの取得に
適している。この試験方法は,紫外光照射下において,バクテリオファージと試験片とが接触することに
よる光触媒材料の抗ウイルス性を得るために適用する。フィルム密着法は,平板状の材料に適用できる。
ガラス密着法は,繊維状の材料に適用できる。
試験片をシャーレに置き,バクテリオファージ液を試験片に滴下する。次に,密着フィルム又は密着ガ
ラスでバクテリオファージ液を覆い,保湿ガラスをシャーレの上にかぶせる。試験片を入れたシャーレに
紫外光を照射する。照射後,試験片及び密着フィルム又は密着ガラスからバクテリオファージ液を洗い出
す。この洗い出されたバクテリオファージ液の感染価をバクテリオファージに感受性をもつ大腸菌を用い
たプラーク形成法によって測定する。得られた結果は,光触媒抗ウイルス加工した試験片と同様の条件で
5
R 1706:2020
紫外光照射をした無加工試験片,暗所に置いた光触媒抗ウイルス加工した試験片及び無加工試験片の測定
結果と比較する。
6
材料
6.1
試験に用いるバクテリオファージ,細菌株及び試験の準備
6.1.1
試験に用いるバクテリオファージ及び細菌の種類
試験に用いるバクテリオファージ及び細菌株は,世界微生物株保存連盟(World Federation for Culture
Collections)又は日本微生物資源学会に加入している機関において保存されている同一系統の株を使用する
(表1参照)。また,バクテリオファージの宿主細菌株は,表1に示すほか,同等の感染性をもつ宿主細菌
株を用いてもよい。微生物を用いる作業は適切な安全キャビネット内で行い,バイオセーフティレベル1
に必要な設備が用意された実験室で試験する。
なお,ハザードレベル及び必要な設備については,国立感染症研究所病原体等安全管理規程などを参考
とするのがよい。
表1−試験に用いる株
細菌の種類
保存番号
保存機関名
バクテリオファージ Qβ
(Bacteriophage Q-beta)
ATCC 23631-B1
American Type Culture Collection
DSM 13768
German Collection of Microorganisms and Cell Cultures (DSMZ)
NBRC 20012
独立行政法人製品評価技術基盤機構バイオテクノロジーセンター
エシェリヒア・コリー
(Escherichia coli)
(大腸菌)
ATCC 23631
American Type Culture Collection
DSM 5210
German Collection of Microorganisms and Cell Cultures (DSMZ)
NBRC 106373
独立行政法人製品評価技術基盤機構バイオテクノロジーセンター
注記 ATCC 23631-B1とNBRC 20012とは,厳密にいえば同一のものではないが,同じ株から分離されたものであ
り,光触媒活性による抗ウイルス効果は,同等である(附属書B参照)。
6.1.2
細菌株の保存
細菌株の保管及び継代は,次によるほか,JIS L 1902の7.2(菌株の保存)による。
a) 6.2.10に規定するLB寒天斜面培地又は6.2.5に規定するLB寒天平板培地で,16時間〜24時間,37 ℃
±1 ℃で培養し,その後5 ℃〜10 ℃で保存する。
b) a)の操作を再度行うことによって,1か月以内に継代培養を繰り返す。
c) LB寒天斜面培地又はLB寒天培地で培養したものは,1か月以上の使用はできない。
d) 保存機関から入手した菌株は初代から数えて10回までの継代培養とする。凍結乾燥,凍結などの長期
間保存可能な方法で保存した菌株にあっては,菌株保存機関から分譲された菌株を,保存菌株を作製
するために元株から培養した継代回数を保存菌株の継代回数とする。この保存菌株を試験に用いる場
合は,10回から保存菌株の継代回数を引いた回数を使用限度とする。最大継代回数は,保存機関から
入手してから10回までとする。JIS L 1902の7.2に規定する保存方法を用いる場合でも,最大継代回
数は保存機関から入手して10回までとする。
6.1.3
バクテリオファージストック液の準備
バクテリオファージストック液の準備は,次による。
a) 300 mlのコニカルフラスコに25 mlの6.2.3に規定するカルシウム添加LB培地を入れて,大腸菌を接
種する。
必要に応じて容量の異なるフラスコを用いてもよいが,菌が増殖しやすい環境を作るため,加える
6
R 1706:2020
培地液量は,フラスコの容量の1/6以下とする。
b) 18時間±2時間,37 ℃±1 ℃,110 rpm±10 rpmで培養する。
c) 300 mlのコニカルフラスコに25 mlのカルシウム添加LB培地を入れ,あらかじめ35 ℃〜37 ℃に温
めておく。そこにb)で作成した培養液0.025 mlを接種する。
d) a)〜c)に規定した条件で,菌濃度が2.0±1.0 cfu/ml×108 cfu/mlとなるまで培養する。
この手順は,濁度の測定とコロニー数との関係を確立するために,数回行う必要がある。十分なデ
ータが得られた場合,その後は濁度の測定値に基づいて次の作業を行ってよい。
e) 最終濃度約2×107 pfu/ml[m.o.i(multiplicity of infection,多重感染価,バクテリオファージ感染価/
大腸菌数)は,おおよそ0.1]となるように,バクテリオファージを菌培養液に接種する。
f)
b)の条件で4時間培養する。
g) 培養液を4 ℃±2 ℃で終夜保存する。
h) 遠心チューブに培養液を入れて20分,4 ℃±2 ℃,かつ,遠心加速度10 000 gで遠心分離する。
i)
上清を滅菌チューブに移す。
j)
滅菌シリンジフィルタを通して,バクテリオファージを含む上清を精製する。
k) バクテリオファージストック液の感染価を確認して,4 ℃±2 ℃又は−80 ℃で保存する。
バクテリオファージストック液の感染価は,1.0×1011 pfu/ml以上が望ましく,1.0×1013 pfu/ml程度
となってもよい。時間の経過で,徐々にバクテリオファージストック液の感染価は,減少する。
l)
宿主菌のコンタミネーションを確認するために,バクテリオファージストック液1 mlを6.2.5に規定
するLB寒天平板培地と混ぜ,24時間,37 ℃±1 ℃で培養する。コロニーが検出された場合には,バ
クテリオファージストック液は捨てて使用しない。
m) 1.0×1010 pfu/ml未満(調製直後の感染価から1/10以下に感染価が低下したバクテリオファージストッ
ク液)を用いてはならない。また,コンタミネーションしたバクテリオファージストック液は,使用
しない。
寒天平板培地法を用いて,バクテリオファージストック液を準備してもよい(附属書JA参照)。
6.2
試薬及び材料
試験に用いる試薬及び材料は,6.2.1〜6.2.18による。
なお,培地は,同一成分であれば,市販のものを用いることができ,また作成する培地量は試験片の数
に合わせて変更することができる。
6.2.1
1/500濃度普通ブイヨン培地(以下,1/500 NBという。) JIS Z 2801の5.4 a)(普通ブイヨン培地)
に規定する方法による。
6.2.2
0.2 mol/lカルシウム水溶液 精製水1 000 mlに対して化学はかりを用いて塩化カルシウム二水和物
29.4 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れて混合し,内容物を十分に溶解した後,高圧蒸
気殺菌する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。6か月を過ぎたものは,
使用しない。
6.2.3
カルシウム添加LB培地 精製水1 000 mlに対して化学はかりでトリプトン10.0 g,酵母エキス5.0
g及び塩化ナトリウム10.0 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れて混合し,内容物を十分
に溶解した後,pH 7.0±0.2(25 ℃)になるように水酸化ナトリウム溶液で調整し,高圧蒸気殺菌する。高
圧蒸気殺菌した培地が60 ℃以下に下がったことを確認した後,6.2.2に規定する0.2 mol/lカルシウム水溶
液を10 ml添加し,混合して作製する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。
7
R 1706:2020
1か月を過ぎたものは,使用しない。
6.2.4
寒天 1.5 %寒天の強度が400 g/cm2〜600 g/cm2で,JIS K 8263に規定する特級又は微生物試験用の
ものを用いる。
6.2.5
LB寒天平板培地 精製水1 000 mlに対して化学はかりでトリプトン10.0 g,酵母エキス5.0 g及び
塩化ナトリウム10.0 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れて混合し,内容物を十分に溶解
した後,pH 7.0±0.2(25 ℃)になるように0.1 mol/l水酸化ナトリウム溶液で調整する。これに化学はか
りで軽量した寒天粉末15.0 gを加え,高圧蒸気殺菌などを用いて完全に溶解,殺菌する。高圧蒸気殺菌し
た培地が60 ℃以下に下がったことを確認した後,7.5に規定するシャーレに15 ml〜20 ml程度分注して平
板培地を調製する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。1か月を過ぎたも
のは,使用しない。
6.2.6
カルシウム添加LB寒天平板培地 精製水1 000 mlに対して化学はかりでトリプトン10.0 g,酵母
エキス5.0 g及び塩化ナトリウム10.0 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れて混合し,内容
物を十分に溶解し,化学はかりで計量した寒天粉末15.0 gを加え,高圧蒸気殺菌などを用いて完全に溶解,
殺菌する。高圧蒸気殺菌した培地が60 ℃以下に下がったことを確認した後,6.2.2に規定する0.2 mol/lカ
ルシウム水溶液を10 ml添加し,混合する。この培地を7.5に規定するシャーレに15 ml〜20 ml程度分注
して平板培地を調製する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。14日を過
ぎたものは,使用しない。
6.2.7
カルシウム添加LB軟寒天培地 精製水1 000 mlに対して化学はかりでトリプトン10.0 g,酵母エ
キス5.0 g及び塩化ナトリウム10.0 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れてよく混合し,内
容物を十分に溶解し,これに化学はかりで計量した寒天粉末5.0 gを加え,高圧蒸気殺菌などを用いて完全
に溶解し,殺菌する。pH 7.0±0.2(25 ℃)になるように,0.1 mol/l水酸化ナトリウム溶液で調整する。高
圧蒸気殺菌した培地が60 ℃以下に下がったことを確認した後,6.2.2に規定する0.2 mol/lカルシウム水溶
液を15 ml添加し,混合する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。1か月
を過ぎたものは,使用しない。
一度固まったカルシウム添加LB軟寒天培地を再度融解する場合は,沸騰する水浴中又はその他の方法
を用い,高圧蒸気殺菌は用いない。
6.2.8
SCDLP培地 JIS Z 2801の5.4 e) (SCDLP培地)に規定する方法による。
6.2.9
ペプトン加生理食塩水 JIS L 1902の6.6(ペプトン食塩水)に規定する方法による。調製後,直
ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。1か月を過ぎたものは,使用しない。
6.2.10 LB寒天斜面培地 精製水1 000 mlに対して化学はかりでトリプトン10.0 g,酵母エキス5.0及び塩
化ナトリウム10.0 gを計量し,フラスコ,ガラス製ねじ口瓶などに入れてよく混合し,内容物を十分に溶
解した後,pH 7.0±0.2(25 ℃)になるように,0.1 mol/l水酸化ナトリウム溶液又は塩酸溶液で調整する。
これに化学はかりで計量した寒天粉末15.0 gを加え,高圧蒸気殺菌などを用いて完全に溶解し,殺菌する。
これを,試験管に6 ml〜10 ml注ぎ,清浄な室内に試験管を水平面に対して約15度傾けて置き,内容物を
凝固させる。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。1か月を過ぎたものは,
使用しない。
6.2.11 塩化カルシウム二水和物(CaCl2・2H2O) JIS K 8122に規定する特級を用いる。
6.2.12 精製水 JIS K 0557に規定するA2又はA3に適合するものを用いる。
6.2.13 塩化ナトリウム(NaCl) JIS K 8150に規定する特級を用いる。
6.2.14 水酸化ナトリウム(NaOH) JIS K 8576に規定する特級を用いる。
8
R 1706:2020
6.2.15 塩酸(HCl) JIS K 8180に規定する特級を用いる。
6.2.16 エタノール(C2H5OH) JIS K 8101に規定する特級を用いる。
6.2.17 非イオン界面活性剤 JIS R 1702の6.2.16(非イオン界面活性剤)に規定するもの。
6.2.18 綿標準布 JIS L 0803に規定する綿100 %の添付白布(綿3-1号)を用いて,洗剤及び漂白剤を使
用せず,60 ℃の水温で10分間水洗い後,すすぎ5分を2回繰り返し,この一連の処理を10回繰り返し,
風乾したものを用いる。
6.3
殺菌方法
殺菌方法は,高圧蒸気殺菌とし,JIS Z 2801の5.3 b) (高圧蒸気殺菌)による。
7
装置及び機器
装置及び機器は,次による。
7.1
試験装置 JIS R 1702の7.1(試験装置)に規定する試験装置。
7.2
密着フィルム JIS R 1702の7.2(密着フィルム)に規定するもの。
7.3
密着ガラス JIS R 1702の7.3(密着ガラス)に規定するもの。
7.4
保湿用ガラス JIS R 1702の7.4(保湿用ガラス)に規定するもの。
7.5
保存シャーレ 内径約90 mmのガラス製,又はJIS K 0950に規定する90A号若しくは90B号に適
合するもの。
7.6
調湿用ろ紙 JIS P 3801に規定する微生物の発育に影響を及ぼさないろ紙で,試験片を置く容器に入
るよう切断したもの。
7.7
ガラス管・ガラス棒 JIS R 3644に規定するガラス管又はJIS R 3645に規定するガラス棒を試験片
を置く容器に入るように切断したもの。
7.8
光源 JIS R 1709に規定するブラックライトブルー形紫外線蛍光ランプ(BLBランプ)又はブラッ
クライト形紫外線蛍光ランプ(BLランプ)。
7.9
紫外放射照度計 JIS R 1709に規定するもので,0.001 mW/cm2まで計測できるもの。
7.10 金属製遮光板 JIS R 1702の7.11(金属製遮光板)に規定する金属製遮光板。
7.11 暗箱 JIS R 1702の7.12(暗箱)に規定するもの。
7.12 滅菌シリンジフィルタ シリンジに装着可能な0.22 μm〜0.45 μmのポアサイズでPES又はPDVFメ
ンブレンを用いたもの。セルロース製は,吸着が起こるため不適である。
7.13 遠心機 4 ℃±2 ℃で遠心加速度10 000 gの遠心が可能なもの。
7.14 安全キャビネット JIS K 3800に適合するもの又は同等の性能をもつもの。
7.15 ピペット JIS K 0970若しくはJIS R 3505のクラスAに適合するもの,又は同等の精度をもつもの。
7.16 化学はかり JIS K 0050に規定する化学はかり又は同等の性能をもつもの。
7.17 pH計 JIS Z 8802に適合するもの。
8
試験片
8.1
フィルム密着法
フィルム密着法で用いる試験片は,次による。
a) 平板状の材料の平らな部分を50 mm±2 mm角(厚さ10 mm以内)の正方形に切り取り,これを標準
の大きさの試験片とする。
平板状の材料を50 mm±2 mm角(厚さ10 mm以内)にカットすることが難しい,又は不可能な場
9
R 1706:2020
合には,1/2のサイズ(厚さ10 mm以内)にした試験片を使用してもよい。試験片の大きさを小さく
した場合,密着フィルムの大きさも小さくする。表面積800 mm2〜1 600 mm2の密着フィルムをかぶせ
ることが可能な試験片の大きさであれば,ここに規定する形状及び大きさ以外の試験片を使用しても
よい。
b) これらの試験片を,無加工試験片は9個,光触媒抗ウイルス加工した試験片は6個準備する。無加工
試験片が準備できない場合は,ガラス板を使用する。微生物汚染と試験片との間の相互汚染に十分注
意する。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源で24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は試験前にエタノール又は70 %
エタノール水溶液を用いて消毒するなどによって,無菌化処理を行うことができる。
8.2
ガラス密着法
ガラス密着法で用いる試験片は,次による。
a) 繊維状の材料を50 mm±2 mm角の正方形に切り取り,これを標準の大きさの試験片とする。
b) これらの試験片を,無加工試験片は9個,光触媒抗ウイルス加工した試験片は6個準備する。微生物
汚染,試験片間の相互汚染及び汚れに十分注意する。
c) 無加工試験片が準備できない場合は,6.2.18に規定する綿標準布を使用してもよい。
綿標準布を無加工試験片として用いる場合,紫外放射照度によっては,試験成立条件を満足しない
場合があるので注意する。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源で24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は試験前に高圧蒸気殺菌などの
無菌化処理を行うことができる。
9
試験方法
9.1
一般事項
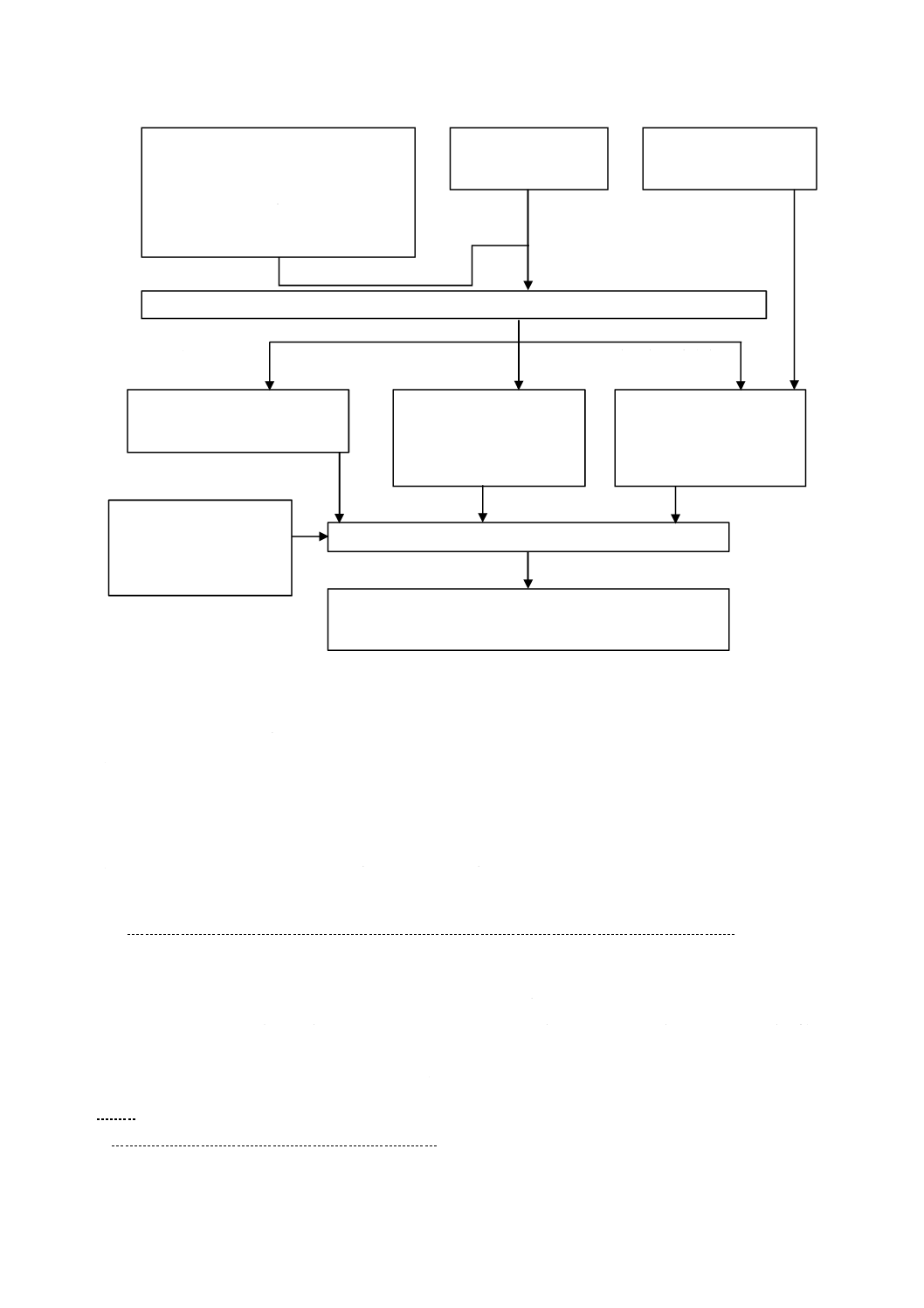
試験方法のフローチャートを,図1に示す。
試験片を取り扱う作業でSCDLP培地を加えるまでの作業を行うときに,安全キャビネット内に漏れる
光によって光触媒作用が働かないことを確実にするため,紫外放射照度計を用いて,安全キャビネットの
作業台上の紫外放射照度を測定する。紫外放射照度が0.001 mW/cm2以上の場合は,紫外放射照度が0.001
mW/cm2未満になるよう,要因を取り除いてから試験する。
10
R 1706:2020
バクテリオファージ
6.1.3
バクテリオファージストック液
の準備
↓
9.3
試験バクテリオファージ液の調製
方法
試験片
8
試験片
光照射条件
9.6
紫外光照射条件
9.4 a),b),c)又は9.5 a),b),c)
試験片への試験液の接種
接種直後の試験片
9.4 e)又は9.5 e) 洗い出し
接種後の試験片
9.6 d)
暗所保存
↓
9.4 e)又は9.5 e) 洗い出し
接種後の試験片
9.6 c)
光照射
↓
9.4 e)又は9.5 e)
洗い出し
細菌
6.1.2
細菌株の保存
↓
9.2
宿主菌液の調製方法
3個の無加工試験片
3個の加工試験片
3個の無加工試験片
3個の加工試験片
3個の無加工試験片
9.7
バクテリオファージ感染価の測定
10
試験結果の計算
↓
11
試験結果の報告
図1−試験方法のフローチャート
9.2
宿主菌液の調製方法
試験で用いる菌液の調製は,次による。
a) 6.1.2に規定する保存菌を3 mlのカルシウム添加LB培地に白金耳を用いて移植する。
b) 37 ℃±1 ℃で16時間〜24時間培養する。
c) b)で作成した培養後の菌液の約1/1 000をカルシウム添加LB培地に移植する。カルシウム添加LB培
地の量は,試験に必要な量によって変更することができる。
d) 37 ℃±1 ℃で菌の密度が5.0×108 cfu/ml〜2.0×109 cfu/mlになるまで培養する。
この手順は,濁度の測定とコロニー数との関係性を確立するために,数回行うことが望ましい。十
分なデータが得られた場合,その後は濁度の測定値に基づいて次の作業を行ってよい。
9.3
試験バクテリオファージ液の調製方法
試験で用いるバクテリオファージ液の調製は,次による。
a) 6.1.3に規定するバクテリオファージストック液を6.7×106 pfu/ml〜2.6×107 pfu/mlの感染価になるよ
うに1/500 NBで希釈し,試験液とする。バクテリオファージストック液を希釈するときは,試験管ミ
キサーを用いず,しっかりと手でかくはんすることが望ましい。
b) 試験液をすぐに使用しない場合,0 ℃に保存し,2時間以内に使用する。
9.4
フィルム密着法
フィルム密着法による試験準備は,次による。
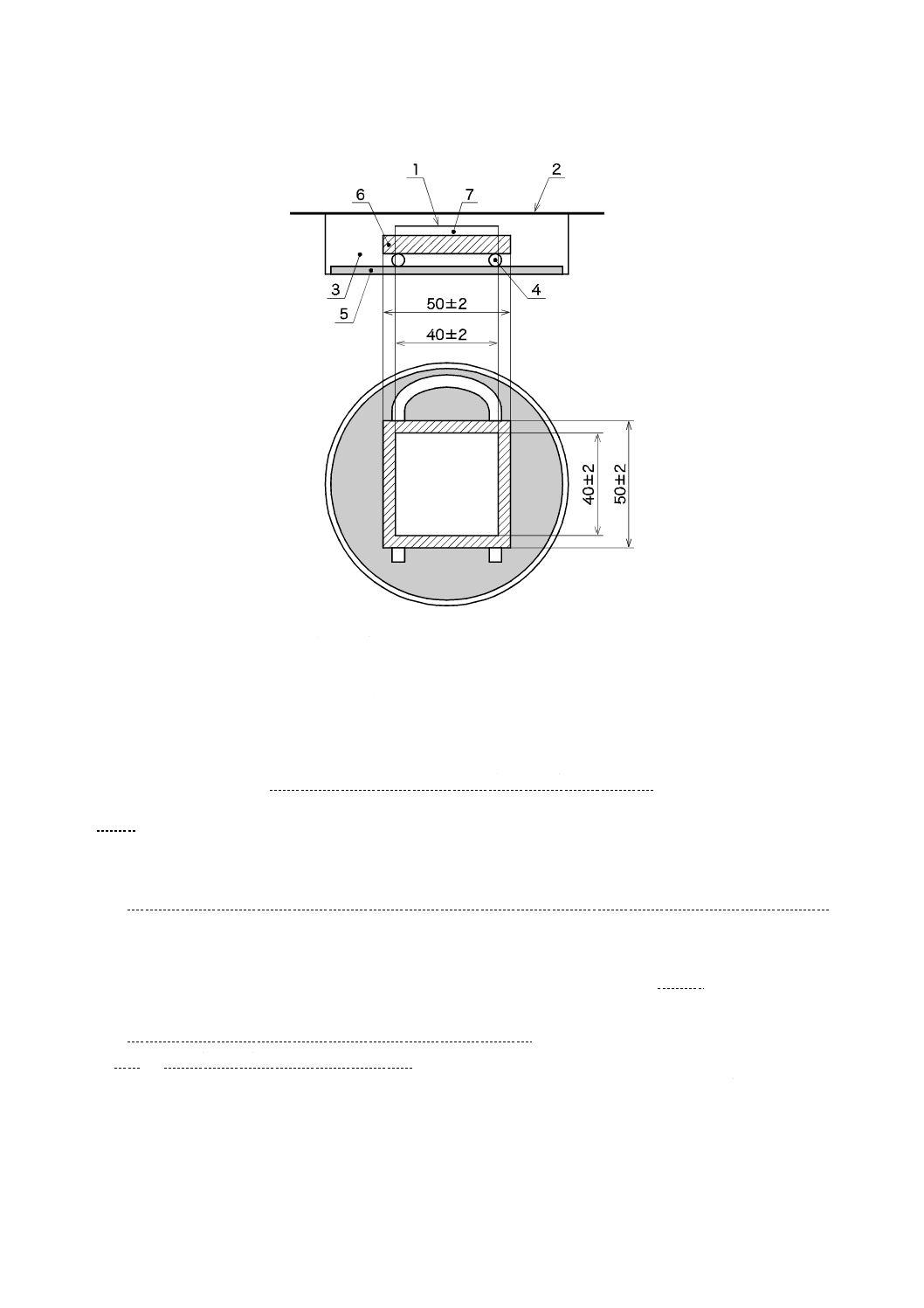
a) 滅菌済み保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙
11
R 1706:2020
とが触れないようガラス管又はガラス棒を置き,その上に光触媒抗ウイルス加工した面を上にして試
験片を置く(図2参照)。試験面は,光触媒抗菌加工した試験片の表面とする。内部まで光触媒抗菌加
工した試験片であっても,切断面は試験面としない。また,高圧蒸気殺菌によってろ紙が湿った場合
は,乾燥させてから使用する。
滅菌水の量は,入れすぎると保湿用ガラスが曇り,試験に影響するので,4 ml〜6 mlで十分である。
b) 9.3 a)に規定する試験液をピペットで0.15 ml採取し,a)で準備した各試験片に滴下する。滴下した試
験液の上に密着フィルムをかぶせ,試験液が密着フィルムの端からこぼれないように注意しながら試
験液が密着フィルム全体に行き渡るように軽く押さえ付ける。標準の大きさ以外の試験片の場合,試
験液の接種量は,被覆する密着フィルムに合わせて調製する[8.1 a)参照]。
密着フィルムは,あらかじめ裁断したものをエタノールを吸収させた局方ガーゼ若しくは脱脂綿を
用いて両面を拭くか,又はエタノールで両面を拭いた密着フィルムを無菌的に裁断したものを使用す
ることが望ましい。
規定に基づく試験液量を接種したとき,密着フィルム全体に行き渡らなかったり,密着フィルムの
端から試験液が漏れ出したりする場合がある。このような場合は,接種試験液量を規定量の2倍から
1/2を限度に調整してもよい。ただし,試験片に接種する試験液量を変更した場合においても,1試験
片当たり1.0×106 pfu〜4.0×106 pfuとする。この場合,試験液のバクテリオファージ濃度は,9.3 a)の
規定によらず,接種液量から換算して調整する。
c) 保存シャーレの上部に保湿用ガラスを置く。保湿用ガラスは,エタノールを吸収させた局方ガーゼ又
は脱脂綿で両面を拭いた後,十分に乾燥してから使用することが望ましい。
d) 試験液接種直後の感染価測定用の3個の無加工試験片を除いて(9.7参照),試験液を接種した後,速
やかに,9.6に規定する光照射試験を行う。
e) 試験液接種直後の3個の無加工試験片については,密着フィルム及び無加工試験片を滅菌ピンセット
を用い,試験液が漏れないように注意しながら,ストマッカー袋に入れる。10 mlのSCDLP培地を加
え,ストマッカー袋の外側から試験片とフィルムを手で十分もみ,試験液を洗い出す。この洗い出し
液は,速やかに9.7に規定する感染価の測定を行う。この方法と同等の結果が得られる場合は,スト
マッカー袋に代わるものを用いてもよい。
試験片の大きさによって,SCDLP培地10 mlで洗い出しが困難な場合は,液量を増やしてもよい。
12
R 1706:2020
単位 mm
1
密着フィルム
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験液
図2−フィルム密着法試験片及び保湿用ガラスの組立て
9.5
ガラス密着法
ガラス密着法による試験準備は,次による。
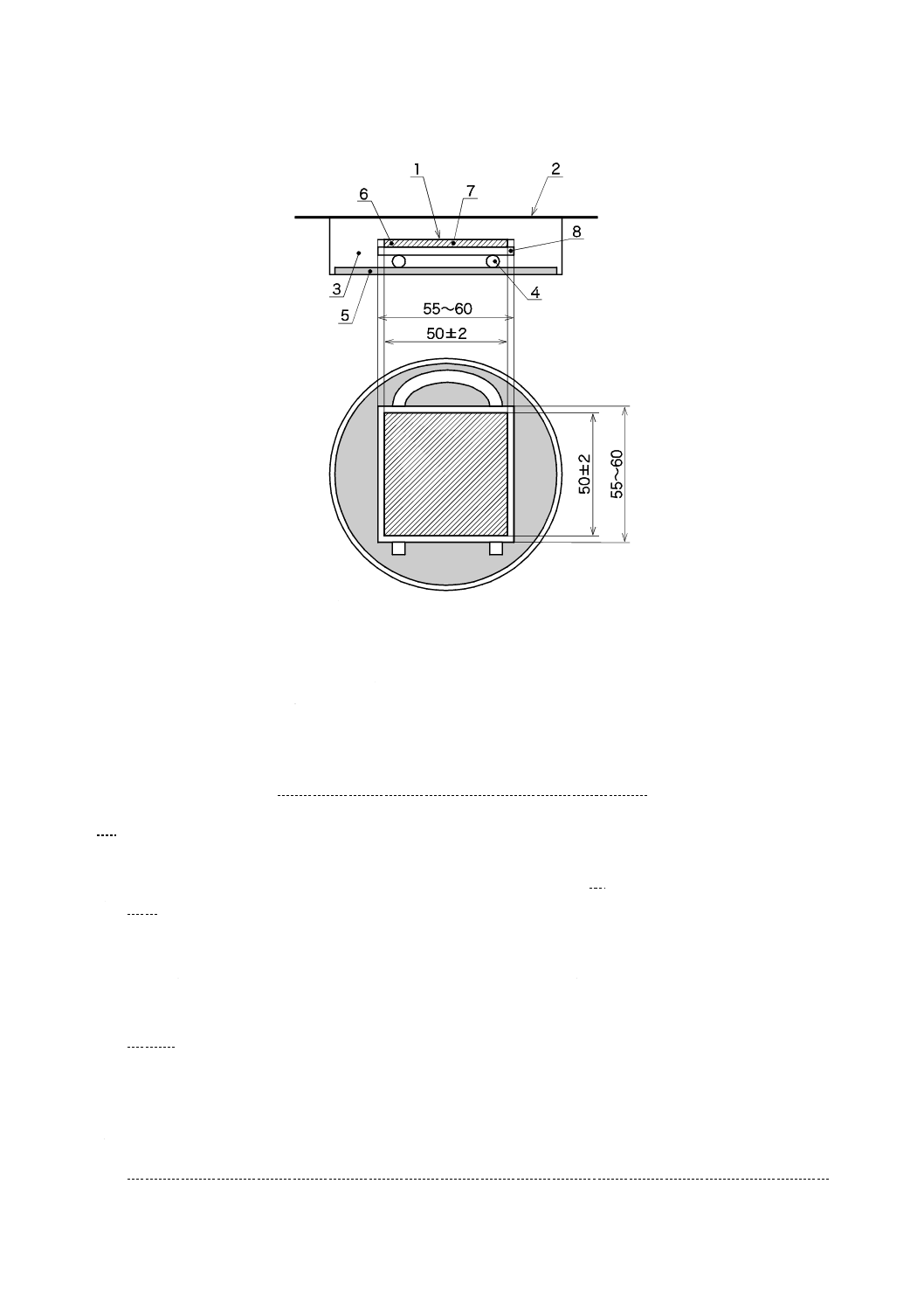
a) 滅菌済み保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙
とが触れないようガラス管又はガラス棒を置き,その上に一辺が55 mm〜60 mmの正方形の殺菌した
ガラス板を置く。その上に,光触媒抗ウイルス加工した面を上にして試験片を置く(図3参照)。高圧
蒸気殺菌によってろ紙が湿った場合は,乾燥させてから使用する。
滅菌水の量は,入れすぎると保湿用ガラスが曇り,試験に影響するので,4 ml〜6 mlで十分である。
また,ガラス板は,ガラスの全面をエタノールを吸収させた局方ガーゼ又は脱脂綿で軽く2回〜3回
拭いた後,十分に乾燥してから使用することが望ましい。
b) 9.3 a) に規定する試験液をピペットで0.15 ml採取し,これをa)によって準備した各試験片に滴下する。
滴下した試験液の上に滅菌した密着ガラスをかぶせ,試験液が密着ガラスの端からこぼれないように
注意しながら試験液が密着ガラス全体に行き渡るように軽く押さえ付けた後,保湿用ガラスを載せる
(図3参照)。この手順を試験に使用する試験片(可視光応答形光触媒抗菌加工した試験片は6個,無
加工試験片は9個)全てに行う。
13
R 1706:2020
密着ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いて,十分に乾燥してか
ら使用することが望ましい。
規定に基づく試験液量を接種したとき,試験片全体に行き渡らなかったり,試験片の端から試験液
が漏れ出したりする場合がある。このような場合は,接種試験液量を規定量の2倍から1/2を限度に
調整してもよい。ただし,試験片に接種する試験液は接種液量を変更した場合においても,1試験片
当たり1.0×106 pfu〜4.0×106 pfuとする。この場合,試験液のバクテリオファージ濃度は,9.3 a)の規
定によらず,接種液量から換算して調整する。
保湿用ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いて十分に乾燥してか
ら使用することが望ましい。
c) 試験片に試験液を十分に浸透させるために,非イオン界面活性剤0.05 %を含む試験液を用いてもよい。
試験菌液に非イオン界面活性剤を使用した場合は,その記録を試験報告書に記載する。
d) 試験液接種直後の感染価測定用の3個の無加工試験片を除いて(9.7参照),試験液を接種した後,速
やかに,9.6に規定する光照射試験を行う。
e) 試験液接種直後の3個の無加工試験片については,密着ガラス,無加工試験片及びガラス板を滅菌ピ
ンセットで試験液が漏れないように注意しながら,ストマッカー袋に入れる。20 mlのSCDLP培地を
加え,ストマッカー袋の外側から密着ガラス,試験片及びガラス板を手で十分もみ,試験液を洗い出
す。この洗い出し液は,速やかに9.7に規定する感染価の測定を行う。この方法と同等の結果が得ら
れる場合は,ストマッカー袋に代わるものを用いてもよい。
14
R 1706:2020
単位 mm
1
密着ガラス
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験液
8
ガラス板
図3−ガラス密着法試験片及び保湿用ガラスの組立て
9.6
紫外光照射条件
紫外光照射条件は,次による。
a) 試験装置内における紫外光照射時は,試験片周囲の温度を25 ℃±3 ℃に保つ。
b) JIS R 1702の9.4.1(紫外放射照度の測定及び試験片設置位置の準備)及び9.4.2(光照射条件)に規定
する方法によって,紫外放射照度の測定及び試験片設置の位置決めを行う。
c) 試験液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び光触媒抗ウイルス加工した試
験片3個)を,b)で準備した試験片設置位置へ置き,4時間光照射する。
光触媒材料の用いられる場所の実情を考慮して,光照射時間を2時間〜8時間の範囲で変更しても
よい。
d) 試験液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び光触媒抗ウイルス加工した試
験片3個)を,c)に規定する試験と同じ時間,7.11に規定する暗箱の中に保存する。
保存シャーレを覆う保湿用ガラスの代わりに,保存シャーレの蓋を用いてもよい。
e) c)及びd)に規定する試験片は,9.4 e)又は9.5 e)に規定する操作によって,試験液を洗い出す。この洗
い出し液は,速やかに9.7に規定する感染価の測定を行う。この方法と同等の結果が得られる場合は,
15
R 1706:2020
ストマッカー袋に代わるものを用いてもよい。
9.7
バクテリオファージ感染価の測定
感染価の測定は,次による。
a) 6.2.7に規定するカルシウム添加LB軟寒天培地を溶解し,約50 ℃にしておく。蓋付きの試験管に,
カルシウム添加LB軟寒天培地2.0 mlを必要数分注し,45 ℃±1 ℃に設定した恒温水槽で保温する。
b) 6.2.6に規定するカルシウム添加LB寒天平板培地を必要な個数用意し,37 ℃±1 ℃で加温しておく。
寒天平板培地の表面に凝縮水が残っている場合は,正確に感染価が測定できないので,安全キャビ
ネット内で表面を10分〜15分程度乾燥させてから使うとよい。凝縮水が残っていない場合は,省略
してもよい。
c) 洗い出し液又は9.3 a)に規定する試験液を1 ml滅菌ピペットでとる。6.2.9に規定するペプトン加生理
食塩水9.0 ml±0.1 mlが入った試験管に加え,試験管ミキサーを用いず,十分にかくはんする。洗い
出し液又は希釈液を直ちに大腸菌へ感染させない場合,洗い出し液を0 ℃に保存し2時間以内に,希
釈して感染に使用する。
d) c)の試験管から1.0 mlを新しいピペットでとり,ペプトン加生理食塩水9.0 ml±0.1 mlが入った別の試
験管に加え,再度,試験管を転倒混和するか,又は手で振ってかくはん混合する。
e) この操作を順次繰り返し,10倍希釈法による希釈系列を作製する。
f)
洗い出し液及び各希釈液を37 ℃±1 ℃で10分間温める。
g) 0.1 mlの大腸菌培養液[9.2 d)参照]をa)の試験管に加え,試験管ミキサーを用いず,十分にかくはん
する。
h) f)の洗い出し液及び各希釈液1.0 mlをg)の作業を行ったa)の試験管に加え,試験管ミキサーを用いず,
十分にかくはんする。
i)
h)で作成したものをあらかじめ温めておいたb)のカルシウム添加LB寒天平板培地に重層する。これ
をそれぞれの洗い出し液及び希釈液について,2枚作成する。
重層するときは,軟寒天培地の泡が入らないよう注意する。
j)
15分〜30分室温に静置する。
k) カルシウム添加LB軟寒天培地が固化したら,37 ℃±1 ℃で18時間±2時間培養する。培養するとき,
寒天培地は上向きで培養,下向きで培養のどちらでもよい。
l)
培養後,30 pfu〜300 pfuのプラークが現れた希釈系列のシャーレのプラーク数を測定する。
10 試験結果の計算
10.1 一般事項
試験結果は,次のように計算する。
a) 3個の試験片の感染価の平均値は,10.2に規定する方法で求めた数値を用いて計算し,抗ウイルス活
性値の計算時には,四捨五入しない数値を用いる。
b) 得られた抗ウイルス活性値は,小数点2桁目を四捨五入する。
c) 報告書に記載する平均値は,有効数字3桁目を四捨五入して,有効数字2桁とした数値とする。
注記 試験結果例を附属書Aに示す。
10.2 感染価の計算
感染価の計算は,式(1)による。洗い出し液1.0 ml中のプラーク数が30 pfu未満の場合は,測定したプラ
ーク数の平均値を用いて,感染価を算出する。また,洗い出し液1.0 mlを用いたシャーレからプラークが
16
R 1706:2020
認められない場合は,プラーク数の平均値に“1”を用いて感染価を算出する。
N=Z×DF×W ··········································································· (1)
ここに,
N: 感染価(pfu)
Z: 2枚のシャーレのプラーク数の平均値(pfu)
DF: 希釈倍率
W: 洗い出しに用いたSCDLP培地の液量(ml)
10.3 試験成立条件
次の4項目の試験成立条件を全て満たすとき,その試験は有効と判定する。全ての条件を満足しない場
合は,試験不成立と判定し,再度試験を実施する。
a) 無加工試験片の接種直後の感染価の対数値について,次の式(2)が成立する。
(Logmax−Logmin)/Logmean≦0.2 ························································· (2)
ここに, Logmax: 3個の試験片の感染価の常用対数値の最大値
Logmin: 3個の試験片の感染価の常用対数値の最小値
Logmean: 3個の試験片の感染価の常用対数値の平均値
b) 無加工試験片の接種直後の感染価の平均値は,1.0×106 pfu〜4.0×106 pfuである。
c) 無加工試験片の光照射後の感染価は,3個の値が全て1.0×104 pfu以上である。ただし,無加工試験片
にガラス板を用いた場合は,光照射後の感染価の値が全て1.0×105 pfu以上とする。
d) 無加工試験片の暗所に保存した後の感染価は,3個の値が全て1.0×104 pfu以上である。ただし,無加
工試験片にガラス板を用いた場合は,暗所に保存した後の感染価の値が全て1.0×105 pfu以上とする。
10.4 抗ウイルス活性値の計算
試験成立時の光触媒抗ウイルス加工材料の抗ウイルス活性値の計算は,式(3)による。
VL=log(BL/A)−log(CL/A)=log(BL/CL) ·············································· (3)
ここに,
VL: 紫外放射照度Lで光照射した光触媒抗ウイルス加工材料によ
る抗ウイルス活性値
L: 紫外放射照度(mW/cm2)
A: 無加工試験片の接種直後の3個の試験片の感染価の平均値
(pfu)
BL: 無加工試験片を紫外放射照度Lで光照射した後の3個の試験
片の感染価の平均値(pfu)
CL: 光触媒抗ウイルス加工した試験片を紫外放射照度Lで光照射
した後の3個の試験片の感染価の平均値(pfu)
10.5 光照射による抗ウイルス活性値の計算
光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値の計算は,式(4)による。
ΔV=log(BL/CL)−[log(BD/A)−log(CD/A)]=log(BL/CL)−log(BD/CD) ··········· (4)
ここに,
ΔV: 光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値
BD: 無加工試験片を暗所に保存した後の3個の試験片の感染価の
平均値(pfu)
CD: 光触媒抗ウイルス加工した試験片を暗所に保存した後の3個
の試験片の感染価の平均値(pfu)
10.6 暗所における抗ウイルス活性値の計算
光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値の計算は,式(5)による。
VD=log(BD/CD) ·········································································· (5)
ここに,
VD: 光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値
17
R 1706:2020
11 試験結果の報告
試験結果の報告には,次の事項を記載する(表2参照)。
a) 規格番号及び試験方法
b) 光触媒抗ウイルス加工した試験片及び無加工試験片の種類・大きさ・形状・厚さ
c) 光源の種類,製造業者名及び品番
d) 紫外放射照度計の製造業者名及び品番
e) 有機物を除去した場合の情報(光源の種類,製造業者名,品番,照射時間など)
f)
光照射条件(紫外放射照度及び光照射時間)
g) 密着フィルム又は密着ガラス及び保湿用ガラスの種類及び大きさ
h) 試験に用いたバクテリオファージ及び細菌の保存番号
i)
試験液の接種量及び感染価
j)
試験値(A,BL,CL,VL,BD,CD,ΔV及びハイブリッド光触媒抗ウイルス加工した試験片の場合は,
これらに加えてVD)
k) ガラス密着法の場合は,試験菌液に非イオン界面活性剤を添加した場合の情報(名称及び濃度)
l)
その他の必要な事項
表2−試験結果の報告例(フィルム密着法の場合)
項目
内容
規格番号及び試験方法
JIS R 1706,フィルム密着法
光触媒抗ウイルス加工した試験片の種類・大き
さ・形状・厚さ
光触媒フィルム,50 mm×50 mm×0.2 mm
無加工試験片の種類・大きさ・形状・厚さ
PETフィルム,50 mm×50 mm×0.2 mm
光源の種類
ブラックライト蛍光灯(○○電気,FL20̲BLB)
紫外放射照度計
紫外放射測定器(△△製作所,本体:UV-X,受光部:UV-Y)
有機物の除去方法
FL20̲BLB,1.0 mW/cm2で24時間予備照射
光照射条件
0.10 mW/cm2,4時間
密着フィルム,又は密着ガラスの種類
ポリプロピレンフィルム(□□商会),40 mm×40 mm
保湿用ガラスの種類
ほうけい酸ガラス
試験に用いたバクテリオファージの保存番号
Qβ(NBRC 20012)
試験に用いた細菌の保存番号
大腸菌(NBRC 106373)
接種量
0.15 ml
試験液の感染価(pfu/ml)
1.6×107
A
2.3×106
B0.10
1.8×106
C0.10
1.0×103
V0.10
3.2
BD
2.0×106
CD
1.8×106
ΔV
3.2
18
R 1706:2020
附属書A
(参考)
インフルエンザウイルス及びバクテリオファージQβに対する
光触媒の効果比較結果
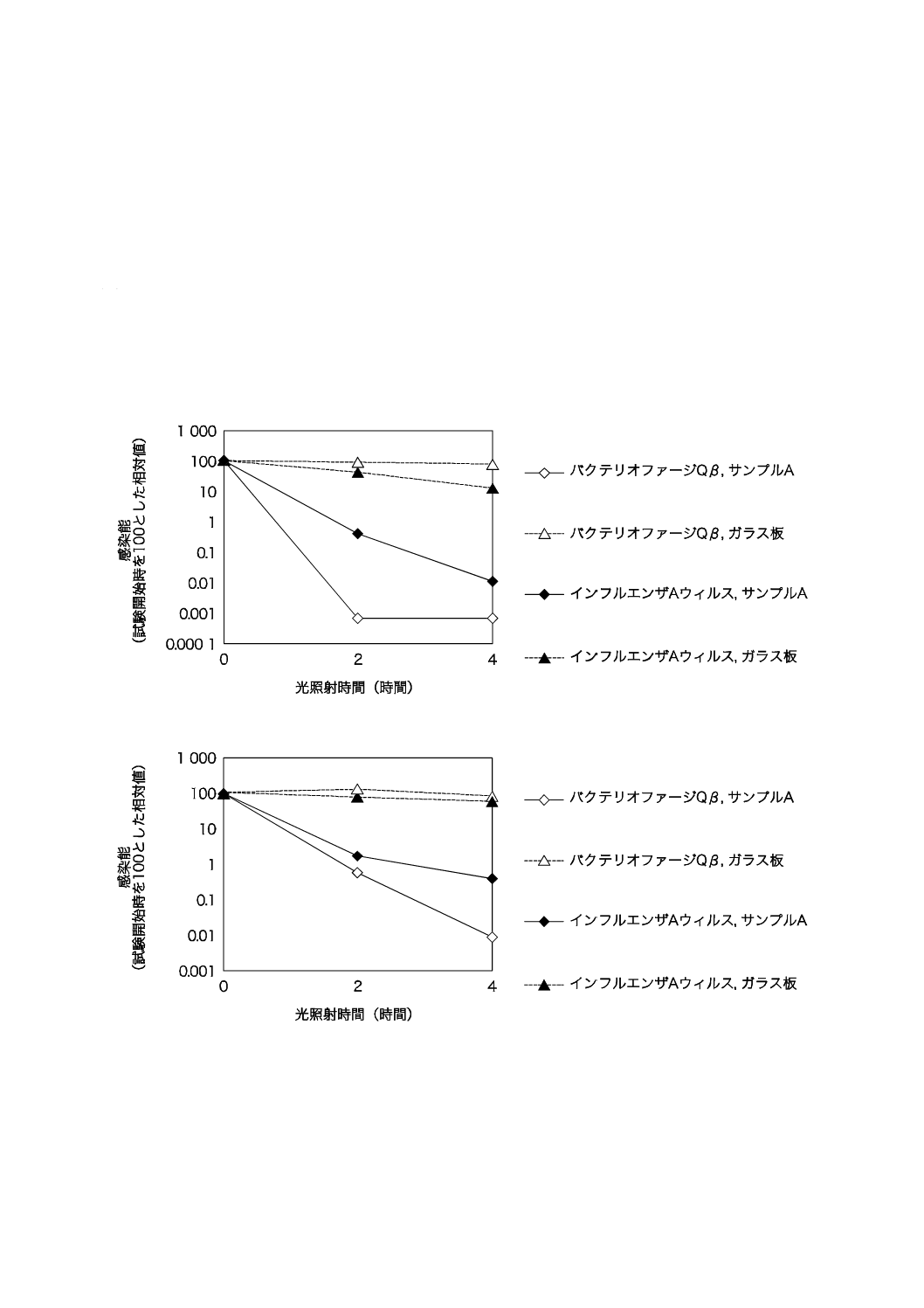
A.1 効果比較の例
光触媒の抗ウイルス性評価として,バクテリオファージQβがヒトに感染するウイルスの代用特性とし
て使用できることの情報として,インフルエンザウイルス及びバクテリオファージQβに対するTiO2を用
いて光触媒の効果を比較した結果の例を示す。紫外放射照度0.10 mW/cm2の結果を図A.1に,紫外放射照
度0.01 mW/cm2の結果を図A.2に示す。
図A.1−サンプルAを用いて紫外放射照度0.10 mW/cm2で評価した結果
図A.2−サンプルAを用いて紫外放射照度0.01 mW/cm2で評価した結果
注記 用いたバクテリオファージは,1/500 NBを用いて試験液を調製した。インフルエンザウイルス
は,りん酸緩衝生理食塩水(PBS)を用いて調製し,ウイルスの活性を保つために,たんぱく
質濃度が0.2 mg/mlになるようにウシ血清アルブミンを添加して試験液を調製した。
19
R 1706:2020
附属書B
(参考)
ATCC 23631-B1及びNBRC 20012株を用いた光触媒による
抗バクテリオファージQβの効果比較結果
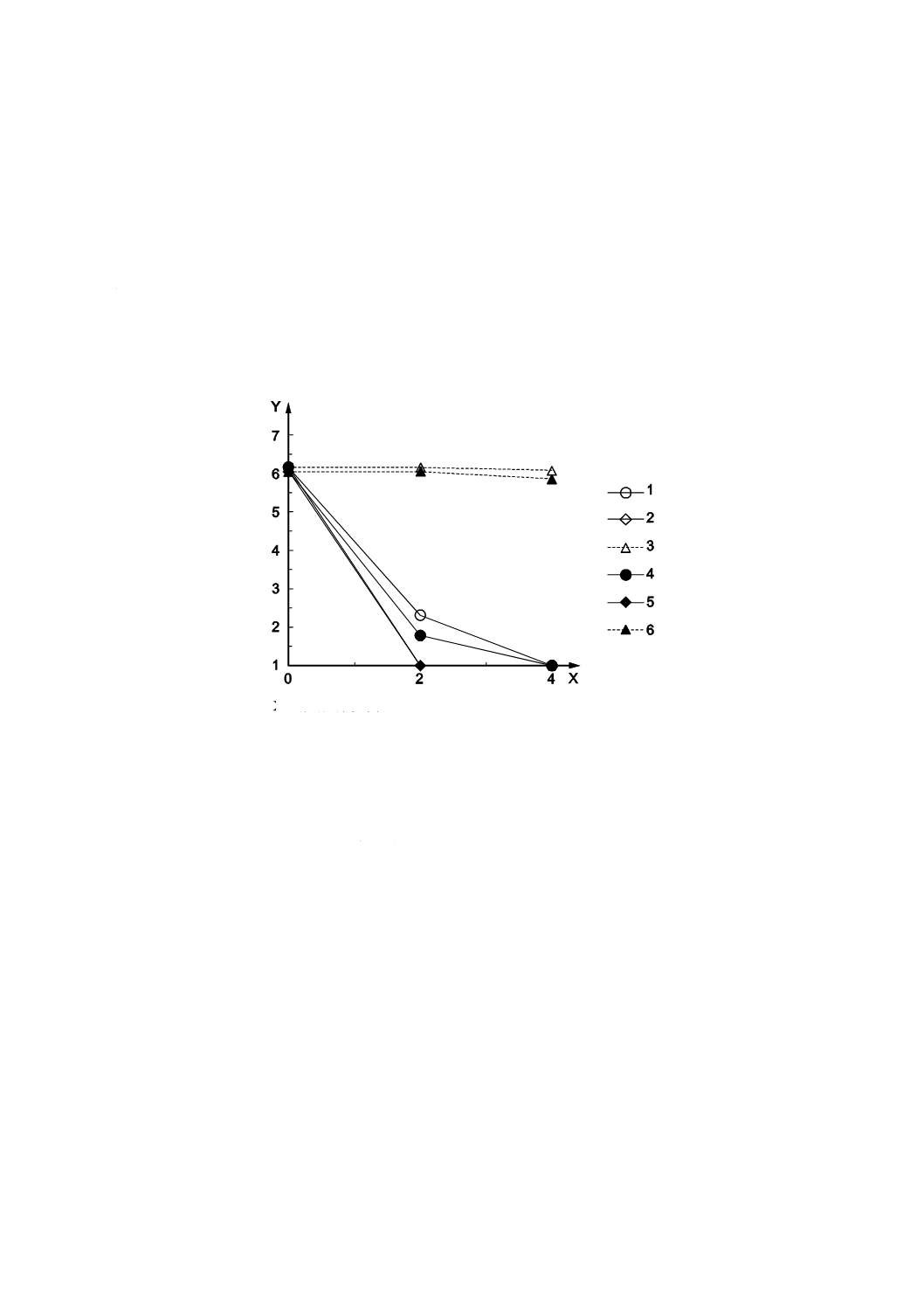
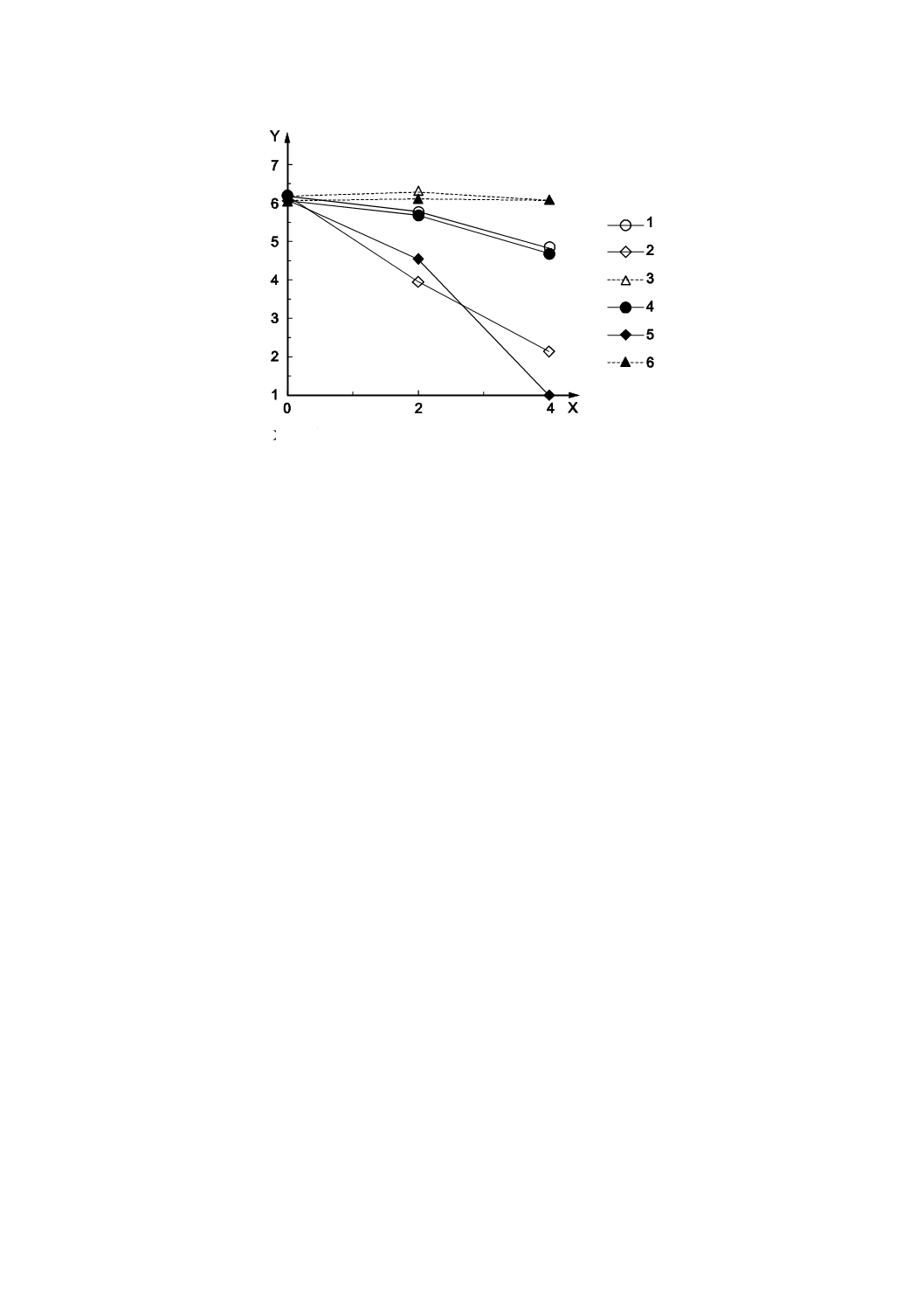
B.1
効果比較の例
バクテリオファージQβ(ATCC 23631-B1及びNBRC 20012)に対する二酸化チタン(TiO2)を用いて光
触媒の効果を比較した結果の例を示す。紫外放射照度0.10 mW/cm2の結果を図B.1に,紫外放射照度0.01
mW/cm2の結果を図B.2に示す。
X 照射時間(h)
Y バクテリオファージ感染価(log10)
1
NBRC,サンプルA
2
NBRC,サンプルB
3
NBRC,ガラス板
4
ATCC,サンプルA
5
ATCC,サンプルB
6
ATCC,ガラス板
図B.1−ATCC 23631-B1及びNBRC 20012を紫外放射照度0.10 mW/cm2で評価した結果
20
R 1706:2020
X 照射時間(h)
Y バクテリオファージ感染価(log10)
1
NBRC,サンプルA
2
NBRC,サンプルB
3
NBRC,ガラス板
4
ATCC,サンプルA
5
ATCC,サンプルB
6
ATCC,ガラス板
図B.2−ATCC 23631-B1及びNBRC 20012を紫外放射照度0.01 mW/cm2で評価した結果
21
R 1706:2020
附属書JA
(参考)
カルシウム添加LB寒天平板培地を用いたバクテリオファージの調製方法
JA.1 一般事項
バクテリオファージの準備方法の参考として,カルシウム添加LB寒天平板培地を用いたバクテリオフ
ァージ液の調製方法の例を記載する。
使用する寒天のメーカー及びグレードによって,バクテリオファージ液の使用可能期間が異なることが
あるため,事前に検討しておくことが望ましい。
JA.2 バクテリオファージの調製(寒天平板培地法)
バクテリオファージの準備は,次による。
a) 保存大腸菌株から6.2.3のカルシウム添加LB培地3 ml〜5 mlに1白金耳移植し,温度37 ℃±1 ℃に
設定した培養器で12時間〜18時間培養する。
b) この培養菌から試験に必要な量の新たなカルシウム添加LB培地に1/1 000量を移植し,温度37 ℃±
1 ℃に設定した培養器で,5.0×108 cfu/ml〜2.0×109 cfu/mlになるまで培養する。
あらかじめ,大腸菌数及び大腸菌液の透過率(濁度)の関係を分光光度計などで求めておくとよい。
大腸菌液が準備できるまでの間に,次のc)〜f)の作業をしておく。
c) g)の感染時にm.o.i.が0.1程度になるよう,バクテリオファージ液をペプトン加生理食塩水で希釈し,
感染用バクテリオファージ液を調製しておく。バクテリオファージ液を希釈するときには,試験管ミ
キサーを用いず,十分にかくはんする。
d) 保存シャーレに6.2.6のカルシウム添加LB寒天平板培地を15 ml〜20 ml分注して作製した寒天平板培
地を必要な枚数用意し,37 ℃±1 ℃で加温しておく。
注記 必要に応じて,異なるサイズのシャーレを用いてもよい。
e) 保存シャーレ1枚当たり6.2.7のカルシウム添加LB軟寒天培地2.0 mlを分注した試験管を用意し,
45 ℃±1 ℃に設定した恒温水槽で保温する。
f)
g)の作業をする10分〜20分程度前に,c)の感染用バクテリオファージ液の入った試験管を37 ℃±
1 ℃の培養器又は恒温水槽で加温しておく。c)の感染用バクテリオファージ液は37 ℃では不安定なの
で,30分以上加温しない。
g) e)の試験管に保存シャーレ1枚当たりb)の大腸菌培養液0.1 mlを添加し,試験管ミキサーを用いず,
十分にかくはんする。次いで,f)の感染用バクテリオファージ液1.0 mlを添加し,再度かくはんして
から,d)のカルシウム添加LB寒天平板培地に重層する。重層するときは,軟寒天培地の泡が入らな
いよう注意する。このとき,b)の大腸菌培養液についても試験管ミキサーを用いず,十分にかくはん
する。また,バクテリオファージを感染させる時点の大腸菌生菌数を測定する。具体的には,バクテ
リオファージを感染させる直前に大腸菌液を1.0 ml抜き取り,10倍希釈法で希釈し,希釈液をLB寒
天培地に混釈し,37 ℃±1 ℃で24時間培養して算出する。
接種したファージ感染価と測定した大腸菌生菌数とから,m.o.i.を算出しておく。
h) g)の平板培地を温度37 ℃±1 ℃に設定した培養器で16時間〜24時間培養する。寒天培地は,上向き
で培養しても下向きで培養してもよい。
22
R 1706:2020
i)
保存シャーレ1枚当たりカルシウム添加LB培地2.0 mlを注ぎ,平板培地を4 ℃±1 ℃で,翌日まで
冷蔵保存する。液体培地がこぼれないよう,シャーレをシールするのがよい。
j)
スクレバーなどを使って,液体培地に重層した軟寒天培地部分を試験管に回収する。
k) j)を遠心分離(4 ℃,10 000 x g,20分)した後,上清を回収する。
遠心後の沈さ(渣)と上清との界面には,溶菌した大腸菌の層が存在するので,界面近くまで上清
を取らないよう注意深く作業する。
l)
上清をポアサイズが0.22 μm径のポリビニリデンフルオライド(PVDF)製又はポリエーテルスルホン
(PES)製ディスポーザブル・メンブレン・フィルタでろ過する。
注記1 25 mm径のディスポーザブル・メンブレン・フィルタ1個で,約10 mlの上清をろ過でき
る。
注記2 保存シャーレ1枚で,約2 mlのバクテリオファージ液が調製できる。
m) ろ過液を精製バクテリオファージ液として,4 ℃±1 ℃又−80 ℃で保存する。
23
R 1706:2020
参考文献
[1] JIS L 1916 繊維製品の白色度測定方法
注記 対応国際規格:ISO 105-F,Textiles−Tests for colour fastness−Part F: Standard adjacent fabrics
[2] JIS Z 8703 試験場所の標準状態
注記 対応国際規格:ISO 554,Standard atmospheres for conditioning and/or testing−Specifications
[3] JIS K 7350-3 プラスチック−実験室光源による暴露試験方法−第3部:紫外線蛍光ランプ
注記 対応国際規格:ISO 4892-3,Plastics−Methods of exposure to laboratory light sources−Part 3:
Fluorescent UV lamps
[4] JIS K 8951 硫酸(試薬)
注記 対応国際規格:ISO 6353-2,Reagents for chemical analysis−Part 2: Specifications−First series
[5] JIS K 8342 酸化りん(V)(試薬)
注記 対応国際規格:ISO 6353-3,Reagents for chemical analysis−Part 3: Specifications−Second
series
[6] JIS R 1752 ファインセラミックス−可視光応答形光触媒抗菌加工材料の抗菌性試験方法及び抗菌
効果
注記 対応国際規格:ISO 17094,Fine ceramics (advanced ceramics, advanced technical ceramics)−
Test method for antibacterial activity of semiconducting photocatalytic materials under indoor
lighting environment
[7] JIS R 1756 ファインセラミックス−可視光応答形光触媒材料の抗ウイルス性試験方法−バクテリ
オファージQβを用いる方法
注記 対応国際規格:ISO 18071,Fine ceramics (advanced ceramics, advanced technical ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials under indoor lighting
environment−Test method using bacteriophage Q-beta
[8] ISO 10705-1,Water quality−Detection and enumeration of bacteriophages−Part 1: Enumeration of
F-specific RNA bacteriophages
[9] Ishiguro H, Yao Y, Nakano R, Hara M, Sunada K, Hashimoto K, Kajioka J, Fujishima A, Kubota Y.
Photocatalytic activity of Cu2+/TiO2-coated cordierite foam inactivates bacteriophages and Legionella
pneumophila. Applied Catalysis B: Environmental. 129: 56-61, 2013.
[10] Ishiguro H, Nakano R, Yao Y, Kajioka J, Fujishima A, Kubota Y. Inactivation of Qβ bacteriophage by
photocatalysis using TiO2 thin film under weak with long wavelength UV irradiation. Photochemical and
Photobiological Science. 10: 1825-1829, 2011.
[11] Watanabe I, Miyake T, Sakurai T, Shiba T, Ohno T. Isolation and grouping of RNA phtages. Proceedings of
the Japan Academy. 43: 204-209, 1967.
[12] 西原徹,渡辺格.大腸菌ファージQβの生成とその性質.ウイルス,16:1-6,1966.
[13] 病原体等安全管理規程
[14] 公益社団法人日本薬学会編 衛生試験法・注解(2015)
[15] 厚生労働省監修 食品衛生検査指針微生物編(2015)
24
R 1706:2020
附属書JB
(参考)
JISと対応国際規格との対比表
JIS R 1706:2020 ファインセラミックス−光触媒材料の抗ウイルス性試験方法
−バクテリオファージQβを用いる方法
ISO 18061:2014,Fine Ceramics (Advanced Ceramics, Advanced Technical Ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials−Test
method using bacteriophage Q-beta
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 光触媒を含有する加工
材料及び表面に光触媒
加工を含む材料の抗ウ
イルス性試験方法・抗
ウイルス活性値の求め
方について規定
1
JISとほぼ同じ
追加
平板状及びISO規格には規定されていない繊
維状に加工できるものについてこの試験法が
使用できることを追加した。
ISO規格の改正時に追加するこ
とを提案する。
追加
可視光応答形光触媒の抗ウイルス性能を試験
する場合にはJIS R 1756を用いることを追加
した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3 用語及び
定義
3.1
光触媒
削除
JIS R 1702を引用しているため削除した。
実質的な技術的差異はない。
3.2
光触媒材料
削除
JIS R 1600を引用しているため削除した。
実質的な技術的差異はない。
3.4 感染価
−
−
追加
細菌に感染して増殖可能なバクテリオファー
ジ粒子の数の規定として追加した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.5 光触媒抗ウイルス
加工
−
−
追加
光触媒の抗ウイルス機能を利用するために,
光触媒で抗ウイルス加工することとその分類
を追加した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.6 単味光触媒抗ウイ
ルス加工
−
−
追加
光触媒抗ウイルス加工の方法と内容を追加し
た。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.7 ハイブリッド光触
媒抗ウイルス加工
−
−
追加
暗所においても抗ウイルス効果をもつ光触媒
抗ウイルス加工の方法と内容を追加した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
2
R
1
7
0
6
:
2
0
2
0
25
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及び
定義(続き)
3.8 光触媒抗ウイルス
加工材料
−
−
追加
光触媒抗ウイルス加工した膜状,平板状,繊
維状などの材料を追加した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.9 フィルム密着法
−
−
追加
ISO規格の試験方法をフィルム密着法とし
て,名称を追加した。
ISO規格の改正時に,フィルム密
着法を追加することを提案する。
3.10 ガラス密着法
−
−
追加
ガラス密着法を規定するため,従来のISO規
格試験をフィルム密着法とし,試験法を区別
するために追加した。
ISO規格の改正時に,ガラス密着
法を追加することを提案する。
3.11 光触媒抗ウイル
ス加工材料の抗ウイル
ス活性値
3.6
JISとほぼ同じ
変更
ISO規格では光触媒抗ウイルス活性値として
いるが,JISでは光触媒抗ウイルス加工材料
の抗ウイルス活性値とし,光触媒抗ウイルス
加工した材料と無加工材料との感染価の対数
値の差と記載を変更した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.12 光触媒抗ウイル
ス加工材料の光照射に
よる抗ウイルス活性値
3.7
JISとほぼ同じ
変更
ISO規格では紫外光照射による光触媒抗ウイ
ルス活性値としているが,JISでは光触媒抗
ウイルス加工材料の光照射による抗ウイルス
活性値とし,記載を変更した。
規格使用者の理解のため,JISに
追加している。実質的な技術的差
異はない。
3.13 光触媒抗ウイル
ス加工材料の暗所にお
ける抗ウイルス活性値
−
−
追加
暗所に保存した後の抗ウイルス活性値を追加
した。
ISO規格の改正時に追加するこ
とを提案する。
4 記号及び
単位
4
JISとほぼ同じ
変更
ISO規格では光触媒加工試験片としている
が,JISでは光触媒抗ウイルス加工した試験
片と記載を変更した。
規格使用者が分かりやすくする
ために記載した。実質的な技術的
差異はない。
4
JISとほぼ同じ
変更
ISO規格には記載がないが,JISでは各値で3
試験片の感染価を用いることに記載を変更し
た。
規格使用者が分かりやすくする
ために記載した。実質的な技術的
差異はない。
W:洗い出しに用いた
SCDLP培地の液量
(ml)
−
−
追加
ISO規格には記載がないが,JISではガラス
密着法を規定することで,洗い出し液量が変
わるため,追加した。
ISO規格の改正時に,ガラス密着
法を追加することを提案する。
2
R
1
7
0
6
:
2
0
2
0
26
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5 測定原理
5
JISとほぼ同じ
追加
従来のISO規格をJISではフィルム密着法と
し,繊維状材料についてはガラス密着法とし
て,繊維状材料に適用できることを追加した。
ISO規格の改正時に,追加するこ
とを提案する。
6 材料
6.1.1 試験に用いるバ
クテリオファージ及び
細菌株
6.1.1
JISとほぼ同じ
追加
バイオセーフティレベル1の設備を用いるこ
とを追加した。
実質的な技術的差異はない。
6.1.1 試験に用いるバ
クテリオファージ及び
細菌株
6.1.1
−
追加
バクテリオファージQβの感染が可能な他の
大腸菌株の使用を追加した。
ISO規格の改正時に追加するこ
とを提案する。
6.1.2 細菌株の保存
6.1.2
−
変更
ISO規格では細菌の準備となっているが,JIS
では細菌株の保存と変更した。
実質的な技術的差異はない。
6.1.2 細菌株の保存
6.1.2
−
追加
JIS L 1902の引用を追加した。
ISO規格の改正時にJIS L 1902
にある保管方法を追加すること
を提案する。
6.1.2 細菌株の保存
6.1.2
−
追加
LB寒天斜面培地に加えて,LB寒天培地で培
養することを追加した。
ISO規格の改正時に培養方法を
追加することを提案する。
6.1.2 細菌株の保存
6.1.2
−
追加
菌株の使用回数について,詳細を追加した。 実質的な技術的差異はない。
6.1.3 バクテリオファ
ージストック液の準備
6.1.3
JISとほぼ同じ
変更
バクテリオファージストックについての注記
をJISでは本文に記載した。
実質的な技術的差異はない。
6.2 試薬及び材料
6.2
JISとほぼ同じ
変更
ISO規格では培地としているが,JISでは試
薬及び材料と変更した。
実質的な技術的差異はない。
6.2 試薬及び材料
6.2.1
JISとほぼ同じ
変更
ISO規格では6.2.1としているが,JISでは6.2
に含めることとし,箇条番号を変更した。
実質的な技術的差異はない。
6.2.1 1/500濃度普通ブ
イヨン培地
6.2.2
JISとほぼ同じ
変更
JIS Z 2801を引用するように変更した。
実質的な技術的差異はない。
6.2.2 0.2 mol/lカルシウ
ム水溶液
6.2.3
JISとほぼ同じ
変更
ISO規格では100 mlで調製するが,JISでは
他の試薬調製に合わせて1 000 mlの調製方法
に変更した。
実質的な技術的差異はない。
6.2.2 0.2 mol/lカルシウ
ム水溶液
6.2.3
JISとほぼ同じ
追加
ガラス製ねじ口瓶などを用いてもよいことを
追加した。
実質的な技術的差異はない。
2
R
1
7
0
6
:
2
0
2
0
27
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 材料
(続き)
6.2.3 カルシウム添加
LB培地
6.2.4
JISとほぼ同じ
変更
ISO規格ではペプトンを使用しているが,JIS
ではトリプトンを用いることに変更した。
現状で使用されている組成に変
更しており,ISO規格改正時に変
更することを提案する。
6.2.3 カルシウム添加
LB培地
6.2.4
JISとほぼ同じ
追加
ガラス製ねじ口瓶などを用いてもよいことを
追加した。
実質的な技術的差異はない。
6.2.3 カルシウム添加
LB培地
6.2.4
JISとほぼ同じ
追加
JISではカルシウム水溶液を添加する際の温
度を追加した。
温度の規定を追加したことにつ
いて,ISO規格改正時に変更する
ことを提案する。
6.2.4 寒天
6.2.5
JISとほぼ同じ
変更
JIS K 8263を引用することを追加した。
実質的な技術的差異はない。
6.2.5 LB寒天平板培地
6.2.6
JISとほぼ同じ
変更
ISO規格ではペプトンを用いているが,JIS
ではトリプトンを用いることに変更した。
現状で使用されている組成及び
方法に変更しており,ISO規格改
正時に変更することを提案する。
6.2.5 LB寒天平板培地
6.2.6
JISとほぼ同じ
追加
ガラス製ねじ口瓶などを用いてもよいことを
追加した。
実質的な技術的差異はない。
6.2.5 LB寒天平板培地
6.2.6
JISとほぼ同じ
変更
ISO規格では沸騰水にて試薬を溶解するが,
JISでは現状に合わせて溶解方法を変更した。
実質的な技術的差異はない。
6.2.6 カルシウム添加
LB寒天平板培地
6.2.7
JISとほぼ同じ
変更
ISO規格ではペプトンを用いているが,JIS
ではトリプトンを用いることに変更した。
現状で使用されている組成及び
方法に変更しており,ISO規格改
正時に変更することを提案する。
6.2.6 カルシウム添加
LB寒天平板培地
6.2.7
JISとほぼ同じ
追加
高圧蒸気殺菌時に,ガラス製ねじ口瓶などを
用いてもよいことを追加した。
実質的な技術的差異はない。
6.2.6 カルシウム添加
LB寒天平板培地
6.2.7
JISとほぼ同じ
変更
ISO規格では沸騰水にて試薬を溶解するが,
JISでは現状に合わせて溶解方法を変更した。
ISO規格改正時に変更すること
を提案する。
6.2.6 カルシウム添加
LB寒天平板培地
6.2.7
−
追加
JISではカルシウム水溶液を添加する際の温
度を追加した。
温度の規定を追加したことにつ
いて,ISO規格改正時に変更する
ことを提案する。
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
JISとほぼ同じ
変更
ISO規格ではペプトンを用いているが,JIS
ではトリプトンを用いることに変更した。
現状で使用されている組成及び
方法に変更しており,ISO規格改
正時に変更することを提案する。
2
R
1
7
0
6
:
2
0
2
0
28
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 材料
(続き)
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
JISとほぼ同じ
変更
ISO規格で使用されている寒天濃度をJISで
は変更した。
現状で使用されている組成及び
方法に変更しており,ISO規格改
正時に変更することを提案する。
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
JISとほぼ同じ
変更
ISO規格で使用されている寒天以外の試薬組
成をJISの6.2.6に合わせるように変更した。
現状で使用されている組成及び
方法に変更しており,ISO規格改
正時に変更することを提案する。
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
JISとほぼ同じ
追加
高圧蒸気殺菌時に,ガラス製ねじ口瓶などを
用いてもよいことを追加した。
実質的な技術的差異はない。
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
JISとほぼ同じ
変更
ISO規格では沸騰水にて試薬を溶解するが,
JISでは現状に合わせて溶解方法を変更した。
ISO規格改正時に変更すること
を提案する。
6.2.7 カルシウム添加
LB軟寒天培地
6.2.8
−
追加
JISではカルシウム水溶液を添加するときの
温度を追加した。
温度の規定を追加したことにつ
いて,ISO規格改正時に変更する
ことを提案する。
6.2.7カルシウム添加
LB軟寒天培地
6.2.8
−
変更
寒天培地についての注記をJISでは本文に記
載した。
実質的な技術的差異はない。
6.2.8 SCDLP培地
6.2.9
JISとほぼ同じ
追加
JIS Z 2801を引用するように変更した。
実質的な技術的差異はない。
6.2.9 ペプトン加生理
食塩水
6.2.10
JISとほぼ同じ
変更
JIS L 1902を引用するように変更した。
引用では,現状で使用されている
組成に変更しており,ISO規格改
正時に変更することを提案する。
6.2.10 LB寒天斜面培
地
−
−
追加
JISでは斜面培地の詳細な作成方法を追加し
た。
ISO規格改正時に追加すること
を提案する。
6.2.11 塩化カルシウム
二水和物(CaCl2・
2H2O)
−
−
追加
JIS K 8122を引用するように追加した。
実質的な技術的差異はない。
6.2.12 精製水
−
−
追加
JIS K 0557を引用するように追加した。
実質的な技術的差異はない。
6.2.13 塩化ナトリウム
(NaCl)
−
−
追加
JIS K 8150を引用するように追加した。
実質的な技術的差異はない。
6.2.14 水酸化ナトリウ
ム(NaOH)
−
−
追加
JIS K 8576を引用するように追加した。
実質的な技術的差異はない。
6.2.15 塩酸(HCl)
−
−
追加
JIS K 8180を引用するように追加した。
実質的な技術的差異はない。
2
R
1
7
0
6
:
2
0
2
0
29
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 材料
(続き)
6.2.16 エタノール
(C2H5OH)
−
−
追加
JIS K 8101を引用するように追加した。
実質的な技術的差異はない。
6.2.17 非イオン界面活
性剤
−
−
追加
JIS R 1702を引用するように追加した。
実質的な技術的差異はない。
6.2.18 綿標準布
−
−
追加
ISO規格には規定されていないガラス密着法
で使用する綿標準布をJIS L 0803を引用する
よう追加した。
ISO規格改正時に追加すること
を提案する。
6.3 殺菌方法
−
−
追加
高圧蒸気殺菌方法について,JIS Z 2801を引
用するように追加した。
規格使用者が分かりやすくする
ために記載した。実質的な技術的
差異はない。
7 装置及び
機器
7.1 試験装置
7.1
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
7.2 密着フィルム
7.2
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
7.3 密着ガラス
−
−
追加
ISO規格には規定されていないガラス密着法
で使用するガラスをJIS R 1702を引用するよ
う追加した。
ISO規格改正時に追加すること
を提案する。
7.4 保湿用ガラス
7.3
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
7.5 保存シャーレ
−
−
追加
JIS K 0950を引用するよう追加した。
実質的な技術的差異はない。
7.6 調湿用ろ紙
7.5
JISとほぼ同じ
変更
JIS P 3801を引用するように変更した。
実質的な技術的差異はない。
7.7 ガラス管・ガラス
棒
7.4
JISとほぼ同じ
変更
JIS R 3644及びJIS R 3645を引用するように
変更した。
実質的な技術的差異はない。
7.8 光源
7.6
JISとほぼ同じ
変更
JIS R 1709を引用するように変更した。
実質的な技術的差異はない。
7.9 紫外放射照度計
7.7
JISとほぼ同じ
変更
JIS R 1709を引用するように変更した。
実質的な技術的差異はない。
7.10 金属製遮光板
7.8
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
7.11 暗箱
−
−
追加
暗所保管に使用する暗箱について,JIS R
1702を引用して追加した。
ISO規格改正時に改正すること
を提案する。
7.12 減菌シリンジフ
ィルタ
7.10
−
変更
シリンジフィルタについての注記をJISでは
本文に記載した。
実質的な技術的差異はない。
7.14 安全キャビネッ
ト
−
−
追加
JIS K 3800を引用するよう追加した。
実質的な技術的差異はないため,
特に対応は必要ない。
2
R
1
7
0
6
:
2
0
2
0
30
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7 装置及び
機器(続き)
7.15 ピペット
−
−
追加
JIS K 0970又はJIS R 3505を引用するよう追
加した。
実質的な技術的差異はないため,
特に対応は必要ない。
7.16 化学はかり
−
−
追加
JIS K 0050を引用するよう追加した。
実質的な技術的差異はないため,
特に対応は必要ない。
7.17 pH計
−
−
追加
JIS Z 8802を引用するよう追加した。
実質的な技術的差異はないため,
特に対応は必要ない。
8 試験片
8.1 フィルム密着法
8
JISとほぼ同じ
追加
ISO規格の試験方法をフィルム密着法とし
て,名称を追加した。
試験片についての注記をJISでは本文に記載
した。
ISO規格改正時に追加すること
を提案する。
8.2 ガラス密着法
−
−
追加
JISではガラス密着法を規定するため,ガラ
ス密着法で用いる試験片について追加した。
ISO規格改正時に追加すること
を提案する。
9 試験方法 9.1 一般事項
9.1
JISとほぼ同じ
追加
ISO規格のフローチャートに加えて,作業中
の紫外放射照度が0.001 mW/cm2未満となる
ようにすることを追加した。
ISO規格改正時に追加すること
を提案する。
9.2 宿主菌液の調製方
法
9.2
JISとほぼ同じ
追加
試験の量によって,培地量を変更できること
を追加した。
手順についての注記をJISでは本文に記載し
た。
実質的な技術的差異はない。
9.3 試験バクテリオフ
ァージ液の調製方法
9.3
JISとほぼ同じ
変更
ISO規格では1.0 pfu/ml×107 pfu/ml〜4.0
pfu/ml×107 pfu/mlに調製するように記述され
ているが,それを0.15 ml接種すると試験範囲
外の濃度になるため,JISでは6.7×106 pfu/ml
〜2.6×107 pfu/mlに調製するように変更し
た。
希釈についての注記をJISでは本文に記載し
た。
ISO規格改正時に変更すること
を提案する。
9.4 フィルム密着法
9.4
JISとほぼ同じ
変更
ISO規格の試験方法をJISではフィルム密着
法と変更した。
ISO規格改正時に追加すること
を提案する。
9.4 フィルム密着法
9.4
JISとほぼ同じ
追加
使用する試験面や,調湿用ろ紙の取扱いにつ
いて追加した。
実質的な技術的差異はない。
2
R
1
7
0
6
:
2
0
2
0
31
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
9 試験方法
(続き)
9.4 フィルム密着法
9.4
JISとほぼ同じ
追加
図を追加し,試験片の設置について説明を追
加した。
実質的な技術的差異はない。
9.4 フィルム密着法
9.4
−
変更
滅菌水量,密着フィルム,接種液量,保湿用
ガラス及びストマッカー袋についての注記を
JISでは本文に記載した。
実質的な技術的差異はない。
9.4 フィルム密着法
9.4
−
追加
ISO規格では洗い出し液を10 mlとしている
が,JISでは,洗い出し液量を増減させるこ
とを想定し,洗い出し液量の記載を変更した。
実質的な技術的差異はない。
9.5 ガラス密着法
−
−
追加
ISO規格ではガラス密着法が規定されていな
いが,JISではガラス密着法を規定するため
にその方法について,追加した。
ISO規格改正時に追加すること
を提案する。
9.6 紫外光照射条件
9.5
JISとほぼ同じ
変更
ISO規格では25 ℃±5 ℃と規定されている
が,JISでは試験装置内の温度を25 ℃±3 ℃
とするように変更した。
ISO規格改正時に変更すること
を提案する。
9.6 紫外光照射条件
9.5
−
変更
JISでは紫外放射照度測定と設置位置につい
て,JIS R 1702を引用するように変更した。
光照射時間ついての注記をJISでは本文に記
載した。
実質的な技術的差異はない。
9.7 バクテリオファー
ジ感染価の測定
9.6
JISとほぼ同じ
追加
かくはん混合の方法及び培養時のプレートの
向きについて追加した。
注記をJISでは本文に記載した。
実質的な技術的差異はない。
10 試験結
果の計算
10.1 一般事項
10.1
JISとほぼ同じ
追加
抗ウイルス活性値の計算時及び報告書に記載
する平均値の取扱いについて追加した。
実質的な技術的差異はない。
10.2 感染価の計算
10.2
JISとほぼ同じ
変更
平均値を算出する数値の説明をJISでは追加
した。
規格使用者が分かりやすくする
ために記載した。実質的な技術的
差異はない。
10.4 抗ウイルス活性
値の計算
10.4
JISとほぼ同じ
変更
ISO規格の10.4に記載のΔVの項目をJISで
は10.5として別の項目に変更した。
実質的な技術的差異はない。
10.5 光照射による抗
ウイルス活性値の計算
10.4
JISとほぼ同じ
変更
ISO規格の10.4に記載のΔVの項目をJISで
は10.5として別の項目に変更した。
実質的な技術的差異はない。
2
R
1
7
0
6
:
2
0
2
0
32
R 1706:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
10 試験結
果の計算
(続き)
10.6 暗所における抗
ウイルス活性値の計算
10.5
JISとほぼ同じ
変更
ISO規格では光触媒以外の抗ウイルス材料に
よる抗ウイルス活性値としているが,JISで
は暗所における光触媒抗ウイルス活性値と分
かりやすい記載に変更した。
実質的な技術的差異はない。
11 試験結
果の報告
11
JISとほぼ同じ
追加
ISO規格の報告内容に加えて,その他必要な
事項の項目を追加した。
実質的な技術的差異はない。
11
JISとほぼ同じ
追加
JISでは表2として,試験結果の報告例を追
加した。
実質的な技術的差異はない。
附属書A
(参考)
インフルエンザウイル
ス及びバクテリオファ
ージQβに対する光触
媒の効果を比較
Annex
A
JISとほぼ同じ
変更
ISO規格ではサンプルBとされているもの
を,JISではサンプルAと記載を変更した。
実質的な技術的差異はない。
附属書B
(参考)
ATCC株とNBRC株の
バクテリオファージ
Qβに対する光触媒の
効果を比較
Annex
B
JISとほぼ同じ
変更
ISO規格では表題に記載のないバクテリオフ
ァージQβの記載をJISでは追加した。
実質的な技術的差異はない。
附属書JA
(参考)
カルシウム添加LB寒
天平板培地を用いたバ
クテリオファージの調
製方法
−
−
追加
参考として,平板培地を用いたバクテリオフ
ァージ液の調製方法を追加した。
実質的な技術的差異はない。
JISと国際規格との対応の程度の全体評価:ISO 18061:2014,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
R
1
7
0
6
:
2
0
2
0