L 1921:2015
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 原理······························································································································· 2
5 安全対策························································································································· 2
6 試験かび························································································································· 3
7 装置······························································································································· 3
8 試薬及び培地 ··················································································································· 4
9 かびの保存及び使用 ·········································································································· 6
9.1 かびの保存 ··················································································································· 6
9.2 試験かびの前培養 ·········································································································· 6
10 かび胞子懸濁液 ·············································································································· 6
10.1 培地から胞子の洗い出し ································································································ 7
10.2 培地からのかび胞子懸濁液の採取及び分散 ········································································ 7
10.3 菌糸の除去 ·················································································································· 7
10.4 培地成分の除去 ············································································································ 7
10.5 胞子濃度確認 ··············································································································· 8
10.6 吸収法のかび胞子懸濁液の調製 ······················································································· 8
11 ATP検量線の作成 ··········································································································· 8
12 試験方法 ······················································································································· 9
12.1 試験片の準備及び接種 ··································································································· 9
12.2 培養 ·························································································································· 11
13 発光量の測定 ················································································································ 11
13.1 吸収法 ······················································································································· 11
13.2 トランスファー法 ········································································································ 12
14 試験結果 ······················································································································ 12
14.1 試験成立の判定 ··········································································································· 12
14.2 抗かび活性値の計算 ····································································································· 13
15 抗かび効果 ··················································································································· 13
16 試験報告書 ··················································································································· 13
附属書A(規定)試験に用いるかび ························································································ 14
附属書B(参考)抗かび効果 ································································································· 16
参考文献 ···························································································································· 17
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 19
L 1921:2015
(2)
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,一般社団法人繊維評価技術協議会(JTETC)
及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出
があり,日本工業標準調査会の審議を経て,経済産業大臣が制定した日本工業規格である。
また,令和2年10月20日,産業標準化法第17条又は第18条の規定に基づく確認公示に際し,産業標
準化法の用語に合わせ,規格中“日本工業規格”を“日本産業規格”に改めた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
L 1921:2015
繊維製品の抗かび性試験方法及び抗かび効果
Textiles-Determination of antifungal activity and efficacy of textile products
序文
この規格は,2012年に第1版として発行されたISO 13629-1を基とし,我が国の技術動向,実態に即し
て技術的内容を変更して作成した日本産業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,アデノシン三りん酸(以下,ATPという。)を酵素反応によって励起させた発光強度を測
定することによる抗かび活性の定量試験方法及び抗かび効果について規定する。
この規格は,糸,織編物,不織布,衣類,寝具,家具,雑貨などの繊維製品に適用する。
なお,抗かび性試験方法は,用途及び繊維製品が使用される環境を考慮し,次のいずれかの試験方法か
ら最も適切な評価方法を選択する。
a) 吸収法 試験かび胞子懸濁液を直接試験片上に接種する試験方法。
b) トランスファー法 試験かび胞子を寒天培地に塗布し,それを試験片に転写する試験方法。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 13629-1:2012,Textiles−Determination of antifungal activity of textile products−Part 1:
Luminescence method(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 8150 塩化ナトリウム(試薬)
JIS L 0803 染色堅ろう度試験用添付白布
注記 対応国際規格:ISO 105-F02,Textiles−Tests for colour fastness−Part F02: Specification for cotton
and viscose adjacent fabrics(MOD)
JIS Z 8401 数値の丸め方
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
L 1921:2015
3.1
対照試料(control specimen)
試験する繊維製品と同じもの,かつ,抗かび加工が行われていないもので,試験の成立条件の検証用に
使用する試料。ただし,対照試料が入手できない場合は,JIS L 0803に規定する綿100 %の添付白布(綿
3-1号)を用いて,洗剤及び漂白剤を使用せず,60 ℃の水温で10分間水洗い後,すすぎ5分を2回繰り
返す。この一連の処理を10回繰り返し,風乾したものを用いる。
3.2
抗かび剤(antifungal agent)
かびの発育を阻害,又はかびを死滅させることによって,かびの発育を阻止及び抑制する薬剤。
3.3
抗かび加工(antifungal treatment)
かびの発育を阻害,又はかびを死滅させることによって,かびの発育を阻止及び抑制する加工。
3.4
かび胞子懸濁液(spore suspension)
陰イオン界面活性剤(8.3を参照)を含む水にかび胞子を均一に分散させた液体。
3.5
ATP(アデノシン三りん酸)
かび生細胞中に存在する多機能性ヌクレオチド。
3.6
抗かび活性(antifungal activity)
かびの発育を阻害又は抑制する性能。ATP量の対数値で計算され,対照試料の発育値と試験試料の発育
値との差で表される。
3.7
抗かび効果(antifungal efficacy)
抗かび加工によって認められる抗かび性の効果。抗かび活性値によって評価される。
3.8
発光測定法(luminescence method)
かび細胞に含まれるATP濃度を発光光度計で測定し,ATP量(モル)を算出する方法。
4
原理
試験試料及び対照試料に試験かび胞子懸濁液を接種し,25 ℃で42時間培養させる。
この規格では,試験片上でのかび発育性,すなわち,抗かび活性は,試験試料上及び対照試料上のかび
細胞内ATP量の測定結果を比較することによって定量的に決定される。
5
安全対策
この試験方法では,かびを使用する。
この規格の試験実施者は,微生物学的技術に関して訓練を受け,経験をもつ者が望まれる。また,安全
対策については,法規制に照らし合わせて適切であることを確認しておかなければならない。
3
L 1921:2015
6
試験かび
試験で使用するかびは,附属書Aに規定する試験かびの中からいずれかを選択して試験する。
微生物株保存の世界機関(WFCC)に加盟する機関がもつ同等なかび類についても,試験当事者間の協
定によって使用してもよい。
試験に使用したかびの保存株番号及び供給先は,試験報告書に記載する。
7
装置
7.1
ガーゼ 生化学試験用のもの又はガラスウール(FR仕様)。
7.2
シャーレ 滅菌されたもので内径が約90 mmのもの,及びトランスファー法の試験片を入れるもの
は,内径55 mm〜60 mmのもの。
7.3
乾熱滅菌器 160 ℃〜180 ℃の温度で使用可能なもの。
7.4
オートクレーブ 121 ℃±2 ℃(103 kPaと同等)で使用可能なもの。
7.5
安全キャビネット 生化学試験用のもの,又は同等の性能をもつもの。
7.6
白金耳 直径で2 mm〜4 mmのループのもの。
7.7
かぎ型白金耳 胞子をかき取れるもの。
7.8
培養器 20 ℃〜37 ℃の範囲で設定温度±2 ℃の精度で使用可能なもの。
7.9
バイアル瓶 30 mLのガラス瓶。ねじ蓋式のものでポリテトラフルオロエチレン又はシリコンのパ
ッキンを使用し,ポリプロピレンで作られたキャップを使用したもの。
7.10 ガラス棒 直径5 mm〜18 mmのもので重さが1 g〜50 gのもの。
7.11 ガラス製漏斗 内径60 mmのもの。
7.12 ピペット 容量が0.05 mL,0.1 mL,0.2 mL,5 mL及び10 mLのもので,誤差が呼び容量の5.0 %
以内のもの。
7.13 パスツールピペット 微生物学試験用のもの。
7.14 フラスコ 容量が100 mL〜500 mLのもの。
7.15 ピンセット 滅菌できる材料で作られたもの。
7.16 プラスチック試験管 発光光度計用のもの。
7.17 試験管かくはん(攪拌)機 バイアル瓶及び試験管をかくはんできるもの。
7.18 遠心分離機 遠心加速度が約2 000 Gのもの。
7.19 遠心分離用試験管 遠心分離機で使用できるもの。
7.20 ヘモサイトメータ 1×106 /mL〜3×106 /mLが計測できるもの。
7.21 顕微鏡 倍率200倍のもの。
7.22 超音波洗浄器 実験用のコンパクトで,30 kHz〜50 kHzで使用できるもの。
7.23 発光光度計 300 nm〜650 nmの波長で測定できるもので,8.4,箇条11及び箇条13で規定する条件
で,1×10−11 mol/L〜1×10−5 mol/LのATP濃度を測定できるもの。
7.24 pHメータ 25 ℃で±0.1の精度のもの。
7.25 冷蔵庫 2 ℃〜10 ℃の温度で使用できるもの。
7.26 冷凍庫 −80 ℃以下で使用できるもの,及び−20 ℃以下で使用できるもの。
なお,試験管,バイアル瓶,フラスコ,ピペット及びピンセットは,使用前にアルカリ及び中性洗剤を
使用して洗浄,水洗,及び乾燥し,その後,乾熱滅菌又は高圧蒸気滅菌処理を行う。
4
L 1921:2015
8
試薬及び培地
8.1
一般 試験に使用する試薬は,分析用グレード及び/又は微生物試験用のもの。
培地の調製については,市場に無水製品がある場合には,厳密に製造業者の指示に従うことを前提に,
それを使用することを推奨する。
8.2
水 微生物試験用又は試薬調製用の分析用グレードの水。新たに蒸留されたもの,イオン交換され
たもの及び/又は逆浸透膜を使用してろ過されたものとする。また,あらゆる毒性物質及びかび阻害物質
がないものとする。
8.3
陰イオン界面活性剤 かび胞子懸濁液用のジオクチルスルホこはく酸ナトリウム。
8.4
発光測定試薬,試薬及び緩衝液
8.4.1
一般 8.4.2〜8.4.8に規定する試薬及び緩衝液を使用する。市場で入手できるものは,適切な検証
試験を行ってから使用しなければならない。
8.4.2
ATP標準試薬原液(10−3 mol/L)(以下,ATP標準液という。) アデノシン-5'3りん酸二ナトリウ
ム三水和物(C10H14O13P3Na2·3H2O)60.5 mgを水に溶解し,100 mLに調製したもの。
調製後,容器に入れ,しっかり密封して,−20 ℃以下で冷凍保存する。保存期間は6か月までとする。
一度溶解したものを再凍結してはならない。
8.4.3
ATP発光試薬の緩衝液 次の成分からなり,pHを7.5±0.2に調整したもの。
− N-トリス(ヒドロキシメチル)メチルグリシン
1 117 mg
− エチレンジアミン四酢酸二水和物ジナトリウム塩
183 mg
− 酢酸マグネシウム四水和物
808 mg
− DL-ジチオスレイトール
6.7 mg
− デキストリン
25 000 mg
− スクロース
925 mg
− 水
250 mL(調製後)
8.4.4
ATP発光試薬 次の成分からなり,発光光度計(7.23)を使用し,8.4並びに箇条11及び箇条13
で規定する試験で,1×10−11 mol/L〜1×10−5 mol/LのATP濃度を測定できるもの。
− ルシフェラーゼ
0.7 mg
− D-ルシフェリン
12.6 mg
− うし血清アルブミン
56 mg
− 緩衝液(8.4.3参照)
30 mL
使用前に一度完全溶解させ,室温で15分間おき,3時間以内に使用する。
上記以外のATP発光試薬を使用する場合は,その成分を試験報告書に記載する。
8.4.5
ATP抽出試薬 次の成分からなり,pHを12.0±0.5に調整したもので,かび細胞内ATPを80 %又
はそれ以上の効率で抽出できなければならない。
なお,pHの調整は,水酸化ナトリウムによる。
− N-トリス(ヒドロキシメチル)メチルグリシン
45 mg
− 塩化ベンザルコニウム10 %水溶液
0.2 mL
− 水
9.8 mL
上記以外のATP抽出試薬を使用する場合は,その成分を試験報告書に記載する。
5
L 1921:2015
8.4.6
ATP消去試薬 次の成分からなり,pHを6.0±0.5に調整したもので,ATP消去試薬を培地の1/10
量を加えたときに,培地(8.5.1参照)のATP含有量を15分以内に10−11 mol/Lまで減少させる能力がなけ
ればならない。調製後は,8時間以内に使用する。
− アピラーゼ(EC:3.6.1.5)
4.6国際単位/mL
− アデノシンりん酸デアミナーゼ(EC:3.5.4.6 又EC:6.3.5.4.17) 4.6国際単位/mL
− スクロース
37 mg
− うし血清アルブミン
20 mg
− 0.05 mol/Lの2-モノホリノエタンスルホン一水和物酸緩衝液
10 mL
上記以外のATP消去試薬を使用する場合は,その成分を試験報告書に記載する。
8.4.7
生理食塩水 JIS K 8150に規定する塩化ナトリウム(NaCl)8.5 gを水に溶解し,1 000 mLに調製
したもの。その後,オートクレーブ(7.4)で滅菌する。
8.4.8
湿潤剤添加水 陰イオン界面活性剤(8.3参照)を水で溶解し,1 000 mLに調製したもの。その後,
オートクレーブ(7.4)で滅菌する。
8.5
培地
8.5.1
一般
8.5.2〜8.5.5に規定する培地を使用する。市場で入手できる培地は,適切な検証試験を行ってから使用す
る。調製後すぐに使用しない培地は,5 ℃〜10 ℃の冷蔵庫に保存する。1か月を経過したものは,使用し
てはならない。
8.5.2
サブローデキストロース液体培地(SDB) 次の成分からなり,pHを5.6±0.2に調整後,オート
クレーブ(7.4)で滅菌する。
− ペプトン
10 g
− デキストロース
20 g 〜 40 g
− 水
1 000 mL
8.5.3
ポテトデキストロース寒天培地(PDA) 次の手順によって作成したもの。
a) きずの少ないじゃがいもを洗い,皮をむく。各芽の周り約10 mmを取り除き,約10 mm角のサイコ
ロ状に切る。
b) この細断したじゃがいも200 gを1 000 mLの水に入れ,1時間煮沸する。その後,2〜3枚重ねのガー
ゼ(7.1)で包み,脱水する。
c) 次に,合計容量が1 000 mLになるよう水を加える。
d) 続いて,20 gのグルコース,15 g〜20 gの寒天を加える。完全に溶解させてオートクレーブ(7.4)に
よって処理する。
8.5.4
斜面培地 次の手順によって作成したもの。
a) 完全に溶解させたPDA(8.5.3)約10 mLを試験管に入れて栓をし,オートクレーブ(7.4)で処理す
る。
b) 滅菌後,清潔な実験台に水平面に対し約15°の角度で静置し,寒天培地を固化させる。固化した寒天
培地上に凝結水がない場合は,再度溶解し,固化させて凝結水を確認してから使用する。
8.5.5
サブローデキストロース寒天培地(SDA) 次の成分からなり,pHを5.6±0.2に調整後,オート
クレーブ(7.4)で滅菌する。
− 牛肉由来ペプトン
10 g
− デキストロース
35 g
6
L 1921:2015
− 寒天
15 g
− 水
1 000 mL(調製後)
注記 この培地は,トランスファー法で使用する。
9
かびの保存及び使用
9.1
かびの保存
試験かびの継代培養及び取扱いは,安全キャビネット(7.5)又は同等の設備の中で行い,次による。
a) 継代培養の前後に,試験管の栓と試験管口周辺とを火炎滅菌するか又は化学滅菌する。
b) 元株から少量のかび胞子を白金耳(7.6)及びかぎ型白金耳(7.7)でかき取り,斜面培養の下部の凝結
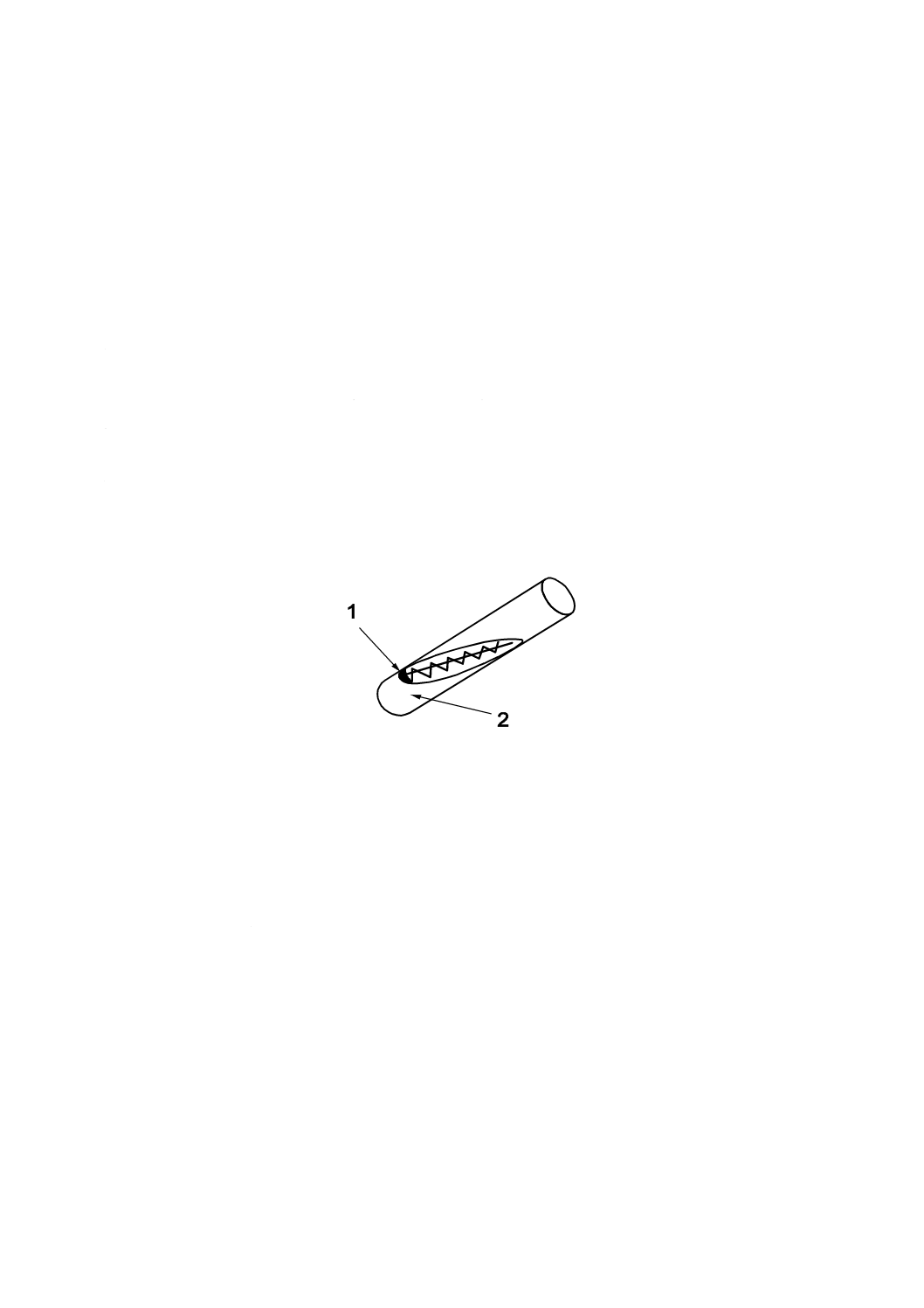
水に分散させ,斜面培養の上部に直線状又は波線状に塗り付ける(図1参照)。
c) 異なるかびの継代培養を行う都度,白金耳及びかぎ型白金耳を火炎滅菌する。
d) 継代培養された斜面培養を25 ℃±2 ℃に設定された培養器(7.8)に少なくとも8日間培養する。十
分な胞子が発生したことを確認し,5 ℃〜10 ℃で保存する。
e) 3か月以内に,更なる培養又は保存のために継代培養されたかびを新しい斜面培養に移植する。
f)
継代培養を最大3か月間隔で繰り返す。ただし,継代培養は5回までとする。また,3か月を過ぎた
かびは,それ以上の継代培養に使用してはならない。
1
凝結水
2
斜面状の寒天培地
図1−斜面培地での継代培養
9.2
試験かびの前培養
かび胞子懸濁液調製のための前培養は,9.1で保存されたかび胞子を白金耳及びかぎ型白金耳でかき取り,
平板培地中央に接種し,25 ℃±2 ℃の条件で少なくとも8日間培養する。培養後,直ちに使用しない場合
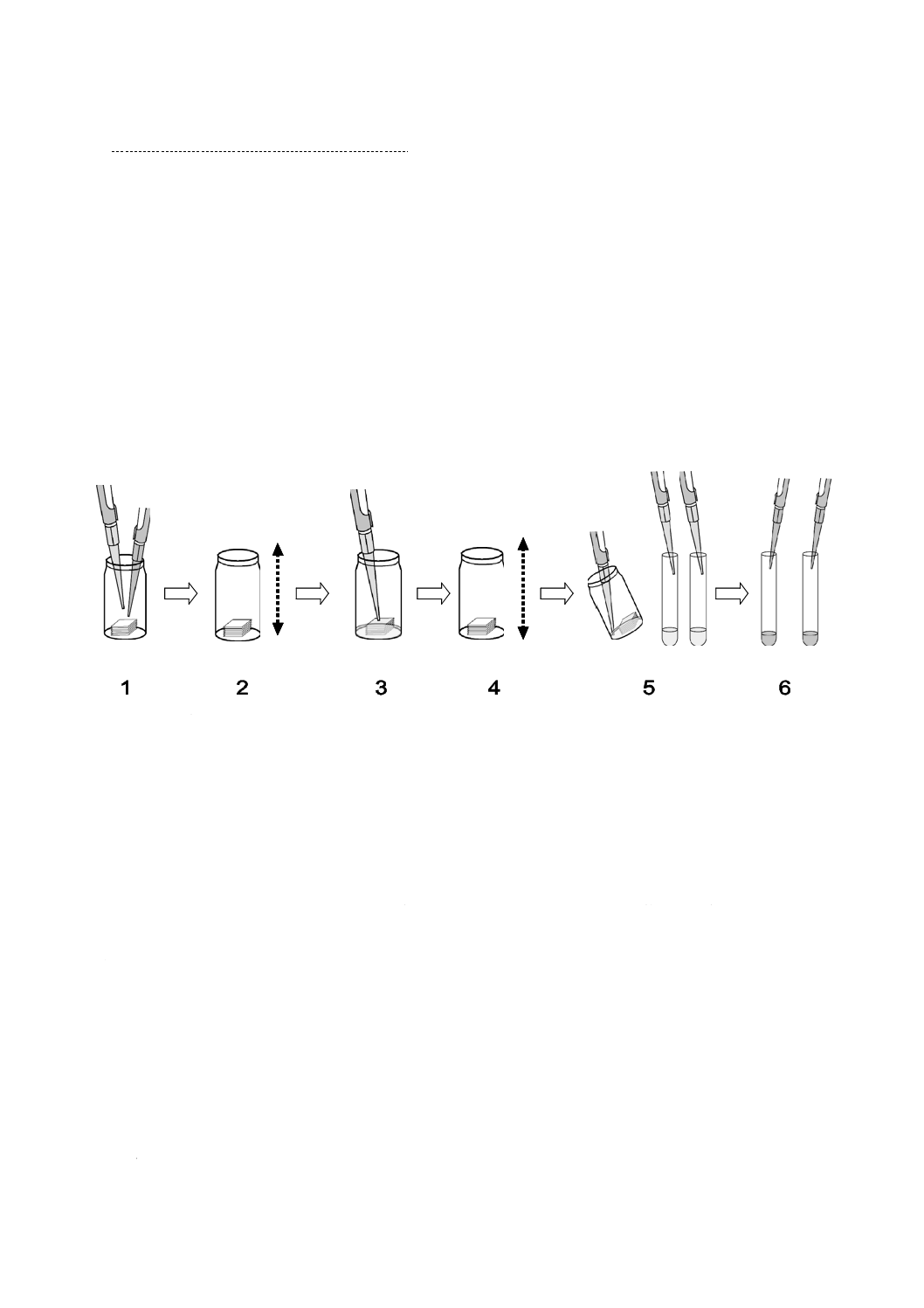
は,5 ℃〜10 ℃に保存し,7日以内に使用する(図2参照)。
10 かび胞子懸濁液
かび胞子懸濁液の調製手順は,次による。

7
L 1921:2015
1
PDA平板上での9.2の前培養
2
ステップ1
3
ステップ2
4
ステップ3
5
ステップ4
6
ステップ5
図2−かび胞子懸濁液調製手順
10.1 培地から胞子の洗い出し
培地から胞子の洗い出しは,次による。
a) パスツールピペット(7.13)又は同等の器具を用いて,湿潤剤添加水(8.4.8)約0.5 mLをとる(ステ
ップ1)。
b) 寒天培地の中央の胞子上に湿潤剤添加水をゆっくり滴下し,寒天の表面をピペッティングでゆっくり
と5回すすぎ洗う(ステップ2)。
注記 湿潤剤添加水量の変更のような軽微な変更を行った場合は,その変更した条件を試験報告書
に記載する。
10.2 培地からのかび胞子懸濁液の採取及び分散
培地からのかび胞子懸濁液の採取及び分散は,次による。
a) 10.1のかび胞子懸濁液をパスツールピペット又は同等の器具を用いて採取する。
b) その懸濁液の適量を,湿潤剤添加水5 mL入りの容器に入れる。
c) 胞子を十分に分散させるため,約100回のピペッティングをするか,試験管かくはん機でかくはんす
るか,又は約5分間軽い超音波洗浄を行う。
d) 目視によって,懸濁液が僅かに濁っていることを確認する(ステップ3)。
10.3 菌糸の除去
ガーゼ又はガラスウール(7.1)を置いた漏斗,若しくはこれらと同等の器具でろ過する(ステップ4)。
ガーゼ又はガラスウールは,50 mm×50 mm角のものを4±1枚使用する。
10.4 培地成分の除去
培地成分の除去は,次による。
a) ろ過後,遠心分離機を用い,25 ℃±2 ℃において,約2 000 Gで少なくとも5分間遠心分離する。遠
心分離機に温度調節機能がない場合は室温でもよい。
b) 上澄み液をピペットで除去する。
c) 湿潤剤添加水約5 mLを加える。
d) 胞子を十分に分散させるため,十分にピペッティングをするか,試験管かくはん機でかくはんするか,
8
L 1921:2015
又は約5分間軽い超音波洗浄を行う(ステップ5)。
10.5 胞子濃度確認
胞子濃度確認は,ヘモサイトメータで,次の項目を確認する。
a) 胞子数及び胞子の状態 胞子数が1×106 /mL〜3×106 /mL内にあることを確認する。また,その90 %
以上が菌糸から離れた単一の遊離胞子とする。胞子数の確認は,ヘモサイトメータでの測定場所を異
なる2か所以上で行い,その平均値を胞子数とする。
b) 胞子数が過剰な場合 胞子数が1×106 /mL〜3×106 /mL内になるように湿潤剤添加水で10.4のd)で処
理したかび胞子懸濁液を希釈する。希釈後,再度a) によって胞子数を確認する。
c) 胞子数が過少な場合 遠心分離を繰り返し,上澄み液を除去する。胞子数が1×106 /mL〜3×106 /mL
内になるように湿潤剤添加水で胞子数を調整する。調整後,再度a) によって胞子数を確認する。
d) トランスファー法の場合 胞子数を1×108 /mL〜3×108 /mLに調整し,それを試験に使用する。
10.6 吸収法のかび胞子懸濁液の調製
吸収法のかび胞子懸濁液の調製は,次による。
a) 20倍希釈したSDBによって,10.5のかび胞子懸濁液の胞子濃度を1×105 /mL〜3×105 /mLに調製す
る。この濃度を接種胞子濃度とする。接種胞子濃度は,胞子濃度(10.5)を希釈倍率で除した値から
求める。SDBを20倍希釈する場合は,湿潤剤添加水を使用する。
b) 希釈時の懸濁液については,十分にかくはんする。
c) 調製後,懸濁液を氷で冷却し,4時間以内に使用する。
11 ATP検量線の作成
ATP検量線作成の手順は,次のとおりとする。また,検量線は,ATP発光試薬の調製ごとに作成しなけ
ればならない。
a) ATP標準試薬原液(8.4.2)を水で希釈し,1×10−8 mol/L,1×10−7 mol/L及び1×10−6 mol/Lの濃度水
準を作製する。
b) 第1希釈の作製手順 各濃度水準から0.1 mLを別のプラスチック試験管にとる。それに,0.05 mLの
水及び0.35 mLの生理食塩水を入れ,十分にかくはんする。
c) 第2希釈の作製手順 第1希釈の試験管から0.1 mLをとり,別のプラスチック試験管に入れ,0.4 mL
の生理食塩水を加えてよくかくはんする。
d) 測定用希釈ATP標準液の準備 測定用希釈ATP標準液測定のため,二つのプラスチック試験管に第2
希釈の0.1 mLをそれぞれ入れる。
e) 第1ブランクの準備 プラスチック試験管に0.1 mLの湿潤剤添加水を加え,0.35 mLの生理食塩水及
び0.05 mLのATP消去試薬を加える。よくかくはんし,その後,10分間〜20分間静置する。
f)
第2ブランクの準備 第1ブランクから0.1 mLをプラスチック試験管にとり,次に,生理食塩水0.4 mL
を加え,よくかくはんする。
g) ブランク測定準備 第2ブランクから二つのプラスチック試験管にそれぞれ0.1 mLを入れ,これらを
ブランク測定に使用する。
h) g) で準備した二つのプラスチック試験管に,各々0.1 mLのATP抽出試薬を加え,よくかくはんする。
i)
h) で準備した二つの試験管に,各々0.1 mLのATP発光試薬を加え,試験管かくはん機で5秒間かく
はんする。
j)
ブランクの発光量 発光光度計で二つのプラスチック試験管のブランク発光量を直ちに測定する。
9
L 1921:2015
k) 測定用希釈ATP標準液の測定は,最低濃度のものから順に行う。ATP抽出試薬0.1 mLをd) で準備し
た第2希釈のプラスチック試験管それぞれに加える。その後,十分にかくはんする。
l)
ATP発光試薬0.1 mLを加える。次に,試験管かくはん機で5秒間かくはんする。
m) 測定用希釈ATP標準液の発光量 発光光度計で二つのプラスチック試験管の発光量を直ちに測定す
る。
n) 検量線を求めるために,式(1)を用いて係数A及び係数Bを次によって計算する。
1) 係数Aは,対応するATP濃度(mol/L)をm) で得られた測定用希釈ATP標準液の発光量のそれぞ
れの平均値で除して得られる三つの値の平均値である。
2) 係数Bは,式(1)に係数Aを入れ,ブランクの発光量の平均値をXに代入して,Yをゼロとして計算
する。
B
AX
Y
+
=
··············································································· (1)
ここに,
Y: ATP濃度(mol/L)
X: 発光量(RLU=相対発光量)
Y及びXの相関係数が0.9を下回ったときは,再度,検量線作成を実施する。
12 試験方法
12.1 試験片の準備及び接種
12.1.1 一般
接種方法は,吸収法又はトランスファー法を選択する。トランスファー法は,吸水性のない試験片に適
用する。
12.1.2 吸収法
12.1.2.1 試験片の質量及び形状
試料から0.20 g±0.03 gをとり,試験に適切な大きさに裁断する。対照試料を6検体及び試験試料を6
検体準備する。
注記 対照試料3検体及び試験試料3検体は,接種直後の測定に使用し,残りは培養後の測定に使用
する。
12.1.2.2 試験片の準備
試験片の準備は,試験片の特性に合わせ,次の方法の中から適切な方法を選択し,試験片を別々のバイ
アル瓶にそれぞれ入れる。
a) 試験片がカールしやすい織編物製品の場合,詰め物又は羽毛を含んでいる場合は,バイアル瓶の中の
試験片をガラス棒で押さえる。別の方法として,試験片の両端を糸で縛ってもよい。
b) 試験片が糸の場合は,その糸を束にしてバイアル瓶に入れ,試験片をガラス棒で押さえる。
c) 試験片がカーペットなどの場合は,カーペット又はそのパイルを切り,それをバイアル瓶に入れ,ガ
ラス棒で押さえる。
d) 必要な場合は,試験当事者間の合意に基づき前処理を行う。実施した前処理に関しては,その詳細を
試験報告書に記載する。
e) 汚染がないことが確認されている場合以外には,次の手順に従って,オートクレーブによって試験片
を滅菌する。
1) 試験片が入っているバイアル瓶の上部の口にアルミニウムホイルをかぶせる。
2) アルミニウムホイルでカバーされたバイアル瓶を金網かごに入れる。
10
L 1921:2015
3) バイアル瓶のキャップをアルミニウムホイルで包み,金網かごに入れる。
4) 試験片が入ったバイアル瓶及びキャップを,オートクレーブで121 ℃(103 kPa)の条件で15分〜
20分間処理する。
5) 滅菌後,バイアル瓶及びキャップを安全キャビネット又は他の空中汚染の危険がないところに置き,
アルミニウムホイルを取り除き,60分間又はそれ以上の時間乾燥させる。
6) バイアル瓶のキャップをしっかりと締める。
注記1 オートクレーブ以外の他の滅菌法,例えば,エチレンオキサイドガス及びγ線照射を使
用した場合は,その方法を試験報告書に記載する。
注記2 滅菌法によっては,抗かび加工を不活性化する,又はある種の抗微生物薬剤を放出する
可能性があり,誤った結果になることがある。
注記3 対照試料も試験試料の滅菌方法と同様に滅菌できる。
12.1.2.3 試験片への接種
10.6で準備したかび胞子懸濁液をピペットで正確に0.2 mLとり,12.1.2.2で準備した試験片に接種する。
試験片に接種する前に懸濁液をよくかくはんする。
接種は,かび胞子懸濁液を試験片の数箇所に行い,十分にかび胞子懸濁液が吸収されるようにピペット
チップなどを用いて処置を行う。接種直後の発光量の測定は,13.1による。
注記 容易にかび胞子懸濁液を吸収しない試験片については,トランスファー法を使用することがで
きる。
12.1.3 トランスファー法
12.1.3.1 試験片の準備
裁断型枠を用いて,直径約38 mmの対照試料6検体及び試験試料6検体を準備する。
対照試料及び試験試料検体の各々を計量し,その質量を記録する(質量mA)。
必要な場合は,試験当事者間の合意に基づき前処理を行う。実施した前処理に関しては,その詳細を試
験報告書に記載する。
12.1.3.2 寒天平板への接種
直径55 mm〜60 mmのシャーレにSDA寒天培地(8.5.5)を入れたものを対照試料用に6枚,及び試験
試料用に6枚用意する。これらに10.5 d)で準備したかび胞子懸濁液1 mLを滴下する。シャーレを多方向
に傾け,寒天の表面に懸濁液が行きわたった後,余分な液体を可能な限り吸い取る。その後,300秒間±
30秒間静置する。
12.1.3.3 試験片への転写
各々の試験片を抗かび加工面を培地側に向けて,12.1.3.2の平板の表面に載せ,その上から200 gのステ
ンレス分銅を60秒間±5秒間載せる。その後,ステンレス分銅を取り除き,各々の試験片を直径55 mm〜
60 mmのシャーレに転写面を上向きにして置く。
試験片を入れるシャーレは,使用前に質量を測り,その質量(質量mB)を記録する。次に,転写した試
験片を入れたシャーレの質量を測り,総質量(質量mC)を記録する。
試験片に転写された液の質量mDは,式(2)で計算する。
(
)
B
A
C
D
m
m
m
m
+
−
=
···································································· (2)
11
L 1921:2015
接種直後の発光量の測定は,13.2による。
12.2 培養
12.2.1 吸収法
12.1.2.3によって接種した後,接種直後の測定をしない対照試料3検体及び試験試料3検体は,25 ℃±
2 ℃で42時間±2時間培養する。
12.2.2 トランスファー法
12.1.3.3によって転写した後,接種直後の測定をしない対照試料3検体及び試験試料3検体は,調湿チャ
ンバー内に入れ,25 ℃±2 ℃で42時間±2時間培養する。
13 発光量の測定
13.1 吸収法
吸収法における発光量測定の準備手順は,次による(図3参照)。
1
ステップ6
2
ステップ7
3
ステップ8
4
ステップ9
5
ステップ10
6
ステップ11
図3−発光量測定準備手順
a) ATP消去試薬0.1 mLを,接種直後の場合は12.1.2.3で準備した試験片,培養後の場合は12.2.1で準備
した試験片に加える。さらに,生理食塩水4.7 mLを加える(ステップ6)。
b) キャップを締め,よくかくはんする。手によるかくはんの場合は30回振る,又は試験管かくはん機を
用いる場合は5秒間のかくはんを5回行う。その後,室温に20分間静置する(ステップ7)。
注記1 試験片が浮く場合には,完全に浸るようにする。
c) ATP抽出試薬5.0 mLを加える(ステップ8)。
d) キャップを締め,よくかくはんする。手によるかくはんの場合は30回振る,又は試験管かくはん機を
用いる場合は5秒間のかくはんを5回行う。その後,室温に10分間静置する(ステップ9)。
注記2 試験片が浮く場合には,完全に浸るようにする。
e) d) で準備した液0.2 mLを二つのプラスチック試験管に移す(ステップ10)。
12
L 1921:2015
f)
ATP発光試薬をe) で準備した試験管に0.1 mL加え,試験管かくはん機で5秒間かくはんする。直ち
に発光光度計を用いて発光量を測定する(ステップ11)。
g) 二つの試験管の発光量を測定する。
h) 検量線式によって,g) の発光量の平均値からATP濃度を計算する。その際のATP濃度の下限値は,
10−11 mol/Lとする。
i)
式(3)からATP量を求める。
V
c
M
×
=
ATP
············································································· (3)
ここに,
M: 1試験片当たりのATP量
cATP: h)で得たATP濃度
V: バイアル瓶の液量 0.01(L)
13.2 トランスファー法
トランスファー法における発光量測定の準備手順は,次による。
a) ATP消去試薬0.1 mLを,接種直後の場合は12.1.3.3で準備した試験片,培養後の場合は12.2.2で準備
した試験片に加える。次に,生理食塩水(4.9−mD)mL(12.1.3.3)を加える(ステップ6)。
b) ピペッティングを約30回行い,よくかくはんする。ピペッティングしやすいようにシャーレを傾けて
もよい。その後,室温に20分間静置する(ステップ7)。
注記1 試験片が浮く場合には,完全に浸るようにする。
c) ATP抽出試薬5.0 mLを加える(ステップ8)。
d) ピペッティングを約30回行い,よくかくはんする。ピペッティングしやすいようにシャーレを傾けて
もよい。その後,室温に10分間静置する(ステップ9)。
注記2 試験片が浮く場合には,完全に浸るようにする。
e) 次に,d) で準備した溶液0.2 mLを二つのプラスチック試験管に移す(ステップ10)。
f)
ATP発光試薬をe) で準備した試験管に0.1 mL加え,試験管かくはん機で5秒間かくはんする。直ち
に発光光度計(7.23)を用いて発光量を測定する(ステップ11)。
g) 二つの試験管の発光量を測定する。
h) 検量線式によって,g) の発光量の平均値からATP濃度を計算する。その際のATP濃度の下限値は,
10−11 mol/Lとする。
i)
式(3)からATP量を求める。
14 試験結果
14.1 試験成立の判定
試験かびの発育値がb) を満足する場合に試験成立と判定する。b) を満足しない場合には,試験は不成
立と判定し,再試験を実施する。
a) 式(4)によって,試験かびの発育値Fを計算する。
b) 式(4)によって,計算された発育値Fが1.5以上であること。
結果は,JIS Z 8401の規則B(四捨五入法)によって小数点以下1桁に丸める。
発育値が1.5未満の場合,対照試料をJIS L 0803の綿添付白布として再試験を実施する。
13
L 1921:2015
o
tlog
log
C
C
F
−
=
······································································· (4)
ここに,
F: 試験かびの発育値
logCo: 接種直後の対照試料3検体のATP量の算術平均の常用
対数値
logCt: 42時間培養後の対照試料3検体のATP量の算術平均の
常用対数値
14.2 抗かび活性値の計算
試験が成立した場合,式(5)によって抗かび活性値を求める。
結果は,JIS Z 8401の規則Bによって小数点以下1桁に丸める。
(
)(
)
o
t
o
t
a
log
log
log
log
T
T
C
C
A
−
−
−
=
·············································(5)
ここに,
Aa: 抗かび活性値
logCo: 接種直後の対照試料3検体のATP量の算術平均の常用
対数値
logCt: 42時間培養後の対照試料3検体のATP量の算術平均の
常用対数値
logTo: 接種直後の試験試料3検体のATP量の算術平均の常用
対数値
logTt: 42時間培養後の試験試料3検体のATP量の算術平均の
常用対数値
15 抗かび効果
抗かび効果は,14.2で求めた抗かび活性値Aaが,2.0以上とする。抗かび活性値による抗かび効果を示
す指標を,参考として附属書Bに示す。
16 試験報告書
試験報告書は,次の事項を含めなければならない。
a) この規格の規格番号
b) 試験試料の詳細
c) 使用した対照試料
d) 使用した試験かび
e) かびの元株の詳細:かび保存番号及び保存機関
f)
接種胞子濃度
g) 接種方法
h) 発育値
i)
各試験試料の抗かび活性値の値
j)
評価日及び試験期間
k) 試験機関名,試験担当者の名前及び署名
l)
試験当事者間の合意事項,及びこの規格からの逸脱事項
14
L 1921:2015
附属書A
(規定)
試験に用いるかび
A.1 一般
この規格で用いるかびは,表A.1に示したものと同一系で,国際微生物保存連盟(WFCC)に加入して
いる機関において保存されたものでなければならない。
A.2 試験かびの種類
試験かびの種類及びWDCMコードを,表A.1に示す。
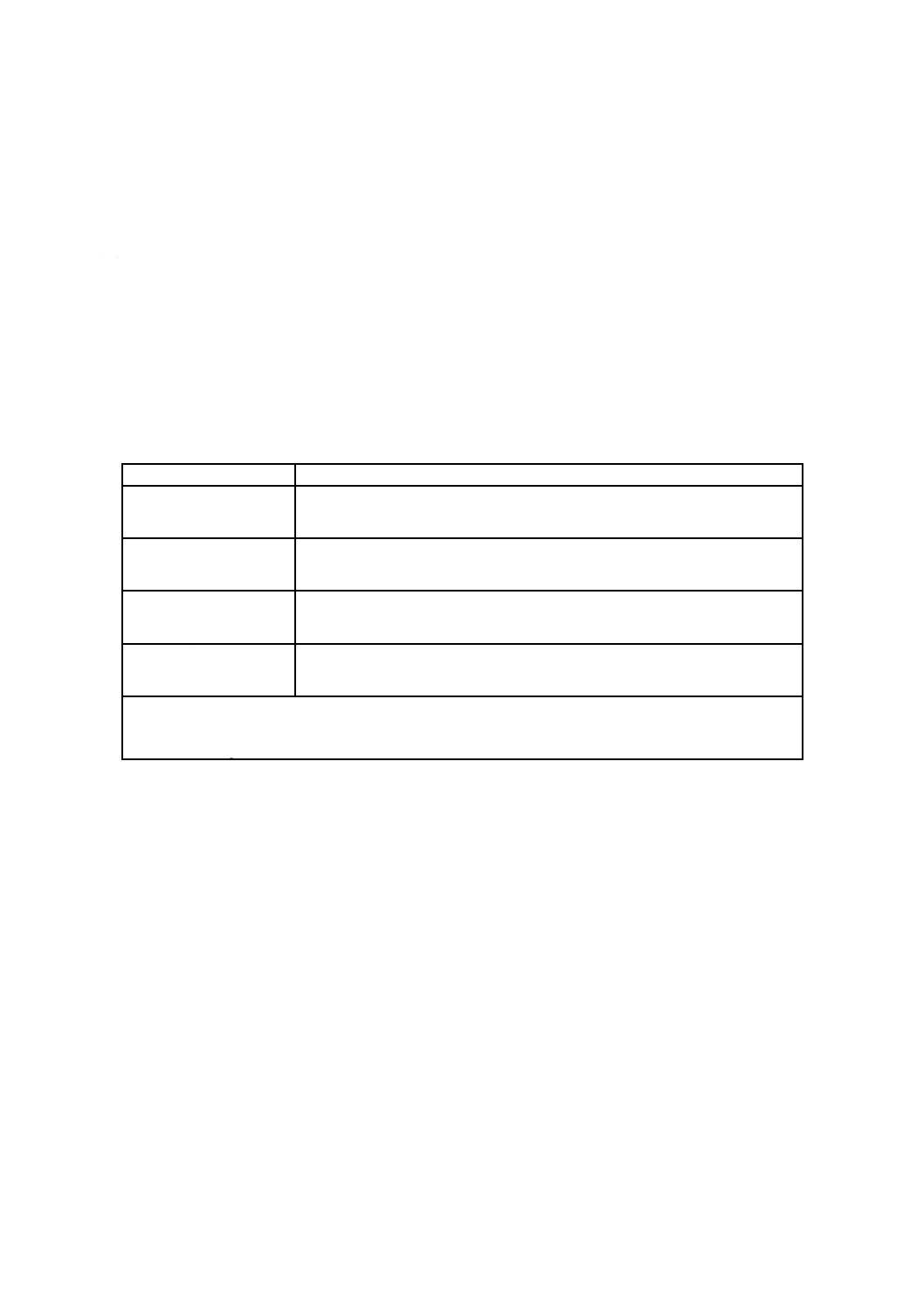
表A.1−試験に用いるかび
かびの種類
WDCMコード
クロコウジカビ
00144
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00144
アオカビ
00189
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00189
クロカビ
00190
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00190
白せん(癬)菌
00191
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00191
注記1 試験が成立する場合,他のかびも使用できる。
注記2 WDCMウェブサイト参照:http://refs.wdcm.org/search.htm(WDCMは,World Data Centre for
Microorganismsの略称)

15
L 1921:2015
表A.1に示すかびの種類に対して,国別保存番号及び保存機関名の例を,表A.2に示す。
表A.2−試験に使用されるかびの国別保存番号及び保存機関名の例
かびの種類
WDCM
コード
国別保存番号
国別保存機関名
クロコウジカビ
Aspergillus niger
00144
ATCC 6275
American Type Culture Collection (USA)
(米国基準微生物株保存機関)
A-NRRL 3361
Northern Utilization Research Branch (USA)
CBS 131.52
Centraalbueau voor Schimmelcultures, Fungal Biodiversity Centre
(Netherlands)
(オランダ真菌生物多様性センター)
DSM 1957
German Collection of Microorganism and Cell Culture (Germany)
(独国微生物・培養細胞保存機関)
NBRC 105649
NITE Biological Resource Center (Japan)
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンタ
ー)
UMIP 2475.98
Insitut Pasteur, Fungi Culture Collection (France)
アオカビ
Penicillium
citrinum
00189
ATCC 9849
American Type Culture Collection (USA)
(米国基準微生物株保存機関)
NBRC 6352
NITE Biological Resource Center (Japan)
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンタ
ー)
クロカビ
Cladosporium
cladosporioides
00190
ATCC 11277
American Type Culture Collection (USA)
(米国基準微生物株保存機関)
NBRC 6348
NITE Biological Resource Center (Japan)
NBRC 6368
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンタ
ー)
白せん(癬)菌
Trichophyton
mentagropytes
00191
NBRC 32409
NITE Biological Resource Center (Japan)
NBRC 32412
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンタ
ー)
注記 実際に入手する場合は,それぞれの保存機関に問い合わせるのがよい。
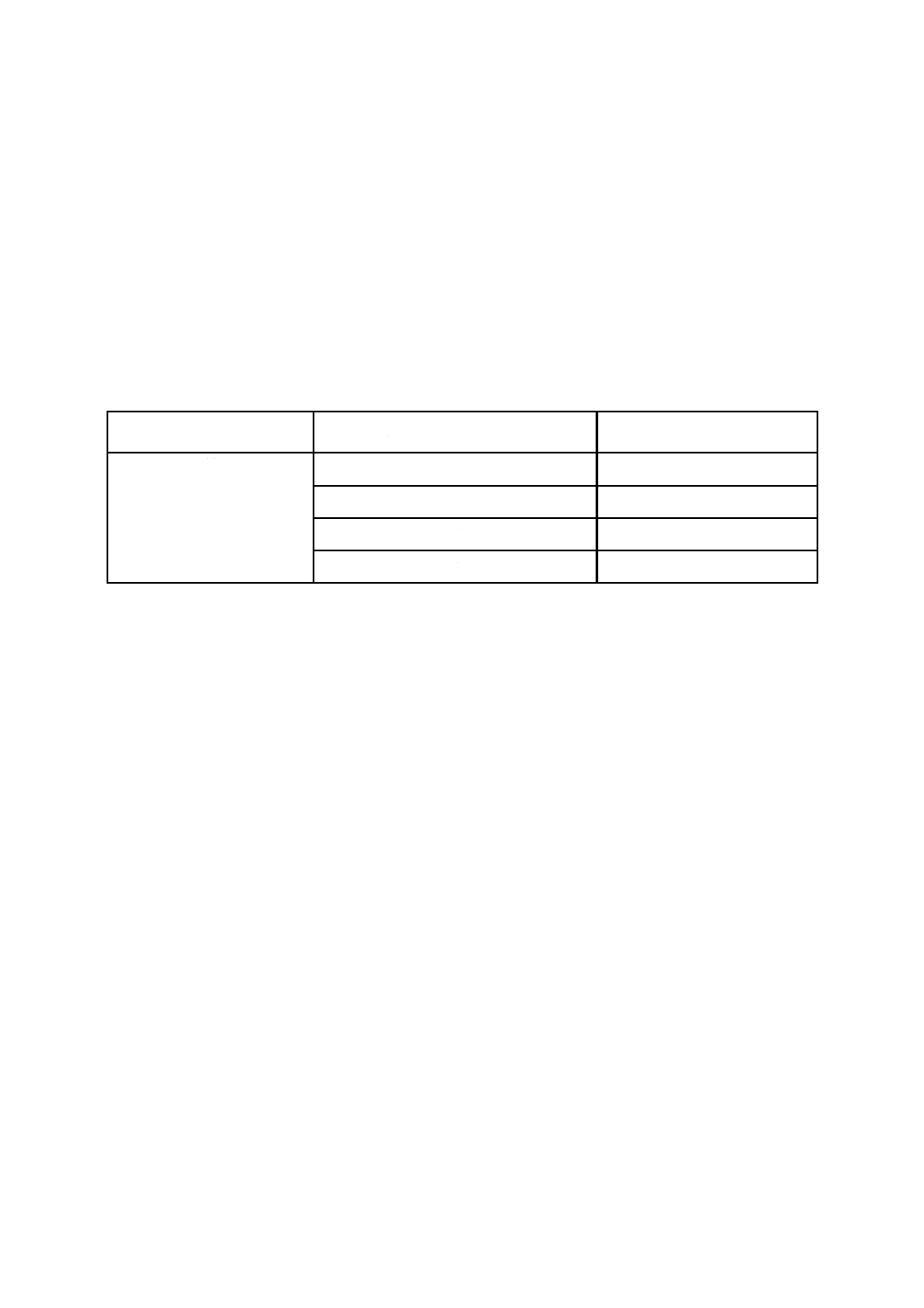
16
L 1921:2015
附属書B
(参考)
抗かび効果
次に示す基準を,抗かび特性の明確な効果を示す指標として適用することが望ましい(表B.1参照)。
注記 表B.1の効果基準は,かびの発育がないことを保証するものではない。効果基準は,抗かび製
品に付着したかび胞子が,抗かび加工をしていないものと比較して,その発育を抑制している
ことを意味している。
表B.1−抗かび活性及び抗かび効果
項目
抗かび活性値式[式(5)]のAaで規定する
抗かび活性値効果基準
効果の説明
試験試料 対 対照試料
1.0>Aa
効果が認められない。
2>Aa≧1.0
弱い効果がある。
3>Aa≧2.0
効果がある。
Aa≧3.0
強い効果がある。
17
L 1921:2015
参考文献
[1] JIS Z 2911:2000 かび抵抗性試験方法
[2] JIS Z 2911:2006 かび抵抗性試験方法(追補1)
[3] JIS A 6922:2003 壁紙施工用及び建具用でん粉系接着剤
[4] JIS W 0812:2004 航空機搭載機器−環境条件及び試験手順
[5] JIS R 1705:2008 ファインセラミックス−光照射下での光触媒抗かび加工製品の抗かび性試験方法
[6] ISO 846:1997,Plastics−Evaluation of the action of microorganisms
[7] ISO 3801:1977,Textiles−Woven fabrics−Determination of mass per unit length and mass per unit area
[8] ISO 6330:2000,Textiles−Domestic washing and drying procedures for textile testing
[9] ISO 7218:2007,Microbiology of food and animal feeding stuffs−General requirements and guidance for
microbiological examinations
[10] ISO 9022-11:1994,Optics and optical instruments−Environmental test methods−Part 11: Mould growth
[11] ISO 11721-1:2001,Textiles−Determination of resistance of cellulose-containing textiles to micro-organisms
−Soil burial test−Part 1: Assessment of rot-retardant finishing
[12] ISO 11721-2:2003,Textiles−Determination of the resistance of cellulose-containing textiles to
micro-organisms−Soil burial test−Part 2: Identification of long-term resistance of a rot retardant finish
[13] ISO 16869:2008,Plastics−Assessment of the effectiveness of fungistatic compounds in plastics formulations
[14] ISO 20743:2007,Textiles−Determination of antibacterial activity of antibacterial finished products
[15] IEC 60068-2-10:2005,Environmental testing−Part 2-10: Tests−Test J and guidance: Mould growth
[16] AATCC試験法30:2004,Antifungal activity, Assessment on Textile materials: Mildew and Rot resistance of
Textile Materials
[17] AATCC試験法174:2007,Antimicrobial Activity Assessment of Carpets
[18] ASTM基準21-96:2002,Standard Practice for Determining Resistance of Synthetic Polymeric Materials to
Fungi
[19] MIL STD 810F-508.5:2003,Department of defense test method standard for environmental engineering
consideration and laboratory tests−Method 508.5: Fungus
[20] Federal Test Method Standard, No.311, 5041-1975, Mildew Resistance, Tropical Chamber Method
[21] DIN 53931,Testing of textiles; determination of resistance of textiles to mildew; growth test
[22] BS 6085:1992,Methods for determination of the resistance of textiles to microbiological deterioration
[23] BS 2011:Part 2.1J (IEC 68-2-10),Basic environmental testing procedures
[24] AS 1157.2:1999,Australian Standard−Methods of Testing Materials for Resistance to Fungal Growth Part 2:
Resistance of Textiles to Fungal growth. Section 1−Resistance to Surface Mould Growth
[25] AS 1157.3:1999,Australian Standard−Methods of Testing Materials for Resistance to Fungal Growth Part 2:
Resistance of Cordage and Yarns to Fungal Growth
[26] AS 1157.4:1999,Australian Standard−Methods of Testing Materials for Resistance to Fungal Growth Part 2:
Resistance of Textiles to Fungal Growth. Section 2−Resistance to Cellulolytic Fungi
[27] EN 12225:2000,Geotextiles and geotextile-related products−Method for determining the microbiological
resistance by a soil burial test
18
L 1921:2015
[28] EN 12353:2006,Chemical disinfectants and antiseptics−Preservation of test organisms used for the
determination of bactericidal, mycobactericidal, sporicidal and fungicidal activity
[29] EN 14119:2003,Testing of textiles−Evaluation of the action of microfungi
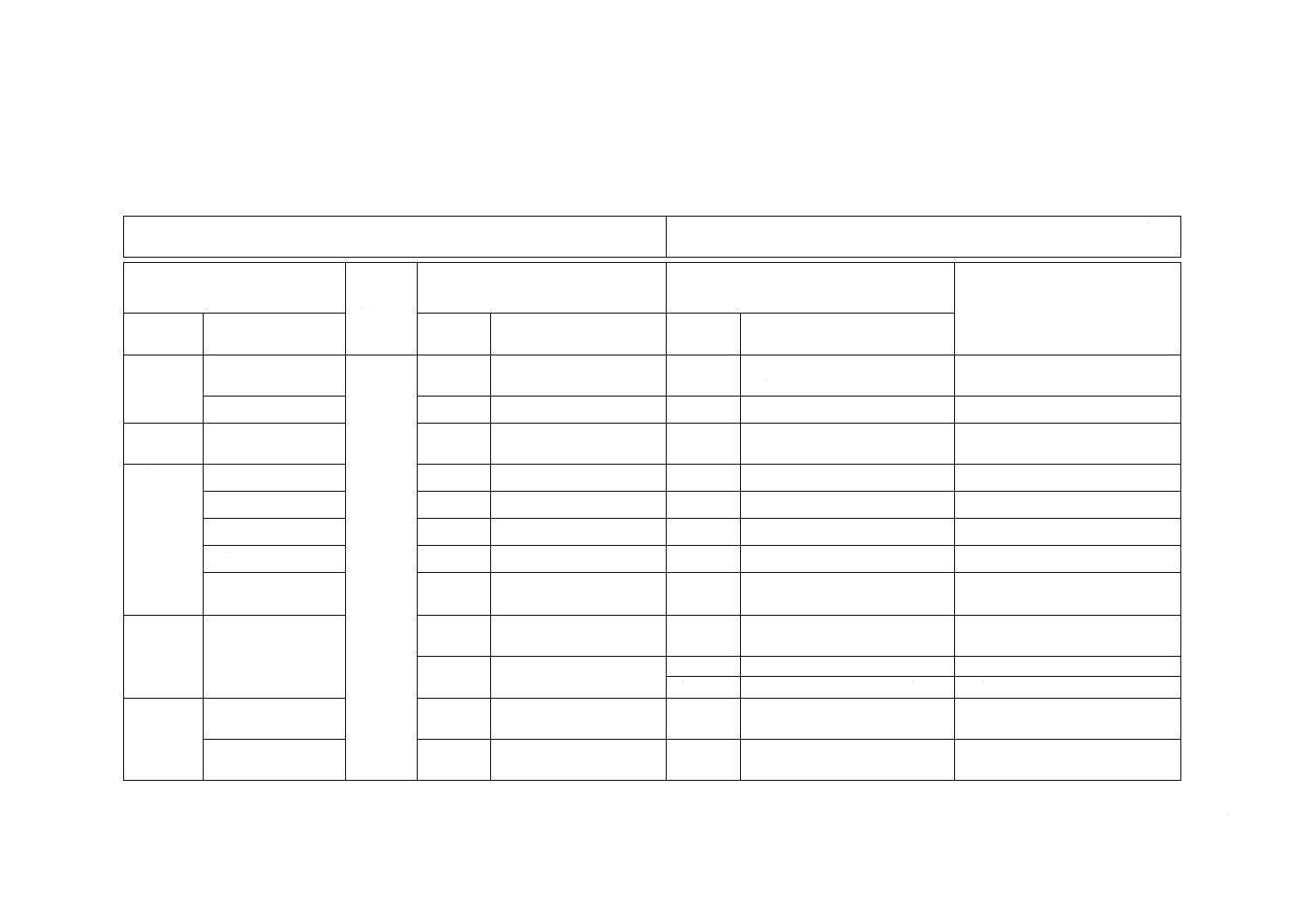
19
L 1921:2015
附属書JA
(参考)
JISと対応国際規格との対比表
JIS L 1921:2015 繊維製品の抗かび性試験方法及び抗かび効果
ISO 13629-1:2012,Textiles−Determination of antifungal activity of textile products
−Part 1: Luminescence method
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及
び定義
3.1 対照試料
JISにほぼ同じ
(以下同文)
追加
綿布の洗濯処理の詳細を追加
した。
国際規格では対照試料としての
綿布の作製法が不十分なため
3.7 抗かび効果
追加
用語及び定義を追加した。
抗かび効果を規定するため
6 試験か
び
試験で使用するか
び
追加
表A.2を追加した。
Web参照の手間を省くため
7 装置
7.2 シャーレ
追加
規定の追加をした。
不十分のため追加した。
7.7 かぎ型白金耳
追加
規定の追加をした。
不十分のため追加した。
7.11 ガラス製漏斗
追加
規定の追加をした。
不十分のため追加した。
7.15 ピンセット
追加
規定の追加をした。
不十分のため追加した。
7.23 発光光度計
変更
仕様が規格に適合していない。 国際規格の仕様では適切な結果
を求められないため
8 試薬及
び培地
8.4.4 ATP発光試薬
変更
仕様が規格に適合していない。 国際規格の仕様では適切な結果
を求められないため
追加
箇条13を追加した。
国内の試験実態に合わせた。
追加
他の試薬の使用について追記。 国内の利用実態に合わせた。
10 かび胞
子懸濁液
10.4 培地成分の除
去
追加
上澄み液の採取方法を追加し
た。
他の方法をとらないよう限定し
た。
10.5 胞子濃度確認
追加
計測方法を追加した。
作業者によって作業が異なるの
を避けるための追加規定
2
L
1
9
2
1
:
2
0
1
5
20
L 1921:2015
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
10 かび胞
子懸濁液
(続き)
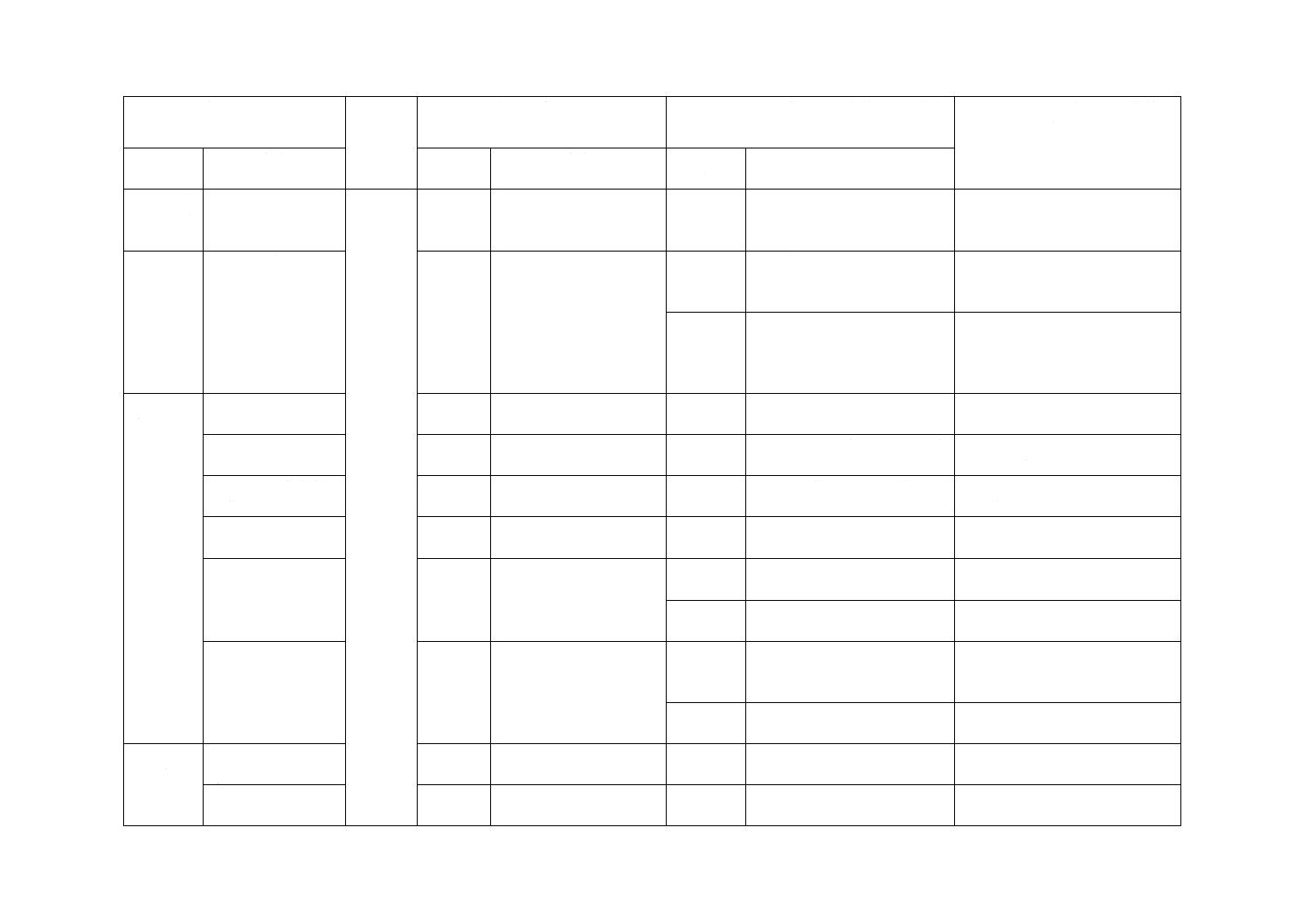
10.6 吸収法のかび
胞子懸濁液の調製
追加
ISO規格では接種胞子濃度の
算出方法の詳細が記載されて
いない。
接種胞子濃度の算出を明確化し
た。
11 ATP検
量線の作
成
ATP検量線の作成
変更
検量線作成頻度を変更した。
設定頻度が試験運用上不適切な
ため
変更
相関係数を変更した。
国際規格の設定では試験運用実
態に合わないため,また,同様の
試験であるJIS L 1902と合わせ
た。
12 試験方
法
12.1.2.2 c)カーペッ
トなどの場合
追加
本体も使用できることとした。 試験運用実態に合わないため追
加した。
12.1.2.2 d)前処理に
ついて
選択
洗濯処理に限定しないよう変
更した。
洗濯処理に対応するJISが検討段
階のため変更した。
12.1.2.2 e)試験片の
滅菌について
変更
原則,滅菌する表現に改めた。 試験片に微生物汚染がないこと
を確実にするため
12.1.2.3 試験片への
接種
変更
ガラス棒限定を解除した。
ガラス棒への液付着による液量
変化を避けるための変更
12.1.3.1 試験片の準
備
削除
試料の採取部位の説明部分を
削除した。
試料の採取においては,JISの試
験通則が前提にあるため
追加
前処理の記載なし。
前処理をした場合の対応方法を
記載した。
12.1.3.3 試験片への
転写
変更
“培養後”ではなく“接種直後”
に変更した。
シャーレに入れて質量計測する
のは“培養後”ではなく“接種直
後”のため
追加
接種直後の測定を明記した。
国際規格に抜けているので追加
した。
13 発光量
の測定
13.1 吸収法
a)
追加
接種直後の測定を明記した。
国際規格に抜けているので追加
した。
b),d)注記
削除
ガラス棒限定を削除した。
ガラス棒への液付着による液量
変化を避けるため
2
L
1
9
2
1
:
2
0
1
5
21
L 1921:2015
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
13 発光量
の測定
h),i)
追加
検出限界とATP量への計算式
を追加した。
国際規格に抜けているので追加
した。
(続き)
13.2 トランスファ
ー法
a)
追加
接種直後の測定を明記した。
国際規格に抜けているので追加
した。
b),d)注記
削除
ガラス棒限定を削除した。
ガラス棒への液付着による液量
変化を避けるため
h),i)
追加
検出限界とATP量への計算式
を追加した。
国際規格に抜けているので追加
した。
14 試験結
果
14.1 試験成立の判
定 b)
変更
数値の丸め方を変更した。
結果の表記を明確にするため
14.2 抗かび活性値
の計算
変更
数値の丸め方を変更した。
結果の表記を明確にするため
変更
常用対数値の平均ではなく,算
術平均の常用対数値へ変更し
た。
直近の国際規格との整合による
変更
15抗かび
効果
抗かび効果
追加
抗かび効果を追加規定した。
市場事情に対応するため
附属書A
(規定)
この規格で使用さ
れる試験かび
追加
例を表A.2として追加規定し
た。
Web参照の手間を省くため
JISと国際規格との対応の程度の全体評価:ISO 13629-1:2012,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
− 選択……………… 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
2
L
1
9
2
1
:
2
0
1
5