L 1918:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 試験の準備 ······················································································································ 2
4.1 培養ヒト皮膚モデル取扱時の条件······················································································ 2
4.2 試験に用いる培養ヒト皮膚モデル······················································································ 2
4.3 試薬,材料及び器具 ······································································································· 3
4.4 殺菌方法 ······················································································································ 4
4.5 試薬の調製方法 ············································································································· 4
4.6 コントロール試料 ·········································································································· 5
5 試験······························································································································· 5
5.1 試験手順 ······················································································································ 5
5.2 試験操作 ······················································································································ 6
5.3 試験結果 ······················································································································ 7
附属書A(参考)入手可能な培養ヒト皮膚モデル ······································································ 11
L 1918:2011
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,社団法人繊維評価
技術協議会(JTETC)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改
正すべきとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した日本工業規格であ
る。これによって,JIS L 1918:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
L 1918:2011
繊維製品の皮膚一次刺激性試験方法−
培養ヒト皮膚モデル法
Testing for skin primary irritation on textile products-
in vitro human skin model method
序文
この規格は,生体(ヒト又は動物)を用いることなく,繊維製品の皮膚への一次刺激性を予測・予知する
ため,培養ヒト皮膚モデルによるインビトロ試験方法の標準化を目的に2005年に制定され,今日に至って
いる。その後の新たな皮膚モデルの開発が進む中,試験手順又は試験方法の見直しが必要となったことか
ら,それらに対応するために改正した。
なお,対応国際規格は現時点で制定されていない。
1
適用範囲
この規格は,培養ヒト皮膚モデルを用いて,繊維製品の皮膚への化学刺激性を予測・予知するインビト
ロ試験方法について規定する。
注記 インビトロ試験方法由来の特性として,この規格の試験結果をもって臨床的に絶対に安全であ
るとはいえない。また,この培養ヒト皮膚モデルは,皮膚の角質層及び/又は角化細胞に直接
的に影響を及ぼす皮膚一次刺激性のうち化学刺激性を予測・予知するもので,熱及び物理刺激
性は予測・予知できない。さらに,免疫応答に関与する細胞などを含まないので,実際の皮膚
で見られるアレルギー性又は慢性の刺激性も予測・予知できない。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0115 吸光光度分析通則
JIS K 0557 用水・排水の試験に用いる水
JIS K 3600 バイオテクノロジー用語
JIS K 8101 エタノール(99.5)(試薬)
JIS K 8150 塩化ナトリウム(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8839 2-プロパノール(試薬)
JIS K 9009 りん酸二水素ナトリウム二水和物(試薬)
JIS K 9019 りん酸水素二ナトリウム・12水(試薬)
JIS K 9050 L-ヒスチジン塩酸塩一水和物(試薬)
2
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS L 0803 染色堅ろう度試験用添付白布
JIS L 0848 汗に対する染色堅ろう度試験方法
JIS R 3505 ガラス製体積計
JIS Z 8401 数値の丸め方
JIS Z 8805 pH測定用ガラス電極
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
培養ヒト皮膚モデル
ヒト皮膚由来の細胞を用いて3次元的に再構築させた角質層をもつ皮膚モデル。
3.2
細胞生存率
無刺激下における培養ヒト皮膚モデルの生存細胞量に対し,刺激下の培養ヒト皮膚モデルの生存細胞量
の比率(%)。
3.3
皮膚一次刺激性
繊維製品が皮膚の角質層,角化細胞に及ぼす急性の刺激性。
3.4
化学刺激性
繊維製品に含まれる化学物質が直接,皮膚の角質層及び/又は角化細胞に及ぼす刺激性。熱,摩擦など
の皮膚への物理刺激性と区別される。
3.5
インビトロ試験方法
生体から取り出した組織成分,細胞などを,試験管内などの生体外で試験する方法。
3.6
MTT法
培養ヒト皮膚モデルの細胞の生死を検出する方法。生細胞は青紫色に染色される。
3.7
貼付試験
培養ヒト皮膚モデルに被験試料を貼付し,24時間又は48時間インキュベーションする試験。
4
試験の準備
4.1
培養ヒト皮膚モデル取扱時の条件
培養ヒト皮膚モデルは,クリーンベンチ内で開封し,無菌状態で使用する。試験操作時は,手袋を使用
する。
4.2
試験に用いる培養ヒト皮膚モデル
この規格で用いる培養ヒト皮膚モデルは,次に規定する要件を満たすものとする。
a) ヒト由来の皮膚角化細胞又はヒト由来の皮膚角化細胞及び皮膚線維芽細胞で構成され,3次元的に再
構築された角質層をもつもの。
3
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 直径6 mm以上の試験片が接触できる表面積をもち,試験片を直接,培養ヒト皮膚モデル表面に接触
させることができるもの。
注記 2010年10月の時点で入手可能な培養ヒト皮膚モデルの製品名及び供給者名を表A.1に参考と
して示す。
なお,日本工業規格は,表A.1を推奨するものでなく,また,4.2の要件を満たすことを保証
するものではない。
4.3
試薬,材料及び器具
この規格で用いる試薬,材料及び器具は,特に指定がない限り,次による。
a) エタノール(C2H5OH) JIS K 8101に規定する1級以上のもの。
b) 塩酸(HCl) JIS K 8180に規定する特級のもの。
c) 2-プロパノール[(CH3)2CHOH] JIS K 8839に規定するもの。
d) 塩化ナトリウム(NaCl) JIS K 8150に規定する特級のもの。
e) 蒸留水(H2O) 第十五改正日本薬局方の基準に適合するもの又はJIS K 0557に規定するA2又はA3
に適合するもの。
f)
りん酸二水素ナトリウム二水和物(NaH2PO4・2H2O) JIS K 9009に規定するもの。
g) りん酸水素二ナトリウム・12水(Na2HPO4・12H2O) JIS K 9019に規定するもの。
h) ラウリル硫酸ナトリウム(SLS)[CH3(CH2)11OSO3Na] 純度99.0 %以上の生化学試験用のもの。
i)
L-ヒスチジン塩酸塩一水和物(C6H9N3O2・HCl・H2O) JIS K 9050に規定するもの。
j)
MTT試薬[3-(4,5-ジメチル-2-チアゾリル)-2.5-ジフェニル-2H-テトラゾリウムブロマイド,
C18H16BrN5S] 生化学試験用のもの。
k) 人工汗液 JIS L 0848に規定する酸性人工汗液。
l)
基準布 JIS L 0803に規定する染色堅ろう度試験用添付白布の綿(通常,綿3-1号)を,ウォッシャ
ーで,60 ℃に保持して10分間湯洗いし,5分間のすすぎを2回行い,これを10回繰り返したものを
沸騰水中で30分間処理し,蒸留水すすぎを3回行い,風乾したもの。
m) 培地 試験に用いる培養ヒト皮膚モデル用のもの。
n) ピペット 細胞培養用のもの。
o) アスピレータ 化学試験用のもの。
p) ピンセット 試験に用いる直径6 mm以上の試験片を取り扱えるもの。
q) 全量フラスコ JIS R 3505に規定するもの。
r) 培養プレート 細胞培養用のもの。
s)
メンブランフィルタ 孔径0.22 μm〜0.45 μmのもの。
t)
打抜きポンチ 試験片及び培養ヒト皮膚モデルを円形に打ち抜けるもので,直径6 mm以上の打抜き
径をもつもの。
u) CO2インキュベータ 温度37 ℃±1 ℃及びCO2濃度5〜10体積%に保てる細胞培養用のもの。
v) 乾熱殺菌器 温度を160 ℃〜170 ℃に保てるもの。
w) オートクレーブ 温度121 ℃(圧力103 kPa相当)に保てるもの。
x) クリーンベンチ 微生物試験用のもの。
y) 分光光度計 JIS K 0115に規定するもの。
z) マイクロプレートリーダ JIS K 3600に規定するもの。
aa) pH測定器 JIS Z 8805に規定するもの。
4
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ab) 遠心分離機 一般的なもの。
注記 試験管,フラスコ,ピペット,ピンセットなどは,アルカリ性又は中性洗剤で丁寧に洗浄し,
水で十分すすぎ,乾燥してから乾熱殺菌,高圧蒸気殺菌,火炎殺菌,アルコール殺菌又はγ線
殺菌したものを用いる。
4.4
殺菌方法
殺菌方法は,次の中から適切な方法を選択する。
a) 乾熱殺菌 殺菌しようとするものを,160 ℃〜170 ℃の乾熱殺菌器[4.3 v)]に入れ,1〜2時間保ち,
綿栓又は新聞紙が焦げて黄色くなる程度を限度に処理する。
b) 高圧蒸気殺菌 オートクレーブ[4.3 w)]に水を入れ,殺菌しようとするものを金網かごに入れてオ
ートクレーブの棚に載せる。オートクレーブの蓋を締めて加熱し,温度121 ℃(圧力103 kPa相当)
で15〜20分間保つ。加熱を止め,100 ℃以下に自然冷却後,排気弁を開き蒸気を抜き去り,蓋を開け
殺菌したものを取り出し,必要に応じてクリーンベンチ[4.3 x)]内で冷却する。
c) 火炎殺菌 殺菌しようとするものをガス又はエタノール[4.3 a)]の火炎に当てる。試験管の場合は,
2〜3秒間火炎に当てる。
d) アルコール殺菌 エタノール(75 vol%)に脱脂綿又はガーゼをひたし,軽く絞り,殺菌するものを十
分に拭き取る。
e) γ線殺菌 殺菌しようとするものに,15 kGy〜25 kGyのγ線を照射する。
4.5
試薬の調製方法
試薬の調製方法は,次による。
a) MTT溶液 MTT試薬[4.3 j)]を30 mg〜100 mgとり,培地[4.3 m)]に溶解して,0.3 mg/mL〜1.0 mg/mL
の濃度に調製する。MTT溶液は,使用時に調製し,8時間以内に使用する。調製後,直ちに使用しな
いときは,使用するまで,冷暗所に保存する。
b) 抽出溶媒 培養ヒト皮膚モデルの培養後の生細胞から,色素を90 %以上の効率で抽出可能なものに調
製する。
組成及び調製例を,次に示す。
全量フラスコ[4.3 q)]1 000 mLに2-プロパノール[4.3 c)]800 mL,塩酸[4.3 b)]3.3 mL以下を
加え混合し,2-プロパノールを標線まで加える。調製後,密栓して室温で保存する。調製後,6か月
を過ぎた抽出溶媒は用いてはならない。ただし,2-プロパノールだけを抽出溶媒とする場合は,この
限りではない。
c) 人工汗液 全量フラスコ1 000 mLに蒸留水[4.3 e)]800 mLを入れ,L-ヒスチジン塩酸塩一水和物[4.3
i)]0.5 g,塩化ナトリウム[4.3 d)]5.0 g,りん酸二水素ナトリウム二水和物[4.3 f)]2.2 gを加え溶か
し,0.1 mol/L水酸化ナトリウム溶液を加え,pH5.5±0.2(25 ℃)に調節する。調製後,全量フラスコ
1 000 mLに移し,蒸留水を標線まで加える。人工汗液[4.3 k)]は,使用する前に雑菌を取り除くた
め,孔径0.22 μm〜0.45 μmのメンブランフィルタ[4.3 s)]で除菌する。調製後,直ちに使用しないも
のは4 ℃〜10 ℃で保存する。調製後,3日を過ぎた人工汗液は用いてはならない。
d) 0.2 mol/Lりん酸二水素ナトリウム溶液 全量フラスコ500 mLに蒸留水400 mLを入れ,りん酸二水
素ナトリウム二水和物15.6 gを加え溶かし,蒸留水を標線まで加える。調製後,直ちに使用しないも
のは,密栓して,4 ℃〜10 ℃の温度で保存する。調製後,3か月を過ぎた0.2 mol/Lりん酸二水素ナ
トリウム溶液は用いてはならない。
e) 0.2 mol/Lりん酸水素二ナトリウム溶液 全量フラスコ500 mLに蒸留水400 mLを入れ,りん酸水素

5
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
二ナトリウム・12水[4.3 g)]35.8 gを加え溶かし,蒸留水を標線まで加える。調製後,直ちに使用し
ないものは,密栓して,4 ℃〜10 ℃の温度で保存する。調製後,3か月を過ぎた0.2 mol/Lりん酸水
素二ナトリウム溶液は用いてはならない。
f)
りん酸緩衝液 全量フラスコ300 mLにe) の0.2 mol/Lりん酸水素二ナトリウム溶液100 mLを入れ,
d) の0.2 mol/Lりん酸二水素ナトリウム溶液をかくはんしながら加え,pH測定器[4.3 aa)]でpH7.2
±0.2に調節する。全量フラスコ500 mLに,この溶液50 mL,蒸留水300 mLを入れ,塩化ナトリウ
ム4.5 gを加え溶かし,蒸留水を標線まで加える。りん酸緩衝液は,使用する前に雑菌を取り除くため,
孔径0.22 μm〜0.45 μmのメンブランフィルタで除菌する。調製後,直ちに使用しないものは,密栓し
て,4 ℃〜10 ℃の温度で保存する。調製後,1か月を過ぎたりん酸緩衝液は用いてはならない。
なお,これらの処方に準じて調製されている市販の滅菌済みりん酸緩衝液を用いてもよい。この場
合の使用期限は,メーカが定めた使用期限に従う。
g) ラウリル硫酸ナトリウム溶液(SLS) ラウリル硫酸ナトリウム[4.3 h)]溶液は,次による。
− ラウリル硫酸ナトリウム溶液(10 g/L)は,全量フラスコ100 mLに蒸留水80 mLを入れ,ラウリル
硫酸ナトリウム1.0 gを加え溶かし,蒸留水を標線まで加える。これをコントロール試料A用溶液
とする。
− ラウリル硫酸ナトリウム溶液(1 g/L)は,全量フラスコ100 mLに,ラウリル硫酸ナトリウム溶液
(10 g/L)10 mLを入れ,蒸留水を標線まで加える。これをコントロール試料B用溶液とする。
− ラウリル硫酸ナトリウム溶液(5 g/L)は,全量フラスコ100 mLに,ラウリル硫酸ナトリウム溶液
(10 g/L)50 mLを入れ,蒸留水を標線まで加える。これをコントロール試料C用溶液とする。
− ラウリル硫酸ナトリウム溶液(0.1 g/L)は,全量フラスコ100 mLに,ラウリル硫酸ナトリウム溶
液(1 g/L)10 mLを入れ,蒸留水を標線まで加える。これをコントロール試料D用溶液とする。
調製後は,いずれも密栓して,室温で保存する。調製後,1か月を過ぎたラウリル硫酸ナトリウム
溶液は用いてはならない。
4.6
コントロール試料
4.5 c) の人工汗液又は4.5 g) のラウリル硫酸ナトリウム溶液を,基準布[4.3 l)]に,基準布質量の3倍
量しみ込ませたものを,コントロール試料として,試験成立の判定に用いる。コントロール試料は,しみ
込ませる4.5 c) の人工汗液又は4.5 g) のラウリル硫酸ナトリウム溶液の濃度によって,表1に示す5種類
のコントロール試料に分類する。
表1−コントロール試料の分類
しみ込ませる溶液
コントロール試料の分類
ラウリル硫酸ナトリウム溶液(10 g/L)
コントロール試料A
ラウリル硫酸ナトリウム溶液(1 g/L)
コントロール試料B
ラウリル硫酸ナトリウム溶液(5 g/L)
コントロール試料C
ラウリル硫酸ナトリウム溶液(0.1 g/L)
コントロール試料D
人工汗液
コントロール試料O
5
試験
5.1
試験手順
試験は,24時間貼付試験から実施し,表3の試験結果の分類から,細胞生存率が50.0 %以上80.0 %未満
6
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
の場合は,48時間貼付試験を実施する。ただし,24時間貼付試験及び48時間貼付試験を同時に行っても
よい。
5.2
試験操作
5.2.1
培養ヒト皮膚モデルの組立
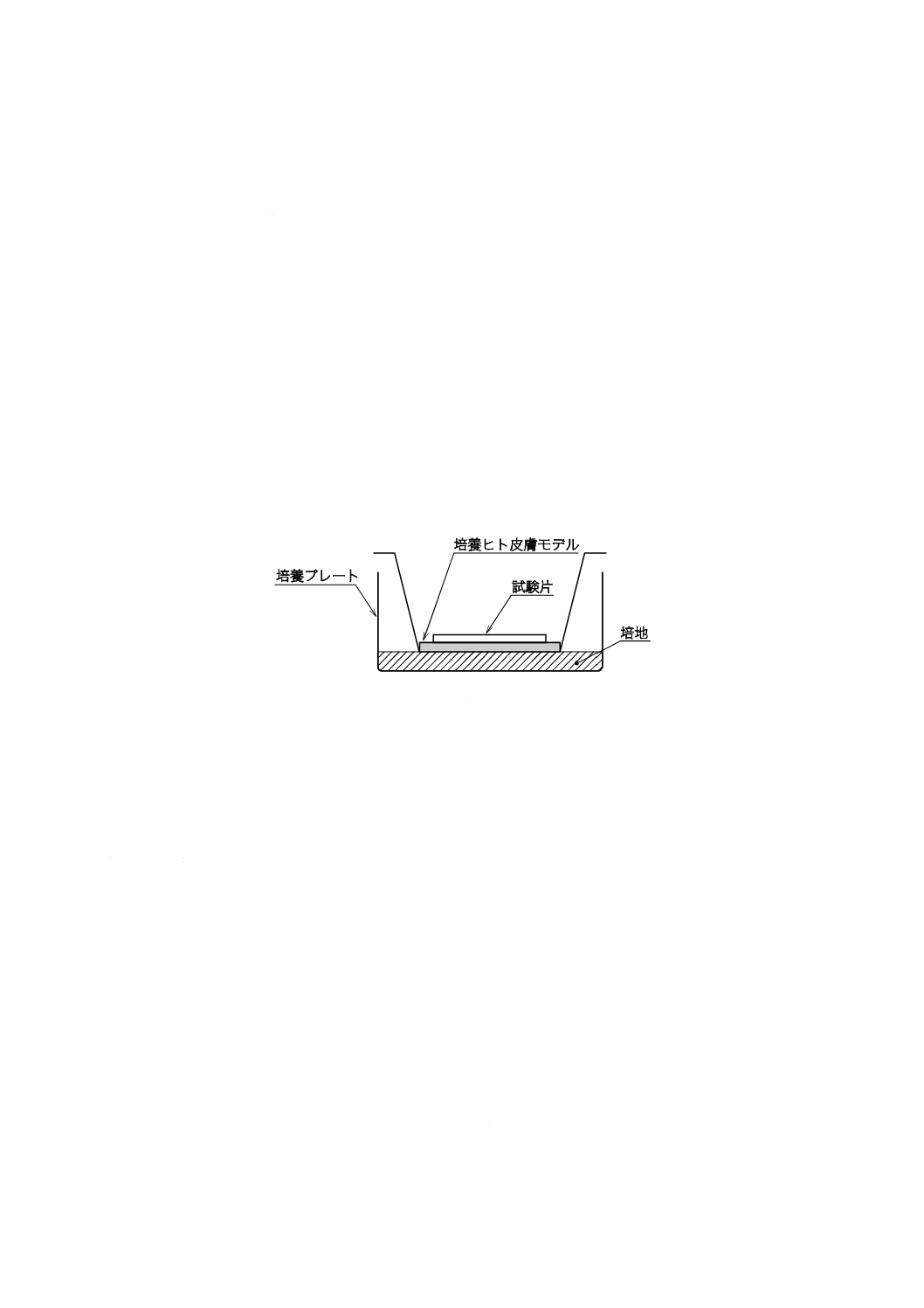
クリーンベンチ内で,図1に示すように,培養プレート[4.3 r)]のウエルに培養ヒト皮膚モデルを設置
する。次に,ピペット[4.3 n)]を用いて,培地を,培養ヒト皮膚モデルの底面が浸る程度に加えて,培養
ヒト皮膚モデルの表面が空気にさらされるようにする。このとき,培養ヒト皮膚モデルと培地との境界に
気泡が入らないように注意する。この培養ヒト皮膚モデルの組立を,15ウエル用意する。
なお,培養ヒト皮膚モデルの組立15ウエルの内訳は,次による。
− 3ウエルは被験試料の貼付試験用。
− 3ウエルはコントロール試料Oの貼付試験用。
− 6ウエルはコントロール試料(24時間貼付試験はコントロール試料A及びB,48時間貼付試験はコン
トロール試料C及びD)の貼付試験用。
− 3ウエルは,対照(比較用の試料)として試料を貼付しない。
図1−培養ヒト皮膚モデルの組立(1ウエル)
5.2.2
試験片の採取
培養ヒト皮膚モデルの大きさに合わせて,打抜きポンチ[4.3 t)]で,直径6 mm以上の円形に打ち抜い
たものを1片とし,被験試料を3片,基準布を9片採取する。試験片の採取に当たっては,汚染に十分注
意する。ただし,被験試料が綿,糸などの場合は,隙間がないように均一にへん(扁)平状にし,打抜き
ポンチで,直径6 mm以上の円形に打ち抜いて試験片とする。
なお,基準布の9片は,24時間貼付試験の場合は,4.6のコントロール試料A,B及びOの作製のため
に,それぞれ3片を用い,48時間貼付試験の場合は,4.6のコントロール試料C,D及びOの作製のため
に,それぞれ3片を用いる。
5.2.3
試験片の貼付
5.2.2の各試験片は,1試験片ごとピンセット[4.3 p)]を用いて培養ヒト皮膚モデルの表皮面に貼付する。
ただし,コントロール試料貼付及び未貼付の培養ヒト皮膚モデル試験は,同一製造ロットの培養ヒト皮膚
モデルを用いる限り,被験試料ごとに行う必要はなく,試験操作内で1回の試験でよい。
次に,被験試料の試験片3片には,ピペットを用いて試験片質量の3倍量の4.5 c) の人工汗液をしみ込
ませる。この場合,人工汗液が容易にしみ込まない試験片については,アルコール殺菌を行った台の上で
圧力などをかけて,あらかじめ,しみ込ませたものを貼付してもよい。
コントロール試料の試験片においても,被験試料と同様の操作で実施する。
7
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
24時間貼付試験の場合は,4.5 c) の人工汗液をしみ込ませたコントロール試料Oの3片,4.6に示す濃
度の4.5 g) のラウリル硫酸ナトリウム溶液をしみ込ませたコントロール試料Aの3片及びコントロール試
料Bの3片を用いる。
48時間貼付試験の場合は,4.5 c) の人工汗液をしみ込ませたコントロール試料Oの3片,4.6に示す濃
度の4.5 g) のラウリル硫酸ナトリウム溶液をしみ込ませたコントロール試料Cの3片及びコントロール試
料Dの3片を用いる。
このとき,培養ヒト皮膚モデルの表皮と試験片との接触面には,気泡が入らないように十分注意する。
5.2.4
インキュベーション
5.2.3の試験片を貼付した培養ヒト皮膚モデルの培養プレートの蓋を締めた後,培養プレートを静かに
CO2インキュベータ[4.3 u)]に移し,CO2濃度を5〜10 体積%に保ちながら,37 ℃±1 ℃で24時間培養
する。
5.2.5
試験片の除去
CO2インキュベータから培養プレートを取り出し,クリーンベンチ内に移す。培養プレートの蓋を開き,
ピンセットを用いて培養ヒト皮膚モデルの表面をきず付けないように注意して,培養ヒト皮膚モデルの表
面から試験片を剥がす。試験片を除去した後,培養ヒト皮膚モデルの表面に,試験片由来の人工汗液及び
/又はラウリル硫酸ナトリウム溶液が残存するときは,培地又は4.5 f) のりん酸緩衝液を用いて表面を洗
浄する。
洗浄後,培養ヒト皮膚モデルの表面に残った培地,又はりん酸緩衝液は,ピペット,アスピレータ[4.3
o)]などで吸引して取り除く。
5.2.6
生細胞の染色
培養ヒト皮膚モデルが,十分に浸せきする量の4.5 a) のMTT溶液を,ピペットを用いて,各培養プレ
ートに加える。次いで,各培養プレートを,CO2インキュベータに移し,CO2濃度を5〜10 体積%に保ち
ながら,37 ℃±1 ℃で3時間培養して生細胞を染色する。
5.2.7
抽出
CO2インキュベータから培養プレートを取り出し,クリーンベンチ内に移す。次に,打抜きポンチを用
いて,試験片が接触していた培養ヒト皮膚モデルの部分を打ち抜く。打ち抜いた培養ヒト皮膚モデルの組
織片を,注意深くピンセットでつまみ上げ,あらかじめ準備しておいた4.5 b) の抽出溶媒が入っている培
養プレート又は試験管に浸せきする。
抽出溶媒の量は,組織片が十分に浸せきする最少量でよい(直径6 mmの組織片では,0.3 mL〜0.5 mL
の抽出溶媒を使用する。)。抽出は,抽出溶媒が気散しないよう,培養プレートの場合は蓋を閉め,試験管
の場合は,シリコン栓などで密栓し,2時間〜24時間以内に室温暗所で行う。
5.2.8
測定
抽出した液は,分光光度計[4.3 y)]又はマイクロプレートリーダ[4.3 z)]で,波長570 nmにおける吸
光度を測定する。
抽出した液に,濁りが見られるときは,回転速度3 000 min−1以上で1分間遠心分離[4.3 ab)]して,そ
の上澄み液を用いて測定する。同時に,空試験として,抽出溶媒の吸光度を測定する。
5.3
試験結果
試験結果は,次による。
a) 吸光度の求め方 試料ごとに,抽出した三つの液の吸光度を平均し,JIS Z 8401によって有効数字3
桁まで求める。
8
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
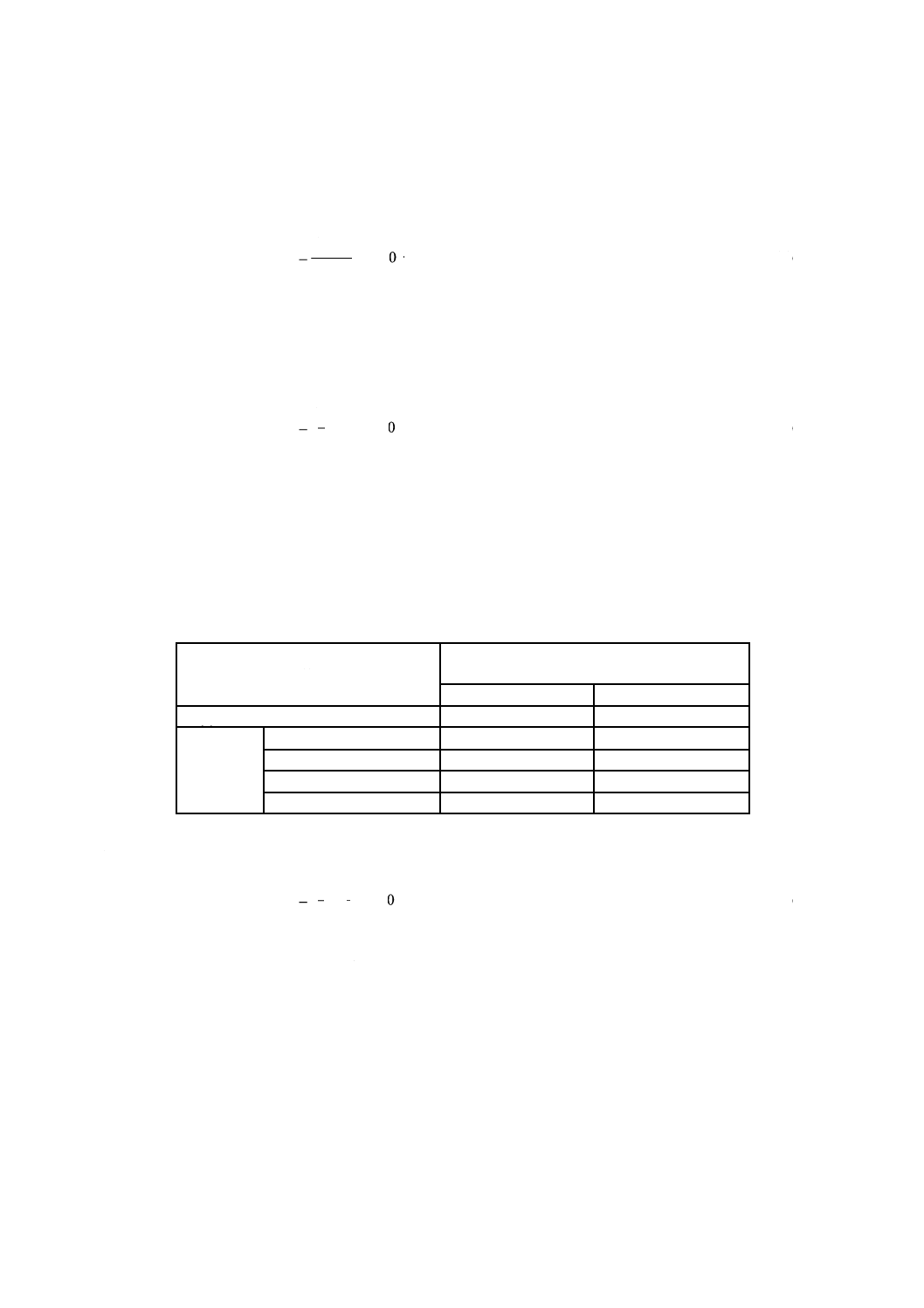
b) 試験成立の判定 試験成立の判定は,細胞生存率によって行う。細胞生存率は,式(1)及び式(2)によっ
て,有効数字3桁まで求める。細胞生存率が,表2に示す細胞生存率の値を満たしているとき,試験
成立と判定する。ただし,細胞生存率の値を満たしていない場合は,試験不成立と判定し,再試験を
行う。
(
)
(
)100
2
1
×
−
−
=
b
B
b
B
V
······································································· (1)
ここに,
V: 細胞生存率(%)
B1: コントロール試料Oの試験片を貼付した組織片から抽出した
液の吸光度
B2: 未貼付の組織片から抽出した液の吸光度
b: 抽出溶媒の吸光度
(
)
(
)100
1
1
×
−
−
=
b
B
b
C
V
······································································· (2)
ここに,
V: 細胞生存率(%)
C1: コントロール試料の試験片を貼付した組織片から抽出した液
の吸光度
B1: コントロール試料Oの試験片を貼付した組織片から抽出した
液の吸光度
b: 抽出溶媒の吸光度
表2−貼付試験の成立条件
計算式
細胞生存率
%
24時間貼付試験
48時間貼付試験
式(1)
80.0以上
80.0以上
式(2)
コントロール試料A
20.0未満
−
コントロール試料B
80.0以上
−
コントロール試料C
−
20.0未満
コントロール試料D
−
80.0以上
c) 被験試料の細胞生存率の計算 試験が成立したものについて,式(3)によって細胞生存率を求める。
(
)
(
)100
1
1
×
−
−
=
b
B
b
A
V
······································································· (3)
ここに,
V: 細胞生存率(%)
A1: 被験試料の試験片を貼付した組織片から抽出した液の吸光度
B1: コントロール試料Oの試験片を貼付した組織片から抽出した
液の吸光度
b: 抽出溶媒の吸光度
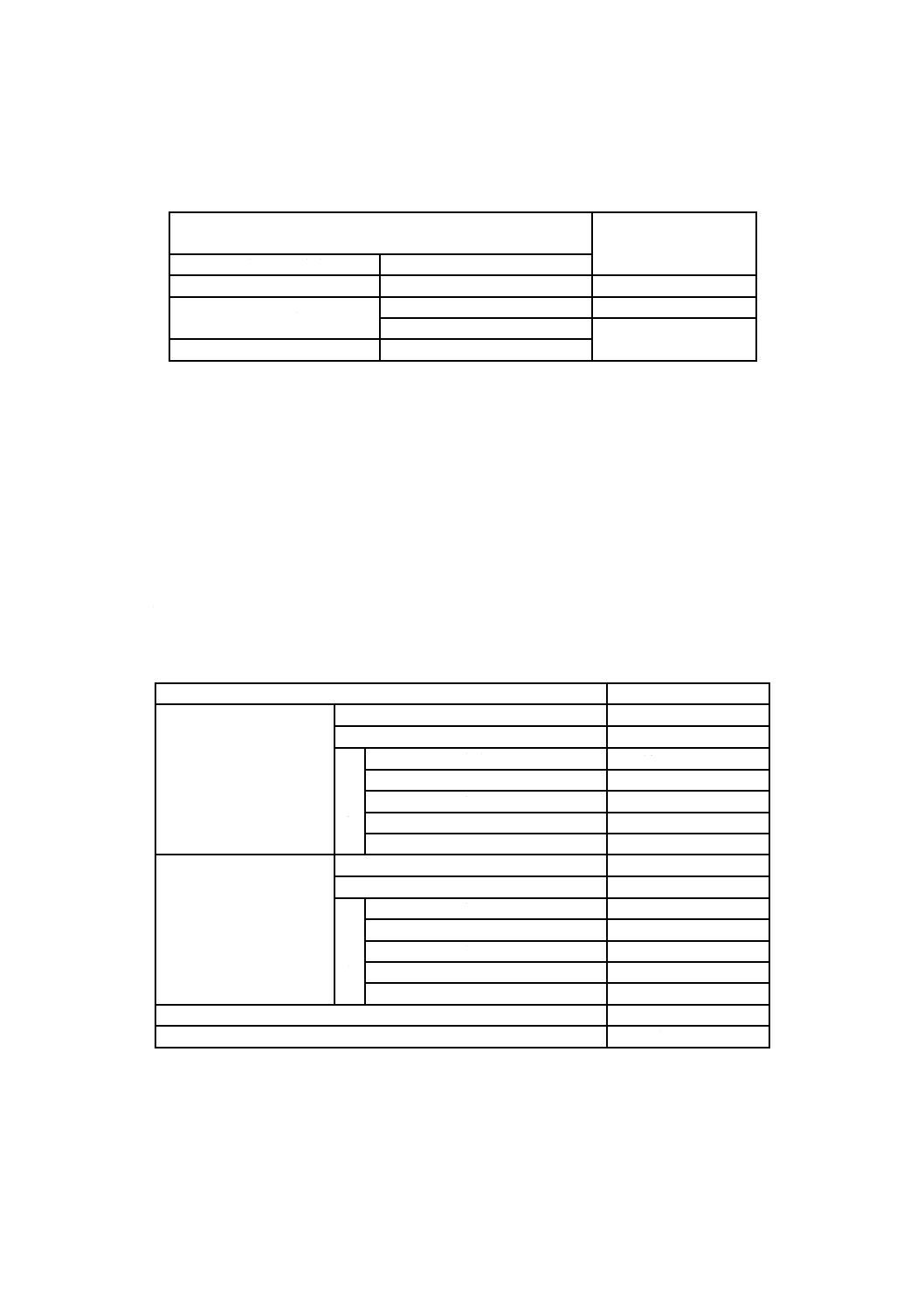
d) 試験結果の分類 式(3)によって求めた細胞生存率の値から,表3によって,被験試料の皮膚一次刺激
性を分類する。
24時間貼付試験で,細胞生存率が80.0 %以上を示した場合は,被験試料の皮膚への一次刺激性は,
陰性に分類し,50.0 %未満を示した場合は,陽性に分類する。24時間貼付試験で,細胞生存率が50.0 %
以上,80.0 %未満を示した場合は,更に,48時間貼付試験を実施し,細胞生存率が50.0 %未満の場合
9
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
は,弱陽性に分類し,50.0 %以上の場合は,陰性に分類する。
表3−皮膚一次刺激性の分類
細胞生存率
%
皮膚一次刺激性の分類
24時間貼付試験
48時間貼付試験
50.0未満
−
陽性
50.0以上 80.0未満
50.0未満
弱陽性
50.0以上
陰性
80.0以上
−
e) 試験結果の記録 試験結果の記録事項は,次による(表4及び表5参照)。
1) 被験試料名及び素材名
2) 試験に用いた培養ヒト皮膚モデル製品名
3) 培養ヒト皮膚モデルの製造ロット番号
4) コントロール試料の細胞生存率(%)
5) 試験成立の判定結果
6) 被験試料の細胞生存率(%)
7) 皮膚一次刺激性の分類
8) 試験年月日
表4−靴下の試験結果の例
試料名(素材)
靴下(綿100 %)
24時間貼付試験
試験に用いた培養ヒト皮膚モデル
(製品名)
製造ロット番号
0728
細
胞
生
存
率
コントロール試料O
95.3 %
コントロール試料A
15.4 %
コントロール試料B
93.1 %
試験成立判定
成立
被験試料
70.8 %
48時間貼付試験
試験に用いた培養ヒト皮膚モデル
(製品名)
製造ロット番号
0305
細
胞
生
存
率
コントロール試料O
96.6 %
コントロール試料C
12.7 %
コントロール試料D
97.2 %
試験成立判定
成立
被験試料
58.3 %
皮膚一次刺激性の分類
陰性
試験年月日
年 月 日

10
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5−Tシャツの試験結果の例
試料名(素材)
Tシャツ(綿100 %)
24時間貼付試験
試験に用いた培養ヒト皮膚モデル
(製品名)
製造ロット番号
030120
細
胞
生
存
率
コントロール試料O
97.3 %
コントロール試料A
10.8 %
コントロール試料B
96.8 %
試験成立判定
成立
被験試料
32.6 %
皮膚一次刺激性の分類
陽性
試験年月日
年 月 日
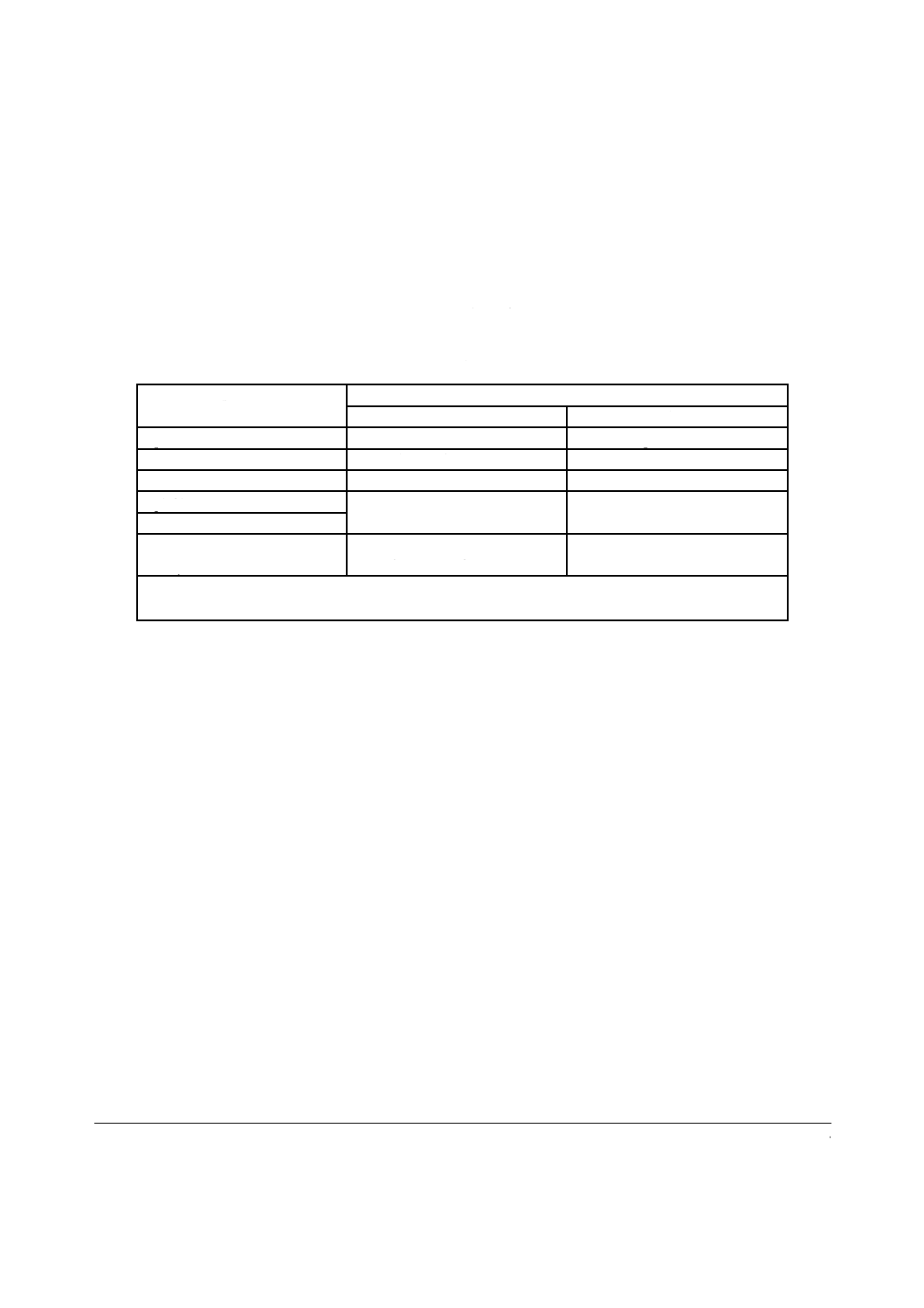
11
L 1918:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(参考)
入手可能な培養ヒト皮膚モデル
この規格は,繊維製品のヒトへの皮膚一次刺激性を予測・予知するための試験方法であることから,ヒ
ト皮膚由来の細胞を用いて3次元的に再構築させた角質層をもつ培養ヒト皮膚モデルを用いることとした。
2010年10月時点における,入手可能な培養ヒト皮膚モデルの製品名及び供給者名を,表A.1に示す。
表A.1−培養ヒト皮膚モデルの製品名及び供給者名
製品名
供給者名
国内
海外
EpiDerm EPI-200 a)
倉敷紡績株式会社
MatTek Corporation(USA)
Testskin LSE a)
東洋紡績株式会社
−
Vitrolife a)
グンゼ株式会社
−
EpiSkin
株式会社ニコダームリサーチ
SkinEthic Laboratories(France)
SkinEthic RHE
LabCyte EPI-MODEL12
LabCyte EPI-MODEL24
株式会社ジャパン・ティッシュ・
エンジニアリング
−
注a) 規格制定時に皮膚貼付試験との対比試験を行った培養ヒト皮膚モデルは,EpiDerm EPI-200,
Testskin LSE及びVitrolifeの3製品である。
参考文献 OECD:2004 In vitro Skin Corrosion:Human Skin Model Test, OECD Guideline for the Testing of
Chemicals No.431