K 6951 : 2000 (ISO 14852 : 1999)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法に基づいて,日本工業標準調査会の審議を経て,通商産業大臣が制定した日
本工業規格である。
今回の制定では,対応国際規格ISO 14852 : 1999を基礎として用いた。
JIS K 6951には,次に示す附属書がある。
附属書A(参考) 発生二酸化炭素量を測定する試験装置の原理(例)
附属書B(参考) 発生二酸化炭素の定量法の例
附属書C(参考) 炭素収支の測定例
附属書D(参考) 生分解度試験の終わりに,水に不溶性のポリマーの残存量及びその分子量を測定
する例
附属書E(参考) 参考文献
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 6951 : 2000
(ISO 14852 : 1999)
プラスチック−水系培養液中の
好気的究極生分解度の求め方
−発生二酸化炭素量の測定による方法
Determination of the ultimate aerobic biodegradability
of plastic materials in an aqueous medium
−Method by analysis of evolved carbon dioxide
序文 この規格は,1999年に発行されたISO 14852, Determination of the ultimate aerobic biodegradability of
plastic materials in an aqueous medium−Method by analysis of evolved carbon dioxideを翻訳し,技術的内容及
び規格票の様式を変更することなく作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格にはない事項である。
警告 下水汚水,活性汚泥,土壌及びコンポストは,潜在的に病原性生物を含む可能性がある。したがっ
て,取扱いに際し,適切な予防措置を講じる必要がある。有毒な及び性質の未知な試験物質を扱う
場合は,注意深く取り扱わなければならない。
0. 緒言 プラスチック材料の使用量の増大に伴い,その回収及び廃棄が,大きな問題となった。回収を
促進するのが,最優先である。しかし,プラスチックの完全な回収は,困難である。例えば,主として消
費者から出るプラスチックごみの完全な回収は困難である。さらに,回収困難な例として,漁具・農業用
マルチフィルム及び水溶性ポリマーが挙げられる。これらプラスチック材料は,閉鎖系の廃棄物処理サイ
クルから環境に流出する傾向がある。生分解性プラスチックは,現在このような環境問題を解決する手段
の一つとして登場した。コンポスト施設に送られる製品又は包装材のようなプラスチック材料は,生分解
性をもつべきである。したがって,生分解性の可能性及び自然環境下でのプラスチック材料の生分解性の
尺度を得ることは重要である。
1. 適用範囲 この規格は,発生二酸化炭素量を測定することによって,成形添加物を含むプラスチック
材料の好気的生分解度を求めるための方法について規定する。試験材料は,水系培養液による実験室条件
下で,活性汚泥,コンポスト又は土壌からの植種源に暴露される。
もし,植種源として非じゅん(馴)化活性汚泥を用いる場合には,この試験は,水系自然環境下での生
分解過程を模擬し,混合又は予暴露植種源を用いる場合は,試験材料のあらゆる生分解性の可能性を検討
する方法である。
この規格に使用された条件は,必ずしも最大の生分解が生じる最適条件に対応しないが,あらゆる生分
2
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
解性の可能性又は自然環境下でのプラスチック材料の生分解性の尺度を測定するように定められている。
この方法は,炭素収支を計算することによって,生分解度の試験を向上させるものである(任意,附属
書C参照)。
この方法が適用される物質は,
− 天然及び/又は合成高分子,共重合体又は,これらの混合物;
− 可塑剤,着色材又は他の物質のような添加物を含むプラスチック材料;
− 水溶性高分子;
− 植種源に存在する微生物に試験条件下で阻害的でない材料。阻害性効果は,阻害対照を使用するか,
又は他の適切な方法(例えば,ISO 8192参照)によって決定できる。もし試験材料が,植種源に阻
害的で,低い試験濃度であるなら,他の植種源又は予暴露植種源を用いることができる。
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格のうちで,発行年を付記してあるものは,記載の年の版だけが,この規格の規定を
構成するものであって,その後の改正版・追補には適用しない。
ISO 8245 : 1999 Water quality−Guidelines for the determination of total organic carbon (TOC) and
dissolved organic carbon (DOC)
ISO 9439 : 1) Water quality−Evaluation of ultimate aerobic biodegradability of organic compounds in
aqueous medium−Carbon dioxide evolution test
ISO 10634 : 1995 Water quality−Guidance for the preparation and treatment of poorly water-soluble organic
compounds for the subsequent evaluation of their biodegradability in an aqueous medium
ISO/TR 15462 : 1997 Water quality−Selection of tests for biodegradability
3. 定義 この規格では,次の定義を適用する。
3.1
好気的究極生分解 (ultimate aerobic biodegradation) 微生物による酸素の存在下での,有機物の二
酸化炭素,水及び存在する他の元素の無機塩(無機質化)並びに新しいバイオマスへの分解。
3.2
活性汚泥 (activated sludge) 細菌又は他の微生物の成長によって好気的廃水処理において溶存酸
素の存在下,作られるバイオマス。
3.3
活性汚泥の懸濁固形物濃度 (concentration of suspended solids of an activated sludge) 既知量の活
性汚泥をろ過又は遠心分離し,105℃で一定質量になるまで乾燥することによって得られた固形物量。
3.4
溶存無機炭素量 DIC (dissolved inorganic carbon) 特定の相分離,例えば,15分間,40 000ms-2
の遠心分離又は,0.2μm-0.45μm直径の孔をもつ膜を用いる膜ろ過によって除去不可能な水中の無機炭素部
分。
3.5
理論的発生二酸化炭素量 ThCO2 (theoretical amount of released carbon dioxide) 化学物質が,完
全に酸化されるときに発生する二酸化炭素の最大理論量。分子式から計算され,試験物質1mg又は1g当
たり必要とされるmg-二酸化炭素量として表される。
3.6
全有機炭素量 TOC (total organic carbon) 水溶液及び水懸濁中の有機物に存在する有機炭素の総
量。
1)
改訂版を印刷中(ISO 9439:1990の改訂)
3
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.7
溶存有機炭素量 DOC (dissolved organic carbon) 特定の相分離,例えば,15分間,40000ms-2の
遠心分離,又は0.2μm-0.45μm直径の孔をもつ膜を用いる膜ろ過によって除去不可能な水中の有機炭素部
分。
3.8
誘導期 (lag phase) 試験の開始から,分解微生物のじゅん化及び選択のために要する時間(日数)
であり,化学物質又は有機物の生分解度が,理論最大分解度の10%に達する。
3.9
生分解の最大レベル (maximum level of biodegradation) 化学物質又は有機物が試験中に到達する
最大生分解度で百分率で表示される。これ以上生分解は起こらない。
3.10 生分解期 (biodegradation phase) 試験の誘導期終了時から生分解の最大レベルの約90%に到達す
るまでの時間(日数)。
3.11 定常期 (plateau phase) 生分解期の最後(最大生分解レベル)から試験終了までの時間(日数)。
3.12 予暴露 (pre-exposure) 微生物のじゅん化及び選択によって試験物質を分解する植種源の能力向上
を目的とする試験対象化学物質又は有機物の存在下での植種源の前培養。
3.13 予調整 (pre-conditioning) 試験条件での微生物のじゅん化によって試験性能の向上を目的とする
試験物質の存在しない試験条件下での植種源の前培養。
4. 原理 水試験系の好気的微生物を用いてプラスチック材料の生分解度を求める。試験混合物は,無機
塩培養液及び唯一の炭素源及びエネルギー源として,有機炭素の濃度が,100mg/l〜2 000mg/lである試験
材料,並びに植種源として活性汚泥若しくは活性土壌又はコンポストの懸濁液を含んでいる。この混合物
は,試験フラスコ中でかくはんされ,試験期間中生分解の速度に応じて,二酸化炭素を含まない空気が吹
き込まれる。微生物分解で発生した二酸化炭素量は,適切な分析手法で測定され,その例は附属書A及び
附属書Bに示されている。
生分解度は,発生した二酸化炭素量と理論量 (ThCO2) との比として計算され,パーセントで表される。
この試験結果は,生分解度曲線の定常期から決定された生分解の最大レベルである。生分解度の補足的な
情報を得るために炭素収支を計算してもよい(附属書C)。
各種の有機物に対して用いられるISO 9439と違って,この規格はプラスチック材料の生分解度を測定す
るために特別に作成されたものである。この特別な要求に基づいて,植種源,試験培養液を選択し,また
炭素収支の計算によって生分解度の評価の精度を向上させることを可能にした。
5. 試験環境 培養は,暗所若しくは散乱光下,微生物に有害な種々の蒸気から遮断された囲いの中,一
定温度,望ましくは20℃〜25℃,精度±1℃,又は使用される植種源と試験環境によって他の適切な温度
に保たれたところで行わなければならない。
備考 植種源がコンポストの場合は,より高い温度が適切であろう。
6. 試薬 評価の定まった分析用試薬だけを用いる。
6.1
蒸留水又は脱イオン水 有害な物質(特に銅)とDOC 2mg/l以上を含まないもの。
6.2
試験培養液 試験の目的に応じて,異なった試験培養液を使用できる。例えば,自然環境を模擬す
る場合は,標準試験培養液(6.2.1)を用いる。試験材料が高濃度で使用される場合は,より高い緩衝能力と
栄養分濃度をもつ最適化試験培養液(6.2.2)を用いる。
6.2.1
標準試験培養液
6.2.1.1
溶液 A
4
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
無水りん酸二水素カリウム (KH2PO4)
8.5 g
無水りん酸水素二カリウム (K2HPO4)
21.75 g
りん酸水素二ナトリウム二水和物 (Na2HPO4・2H2O)
33.4 g
塩化アンモニウム (NH4Cl)
0.5 g
を水(6.1)に溶解して1 000mlにする。
備考 溶液の正確な組成はpHによって確認でき,それは7.4がよい。
6.2.1.2
溶液 B 硫酸マグネシウム七水和物 (MgSO4・7H2O) 22.5gを水(6.1)に溶解し,全量を1 000mlと
する。
6.2.1.3
溶液 C 塩化カルシウム二水和物 (CaCl2・2H2O) 36.4gを水(6.1)に溶解し,全量を1 000mlとす
る。
6.2.1.4
溶液 D 塩化鉄 (III) 六水和物 (FeCl3・6H2O) 0.25gを水(6.1)に溶解し,全量を1 000mlとする。
沈殿を防ぐために,使用直前に新しく溶液を調製するか,又は濃塩酸 (HCl) を1滴若しくはエチレンジ
アミン四酢酸 (EDTA) の0.4g/l水溶液を1滴添加する。
6.2.1.5
調製 試験培養液1 000mlを調製するため,500mlの水(6.1)に
− 溶液 Aを10ml
− 溶液 B〜Dをそれぞれ1mlずつ
加え,水(6.1)を加えて全量を1 000mlにする。
6.2.2
最適化試験培養液 この適化試験培養液は高度に緩衝化されており,多くの無機栄養分を含んでい
る。これは,試験材料の濃度が高い場合でも試験中の系のpHを一定に保つために必要である。この培養
液は,りん約2 400mg/l及び窒素50mg/lを含有しており,このため2 000mg/l・有機炭素までの試験材料濃
度に適切である。さらに,高濃度又は低濃度の試験材料を用いる場合は,C/N比を約40 : 1に保つように
窒素濃度を増加又は減少しなければならない。
6.2.2.1
溶液 A
無水りん酸二水素カリウム (KH2PO4)
37.5 g
りん酸水素二ナトリウム二水和物 (Na2HPO4・H2O)
87.3 g
塩化アンモニウム (NH4Cl)
2.0 g
を水(6.1)に溶解し,全量を1 000mlにする。
6.2.2.2
溶液 B 硫酸マグネシウム七水和物 (MgSO4・7H2O) 22.5gを水(6.1)に溶解し,全量を1 000mlに
する。
6.2.2.3
溶液 C 塩化カルシウム二水和物 (CaCl2・2H2O) 36.4gを水(6.1)に加え,全量を1 000mlにする。
6.2.2.4
溶液 D 塩化鉄 (III) 六水和物 (FeCl3・6H2O) 0.25gを水(6.1)に加え,全量を1 000mlにする
(6.2.1.4参照)。
6.2.2.5
溶液 E(微量元素溶液,任意) 塩酸水溶液 (25%, 7.7mol/l) 10mlに,次の順序で加える。
ZnCl2 70mg,MnCl2・4H2O 100mg,H3BO4 6mg,CoCl2・6H2O 190mg,CuCl2・2H2O 3mg,NiCl2・6H2O 240mg,
NaMoO4・2H2O 36mg,Na2WO4・2H2O 33mg及びNaSeO3・5H2O 26mg,水(6.1)を加えて全量を1 000mlにする。
6.2.2.6
溶液 F(ビタミン液,任意) 100mlの水(6.1)に,ビオチン0.6mg,ナイアシンアミド2.0mg,
ρ-アミノ安息香酸2.0mg,パントテン酸1.0mg,ピリドキサール塩酸塩10.0mg,シアノコバラミン5.0mg,
葉酸2.0mg,リボフラビン5.0mg,DL-6,8−チオクト酸5.0mg及び二塩化チアミン1.0mgを加える。又は
酵母抽出物15mgを100mlの水(6.1)に溶かした溶液を用いる。除菌のためにメンブレンフィルターで溶液
をろ過する(7.4参照)。
5
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
備考 溶液 E及び溶液 Fの添加は任意であり,もし十分な濃度の植種源,例えば,活性汚泥,土
壌又はコンポストが使われる場合は必要ない。調製後,使用するまでは1mlずつ小分けして冷
蔵しておくことが推奨される。
6.2.2.7
調製 1 000mlの試験培養液を調製するため,800mlの水(6.1)に
− 溶液 A 100ml
− 溶液 B〜D それぞれ1mlを,EとFは任意
加え,さらに水(6.1)を加えて全量を1 000mlにして,pHを測定する。
備考 培養液の正確な組成は,pHを計ることによって確認でき,7.0±0.2である。
6.3
ピロりん酸塩溶液 二りん酸四ナトリウム塩 (Na4P2O7) 2.66gを水(6.1)に溶解し,全量を1 000mlに
する。
6.4
二酸化炭素吸収剤 望ましくはソーダ石灰又は他の適切な吸収剤
7. 装置 すべてのガラス器具は,完全に洗浄され,特に有機物又は有害物質が付着してはならない。
通常の実験室の器具のほかに次のものを用意する。
7.1
試験容器 気体排出及び振とう又はかくはんができ,二酸化炭素を通さない管を備えたガラスフラ
スコ(例えば,瓶又は三角フラスコ)。恒温室又は,定温装置(例えば,恒温水槽)の中に設置する。
7.2
二酸化炭素を含まない空気製造装置 各試験容器に50ml/min〜100ml/min±10%の範囲で一定流量の
空気を供給できるもの(試験容器及び組み合わせた例は,附属書A参照)。
7.3
二酸化炭素を測定するための分析機器 十分な精度をもつ適切な機器又は手法,例えば,CO2若し
くはDIC分析計又は塩基性溶液に完全に吸収した後,滴定する方法(附属書Bの例参照)。
7.4
全有機炭素量 (TOC) 及び溶解有機炭素量 (DOC) を測定するための分析機器(ISO 8245参照)
7.5
はかり 通常実験室で使用するはかり。
7.6
遠心分離機又は有機炭素を著しく吸着したり,発生したりしない膜フィルター(孔径0.45μm)をも
つろ過装置。
7.7
pHメーター 通常実験室で使用するpHメーター。
7.8
かくはん装置 通常実験室で使用するかくはん装置。
8. 操作
8.1
試験材料 試験材料(1)は,質量が既知で,試験に使用する分析方法で二酸化炭素の発生量が測定可
能な十分な量の炭素を含んでいなければならない。TOCを化学式から計算するか,適切な分析方法(例え
ば,元素分析又はISO 8245によるTOC測定)によって測定し,ThCO2を計算する。試験材料濃度は,TOC
として少なくとも100mg/lとなるようにする。試験材料濃度の最大値は,試験系の酸素供給力及び試験培
養液によって決まる。最適化試験培養液(6.2.2)を使用する場合,試験材料濃度はC/N比が約40 : 1になる
約2 000mg/lを超えてはならない。より高濃度での試験が必要な場合,試験培養液の窒素濃度を増やさな
ければならない。
備考 試験材料(1)は,粉体を用いるべきであるが,フィルム,破片,断片又は成形品を用いてもよい。
試験材料の形状は,生分解度に影響を及ぼすことがある。異なるタイプのプラスチック間で分
解度を比較する場合,同様の形状の試料を用いるべきである。粉体を試験材料とする場合,限
定した狭い範囲の粒度分布をもつ試を使用すべきである。最大直径が250μmの粒度分布が推奨
される。また,試験材料の形状によって使用する試験装置の大きさが決まる。かくはん方式な
6
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
どの試験条件によって機械的な異常が発生しないことを調べておかなければならない。試験材
料を加工する場合は,試験材料の分解挙動に影響を与えてはいけない(例えば,混合物の場合
は粉体を使用する)。任意としてポリマー試験材料の水素,酸素,窒素,りん及び硫黄含量並び
に,例えば,サイズ排除クロマトグラフ法によって分子量を測定する(ASTM D 3536-91その
他の標準法を参照)。可塑剤などの添加剤を含んでいないポリマーを試験材料とすることが望ま
しい。試験材料中に,そのような添加物が含まれている場合,プラスチック材料の正確な生分
解度を求めるためには添加物の生分解性に関する情報が必要である。
注(1) 一般にプラスチック材料の物性の比較をするときは,試験材料の形状を厳密に規定しているこ
とが多い。この規格を用いて異なるタイプのプラスチック間で生分解度を比較する場合,同一
形状(大きさ,形,厚み)の試験材料を用いる。同一形状の試験材料を用意できれば,試験時
期が異なるような場合の比較も可能であるが,一般には,時期が異なると同一形状の試験材料
を用意することは難しいので,同じ粒径の粉体を用いるのがよい。
水に難溶な物質の取扱いについての詳細は,ISO 10634を参照する。
8.2
対照材料 アニリン又は生分解度が既知のポリマー(例えば,微結晶セルロース粉体,灰分のない
セルロースろ紙,又はポリ-β-ヒドロキシ酪酸)を対照材料とする。可能ならば,TOC,形状及び大きさは
試験材料と同じにする。
陰性対照として,試験材料と同じ形状の非分解性ポリマー(例,ポリエチレン)を用いることができる。
8.3
植種源の調製方法 主として,家庭下水を処理している下水処理場の活性汚泥が植種源に適する。
これは,活性な好気的環境から得られ,広範囲のプラスチック材料が試験されるどの地域でも利用できる。
代わりに,土壌及びコンポストの懸濁液を植種源として用いることもできる。幾つかのプラスチック材料
の分解には,菌類が重要な役目をしているので,特定の廃水処理系での生分解性を調べる場合,植種源は
そのような環境から採取しなければならない。
植種源は,十分な分解活性をもった多様な凝集微生物フローラを得るため,8.3.1及び8.3.2に記載され
た植種源又はそれらの混合物から調製する。植種源の内性呼吸量が極端に大きい場合,使用前にばっ(曝)
気を行って植種源を安定化させる。試験温度を使用した植種源と調和させる(5.の備考参照)。
備考 使用する植種源のコロニー形成数 (CFU) を測定することは有益である。試験混合物は,少な
くとも106CFU/mlの菌数を含んでいなければならない。
8.3.1
廃水処理場から採取した植種源 主として,家庭下水を処理して正常に稼動している下水処理場又
は実験室プラントから活性汚泥を採取する。十分にかくはんし,好気条件に保ち,採取した日に使用する
ことが望ましい(少なくとも72時間以内に使用する)。
使用する前に,懸濁固形物濃度を測定する(例えば,ISO 11923を使用する。)。必要に応じて活性汚泥
を濃縮して,試験系に添加する汚泥量が最小限量となるようにする。懸濁固形物濃度が30mg/l〜1 000mg/l
になるように適正量の汚泥を添加する。
備考1. 自然環境における生分解過程を模擬する場合や,炭素収支の測定を行う場合(附属書C),植
種源濃度は,懸濁固形物として30mg/lとすることが推奨される。固形物は,炭素収支の測定
を妨害するので,次の方法で植種源を調製することが推奨される。活性汚泥500mlを採り,
ブレンダー又はそれに相当する高速ミキサーを用いて中程度のスピードで2分間均一化する。
上澄み液に固形物がほとんど含まれなくなるまで,少なくとも30分間放置する。上澄み液を
デカンテーションで採り,試験液中濃度として1容量%〜5容量%となるように試験フラスコ
に添加する。このとき,汚泥粒子が混入するのを避ける。
7
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2. 植種源は予調整を行ってよいが,通常は予暴露した植種源は使用しない。特に自然環境下で
の生分解挙動を模擬した標準試験の場合はそうである。試験の目的に応じて予暴露を行った
植種源を用いることができる。この場合,試験報告書には,予暴露した植種源を用いたこと
及び予暴露の詳細な方法を明記する(例えば,予暴露菌を用いた条件での生分解度=X%)。
予暴露した植種源は,種々の条件下で行っている適切な実験室内生分解試験(ISO/TR 15462
参照)又は関連した環境条件が存在する場所(例えば,環境中に物質が存在する地域又は工
場処理場)から採取することができる。
8.3.2
土壌及び/又はコンポスト植種源 10gの殺菌処理を施していない肥よくな土壌,若しくは主とし
て有機廃棄物を処理しているコンポスト工場から採取したコンポストを100mlの試験培養液(6.2.1又は
6.2.2)又は一般に土壌微生物学で使用されているピロりん酸溶液(6.3)に懸濁させ,約30分間放置する。上
澄み液をデカンテーションし,粗い目のフィルターでろ過した後,1容量%〜5容量%濃度となるように適
正量を試験培養液に添加する。これより高濃度の植種源を使用することができるが,その場合炭素収支の
測定が難しくなる。コンポストを使用することによって試験フラスコ中の菌類数を増やしてプラスチック
材料の分解性を向上させることができる。この場合,使用したコンポストの状態を試験報告書に記載する
(例えば,熟成コンポスト,温度約50℃の高温相から採取したコンポストなど)。
8.4
試験 少なくとも次の試験を含む数のフラスコを用意する。
a) 試験材料用フラスコ(略号FT) 2個(2)
b) 空試験用フラスコ(略号FB)
2個(2)
c) 対照材料を用いて植種源の活性を調べるためのフラスコ(略号FC)1個
必要に応じて次のフラスコを用意する。
d) 加水分解などの非生物分解又は非微生物的分解を調べるためのフラスコ(略号FS)1個。
Fs中の試験溶液は,例えば,オートクレーブか塩化水銀 (II) (HgCl2) の10g/l溶液5mlを添加するか,
その他の微生物活性抑制物質を添加することによって殺菌しなければならない。必要ならば,同量の
抑制物質を試験期間中加える。
e) 試験材料と同一形状の非分解性プラスチック材料を試験材料とする陰性対照用フラスコ(略号FN)1
個。
f)
試験材料の微生物活性阻害性を調べるためのフラスコ(略号FI)1個。試験材料及び対照材料中の炭
素量と培養液の窒素量は,少なくとも約C/Nの比を40 : 1にする。必要に応じて窒素を添加する。
注(2) 試験の繰返し数を確保するため,試験材料,及び空試験用のフラスコを2個用意する。試験実施
上可能であれば,これらを3個ずつ,またc)〜f)のフラスコを複数にしてもよい。
表1に示されているように試験培養液(6.2)及び植種源(8.3)の適正量を各試験フラスコに添加する。
フラスコを二酸化炭素を含んでいない空気発生器(附属書A参照)に接続する。フラスコを所定の試験
温度(5.参照)にし,24時間通気して二酸化炭素を追い出す。温度が高い場合,適切な装置を用いて液体
の混入又は消失を防ぐ。試験液中は,マグネティックスタラー又はシェイカーでかくはんする。過剰の気
泡が発生した場合,空気の吹込みに代えて,培養液をかくはんしながら液面上に空気を吹き付ける。事前
にばっ(曝)気を行った後,各フラスコの空気出口を二酸化炭素補集系又は二酸化炭素量測定系に接続す
る。
炭素収支を測定する場合(附属書C参照)は,試験開始時及び試験終了後に,DOC及びバイオマスの
測定用に,各フラスコ又は別個に設けたフラスコから所定量の試験溶液を分取する。分取した液量は,最
終試験液量を調整するとき,又は試験結果を計算するときに考慮する。

8
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1に示した試験材料(8.1),対照材料及び陰性対照材料(8.2)をそれぞれのフラスコに添加した後,
50ml/min〜100ml/minの速度(1秒間に1〜2泡)でフラスコに二酸化炭素を含まない空気を通して試験を
開始する。
二酸化炭素発生速度に応じた時間間隔で各フラスコから発生する二酸化炭素量を適切な方法で測定する
(附属書B参照)。
表1 試験材料及び対照材料の構成
フラスコ
試験材料
対照材料
植種源
FT 試験
+
−
+
FT 試験
+
−
+
FB 空試験
−
−
+
FB 空試験
−
−
+
Fc 植種源活性チェック
−
+
+
Fs 非生物的分解チェック(任意)
+
−
−
FI 阻害対照(任意)
+
+
+
FN 陰性対照(任意)
−
+
+
二酸化炭素の発生量が一定量(定常期)となり,生分解がそれ以上進まないと考えられる場合,試験は
終了したとみなす。通常,最大試験期間は6か月を超えてはならない。長期試験の場合は,外部からの二
酸化炭素の混入及び漏れがないことを確認する。
試験終了日にpHを測定した後,すべてのフラスコに1mlの濃塩酸を添加して炭酸塩及び重炭酸塩を分
解して二酸化炭素を追い出す。24時間空気を吹き込んだ後,各フラスコ (FT,Fc,FB…) から発生した二
酸化炭素量を測定する。
9. 計算及び結果の表示
9.1
計算
9.1.1
試験材料の理論上の二酸化炭素の総量 ミリグラムで表される理論上の二酸化炭素の総量
(ThCO2) は,式(1)によって算出する。
ThCO2=m×Xc×44/12 ································································· (1)
ここに,
m: 試験系中に導かれた試験材料の質量 (mg)
Xc: 化学式から決定されるか又は元素分析から計算され
質量の分数として表された試験材料の炭素含有量
(mg)。
44及び12: それぞれ二酸化炭素及び炭素の相対的な分子量及び
原子量。
同じ方法で対照材料の二酸化炭素及び試験の混合物並びにフラスコF1中の試験及び対照材料の混合物
の理論上の二酸化炭素総量を計算する。
9.1.2
発生二酸化炭素からの生分解の百分率 それぞれの測定間隔ごとに発生した二酸化炭素量から試
験フラスコFTに対する生分解度百分率Dtは,次の式(2)によって算出する。
(
)
(
)
100
2
2
2
×
−
=∑
∑
ThCO
CO
CO
D
B
T
t
··················································· (2)
ここに,
Σ (CO2) T: 試験のスタートから時間tの間にフラスコFT中に発
生した二酸化炭素の質量 (mg)。
Σ (CO2) B: 試験のスタートから時間tの間に空試験対照FB中に
発生した二酸化炭素の質量 (mg)。
9
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ThCO2: 試験材料の理論上の二酸化炭素総量 (mg)。
できれば,繰返しの二つのフラスコの平均値も算出する。同様に植種源チェックFc中の対照材料の生分
解度百分率を算出する。もし含まれているならば阻害対照FI中の試験及び対照材料の混合物の生分解度,
微生物起因でない分解対照Fs中の試験材料の生分解度及び陰性対照FNの生分解度も算出する。
炭素収支を求めるならば,試験を通じて発生した二酸化炭素量及び作られたバイオマスの炭素含量から,
試験材料の生分解度を算出する(附属書C参照)。
9.2
結果の表示及び解釈 それぞれの測定間隔ごとに,及びそれぞれの試験フラスコごとに発生した二
酸化炭素量及び生分解度は,表を作成して表示する。それぞれの容器ごとに,時間の関数として発生した
二酸化炭素曲線と生分解度百分率曲線をプロットする。二つのフラスコの結果が似たようなものなら平均
曲線をプロットする。
生分解度曲線の定常期の平均値,又は例えば,曲線が下降また,更に定常期がゆっくり増加するときに
は,測定された最高レベルの生分解度は,その試験材料の生分解度の特性を表す。炭素収支が計算される
ならば,この収支結果は最終生分解度の特性を表す。
試験材料のぬ(濡)れ能力及び形状は,得られた結果に影響を及ぼすかもしれない。したがって,その
試験方法は,類似の化学構造のプラスチック材料の比較に限定されるかもしれない。
試験材料の毒性に関する情報は,低い生分解性を示す試験結果の解釈に有効であるかもしれない。
10. 結果の正当性 試験は,次のような場合に正当とみなされる。
a) 対照材料の生分解度(植種源チェックFc)は,試験終了時に60%以上でなければならない。
b) 試験終了時に空試験FBから発生した二酸化炭素の量は,実験で得られた上限値を超えてはならない
(この値は植種源の量によるが,例えば,30mg/lの乾燥物を使用した場合,実験室間試験が示してい
るように90mg/lである。)。
フラスコFI(阻害チェック)を含むならば,その生分解度百分率が25%以下で試験混合物の有意な
分解が見られない場合は,試験混合物は抑制の働きをすると仮定することができる。
フラスコFs(非生物的分解チェック)を含むならば,有意な量(10%以上)の二酸化炭素の発生が
見られるような場合は,非生物的分解プロセスが生じているかもしれない。
フラスコFN(陰性対照)を含むならば,発生二酸化炭素量は有意な量にはならない。
これらの基準が満たされない場合は,その試験は他の予調整された又は予暴露された植種源を使用
して繰返し行わなければならない。
11. 試験報告書 試験報告書には,少なくとも次の情報を含むべきである。
a) この規格及びそれぞれの附属書の番号の記載
b) 試験材料及び対照材料を同定するために必要なすべての情報:TOC,ThOD,化学組成,化学式(分
かるなら),形状,形態,量/濃度を含む
c) 試験条件の主なパラメータ:試験容積,使用した試験培養液,培養温度,最終pHを含む
d) 使用された植種源の出所及び量:使用されたコンポストの予暴露の細目及び状態を含む
e) 使用された分析技術:二酸化炭素検出方法,TOC,DOC,バイオマスの測定方法を含む
f)
得られた試験及び対照材料の試験結果のすべて(表及びグラフ形式で):測定された積算二酸化炭素,
生分解度パーセント,時間の変数に対してのそれぞれの曲線(3)を含む
10
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
g) 誘導期,分解期,分解の最高レベルの期間及び全体の試験期間
そして任意に実施されて測定された場合は,
h) 微生物の働きでない分解チェックFs,阻害対照FI,及び陰性対照FNの結果
i)
次の例を含む炭素収支の測定結果
1) 二酸化炭素に酸化された試験材料の全炭素量
2) 水溶性の物質による培養期間を通じての試験培養液中のDOCの増加
3) 試験を通じてのバイオマス中の有機炭素の増加
4) 試験終了時での残りのポリマーの炭素含量
5) 試験材料によって作られた炭素パーセントとして測定され表示された全炭素の合計量
j)
植種された試験混合物中のコロニー形成単位 (CFU/ml)
k) 他の関連データすべて(例えば,試料の最初の分子量,生分解されないで残ったポリマーの分子量)
注(3) 分解度が50%を超える場合,分解度が50%に達するまでの時間を示してもよい。
11
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
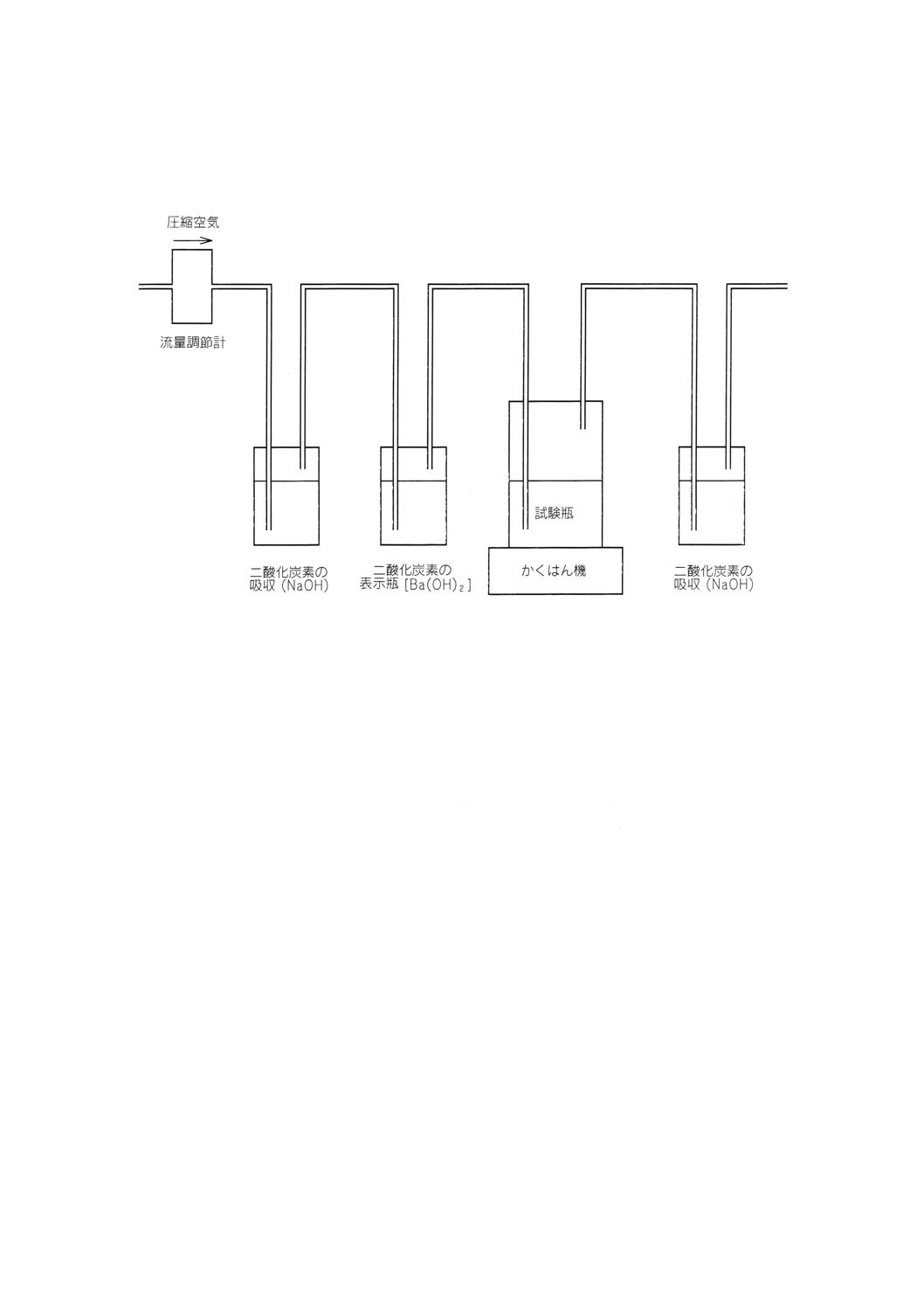
附属書A(参考) 発生二酸化炭素量を測定する試験装置の原理(例)
図A.1 発生した二酸化炭素量を測定する試験装置の原理
A.1 試験装置の記述 次の瓶は,ガスを通さない管によって図A.1に示したように直列につなぐ。一定の
低圧で50ml/min〜100ml/minのCO2を除去した空気で試験装置を置換する。空気の流通量を調べるために,
空気の泡の数を数えるか,又は適切なガス流量装置を使用する。CO2を除去した空気か,又は圧縮した空
気を使用する。後者の場合,空気を乾燥ソーダ石灰の入った瓶に通すか,又は例えば,10mol/lの水酸化カ
リウム (KOH) 水溶液500mlの空気洗浄ガス瓶を少なくとも2本通すことによってCO2を除去する。0.012
5mol/lの水酸化バリウム [Ba (OH) 2] 100mlが入った第二の瓶は,CO2が空気中にないことを濁りによって
確認するために使う。指示瓶と次の試験瓶の間の空の瓶は,液体の流入を防ぐ。もし生分解が起これば,
試験槽内でCO2が発生し,次いで附属書Bに記載する次の吸収瓶でCO2は吸収される。
12
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(参考) 発生二酸化炭素の定量法の例
B.1 DIC測定によるCO2定量法 発生した二酸化炭素 (CO2) は,水酸化ナトリウム (NaOH) 水溶液に吸
収され,灰化することなしにDOC分析装置などを使用して溶存無機炭素 (DIC) として定量する。
脱イオン水を使って0.05mol/lのNaOH水溶液を準備する。CO2発生量を計算するとき,この水溶液の
DICの測定値を空試験の値とする。試験瓶にNaOH水溶液が,各々100ml入った2本の吸収瓶を直列につ
なぐ。空気中のCO2がNaOH溶液に入らないように小さいサイフォンで最後の瓶の出口は閉じる。試験瓶
の次の吸収瓶をCO2の測定日に外し,次にDIC測定のために十分なサンプルを採取する(例えば,10ml)。
その瓶を第二の瓶と取り替え,新たに調製したNaOH溶液が入った試験瓶をつなぐ。最後の日には,試験
溶液を酸性化後,両方の瓶のDICを測定する。
発生したCO2は,次の式(B.1)によって算出する。
(
)
(
)
10
67
.3
2
×
−
=
b
T
T
DIC
DIC
CO
···················································· (B.1)
ここに, (CO2) T: CO2発生質量 (mg)
DICT: DIC測定値 (mg)
DICb: NaOH溶液のDIC空試験測定値 (mg)
3.67: 炭素 (12) とCO2 (44) の分子量の関係
10: 100mlのNaOH溶液の補正係数
B.2 水酸化バリウム溶液での滴定法 発生したCO2は,水酸化バリウム [Ba (OH) 2] と反応する。次いで,
炭酸バりウム塩 (BaCO3) として沈殿する[式(B.2)参照]。発生したCO2量は,塩酸 (HCl) を用いて残存
しているBa (OH) 2を滴定することによって定量する[式(B.3)参照]。
CO2+Ba (OH) 2→BaCO3+H2O ··················································· (B.2)
Ba (OH) 2+2HCl→BaCl2+2H2O ················································· (B.3)
Ba (OH) 2・8H2O4.0gをイオン交換水又は蒸留水1 000mlに溶解し0.012 5mol/l溶液を調製する。一連の試
験を行うときに十分な量,例えば,5l程度を準備することを推奨する。固形分をフィルターでろ過し,試
験結果の計算のために,標準HCI液で正確な規定度を決定する。空気中からの二酸化炭素の吸収を防ぐた
め,密封下で保存する。
1mol/lのHCl (36.5g/l) の50mlをイオン交換水又は蒸留水1 000mlに溶解し0.05mol/l溶液を得る。
試験開始時,Ba (OH) 2水溶液100mlを正確に,三つの吸収瓶それぞれに量り採る。試験材料の特性及び
量に応じて捕集する体積を調整する。定期的に,試験槽に最も近い瓶を滴定のために取り外す。これは,
最初の瓶が濁り,二番目の吸収瓶にBaCO3の沈殿が観察される前に取り替える必要がある。滴定は,試験
開始時は,1日おきに行いそれから定常期に至ったら5日ごとに行う。瓶を取り外した後,直ちに空気か
らのCO2の流入を防ぐために栓でシールする。残りの二つの瓶を一つずつ試験瓶側に移動させ,調製直後
のBa (OH) 2で満たした新しい瓶を列の最後に取り付ける。特に試験の期間が長いときには,溶液の正確な
濃度を求める。試験材料,対照材料,空試験,標準抑制剤,及び標準菌株対照を含む瓶は,正確に同一の
方法で取り扱う。
瓶を取り外した後,直ちに,Ba (OH) 2溶液を2〜3滴に分けHC1溶液で滴定する。
13
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
吸収瓶で捕集されたCO2量は,次の式(B.4)によって算出する。
22
2
0
×
×
−
×
=
A
BZ
Bt
A
A
B
B
C
V
V
V
C
V
C
m
·············································· (B.4)
ここに,
m: 吸収瓶に捕集されたCO2の質量 (mg)
CA: HCI水溶液の正確な濃度 (mol/l)
CB: Ba (OH) 2水溶液の正確な濃度 (mol/l)
VBO: 試験開始時のBa (OH) 2水溶液の体積 (ml)
VBt: 時間t時点での滴定前のBa (OH) 2水溶液の体積 (ml)
VBZ: 滴定に使用したBa (OH) 2水溶液の体積 (ml)
VA: 滴定に使用したHCI水溶液の体積 (ml)
22: CO2の1/2分子量
次の条件が満たされるときは,
−
吸収前後のBa (OH) 2水溶液の体積が正確に100mlで,すべての水溶液を滴定に使用 (VBO=VBT=
VBZ)
−
Ba (OH) 2水溶液の濃度が正確にCB=0.012 5mol/l
−
HCI水溶液の濃度が正確にCB=0.05mol/l
式(B.5)が使える
m=1.1 (50−VA) ······································································ (B.5)
14
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C(参考) 炭素収支の測定例
C.1 原則及び範囲 プラスチック材料は,通常低分子量の物質に比較して,より複雑な組織からなりたっ
ている。二酸化炭素放出量又は生物学的酸素要求量 (BOD) だけを測定することは,その生分解性を特徴
付けたり,定量化するには十分でない場合が多い。生分解している間に,新しいバイオマス(生物資源)
が微生物によって築き上げられ,試験に使われる物質の炭素の一部は,生化学的に酸化されるのではなく,
バイオマスに変換される。したがって,二酸化炭素放出及び生物学的酸素要求量のような分析のパラメー
タは,試験材料の完全生分解の場合でさえも各々の理論値の100%にしばしば到達せず,また,その試験
結果から不十分な分解であると誤って過小評価されることにもなる。この附属書で記載されるように,全
体の炭素収支の測定は,このような場合,完全生分解性を確認するのに役立つだろう。
そのような収支は,次に示す測定から得られる炭素量の加算に基づいている。二酸化炭素として放出さ
れる炭素,新しいバイオマスとして生産される炭素,水溶性有機代謝物に変換されDOCとして測定され
る炭素,及び分解されない残存高分子物質。炭素総量は,試験系に導入された試験材料の有機炭素の量と
比較される。
C.2 試験方法 本体の8.4に規定するように発生する二酸化炭素を測定する。
試験のはじめ,試験材料を加える前,培養の終了時に培養液のサンプリングをする。サンプリングは,
代表する試料を得るために注意して行わなければならない。これらの試料を膜ろ過又は約40 000ms-2で遠
心分離する。
フィルター上又は残さ(渣)中のバイオマスを適切な方法,例えば,たんぱく測定によって測定する。
バイオマス中の炭素量を測定又は推測し,その差からバイオマスの有機炭素の増分を計算する。
試料のろ液中,DOCをISO 8245に従って測定し,有機炭素の増分を計算する。可能ならば,水溶性代
謝分の生産を確認するためにDOCを形成する物質の同定を試みる。
試験の終了時に,すべての残った試料を使って残存ポリマー中の炭素量を測定する。これは通常難しい
方法であり,もし,あるポリマーに特異的な分析が利用できるならば直接に(附属書F参照)又は間接に
測定できる。前者の場合,残さポリマーの量を抽出,測定し,その公知の組成から炭素量を計算する。間
接的に測定する方法は,洗浄,乾燥,残さ質量測定及び全有機炭素量 (TOC) 測定によって可能になる。
それから残さポリマーの炭素量を得るために,バイオマスの測定結果を使ってTOCからバイオマス炭素を
差し引く。さらに,別に可能なことは,残さを正確にひょう量し,あらかじめ確認するべきことであるが,
ポリマーではなくバイオマスを破砕するための適切な方法で処理することである。例えば,次亜塩素酸ナ
トリウムを使って,可溶部を除き,再び同試料をひょう量する。すべてのバイオマスが除かれたと仮定し
て,その質量から残さ中のポリマ量を算出する。
C.3 炭素収支の計算 試験系に導入された試験材料 (CMAT) のうち,生化学的に酸化された炭素量CBOD
(mg/l) をCO2発生試験(9.1.2参照)の生分解性の程度Dt (%) から次の式(C.1)によって算出する。
100
2
T
MAT
CO
D
C
C
×
=
··································································· (C.1)
培養試験期間の最初と最後のバイオマスを比較することによって,試験材料を含んだフラスコ中のバイ

15
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
オマスの炭素の増分CBIO (mg/l) を計算する。その際,式(C.2)に従ってバイオマスの炭素の測定量又は推定
量CB (start) ,CB (end) を考慮する。
CBIO=CB (end) −CB (start)······························································ (C.2)
最初と最後のDOC濃度DOC (start) 及びDOC (end) を比較することによって,培養期間のDOCの増分CDOC
(mg/l) を式(C.3)によって算出する。
CDOC=DOC (end) −DOC (start) ······················································· (C.3)
試験の終わりの残存ポリマー中の有機炭素の量Cpolを測定する。
導入された炭素CMATの百分率として変換された炭素の異なった量を計算し,式(C.4)によって算出された
炭素CCALC (%) を得るために加算する。
CCALC=CBOD+CBIO+CPOC+CPOL ················································· (C.4)
C.4 ポリ-(β-ヒドロキシ酪酸)の炭素収支の例3)
試験材料の投入:CMAT600mg/l=334.8mg/lC
生分解の程度:Dt=78%
CB (start) CB (end)
CB
DOC (start)
DOC
(end)
DOC CBOD
g/l
3.2
61.0
57.8
2.0
22.0
20.0 261
of CMAT
17.2
6.0
78
計算された炭素収支:CCALC=78%+17%+6%=101% of CMAT
3)
データ提供:PÜCHNER (1994) (附属書E参照)
16
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D(参考) 生分解度試験の終わりに,水に不溶性のポリマーの
残存量及びその分子量を測定する例
生分解度試験の終わりに残っているポリマーの量又は分子量を測定する方法を使うことが役立つかもし
れない。次のような方法又は他の適切な方法が,水と混和しない有機溶剤に可溶で,水に不溶なポリマー
を分析するために使われる。
a) 分液漏斗に試験混合物を移液し,適切な有機溶剤を加え,生分解されないで残ったポリマーを抽出す
るために10分〜20分間振とうする。水層から有機溶剤層を分離する。新しい溶剤を加えこの手順を
繰り返す。
b) 有機溶(溶媒)層を混合して乾燥するまで溶媒を蒸発させる。その固体サンプルを適正な容量の適切
な溶媒に溶解する。
c) マイクロシリンジを使用してサイズ排除のクロマトグラフ法のゲルを詰めたカラムを使った高速液体
クロマトグラフ (HPLC) に適正量を注入する。分析を開始しクロマトグラフを記録する。
d) 検量線を使ってポリマー量を測定する。
e) (検量線の作成には)同じポリマー,又は試験ポリマーに類似の構造をもつ分子量が既知のポリマー
をクロマトグラフに注入することによってポリマーの分子量を測定する。保持時間と分子量の関係が
クロマトグラムから得られる。これらの関係(検量線)を使って分子量を計算する。
試験ポリマーの絶対分子量は,Low Angle Laser Light Scattering (LALLS) 及びDifferential Refractive Index
(示差屈折率)を組み合わせた検知器をもったHPLCによっても測定することができる。
17
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E(参考) 参考文献
[1] ASTM D 3536-91, Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion
Chromatography (GEL Permeation Chromatography−GPC) .
[2] ISO 8192 : 1986, Water quality−Test for inhibition of oxygen consumption by activated sludge.
[3] ISO 11923 : 1997, Water quality−Determination of suspended solids by filtration through glass-fibre filters.
[4] MULLER, R.-J., AUGUSTA, J., and PANTKE, M. (1992) , An Interlaboratory Investigation into
Biodegradation of Plastics ; Part 1 : A Modified Sturm Test, Material and Organisms, 27/3, pp.179-189.
[5] PÜCHNER, P., MUELLER, W.R., and BARDTKE, D. (1995) , Assessing the Biodegradation Potential of
Polymers in Screening and Long-Term Test Systems, J. Environm. Polymer Degradation, 3, pp.133-143.
[6] PÜCHNER, P. (1994) , Screening−Testmethoden zur Abbaubarkeit von Kunststoffen unter aeroben und
anaeroben Bedingungen, Dissertation, Stuttgart University Fakultat fur Bauingenieurwesen, Stuttgarter Berichte
zur Abfallwirtschaft, 59, Erich Schmidt Verlag, Berlin.
[7] SPERANDIO, A., and PÜCHNER, P. (1993) , Bestimmung der Gesamtproteine als Biomasse-Parameter in
wärigen Kulturen und auf Trägermaterialien aus Bio-Reaktoren, gwf Wasser, Abwasser, 134, pp.482-485.
[8] URSTADT, S., AUGUSTA, J., MÜLLER, R.-J., and DECKWER, W.-D. (1995) , Calculation of Carbon
Balances for the Evaluation of Biodegradability of Polymers, J. Environm. Polymer Degradation, 3(3),
pp.121-131.
18
K 6951 : 2000 (ISO 14852 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
原案作成委員会 構成表
氏名
所属
(委員長)
土 肥 義 治
理化学研究所
西 出 徹 雄
通商産業省基礎産業局
堅 尾 和 夫
通商産業省基礎産業局
大 嶋 清 治
通商産業省工業技術院
常 盤 豊
生命工学工業技術研究所
橋 本 繁 晴
財団法人日本規格協会
中 崎 清 彦
静岡大学工学部
鹿 毛 紀久雄
財団法人高分子素材センター
川 島 信 之
三井化学株式会社
北 國 英 一
昭和電工株式会社
栗 山 昌 樹
日本モンサント株式会社
河 野 通 紀
凸版印刷株式会社
澤 田 秀 雄
ISO/TC61/SC5/WG22コンビナー
辻 正 男
株式会社クラレ
富 田 敏 彦
三菱樹脂株式会社
野長瀬 三 樹
ダイセル化学工業株式会社
平 野 惇
財団法人バイオインダストリー協会
福 田 和 彦
生分解性プラスチック研究会
三 宅 辛 二
日本合成化学工業株式会社
矢可部 芳 州
財団法人化学品検査協会
吉 木 健
日本プラスチック工業連盟
(事務局)
三 宅 孝 治
日本プラスチック工業連盟


