K 6950 : 2000 (ISO 14851 : 1999)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法に基づいて,日本工業標準調査会の審議を経て,通商産業大臣が改正した日
本工業規格である。これによってJIS K 6950 : 1994は改正され,この規格に置き換えられる。
今回の改正では,対応国際規格ISO 14851 : 1999を基礎として用いた。
JIS K 6950には,次に示す附属書がある。
附属書A(参考) 理論的酸素要求量 (ThOD)
附属書B(参考) 硝化による妨害のためのBOD値の補正
附属書C(参考) 閉鎖圧力測定型呼吸装置の原理
附属書D(参考) 二相密閉瓶を用いた呼吸試験
附属書E(参考) 炭素収支の測定例
附属書F(参考) 生分解度試験の終わりに,水に不溶性のポリマーの残存量及びその分子量を測定
する例
附属書G(参考) 参考文献
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 6950 : 2000
(ISO 14851 : 1999)
プラスチック−水系培養液中の
好気的究極生分解度の求め方
−閉鎖呼吸計を用いる酸素消費量の
測定による方法
Determination of the ultimate aerobic biodegradability
of plastic materials in an aqueous medium−
Method by measuring the oxygen demand in a closed respirometer
序文 この規格は,1999年に発行されたISO 14851, Determination of the ultimate aerobic biodegradability of
plastic materials in an aqueous medium−Method by measuring the oxygen demand in a closed respirometerを翻訳
し,技術的内容及び規格票の様式を変更することなく作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格にはない事項である。
警告 下水汚水,活性汚泥,土壌及びコンポストは,潜在的に病原性生物を含む可能性がある。したが
って,取扱いに際し,適切な予防措置を講じる必要がある。有毒な及び性質の未知な試験物質を扱う場合
は,注意深く取り扱わなければならない。
0. 緒言 プラスチック材料の使用量の増大に伴い,その回収及び廃棄が,大きな問題となった。回収を
促進するのが,最優先である。しかし,プラスチックの完全な回収は,困難である。例えば,主として消
費者から出るプラスチックごみの完全な回収は困難である。さらに,回収困難な例として,漁具・農業用
マルチフィルム及び水溶性ポリマーが挙げられる。これらプラスチック材料は,閉鎖系の廃棄物処理サイ
クルから環境に流出する傾向がある。生分解性プラスチックは,現在このような環境問題を解決する手段
の一つとして登場した。コンポスト施設に送られる製品又は包装材のようなプラスチック材料は,生分解
性をもつべきである。したがって,生分解性の可能性及び自然環境下でのプラスチック材料の生分解性の
尺度を得ることは重要である。
1. 適用範囲 この規格は,閉鎖呼吸計を用い酸素消費量を測定することによって,成形添加物を含むプ
ラスチック材料の好気的生分解度を求めるための方法について規定する。試験材料は,水系培養液による
実験室条件下で,活性汚泥,コンポスト又は土壌からの植種源に暴露される。
もし,植種源として非じゅん(馴)化活性汚泥を用いる場合には,この試験は,水系自然環境下での生
分解過程を模擬し,混合又は予暴露植種源を用いる場合は,試験材料のあらゆる生分解性の可能性を検討
2
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
する方法である。
この規格に使用された条件は,必ずしも最大の生分解が生じる最適条件に対応しないが,あらゆる生分
解性の可能性又は自然環境下でのプラスチック材料の生分解性の尺度を測定するように定められている。
この方法は,炭素収支を計算することによって,生分解度の試験を向上させるものである(任意,附属
書E参照)。
この方法が適用される物質は,
− 天然及び/又は合成高分子,共重合体又は,これらの混合物;
− 可塑剤,着色材又は他の物質のような添加物を含むプラスチック材料;
− 水溶性高分子;
− 植種源に存在する微生物に試験条件下で阻害的でない材料。阻害性効果は,阻害対照を使用するか,
又は他の適切な方法(例えば,ISO 8192参照)によって決定できる。もし試験材料が,植種源に阻
害的で,低い試験濃度であるなら,他の植種源又は予暴露植種源を用いることができる。
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格のうちで,発行年を付記してあるものは,記載の年の版だけが,この規格の規定を
構成するものであって,その後の改正版・追補には適用しない。
ISO 8245 : 1999 Water quality−Guidelines for the determination of total organic carbon (TOC) and
dissolved organic carbon (DOC)
ISO 9408 : 1) Water quality−Evaluation of ultimate aerobic biodegradability of organic compounds in
aqueous medium by determination of oxygen demand in a closed respirometer
ISO 10634 : 1995 Water quality−Guidance for the preparation and treatment of poorly water-soluble organic
compounds for the subsequent evaluation of their biodegradability in an aqueous medium
ISO/TR 15462 : 1997 Water quality−Selection of tests for biodegradability
3. 定義 この規格では,次の定義を適用する。
3.1
好気的究極生分解 (ultimate aerobic biodegradation) 微生物による酸素の存在下での,有機物の二
酸化炭素,水及び存在する他の元素の無機塩(無機質化)並びに新しいバイオマスへの分解。
3.2
活性汚泥 (activated sludge) 細菌又は他の微生物の成長によって好気的廃水処理において溶存酸
素の存在下,作られるバイオマス。
3.3
活性汚泥の懸濁固形物濃度 (concentration of suspended solids of an activated sludge) 既知量の活
性汚泥をろ過又は遠心分離し,105℃で一定質量になるまで乾燥することによって得られた固形物量。
3.4 生物化学的酸素要求量 BOD (biochemical oxygen demand) 化学物質又は有機物が,特定条件下で,
水中での好気的生物酸化によって消費された溶存酸素の質量濃度。試験物質1mg又は1g当たりのmg-酸
素量として表される。
3.5
理論的酸素要求量 ThOD (theoretical oxygen demand) 化学物質が,完全に酸化されるために必要
とされる分子式から計算される最大理論酸素要求量。試験物質1mg又は1g当たり必要とされるmg-酸素
量として表される。
1) 改訂版を印刷中(ISO 9408 : 1991の改訂)
3
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.6
全有機炭素量 TOC (total organic carbon) 水溶液及び水懸濁中の有機物に存在する有機炭素の総
量。
3.7
溶存有機炭素量 DOC (dissolved organic carbon) 特定の相分離,例えば,15分間,40 000ms−2の
遠心分離,又は0.2μm−0.45μm直径の孔をもつ膜を用いる膜ろ過によって除去不可能な水中の有機炭素部
分。
3.8
誘導期 (lag phase) 試験の開始から,分解微生物のじゅん化及び選択のために要する時間(日数)
であり,化学物質又は有機物の生分解度が,理論最大分解度の10%に達する。
3.9
生分解の最大レベル (maximum level of biodegradation) 化学物質又は有機物が試験中に到達する
最大生分解度で百分率で表示される。これ以上生分解は起こらない。
3.10 生分解期 (biodegradation phase) 試験の誘導期終了時から生分解の最大レベルの約90%に到達す
るまでの時間(日数)。
3.11 定常期 (plateau phase) 生分解期の最後(最大生分解レベル)から試験終了までの時間(日数)。
3.12 予暴露 (pre-exposure) 微生物のじゅん化及び選択によって試験物質を分解する植種源の能力向上
を目的とする試験対象化学物質又は有機物の存在下での植種源の前培養。
3.13 予調整 (pre-conditioning) 試験条件での微生物のじゅん化によって試験性能の向上を目的とする
試験物質の存在しない試験条件下での植種源の前培養。
4. 原理 水試験系の好気的微生物を用いてプラスチック材料の生分解度を求める。試験混合物は,無機
塩培養液及び唯一の炭素源,エネルギー源として,有機炭素の濃度が,100mg/l〜2 000mg/lである試験材
料,並びに植種源として活性汚泥若しくは活性土壌又はコンポストの懸濁液を含んでいる。この混合物は,
呼吸計の密閉フラスコ中でかくはんされる。発生した二酸化炭素は,試験フラスコの頭部に付けられた適
切な吸収剤で吸収される。酸素の消費量 (BOD) は,例えば,呼吸計フラスコの気体体積を一定に保つの
に要する酸素の量を測るか,体積又は圧力(又は両方の組合せ)を自動的若しくは手動で測ることによっ
て測定される。呼吸計の一例は附属書Cに示されている。この代わりにISO 10708(附属書D参照)によ
る二相密閉瓶方式も使用できる。
生分解度は,BODと理論的酸素要求量 (ThOD) の比として計算され,パーセントで表される。BODに
対する硝化反応の影響は考慮しなければならない。試験結果は,生分解度曲線の定常期から決定された生
分解の最大レベルである。生分解度の補足的な情報を得るために炭素収支を計算してもよい(附属書E)。
各種の有機物に対して用いられるISO 9408と違って,この規格はプラスチック材料の生分解度を測定す
るために特別に作成されたものである。この特別な要求に基づいて,植種源,試験培養液を選択し,また
炭素収支の計算によって生分解度の評価の精度を向上させるのを可能にした。
5. 試験環境 培養は,暗所又は散乱光下,微生物に有害な種々の蒸気から遮断された囲いの中,一定温
度(±1℃以内)望ましくは (20〜25) ℃±1℃又は,使用される植種源と試験環境によって他の適切な温
度に保たれたところで行わなければならない。
備考 植種源がコンポストの場合は,より高い温度が適切であろう。
6. 試薬 評価の定まった分析用試薬だけを用いる。
6.1
蒸留水又は脱イオン水 有害な物質(特に銅)とDOC 2mg/l以上を含まないもの。
4
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
6.2
試験培養液 試験の目的に応じて,異なった試験培養液を使用できる。例えば,自然環境を模擬す
る場合は,標準試験培養液 (6.2.1) を用いる。試験材料が高濃度で使用される場合は,より高い緩衝能力
と栄養分濃度をもつ最適化試験培養液 (6.2.2) を用いる。
6.2.1
標準試験培養液
6.2.1.1
溶液A
無水りん酸二水素カリウム (KH2PO4)
8.5g
無水りん酸水素二カリウム (K2HPO4)
21.75g
りん酸水素二ナトリウム二水和物 (Na2HPO4・2H2O)
33.4g
塩化アンモニウム (NH4Cl)
0.5g
を水 (6.1) に溶解して1 000mlにする。
備考 溶液の正確な組成はpHによって確認でき,それは7.4がよい。
6.2.1.2
溶液B 硫酸マグネシウム七水和物 (MgSO4・7H2O) 22.5gを水 (6.1) に溶解し,全量を1 000ml
とする。
6.2.1.3
溶液C 塩化カルシウム二水和物 (CaCl2・2H2O) 36.4gを水 (6.1) に溶解し,全量を1 000mlとす
る。
6.2.1.4
溶液D 塩化鉄(III)六水和物 (FeCl3・6H2O) 0.25gを水 (6.1) に溶解し,全量を1 000mlとする。
沈殿を防ぐために,使用直前に新しく溶液を調製するか,又は濃塩酸 (HCl) を1滴若しくはエチレンジ
アミン四酢酸 (EDTA) の0.4g/l水溶液を1滴添加する。
6.2.1.5
調製 試験培養液1 000mlを調製するため,500mlの水 (6.1) に
− 溶液Aを10ml
− 溶液B〜Dをそれぞれ1mlずつ
加え,水 (6.1) を加えて全量を1 000mlにする。
6.2.2
最適化試験培養液 この最適化試験培養液は高度に緩衝化されており,多くの無機栄養分を含んで
いる。これは,試験材料の濃度が高い場合でも試験中の系のpHを一定に保つために必要である。この培
養液は,りん約2 400mg/l及び窒素50mg/lを含有しており,このため2 000mg/l・有機炭素までの試験材料
濃度に適切である。さらに,高濃度の試験材料を用いる場合は,C/N比を約40 : 1に保つように窒素濃度
を増加しなければならない。
6.2.2.1
溶液A
無水りん酸二水素カリウム (KH2PO4)
37.5g
りん酸水素二ナトリウム二水和物 (Na2HPO4・H2O)
87.3g
塩化アンモニウム (NH4Cl)
2.0g
を水 (6.1) に溶解し,全量を1 000mlにする。
6.2.2.2
溶液B 硫酸マグネシウム七水和物 (MgSO4・7H2O) 22.5gを水 (6.1) に溶解し,全量を1 000ml
にする。
6.2.2.3
溶液C 塩化カルシウム二水和物 (CaCl2・2H2O) 36.4gを水 (6.1) に加え,全量を1 000mlにする。
6.2.2.4
溶液D 塩化鉄 (III) 六水和物 (FeCl3・6H2O) 0.25gを水 (6.1) に加え,全量を1 000mlにする
(6.2.1.4参照)。
6.2.2.5
溶液E(微量元素溶液,任意) 塩酸水溶液 (25%, 7.7mol/l) 10mlに次の順序で加える。
ZnCl2 70mg,MnCl2・4H2O 100mg,H3BO4 6mg,CoCl2・6H2O 190mg,CuCl2・2H2O 3mg,NiCl2・6H2O 240mg,
NaMoO4・2H2O 36mg,Na2WO4・2H2O 33mg及びNaSeO3・5H2O 26mg,水 (6.1) を加えて全量を1 000mlにす
5
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る。
6.2.2.6
溶液F(ビタミン液,任意) 100mlの水 (6.1) に,ビオチン0.6mg,ナイアシンアミド2.0mg,
p-アミノ安息香酸2.0mg,パントテン酸1.0mg,ピリドキサール塩酸塩10.0mg,シアノコバラミン5.0mg,
葉酸2.0mg,リボフラビン5.0mg,DL-6,8-チオクト酸5.0mg及び二塩化チアミン1.0mgを加える。又は酵
母抽出物15mgを100mlの水 (6.1) に溶かした溶液を用いる。除菌のためにメンブレンフィルターで溶液
をろ過する(7.4参照)。
備考 溶液E及び溶液Fの添加は任意であり,もし十分な濃度の植種源,例えば,活性汚泥,土壌又
はコンポストが使われる場合は必要ない。調製後,使用するまでは1mlずつ小分けして冷蔵し
ておくことが推奨される。
6.2.2.7
調製 1 000mlの試験培養液を調製するため,800mlの水 (6.1) に
− 溶液A 100ml
− 溶液B〜D それぞれ1mlを,EとFは任意
加え,さらに水 (6.1) を加えて全量を1 000mlにして,pHを測定する。
備考 培養液の正確な組成は,pHを測ることによって確認でき,7.0±0.2である。
6.3
ピロりん酸塩溶液 二りん酸四ナトリウム塩 (Na4P2O7) 2.66gを水 (6.1) に溶解し,全量を1 000ml
にする。
6.4
二酸化炭素吸収剤 望ましくはソーダ石灰又は他の適切な吸収剤。
7. 装置 すべてのガラス器具は,完全に洗浄され,特に有機物又は有害物質が付着してはならない。
通常の実験室の器具のほかに次のものを用意する。
7.1
閉鎖呼吸計 すべての必要な器具及びかくはん機を備えた試験容器(フラスコ)を含む閉鎖呼吸計。
恒温室又は,定温装置(例えば,恒温水槽)の中に設置する(例として附属書C参照)。
備考 十分な精度で生物化学的酸素要求量を測定できるいかなる呼吸計でもよいが,望ましくは,消
費酸素量を検知し,自動的にその酸素を補給する装置がよい。これによって分解過程における
酸素不足及び微生物活性の阻害が生じない。呼吸計の代わりに二相密閉瓶も使用できる(附属
書D参照)。
7.2
全有機炭素量 (TOC) 及び溶存有機炭素量 (DOC) を測定するための分析機器(ISO 8245参照)
7.3
硝酸塩及び亜硝酸塩を測定するための分析機器
備考 硝化反応が起こっているかどうかを調べるための定性試験を最初に行うことを推奨する。もし,
培養液中に硝酸塩/亜硝酸塩の存在が認められるならば,適切な試験方法(例えば,イオンク
ロマトグラフ法)による定量が必要である。
7.4
遠心分離機又は有機炭素を著しく吸着したり,放出したりしない膜フィルター(孔径0.45μm)をも
つろ過装置。
7.5
はかり 通常実験室で使用されるはかり。
7.6
pHメーター 通常実験室で使用されるpHメーター。
6
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
8. 操作
8.1
試験材料 試験材料(1)は,質量が既知で,試験に用いる呼吸計でBODが測定可能な十分な量の炭素
を含んでいなければならない。ThOD(附属書A参照)及びTOC(例えば,ISO 8245を使用)を化学式か
ら計算するか,元素分析によって決定する。試験材料濃度は,少なくとも100mg/lとする。この濃度は,
ThODとして約170mg/l又はTOCとして約60mg/lに相当する。もし,呼吸計の感度に余裕がある場合,よ
り低い濃度を用いることもできる。試験材料濃度の最大値は,試験に使用する呼吸計の酸素供給力と試験
培養液によって決まる。最適化試験培養液 (6.2.2) を使用する場合,試験材料濃度はC/N比が約40 : 1に
なる約2 000mg/lを超えてはいけない。より高濃度での試験が必要な場合,試験培養液の窒素濃度を増や
さなければならない。
備考1. 自然環境中での生分解過程を模擬する場合,標準培養液を使用し,試験材料濃度を100mg/l
とすることを推奨する。
2. 試験材料(1)は,粉体を用いるべきであるが,フィルム,破片,断片又は成形品を用いてもよ
い。試験材料の形状は,生分解度に影響を及ぼすことがある。異なるタイプのプラスチック
間で分解度を比較する場合,同一の形状の試料を用いるべきである。粉体を試験材料とする
場合,限定した狭い範囲の粒度分布をもつ試料を使用すべきである。最大直径が250μmの粒
度分布が推奨される。また,試験材料の形状によって使用する試験装置の大きさが決まる。
かくはん方式などの試験条件によって機械的な異常が発生しないことを調べておかなければ
ならない。試験材料を加工する場合は,試験材料の分解挙動に影響を与えてはいけない(例
えば,混合物の場合は粉体を使用する。)。任意としてポリマー試験材料の水素,酸素,窒素,
りん及び硫黄含量並びに,例えば,サイズ排除クロマトグラフ法によって分子量を測定する
(ASTM D 3536-91その他の標準法を参照)。可塑剤などの添加剤を含んでいないポリマーを
試験材料とすることが望ましい。試験材料中に,そのような添加物が含まれている場合,プ
ラスチック材料の正確な生分解度を評価するためには添加物の生分解性に関する情報が必要
である。
注(1) 一般にプラスチック材料の物性の比較をするときは,試験材料の形状を厳密に規定しているこ
とが多い。この規格を用いて異なるタイプのプラスチック間で生分解度を比較する場合,同一
形状(大きさ,形,厚み)の試験材料を用いる。同一形状の試験材料を用意できれば,試験時
期が異なるような場合の比較も可能であるが,一般には,時期が異なると同一形状の試験材料
を用意することは難しいので,同じ粒径の粉体を用いるのがよい。
水に難溶な物質の取扱いについての詳細は,ISO 10634を参照する。
8.2
対照材料
アニリン又は生分解度が既知のポリマー(例えば,微結晶セルロース粉体,灰分のな
いセルロースろ紙,又はポリ-β-ヒドロキシ酪酸)を対照材料とする。可能ならTOC,形状及び大きさは,
試験材料と同じにする。
陰性対照として,試験材料と同じ形状の非分解性ポリマー(例えば,ポリエチレン)を用いることがで
きる。
8.3
植種源の調製方法 主として,家庭下水を処理している下水処理場の活性汚泥が植種源に適する。
これは,活性な好気的環境から得られ,広範囲のプラスチック材料が試験されるどの地域でも利用できる。
代わりに,土壌及びコンポストの懸濁液を植種源として用いることもできる。幾つかのプラスチック材料
の分解には,菌類が重要な役目をしているので,特定の廃水処理系での生分解性を調べる場合,植種源は,
そのような環境から採取しなければならない。
7
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
植種源は,十分な分解活性をもった多様な凝集微生物フローラを得るため,8.3.1及び8.3.2に記載され
た植種源又はそれらの混合物から調製する。植種源の内性呼吸量が大きい場合,使用前にばっ(曝)気を
行って植種源を安定化させる。試験温度を使用した植種源と調和させる(5.の備考参照)。
備考 使用する植種源のコロニー形成数 (CFU) を測定することは有益である。試験混合物は,少な
くとも106CFU/mlの菌数を含んでいなければならない。
8.3.1
廃水処理場から採取した植種源 主として,家庭下水を処理して正常に稼動している下水処理場又
は実験室プラントから活性汚泥を採取する。十分にかくはんし,好気条件に保ち,採取した日に使用する
ことが望ましい(少なくとも72時間以内に使用する。)。
使用する前に,懸濁固形物濃度を測定する(例えば,ISO 11923を使用する。)。必要に応じて活性汚泥
を濃縮して,試験系に添加する汚泥量が最小限量となるようにする。懸濁固形物濃度が30mg/l〜1 000mg/l
になるように適正量の汚泥を添加する。
備考1. 自然環境における生分解過程を模擬する場合や,炭素収支の測定を行う場合(附属書E),植
種源濃度は,懸濁固形物として30mg/lとすることが推奨される。固形物は,炭素収支の測定
を妨害するので,次の方法で植種源を調製することが推奨される。活性汚泥500mlを採り,
破砕混合機又はそれに相当する高速ミキサーを用いて中程度のスピードで2分間均一化する。
上澄み液に固形物がほとんど含まれなくなるまで,少なくとも30分間放置する。上澄み液を
デカンテーションで採り,試験液中濃度として1容量%〜5容量%となるように試験フラスコ
に添加する。このとき,汚泥粒子が混入するのを避ける。
2. 植種源は予調整を行ってよいが,通常は予暴露した植種源は使用しない。特に自然環境下で
の生分解挙動を模擬した標準試験の場合はそうである。試験の目的に応じて予暴露を行った
植種源を用いることができる。この場合,試験報告書には,予暴露した植種源を用いたこと
及び予暴露の詳細な方法を明記する(例えば,予暴露菌を用いた条件での生分解度=X%)。
予暴露した植種源は,種々の条件下で行っている適切な実験室内生分解試験(ISO/TR 15462
参照)又は関連した環境条件が存在する場所(例えば,環境中に物質が存在する地域又は工
場処理場)から採取することができる。
8.3.2
土壌及び/又はコンポスト植種源 10gの殺菌処理を施していない肥よくな土壌,若しくは主とし
て有機廃棄物を処理しているコンポスト工場から採取したコンポストを100mlの試験培養液(6.2.1又は
6.2.2)又は一般に土壌微生物学で使用されているピロりん酸溶液 (6.3) に懸濁させ,約30分間放置する。
上澄み液をデカンテーションし,粗い目のフィルターでろ過した後,1容量%〜5容量%濃度となるように
適正量を試験培養液に添加する。これより高濃度の植種源を使用することができるが,その場合炭素収支
の測定が難しくなる。コンポストを使用することによって試験フラスコ中の菌類数を増やしてプラスチッ
ク材料の分解性を向上させることができる。この場合,使用したコンポストの状態を試験報告書に記載す
る(例えば,熟成コンポスト,温度約50℃の高温相から採取したコンポストなど)。
高濃度の植種源濃度が必要な場合,より多くの土壌又はコンポストを試験培養液に懸濁させて,植種時
に適切な濃度に希釈する。
8.4
試験 少なくとも次の試験を含む数のフラスコを用意する。
a) 試験材料用フラスコ(略号FT) 2個(2)
b) 空試験用フラスコ(略号FB)
2個(2)
c) 対照材料を用いて植種源の活性を調べるためのフラスコ(略号FC)1個
必要に応じて次のフラスコを用意する。
8
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 加水分解などの非生物的分解又は非微生物的分解を調べるためのフラスコ(略号FS)1個。
FS中の試験溶液は,例えば,オートクレーブか塩化水銀(II) (HgCl2) の10g/l溶液5mlを添加するか,
その他の微生物活性抑制物質を添加することによって殺菌しなければならない。必要ならば,同量の
抑制物質を試験期間中加える。
e) 試験材料と同一形状の非分解性プラスチック材料を試験材料とする陰性対照用フラスコ(略号FN)1
個。
f)
試験材料の微生物活性阻害性を調べるためのフラスコ(略号FI)1個。
試験材料及び対照材料中の炭素量と培養液の窒素量は,少なくとも約C/N比を40 : 1にする。必要
に応じて窒素を添加する。
注(2) 試験の繰返し数を確保するため,試験材料,及び空試験用のフラスコを2個用意する。試験実施
上可能であれば,これらを3個ずつ,またc)〜f)のフラスコを複数にしてもよい。
表1に示されているように試験培養液 (6.2) 及び植種源 (8.3) の適正量を各試験フラスコに添加する。
各フラスコのpHを測定し,必要ならば7に調整する。二酸化炭素吸収剤 (6.4) を呼吸計(附属書C参
照)の吸収剤用容器に入れる。各フラスコに試験材料 (8.1),対照材料又は陰性対照材料 (8.2) を表1に従
って添加する。炭素収支を測定する場合(附属書E参照),試験開始時及び試験終了後に,DOC及びバイ
オマスの測定用に,各フラスコ又は別個に設けたフラスコから所定量の試験溶液を分取する。分取した液
量は,最終試験液量を調整するとき,又は試験結果を計算するときに考慮する。
これらの試験フラスコを恒温環境5.に置いて所定の温度になるまで放置する。試験フラスコを呼吸計に
接続し,かくはんを開始する。圧力計の目盛を読み取る(手動装置の場合)又は酸素消費量の記録計が正
常に作動しているかを確認する(自動測定呼吸計の場合)。その他の方法として附属書Dに示す二相密閉
瓶法を用いることができる。
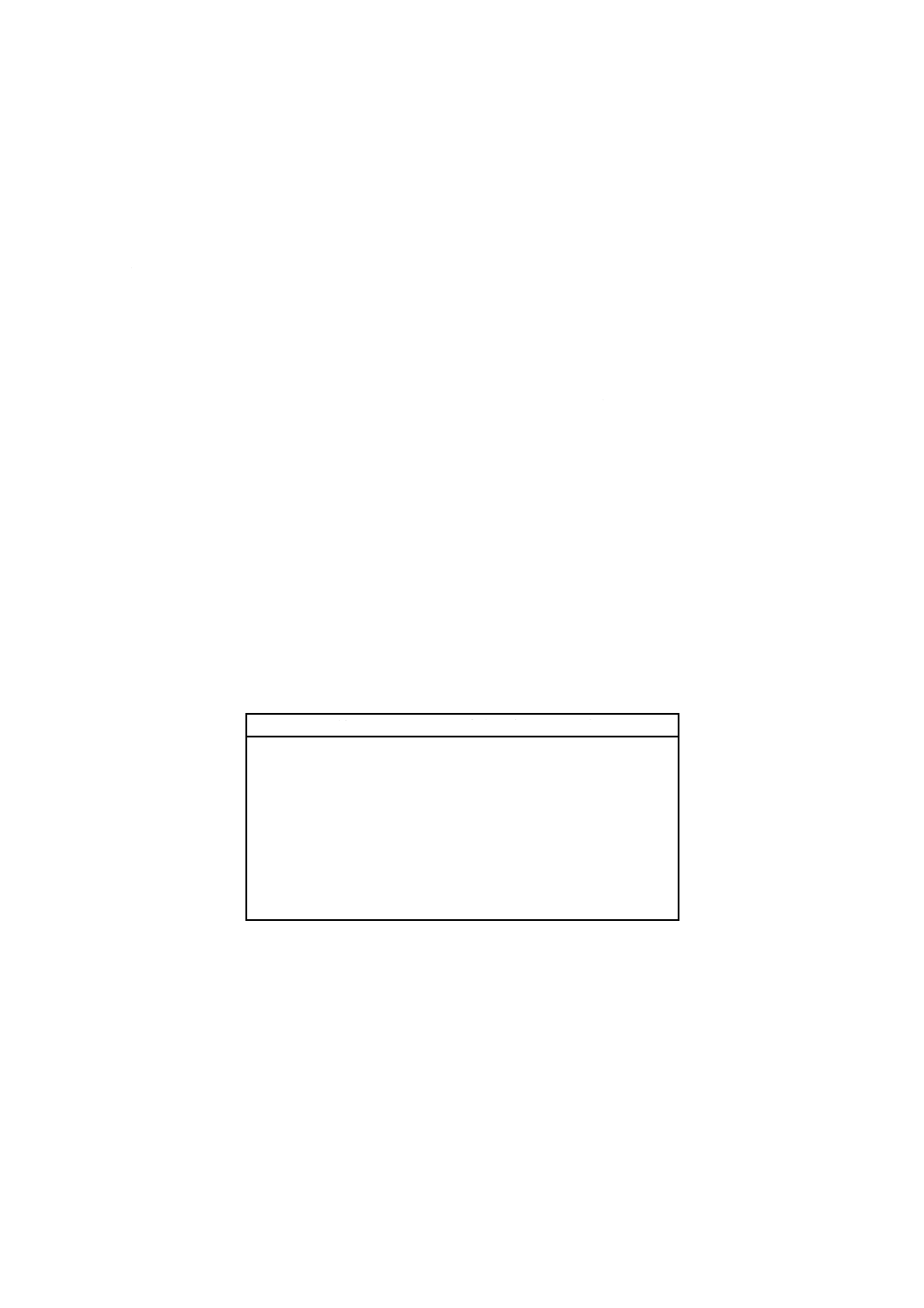
表1 試験材料及び対照材料の構成
フラスコ
試験材料
対照材料
植種源
FT 試験
+
−
+
FT 試験
+
−
+
FB 空試験
−
−
+
FB 空試験
−
−
+
FC 植種源活性チェック
−
+
+
FS
非生物的分解チェック(任
意)
+
−
−
FI
阻害対照(任意)
+
+
+
FN 陰性対照(任意)
−
+
+
BOD値が一定レベルに至り(定常期になる),それ以上は分解が進まないと考えられるときに,試験は
終了したとみなされる。最長の試験期間は6か月。長期試験の場合は,試験系(例えば,試験容器及び連
結部分の気密性)に特別の注意を払うべきである。
試験終了後に,フラスコFTのpH,硝酸及び亜硝酸濃度(備考6.参照)を直ちに測定するか,一部を分
取して測定材料として保存する。硝酸及び亜硝酸濃度は,硝化反応に対する分解度の補正に用いる。
備考 アリルチオ尿素は生分解されるので,短期間でしか硝化反応を阻害することができない。この
ため硝化反応の阻害剤としてアリルチオ尿素を添加することは推奨できない。しかし,経験的
に植種源濃度が低い場合(約1容量%),阻害剤を使用しなくても長期間硝化反応は起こらない
ことが分かっている。
9
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9. 計算及び結果の表示
9.1
計算 適切なタイプの呼吸計に対して製造業者から与えられた方法を使用して,それぞれのフラス
コごとに酸素消費量を測り,試験材料の特定の生物化学的酸素要求量BODSは,試験フラスコFTと空試験
フラスコFBの酸素消費量差を試験材料の濃度で割り,式(1)によって算出する。
TC
Bt
t
BOD
BOD
BODS
ρ
−
=
······························································· (1)
ここに,
BODS: 試験材料グラム当たりの特定BOD値 (mg)。
BODt: 時間tで試験材料に含まれるフラスコFTのBOD値
(mg/l)。
BODBt: 時間tで空試験対照FBのBOD値 (mg/l)。
ρTC: フラスコFT,の反応混合物中の試験材料の濃度 (mg/l)。
理論上の酸素要求量に対する特定の生物化学的酸素要求量の比として生分解度百分率Dtは,次の式(2)
によって算出する[試験材料グラム当たりのThOD値 (mg)]。
100
×
=ThOD
BOD
D
s
t
········································································ (2)
同様な方法でBOD及び対照材料FCの生分解度百分率を算出する。もし,含まれているならば生分解で
はない分解度チェックFS,阻害対照FI及び陰性対照FNについても算出する。
備考 ThODの計算は附属書Aを参照。もし,亜硝酸塩及び硝酸塩の有意な濃度が測定されたら,酸
素要求量は硝化によるものとみなす(附属書B参照)。炭素収支を計算する場合は,附属書E
に与えられている情報を使用する。
9.2
結果の表示及び解釈 測定されたBOD値及び生分解度百分率を測定間隔ごとに,また,試験フラス
コごとに表を作って表示する。時間の関数としてフラスコごとのBOD曲線及び百分率表示の生分解度曲
線をプロットする。二つのフラスコの結果が似たようなものなら,平均曲線をプロットする。
生分解度曲線の定常期の平均値,又は例えば,曲線が下降また,更に定常期にゆっくり増加するときに
最高値として測定された最高レベルの生分解度は,その試験材料の生分解度の特性を表す。炭素収支が計
算されるならば,この収支結果は最終生分解度の特性を表す。
試験材料のぬ(濡)れ能力及び形状は,得られた結果に影響を及ぼすかもしれない。したがって,その
試験方法は,類似の化学構造のプラスチック材料の比較に限定されるかもしれない。
試験材料の毒性に関する情報は,低い生分解性を示す試験結果の解釈に有効であるかもしれない。
10. 結果の正当性 試験は,次のような場合に正当であると考える。
a) 対照材料の生分解度(植種源チェックFC)は,試験の終了時で60%以上でなければならない。
b) 試験終了時の空試験FB中のBOD量は,実験で得られた上限値を超えてはならない(この値は植種源
の量によるが,例えば,30mg/lの乾燥物を使用した場合,実験室間試験が示しているように60mg/l
である。)。
フラスコFI(阻害チェック)を含むならば,その生分解度百分率が25%以下で,試験材料の十分な分解
が見られないならば,試験材料は抑制的であると推定することができる。
フラスコFS(非生物的分解チェック)を含むならば,そのBODの有意な量(10%以上)が観測される
場合は,非生物的分解プロセスが生じているかもしれない。
フラスコFN(陰性対照)を含むならば,そのBODの有意な量は見られない。
10
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
これらの基準が満たされない場合は,その試験は他の予調整された又は予暴露された植種源を使って繰
り返し行う。
11. 試験報告書 試験報告書には,少なくとも次の情報を含むべきである。
a) この規格及びそれぞれの附属書の番号の記載
b) 試験材料及び対照材料を同定するために必要なすべての情報:TOC,ThOD,化学組成,化学式(分
かるなら),形状,形態,量/濃度を含む
c) 試験条件の主なパラメータ:試験容積,使用した試験培養液,培養温度,最終pHを含む
d) 使用された植種源の出所及び量:使用されたコンポストの予暴露の細目及び状態を含む
e) 使用された分析技術:呼吸計の原理,TOC,硝酸塩/亜硝酸塩の決定を含む
f)
得られた試験及び対照材料の試験結果のすべて(表及びグラフ形式で):測定されたBOD,生分解度
百分率,時間に対するこれらの変数の対応する分解曲線(3),硝酸塩/亜硝酸塩濃度を含む
g) 誘導期,分解期,分解の最高レベルの期間及び全体の試験期間
そして任意に実施されて測定された場合は
h) 微生物の働きでない分解チェックFS,阻害対照FI,及び陰性対照FNの結果
i)
次の例を含む炭素収支の測定結果
1) 二酸化炭素に酸化されBODによる生分解度から見積もられた試験材料の全炭素量
2) 水溶性の物質による培養期間を通じての試験培養液中のDOCの増加
3) 試験を通じてのバイオマス中の有機炭素の増加
4) 試験終了時での残りのポリマーの炭素含量
5) 試験材料によって作られた炭素パーセントとして測定され表示された全炭素の合計量
j)
植種された試験混合物中のコロニー形成単位 (CFU/ml)
k) 他の関連データすべて(例えば,試料の最初の分子量,生分解されないで残ったポリマーの分子量)
注(3) 分解度が50%を超える場合,分解度が50%に達するまでの時間を示してもよい。

11
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A(参考) 理論的酸素要求量 (ThOD)
A.1 ThODの計算 分子量Mtをもつ物質CcHhClclNnSsPpNanaOoの理論的酸素要求量は,元素組成が既知
か,元素分析によって決定することができれば,次の式によって算出することができる。
t
M
o
na
p
s
n
cl
h
c
ThOD
]
5.0
5.2
3
)
3
(5.0
2[
16
−
+
+
+
−
−
+
=
この計算は,炭素は二酸化炭素に,水素は水に,りんはP2O5に,硫黄は六価の酸化状態に,さらに,塩
素はハロゲン化水素になることを暗に示している。N,P,及びSの酸化は,分析によって確認する必要が
ある。この計算では,窒素はアンモニウムとして放出される。硝化の影響は,附属書B参照。
ThODを試験物質1g又は1mg当たりのmg-酸素量として表示する。
A.2 例:ポリ-β-ヒドロキシ酪酸 (PHB)
化学式3) C4H6O2 c=4,h=6,o=2,ユニット分子量Mt : 86
86
]2
6
5.0
4
2[
16
−
×
+
×
=
ThOD
ThOD=1.674 4mg/mg PHB=1 674.4mg/g PHB
A.3 例:ポリエチレン/でんぷん/グリセロールブレンド物
組成
化学式
ThOD
組成量
ThOD
(mg/g) (%) (mg/フラスコ) (mg/フラスコ)
ポリエチレン (C2H4) n
3 400
50
500
1 700
でんぷん
(C6H10O5) n
1 190
40
400
476
グリセロール C3H8O3
1 200
10
100
120
ブレンド計
100
1 000
2 296
3) PHBは,β-ヒドロキシ酢酸モノマーからなる高分子である。重合(エステル形成)のために水が除去
される。したがって,PHBの最終的な分子式は,モノマーから(化学反応によって外れる)水1分子を差
し引いたものに等しい。
12
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(参考) 硝化による妨害のためのBOD値の補正
B.1 硝化による影響 BOD値は,硝化によって影響を受ける。窒素を含む被検物質の炭素の酸化に基づく
生分解度の計算の重大な誤りを防ぐためには,BOD値を修正しなければならない。培養液中のアンモニウ
ム塩の酸化は,空試験として差し引かれるので,窒素を含まない物質の場合の誤差は,一般的には無視で
きる。
アンモニウム塩及び窒素を含む試験物質は,生分解試験期間の培養期間中に亜硝酸又は硝酸に酸化され
る。反応が(異なった細菌群によって)連続的に行われるので,亜硝酸塩濃度の増減は可能である。後者
の場合,硝酸態の平衡濃度が形成される。
反応は,次の式(B.1)〜(B.3)と続く。
2NH4Cl+3O2=2HNO2+2HCl+2H2O ·········································· (B.1)
2HNO2+O2=2HNO3 ································································ (B.2)
全体として
2NH4Cl+4O2=2HNO3+2HCl+2H2O ·········································· (B.3)
これらの式から,次のことが結論付けられる;
− 無機培養液にNH4Clとして添加された2モル (28g) のアンモニア態窒素の亜硝酸への酸化には,3モ
ル (96g) の酸素が必要である (BODNO2)。なぜならば,1mgの窒素に対して3.43 (98÷28) 倍の酸素が
必要であるからである。
− 2モル (28g) のアンモニア態窒素の硝酸への酸化には,4モル (128g) の酸素が必要である (BODNO3)。
なぜならば,1mgの窒素に対して4.57 (128÷28) 倍の酸素が必要であるからである。
硝化量は,試験終了後のフラスコFTの培養液中の硝酸及び亜硝酸濃度を測定することによって決定され
る。硝化が起こっているかどうかを決定するために,最初に定性試験を行うことを推奨する。亜硝酸又は
硝酸の形跡があれば定量試験が必要である。
BODの一部で窒素の酸化から得られるBODN (mg/l) は,試験終了後に次の式(B.4)によって算出する。
BODN= (ρNO3×4.57) + (ρNO2×3.43) ········································ (B.4)
ここに,
ρNO3: 試験終了後に測定された試験フラスコFT中の硝酸態窒素
の濃度 (mg/l)
ρNO2: 試験終了後に測定された試験フラスコFT中の亜硝酸態窒
素の濃度 (mg/l)
4.57: 硝酸合成のために要求される酸素に対する係数
3.43: 亜硝酸合成のために要求される酸素に対する係数
BODの一部で炭素の酸化から得られるBODC (mg/l) は,試験終了後に次の式(B.5)によって算出する。
BODC=BODG−BODN−BODbt ···················································· (B.5)
ここに, BODG: 試験終了後に測定されたフラスコFTのBOD (mg/l)
BODbt: 試験終了後に測定された空試験フラスコFBのBOD (mg/l)
BODCはBODtに相当し,BODS及びDt[9.1の式(1)及び(2)参照]の計算に用いる。
B.2 例 被験物質である2-エチルヘキシルp-アミノ安息香酸エステルが,フラスコFT中に濃度100mg/l
である場合。
13
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ThOD
239mg/l
試験終了後におけるBODt測定値
199mg/l
空試験BODBt則定値
8mg/l
硝化分未修正のDt
80%
試験終了後における硝酸15mg/l,ρNO3
3.5mg/l
試験終了後における亜硝酸1mg/l,ρNO2
0.3mg/l
試験終了後のBODN
17mg/l
BODC
174mg/l
硝化に対する修正後のDt
73%
14
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
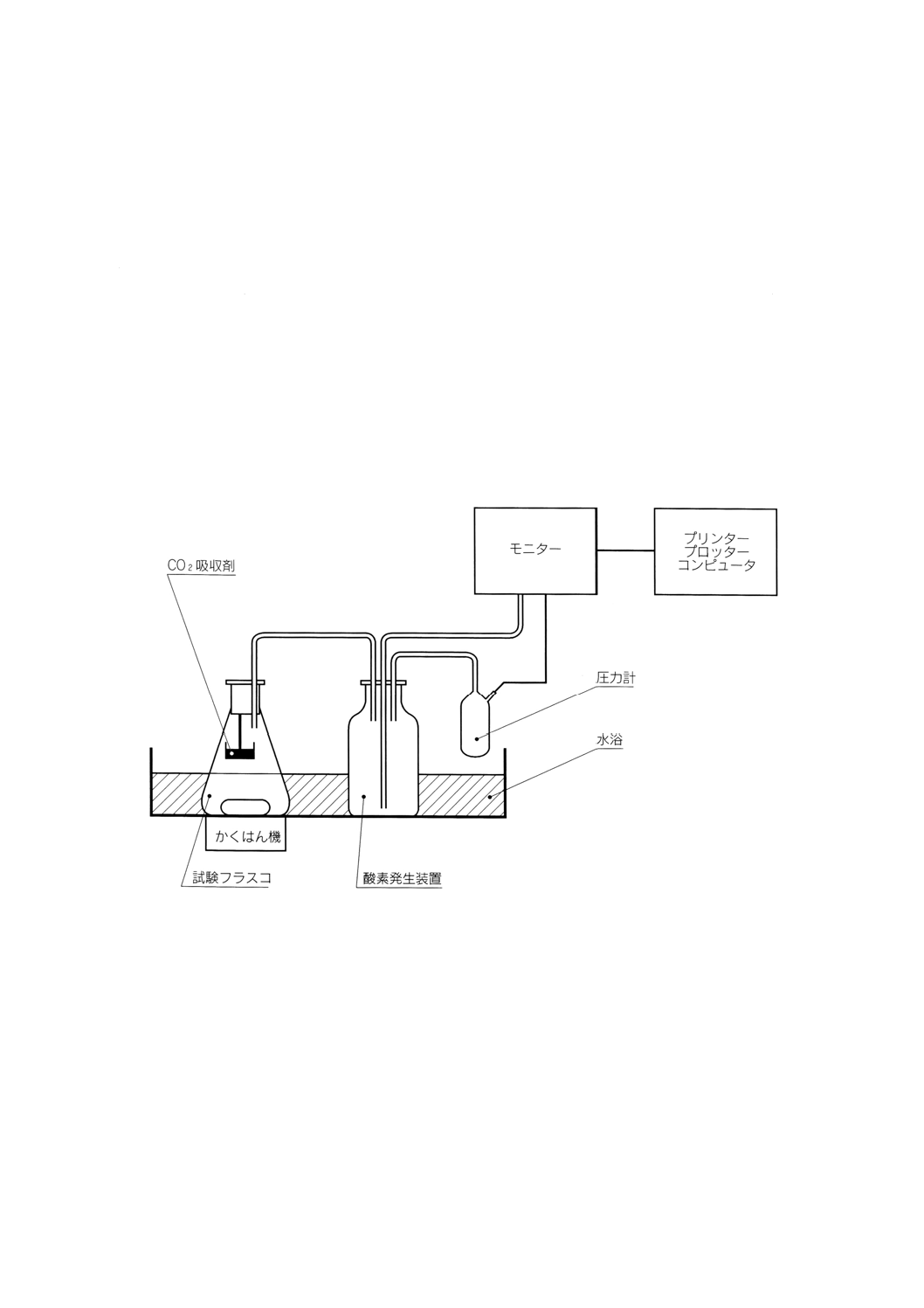
附属書C(参考) 閉鎖圧力測定型呼吸装置の原理
温度管理できる条件下(例えば,湯せんなどを用いて),マグネティックスタラー棒を入れた試験容器及
び,二酸化炭素吸収剤のための上部空間をもつ容器,電量分析型酸素発生装置,圧力計,試験容器用のマ
グネティックスタラー,外部モニタリング装置,(プリンター,プロッター又はコンピュータのような)記
録装置などからなる密閉型呼吸装置を準備する。試験容器には,その容積の約3分の1を試験混合物で満
たす。マグネティックスタラーを用いて,連続的に試験容器内をかくはんすることによって液相と気相間
の酸素濃度平衡を保つようにする。生分解が起こると微生物が酸素を消費し,二酸化炭素が発生する。こ
の二酸化炭素は,すべて二酸化炭素吸収剤に吸収される。その結果,試験容器内の圧力は減少する。この
圧力減少は,圧力計によって検出されて,電気信号として酸素発生装置に送られ,酸素を発生させる。同
様にして初期の圧力値が回復すると,酸素を発生させる電気分解は止まる。供給された電気量は,酸素消
費量に比例することから,電気量を連続的に測定して,記録計にmg/l BODの単位で酸素消費量を記録で
きるように設定しておく。
図C.1 圧力測定型呼吸装置
15
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D(参考) 二相密閉瓶を用いた呼吸試験
D.1 原理 この試験方法は,例えば,先に記載したような呼吸装置が利用できない場合の代案となる。植
種源,試験材料及び参照物質は,あらかじめ体積の分かっている水溶液若しくは空気が入っている密閉瓶
に混入し,20〜25℃の温度条件下で振るか又はかき混ぜる。これによって水相と気相間の静的酸素分圧を
調整する。生分解は,水相での溶存酸素濃度を定期的に測定することによって求める。試験フラスコ内の
総酸素取込み量は,空試験及び試験フラスコで測定される溶存酸素濃度の差を,標準条件下での飽和酸素
量で除し,これに最初に液相及び気相に存在した総酸素量を乗じることで算出される。生分解度は,総酸
素取込み量を理論的酸素需要 (ThOD) で除すことで計算され,百分率で表される。
D.2 特別な装置
D.2.1 培養瓶 ガスを通さない瓶,例えば,容積200〜300mlの栓(例えば,すりガラス,ブチルゴム製,
又はスクリューキャップのもの)付きの首の部分が細くなった瓶で,光を通さない(例えば,褐色ガラス
製)の瓶を用意する。栓には留め金をすることを推奨する。各瓶は,油性ペンで印を付けておく。スター
ラー付き酸素電極が用意できない場合は,ポリテトラフルオロエチレンで被膜したマグネティックスター
ラーを用意する。標準容積の試験瓶を用いる場合は,使用する試験瓶の平均容積の標準偏差が1ml以内に
なるようにしなければならない。又は各番号を付けられた試験瓶の容積が,個別に1mlの精度で測定し,
記録しておく。試験瓶の密閉度を確実にするとともに,栓の取外しを容易にするために,不活性のシリコ
ン油を栓部分に塗っておくとよい。
D.2.2 酸素電極 望ましくは据え付けてあるかくはん装置を用い,0〜10mg/lの濃度範囲を1%の精度で測
れるものがよい。電極の応答性については,約1.5分以内に安定状態に達するものを選んでおく。電極の
位置は,例えば,試験瓶の首の磨きガラス部分に,漏れのないように栓ができる状態で取り付けるか,又
は試験瓶に工夫してバイパスによって酸素濃度を測定できるようにしておくとよい。
D.2.3 マグネティックスタラー又はかくはん装置
D.3 操作 8.4に記載された試験瓶FT,FB,FCの三つを準備する。試験瓶内の試験培養液をかき混ぜる場
合は,振とうでなく,かくはんする場合は,スタラー棒をそれぞれの瓶に入れる。十分な試験培養液,望
ましくは標準試験培養液 (6.2.1) を準備して,完全な試験が実施できるようにする。十分な量の栄養を供
給するために,保存溶液中の塩化アンモニウムを3倍の1.5g/lとする。8.3に従って培養液に植種源を加え
る。このとき,できれば30mg/lの活性汚泥を用いることが望ましい。植種源と培養液とは,よく混合して
試験瓶に加えるとよい。このとき,試験瓶の空間容積の3分の2に相当する量を加える(例えば,300ml
の試験瓶なら200ml)。次に,試験瓶を培養装置に取り付けるか又は装置を使ってかき混ぜながら,20℃〜
25℃で1週間培養する。この間,微生物は体内の蓄積物質を消費するので,植種源は安定化(栄養が枯渇)
する。その後,飽和水蒸気で満たした圧縮空気を空気拡散器によって約15分間,試験瓶内をばっ気し,初
期酸素濃度を測定する。次に,試験材料及び対照材料を8.1及び8.2に規定された試験瓶に加える。この試
験では,試験材料の濃度は最大150mg/l ThOD,すなわち約90mg/l TOCに相当するものでなければならな
い。この後,試験瓶にしっかり栓をし培養を続ける。
1週間ごとに各試験瓶の溶存酸素濃度を測定する。試験期間中は試験瓶の温度は,常に設定温度のプラ
16
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
スマイナス0.5℃で管理する。酸素電極は,製品仕様に従って正確に校正しておく。酸素測定は,試験瓶を
連続的に取り出して,約30秒間,手で勢いよくかくはんさせた後,試験瓶をスターラー装置に移して行う。
このとき培養操作は行わない。
次に栓を外して,直ちに酸素電極を取り付けた栓を試験瓶の首の部分に差し込む。このとき,栓は試験
瓶をうまく密閉でき,かつ電極の先端が液面下に届くように調整しておく。次に,スターラーをスタート
させ,渦が生じないようにしながら酸素濃度が測定できるように回転速度を調節する。この回転速度は,
酸素濃度測定時及び電極校正時を通して,一定にしておくとよい。電極の指示が安定したら,普通約2分
以内である,酸素濃度値を記録する。酸素濃度が1.5mg/l以上を示す試験瓶に限り試験を有効とし,試験
結果の生分解度の計算に用いる。この方法に代えて,水相での溶存酸素濃度を測定する他の適切な方法,
例えば,試験瓶の密閉度を保ったうえで,バイパスを設けて酸素電極を取り付けておくようなものがあれ
ば採用してもよい。
次に各試験瓶のpHを測定し記録しておく。もしpHが6.0以下であれば0.1mol/l〜0.5mol/lの水酸化ナト
リウムを用いて7.5に調整しておく。最後に空気拡散器を用いて試験瓶の培養液を約15分間ばっ気し,前
述の方法で酸素濃度を測定する。再び試験瓶に栓をし,シエーカーに取り付けて培養を続ける。測定した
BODは,試験の最後に窒素化することで補正する(8.4及び附属書Bを参照)。
D.4 結果の計算 各試験瓶の水相の取込み酸素量比Urは,式(D.1)によって算出する。
Ur= (CBt−Ct) /CS ··································································· (D.1)
ここに, CBt: 培養時間tでの空試験の溶存酸素濃度の平均値 (mg/l)
Ct: 培養時間tでの試験瓶の溶存酸素濃度 (mg/l)
CS: 飽和溶存酸素量 (mg/l)
である。
このCSは,空試験又は試験瓶のばっ気後に測った平均値を用いる。標準気圧 (1 013hPa),20℃でのCS
の理論値は9.08となる。
試験瓶の総酸素容量OC(mg/瓶)は,次の式(D.2)によって,標準気圧,20℃での気相の最大含有酸素量
及び液相での酸素含量から算出する。
OC= (0.28×Vg) + (0.009×Vl) ················································ (D.2)
ここに,
0.28: 標準的な空気の酸素含量 (mg/ml)
Vg: 試験瓶中のガス体積 (ml)
0.009: 飽和水の酸素含量 (mg/ml)
Vl: 試験瓶中の溶液体積 (ml)
通常Vlは,一試験当たり一定となるようにするが,分析のために試料の一部が取り出された場合は例外
とする。また,Vgは試験に供した試験瓶によって異なる。各試験瓶間の容積差はできるだけ小さくし,OC
を一定として扱う。また,その差が顕著な場合(例えば,200ml容量瓶で2ml以上である場合など)は,
各試験瓶ごとにOCを計算しなければならない。試料が分取されるに従ってVlが減少する場合は,Vgはそ
れに伴って増加させないといけない。
酸素取込み量 (BOD) は,次の式(D.3)によって算出する。
BOD=Ur×OC ········································································ (D.3)
17
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
試験の終了時には,全(試験数nについて)培養期間のBOD総量を式(D.4)を用いて総計する。
ΣBOD=BOD1+BOD2+…+BODn ················································ (D.4)
次に9.1に従って生分解度をパーセンテージに換算する。
非生物的な関与の除外,対照材料の生分解度及び植種源への生育阻害を評価する場合は,適宜,目的に
合った式を用いて求める。
18
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E(参考) 炭素収支の測定例
E.1 原則及び範囲 プラスチック材料は,通常低分子量の物質に比較して,より複雑な組織からなりたっ
ている。二酸化炭素放出量又は生物学的酸素要求量 (BOD) だけを測定することは,その生分解性を特徴
付けたり,定量化するには十分でない場合が多い。生分解している間に,新しいバイオマス(生物資源)
が微生物によって築き上げられ,試験に使われる物質の炭素の一部は,生化学的に酸化されるのではなく,
バイオマスに変換される。したがって,二酸化炭素放出及び生物学的酸素要求量のような分析のパラメー
タは,試験材料の完全生分解の場合でさえも各々の理論値の100%にしばしば到達せず,また,その試験
結果から不十分な分解であると誤って過小評価されることにもなる。この附属書で記載されるように,全
体の炭素収支の測定は,このような場合,完全生分解性を確認するのに役立つだろう。
そのような収支は,次に示す測定から得られる炭素量の加算に基づいている。二酸化炭素として放出さ
れる炭素,新しいバイオマスとして生産される炭素,水溶性有機代謝物に変換されDOCとして測定され
る炭素,及び分解されない残存高分子物質。炭素総量は,試験系に導入される試験材料の有機炭素の量と
比較される。
E.2 試験操作 8.4で記載したようにBODを測定する。
試験のはじめ,試験材料を加える前,培養の終了時に培養液のサンプリングをする。サンプリングは,
代表する試料を得るために注意して行わなければならない。これらの試料を膜ろ過又は約40 000ms−2で遠
心分離する。
フィルター上又は残さ(渣)中のバイオマスを適切な方法,例えば,たんぱく測定によって測定する。
バイオマス中の炭素量を測定又は推測し,その差からバイオマスの有機炭素の増分を計算する。
試料のろ液中,DOCをISO 8245に従って測定し,有機炭素の増分を計算する。可能ならば,水溶性代
謝分の生産を確認するためにDOCを形成する物質の同定を試みる。
試験の終了時に,すべての残った試料を使って残存ポリマー中の炭素量を測定する。これは通常難しい
方法であり,もし,あるポリマーに特異的な分析が利用できるならば直接に(附属書F参照)又は間接に
測定できる。前者の場合,残さポリマーの量を抽出,測定し,その公知の組成から炭素量を計算する。間
接的に測定する方法は,洗浄,乾燥,残さ質量測定及び全有機炭素量 (TOC) 測定によって可能になる。
それから残さポリマーの炭素量を得るために,バイオマスの測定結果を使ってTOCからバイオマス炭素を
差し引く。さらに,別に可能なことは,残さを正確にはかり,あらかじめ確認するべきことであるが,ポ
リマーではなくバイオマスを破砕するための適切な方法で処理することである。例えば,次亜塩素酸ナト
リウムを使って,可溶部を除き,再び同試料をひょう(秤)量する。すべてのバイオマスが除かれたと仮
定して,その質量から残さのポリマー量を算出する。
E.3 炭素収支の計算 試験系に導入された試験材料(炭素含量CMAT)中,生化学的に酸化された炭素量
CBOD (mg/l) を,呼吸試験(9.1参照)の生分解性の程度Dt (%) から式(E.1)によって算出する。
100
PO
MAT
BOD
D
C
C
×
=
································································ (E.1)
培養試験期間の最初と最後のバイオマスを比較することによって,試験材料を含んだフラスコ中のバイ

19
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
オマスの炭素の増分CBIO (mg/l) を計算する。その際,式(E.2)に従ってバイオマスの炭素の測定量又は推定
量CB (start),CB (end) を考慮する。
CBIO=CB (end) −CB (start) ····························································· (E.2)
最初と最後のDOC濃度DOC (start) とDOC (end) を比較することによって,培養期間のDOCの増分CDOC
(mg/l) を式(E.3)によって算出する。
CDOC=DOC (end) −DOC (start) ······················································ (E.3)
試験の終わりの残存ポリマー中の有機炭素の量Cpolを測定する。
導入された炭素CMATの百分率として変換された炭素の異なった量を計算し,式(E.4)に示されるように炭
素計算値CCLAC (%) を得るために加算する。
CCLAC=CBOD+CBIO+CPOC+Cpol ·················································· (E.4)
E.4 ポリ-(β-ヒドロキシ酪酸)の炭素収支の例4) 試験材料の投入:CMAT600mg/l=334.8mg/lC
生分解の程度:Dt=78%
CB (start)
CB (end)
CB
DOC (start)
DOC (end) DOC CBOD
g/l
3.2
61.0
57.8
2.0
22.0
20.0
261
of CMAT
17.2
6.0
78
計算された炭素収支:CCLAC=78%+17%+6%=101% of CMAT
4) データ提供:Puechner (1994) (附属書G参照)
20
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書F(参考) 生分解度試験の終わりに,水に不溶性のポリマーの
残存量及びその分子量を測定する例
生分解度試験の終わりに残っているポリマーの量又は分子量を測定する方法を使うことが役立つかもし
れない。次のような方法又は他の適切な方法が,水と混和しない有機溶剤に溶ける水に不溶なポリマーを
分析するために使われる。
a) 分液漏斗に試験混合物を移液し,適切な有機溶剤を加え,残ったポリマーを抽出するために10分〜20
分間振とうする。水層から有機溶剤層を分離する。新しい溶剤を加え,この手順を繰り返す。
b) 有機抽出物を混合して乾燥するまで溶媒を蒸発させる。その固体サンプルを適正な容量の適切な溶質
に溶解する。
c) サイズ排除クロマトグラフ法のゲルを詰めたカラムを使った高速液体クロマトグラフ (HPLC) に適
正量を注入する。分析を開始しクロマトグラフを記録する。
d) 検量線を使ってポリマー量を測定する。
e) (検量線の作成には)同じポリマー又は,試験ポリマーに類似の構造をもつ分子量が既知のポリマー
をクロマトグラフに注入することによってポリマーの分子量を測定する。保持時間と分子量の関係が
クロマトグラムから得られる。これらの関係(検量線)を使って分子量を計算する。
試験ポリマーの絶対分子量は,Low Angle Laser Light Scattering (LALLS) 及びDifferential Refractive Index
(示差屈折率)を組み合わせた検知器をもったHPLCによっても測定することができる。
21
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書G(参考) 参考文献
[1] ASTM D 3536-91, Molecular Weight Averages and Molecular Weight Distribution by Liquid Exclusion
Chromatography (GEL Permeation Chromatography−GPC).
[2] ASTM D 5271-93, Determining the Aerobic Biodegradation of Plastic Materials in an Activated−Sludge
Wastewater−Treatment System.
[3] ISO 8192 : 1986, Water quality−Test for inhibition of oxygen consumption by activated sludge.
[4] ISO 10708 : 1997, Water quality−Evaluation in an aqueous medium of the ultimate aerobic biodegradability of
organic compounds−Determination of biochemical oxygen demand in a two-phase closed bottle test.
[5] ISO 11923 : 1997, Water quality−Determination of suspended solids by filtration through glass-fibre filters.
[6] JIS K 6950 : 1994, Plastics−Testing Method for Aerobic Biodegradability by Activated Sludge.
[7] KITANO, M., and YAKABE, Y., Strategy for Biodegradability Testing in OECD. Edited by Y. Doi and K.
Fukuda, Biodegradable Plastics and Polymers, Elsevier, Amsterdam, pp. 217-227 (1994).
[8] PÜCHNER, P., MUELLER, W. R., and BARDTKE, D., Assessing the Biodegradation Potential of Polymers in
Screening and Long−Term Test Systems, J. Environm. Polymer Degradation, 3, pp. 133-143 (1995).
[9] PÜCHNER, P., Screening−Testmethoden zur Abbaubarkeit von Kunststoffen unter aeroben und anaeroben
Bedingungen, Dissertation, Stuttgart University Fakultät für Bauingenieurwesen, Stuttgarter Berichte zur
Abfallwirtschaft, 59, Erich Schmidt Verlag, Berlin (1994).
[10] SAWADA, H., Field Testing of Biodegradable Plastics, Edited by Y. Doi and K. Fukuda, Biodegradable Plastics
and Polymers, Elsevier, Amsterdam, pp. 298-312 (1994).
[11] SPERANDIO, A., and PÜCHNER, P., Bestimmung der Gesamtproteine als Biomasse−Parameter in wäBrigen
Kulturen und auf Trägermaterialien aus Bio−Reaktoren, gwf Wasser, Abwasser, 134, pp. 482-485 (1993).
22
K 6950 : 2000 (ISO 14851 : 1999)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
原案作成委員会 構成表
氏名
所属
(委員長)
土 肥 義 治
理化学研究所
西 出 徹 雄
通商産業省基礎産業局
堅 尾 和 夫
通商産業省基礎産業局
大 嶋 清 治
通商産業省工業技術院
常 盤 豊
生命工学工業技術研究所
橋 本 繁 晴
財団法人日本規格協会
中 崎 清 彦
静岡大学工学部
鹿 毛 紀久雄
財団法人高分子素材センター
川 島 信 之
三井化学株式会社
北 國 英 一
昭和電工株式会社
栗 山 昌 樹
日本モンサント株式会社
河 野 通 紀
凸版印刷株式会社
澤 田 秀 雄
ISO/TC61/SC5/WG22コンビナー
辻 正 男
株式会社クラレ
富 田 敏 彦
三菱樹脂株式会社
野長瀬 三 樹
ダイセル化学工業株式会社
平 野 惇
財団法人バイオインダストリー協会
福 田 和 彦
生分解性プラスチック研究会
三 宅 辛 二
日本合成化学工業株式会社
矢可部 芳 州
財団法人化学品検査協会
吉 木 健
日本プラスチック工業連盟
(事務局)
三 宅 孝 治
日本プラスチック工業連盟



