K 3810-3:2003
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,財団法人バイオイ
ンダストリー協会 (JBA)/財団法人日本規格協会 (JSA) から,工業標準原案を具して日本工業規格を改正
すべきとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した日本工業規格である。
これによって,JIS K 3810-3 : 1997は改正され,この規格に置き換えられる。
JIS K 3810の規格群には,次に示す部編成がある。
JIS K 3810-1 第1部:培養による直接検出法
JIS K 3810-2 第2部:DNA蛍光染色による間接検出法
JIS K 3810-3 第3部:PCRによる検出法
K 3810-3:2003
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 1
3. 定義 ······························································································································ 1
4. マイコプラズマの検出限界及び検出感度 ·············································································· 2
5. 試験方法 ························································································································ 2
5.1 装置及び器具 ················································································································ 2
5.2 試薬類 ························································································································· 3
5.3 試料からのDNA抽出 ····································································································· 3
5.4 PCR反応 ····················································································································· 3
5.5 結果の判定 ··················································································································· 4
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 3810-3:2003
マイコプラズマの検出法−
第3部:PCRによる検出法
Mycoplasma detection methods-
Part 3: Nested PCR assay
1. 適用範囲 この規格は,培養細胞及び細胞培養に用いる試薬類並びに細胞培養によって生産された製
品中のマイコプラズマをPCR (polymerase chain reaction) 法によって検出する方法について規定する。
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3600 バイオテクノロジー用語
JIS K 3604 組織培養用培地(最小必須培地)
JIS K 8101 エタノール (99.5)(試薬)
JIS K 8839 2-プロパノール(試薬)
3. 定義 この規格で用いられる主な用語の定義は,JIS K 3600によるほか,次による。
a) 蒸留水 JIS K 3604で規定する純水。
b) マイコプラズマ 無細胞培地で発育可能な無細胞壁原核生物。DNAをゲノムとする。発育にコレステ
ロールを要求しないものはアコレプラズマと呼ばれる。
c) コロニー形成単位 [Colony Forming Unit (CFU) ] 寒天培地上で1個のコロニーを形成する試料1 ml
中のマイコプラズマの量。
d) プライマー DNAを酵素的に合成する際に用いる断片で,PCR法を用いる場合にDNA合成の開始に
必す(須)な合成オリゴヌクレオチド。
e) 二段階PCR法(nested PCR) 特異性及び検出感度を高めるため,一度PCRを行い,PCR産物を再
度1回目のPCR領域内に新たにプライマーを設定し,2回目のPCRを行う方法。1回目及び2回目の
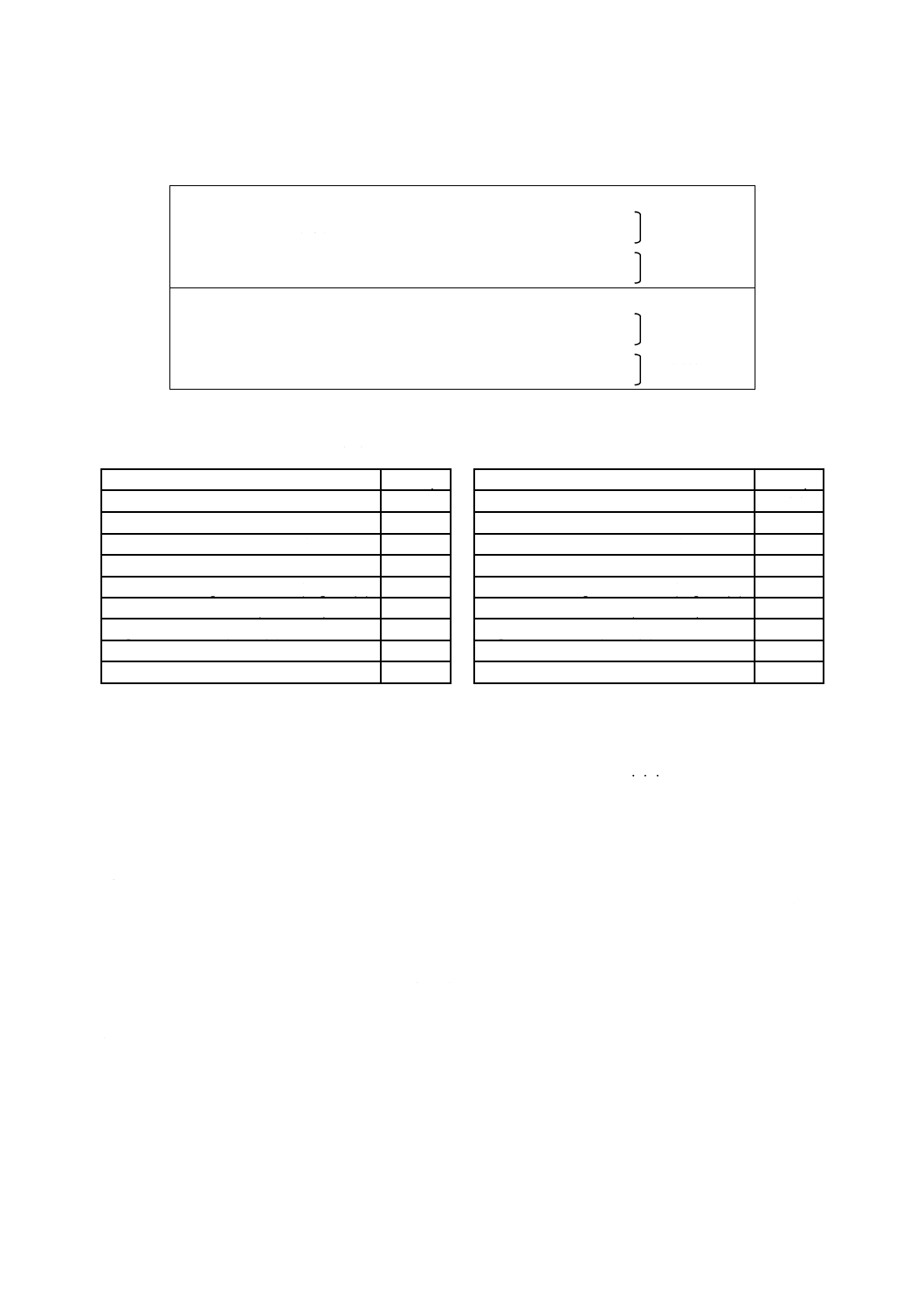
PCRに用いるプライマー,並びにPCR反応液をそれぞれ表1及び表2に示す。
2
K 3810-3:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表 1 マイコプラズマ検出用プライマー
(A) マイコプラズマ検出用プライマー
MCGpF1 : 5'-ACACCATGGGAG (C/T) TGGTAAT-3
1回目 PCR
MCGpR1 : 5'-CTTC (A/T) TCGACTT (C/T) CAGACCCAAGGCAT-3'
MCGpF2 : 5'-GTTCTTTGAAAACTGAAT-3'
2回目 PCR
MCGpR2 : 5'-GCATCCACCA (A/T) A (A/T) ACTCT-3'
(B) アコレプラズマ検出用プライマー
AF5 : 5'-CTAACTAACACTTAGCACAA-3'
1回目 PCR
AR6 : 5'-ACTGTGTGCCCTTTGTTCCTT-3'
AF3 : 5'-GTCACTCAAACAAGTAACCA-3'
2回目 PCR
AR5 : 5'-TTTCAAAGATCTCAATTAGG-3'
表 2 マイコプラズマ検出用PCR反応液
a) 1回目のPCRの反応条件
b) 2回目のPCRの反応条件
組成(成分)
添加量μl
組成(成分)
添加量μl
滅菌蒸留水
50.0
滅菌蒸留水
59.0
10倍緩衝液
10.0
10倍緩衝液
10.0
dNTP混合溶液(各1.25 mmol/L)
16.0
dNTP混合溶液(各1.25 mmol/L)
16.0
プライマーMCGpF1又はAF5 (10 pmol/μl)
2.0
プライマーMCGpF2又はAF3 (10 pmol/μl)
2.0
プライマーMCGpR1又はAR6 (10 pmol/μl)
2.0
プライマーMCGpR2又はAR5 (10 pmol/μl)
2.0
塩化マグネシウム溶液 (25 mmol/L)
8.0
塩化マグネシウム溶液 (25 mmol/L)
8.0
Taqポリメラーゼ (1 unit/μl)
2.0
Taqポリメラーゼ (1 unit/μl)
2.0
試料
10.0
試料(1回目のPCR産物)
1.0
総量
100.0
総量
100.0
4. マイコプラズマの検出限界及び検出感度 この方法では,核酸であるDNAを検出するためマイコプ
ラズマの活性又は不活性の区別ができない。また,この方法を用いた検出感度については,陽性対照とし
てMycoplasma hyorhinis (ATCC 29052又はIFO 14858)及び Mycoplasma arginini (ATCC 23838又はIFO
14476)1 CFUを含む試料中のマイコプラズマを検出できることを必要とする。
5. 試験方法
5.1
一般 PCRによるマイコプラズマの検出は,次による。
このとき,反応及び検出系の確認としてMycoplasma hyorhinis及びMycoplasma argininiを陽性対照とし
て用いる。
5.2
装置及び器具
a) サーマルサイクラ PCR反応に用いる温度変換装置。
b) 水平形電気泳動装置 泳動槽及び定電圧装置。
c) UVトランスイルミネータ 放電管から発生させた紫外線のうち波長254〜365 nmの範囲にある特定
の波長を取り出すフィルタを備えていて,平板ゲルなどに含まれる吸収物質の検出及び観察を行うた
めの装置。
d) 遠心分離器
e) 分光光度計
3
K 3810-3:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
f)
容器 容器は,PCR反応及び高熱(100 ℃)に影響を及ぼさないものとする (1) 。
注(1) 一般的にポリプロピレン製遠心分離管(0.2〜0.5 ml)が用いられている。
5.3
試薬類 試験に用いる試薬類は,次による。
a) ドデシル硫酸ナトリウム (SDS) 溶液 (100 g/L)
b) 酢酸ナトリウム溶液 (3 mol/L)
c) グリコーゲン 生化学用グリコーゲン
d) 2-プロパノール JIS K 8839による。
e) エタノール (体積分率75 %) JIS K 8101による。
f)
dNTP混合溶液 デオキシリボヌクレオチド-3ʼ-三りん酸の混合物。
g) 塩化マグネシウム溶液 (25 mmol/L)
h) Taq DNAポリメラーゼ Taq DNAポリメラーゼ (1 unit/μl)
i)
アガロースゲル
j)
PCR用10倍緩衝液 その組成を表3に示す。表3の組成を混合し,塩酸でpH 8.0に調節する。これ
を高圧蒸気滅菌器で滅菌し,−20 ℃で保存する。PCR用緩衝液の塩類濃度が10倍濃いものをPCR
用10倍緩衝液とする。
表 3 PCR用10倍緩衝液の組成
トリス(ヒドロキシメチル)アミノメタン-HCl (pH8.4)
100 mmol/L
塩化カリウム
500 mmol/L
塩化マグネシウム
20 mmol/L
ゼラチン(日本薬局方)
0.1 g/L
k) 6倍色素液 電気泳動用サンプルと混合し,サンプルの比重を大きくするとともに泳動状況を把握す
るための混合液で,体積分率0.25 %ブロモフェノールブルー,体積分率0.25 %キシレンシアノールな
どの色素と体積分率40 %しょ糖とからなる。
l)
臭化エチジウム溶液 通常10 mg/mlを原液とし,約0.4 μg/mlで用いる。
m) サイズマーカ 100〜1 000 bpのDNAサイズの既知のもの。
5.4
試料からのDNA抽出
a) 試料1 mlにSDS溶液 (100 g/L) 100 μlを加え,激しく10回以上かき混ぜた後,5分間氷冷する。
b) 酢酸ナトリウム溶液 (3 mol/L) 0.5 mlを加え,緩やかに5回以上振り混ぜた後,30分間氷冷する。
c) 約12 000×gで10分間冷却遠心分離し,その上澄み液約1 mlを別の新しい遠心管に移す。
d) グリコーゲン20 mgに蒸留水1 mlを加えて溶かし,その5 μlと2-プロパノール1 mlとを加えて振り
混ぜた後,30分間氷冷する。
e) 約12 000×gで15分間遠心し,DNAを沈殿させる。
f)
DNAペレットをエタノール (体積分率75 %) 5 mlで3回洗浄する。
g) DNAペレットを風乾させた後,蒸留水10 μlに溶かし,分光光度計で260 nmにおける吸光を確認す
る。これをPCR用試料とする。
5.5
PCR反応
5.5.1
1回目PCRの操作 操作は,次による。
a) PCR用反応容器に滅菌した蒸留水50 μlを加える。
b) PCR用10倍緩衝液10 μlを加える。
c) dNTP混合溶液16 μlを加える。
4
K 3810-3:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) MCGpF1及びMCGpR1のプライマー[表1 (A) ]又はAF5及びAR6のプライマー[表1 (B) ]を各々
2 μlずつ加える。
e) 塩化マグネシウム溶液 (25 mmol/L) 8 μlを加える。
f)
Taq DNAポリメラーゼ溶液(1 unit/μl) 2 μlを加える。
g) 5.4. g) で調製したPCR用試料10 μlを加え,振り混ぜる。
h) サーマルサイクラを用いて,初めに94 ℃ 30秒間の加熱操作を行い,次に1サイクルを94 ℃ 30秒
間,55 ℃ 2分間及び,72 ℃ 2分間の条件で30サイクルを繰り返す。最後に72 ℃ 3分間の反応を行
う。
i)
反応終了後,このPCR反応液10 μlをとり,6倍色素液2 μlと混合し,1 %アガロースゲル電気泳動を
実施した後,臭化エチジウム溶液を加える。UVトランスイルミネータを用いて,DNAバンドを検出,
確認する。
5.5.2
2回目PCRの操作手順
a) PCR用反応容器に滅菌した蒸留水59 μlを加える。
b) PCR用10倍緩衝液10 μlを加える。
c) dNTP混合溶液16 μlを加える。
d) MCGpF2及びMCGpR2プライマー又はAF3及びAR5プライマーを各々2 μlずつ加える。
e) 塩化マグネシウム溶液 (25 mmol/L) 8 μlを加える。
f)
Taq DNAポリメラーゼ溶液(1 unit /μl) 2 μlを加える。
g) 1回目のPCR反応産物液1 μlを加える。
h) サーマルサイクラを用いて,初めに94 ℃ 30秒間の加熱操作を行い,次に1サイクルを94 ℃ 30秒
間,55 ℃ 2分間及び72 ℃ 3分間の条件で30サイクルを繰り返す。最後に72 ℃ 3分間の反応を行
う。
i)
反応終了後,このPCR反応液10 μlをとり,6倍色素液2 μlと混合し,1 %アガロースゲル電気泳動を
実施した後,臭化エチジウム溶液を加える。UVトランスイルミネーターを用いてDNAバンドを検出,
確認する。このとき,対照として同時にDNAのサイズマーカを並列して泳動し,サイズを確認する。
5.6
結果の判定
5.6.1
PCR反応生成物と,同時に電気泳動したサイズマーカーとを比較して,陽性,陰性又は不明確か
を判定する。バンドの検出が不明確の場合は,5.5.1及び5.5.2の操作を繰り返す。さらに,不明の場合は,
不明確と判定する。