K 3705:2008
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,財団法人バイオインダストリー協会(JBA)及
び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日
本工業標準調査会の審議を経て,経済産業大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に
抵触する可能性があることに注意を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許
権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に係る確認について,責任は
もたない。
K 3705:2008
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 1
3. 定義 ······························································································································ 2
4. 一般原則 ························································································································ 2
4.1 サルモネラ属菌の検出 ···································································································· 2
4.2 非選択培地による前増菌処理···························································································· 2
4.3 液体選択培地による増菌処理···························································································· 2
4.4 平板培養及び同定 ·········································································································· 2
4.5 同定の確認 ··················································································································· 2
5. 培地,試薬及び血清 ········································································································· 2
5.1 一般事項 ······················································································································ 2
5.2 培地及び試薬 ················································································································ 2
5.3 血清 ···························································································································· 3
6. 装置及びガラス器具 ········································································································· 3
6.1 乾熱滅菌器又は蒸気滅菌器······························································································· 3
6.2 乾燥キャビネット又は乾燥器···························································································· 3
6.3 細菌培養器 ··················································································································· 3
6.4 ウォーターバス ············································································································· 3
6.5 ウォーターバス ············································································································· 3
6.6 ウォーターバス ············································································································· 3
6.7 滅菌白金線 ··················································································································· 3
6.8 滅菌白金耳 ··················································································································· 3
6.9 滅菌ピペット ················································································································ 3
6.10 pHメータ ··················································································································· 3
6.11 試験管又はフラスコ ······································································································ 3
6.12 目盛り付きピペット(メスピペット)又は自動ピペット ······················································ 3
6.13 シャーレ ····················································································································· 3
7. サンプリング方法 ············································································································ 3
8. 試料の調製 ····················································································································· 4
9. 手順 ······························································································································ 4
9.1 試料及び試料懸濁液 ······································································································· 4
9.2 非選択前増菌 ················································································································ 4
9.3 選択増菌 ······················································································································ 4
9.4 平板培養及び同定 ·········································································································· 4
K 3705:2008 目次
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
9.5 確認 ···························································································································· 5
10. 試験結果の表現 ············································································································· 8
11. 試験報告書···················································································································· 8
12. 精度管理 ······················································································································ 8
附属書A(規定)手順の概略図 ······························································································· 9
附属書B(規定)培地・試薬の組成及び調製 ············································································· 10
附属書1(参考)JISと対応する国際規格との対比表 ·································································· 21
K 3705:2008
(4)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
白 紙
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 3705:2008
培地の試験方法−サルモネラ属菌用培地−
サルモネラ属菌の検出
Test methods for culture media-Culture medium for Salmonella spp.-
Detection of Salmonella spp.
序文 この規格は,2002年に第4版として発行されたISO 6579,Microbiology of food and animal feeding
stuffs−Horizontal method for the detection of Salmonella spp. 及びTECHNICAL CORRIGENDUM 1(2004)を翻
訳し,技術的内容を変更して作成した日本工業規格である。ただし,正誤表(TECHNICAL CORRIGENDUM)
については,編集し,一体化した。
なお,この規格で点線の下線を施してある箇所は,原国際規格を変更している事項である。変更の一覧
表をその説明を付けて,附属書1(参考)に示す。
1. 適用範囲 この規格は,サルモネラ属菌(Salmonella spp.)用培地を用いて,チフス菌(Salmonella
Typhimurium)及びパラチフス菌(Salmonella Paratyphimurium)を含むサルモネラ属菌を検出する方法につ
いて規定する。
この規格で用いる試料は,食品,動物用飼料及び食品を製造又は取り扱う現場の環境試料とする。
警告 試験担当者の健康を守るため,サルモネラ属菌,特にチフス菌及びパラチフス菌の検出試験は,
適切な設備が整っている検査室で試験方法に熟達した微生物学の専門家の管理下だけで行われ
ること,及び試験を実施する場合は,サルモネラ属菌に感染しないよう留意し,試験に伴って
調製されたあらゆる培養物の廃棄には細心の注意を払うことが重要である。この規格の方法で
は,すべてのチフス菌及びパラチフス菌を回収できない可能性がある。
備考 この規格の対応国際規格を,次に示す。
なお,対応の程度を表す記号は,ISO/IEC Guide 21に基づき,IDT(一致している),MOD
(修正している),NEQ(同等でない)とする。
ISO 6579:2002,Microbiology of food and animal feeding stuffs - Horizontal method for the detection of
Salmonella spp.及びTECHNICAL CORRIGENDUM 1(2004) (MOD)
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3701 培地の試験方法−通則
備考 ISO 7218:1996,Microbiology of food and animal feeding stuffs−General rules for microbiological
examinations及びAMENDMENT 1:2001からの引用事項は,この規格の該当事項と同等であ
る。
JIS K 8008 生化学試薬通則
2
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3. 定義 この規格で用いる主な用語の定義は,JIS K 8008によるほか,次による。
3.1
サルモネラ属菌(Salmonella spp.) この規格で規定する選択寒天培地上で定形又は非定形コロニー
を形成し,この規格に規定された所期の生化学的及び血清学的特性を示す微生物。
3.2
サルモネラ属菌の検出(detection of Salmonella spp.) この規格で規定する試験で,分取した一定量
の試料中に存在するサルモネラ属菌(3.1)の有無を判定すること。
3.3
精製水 JIS K 8008の3.2に規定するA2の水。
備考 これを超える精製度のものを使用することに関しては制限しない。滅菌水は,イオン交換水の
品質以上のものを乾熱滅菌若しくは蒸気滅菌又はフィルターでろ過し除菌したものとする。ま
た,市販の精製水を用いる場合は,この規格で規定する精製水と同等以上の品質のものとする。
4. 一般原則
4.1
サルモネラ属菌の検出 連続する4段階の操作を必要とする(附属書A参照)。
備考 サルモネラ属菌は菌数が少ない可能性があるうえに,他の腸内細菌科の菌又は他科の菌が同時
に多数存在することがよくある。さらに,少数のサルモネラ属菌又は損傷を受けたサルモネラ
属菌を検出するには事前に増菌処理が必要となる。
4.2
非選択培地による前増菌処理 室温下で緩衝ペプトン水に試料を接種し,37±1 ℃で18±2時間培養
する。一部の試料では,他の前増菌方法を用いる(9.1.2参照)。量が多い場合は,試料接種前に緩衝ペプ
トン水を37±1 ℃まで加温しておくのが望ましい。
4.3
液体選択培地による増菌処理 ラパポート・バシリアディス・ソーヤペプトン(Rappaport-Vassiliadis
with soya)培地(以下,RVSブロスという。)及びミュラー・カウフマン・テトラチオネート・ノボビオシ
ン(Muller-Kauffmann tetrathionate/novobiocin)培地(以下,MKTTnブロスという。)に,4.2で得られた培
養液を接種する。RVSブロスは41.5±1 ℃で24±3時間培養,MKTTnブロスは37±1 ℃で24±3時間培養
する。
4.4
平板培養及び同定 4.3で得られた培養液を,キシロース・リジン・デオキシコール酸塩(xylose lysine
deoxycholate)寒天培地(以下,XLD寒天培地という。)又はXLD寒天培地に相補的で,乳糖陽性のサル
モネラ属菌,チフス菌及びパラチフス菌株を分離するのに特に適した他の選択寒天培地(他の選択寒天培
地のうち,どの培地を選ぶかは,任意とする。)に接種する。
XLD寒天培地は37±1 ℃で培養し,24±3時間後に検査する。もう一方の選択寒天培地は,製造業者の
推奨する方法に従って培養する。
備考 ブリリアントグリーン寒天培地(BGA),亜硫酸ビスマス寒天培地などを一方の選択寒天培地
として使用してもよい。
4.5 同定の確認 サルモネラ属菌と推定されるコロニーを継代培養した後,4.4に従って平板培養を行い,
適切な生化学的・血清学的試験によって確認する。
5. 培地,試薬及び血清
5.1
一般事項 JIS K 3701による。
5.2
培地及び試薬 附属書Bによる。
5.2.1
非選択前増菌培地(緩衝ペプトン水) 附属書B.1による。
5.2.2
一次選択増菌培地(RVSブロス) 附属書B.2による。
5.2.3
二次選択増菌培地(MKTTnブロス) 附属書B.3による。
3
K 3705:2008
。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.2.4
選択寒天平板培地
5.2.4.1
第1培地(XLD寒天培地) 附属書B.4による。
5.2.4.2
第2培地 もう1種の適切な培地の選択は,各検査室の自由裁量にゆだねられる。使用するとき
の調製に関しては,製造業者の使用説明書に従う。
5.2.5
ニュートリエント寒天培地 附属書B.5による。
5.2.6
TSI(Triple Sugar / Iron)寒天培地 附属書B.6による。
5.2.7
クリステンセン尿素寒天培地 附属書B.7による。
5.2.8
L-リジン脱炭酸試験用培地 附属書B.8による。
5.2.9
β-ガラクトシダーゼ検出用試薬 附属書B.9による。
5.2.10 Voges-Proskauer(VP)反応用試薬 附属書B.10による。
5.2.11 インドール反応用試薬 附属書B.11による。
5.2.12 半流動栄養寒天培地 附属書B.12による。
5.2.13 生理食塩水 附属書B.13による。
5.3
血清 使用する抗血清が,サルモネラ属菌の全血清型の検出に適していることを確認する。
備考 単一又は複数のO群を含む抗血清(一価又は多価のO抗血清と呼ばれる。),Vi抗血清,単一
又は複数のH因子に対する抗体を含む抗血清(一価又は多価のH抗血清と呼ばれる。)がある。
6. 装置及びガラス器具 適切な仕様であれば,使い捨ての器具を再利用可能なガラス器具の代わりに使
用できる。通常の微生物検査用機器(JIS K 3701参照)及び次に挙げた機器を用いる。
6.1
乾熱滅菌器又は蒸気滅菌器 JIS K 3701参照。
6.2
乾燥キャビネット又は乾燥器 対流によって換気され,37〜55 ℃で操作できるもの。
6.3
細菌培養器 37±1 ℃で操作できるもの。
6.4
ウォーターバス 41.5±1 ℃で操作できるもの。
6.5
ウォーターバス 44〜47 ℃で操作できるもの。
6.6
ウォーターバス 37±1 ℃で操作できるもの。
サルモネラは,少ない菌量で感染するため,ウォーターバス(6.4,6.5及び6.6)には抗菌剤を入れて使
用するのがよい。
6.7
滅菌白金線 白金/イリジウム又はニッケル/クロム製のものを,火炎滅菌して用いる。プラスチ
ック製の使い捨てのものを用いてもよい。
6.8
滅菌白金耳 白金耳の直径が約3 mm又は容量が10 μLのもの。
6.9
滅菌ピペット 滅菌済みのもの。使い捨てのものを用いてもよい。
6.10 pHメータ 20〜25 ℃における校正精度が±0.1 pHのもの。
6.11 試験管又はフラスコ 適当な容量のもの。毒性がない金属製又はプラスチック製スクリューキャッ
プ付きの,瓶又はフラスコを使用してもよい。
6.12 目盛付きピペット(メスピペット)又は自動ピペット 容量が10 mL及び1 mLで,それぞれ0.5 mL,
0.1 mL単位で目盛られているもの。
6.13 シャーレ 小形(直径90〜100 mm)及び/又は大形(直径140 mm)のもの。
7. サンプリング方法 個別の規格による。
備考 検査対象を真に代表する試料が,輸送中又は保存中に,損傷又は変質を来すことなく,検査室
4
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
に届けられることが重要である。個別の規格がない場合には,受渡当事者間の協定による。
8. 試料の調製 個別の規格による。
備考 個別の規格がない場合には,受渡当事者間の協定による。
9. 手順(附属書A参照)
9.1
試料及び試料懸濁液
9.1.1
一般事項 JIS K 3701参照。試料懸濁液の調製には,一般に,希釈液として5.2.1及び4.2に規定
する前増菌培地(緩衝ペプトン水)を使用する。試料の規定量が25 g以外であれば,10倍希釈とするのに
必要な量の前増菌培地を使用する。
9.1.2
特定試料の試料懸濁液の調製法(サルモネラ属菌の試験にだけ関係するもの)
9.1.2.1
ココア及びココア含有試料(20 %を超えるものなど) 試料がグラム陽性細菌そう(叢)に高
度に汚染されている可能性がある場合は,緩衝ペプトン水(5.2.1)に,50 g/Lのカゼイン(酸カゼインは
使用しない。)又は100 g/Lの滅菌脱脂粉乳を添加し,2時間培養後,0.018 g/Lのブリリアントグリーン
(Brilliant Green。抗菌剤。CAS番号633-03-4)を添加する。
9.1.2.2
酸性試料 前増菌中にpHが4.5未満とならないようにする。
備考 2倍濃度の緩衝ペプトン水を用いれば,試料のpHが安定する。
9.2
非選択前増菌 試料懸濁液(9.1)を37±1 ℃で18±2時間培養する。
9.3
選択増菌
9.3.1
RVSブロス(5.2.2)10 mLの入った試験管に,9.2で得られた培養液0.1 mLを移し入れる。MKTTn
ブロス(5.2.3)10 mLの入った試験管には,9.2で得られた培養液1 mLを移し入れる。
9.3.2
接種済みのRVSブロス(9.3.1)は,41.5±1 ℃で24±3時間培養する。MKTTnブロスの場合は,
37±1 ℃で24±3時間培養する。培養温度として許容されている最高温度(42.5 ℃)を超えてはならない。
9.4
平板培養及び同定
9.4.1
24±3時間培養後,RVSブロスで得られた培養液(9.3.2)を滅菌白金耳(6.8)で大形シャーレ(6.13)
内の第1選択平板培地(XLD寒天培地,5.2.4.1参照)上に塗抹し,よく分離したコロニーを形成させる。
大形のシャーレがない場合は小形シャーレ2枚を用い,同じ滅菌白金耳で連続して塗抹する。第2選択平
板培地(5.2.4.2)にも,滅菌白金耳とシャーレとを用いて同様に接種する。
9.4.2
24±3時間培養後,MKTTnブロスで得られた培養液(9.3.2)についても2種類の選択平板培地を
用いて9.4.1に規定する手順を繰り返す。
9.4.3
シャーレ(9.4.1及び9.4.2)を底が上になるように裏返して,第1選択平板培地(5.2.4.1)の場合
は,37 ℃に設定した細菌培養器(6.3)内に置く。第2選択平板培地(5.2.4.2)の場合は,製造業者の使
用説明書に従う。
9.4.4
24±3時間培養後,サルモネラ属菌の定形コロニー及びサルモネラ属菌の可能性がある非定形コロ
ニーの有無について各平板(9.4.3)を調べる。シャーレの底面に,その位置の印を付ける。XLD寒天培地
上に発育するサルモネラ属菌の定形コロニーは,中心部が黒色を呈し,指示薬(フェノールレッド。CAS
番号143-74-8)の変色によって赤みを帯びたやや透明な帯をもつ。
備考 XLD寒天培地上に発育する硫化水素(H2S)陰性のサルモネラ変異株[パラチフスA菌
(Salmonella Paratyphimurium A)など]は,中心部が暗いピンク色を呈するピンク色のコロニ
ーとなる。XLD寒天培地上に発育する乳糖陽性のサルモネラ属菌は,黒変の有無にかかわらず
5
K 3705:2008
。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
黄色のコロニーとなる。
第2選択平板培地は,適切な温度で培養し,適切な培養時間を経た後に,その特徴からサルモネラ属菌
と推定されるコロニーの有無を調べる。
9.5
確認
9.5.1
一般事項 信頼性があることが示されれば,サルモネラ属菌の生化学的試験用として市販されてい
る同定キットを使用できる。製造業者の取扱説明書に厳密に従う。
備考 サルモネラ属菌のコロニーの識別は,経験によるところが大きい。サルモネラ属菌のコロニー
の外観は,血清型だけでなく,使用した選択培地のバッチごとにも多少変化する可能性がある。
9.5.2
確認試験用のコロニーの選択 確認試験のため,各選択培地(9.4)(小形の平板2枚又は大形の平
板1枚)についてそれぞれの平板から,定形コロニーと考えられるコロニー又は疑わしいコロニーを少な
くとも1個釣菌する。最初のコロニーが陰性であれば,更に4個のコロニーを釣菌する。疫学的研究の場
合は,5個以上のコロニーを同定試験に供するのが望ましい。1平板上の定形コロニー又は疑わしいコロニ
ーの数が5個未満である場合は,その定形コロニー又は疑わしいコロニーすべてを確認試験用として釣菌
する。選択したコロニーを,あらかじめ乾燥させておいた栄養寒天培地(5.2.5)上に,よく分離したコロ
ニーが形成されるような方法で画線塗沫する。接種したこの培地は,9.4.3によって37±1 ℃で24±3時間
培養する。生化学的及び血清学的確認試験には,純培養菌を使用する。
9.5.3
生化学的確認試験
9.5.3.1
一般事項 滅菌白金線(6.7)を用いて,9.5.2で選択したコロニーを釣菌し培養したそれぞれの
培地を9.5.3.2〜9.5.3.7に規定する培地に接種する。
9.5.3.2
TSI寒天培地(5.2.6) 培地の斜面部には画線し,高層部にはせん(穿)刺する。37±1 ℃で24
±3時間培養する。培地の変化は,次のように判定する。
a) 高層部
黄色 :ブドウ糖(グルコース)陽性(ブドウ糖資化性あり。)
赤色又は不変:ブドウ糖(グルコース)陰性(ブドウ糖資化性なし。)
黒色 :硫化水素産生
気泡又はき裂:ブドウ糖からガス産生
b) 斜面部
黄色 :乳糖及び/又は白糖(スクロース)陽性(乳糖及び/又は白糖資化性あり。)
赤色又は不変:乳糖及び白糖陰性(乳糖・白糖いずれの資化性もなし。)
定形なサルモネラ属菌の培養では,斜面部がアルカリ性(赤色)を示し,高層部が酸性(黄色)を示す。
さらに,高層部では,ガスの産生(気泡が発生する。)及び約90 %の例で硫化水素産生(培地が黒変
する。)が認められる(9.5.3.8)。乳糖陽性のサルモネラ属菌が分離される場合(4.4)は,TSI培地の
斜面部が黄変する。したがって,サルモネラ属菌の予備確認では,TSI寒天培地による試験結果だけ
で判定してはならない(9.5.3)。
9.5.3.3
クリステンセン尿素寒天培地(5.2.7) 培地斜面に画線後,37±1 ℃で24±3時間培養し,間隔
をおいて調べる。陽性の場合は,尿素が分解されてアンモニアが遊離し,フェノールレッドが淡紅色から
後には濃紅色へと変色する。この反応は2〜4時間後に生じることが多い。
9.5.3.4
L-リジン脱炭酸試験用培地(5.2.8) 液体培地表面のすぐ下に接種し,37±1 ℃で24±3時間培
養する。培養後,混濁及び紫色を呈した場合は,陽性と判定する。黄色を呈した場合は,陰性とする。
6
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.5.3.5
β-ガラクトシダーゼの検出(5.2.9) 疑わしいコロニーから1白金耳量をとり,生理食塩水
(5.2.13)0.25 mLの入った試験管内で懸濁する。トルエン1滴を加え,試験管をよく振とう(盪)する。
37 ℃に設定したウォーターバス(6.6)に試験管を入れ,約5分間放置する。β -ガラクトシダーゼ検出用
の試薬を0.25 mL加えて混和する。37 ℃に設定したウォーターバスに試験管を再び入れて24±3時間放置
し,その間,試験管を間隔をおいて調べる。黄色を呈した場合は,陽性とする。
備考 この反応は,20分後に生じることが多い。調製済みのペーパー・ディスク(5.2.9)を使用する
場合は,製造業者の取扱説明書に厳密に従う。
9.5.3.6
VP(Voges-Proskauer)反応用培地(5.2.10) 疑わしいコロニーから1白金耳量をとり,VP培
地3 mLの入った滅菌試験管内で懸濁する。37±1 ℃で24±3時間培養する。培養後,クレアチン溶液2
滴,1-ナフトール・エタノール溶液3滴及び水酸化カリウム溶液2滴を加える。このとき,各試薬を加え
るごとに混和する。15分以内にピンクから明赤色の呈色が確認された場合は,陽性とする。
9.5.3.7
インドール反応用培地(5.2.11) トリプトン・トリプトファン培地5 mLの入った試験管に,疑
わしいコロニーを接種する。37±1 ℃で24±3時間培養する。培養後,コバック(Kovacs)試薬1 mLを
加える。赤色の環が形成された場合は陽性,黄褐色の環が認められた場合は,陰性とする。
備考 コバック(Kovacs)試薬の他に市販のインドール試薬も利用可能である。
9.5.3.8
生化学的試験の判定 サルモネラ属菌では,一般に,表1に示す反応が認められる。

7
K 3705:2008
。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表 1 生化学的試験の判定
試験(1)(9.5.3.2〜
9.5.3.7)
サルモネラ属菌株
チフス菌
パラチフス
A菌
パラチフス
B菌
パラチフス
C菌
他の菌株
反
応
%
(2)
反応
%
(2)
反応
%
(3)
反応
%
(3)
反応
%
(2)
TSI:ブドウ糖から酸産生
+
100
+
100
+
+
+
100
TSI:ブドウ糖からガス産
生
−
0
+
100
+
+
+
92
TSI:乳糖から酸産生
−
(4)
2
+
100
−
−
−
1
TSI:白糖から酸産生
−
0
−
0
−
−
−
1
TSI:硫化水素産生
+
97
−
10
+
+
+
92
尿素加水分解
−
0
−
0
−
−
−
1
リジン脱炭酸
+
98
−
0
+
+
+
95
β -ガラクトシダーゼ反応
−
0
−
0
−
−
−
2
(5)
VP(Voges-Proskauer)反応
−
0
−
0
−
−
−
0
インドール産生
−
0
−
0
−
−
−
1
注(1) 参考文献[5]参照
(2) これらの割合は,分離されたサルモネラ血清型のすべてが+又は−の反応を示すとは限らな
いことを示唆している。また,様々な場所から分離された食中毒の原因となる血清型は,こ
れらの割合が各血清型間及び血清型内で異なる可能性がある。
(3) この割合は,入手可能な文献からは不明である。
(4) チフス菌はガス非産生性である。
(5) Salmonella entericaの亜種arizonaeは,乳糖陽性又は乳糖陰性であるが,β -ガラクトシダーゼ
反応は常に陽性である。これらの菌株の場合は,補足的な試験を実施する。
9.5.4
血清学的確認試験及び血清型別
9.5.4.1
一般事項 サルモネラO,Vi,H抗原の有無は,適切な血清を用いたスライド凝集試験によって
確認する。試験には純培養のコロニー(9.5.2)を使用し,自己凝集性株は事前に取り除く。
9.5.4.2,9.5.4.3,9.5.4.4及び9.5.4.5の規定と製造業者の取扱説明書とが異なる場合には,製造業者の取扱
説明書に従って抗血清を使用する。
9.5.4.2
自己凝集性株の除去 生理食塩水(5.2.13)1滴を,入念に洗浄したスライドグラス上に滴下する。
滅菌白金耳(6.8)を用いて,試験に供するコロニーの一部をその1滴中に懸濁し,均一な混濁液を得る。
備考 試験に供するコロニーを精製水1滴中に懸濁し,これを生理食塩水(5.2.13)1滴と混和しても
よい。
スライドグラスを30〜60秒間静かに揺り動かす。背景を暗くして結果を観察する。拡大鏡を利用するの
が望ましい。多少なりともはっきりとした細菌の凝集塊が認められた場合,その菌株は自己凝集性とみな
し,抗原の検出ができないため,次に示す試験に供してはならない。
9.5.4.3
O抗原の試験 非自己凝集性の純培養コロニー1個を使用し,9.5.4.2に準じて試験を実施する。
そのとき,生理食塩水(5.2.13)の代わりにO抗血清(5.3)1滴を使用する。凝集が生じた場合は,陽性
反応とみなす。多価及び一価の血清を交互に使用する。
9.5.4.4
Vi抗原の試験 9.5.4.2に準じて試験を実施するが,生理食塩水の代わりにVi抗血清(5.3)1滴
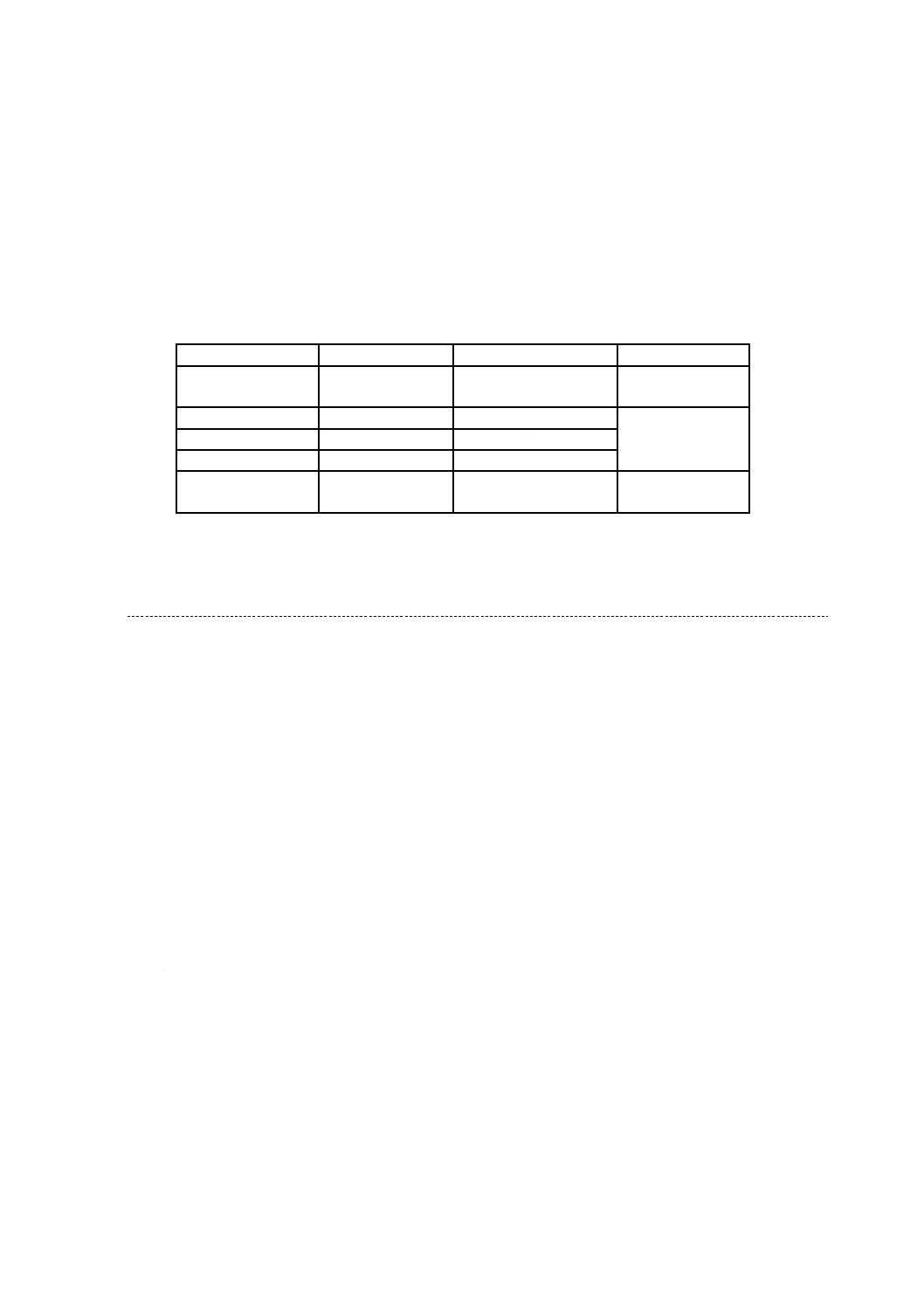
8
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
を使用する。凝集が生じた場合は,陽性反応とみなす。
9.5.4.5
H抗原の試験 半流動ニュートリエント寒天培地(5.2.12)に非自己凝集性の純培養コロニーを
接種し,37±1 ℃で24±3時間培養する。この培養菌をH抗原の試験に使用する。9.5.4.2に準じて試験を
実施するが,生理食塩水の代わりにH抗血清(5.3)1滴を使用する。凝集が生じた場合は,陽性反応とみ
なす。
9.5.5
生化学的及び血清学的反応の判定 9.5.2のコロニーを使用する試験(9.5.3及び9.5.4)結果の判定
は,表2による。
表 2 確認試験の判定
生化学的反応
自己凝集性
血清学的反応
判定
定形
なし
O,Vi又はH抗原陽性
サルモネラ属菌と
する。
定形
なし
すべての反応が陰性
サルモネラ属菌の
可能性がある。
定形
あり
試験せず(9.5.4.2参照)
定形反応なし
なし又はあり
O,Vi又はH抗原陽性
定形反応なし
なし又はあり
すべての反応が陰性
サルモネラ属菌と
しない。
9.5.6
最終確認 試験(9.5.3及び9.5.4)の結果,サルモネラ属菌と判定されたとき,並びにサルモネラ
属菌である可能性(表2参照)があるときは,サルモネラ菌の認定機関に送付して形別を明らかにする。
備考 最終的な形別が不明の場合は,国立感染症研究所細菌第一部がその確認を引き受けている。問
い合わせにおいては,その菌株に関して考えられる全情報(経路不明,突発的,食品由来など)
を添付する。
10. 試験結果の表現 判定結果に従って,製品試料x g又はx mL中のサルモネラ属菌の有無を表示する
(JIS K 3701参照)。
11. 試験報告書 試験報告書には,次の事項を明記する。
a) 使用した試験試料の採取方法(判明している場合)
b) 使用した増菌培地又は培養条件における逸脱事項
c) この規格で規定していないあらゆる操作条件又は任意としたあらゆる操作についての詳細、及び試験
結果に影響を及ぼす可能性のある全事象についての詳細
d) 得られた試験結果
この規格で規定していない平板培地(5.2.4)を用いたときは,陽性結果が得られたかどうかについて
も記載する。
12. 精度管理 この規格で規定する方法及び培地を使用したときの検査室におけるサルモネラ属菌の検出
能力を確認するため,前増菌培地(5.2.1参照)のコントロール(精度管理用)フラスコに標準試料を添加
し,試験菌株と同様に処理する。
9
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
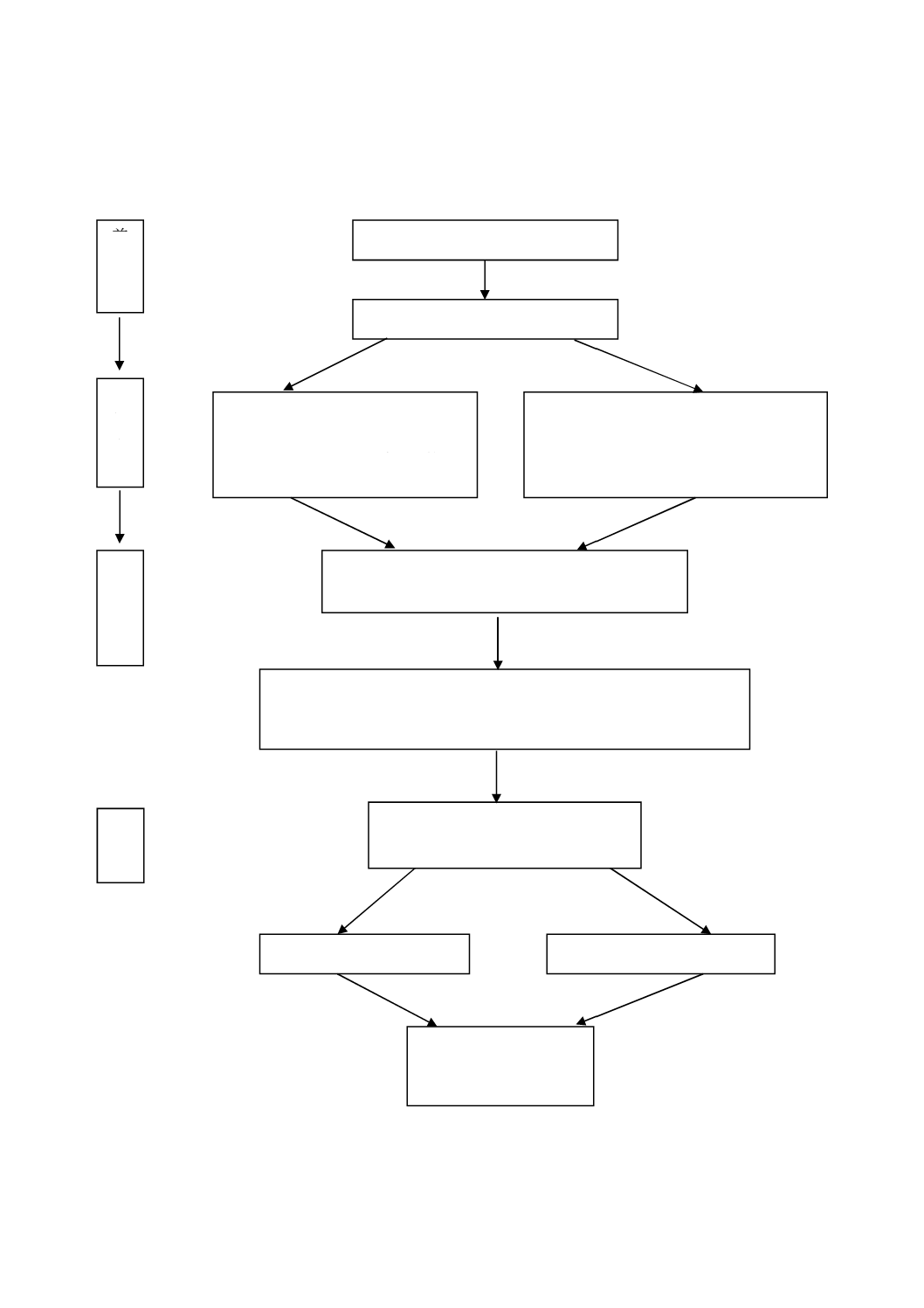
附属書A(規定)手順の概略図
前
増
菌
緩衝ペプトン水,室温
培養液0.1 mL+RVSブロス10 mL
(9.3.1)
41.5±1 ℃,24±3時間培養
培養液 1 mL+MKTTnブロス10 mL
(9.3.1)
37±1 ℃,24±3時間培養
XLD培地及び最適な第2寒天培地(9.4.1)
37±1 ℃,24±3時間培養
各平板から典型的コロニー1個を試験する。
陰性であれば,印を付けた他のコロニー4個を試験する(9.5.2)。
ニュートリエント寒天培地(9.5.2)
37±1 ℃,24±3時間培養
生化学的確認試験(9.5.3)
血清学的確認試験(9.5.4)
試験結果の表示(10.)
選
択
増
菌
平
板
培
養
37±1 ℃,18±2時間培養(9.2)
確
認

10
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(規定)培地・試薬の組成及び調製
B.1 緩衝ペプトン水
B.1.1 組成 組成は,附属書B表1による。
附属書B表1 緩衝ペプトン水の組成
カゼインの酵素消化物
10.0 g
塩化ナトリウム
5.0 g
りん酸水素二ナトリウム12水和物(Na2HPO4・12H2O)
9.0 g
りん酸二水素カリウム(KH2PO4)
1.5 g
精製水
1 000 mL
B.1.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。さらに,pHを調整し,滅菌
後のpHを25 ℃で7.0±0.2とする。適当な容量のフラスコ(6.11)に,試験に必要な分量となるよう培地
を分注する(9.1参照)。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
B.2 ラパポート・バシリアディス・ソーヤペプトン培地(RVSブロス)
B.2.1 溶液A
B.2.1.1 組成 組成は,附属書B表2による。
附属書B表2 RVSブロスの組成
大豆の酵素消化物
5.0 g
塩化ナトリウム
8.0 g
りん酸二水素カリウム(KH2PO4)
1.4 g
りん酸水素二カリウム(K2HPO4)
0.2 g
精製水
1 000 mL
B.2.1.2 調製 各成分を精製水に溶解する。必要であれば約70 ℃まで加熱して溶解する。この溶液は,
RVS完全培地を調製する日に調製しなければならない。
B.2.2 溶液B
B.2.2.1 組成 組成は,附属書B表3による。
附属書B表3 溶液Bの組成
塩化マグネシウム六水和物(MgCl2・6H2O)
400.0 g
精製水
1 000 mL
B.2.2.2 調製 塩化マグネシウムを精製水に溶解する。塩化マグネシウムは吸湿性が非常に高いので,新
たに開けた容器内のMgCl2・6H2O全量を処方に従って溶解するのが望ましい。例えば,MgCl2・6H2O 250 g
を精製水625 mLに加え,溶液の総体積が788 mL,MgCl2・6H2Oの質量濃度が約31.7 g/100 mLとする。こ
の溶液は,濃色の密栓ガラス瓶に室温で少なくとも2年間保存できる。
B.2.3 溶液C
B.2.3.1 溶液C 組成は,附属書B表4による。
11
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表4 溶液Cの組成
マラカイトグリーンシュウ酸塩
0.4 g
精製水
100 mL
B.2.3.2 調製 マラカイトグリーンシュウ酸塩を精製水に溶解する。この溶液は,褐色のガラス瓶に室温
で少なくとも8か月間保存できる。
B.2.4 完全培地
B.2.4.1 組成 組成は,附属書B表5による。
附属書B表5 完全培地の組成
溶液A(B.2.1)
1 000 mL
溶液B(B.2.2)
100 mL
溶液C(B.2.3)
10 mL
B.2.4.2 調製 溶液A (B.2.1)1 000 mLに溶液B(B.2.2) 100 mL及び溶液C (B.2.3)10 mLを加える。
必要であればpHを調整し,滅菌後のpHが5.2±0.2となるようにする。使用前に,試験管(6.11)に10 mL
ずつ分注する。115 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。調製した培地は
3±2 ℃で保存する。培地は,調製日に使用する。
備考 最終的な培地組成は,次による。
大豆の酵素消化物4.5 g/L,塩化ナトリウム7.2 g/L,りん酸二水素カリウム(KH2PO4+K2HPO4)
1.44 g/L,無水塩化マグネシウム(MgCl2)13.4 g/L又は塩化マグネシウム六水和物(MgCl2・6H2O)
28.6 g/L,及びマラカイトグリーンシュウ酸塩0.036 g/L
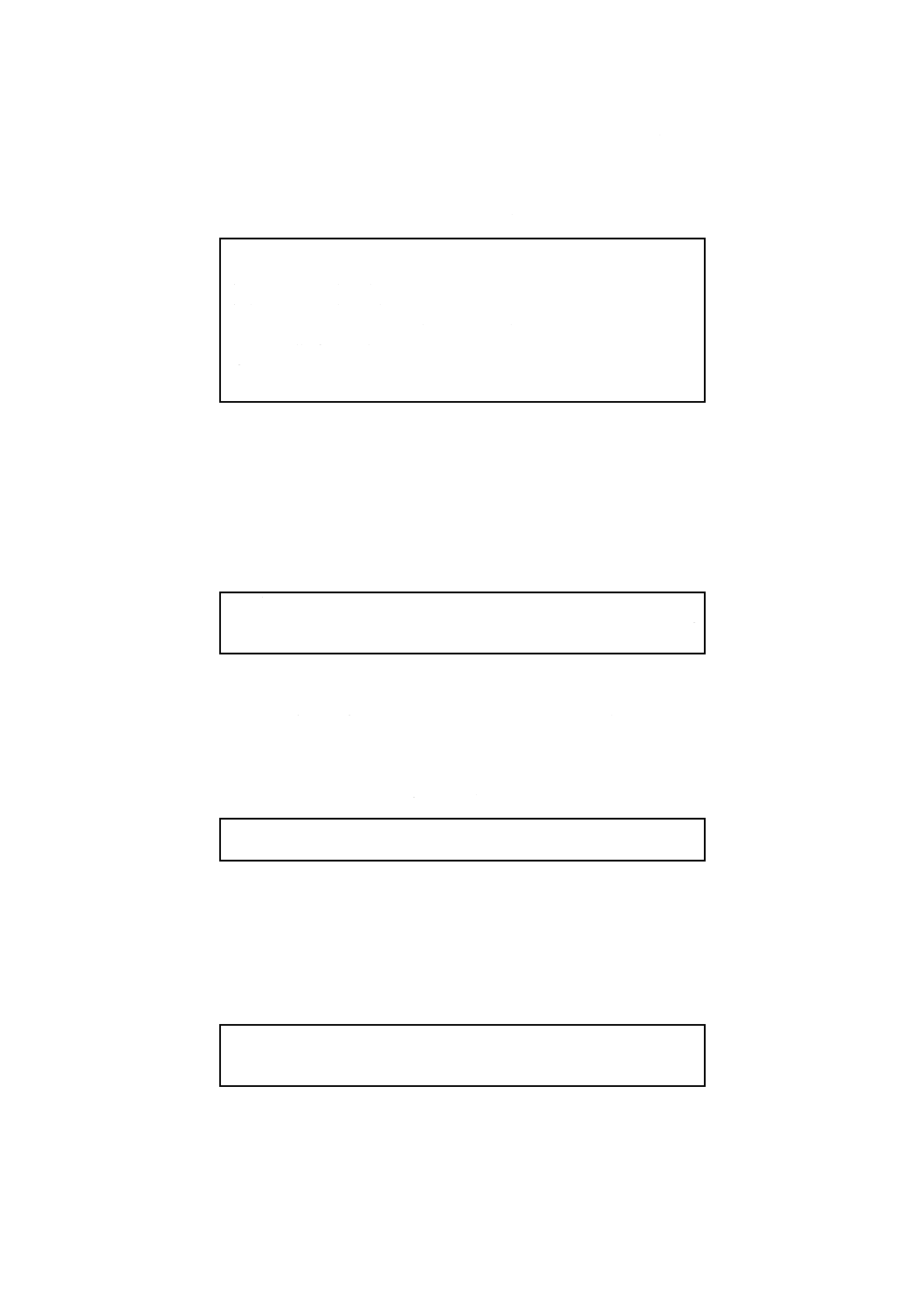
B.2.5 培地の品質保証のための性能 RVSブロスの性能基準を,附属書B表6に示す。
附属書B表6 MKTTnブロスの性能基準
機能
培養
品質管理用菌株
品質
管理
方法
基準及びコロニー
の特徴
培養
能
37 ℃,
24時間
ネズミチフス菌(Salmonella Typhimurium)
ATCC 14028,ゲルトネル菌(Salmonella
Enteritidis)ATCC 13076+競合菌株(大腸菌
(Escherichia coli)ATCC 8739若しくは
25922+Pseudmonas aeruginosa ATCC
27853),又は他の菌株保存機関に登録され
ている同じ菌株
半定
量法
XLD寒天培地又は
用いた他の選択培
地上のコロニー数
が10個を超える。
定形的なコロニー
の特徴は用いた選
択培地によって異
なるので留意する。
選択
性
37 ℃,
24時間
大腸菌ATCC 25922若しくは8739,又は菌
株保存機関に登録されている同じ菌株
半定
量法
トリプトソーヤ寒
天培地上に塗抹後,
発育しない。
腸球菌(Enterococcus faecalis)ATCC29212
若しくは19433,又は菌株保存機関に登録さ
れている同じ菌株
半定
量法
トリプトソーヤ寒
天培地上に塗抹後,
生育するコロニー
数が10未満である
こと。
備考 培養能(productivity)及び選択性(selectivity)の定義については,ISO/TS 11133-2参照。これら
の菌株は理化学研究所生物基盤研究部微生物系統保存施設,独立行政法人製品評価技術基盤機構
生物遺伝資源部門などから購入可能である。
12
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.3 ミュラー・カウフマン・テトラチオネート・ノボビオシン培地(MKTTnブロス)(参考文献[7])
B.3.1 基礎培地
B.3.1.1 組成 組成は,附属書B表7による。
附属書B表7 MKTTnブロスの組成
肉エキス
4.3 g
カゼインの酵素消化物
8.6 g
塩化ナトリウム(NaCl)
2.6 g
炭酸カルシウム(CaCO3)
38.7 g
チオ硫酸ナトリウム五水和物(Na2S2O3・5H2O)
47.8 g
ウシ胆汁(細菌検査用)
4.78 g
ブリリアントグリーン
9.6 mg
精製水
1 000 mL
B.3.1.2 調製 乾燥させた各基礎成分又は粉末培地を精製水に5分間煮沸溶解する。必要であればpHを
調整し,25 ℃で8.0±0.2となるようにする。培地を十分に混和する。基礎培地は,3±2 ℃で4週間保存
できる。
B.3.2 よう素・よう化物溶液
B.3.2.1 組成 組成は,附属書B表8による。
附属書B表8 よう素・よう化物溶液の組成
よう素
20.0 g
よう化カリウム(KI)
25.0 g
精製水
100 mL
B.3.2.2 調製 よう化カリウムを精製水10 mLに完全に溶解した後,よう素を加え,滅菌水で希釈して100
mLとする。加熱しない。調製した溶液は,室温・暗所で気密容器内に保存する。
B.3.3 ノボビオシン溶液
B.3.3.1 組成 組成は,附属書B表9による。
附属書B表 1 ノボビオシン溶液の組成
ノボビオシンナトリウム塩
0.04 g
精製水
5 mL
B.3.3.2 調製 ノボビオシンナトリウム塩を精製水に溶解し,ろ過し,除菌する。3±2 ℃で保存する。保
存期間は,4週間以内とする。
B.3.4 完全培地
B.3.4.1 組成 組成は,附属書B表10による。
附属書B表10 完全培地の組成
基礎培地(B.3.1)
1 000 mL
よう素・よう化物溶液(B.3.2)
20 mL
ノボビオシン溶液(B.3.3)
5 mL
B.3.4.2 調製 ノボビオシン溶液(B.3.3)5 mLを基礎培地(B.3.1)1 000 mLに無菌的に加える。混和し
た後,よう素・よう化物溶液(B.3.2)20 mLを加え,よく混和する。適当な容量の滅菌フラスコ(6.11)
13
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
に,試験に必要な分量となるよう培地を無菌的に分注する。完全培地は,調製日に使用する。
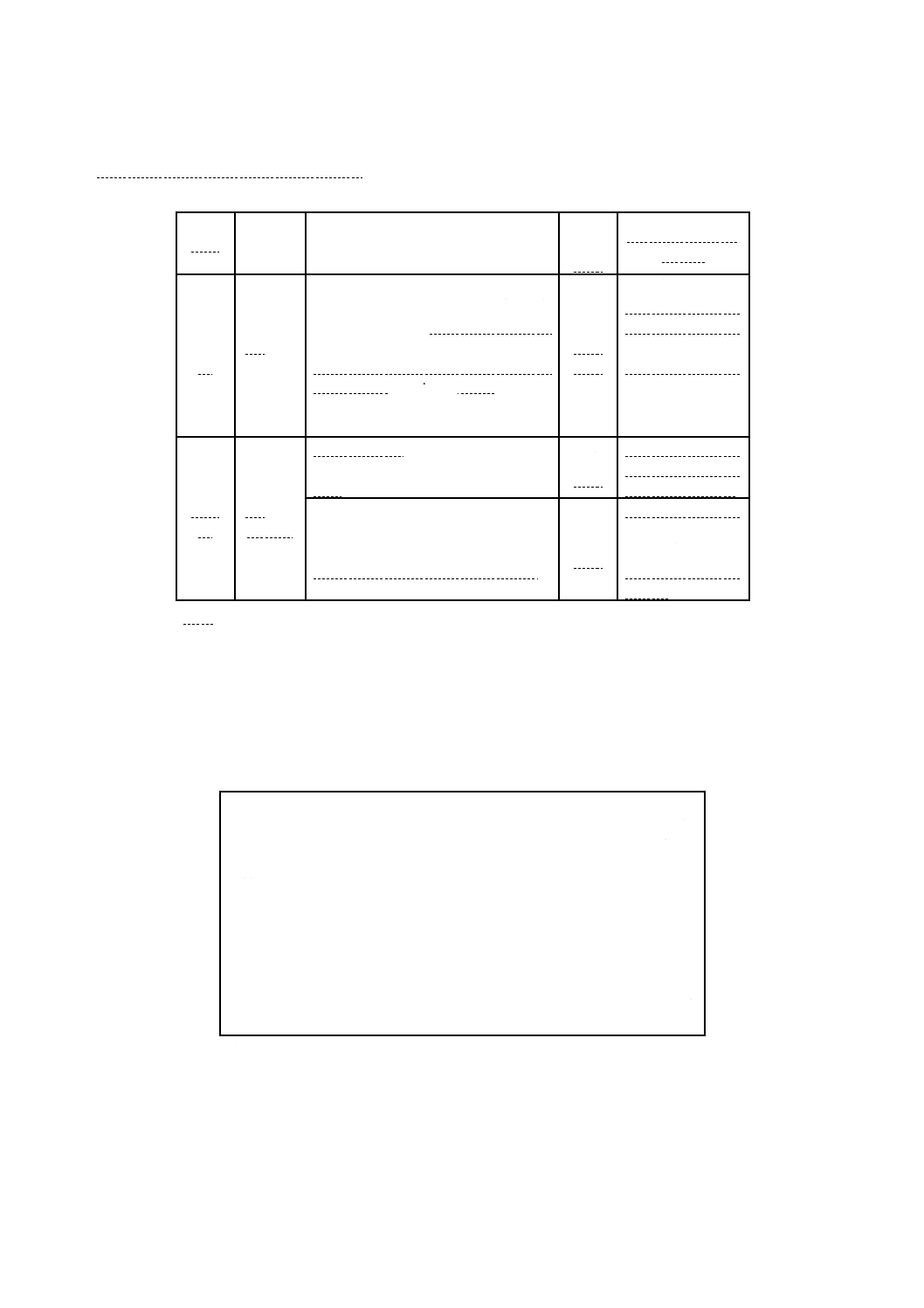
B.3.5 培地の品質保証のための性能 MKTTnブロスの性能基準を,附属書B表11に示す。
附属書B表11 MKTTnブロスの性能基準
機能
培養
品質管理用菌株
品質
管理
方法
基準及びコロニー
の特徴
培養
能
37 ℃,
24時間
ネズミチフス菌(Salmonella
Typhimurium)ATCC 14028,ゲルトネ
ル菌(Salmonella Enteritidis)ATCC
13076+競合菌株(大腸菌(Escherichia
coli)ATCC 8739若しくは25922+
Pseudmonas aeruginosa ATCC 27853),
又は他の菌株保存機関に登録されてい
る同じ菌株
半定
量法
XLD寒天培地又は
用いた他の選択培
地上のコロニー数
が10個を超える。
定形的なコロニー
の特徴は用いた選
択培地によって異
なる。
選択
性
37 ℃,
24時間
大腸菌ATCC 25922若しくは8739,又
は菌株保存機関に登録されている同じ
菌株
半定
量法
トリプトソーヤ寒
天培地上に塗抹
後,発育しない。
腸球菌(Enterococcus faecalis)
ATCC29212若しくは19433,又は菌株
保存機関に登録されている同じ菌株
半定
量法
トリプトソーヤ寒
天培地上に塗抹
後,生育するコロ
ニー数は10未満と
する。
備考 これらの菌株は,理化学研究所生物基盤研究部微生物系統保存施設,独立行政法人
製品評価技術基盤機構生物遺伝資源部門などから購入可能である。
B.4 キシロース・リジン・デオキシコール酸塩寒天培地(XLD寒天培地)(参考文献[7])
B.4.1 基礎培地
B.4.1.1 組成 組成は,附属書B表12による。
附属書B表12 基礎培地の組成
酵母エキス粉末
3.0 g
塩化ナトリウム(NaCl)
5.0 g
キシロース
3.75 g
乳糖(ラクトース)
7.5 g
白糖(スクロース)
7.5 g
L-リジン塩酸塩
5.0 g
チオ硫酸ナトリウム
6.8 g
くえん酸鉄(III)アンモニウム
0.8 g
フェノールレッド
0.08 g
デオキシコール酸ナトリウム
1.0 g
寒天
9〜18 g (1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
B.4.1.2 調製 乾燥させた各基礎成分又は粉末培地を精製水に加温溶解する。培地が沸騰し始めるまで頻
繁にかくはんしながら加熱するが,過度の加熱は避ける。必要であればpHを調整し,滅菌後のpHは25 ℃
で7.4±0.2とする。適当な容量の試験管又はフラスコ(6.11)に培地を注ぎ入れる。培地が沸騰し,寒天
14
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
が溶解するまで,頻繁にかくはんしながら加熱する。過度に加熱しないようにする。
B.4.2 寒天平板の作製 すぐに44〜47 ℃のウォーターバス(6.5)中に移し,かくはんしてシャーレに注
ぎ,平板に固める。使用直前に,寒天平板の表面が乾燥するまで,37〜55 ℃に設定した乾燥キャビネット
又は乾燥器(6.2)内で寒天平板を慎重に乾燥させる(できればふたを外して寒天平板表面を下に向ける。)。
作製した平板は,3±2 ℃で保存する。保存期間は,5日間以内とする。
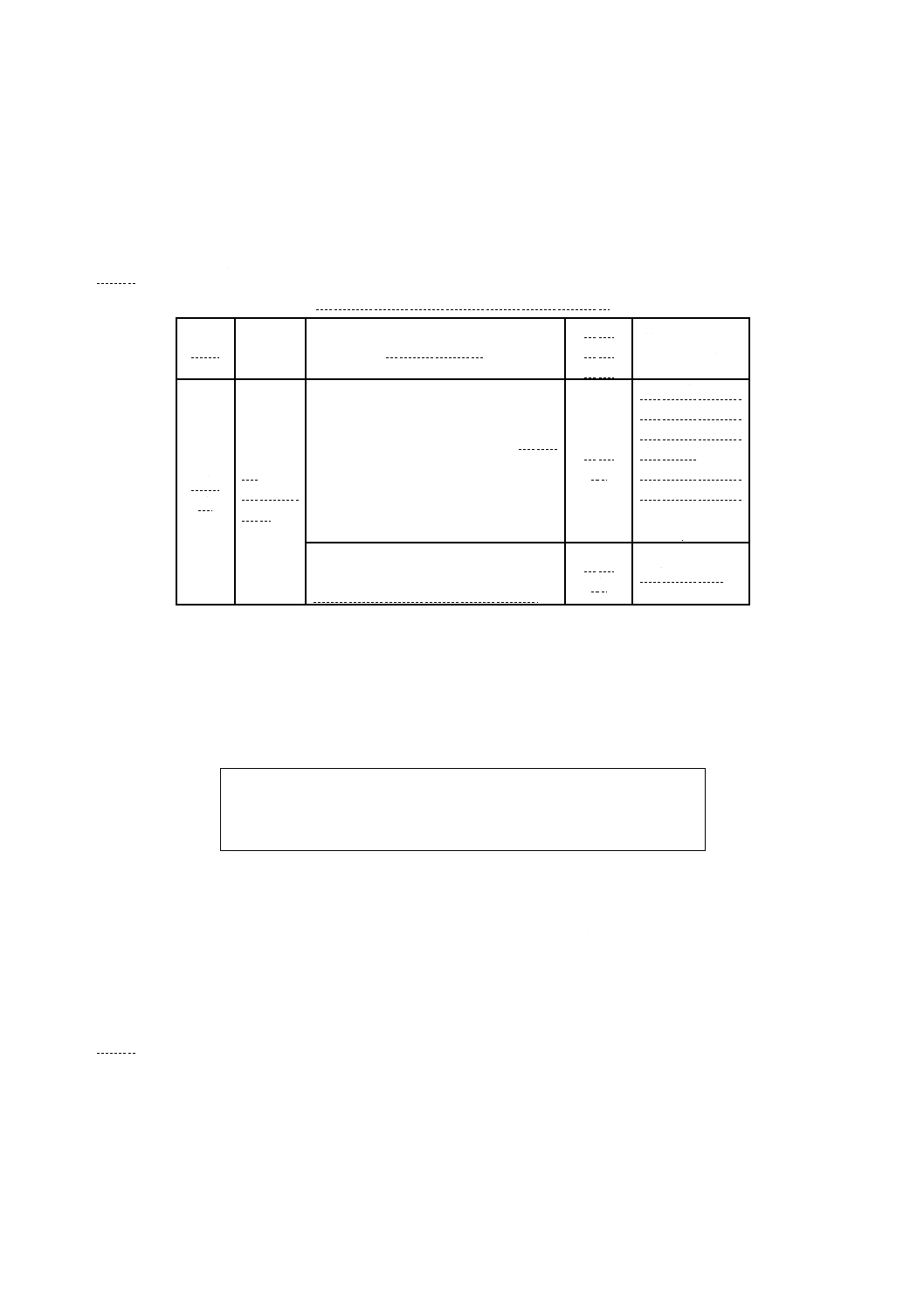
B.4.3 培地の品質保証のための性能 XLD寒天培地の性能基準を,附属書B表13に示す。
附属書B表13 XLD寒天培地の性能基準
機能
培養
品質管理用菌株
品質
管理
方法
基準及びコロニ
ーの特徴
選択
性
37 ℃,
24〜48
時間
大腸菌(Escherichia coli)ATCC 25922
若しくは8739,又は菌株保存機関に登
録されている同じ菌株
定量
法
サルモネラ属菌
の定形的なコロ
ニーが出現しな
いこと。
品質管理用菌株
が生育しない
か,生育が弱い
こと。
腸球菌(Enterococcus faecalis)
ATCC29212若しくは19433,又は菌株
保存機関に登録されている同じ菌株
定量
法
生育しない。
備考 これらの菌株は理化学研究所生物基盤研究部微生物系統保存施設,独立行政法人製
品評価技術基盤機構生物遺伝資源部門などから購入可能である。
B.5 ニュートリエント寒天培地
B.5.1 組成 組成は,附属書B表14による。
附属書B表14 栄養寒天培地の組成
肉エキス
3.0 g
ペプトン
5.0 g
寒天
9〜18 g(1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
B.5.2 調製 各成分又は粉末培地を精製水に溶解する。必要であれば加熱して溶解する。必要であればpH
を調整し,滅菌後のpHは25 ℃で7.0±0.2とする。適当な容量の試験管又は瓶(6.11)に培地を移し入れ
る。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
B.5.3 ニュートリエント寒天平板の作製 融解した培地15 mLを小形の滅菌シャーレ(6.13)に注ぐ。B.4.2
参照。
B.5.4 培地の品質保証のための性能 ニュートリエント寒天培地の性能基準を,附属書B表15に示す。
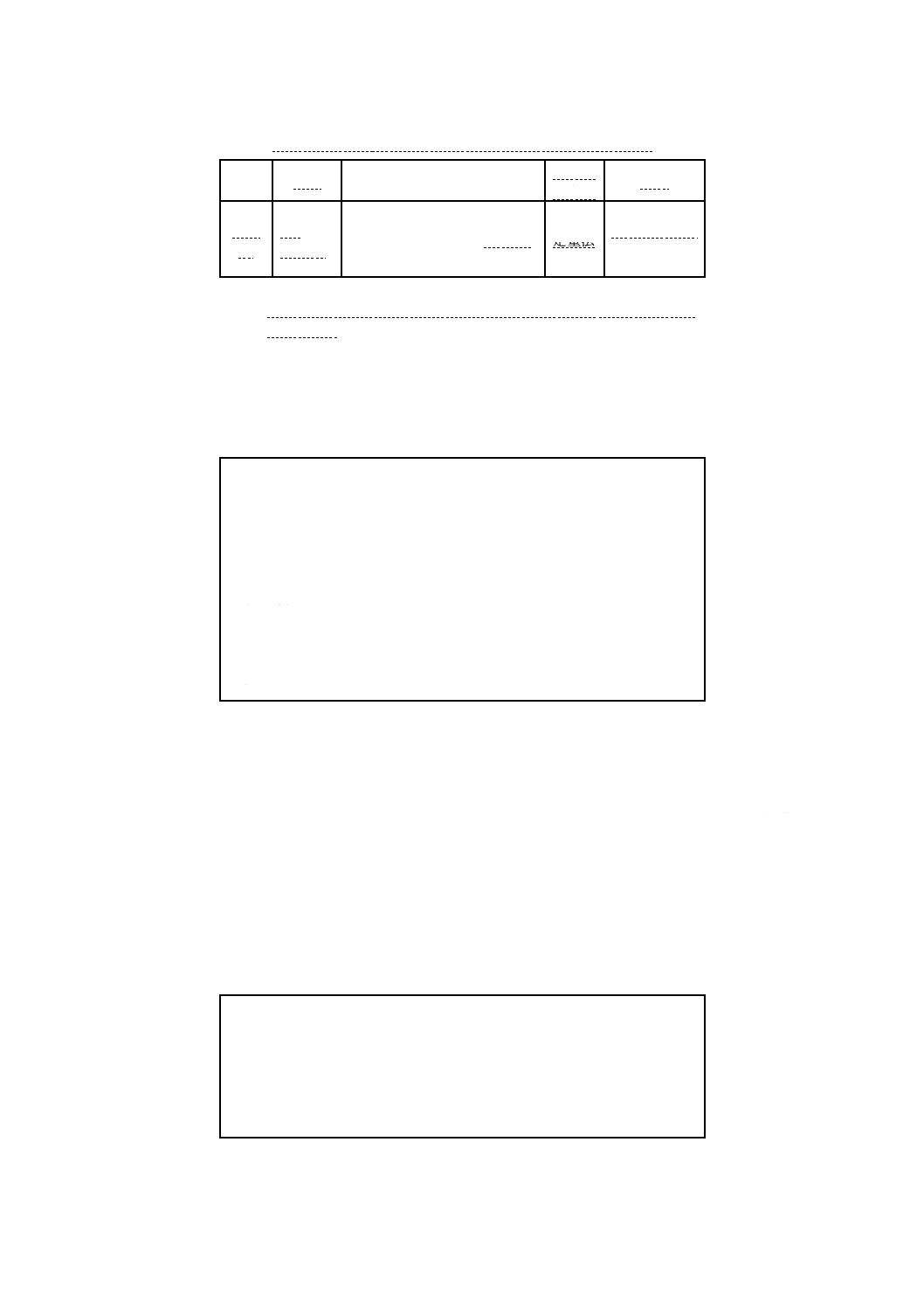
15
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表15 ニュートリエント寒天培地の性能基準
機能
培養
品質管理用菌株
品質管
理方法
基準
培養
能
37 ℃,
24時間
ネズミチフス菌ATCC 14028
定量法 生育が良好で
あること。
備考 これらの菌株は理化学研究所生物基盤研究部微生物系統保存施設,独
立行政法人製品評価技術基盤機構生物遺伝資源部門などから購入可
能である。
B.6 TSI(Triple Sugar / Iron)寒天培地
B.6.1 組成 組成は,附属書B表16による。
附属書B表16 TSI寒天培地の組成
肉エキス
3.0 g
酵母エキス
3.0 g
ペプトン
20.0 g
塩化ナトリウム(NaCl)
5.0 g
乳糖(ラクトース)
10.0 g
白糖(スクロース)
10.0 g
ブドウ糖(グルコース)
1.0 g
くえん酸鉄(III)アンモニウム
0.3 g
チオ硫酸ナトリウム
0.3 g
フェノールレッド
0.024 g
寒天
9〜18 g (1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
B.6.2 調製 各成分又は粉末培地を精製水に溶解する。必要であれば加熱して溶解する。必要であればpH
を調整し,滅菌後のpHを25 ℃で7.4±0.2とする。試験管又はシャーレに培地を10 mLずつ分注する。
121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。高層部の深さが2.5 cmから約5 cm
となるよう斜面に固める。
B.7 クリステンセン(Christensen)尿素寒天培地
B.7.1 基礎培地
B.7.1.1 組成 組成は,附属書B表17による。
附属書B表17 基礎培地の組成
ペプトン
1.0 g
ブドウ糖(グルコース)
1.0 g
塩化ナトリウム(NaCl)
5.0 g
りん酸二水素カリウム(KH2PO4)
2.0 g
フェノールレッド
0.012 g
寒天
9〜18 g (1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。

16
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.7.1.2 調製 各成分又は粉末培地を精製水に溶解する。必要であれば加熱して溶解する。必要であれば
pHを調整し,滅菌後のpHを25 ℃で6.8±0.2とする。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)
で15分間滅菌する。
B.7.2 尿素溶液
B.7.2.1 組成 組成は,附属書B表18による。
附属書B表18 尿素溶液の組成
尿素
400 g
精製水(右記の最終量となるまで)
1 000 mL
B.7.2.2 調製 尿素を精製水に溶解する。ろ過して除菌し,無菌であることを確認する。JIS K 3701参照。
B.7.3 完全培地
B.7.3.1 組成 組成は,附属書B表19による。
附属書B表19 完全培地の組成
基礎培地(B.7.1)
950 mL
尿素溶液(B.7.2)
50 mL
B.7.3.2 調製 無菌条件下で,あらかじめ溶かしてから44〜47 ℃に冷却しておいた基礎培地に尿素溶液
を加える。滅菌試験管(6.11)に完全培地を10 mLずつ分注する。斜面となるように固める。
B.8 L-リジン脱炭酸試験用培地
B.8.1 組成 組成は,附属書B表20による。
附属書B表20 L-リジン脱炭酸試験用培地の組成
L-リジン塩酸塩
5.0 g
酵母エキス
3.0 g
ブドウ糖(グルコース)
1.0 g
ブロモクレゾールパープル
0.015 g
精製水
1 000 mL
B.8.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。さらにpHを調整し,滅菌後
のpHを25 ℃で6.8±0.2とする。培地2〜5 mLを,スクリューキャップ付きの細い試験管(6.11)に分注
する。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
B.9 β -ガラクトシダーゼ検出用試薬
B.9.1 緩衝液
B.9.1.1 組成 組成は,附属書B表21による。
附属書B表21 β -ガラクトシダーゼ検出用試薬の組成
りん酸二水素ナトリウム(NaH2PO4)
6.9 g
水酸化ナトリウム(10 mol/L溶液)
約3 mL
精製水(右記の最終量となるまで)
50 mL
17
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.9.1.2 調製 全量フラスコに入れた精製水約45 mLに,りん酸二水素ナトリウムを溶解する。水酸化ナ
トリウム溶液を添加してpHを25 ℃で7.0±0.2とする。精製水を加え,50 mLとする。
B.9.2 ONPG溶液
B.9.2.1 組成 組成は,附属書B表22による。
附属書B表22 ONPG溶液の組成
ο-ニトロフェニル-β -D-ガラクトピラノシド(ONPG)
0.08 g
精製水
15 mL
B.9.2.2 調製 ONPGを精製水に約50 ℃で溶解する。溶液を冷却する。
B.9.3 完全試薬
B.9.3.1 組成 組成は,附属書B表23による。
附属書B表23 完全試薬の組成
緩衝液(B.9.1)
5 mL
ONPG溶液(B.9.2)
15 mL
B.9.3.2 調製 緩衝液をONPG溶液に加える。
B.10 Voges-Proskauer(VP)反応用試薬
B.10.1 VP培地
B.10.1.1 組成 組成は,附属書B表24による。
附属書B表24 VP培地の組成
ペプトン
7.0 g
ブドウ糖(グルコース)
5.0 g
りん酸水素二カリウム(K2HPO4)
5.0 g
精製水
1000 mL
B.10.1.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。さらに,pHを調整し,滅
菌後のpHを25 ℃で6.9±0.2とする。試験管(6.11)に培地を3 mLずつ分注する。121 ℃に設定した乾熱
滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
B.10.2 クレアチン溶液[N-amidinosarcosine(N-アミジノサルコシン)]
B.10.2.1 組成 組成は,附属書B表25による。
附属書B表25 クレアチン溶液の組成
クレアチン一水和物
0.5 g
精製水
100 mL
B.10.2.2 調製 クレアチン一水和物を水に溶解する。
B.10.3 1-ナフトール・エタノール溶液
B.10.3.1 組成 組成は,附属書B表26による。
18
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表26 1-ナフトール・エタノール溶液の組成
1-ナフトール
6 g
エタノール,95 %以上(体積分率)
100 mL
警告事項 1-ナフトールは,発がん性が報告されているため取扱いに注意する。
B.10.3.2 調製 1-ナフトールをエタノールに溶解する。
B.10.4 水酸化カリウム溶液
B.10.4.1 組成 組成は,附属書B表27による。
附属書B表27 水酸化カリウム溶液の組成
水酸化カリウム
40 g
精製水
100 mL
B.10.4.2 調製 水酸化カリウムを精製水に溶解する。
B.11 インドール反応用試薬
B.11.1 トリプトン・トリプトファン培地
B.11.1.1 組成 組成は,附属書B表28による。
附属書B表28 トリプトン・トリプトファン培地の組成
トリプトン
10 g
塩化ナトリウム(NaCl)
5 g
DL-トリプトファン
1 g
精製水
1 000 mL
B.11.1.2 調製 各成分を沸騰精製水に溶解する。必要であればpHを調整し,滅菌後のpHを25 ℃で7.5
±0.2とする。数本の試験管(6.11)に培地を5 mLずつ分注する。121 ℃に設定した乾熱滅菌器又は蒸気
滅菌器(6.1)で15分間滅菌する。
B.11.2 コバック(Kovacs)試薬
B.11.2.1 組成 組成は,附属書B表29による。
附属書B表29 コバック(Kovacs)試薬の組成
4-ジメチルアミノベンズアルデヒド
5 g
塩酸,ρ=1.18〜1.19 g/mL
25 mL
2-メチルブタン-2-オール
75 mL
B.11.2.2 調製 各成分を混合する。
B.12 半流動ニュートリエント寒天培地
B.12.1 組成 組成は,附属書B表30による。

19
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表30 半流動ニュートリエント寒天培地の組成
肉エキス
3.0 g
ペプトン
5.0 g
寒天
4〜9 g(1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
B.12.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。必要であればpHを調整し,
滅菌後のpHを25 ℃で7.0±0.2とする。適当な容量のフラスコ(6.11)に培地を移し入れる。121 ℃に設
定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
B.12.3 寒天平板の作製 小形の滅菌シャーレ(6.13)に,新たに調製した培地15 mLを注ぐ。寒天平板
は,乾燥させない。
B.13 生理食塩水
B.13.1 組成 組成は,附属書B表31による。
附属書B表31 生理食塩水の組成
塩化ナトリウム(NaCl)
8.5 g
精製水
1 000 mL
B.13.2 調製 塩化ナトリウムを精製水に溶解する。必要であればpHを調整し,滅菌後のpHを25 ℃で
7.0±0.2とする。フラスコ又は試験管(6.11)に,滅菌後の体積が90〜100 mLとなるよう溶液を分注する。
121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間滅菌する。
20
K 3705:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] ISO 6887-2,Microbiology of food and animal feeding stuffs−Preparation of test samples,initial suspension
and decimal dilutions for microbiological examination−Part 2: Specific rules for the preparation of meat and
meat products
[2] ISO 6887-3,Microbiology of food and animal feeding stuffs−Preparation of test samples,initial suspension
and decimal dilutions for microbiological examination−Part 3: Specific rules for the preparation of fish and
fishery products
[3] ISO 6887-4,Microbiology of food and animal feeding stuffs−Preparation of test samples,initial suspension
and decimal dilutions for microbiological examination−Part 4: Specific rules for the preparation of products
other than milk and milk products,meat and meat products,and fish and fishery products
[4] ISO/TS 11133-1,Microbiology of food and animal feeding stuffs−Guidelines on preparation and production
of culture media−Part 1: General guidelines on quality assurance for the preparation of culture media in the
laboratory
[5] ISO/TS 11133-2,Microbiology of food and animal feeding stuffs−Guidelines on preparation and production
of culture media−Part 2: Practical guidelines on performance testing of culture media
[6] Ewing,W.H. and BALL,M.M. The biochemical reactions of the genus Salmonella. National Center for
Disease Control and Prevention,Atlanta,Georgia,USA,1996
[7] Feldsine,P. et al. Recovery of Salmonella in Selected Foods by the ISO 6579 Salmonella Culture Procedure
and the AOAC International Official Method of Analysis: Collaborative Study. J. AOAC Int.,2001
[8] Culture Media for Food Microbiology. In: Progress in Industrial Microbiology. Vol. 34. (Eds. Corry,J.E.L.,
Curtis,G.D.W. and Baird,R.M.). Elsevier,Amsterdam,1995
2
1
K
3
7
0
5
:
2
0
0
8
2
1
K
3
7
0
5
:
2
0
0
8
附属書1(参考)JISと対応する国際規格との対比表
JIS K 3705:2008 培地の試験方法―サルモネラ属菌用培地―サルモネラ属菌の検出
ISO 6579:2002 食品及び動物用飼料の微生物試験―サルモネラ属菌の検出方法
及びTECHNICAL CORRIGENDUM 1(2004)
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体,附属書
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
1.適用範囲
培地を用いてサルモ
ネラ属菌を検出する
方法について規定。
ISO 6579
1
JISとほぼ同じ。
MOD/追加
感染防止を警告。
実質的な技術的差異はない。
2.引用規格
JIS K 3701
2
ISO 7218
IDT
JIS K 8008
−
MOD/追加
−
追加した用語を規定するため。
3.定義
用語の定義を規定
3
JISとほぼ同じ。
MOD/追加
用語(水)を追加。
JISとして必要な用語を規定。
4.一般原則
サルモネラ属菌検出
のための段階操作を
規定。
4
JISとほぼ同じ。
MOD/変更
国内の培地名称を採用(4.3)。
利用者の利便性のため。技術的
差異はない。
5.培地,試薬
及び血清
培地,試薬及び血清に
ついて規定。
5
JISとほぼ同じ。
MOD/削除
支援機関に関する記述を削除
(5.3)。
我が国に該当機関がないため。
6.装置及びガ
ラス器具
通常の微生物検査に
用いる装置及びガラ
ス器具(乾熱滅菌器及
び乾燥キャビネット
など)について規定。
6
JISとほぼ同じ。
MOD/追加
装置を追加。
利用者の利便性のため。技術的
差異はない。
7.サンプリン
グ方法
試料のサンプリング
方法について規定。
7
JISと同じ。
IDT
−
−
8.試料の調製
試料の調製について
規定。
8
JISと同じ。
IDT
−
−
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2
2
K
3
7
0
5
:
2
0
0
8
2
2
K
3
7
0
5
:
2
0
0
8
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体,附属書
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
9.手順
手順(非選択前増菌,選
択増菌及び平板培養な
ど)について規定。
9
JISとほぼ同じ。
MOD/追加
9.1.2の表題を追加修正し,備考で
最終的な形別が不明の場合の国
内問い合わせ先を追記(9.5.6)。
利用者の利便性のため。
10.試験結
果の表現
試験結果の表現(サルモ
ネラ属菌の有無など)に
ついて規定。
10
JISと同じ。
IDT
−
−
11.試験報
告書
試験報告書(培養条件及
び試験結果など)につい
て規定。
11
JISと同じ。
IDT
−
−
12.精度管
理
精度管理(サルモネラ属
菌の検出能力など)につ
いて規定。
12
JISと同じ。
IDT
−
−
附属書A
(規定)
手順の概略図
附属書A
JISと同じ。
IDT
−
−
附属書B
(規定)
培地・試薬の組成及び調
製
附属書B
JISとほぼ同じ。
MOD/追加
MOD/追加
MOD/追加
MOD/追加
国内の培地名称を採用(B.2)。
菌株の国内購入先を追記(B.2.5
など)。
警告事項(1−ナフトール)を追
加(B.10.3.1)。
培地の品質保証のための性能を
追加(B.2.5,B.3.5,B.4.3)。
利用者の利便性のため。技術的
差異はない。
利用者の利便性のため。
発がん性が報告されているた
め。
利用者の利便性のため。
MOD/変更,
追加
エタノール96 %を95 %とし,
また警告文を追加(B.10.3.1)
国内で入手しやすいため。
JISと国際規格との対応の程度の全体評価:MOD
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2
3
K
3
7
0
5
:
2
0
0
8
2
3
K
3
7
0
5
:
2
0
0
8
備考1. 項目ごとの評価欄の記号の意味は,次のとおりである。
― IDT……………… 技術的差異がない。
― MOD/削除……… 国際規格の規定項目又は規定内容を削除している。
― MOD/追加……… 国際規格にない規定項目又は規定内容を追加している。
― MOD/変更……… 国際規格の規定内容を変更している。
2.
JISと国際規格との対応の程度の全体評価欄の記号の意味は,次のとおりである。
― MOD…………… 国際規格を修正している。
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。