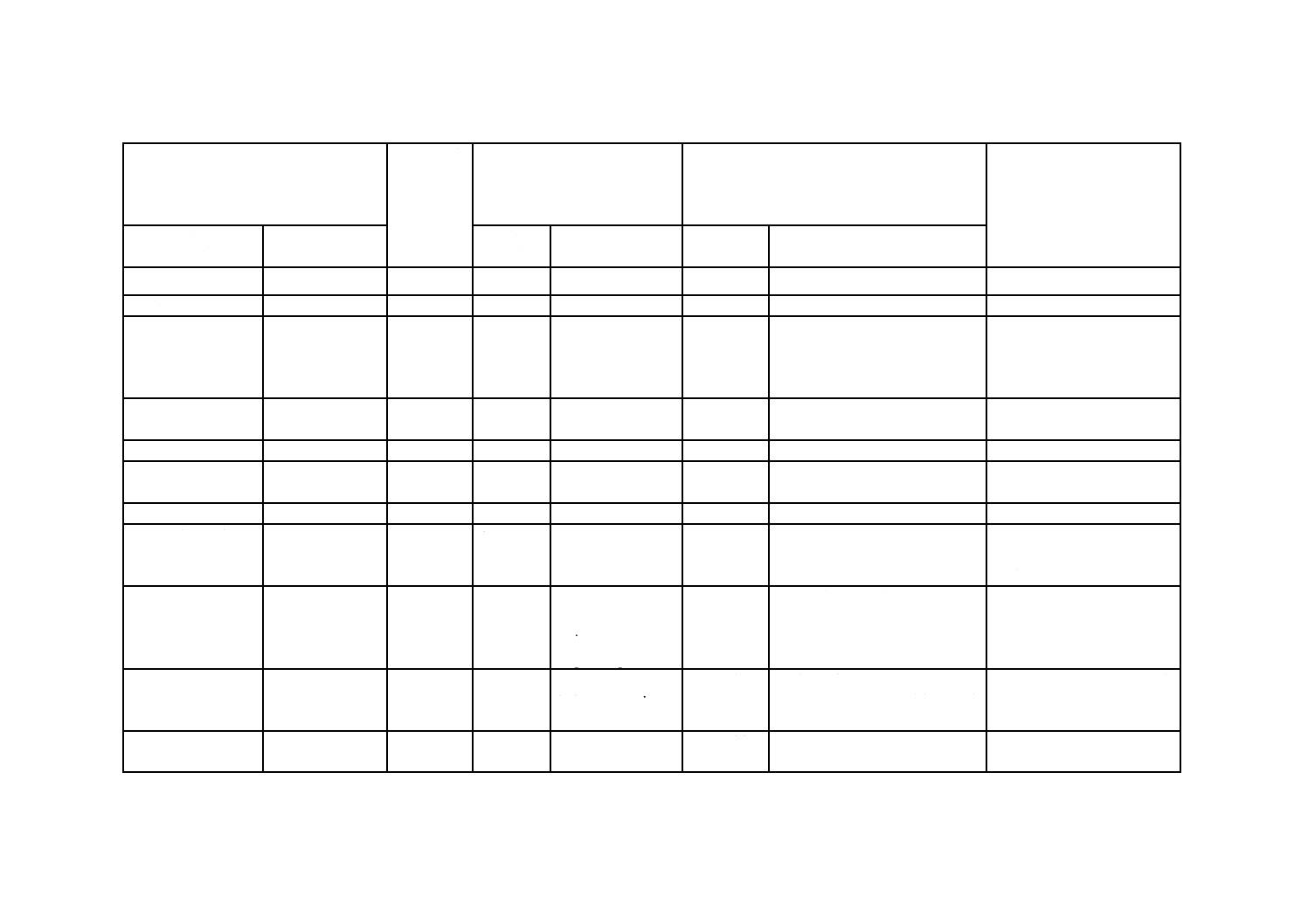K 0461:2006
(1)
まえがき
この規格は,工業標準化法に基づいて,日本工業標準調査会の審議を経て,経済産業大臣が制定した日
本工業規格である。
制定に当たっては,日本工業規格と国際規格との対比,国際規格に一致した日本工業規格の作成及び日
本工業規格を基礎にした国際規格原案の提案を容易にするために,ISO 15089:2000,Water quality―
Guidelines for selective immunoassay for the determination of plant treatment and pesticide agentsを基礎として用
いた。
また,令和2年10月20日,産業標準化法第17条又は第18条の規定に基づく確認公示に際し,産業標
準化法の用語に合わせ,規格中“日本工業規格”を“日本産業規格”に,“工業標準化法”を“産業標準化
法”に改めた。
この規格の一部が,技術的性質をもつ特許権,出願公開後の特許出願,実用新案権,又は出願公開後の
実用新案登録出願に抵触する可能性があることに注意を喚起する。経済産業大臣及び日本産業標準調査会
は,このような技術的性質をもつ特許権,出願公開後の特許出願,実用新案権,又は出願公開後の実用新
案登録出願にかかわる確認について,責任はもたない。
JIS K 0461 には,次に示す附属書がある。
附属書A(参考)フローチャート及びピペッティング方法
附属書B(参考)試験室間試験から得られた精度データの一例
附属書1(参考)免疫測定方法(イムノアッセイ)の分類
附属書2(参考)競合ELISAの誤差原因
附属書3(参考)JISと対応する国際規格との対比表
K 0461:2006
(2)
目 次
ページ
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 1
3. 定義 ······························································································································ 2
4. 妨害 ······························································································································ 3
5. 原理 ······························································································································ 4
6. 試薬 ······························································································································ 4
6.1 一般 ···························································································································· 4
6.2 緩衝洗浄液 ··················································································································· 4
6.3 酸 ······························································································································· 4
6.4 塩基 ···························································································································· 4
6.5 標準物質 ······················································································································ 4
7. 器具及び機器 ·················································································································· 4
7.1 固相 ···························································································································· 4
7.2 マイクロピペット ·········································································································· 4
7.3 磁気ラック ··················································································································· 4
8. サンプリング及び試料調製 ································································································ 4
8.1 サンプリング ················································································································ 4
8.2 固相のコーティング ······································································································· 5
8.3 酵素トレーサー ············································································································· 5
8.4 溶液 ···························································································································· 5
8.5 試料調製 ······················································································································ 5
8.6 試料の前処理 ················································································································ 5
9. 操作方法 ························································································································ 5
9.1 直接酵素免疫測定方法(酵素とハプテントレーサーを用いる,方法a)···································· 5
9.2 ゼロ標準の測定 ············································································································· 6
9.3 校正 ···························································································································· 6
10. 分析方法バリデーション(妥当性確認)············································································· 6
10.1 精度プロファイル ········································································································· 6
10.2 定量下限及び定量上限 ··································································································· 7
10.3 検出下限 ····················································································································· 8
10.4 他の分析方法との比較 ··································································································· 8
11. 計算 ···························································································································· 8
11.1 繰り返し ····················································································································· 8
11.2 B/Bo値の計算 ·············································································································· 9
K 0461:2006
(3)
11.3 曲線への当てはめ ········································································································· 9
12. 精度 ··························································································································· 11
13. 検査報告書 ·················································································································· 11
附属書A(参考)フローチャート及びピペッティング方法 ·························································· 12
附属書B(参考)試験室間試験から得られた精度データの一例 ····················································· 14
附属書1(参考)免疫測定方法(イムノアッセイ)の分類 ··························································· 15
附属書2(参考)競合ELISAの誤差原因·················································································· 17
附属書3(参考)JISと対応する国際規格との対比表 ·································································· 20
日本産業規格 JIS
K 0461:2006
競合免疫測定方法通則
Guidelines for competitive immunoassay
序文 この規格は,2000年に第1版として発行されたISO 15089,Water quality−Guidelines for selective
immunoassay for the determination of plant treatment and pesticide agentsを元に,対応する部分については対応
国際規格を翻訳し,技術的内容を変更することなく作成した日本産業規格であるが,対応国際規格には規
定されていない規定項目を日本産業規格として追加している。
この規格で側線又は点線の下線を施してある箇所は,原国際規格を変更している事項である。変更の一
覧表をその説明を付けて,附属書4(参考)に示す。
なお,免疫測定方法(イムノアッセイ)の分類は附属書1(参考)に記載する。
1. 適用範囲 この規格は,水・土壌中の,農薬及びその分解物,内分泌かく(撹)乱物質,女性ホルモ
ン,残留性有機汚染物質(POPs)並びに界面活性剤を競合免疫測定方法を用いて定量する場合の通則につ
いて規定する。
備考 この規格の対応国際規格を,次に示す。
なお,対応の程度を表す記号は,ISO/IEC Guide 21に基づき,IDT(一致している),MOD
(修正している),NEQ(同等でない)とする。
ISO 15089:2000,Water quality−Guidelines for selective immunoassay for the determination of plant
treatment and pesticide agents (MOD)
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0127 イオンクロマトグラフ分析通則
JIS K 0970 プッシュボタン式液体用微量体積計
JIS K 3211 界面活性剤用語
JIS K 3600 バイオテクノロジー用語
JIS K 8622 炭酸水素ナトリウム(試薬)
JIS K 8625 炭酸ナトリウム(試薬)
JIS K 0410-3-1 水質−サンプリング−第1部:サンプリング計画策定の指針
JIS K 0410-3-2 水質−サンプリング−第2部:サンプリング技術の指針
JIS K 0410-3-3 水質−サンプリング−第3部:試料の保存及び取扱いの指針
ISO/TR 13530 Water quality-Guide to analytical quality control for water analysis
ISO 10381-1 Soil quality−Sampling−Part 1: Guidance on the design of sampling programmes
2
K 0461:2006
ISO 10381-2 Soil quality−Sampling−Part 2: Guidance on sampling techniques
ISO 10381-3 Soil quality−Sampling−Part 3: Guidance on safety
ISO 10381-4 Soil quality−Sampling−Part 4: Guidance on the procedure for investigation of natural,
near-natural and cultivates sites
ISO 14507 Soil quality−Pretreatment of samples for determination of organic contaminants
3. 定義 この規格で用いる主な用語の定義は,JIS K 3600及びJIS K 3211によるほか,次による。
3.1
親和性 (affinity) 分析対象成分への抗体の結合の強さ。
備考 結合の強さは,Ab+H=AbHで表される反応の平衡定数(K)によって定義される。ここで,Ab
は抗体の結合部位,Hはハプテンである。 K は,質量作用式
)
/(
H
Ab
AbH
c
c
c
K
×
=
で示される。
3.2
分析対象成分 (analyte) 競合免疫測定方法の対象となる,水・土壌中の測定成分。
3.3
抗体 (antibodies) 免疫反応によって脊椎動物に産生されるたん(蛋)白。それぞれ抗原又はハプテ
ンと選択的に結合する。
備考1. 単クローン抗体(mAb)は,ハイブリドーマ単細胞クローンから作り出される均一な抗体。
2. ポリクローナル抗体(pAb)は,プラズマ細胞の幾つかのクローンによって生産される抗体の混
合物。
3. 組換え抗体(rAb)は,遺伝子組換え技術で確立された技法を用いて生産される抗体。
3.4
標識抗体 (antibody conjugate) 酵素,蛍光色素などで標識された抗体。
3.5
抗原 (antigen) 抗体の産生を促進して,それらと反応する物質。
3.6
抗血清 (antiserum) 免疫した脊椎動物の血液から細胞成分及び凝固系因子を取り除いて得られる血
清。
備考 抗血清は,通常,抗原又はハプテンに対して,多数の異なる親和性を示すことのできる複数の
抗体を含む。
3.7
固定化複合体 (coating conjugate) 固相に固定化された,ハプテンと結合した巨大分子(ハプテン−
キャリア複合体としても知られる。)。
備考 固定化複合体は,分析対象成分によって占有されていない抗体の結合部位に対して,結合させ
るために用いられる。
3.8
競合免疫測定方法 (competitive immunoassay) 抗体の結合部位のうち,試料中の分析対象成分によっ
て占有されている割合を検出する試験方法。
備考 この試験方法は,占有されていない抗体の結合部位に結合し,次の反応後に測定シグナルを生
じるトレーサーを加えることによって実施される。
3.9
交差反応性 (cross-reactivity) 分析対象成分とは構造的に異なる物質に対して,抗体又は抗血清が反
応する度合い。
備考1. このような物質に対する抗体又は抗血清の交差反応性は,各検量線の比較によって求められ
る。この場合,分析対象成分に対して得られる基準曲線が,基準量(=100 %の交差反応性)
として用いられる。交差反応性は,通常,IC50で決定される。抗体又は抗血清の選択性(い
わゆる特異性)は,交差反応性と逆の関係にある。抗体又は抗血清は,異なる物質に対して
異なる親和性を示す。ある特定の物質に対する抗血清の交差反応性は,その測定濃度範囲内
でも変化することがある。大抵の場合,免疫原の構造が抗血清の選択性(いわゆる特異性)
を本質的に決定する。抗血清でよく見られるように,種々の抗体が集合体として存在してい
3
K 0461:2006
ることによって交差反応が生じている場合,望ましくない抗体は交差吸収によって取り除く
ことができる。
2. 交差反応性を示すすべての(検出可能な濃度で存在している)化合物は,より高濃度値とし
て,又は偽陽性としての結果をもたらす。
3.10 酵素免疫測定方法 (enzyme immunoassay) 抗体中の結合部位を占有した分析対象成分をトレーサー
(酵素標識ハプテン又は酵素標識抗体)を用いて検出することによって,検液中の濃度を測定する免疫化
学測定方法。
備考 検出法の手順は,基質の変化によるトレーサーの酵素活性測定を基礎とする。
3.11 酵素基質 (enzyme substrate) 測定機器にて検知される酵素反応生成物の変換前の物質。
3.12 過剰標準 (excess standard) 免疫測定において,信号強度の低下を生じない標準物質の最大濃度。
3.13 蛍光免疫測定方法 (fluorescence immunoassay) 免疫化学測定方法の一つで,蛍光をもつ基質,及び
蛍光をもつ生成物,蛍光標識したトレーサー,又は蛍光標識した抗体を用いる方法。
3.14 ハプテン (hapten) 抗原又はその誘導体であり,抗体との結合力はあるが,分子サイズが小さいた
めキャリアーたん白質と共有結合しないと抗体を産生できない物質。
3.15 ヘテロジニアス免疫測定方法 (heterogeneous immunoassay) 抗体の抗原結合部位を占有している分
析対象物及びトレーサーの抗体結合部位が異なる占有部分を用いて試料中の分析対象成分の濃度を検出す
るための試験。
3.16 イムノアッセイ(免疫測定方法) (immunoassay) 分析対象成分及び抗体の選択的な結合に基づいて,
トレーサーを用いて遊離又は占有された抗体上抗原結合部位を測定する定量方法。
3.17 免疫原 (immunogen) せき(脊)つい動物に注入して免疫反応を引き起こす物質。
3.18 阻害濃度 IC (inhibition concentration) ゼロ標準(=100 %)の測定信号(シグナル)を減少させる分
析対象成分の濃度。
IC50の場合は,ゼロ標準の50 %に減少させる分析対象成分の濃度。
3.19 発光免疫測定方法 LIA (luminescence immunoassay) 発光性基質,生成物,又は発光性物質標識トレ
ーサーを検出する方式の免疫化学測定方法。
3.20 固相免疫測定方法 (solid phase immunoassay) テストタイプに応じて,固相に固定化された抗体又は
固定化複合体を用いるヘテロジニアス免疫測定方法。
備考 酵素標識トレーサーが用いられる場合,両テストタイプは,通常,ELISA(enzyme-linked
immunosorbent assay)として知られている。
3.21 トレーサー (tracer) 競合免疫測定方法において,分析対象成分が占有していない抗体の結合部位の
割合を測定するために使われる,標識されたハプテン(又は抗原)又は標識された抗体。
3.22 ゼロ標準 (zero standard) 校正に使われる,分析対象成分を含まない標準(ブランク)。
3.23 標識抗原 酵素,蛍光色素等で標識された抗原。
3.24 女性ホルモン 雌の成熟,月経,卵の着床,妊娠の持続などに主として働くホルモンの総称。例え
ば,卵胞ホルモン(エストロゲン),黄体ホルモン(プロゲステロン),人工合成女性ホルモン(エチニル
エストラジオール)などがある。
3.25 残留性有機汚染物質(POPs) 難分解性,高蓄積性,長距離移動性,有害性(人の健康・生態系)
を持つことが懸念される化学物質。“ストックホルム条約”(POPs条約)で規定している。
4
K 0461:2006
4. 妨害 測定への妨害は,不適切な試料採取,例えば,測定されるべき化合物を吸着又は放出するよう
な用具又は材料を選択したことによって起こる。測定条件,例えば,pH及び試料に含まれる金属イオン,
フミン酸,防せい(錆)剤,試験成分に影響する溶媒(例えば,マトリックス効果)などは分析に影響す
る。マトリックス効果の影響は,分析対象成分の一定量を試料に添加することによって推定できる。
5. 原理 免疫測定方法は,分析対象成分の濃度を定量するために,分析対象成分又はその集団に対して
作製された抗体を,生化学的センサーとして使用する方法である。これら免疫測定方法は,スクリーニン
グ用の分析手法として特に有用である。ハプテンを検出する免疫測定方法は,すべて競合免疫測定方法の
原理に基づくものである。農薬の分析は,これまでにも報告されている(参考文献の[1]から[4]を参照)。酵
素免疫測定方法(EIA)の例として,代表的なものを次に示す。
固相には2種類の方法があり,固定化した抗体と溶解したハプテントレーサー(方法a,直接免疫測定
法),又は固定化複合体と溶解した抗体トレーサー(方法b,間接免疫測定法)とのいずれかを一定の比率
で使用する。抗体は,一定量を使用する。したがって,固定化複合体に結合しない成分は,最終的な検出
の前に,洗浄によって除かれる。妨害的なマトリックス効果の大部分もこれにより除去される。より多く
のトレーサー分子が結合するならば,試料中の分析対象成分の濃度はより低くなる。
固定化は,吸着又は固相の官能基との共有結合によって行われる。
検量は,既知濃度の分析対象成分の溶液を用いて行う。
6. 試薬
6.1
一般 高純度の試薬及び水を用いる(例えば,残留物分析用など)。分析結果には,抗体及び抗血清
のタイプ,由来及び交差反応性を記載しなければならない。使用した試薬の保存条件及び安定性に関する
情報を,供給元に要求しなければならない。抗体及び抗血清の特異性が低い場合,化学的又は物理的手法
によって,試料から測定に干渉する物質を取り除かなければならない。抗血清中の交差反応を示す抗体は,
吸収によって取り除くことができる。
6.2
緩衝洗浄液 洗浄には洗浄液を用いる。例えば,りん酸の濃度が80 mmol/L(りん酸二水素ナトリウ
ムとりん酸水素二ナトリウムとで調製),塩化ナトリウムの濃度が8.5 g/Lのりん酸緩衝生理食塩水(PBS:
pH 7.6)。
6.3
酸 pH調節及び酵素反応の停止に用いる。例えば,硫酸(1 mol/L)など。
6.4
塩基 pH調節及び酵素反応の停止に用いる。例えば,水酸化ナトリウム溶液(1 mol/L)など。
6.5
標準物質 測定対象となる物質の標準物質は,日本産業規格(以下,JISという。)の規定によるも
の又は市販の標準物質があればこれを用いる。JISに規定がなく,市販の標準物質もない場合は,市販さ
れている分析対象成分のうち,できるだけ純度の高いものを用いる。
7. 器具及び機器
7.1
固相 ヘテロジニアス免疫測定方法に使用する,プラスチック,ガラス,又は磁性粒子製の固相。
例えば,マイクロプレート,試験管,ビーズ,磁性粒子,薄膜など。
7.2
マイクロピペット JIS K 0970(プッシュボタン式液体用微量体積計)に規定するもの(例えば,10
〜500 µlの可変式ピペット,10 µl,100 µl,及び200 µlの容量固定ピペット,300 µlなどのマルチチャンネ
ルピペット,ディスペンサーなど)。
5
K 0461:2006
7.3
磁気ラック 磁性の基盤付きのラック,磁性粒子に結合した抗体を用いる免疫測定方法で,洗浄工
程で使用する。
8. サンプリング及び試料調製
8.1 サンプリング サンプリングは当事者間の取決めによる。一般的な方法を以下に示す。
“競合免疫測定方法通則”を実試料に適用する際には,サンプリング方法及び前処理方法について規定す
る下記のJIS規格及びISO規格に従い,サンプリング及び前処理を行う。
JIS K 0410-3-1,JIS K 0410-3-2,JIS K 0410-3-3,ISO 10381-1,ISO 10381-2,ISO 10381-3,ISO 10381-4,
ISO 14507
8.2
固相のコーティング 次のように,酵素免疫測定用の固相を調製する。
参考 市販品を用いてもよい。
a) 抗体又は抗血清の希釈溶液を,適切な緩衝液,例えば,JIS K 8625に規定する炭酸ナトリウム及びJIS
K 8622に規定する炭酸水素ナトリウムを用いて調製した50 mmol/L炭酸塩緩衝液(pH 9.6)中で固相化
する。これは直接ELISA法で使用する。
b) 測定を始める前にハプテン−キャリア複合体で固相化する。これは間接ELISA法で使用する。
通常,たん白質がキャリアとして用いられる。コーティング及びそれに続く洗浄段階の後に,ある種の
分析では非特異結合部位のブロッキングが必要である。さらに,それぞれの分析対象成分,又は抗体が分
析対象成分と同等の反応性をもつ標準物質の蒸留水などを用いた標準希釈列の調製が必要である。
8.3
酵素トレーサー 酵素免疫測定方法に使用する酵素標識ハプテントレーサー(直接ELISA法)又は
酵素標識抗体トレーサー(間接ELISA法)は,使用直前に緩衝液で適切に希釈若しくは溶解するか,又は
に使用できるように,安定化した形で製造業者から供給されたものを使用する。酵素の基質は,1種又は
それ以上の成分を使用直前に緩衝液で適切に希釈若しくは溶解するか,又は直ちに使用できるように安定
化した形で製造業者から供給されたものを使用する。
8.4
溶液 固相を洗浄する洗浄液(9.1.2参照),及び酵素反応を終了させる酸又はアルカリ(9.1.3参照)
は,測定前に調製する。又は,緩衝液で適切に希釈するか,直ちに使用できるように安定化した形で製造
業者から供給されたものを使用する。
8.5
試料調製 測定前に,すべての試料,前処理済試料,試薬,溶液,装置,及び固相化物を,規定し
た温度にする。酵素反応は一定の温度で行う。試料のpHが測定に最適な範囲にない場合は,pH調節(例
えば,水酸化ナトリウム又は硫酸で行う。)が必要である。
測定結果から分析対象成分の濃度を計算する場合には,希釈倍率を考慮しなければならない。
9. 操作方法
重要−この規格に従って操作を行うには,専門家及び専門施設が必要である。
この手順を適用する場合は,専門家の指導を受けることが必要であるか否かを個別の場合ごとに(作
業内容によるが)確認すべきである。
9.1
直接酵素免疫測定方法(酵素とハプテントレーサーを用いる,方法a)
なお,間接酵素免疫測定方法(方法 b)の説明については省略する。
9.1.1
結合反応 標準液,試料,又は前処理した試料を,適切に希釈したトレーサー(8.3参照)とともに,
固相に加える。免疫反応が完了するまで,所定の時間反応させる。
6
K 0461:2006
9.1.2
洗浄操作 緩衝洗浄液(PBSなど,6.2参照)で数回洗浄して,結合反応中に結合しなかった,標
準,試料,及びトレーサーを除去する。
9.1.3
酵素反応 次に,ハプテンに結合した酵素トレーサーによって,添加した基質を変換する。使用し
たトレーサーの濃度で,基質が完全に変換されないよう,反応時間及び基質の濃度を選択する。終末点の
測定では,反応時間が終わった後に,酸(6.3参照)又は塩基(6.4参照)を添加して酵素反応を停止させる。
又は,連続的に終末点の測定を行う。
9.1.4
変換された基質の測定 適切な機器分析によって,変換された基質を測定する。市販の免疫測定法
キットには,通常,適切な機器の選択の指針が付けられている。
9.1.5
直接免疫測定方法の例
備考 直接酵素免疫測定方法は,附属書A(参考)に示したフローチャート及びピペッティング方法
に従って実施する。作業方法の例を9.1.5.1〜9.1.5.4に示すが,次の規定に限定されるものでは
なく,具体的手順は製造業者から供給された添付文書の指示に従い実施すべきである。
なお,競合ELISAの誤差原因のフローチャートを附属書2(参考)に示す。
9.1.5.1
結合反応 ピペットを用い,標準溶液又は試料及び必要量のトレーサーを,固相に添付文書で指
示された量ずつ添加し接触させる。
9.1.5.2
洗浄操作 反応後,ウェルごとに十分な量の洗浄液(ウェル当たり300 µl程度)を用い,マイク
ロプレート洗浄機(又は手作業)によって,プレートを洗浄する。この操作は,通常3回程度行えば十分
である。最後の洗浄の後,必要であれば,プレートをきれいな柔い紙(綿)上に叩き付けて(タッピング),
残った緩衝洗浄液を除く。
9.1.5.3
酵素反応 酵素基質を準備した後,一定間隔で反応容器に一定量の酵素基質を注入し,酵素反応
を開始させる。
9.1.5.4
酵素活性測定 適切な光度計を用いて,酵素反応生成物ごとに決められた検出方法によって酵素
活性を測定する。
9.2
ゼロ標準の測定 装置及び試薬の妥当性の最終確認のために,一連の測定ごとにゼロ標準(空試験
用試料)を測定する。試料調製方法の妥当性は,実試料と同じ方法で調製した空試験用試料の分析を,ゼ
ロ標準測定として行うことによって確認できる。ゼロ標準が検出下限を超えた場合は,汚染源を除くため
に,系統的に調査を行い,問題点を特定するべきである。このゼロ標準を含んだ一連の測定から得られた
結果は,破棄すべきである。
9.3
校正 標準液を用いて,免疫測定ごとに検量線を作成する。標準液の濃度が対応する標準に一致し
ていることを,定期的に確認しなければならない。濃度の差が10 %を超えてはならない。
10. 分析方法バリデーション(妥当性確認) データの質を保証するために,新たに導入した免疫測定方
法については,分析方法バリデーション(妥当性確認)を実施する。
免疫測定方法は,次の適切な管理基準を満たしていれば,日常分析として用いることができ,統計的に
妥当性があるといえる。統計的に管理するには,その方法を実験室で初めて行う前に,十分な性能評価(パ
ーフォーマンスバリデーション)をすべての分析対象成分に対して行わなければならない。この性能評価
から,日常の“品質保証及び品質管理”の基準パラメータを決め,管理図を作成しておかなければならな
い。
一連の測定毎に,既知濃度の分析対象成分を加えたゼロ試料を少なくとも一つ分析しなければならない。
この既知濃度の対象化合物を添加した空試験の結果を一つの管理図として使うことが望ましい。
7
K 0461:2006
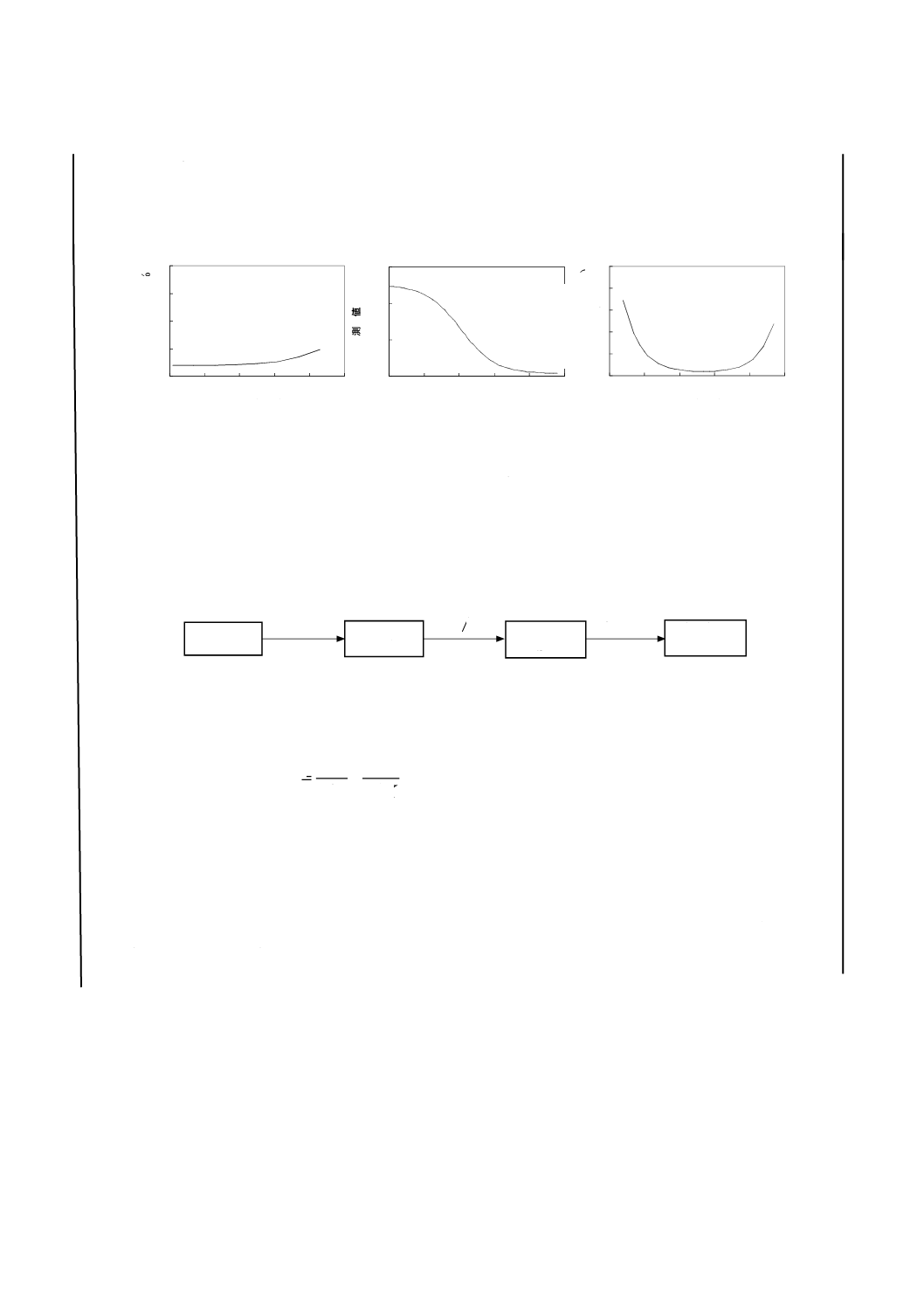
10.1 精度プロファイル 分析値の変動係数を分析対象成分の濃度に対してプロットした図を,精度プロ
ファイルと定義する。精度プロファイルは,測定値の変動係数(CV)のプロット及び定量値の(CV)の
プロットの2種類がある。図1に,競合ELISA法の典型的な精度プロファイルを示す。
0
5
10
15
20
0.001
0.01
0.1
1
10
100
濃度 (μg/L)
測
定
値
の
R
S
D
(
%
)
0.00
0.50
1.00
1.50
0.001
0.01
0.1
1
10
100
濃度 (μg/L)
測
定
値
0
20
40
60
80
100
0.001
0.01
0.1
1
10
100
濃度 (μg/L)
定
量
値
の
R
S
D
(
%
)
a)測定値の精度プロファイル b)検量線 c)定量値の精度プロファイル
図 1 ELISA法の精度プロファイル
測定値のCVから定量値のCVへの変換は,検量線の微分係数
dX
dY
を用いて,標準偏差(SD)間の変換
を行い, 図2に示すように行う。
Y
×
dX
dY
÷
X
÷
測定値の
RSD
測定値の
SD
定量値の
SD
定量値の
RSD
図 2 測定値のCVから定量値のCVへの変換
この変換は,次の式による。
(
)X
dX
dY
Y
r
r
m
c=
ここに,
X: 定量値
Y: 測定値
rc: 定量値のCV
rm: 測定値のCV
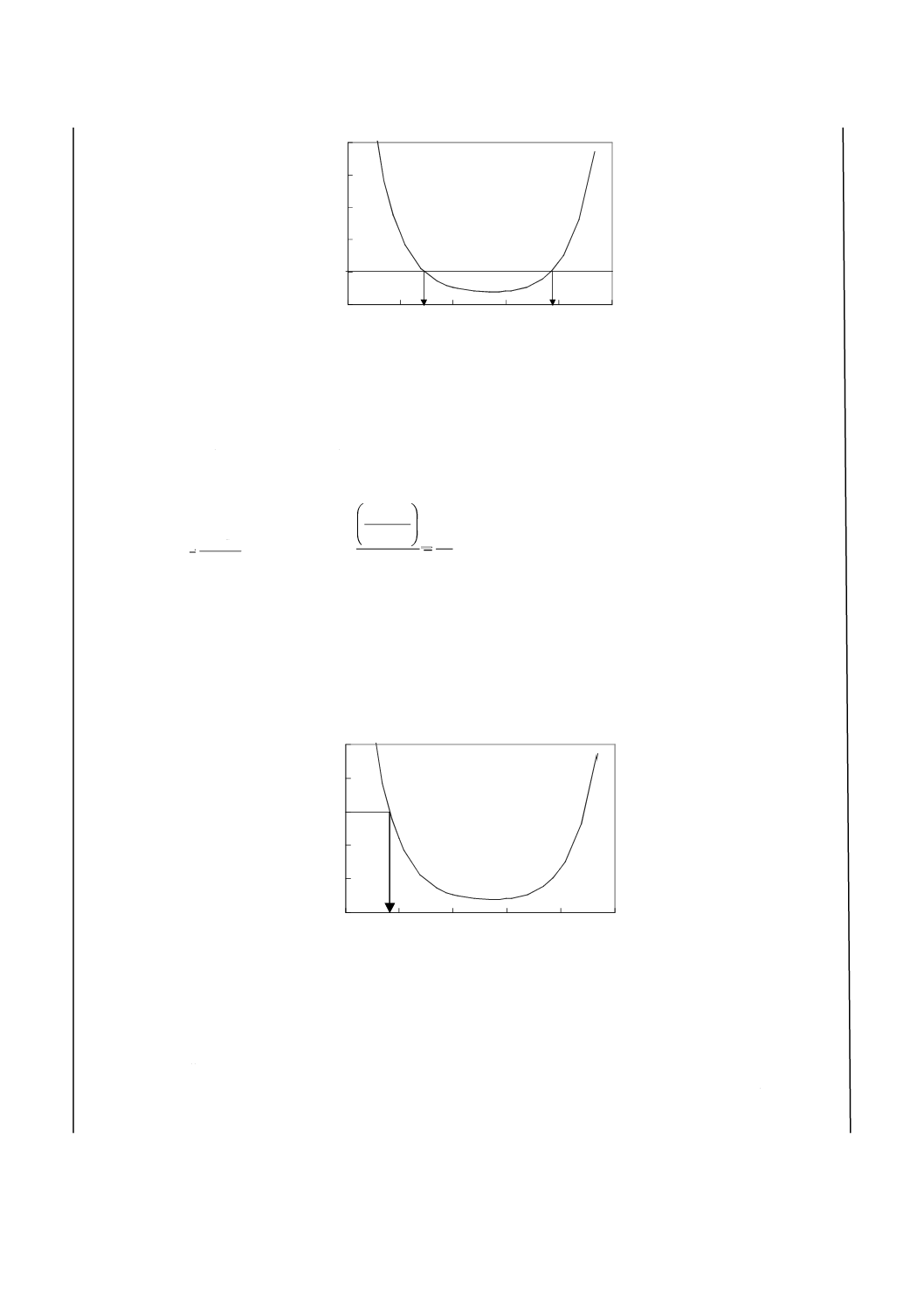
10.2 定量下限及び定量上限 定量下限とは,試料に含まれる分析対象成分の定量が可能な最小量又は最
小濃度であり,定量上限とは,定量が可能な最大量又は最大濃度である。定量値のCVが10 %を示す分
析対象成分の量又は濃度を,それぞれ定量下限及び定量上限とする。
測定値の
CV
定量値の
SD
定量値の
CV
測定値の
SD
測
定
値
の
C
V
(
%
)
定
量
値
の
C
V
(
%
)
8
K 0461:2006
図 3 定量下限及び定量上限の求め方
備考 検量線が原点を通る直線となる場合は,定量下限及び定量上限(L)を測定値の標準偏差 sの
10倍とし,これを換算した濃度と定義すると,定量下限は
dX
dY
s
L
10
=
となる。これを
10
1
=
L
dX
dY
s
と書き直すと,左辺は,定量下限又は定量上限の濃度
での定量値のCVを示し,右辺は10 %を示す。
10.3 検出下限 検出下限とは,試料に含まれる分析対象成分の検出可能な最低の量又は濃度である。定
量値のCVが30 %を示す目的値の量又は濃度を検出下限とする。ただし,検出下限は,精度プロファイ
ルのU字曲線の低濃度側とする。
0
10
20
30
40
50
0.001
0.01
0.1
1
10
100
濃度 (μg/L)
定
量
値
の
R
S
D
(
%)
図 4 検出下限の求め方
備考 JIS K 0127に示す定量値の標準偏差と検量線の傾きに基づく方法は,検量線が原点を通る直線
となる場合に用いられる。この定義では,検出下限Lを測定値の標準偏差 s の3.3倍とし,こ
れを検量線で換算した濃度と定義しており,検出下限は
0
10
20
30
40
50
0.001
0.01
0.1
1
10
100
濃度 (μg/L)
定
量
値
の
R
S
D
(
%
)
定
量
値
の
C
V
(
%
)
定
量
値
の
C
V
(
%
)
9
K 0461:2006
dX
dY
s
L
3.3
=
となる。これを
3.3
1
=
L
dX
dY
s
と書き直すと,左辺は検出限界濃度での定量値のCV
を示し,右辺は30 %を示し,この規格の定義と一致する。
10.4 他の分析方法との比較 既にあるJISに分析方法(GC-MSなど)の規定がある場合,それらの試験
方法との比較を行うとよい。具体的には,既存測定系と同一の標準品を用いて得られた標準曲線,及び値
の異なる幾つかの試料体(通常3試料体程度)を用いて測定を行い,既存測定方法との相関性を明らかに
しておくことが望ましい。
11. 計算
11.1 繰り返し 5〜10 %の変動係数(CV)となるように,繰り返し測定を実施するのがよい。望ましいCV
によって繰り返し数も規定される。各濃度のCVは,図3の精度プロファイルから求め,これから繰り返
し数を決定する。
11.2 B/Bo値の計算 異なる標準曲線の直接比較など,幾つかの目的で,データの標準化が行われねばな
らない。
分光光度法,蛍光光度法,及び発光光度法による測定値は,次の式によってB/Bo値に変換する。これら
の値は百分率で表され,酵素トレーサー又は固定化複合体によって占有された抗体結合部位の率を示す。
簡易的に行うには,両辺で過剰標準吸光度値を引くことは不要である。
(
)
(
)
100
/
e
0
0
×
−
−
=
A
A
A
A
B
B
e
ここに,
B: 試料存在下におけるトレーサーの結合
B0: 試料が存在しないときのトレーサーの結合
A: 試料又は参照標準の吸光度値
A0: ゼロ標準の吸光度値
Ae: 過剰標準の吸光度値
11.3 曲線への当てはめ 次の式は検量線の関数を得るのによく用いられる(参考文献の[6]を参照)。また,
他の方法も利用可能である。例を図5に示す。
y = d+
+
−
b
d
a
IC50
1
ρ
ρ
ここに,
y: 測定値
d: 曲線における下方漸近値
a: 曲線における上方漸近値
ρ: 分析対象成分の質量濃度
ρIC50: IC50における分析対象成分の質量濃度
b: IC50における曲線の傾き
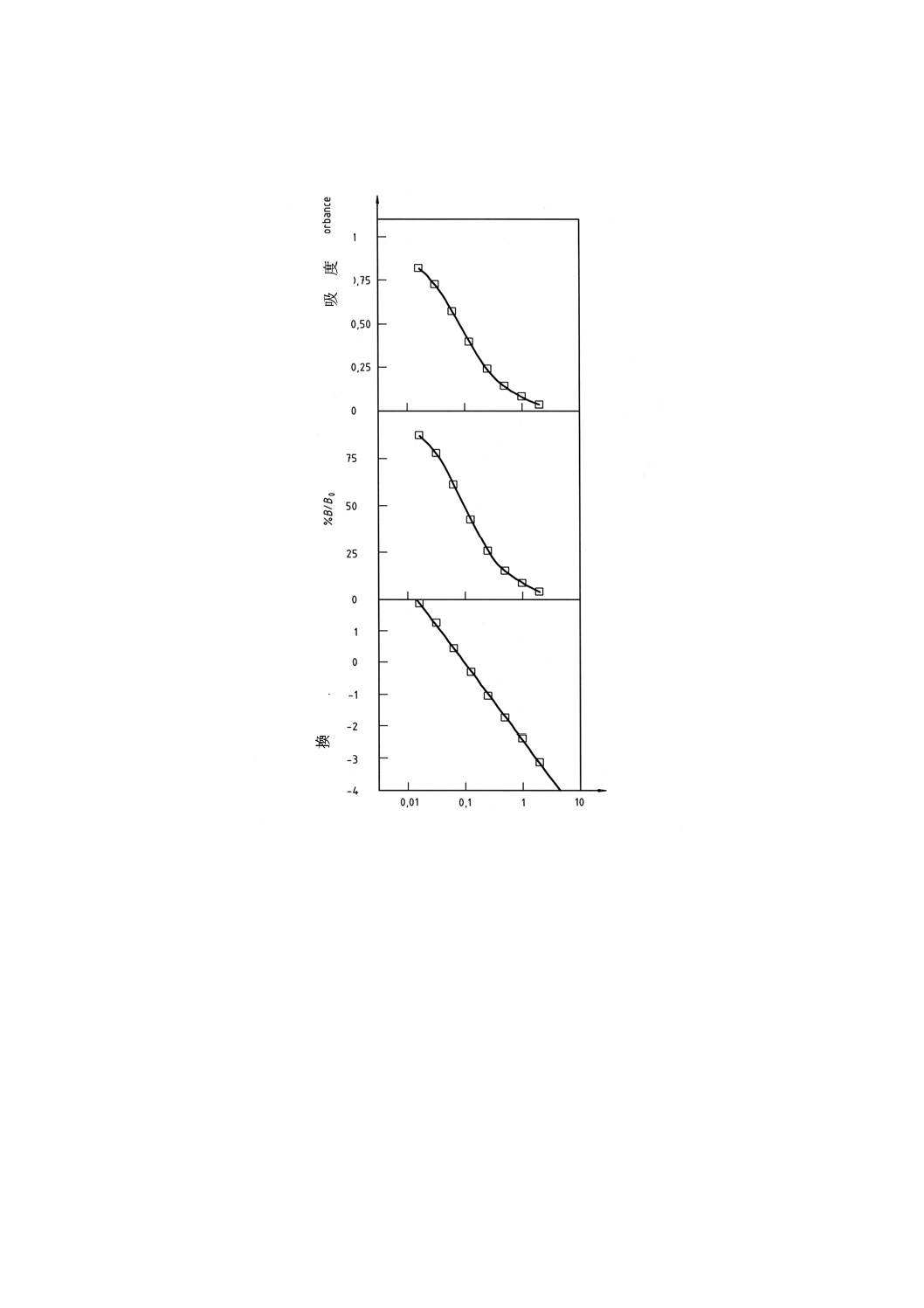
10
K 0461:2006
図 5 モノクローナル抗体(K4E7)(参考文献の[5]参照)の競合EIAで得られたアトラジンの標準曲線の一例
計算にはコンピュータープログラムが利用できる。
質量濃度の計算及び信頼区間についての詳細は,参考文献の[6]を参照。
分析対象成分の質量濃度は,四捨五入によって有効数字3けたで表す。
例 アトラジン 0.572 μg/L; 1.27 μg/L
μg/L
アトラジン
L
o
g
it
変換
値
吸
光
度
11
K 0461:2006
12. 精度 アトラジンのEIA分析を用いた免疫測定方法の性能の例を,附属書B(参考)に示す。これは,
異なった水試料における試験所間の実験結果である。
13. 検査報告書 検査報告書には,次の事項を詳細に明記する。
a) この規格の番号
b) 試料を特定するために必要な情報
c) 試料の前処理方法(必要な場合)
d) 9.3に規定する標準溶液(ゼロ標準を含む。)の検量線
e) 11.3の計算方法
f)
10.に規定する妥当性確認の表明
g) この手順からの逸脱及び結果に影響を及ぼしうるすべての状況の記述
h) 検査に用いられた抗体の交差反応性
i)
他の分析方法との比較結果
参考文献
[1] GEE S.J., HAMMOCK B.D. and SKERRITT J.H. Diagnostics for plant agrochemicals - a meeting of
chemistry and immunoassy. In: Biotechnology in Agriculture Series: New Diagnostics in Crop Sciences
(Skerritt, J.H.and Appels, R., eds.) CAB International, United Kingdom, 1995, pp. 243-276
[2] SHERRY J. Environmental chemistry: The immunoassay option. Crit. Rev. Anal. Chem., 23, 1992,pp.
217-300
[3] HOCK B. Enzyme immunoassays for pesticide analysis. Acta hydrochim. hydrobiol., 21, 1993,
pp.71-93MEULENBERG E.P., MULDER W.H. and STOKS P.G. Immunoassays for pesticides. Environ. Sci.
Technol., 29,1995, pp. 553-561
[4] MEULENBERG E.P., MULDER W.H. and STOKS P.G. Immunoassays for pesticides. Environ. Sci. Technol.,
29,1995, pp. 553-561.
[5] GIERSCH T. A new monoclonal antibody for the sensitive detection of atrazine with immunoassy in
microtiterplate and dipstick format. J. Agric. Food Chem., 41, 1993, pp. 1006-1011
[6] DUDLEY R.A., EDWARDS P., EKINS R.P., FINNEY D.J., MCKENZIE I.G.M., RAAB G.M.,
RODBARD D. and RODGERS R.P.C. Guidelines for immunoassay data processing. Clin. Chem., 31, 1995,
pp. 1264-1271
[7] HAYASHI Y., MATSUDA R., MAITANI T., IMAI K., NISHIMURA W., ITO K., and MAEDA M. Precision,
limit of detection and range of quantification in competitive ELISA. Analyt. Chem., 76,2004. pp. 1295-1301.

12
K 0461:2006
附属書A(参考)フローチャート及びピペッティング方法
この附属書は,本体に関連する事柄を補足するもので,規定の一部ではない。
免疫測定方法におけるフローチャート及びピペッティング方法を,附属書A図1及び表1に例示する。
↓
↓
↓
↓
↓
↓
↓
↓
附属書A図 1 免疫測定方法の一例のフローチャート
(エンドポイント法の場合)10〜30分間反応する
洗浄(結合していない成分を除去する)
酵素基質を加える
5〜60分間反応する
試料(又は標準物質)と酵素トレーサー混合液とを加える
抗体固相化担体 (例 マイクロプレート)
(エンドポイント法の場合)停止液を加える
シグナル強度を読みとる
結果を計算する

13
K 0461:2006
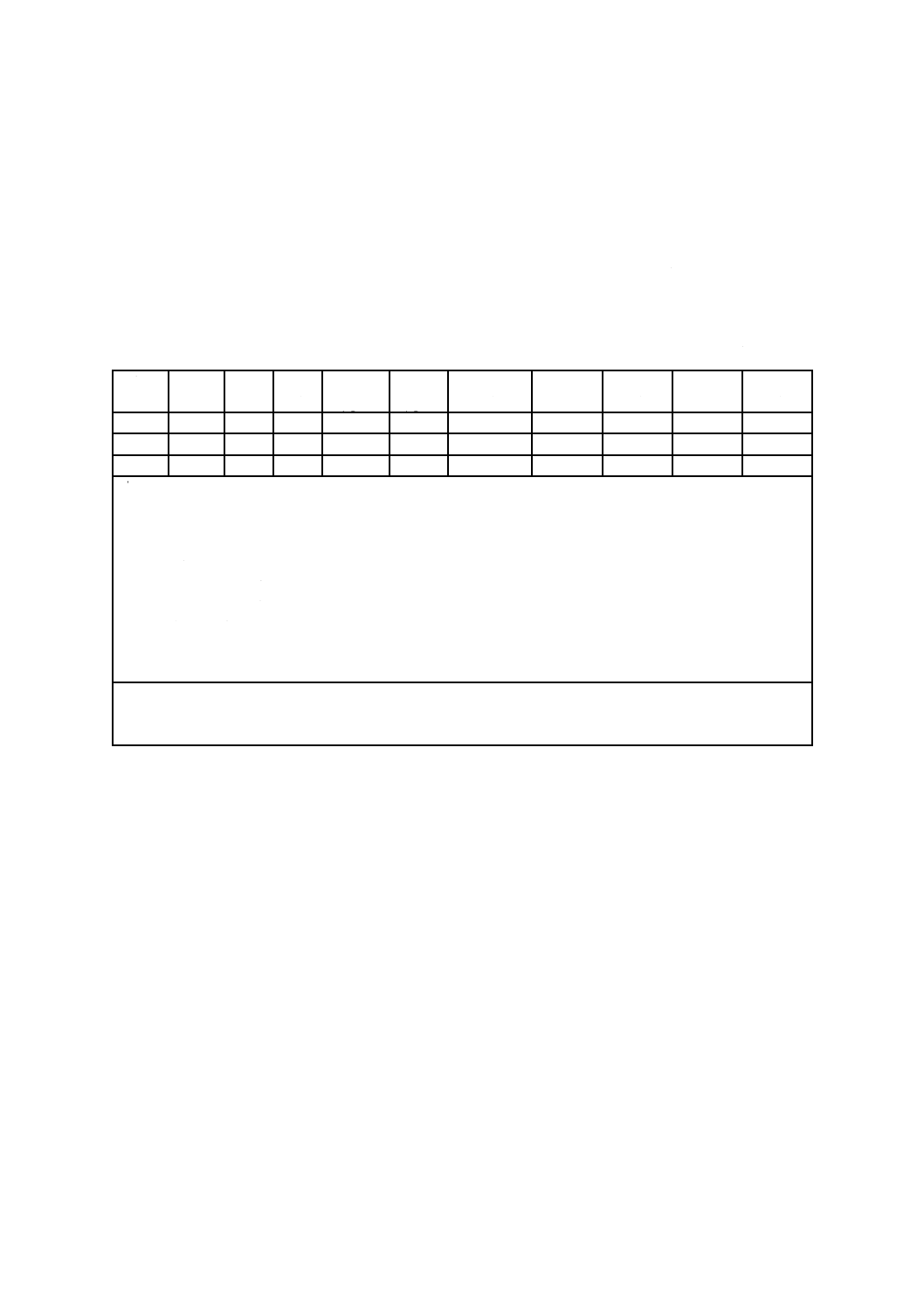
附属書A表 1 免疫測定方法におけるピペッティング方法の一例
(容量用法は各キットの添付文書の指示に従う。)
工程
加えるもの
容量
備考
1
標準物質又は試料
200 µl
プレコートウェル
2
標識物質
50 µl
30秒間かき混ぜ,1時間反応
3
―
―
マイクロプレート洗浄機を使用
4
洗浄液
300 µl (3x)
5
基質
200 µl
10〜30分間反応
6
反応停止液
(例えば,硫酸)
100 µl
7
―
―
吸光度を測定する。
14
K 0461:2006
附属書B(参考)試験室間試験から得られた精度データの一例
この附属書は,本体に関連する事柄を補足するもので,規定の一部ではない。
附属書B表 1には,3種の異なる水試料を用い,そのうちの2試料には分析対象の標準物質を添加し,
酵素免疫測定方法を用いて濃度を測定する,試験室間試験から得られた精度データを示す。
附属書B表 1 EIAを用いたアトラジン定量分析の試験室間試験から得られた精度データ
試料
l
n
o
%
x nom
μg/L
x
μg/L
回収率
%
σR
CVR
%
σr
CVr
%
1
15
56
11.1
―
0.003
―
0.001 6
52.8
0.006
18.9
2
15
57
9.5
0.130
0.125
95.8
0.0153
12.3
0.008
6.4
3
14
54
8.5
0.115
0.116
100.5
0.023 4
20.2
0.010 9
9.4
l 試験室数
n 測定値の数(外れ値を除いた後)
o 外れ値
xnom 名目上の真値
x 全平均値
σR 室間再現精度の標準偏差
CVR 室間再現精度の変動係数
σr 併行精度の標準偏差
CVr 併行精度の変動係数
試料1:飲料水
試料2:深い井戸から採取した地下水,0.130 μg/L添加
試料3:トンネル内の湧水,0.115 μg/L添加
15
K 0461:2006
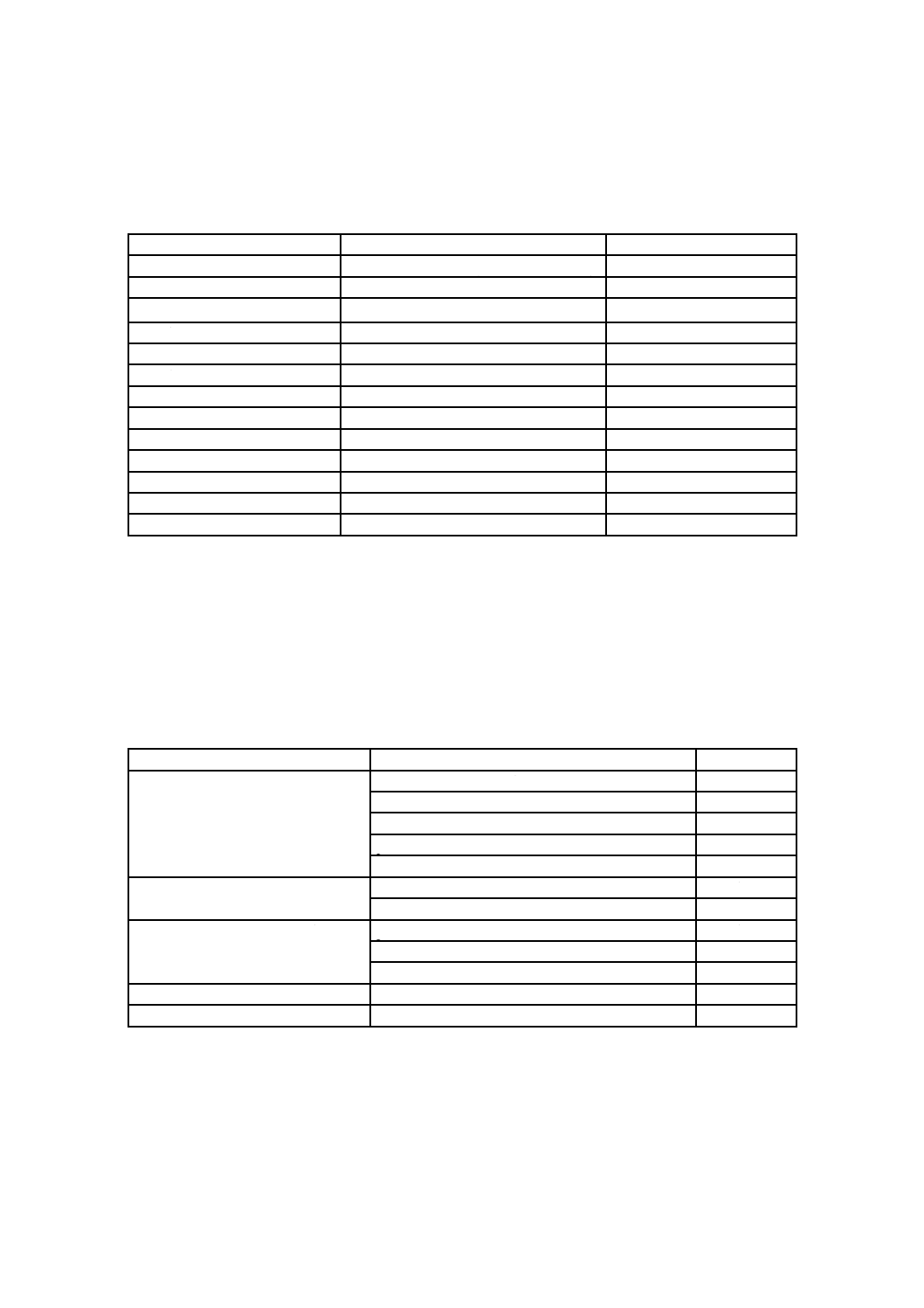
附属書1(参考)免疫測定方法(イムノアッセイ)の分類
この附属書は,本体に関連する事柄を補足するもので,規定の一部ではない。
免疫測定方法(イムノアッセイ)は附属書1図1のように分類される。
附属書1図1 免疫測定法(イムノアッセイ)の分類
非標識法とは,沈降性の抗原抗体結合物を濁度,光散乱,沈降線の有無などによって検出する方法であ
る。しかし,これらの方法は簡便ではあるが,多くの成分が共存している複雑な試料中の目的成分だけを
高感度に適用することはできない。
これに対し標識法は,標識された抗原抗体結合物又は標識体だけを測定する方法である。
均一(ホモジニアス)法とは,標識体,試料間で抗原抗体反応の結果,標識シグナルの増減によって,
抗原又は抗体を測定する方法である。不均一(ヘテロジニアス)法とは,何らかの方法で,抗原抗体結合
物(B)及び遊離体(F抗原だけ,又は抗体だけ)を分離後,B又はF画分の標識シグナルを検出することによ
って,非標識の抗原又は抗体を測定する方法で,現在,最も広く用いられている方法である。両者は,競
合法及び非競合法に大別される。
競合法とは,一定量の抗体に対して標識抗原と非標識抗原とを競合させ,B又はF画分の標識を検出す
る方法で,比較的低分子の分析対象物質に適用され,酵素イムノアッセイは,この典型的方法である。す
なわち,分析対象物質が存在しないときは一定量のシグナル強度を与え,分析対象物質の存在量に依存し
てシグナル強度が減少するいわゆる,右下がりの用量依存カーブが得られる。主としてステロイドホルモ
ンなどの低分子化合物の測定に用いられる。
一方,非競合法は,タンパク質,ペプチドホルモンなど比較的高分子の分析対象物質に適用され,分析
対象物質の存在量に依存してシグナル強度が増加する右上がりの用量依存カーブが得られる。現在,最も
多く用いられているのは標識法で,単にイムノアッセイというときは標識イムノアッセイを意味する。
非標識法
標識法
免疫測定方法
均一法
不均一法
非競合法
競合法
非競合法
競合法
(ホモジニアス)
(イムノアッセイ)
(ヘテロジニアス)
16
K 0461:2006
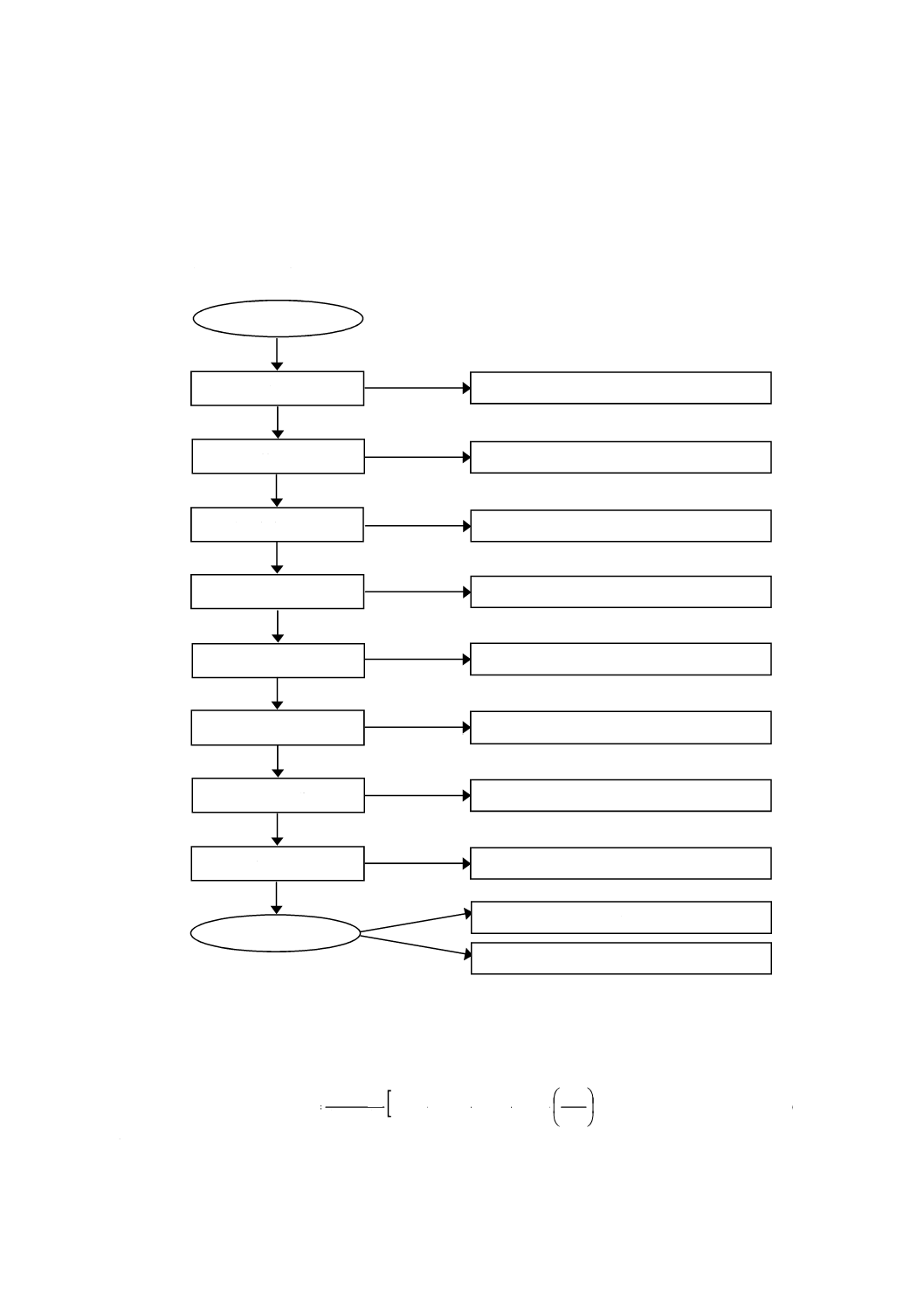
イムノアッセイに用いられる標識及びその検出法の例を,次の表に示す。
附属書1表1 イムノアッセイに用いられる標識及びその検出法の例
イムノアッセイ
標識物質
検出法
Ⅰ.ラジオイムノアッセイ
ラジオアイソトープ(3H,14C,125Iなど)
放射能
Ⅱ.非放射性イムノアッセイ
a.標識体を用いる方法
酵素イムノアッセイ
酵素,補酵素,酵素活性修飾物質
酵素活性
蛍光イムノアッセイ
蛍光物質
蛍光強度,蛍光偏向度など
発光イムノアッセイ
化学発光・生物発光物質
発光強度
スピンイムノアッセイ
遊離ラジカル物質
電子スピン共鳴
メタロイムノアッセイ
金属原子,金属イオン,Eu3+キレート
原始吸光,時間分解蛍光
粒子イムノアッセイ
金属コロイド粒子,ラテックス粒子
原子吸光,粒子数の計数
パイロイムノアッセイ
バクテリオファージ
溶菌数
b.標識しない方法
ネフェロイムノアッセイ
沈降反応
光散乱
イムノセンサー
電位変化
抗体(抗原)電極
放射性同位元素を標識に用いる方法を放射性イムノアッセイと呼ぶのに対して,それ以外の標識イムノ
アッセイを,非放射性イムノアッセイと呼ぶ。これらの内で,酵素イムノアッセイは,酵素反応による増
幅効果と検出法の組合せで,高感度化できる。酵素イムノアッセイに用いられている酵素及びその酵素活
性測定法の例を,次の表に示す。
附属書1表2 酵素イムノアッセイに用いられている酵素及びその酵素活性法の例
酵素
酵素活性測定用基質
測定法
ペルオキシダーゼ
テトラメチルベンチジン
吸光度法
o-フェニレンジアミン
吸光度法
ABTS*
吸光度法
p-ヒドロキシフェニルプロピオン酸
蛍光光度法
ルミノール/過酸化水素
化学発光法
β-D-ガラクトシダーゼ
o-ニトロフェニール-β-D-ガラクトシド
吸光度法
4-メチルウンベリフェリル-β-D-ガラクトシド
蛍光光度法
アルカリ性フォスファターゼ
p-ニトロフェノールりん酸
吸光度法
4-メチルウンベリフェリルりん酸
蛍光光度法
CSPD
化学発光法
りんご酸脱水素酵素
りんご酸/NAD+
紫外吸光度法
グルコース-6-りん酸脱水素酵素
グルコース-6-りん酸/NAD+
紫外吸光度法
注* ABTS:2,2ʼ-アジノ-ビス(3-エチル-ベンズチアゾリンスルホン酸)
17
K 0461:2006
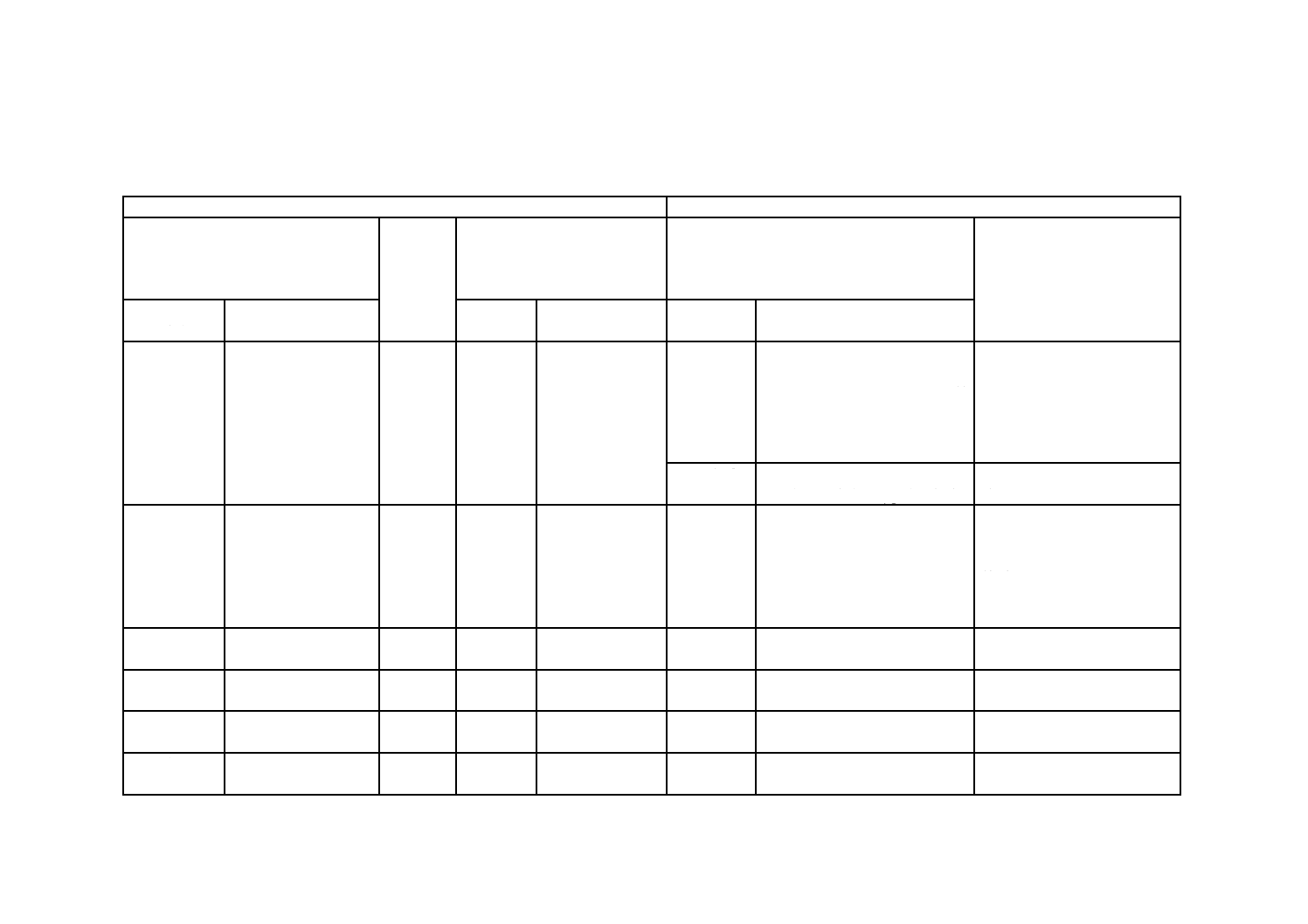
附属書2(参考)競合ELISAの誤差原因
この附属書は,本体に関連する事柄を補足するもので,規定の一部ではない。
次の図に抗体を用いた競合ELISA法の典型的な操作手順と誤差原因を示す。
附属書2図1 競合ELISA法の操作法の一例と要因
この競合ELISA法の測定値のCVをρTとすると,ρTの2乗は,分析対象成分濃度Xの関数として,
(
)[
]
2
W
2
S
2
B
2
X
2
G
2
2
2
T
+
+
+
+
+
=
Y
G
X
X
σ
ρ
ρ
ρ
ρ
ρ
································ (1)
と表せる。
測定
放置, 30分
第1抗体, 50μL
固相化第2抗体
サンプル, 50μL
標識抗原, 50μL
放置,3時間
洗浄,タッピング
反応基質, 100μL
反応停止液, 100μL
●分注量
●分注量
反応時間
残りの液量
●分注量
●分注量
分注量
反応時間
●ウェル自体の吸収
●検出器のノイズ
50 µl
50 µl
50 µl
100 µl
100 µl
18
K 0461:2006
ここに,
X: 分析対象成分の濃度(mg/L)
ρG,ρX: 標識抗原,分析対象物質の注入量(体積)の変動
係数(%)
ρB: 第1抗体の注入量(体積)の変動係数(%)
ρS: 反応基質溶液の分注量が吸光度測定値のばらつ
きに与える影響を表した変動係数(%)
ρS = (注入誤差の変動係数)×(2/3)
G: 標識抗原と分析対象物質とが等量あり,第1抗体
の50 %に標識抗原が結合するときの標識抗原の
濃度(mg/L)
W
σ: ウェル自体の吸光度の標準偏差
Y: 検量線の縦軸(測定値)
なお,測定値Yはすべて,ウェル自体の吸光度を差し引いた値である。図1のa)の縦軸(測定値の変動
係数ρT)は,
100
T
×
=
均
差し引いた測定値の平
ウェル自体の吸光度を
測定値のs
ρ
······················ (2)
と表してある。
19
K 0461:2006
附属書3(参考)JISと対応する国際規格との対比表
JIS K 0461:2005 競合免疫測定方法通則
ISO 15089:2000 水質―農薬の選択的免疫測定法の指針
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
1.適用範囲
試料中の競合免疫測
定方法を規定
ISO
15089
1
農薬類を対象とす
る,水試料の競合
免疫測定方法を規
定
MOD/変更
媒質を水質のみから土壌にも拡
張し,また測定対象物質を農薬類
からより広範囲な例示した物質
を対象とすることに変更。
媒質を広げるとともに,農薬だ
けを対象とすることは産業標
準化法になじまないため,より
重要な例示した物質を対象と
した。ISO規格の見直し時に提
案を検討。
MOD/削除
定量下限が実情に合わないため,
下限値の設定(0.05 μg/L)を削除。
ISO規格の見直し時に提案を
検討。
2.引用規格
2
JIS規格を追加及びISOを対応
JISに変更。水質だけではなく土
壌についても分析可能となるよ
う,サンプリング方法及び前処理
方法のISO規格を追加。
媒質を水に限定せずに,より広
く土壌も追加した。
ISO規格の見直し時に提案を
検討。
3.定義
3
用語定義JIS規格
を含まず。
MOD/追加
JIS規格が必要でありJIS K 3600
及びJIS K 3211を追加。
実質的な技術的差異はない。
3.1親和性
3.1
JISと同じ。
IDT
−
−
3.2分析対象
成分
3.2
substance
to
be
determined
MOD/変更
媒質を追加規定
実質的な技術的差異はない。
3.3抗体
3.3
JISと同じ。
IDT
−
−
1
9
K
0
4
6
1
:
2
0
0
5
20
K 0461:2006
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
3.4標識抗体
3.4
antibody covalently
linked to a label
MOD/変更
意味不明確であるため通常使用
される標識抗体を採用。
実質的な技術的差異はない。
3.5〜3.8
3.5〜3.8
JISと同じ。
IDT
−
−
3.9交差反応
性
備考1.
3.9
Selectivity(選択
性)
MOD/変更
Selectivityの意味不明確であるた
め通常使用される特異性
(specificity)を追加。
実質的な技術的差異はない。
備考2.
3.9
false positive(疑陽
性)
MOD/変更
false positiveだけでは意味が不明
確であり“高濃度として,又は偽
陽性として”に変更。
実質的な技術的差異はない。
3.10〜3.13
3.10〜3.13 JISと同じ。
IDT
−
−
3.14ハプテン
3.14
unless it is
covalently bound to
an immunogen(免
疫原)
MOD/追加
MOD変更
不明確なので“抗体との結合力は
あるが”を追加,免疫原をキャリ
アーたん(蛋)白質に変更。
実質的な技術的差異はない。
3.15ヘテロジ
ニアス免疫測
定法
3.15
detect
the
occupancy of
antibody
binding
sites by the analyte
MOD/変更
“トレーサーの抗体結合部位が
異なる占有部分を用いて”を追加
して明確化。し明確化。
実質的な技術的差異はない。
3.16〜3.22
3.16〜3.22 JISと同じ。
IDT
−
−
3.23標識抗原
−
定義無し。
MOD/追加
競合法で通常使用されるため定
義追加。
実質的な技術的差異はない。
3.24 女性ホ
ルモン
−
定義無し。
MOD/追加
測定対象物の定義追加。
ISO規格の見直し時に提案を検
討。
3.25 残留性
有機汚染物質
(POPs)
−
定義無し。
MOD/追加
測定対象物の定義追加。
ISO規格の見直し時に提案を検
討。
2
0
K
0
4
6
1
:
2
0
0
6
21
K 0461:2006
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
4.妨害
4
JISと同じ。
IDT
−
−
5.原理
5
JISと同じ。
IDT
−
−
6.試薬
6.1一般
6
6.1
deviate by more
than ± 10 %
MOD/削除
この記述は抗体が種々の異性体
に交差反応する場合には不適で
あり削除。
ISO規格の見直し時に提案
を検討。
6.2緩衝洗浄液
6.2
85g/l
MOD/変更
塩化ナトリウム濃度は明らかに
誤りであり変更。
ISO規格の見直し時に提案
を検討。
6.3,6.4
6.3,6.4
JISと同じ。
IDT
−
−
6.5標準物質
−
記載無し。
MOD/追加
標準物質の品質規定が必要であ
り追加。
ISO規格の見直し時に提案
を検討。
7.器具及び機器
7
JISと同じ。
IDT
−
−
8.サンプリング及び
試料調製
8.1サンプリング
附属書3(参考)
記載の方法でサ
ンプリングする
8
8.1
水試料に限定。
MOD/追加
土壌試料も追加。
当事者間の取り決めを追加。
ISO規格の見直し時に提案
を検討。
8.2固相のコーティ
ング
8.2
to
prepare
a
standard calibration
series
of
the
respective pesticide
MOD/変更
分析対象成分が複数となる場合
を考慮した表現に変更
実質的な技術的差異はない。
8.3酵素トレーサー
8.3
prepared
shortly
before use in a
suitable dilution
MOD/追加
凍結乾燥粉末として発売されて
いる例があるため“溶解”を追
加。
ISO規格の見直し時に提案
を検討。
8.4溶液
8.4
記載無し。
MOD/追加
添付溶液を希釈する例及び調製
不要な例があるため追加。
ISO規格の見直し時に提案
を検討。
2
1
K
0
4
6
1
:
2
0
0
5
22
K 0461:2006
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
8.5試料調製
8.5
all water samples,
in the range between
20 ℃ and 37 ℃,
in the range between
7,0 and 7,5
MOD/変更
水試料に限定しないため表現変
更。濃縮が必要な試料,最適温
度,最適pHが異なる例があるた
め表記を一般化。
ISO規格の見直し時に提案
を検討。
9.操作方法
9.1直接酵素免疫測
定方法
9.1.1結合反応
9.1
9.1.1
方法bの記載なし。
the water sample,
within 30 min to 60
min
MOD/変更
MOD/変更
方法bを記載しないことを明確
化。
前処理試料及び反応時間が異な
る例があるため表記を一般化。
ISO規格の見直し時に提案
を検討。
9.1.2,9.1.3
9.1.2
,
9.1.3
JISと同じ。
IDT
−
−
9.1.4変換された基
質の測定
9.1.4
JISと同じ。
IDT
−
−
9.1.5 直接免疫測定
法の例
9.1.5
記載無し。
MOD/追加
実例に即した表現に変更。
誤差原因のフロチャートを追
加。
ISO規格の見直し時に提案
を検討。
9.1.5.1結合反応
9.1.5.1
200μl,10μl,
10ml,1:1000,30s,
20 ℃, for 1 h
MOD/変更
実例に即し表現に変更。
実質的な技術的差異はない。
9.1.5.2洗浄操作
9.1.5.2
washed three times,
MOD/変更
実例に即した表現に変更。
実質的な技術的差異はない。
9.1.5.3酵素反応
9.1.5.3
200μl,10 min,
100μl,
MOD/変更
実例に即した表現に変更。
実質的な技術的差異はない。
2
2
K
0
4
6
1
:
2
0
0
5
23
K 0461:2006
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
9.1.5.4酵素活性測
定
9.1.5.4
450nm,between 1,0
and 1,5
MOD/変更
実例に即した表現に変更。
実質的な技術的差異はない。
9.2ゼロ標準の測
定
9.2
in the same way
MOD/変更
測定の意味を明確にする表現に
変更。
実質的な技術的差異はない。
9.3キャリブレー
ション
9.3
0μg/l; 0,03μg/l;
0,10μg/l; 0,30μ
g/l;1,0μg/l; 10μ
g/l; 1 000μg/l
MOD/変更
標準液の濃度例を削除して一般
化。
実質的な技術的差異はない。
10. 分析方法バリ
デーション
10.1〜10.3
10
10.1〜10.3
ISO/TR1350の引
用を削除し文言変
更
算出方法の記載無
し。
MOD/変更
MOD/追加
ISO/TR1350は水質に限定されて
いるため表現を変更。
定量範囲及び検出下限などの算
出方法を提案。
ISO規格の見直し時に提案
を検討。
10.4他の分析法と
の比較
−
記載無し。
MOD/追加
他の分析法との相関を明らかに
することが必要で追加。
ISO規格の見直し時に提案
を検討。
図1〜図4
−
記載無し。
MOD/追加
分析方法バリデーションの説明
に追加。
ISO規格の見直し時に提案
を検討。
11.計算
11.1くり返し
11.1
記載無し。
MOD/追加
精度プロファイルから決定でき
る旨を追加。
ISO規格の見直し時に提案
を検討。
11.2 B/Bo値の計算
11.2
JISと同じ。
IDT
−
−
B/Bo計算式
Eq.1
JISと同じ。
MOD/変更
分子のA0はAeの間違い。
A0の説明を追加。
実質的な技術的差異はない。
図5
Figure 1
JISと同じ。
MOD/変更
付番を整理。
実質的な技術的差異はない。
2
3
K
0
4
6
1
:
2
0
0
5
24
K 0461:2006
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体
表示方法:側線又は点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
12.精度
12
JISと同じ。
IDT
−
−
13.検査報告書
13
追加以外はJISと
同じ。
MOD/追加
他の分析方法との比較結果を追
加。
ISO規格の見直し時に提案
を検討。
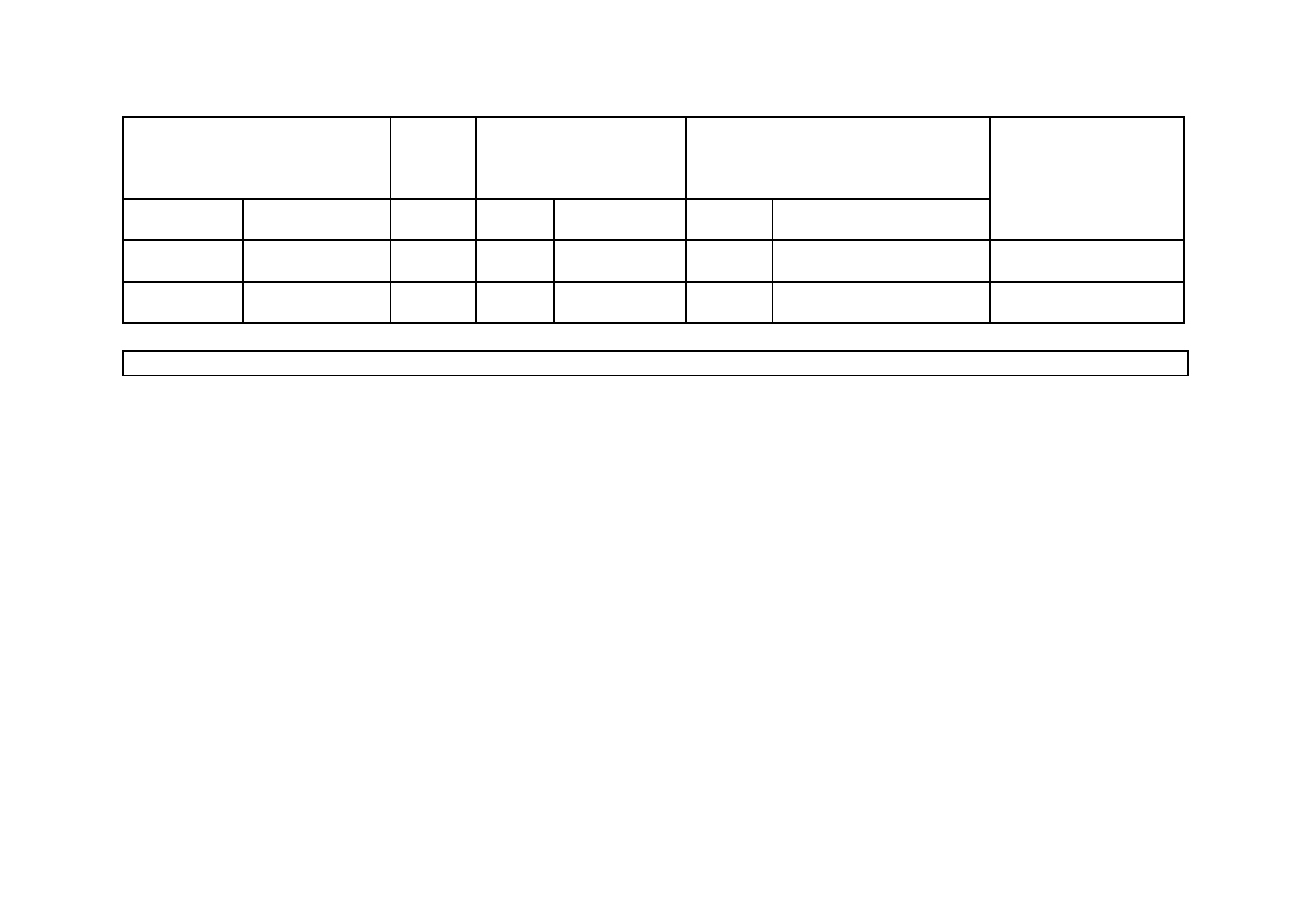
JISと国際規格との対応の程度の全体評価:MOD
備考1. 項目ごとの評価欄の記号の意味は,次のとおりである。
― MOD/削除……… 国際規格の規定項目又は規定内容を削除している。
― MOD/追加……… 国際規格にない規定項目又は規定内容を追加している。
― MOD/変更……… 国際規格の規定内容を変更している。
2.
JISと国際規格との対応の程度の全体評価欄の記号の意味は,次のとおりである。
― MOD…………… 国際規格を修正している。
2
4
K
0
4
6
1
:
2
0
0
5