2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
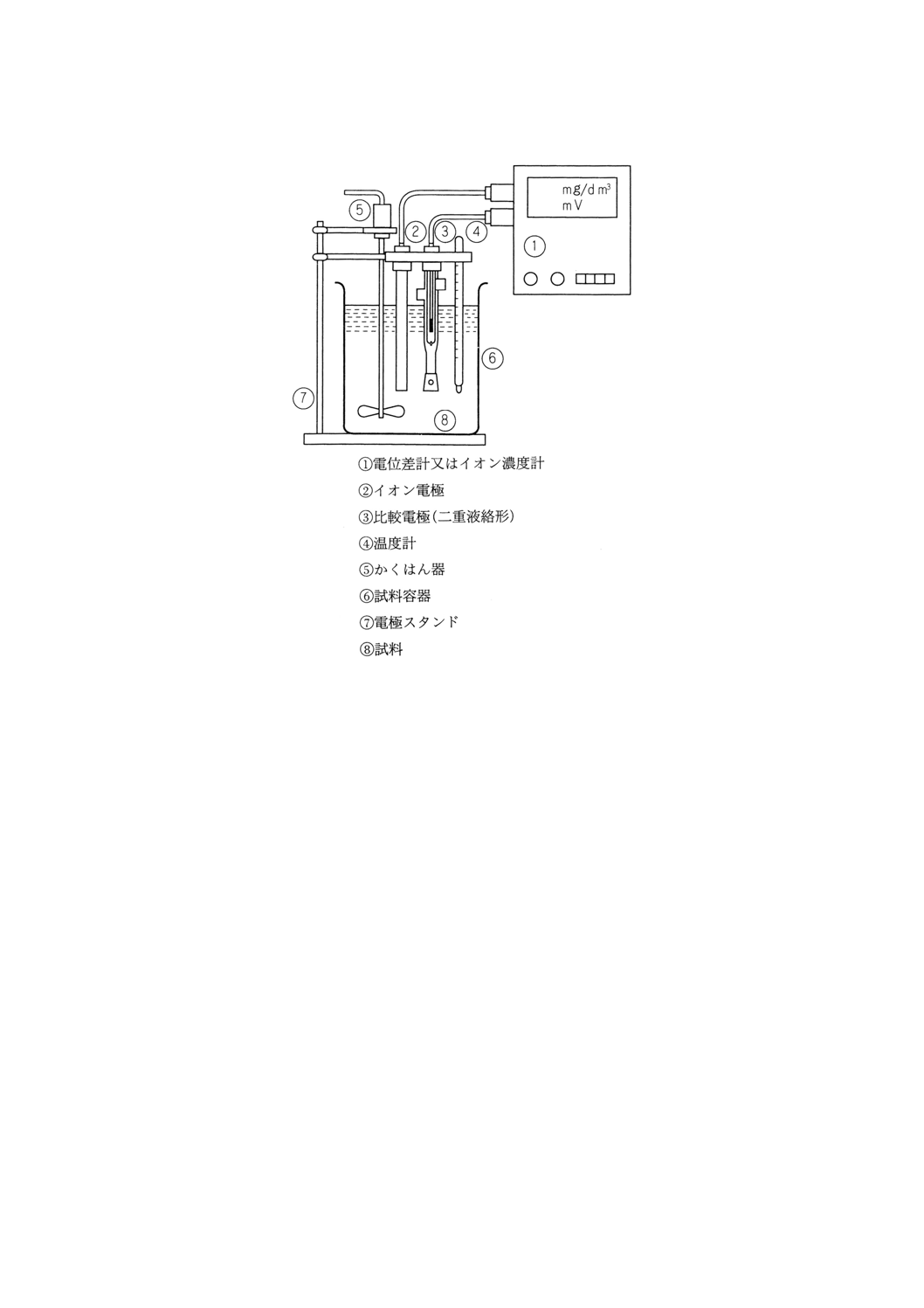
図1 イオン電極を用いるバッチ形測定装置の構成の一例
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 0122-1997
イオン電極測定方法通則
General rules for ion selective electrode method
1. 適用範囲 この規格は,イオン電極を用いて無機物又は有機物のイオン濃度を定量する一般的事項に
ついて規定する。ただし,pH測定方法には適用しない。
備考1. この規格の引用規格を,付表1に示す。
2. この規格の中で用いるdm3はlに,cm3はmlに等しい。
2. 共通事項 共通事項は,JIS K 0050による。
3. 用語の定義 この規格で用いる主な用語の定義は,以下のほか,JIS K 0211,JIS K 0213,JIS K 0215
に規定するものとする。
なお,括弧内の対応英語は参考のために示す。
(1) イオン電極 (ion selective electrode) 溶液中の特定イオンの活量に応答し,電位を発生する電極。イ
オン選択性電極ともいう。
(2) 活量 (activity) ある化学種の化学ポテンシャルに関連して与えられる一種の熱力学的質量モル濃度。
(3) 活量係数 (activity coefficient) ある化学種の活量と濃度の比で,化学種の理想的な挙動からのずれを
表す尺度。
(4) イオン強度 (ionic strength) 溶液中のイオン種Mのモル濃度をCM,イオン価をZMとするとき,
M
MC
Z
2
2
1∑
で与えられる値,又は質量モル濃度を用いて同様に定義される値。
(5) 応答電位 (response potential) 比較電極を対極としたときにイオン電極で測定される電位 (mV) 。
(6) 応答こう配 (response slope) 2種の標準液の濃度比が1けた異なる場合に測定される電位差(mV/10
倍濃度変化)。
(7) 応答時間 (response time) 応答電位が安定した一定指示値に達するまでの時間。
(8) 選択係数 (selectivity coefficient) 測定対象イオンの共存イオンによる影響の度合を実験的に求めた
値。
(9) 膜電極 (membrane electrode) 各種の選択性膜とその内部に設置された電極で構成される電極系。
備考 膜電極は選択性膜の内側に内部基準電極と電解質溶液とを設けて構成されることが多い。
(10) ガラス膜電極 (glass membrane electrode) Na2O-Al2O3-SiO2系,又はLi2O-Al2O3-SiO2系ガラス膜など
を感応膜としたイオン電極。
(11) 固体膜電極 (solid-state membrane electrode) 難溶性金属塩を主成分とする粉末を加圧成型した膜又
は難溶性金属塩の単結晶を感応膜としたイオン電極。
(12) 液体膜電極 (liquid membrane electrode) 液状イオン交換体などを脂溶性有機溶媒に溶かし高分子
物質に含浸させて感応膜としたイオン電極。
2
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(13) 隔膜形電極(ガス透過膜電極) (gas-selective membrane electrode) pH電極又はイオン電極と比較電
極を組み合わせ,内部液と共にガス透過膜で覆った特定のガス成分測定用の電極。
(14) 比較電極(参照電極) (reference electrode) 標準水素電極に対して電位が既知であって,電位が安
定している電極。イオン電極の電位を測定又は制御するために対極として用いられる。
(15) イオン濃度計 (ion meter) イオン電極を用いて溶液中のイオン種の濃度を測定する装置。
(16) イオン強度調整溶液 (ionic strength control solution) 溶液中のイオン強度を一定に保つ目的で加え
られる高濃度の電解質溶液。
4. 測定原理 イオン電極にはイオンに応答する感応膜があり,この感応膜部が試料溶液中の特定イオン
と接すると,そのイオン活量に応じた膜電位を生じる。試料溶液中に浸せきした比較電極をイオン電極の
対極として高入力抵抗の直流電位差計に接続し,両電極間の電位差を測定することによってこの膜電位が
測定されるが,このとき電位差計によって測定される相対電位を応答電位という。
応答電位Eと試料溶液中の測定対象イオン活量aとの間には式(1)の関係があり,これをネルンスト式と
いう。
a
ZF
RT
E
E
log
303
.2
0
+
=
······························································ (1)
ここで,EOは25℃での標準電極電位,Rは気体定数,Tは絶対温度,Zはイオンの価数,Fはファラデ
ー定数,logは常用対数である。式(1)中の2.303RT/ZFをネルンスト定数と呼び,イオン活量が10倍変化
した場合のこの定数値を理論応答こう配という。例えば,25℃での理論応答こう配は1価のイオンで
59.16mV,2価のイオンで29.58mVである。イオン活量aとイオン濃度Cの間には,活量係数をγとして式
(2)に示す関係があるが,一般に全イオン濃度が10-3 (mol/dm3) 以下の低濃度溶液においては,活量と濃度
はほぼ等しい(γ≒1)と考えてよい。
C
aγ
=
····················································································· (2)
イオン電極を用いた測定では,式(1)は実際に測定される応答こう配S及び濃度Cを用いて式(3)のように
表す。
C
S
E
E
log
0
+
=
······································································· (3)
通常イオン電極を利用する測定においては,濃度の異なる複数の既知濃度溶液によってあらかじめイオ
ン濃度Cと応答電位Eとの関係を式(3)によって求めておくことで,試料溶液中のイオン濃度Cを応答電
位Eから決定することができる。
5. 装置 電圧増幅器と表示部を備えた高入力抵抗の直流電位差計,イオン濃度計などによって水溶液中
のイオン濃度をイオン電極とその対極に比較電極を用いて測定する。
5.1
装置の概要 測定装置は,電位差計又はイオン濃度計,イオン電極,比較電極,試料容器,かくは
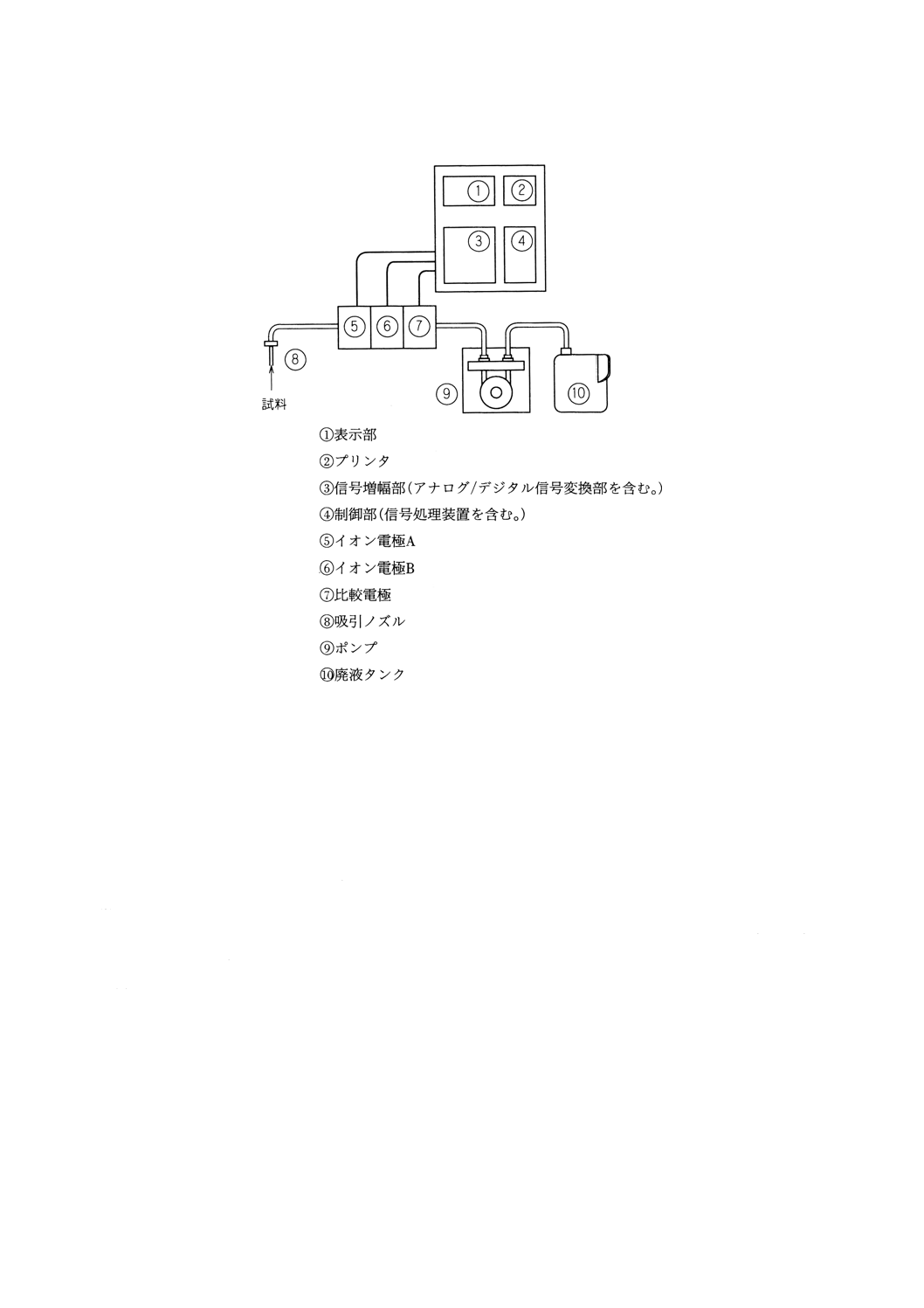
ん器などからなる。その基本構成の一例を図1(バッチ形)と図2(フロー形)に示す。

2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図1 イオン電極を用いるバッチ形測定装置の構成の一例
4
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図2 イオン電極を用いるフロー形測定装置の構成の一例
5.2
測定装置
(1) 形式
(a) 電位差計 イオン電極の応答電位を測定するための高入力抵抗(1012Ω以上)の直流電位差計。応答
電位は作図又はデータ処理によってイオン濃度に変換する必要がある。
例えば,ディジタルpH-mV計,拡大目盛付きpH-mV計などがある。
(b) イオン濃度計(イオンメータ) イオン電極の応答電位を測定して,濃度目盛に変換する機能をも
つ装置。
例えば,アナログ式又はディジタル式イオン濃度計(mg/dm3,mol/dm3目盛付)などがある。
(2) 用途
(a) 実験室用又は携帯用 ナトリウムイオン,ふっ化物イオン,シアン化物イオンなどを測定する専用
のイオン濃度計がある。
(b) イオンモニタ用 シアン化物イオンモニタ,塩化物イオンモニタ,ふっ化物イオンモニタ,ナトリ
ウムイオンモニタなどの専用モニタ又は水質自動監視装置に組み込まれている各種イオンモニタな
どがある。
(c) 臨床検査用 血液などの検体検査用として自動分析装置などに組み込まれている。
血液中のナトリウムイオン,カリウムイオン,塩化物イオン,カルシウムイオン,リチウムイオ
ンなどの測定可能な自動分析装置がある。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(d) フローインジェクション分析装置用 フローインジェクション分析法 (FIA) の検出器として用い
て,イオン濃度定量を行う。
(e) 排ガスモニタ用 排ガス中の成分測定に用いる。塩化水素ガスモニタなどがある。
5.3
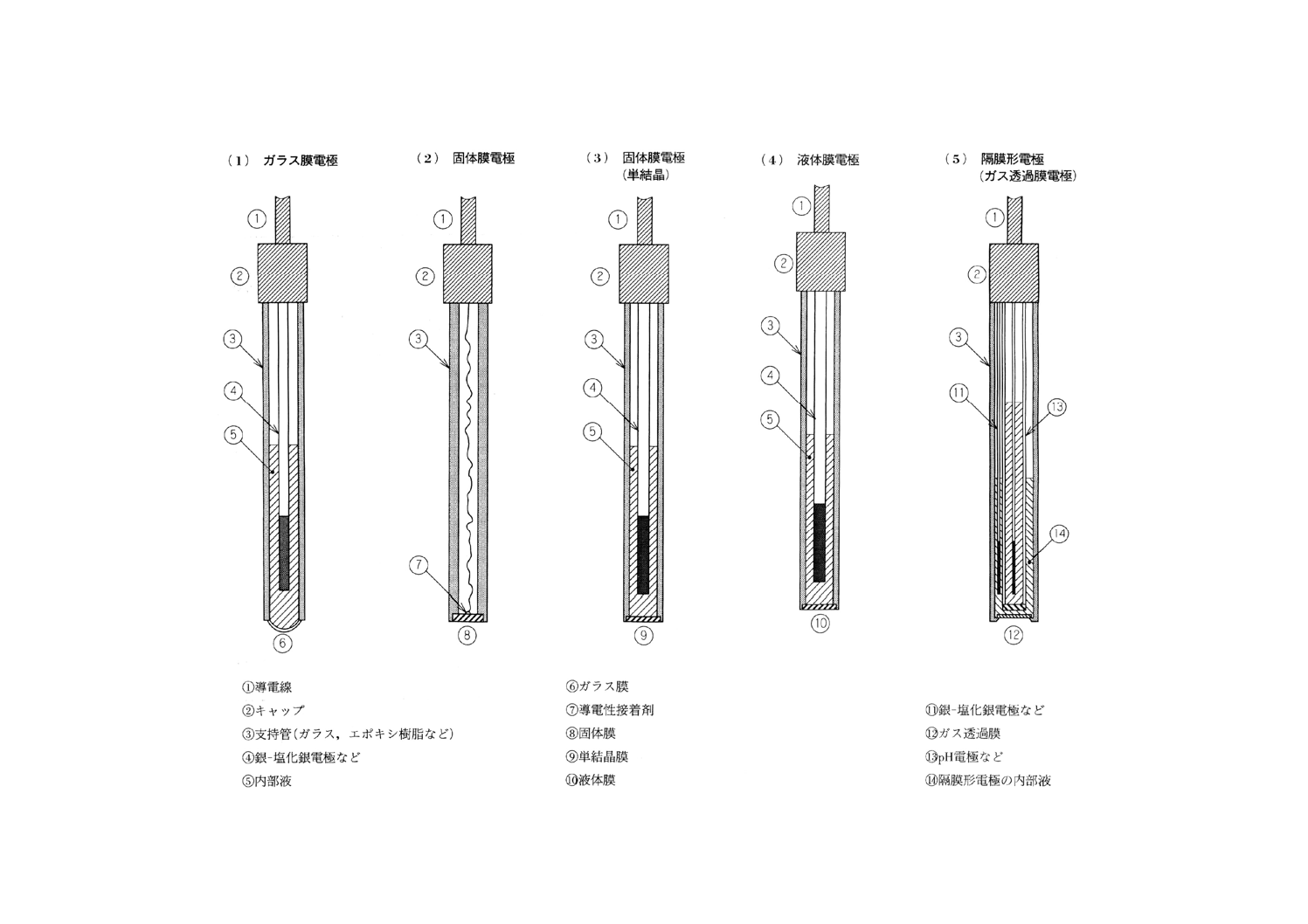
イオン電極の種類 イオン選択性があり,イオン濃度に応じた電位を生じる膜をもった電極で,そ
の感応膜の種類によってガラス膜電極,固体膜電極,液体膜電極,隔膜形電極に分類する。主なイオン電
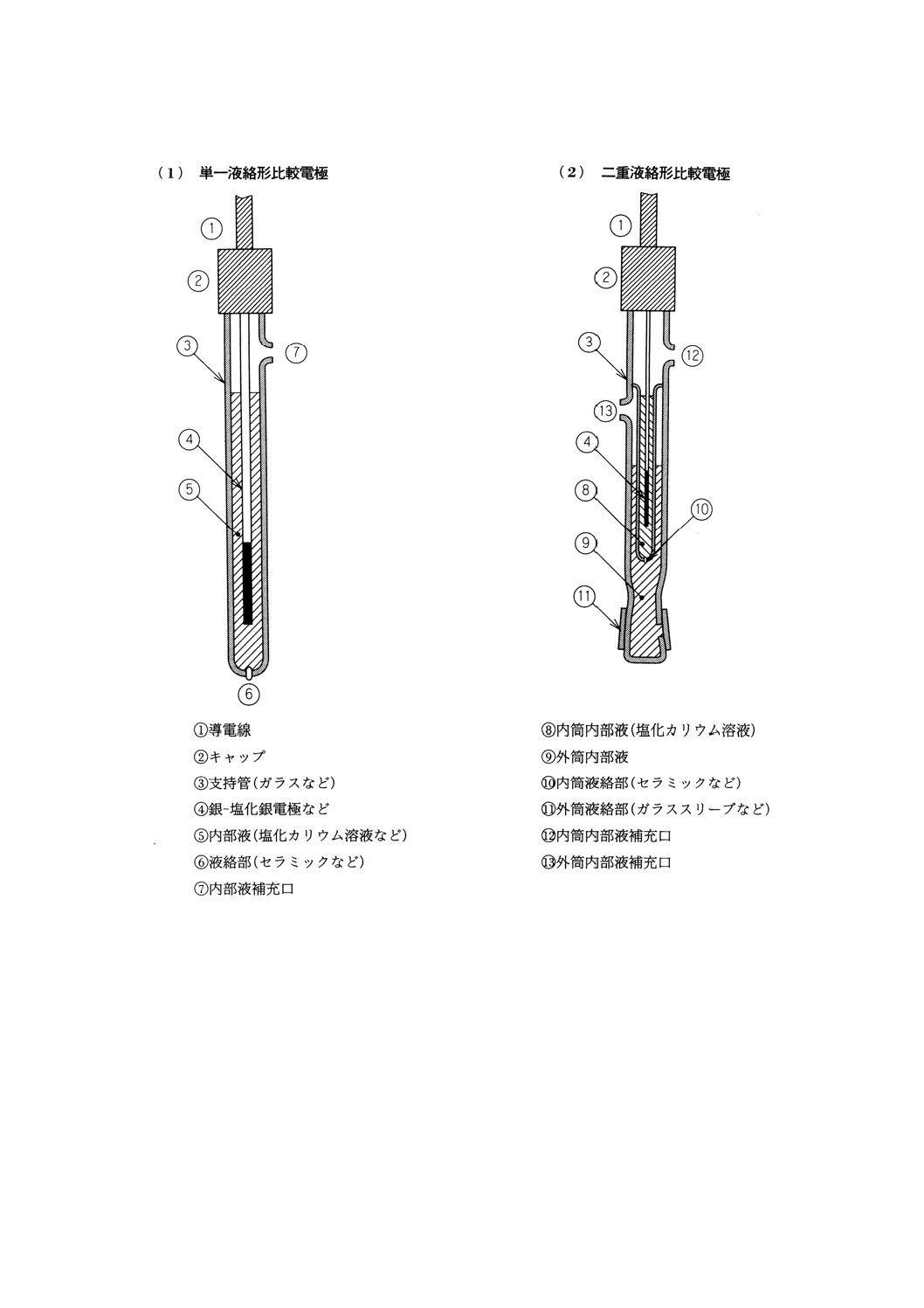
極の種類の例を表1に,構造の例を図3に示す。
5.4
比較電極の種類 電極の形状によって単一液絡形,二重液絡形などがあり,内部には銀−塩化銀電
極又はカロメル[水銀−塩化水銀 (1) 電極]などが使われる。液絡部の形状によってスリーブ形,セラミ
ック形などがある。主な比較電極の構造例を図4に示す。
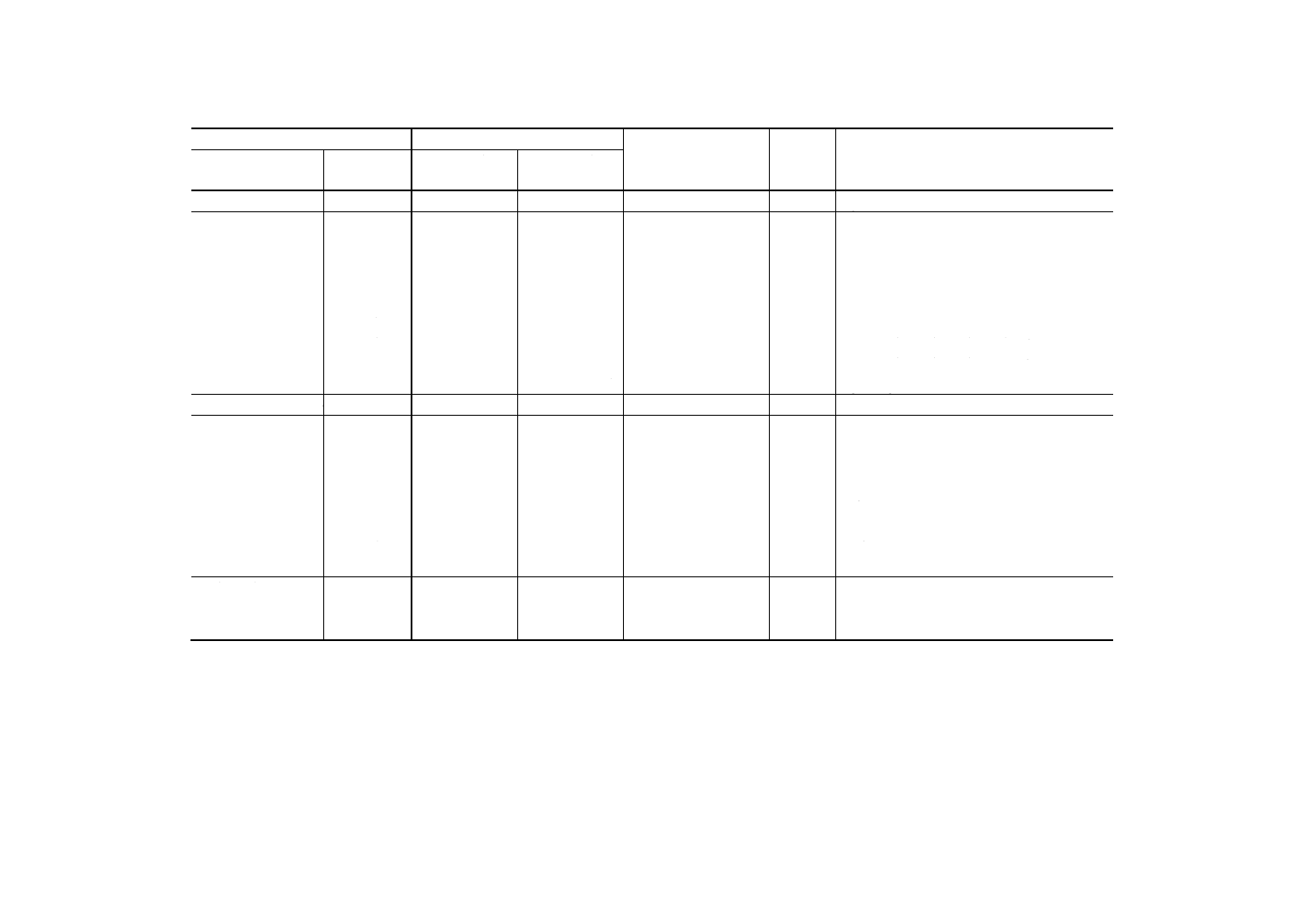
6
K
0
1
2
2
-1
9
9
7
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1 イオン電極の種類の一例
使用するイオン電極
おおよその定量範囲
応答こう配
S
(mV/10倍濃度変化)
測定pH
範囲
妨害を与える主なイオン
電極の形式
電極の種類
mg/dm3
mol/dm3
ガラス膜電極
Na+
0.2〜 23 000
10−5〜100
50〜 60
6〜11
Ag+, H+
固体膜電極
Cl−
2〜 35 000
5×10−5〜100
−50〜−60
2〜11
S2−, CN−, S2O32−, Br−
Br−
0.1〜 80 000
10−6〜100
−50〜−60
2〜12
S2−, CN−
I−
0.1〜 13 000
10−6〜10−1
−50〜−60
3〜12
S2−, CN−
CN−
0.03〜 260
10−6〜10−2
−50〜−60
11〜13
S2−, I−
S2−
0.03〜 32 000
10−6〜100
−25〜−30
13〜14
Ag+
0.01〜 100 000
10−7〜100
50〜 60
2〜 9
Hg2+
Pb2+
0.2〜 20 000
10−6〜10−1
25〜 30
4〜 7
Hg2+, Ag+, Cu2+, Fe3+, Cd2+, Cl2
Cd2+
0.01〜 11 000
10−7〜10−1
25〜 30
3〜 7
Hg2+, Ag+, Cu2+, Fe3+, Pb2+, Cl2
Cu2+
0.01〜 6 000
10−7〜10−1
25〜 30
3〜 7
Hg2+, Ag+
固体膜電極(単結晶)
F−
0.02〜 20 000
10−6〜100
−50〜−60
5〜 8
Al3+, Fe3+, Ca2+, OH−
液体膜電極
Cl−
3〜 3 500
10−4〜10−1
−50〜−60
3〜10
ClO4−, I−, Br−, NO3−
NO3−
6〜 6 000
10−4〜10−1
−50〜−60
3〜10
ClO4−, I−
Li+
0.1〜 700
10−5〜10−1
50〜 60
3〜10
K+, Na+, Cs+
Na+
0.2〜 20 000
10−5〜100
50〜 60
3〜10
K+
K+
0.4〜 4 000
10−5〜10−1
50〜 60
3〜10
Cs+
NH4+
0.2〜 18 000
10−5〜100
50〜 60
4〜 8
K+, Na+
Ca2+
0.4〜 4 000
10−5〜10−1
25〜 30
5〜 8
Zn2+
2価陽イオン
0.4〜 4 000
10−5〜10−1
25〜 30
5〜 8
隔膜形電極
NH3
0.03〜 170
2×10−6〜10−2
−50〜−60
11〜13
揮発性アミン
(ガス透過膜電極)
CO2
4〜 440
10−4〜10−2
50〜 60
0〜 4
NO2, SO2, CH3COO−
NO2
0.2〜 460
5×10−6〜10−2
50〜 60
0〜 1
CO2, CH3COO−
7
K
0
1
2
2
-1
9
9
7
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図3 イオン電極の構造の一例
8
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図4 比較電極の構造の一例
9
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
6. 測定
6.1
試料採取 測定対象とする試料の状況を判断して,試料を採取する。試料の測定目的を十分考慮し
て,採取の日時,場所,採取回数などを決定する。採取容器の材質は,容器からのイオン混入のおそれの
ないプラスチック(ポリエチレン,ポリテトラフルオロエチレンなど)がよい。
採取した試料は,できるだけ速やかに試験に供さなければならない。
なお,水質の測定に当たり試料の保存,運搬が必要な場合には,JIS K 0094による。
6.2
試料溶液の調製 一般に測定結果に影響を与えるような妨害イオンを含むときは,蒸留や錯化など
の操作によって妨害イオンを測定系から除去又はマスキングした後,pH及びイオン強度をできるだけ調整
して分析用の試料溶液とする。
また,必要に応じて,希釈,濃縮,抽出などの前処理を行う。試料以外の水はJIS K 0557に規定する
A2以上の純度のものを使用する。pHはJIS Z 8805に適合した電極を用いて,JIS Z 8802に従って測定す
る。
6.3
測定準備
(1) 試薬 試薬は,該当する日本工業規格がある場合には,その種類の最上級又は適切な用途のものを用
い,該当する日本工業規格がない場合には,試験に支障のないものを用いる。
(2) 標準液の調製 測定対象イオンを含む試薬の必要量を容器にとり,水又は必要な試薬を加えて溶かし,
全量フラスコに移し入れた後,水又は必要な試薬を標線まで加える。これを原液とする。
原液は,保存中に分解などによってイオン濃度が変化するものがあるので注意する。原液を適宜希
釈し,測定の検量に用いる標準液を調製する。
また,イオン濃度の変化の激しいものは,使用の都度,原液から調製する。
(3) イオン電極 イオン電極は,良好な状態で保存したもの又は再生処理を行って十分に安定化したもの
を使用する。イオン電極の一般的な使い始め,保存,再生,取扱い上の注意の例を表2に示す。
(4) 比較電極 比較電極は,良好な状態で保存したものを使用する。
また,二重液絡形の比較電極は内筒及び外筒内部液を新しくするなどの保守を行ってから使用する。
比較電極の一般的な使い始め,保存,再生,取扱い上の注意の例を表2に示す。比較電極は,使用中
に内部液(塩化カリウム溶液等)が少しずつ流出して試料溶液に混入するので,測定に支障を起こさ
ないような内部液を選択する必要がある。塩化カリウム溶液以外の内部液を使用する場合は,一般に
二重液絡形の比較電極を使用する。それぞれのイオン電極を使用する際に用いる二重液絡形比較電極
の外筒内部液の種類の例を表3に示す。
1
0
K
0
1
2
2
-1
9
9
7
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表2 イオン電極及び比較電極の使い始め,保存,再生,取扱い上の注意の一例
電極の形式
使い始め
保存(短期)
再生
取扱い上の注意
ガラス膜電極
水又は薄い標準液に数時間浸
す。
水でよく洗ってから薄い標準液
に浸しておく。
ガラス膜に付着した汚れは,中性洗剤を
しみ込ませたスポンジ等で洗い落とし,
よく水洗する。
感応膜のガラス膜は破損しやすいので衝撃
を与えない。内部液が空にならないように
する。
固体膜電極
感応膜を1200番程度の研磨紙で
研磨し,水又は薄い標準液に数
時間浸す。
水でよく洗ってから薄い標準液
に浸しておく。
感応膜を1200番程度の研磨紙で研磨し,
よく水洗する。
イオン電極の中では比較的丈夫であるが,
感応膜に固いものを当てない。
固体膜電極
(単結晶)
水又は薄い標準液に数時間浸
す。
水でよく洗ってから薄い標準液
に浸しておく。
感応膜に付着した汚れは,エタノールを
しみ込ませた脱脂綿等でふき取り,よく
水洗する。
感応膜はきずがっくと特性が劣化するの
で,固いものを当てない。内部液が空にな
らないようにする。
液体膜電極
水又は薄い標準液に数時間浸
す。
水でよく洗ってから薄い標準液
に浸しておく。
濃い標準液に数時間浸すか,新しい感応
膜に交換する。
感応膜は柔らかいゲル状なので,指や物で
触れないようにする。内部液が空にならな
いようにする。
隔膜形電極
(ガス透過膜電極)
水又は薄い標準液に数時間浸
す。
水でよく洗ってから薄い標準液
に浸しておく。
内部液又はガス透過膜を交換する。
ガス透過膜は薄膜なので,指や物を押し付
けたりきずつけたりしない。内部液が空に
ならないようにする。
比較電極
(単一液絡形)
セラミック液絡部を水でよく洗
浄する。
セラミック液絡部にキャップを
し,内部液補充口に栓をする。
セラミック液絡部を水でよく洗浄し,内
部液を交換する。
セラミック液絡部は清浄に保つ。内部液が
空にならないようにする。
比較電極
(二重液絡形)
外筒内部液を新しいものに交換
して,スリーブを適度に締める。
内筒内部液補充口に栓をする。 外筒は水でよく洗って,新しい外筒内部
液を入れる。
内筒内部液は交換する。
スリーブをきつく締めすぎないようにす
る。内部液が空にならないようにする。

11
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表3 二重液絡形比較電極の外筒内部液の種類の一例
使用するイオン電極
比較電極の外筒内部液
電極の形式
電極の種類
ガラス膜電極
Na+
1mol/dm3塩化アンモニウム溶液
固体膜電極
Cl-
1mol/dm3硝酸カリウム溶液
Br-
1mol/dm3硝酸カリウム溶液
Ag+
1mol/dm3硝酸カリウム溶液
Pb2+
1mol/dm3硝酸カリウム溶液
液体膜電極
Cl-
1mol/dm3酢酸リチウム溶液
NO3-
0.5mol/dm3塩化カリウム溶液
Li+
1mol/dm3塩化アンモニウム溶液
Na+
1mol/dm3酢酸リチウム溶液
K+
1mol/dm3酢酸リチウム溶液
NH4+
1mol/dm3酢酸リチウム溶液
6.4
測定方法
6.4.1
絶対検量線法 イオン電極を用いたイオン濃度測定における最も一般的な方法である。イオン電極
を比較電極と共に試料溶液に浸したときに生じる両電極間の電位差(イオン電極の応答電位)を測定し,
検量線を用いて測定対象イオン濃度を求める。この方法では,検量線の作成に用いる標準液の組成と試料
溶液の組成が類似していなければならない。必要な場合には,標準液と試料溶液にイオン強度調整溶液を
加え,イオン強度を等しくして測定をする。
測定対象イオンが錯体を形成している場合には,錯体解離剤溶液の添加,又はpHの調整などによって
錯体を解離させた後に測定する。以下に,測定操作方法の一例を示す。
(1) 測定対象イオンの濃度が段階的に異なっている数個の検量線作成用の標準液を調製する。標準液の原
液を段階的にとり,それぞれを全量フラスコに入れ,イオン強度調整溶液の一定量を加える。必要が
あれば,pH緩衝液,錯体解離剤溶液を加える。その後,水を標線まで加え,これらを検量線作成用の
標準液とする。
(2) イオン電極と比較電極との先端部を十分に水洗いした後,付着した水分をふき取る。
(3) イオン電極及び比較電極を電位差計に接続し,(1)で調製した最も低濃度の標準液に電極を浸し,かき
混ぜながら,電位差計で応答電位が安定した後,電位を読み取る。
(4) 順次,高濃度の標準液について電位の測定を行う。
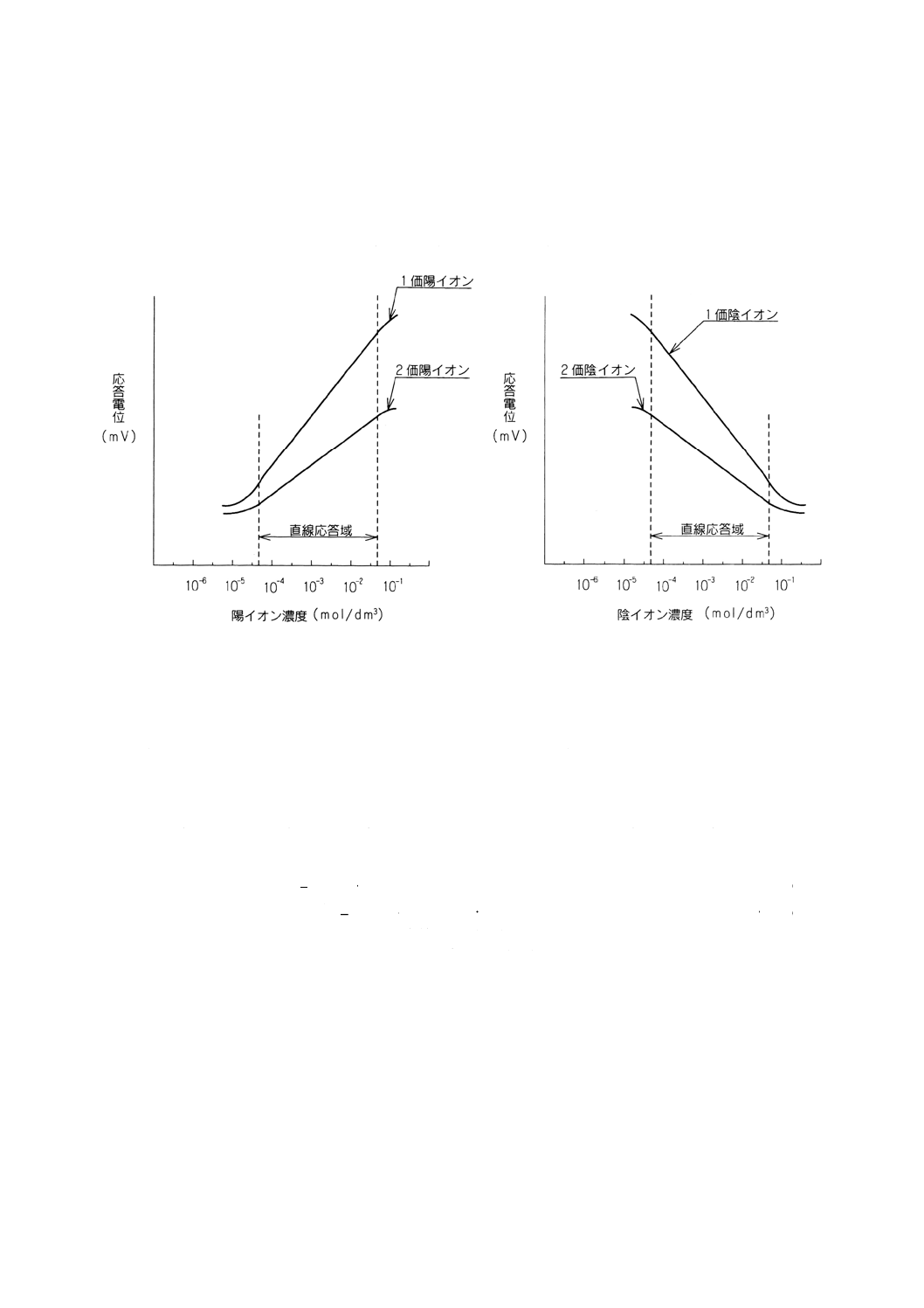
(5) 横軸に標準液の濃度の対数を,縦軸に測定された電位を取り,検量線を作成する。又は片対数方眼紙
の対数軸に標準液の濃度を,均等軸に応答電位を取り,検量線を作成する。検量線の一例を図5に示
す。
(6) (2)の操作を行った後,試料溶液についてイオン強度調整溶液を加え応答電位を測定する。必要があれ
ば試料溶液に,pH調整溶液又は錯体解離剤溶液を加える。
(7) (5)の検量線からイオン濃度を求める。この場合,図5の例に示す直線応答域内で定量することが望ま
しい。
備考1. 測定対象イオン濃度が非常に低くなると,検量線の直線性が失われてくる。この場合は次の
ようにして測定を行ってもよい。
試料溶液に低濃度の標準液を一定量添加し,検量線の直線部でイオン濃度を求め,標準液
の添加によるイオン濃度の増加分を差し引いて試料溶液の測定対象イオン濃度を求める。
12
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2. 測定値がイオン濃度で表示されるイオン濃度計(バッチ形のイオン濃度計,イオンメータや
フロー形の臨床検査用自動分析装置など)を用いるときは上記(3)から(7)の操作で検量線を作
成する代わりに,2種類のイオン濃度の異なる標準液を用いて電位差計の校正を行った後,
試料溶液の測定対象イオン濃度を求める。
図5 絶対検量線法による検量線の一例
6.4.2
標準添加法
(1) 一般法 試料溶液に標準液を一定量添加し,添加前後の応答電位の変化量を測定してイオン濃度を求
める。この方法は既知量添加法とも呼ばれ,試料溶液中の共存成分の影響などによって試料溶液に対
する応答こう配が理論応答こう配と異なる場合にも適用できるが,標準液及び試薬の添加前後で測定
対象イオンについての活量係数が変化しないこと,また測定対象イオンが錯体を形成する場合は,錯
体形成の度合いが変化しないことが必要である。
以下に操作方法の一例を示す。
試料溶液中の測定対象イオン濃度をx,標準液を添加したときの測定対象イオン濃度の増加量をm,
そのときの応答電位の変化量を⊿Eとすると,次の二つの式が成立する。
x
S
E
E
log
0
+
=
········································································ (4)
)
(
log
0
m
x
S
E
E
E
+
+
=
+⊿
························································· (5)
ここに,
E: 応答電位 (mV)
EO: 標準電極電位 (mV)
⊿E: 応答電位の変化量 (mV)
S: 応答こう配
x: 測定対象イオン濃度 (mol/dm3)
m: 測定対象イオン濃度の増加量 (mol/dm3)
13
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(4)及び(5)の式から試料溶液の測定対象イオン濃度 (x) は,次の式で表すことができる。
m
x
S
ΔE
×
−
=
1
10
1
/
······································································ (6)
ここに,
A
S
ΔE
=
−1
10
1
/
·········································································· (7)
このAの値を換算係数という。したがって,測定対象イオン濃度の増加量 (m) に対する応答電位の
変化量(∆E)を測定し,式(6)を用いて試料溶液の測定対象イオン濃度が求められる。測定操作の一例
を次に示す。
(a) 6.4.1(1)〜(5)の操作を行って検量線を作成する(1)。
(b) ビーカーに試料溶液の一定量VOcm3をとり,イオン強度調整溶液を一定量加え(2),更に水を加えて
100cm3とし,応答電位を測定し,(a)で作成した検量線を用いて測定対象イオンのおおよその濃度を
求める。
(c) この濃度の100〜1 000倍の濃度の標準液を調製する(3)。
(d) 三つの100cm3全量フラスコのそれぞれに試料溶液の一定量VOcm3をとり,それぞれにイオン強度調
整溶液を一定量加える(2)。
(e) 各々の全量フラスコに(c)で調製した標準液をそれぞれ1cm3,2cm3,3cm3加え,水を標線まで加え
る。
(f) ビーカーに全量フラスコ中の液を移して応答電位を測定し,(b)で測定した応答電位を差し引いたそ
れぞれの応答電位の変化量(∆E1, ∆E2, ∆E3)を求める。
(g) (a)で作成した検量線から試料溶液のおおよその濃度付近の応答こう配Sを求め(4),式(7)によって応
答こう配 (S) と応答電位の変化量(∆E1, ∆E2, ∆E3)に該当する換算係数 (A1, A2, A3) を求める。
(h) 次の式によって試料溶液の測定対象イオン濃度 (x) を算出する。
0
1
1
V
C
A
x
S
×
=
············································································· (8)
0
2
2
2
V
C
A
x
S
×
=
··········································································· (9)
0
3
3
3
V
C
A
x
S
×
=
········································································· (10)
)
(
3
1
3
2
1
x
x
x
x
+
+
=
···································································· (11)
ここに,
x1, x2, x3: 標準液を1cm3,2cm3,3cm3加えたときの測定対象イ
オン濃度 (mol/dm3)
A1, A2, A3: 標準液を1cm3,2cm3,3cm3加えたときの換算係数
CS: 標準液の濃度 (mol/dm3)
VO: 試料溶液の量 (cm3)
x: 試料溶液の測定対象イオン濃度 (mol/dm3)
注(1) 試料溶液の測定対象イオンのおおよその濃度を求めるための検量線であるから,測定の都度作
り直す必要はない。
14
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(2) 試料溶液の塩濃度が高い場合は,イオン強度調整溶液は添加しなくてもよい。
また,この調整溶液1〜2cm3の添加で試料溶液のイオン強度及びpHが所定の値となるように
調整する。
(3) 高濃度標準液の濃度は,対象イオンが1価イオンの場合,(f)の応答電位の変化量⊿E1の値が20
〜60mV,2価イオンの場合は10〜30mVとなるように選ぶ。
(4) 試料溶液の濃度が低く,検量線の直線域外にあるときは,試料溶液のおおよその濃度が中間の
濃度となり,しかも濃度比が10倍になるような2種類の標準液を調製し,それぞれの応答電位
を測定し,その差を応答こう配 (S) とする。
備考 上述の既知量添加法とは逆に,試料溶液中の測定対象イオンと定量的に反応してイオン濃度を
低下させる試薬を一定量添加し,添加前後の応答電位の変化量を測定して,イオン濃度を求め
る方法(既知量削減法)もある。そのほかに,試料溶液を標準液に加えて,その標準液におけ
る応答電位の変化を測定する方法(試料添加法)がある。
(2) グランプロット法 イオン電極の応答電位Eから計算した10E/Sと測定対象イオン濃度Cが直線関係
にあることを利用して測定対象イオン濃度を求める方法である。ただし,10E/Sと測定対象イオン濃度
Cの直線関係は,イオン電極の応答こう配が一定である範囲で成立する。
この方法は,(1)一般法に示された特徴に加え,イオン電極の応答こう配の一定性が確認でき,検量
線法のような標準液の調製と検量線の作成が不要なため,操作が比較的簡単となる特徴がある。
試料溶液(測定対象イオン濃度:x)VOcm3に濃度CSの標準液VScm3を添加後の応答電位Eは,次
の式で求められる。
+
+
+
=
S
S
S
V
V
V
C
xV
S
E
E
0
0
0
log
······················································· (12)
ここに,
E: 応答電位 (mV)
EO: 標準電極電位 (mV)
S: 試料溶液中の応答こう配
x: 測定対象イオン濃度 (mol/dm3)
VO: 試料溶液の量 (cm3)
CS: 標準液の濃度 (mol/dm3)
VS: 標準液の添加量 (cm3)
k=10Eo/Sとして式(12)を変形すると
)
(
10
)
(
0
/
0
S
S
S
E
S
V
C
xV
k
V
V
+
=
+
···················································· (13)
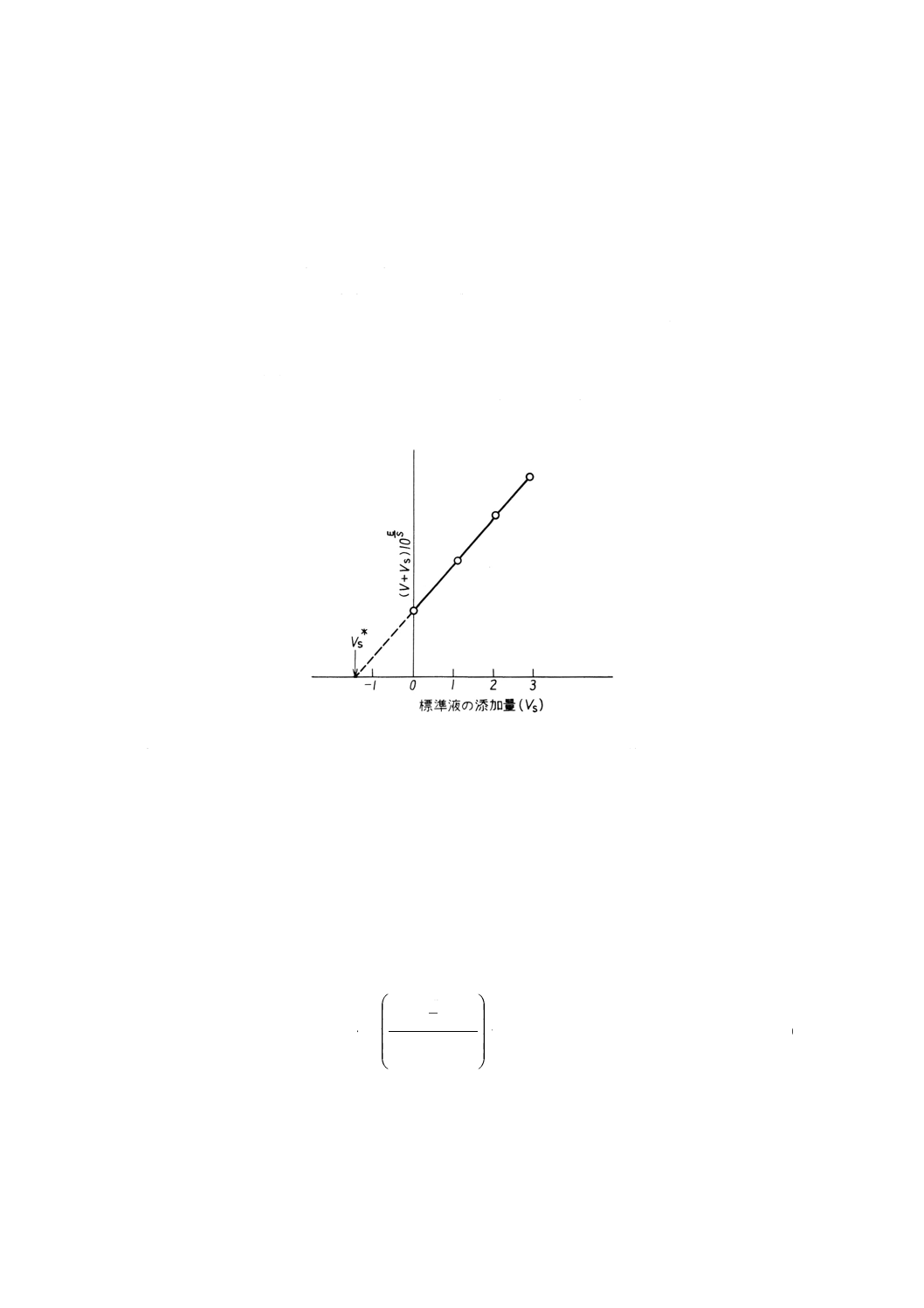
となる。複数の標準液の添加量 (VS) と (VO+VS) 10E/Sとの関係を図示すると,これらを結ぶ線は直
線となる。この直線を延長して横軸と交わる点の値をVS*とすると次の式によって測定対象イオン濃
度 (x) が求められる。
0
100
V
V
V
C
x
S
S
×
×
−
=
·································································· (14)
ここに,
x: 試料溶液の測定対象イオン濃度 (mol/dm3)
VS*: 標準液の添加量 (VS) と (VO+VS) 10E/Sのそれぞれを結ぶ直
線を延長して横軸と交わる点の値 (cm3)
CS: 標準液の濃度 (mol/dm3)
VO: 試料溶液の量 (cm3)
V: イオン強度調整溶液を一定量加えた溶液の量 (cm3)
15
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
測定操作の一例を次に示す。
(a) 6.4.1(1)〜(5)の操作を行って検量線を作成する(1)。
(b) 容量100cm3の全量フラスコに試料溶液の一定量VOcm3を入れ,イオン強度調整溶液を一定量加え(2),
更に水を加えて100cm3とする。
(c) 全量フラスコ中の溶液をビーカに移し,応答電位を測定し,(1)で作成した検量線を用いて測定対象
イオンのおおよその濃度とその濃度付近の電位こう配 (S) を求める。
(d) この濃度の100〜1 000倍の濃度の標準液を調製する。
(e) (3)のビーカに(4)で調製した標準液を添加量が1cm3,2cm3,3cm3,… (VS) となるように数回加え,
そのたびに応答電位 (E) を測定する。
(f) 標準液の添加量 (VS) と (V+VS) 10E/Sとの関係から,これらを結ぶ直線を延長して横軸と交わる点
の値 (VS*) を求め,式(14)から,試料溶液の測定対象イオン濃度 (x) を算出する。
図6 グランプロット法の標準添加法への応用の一例
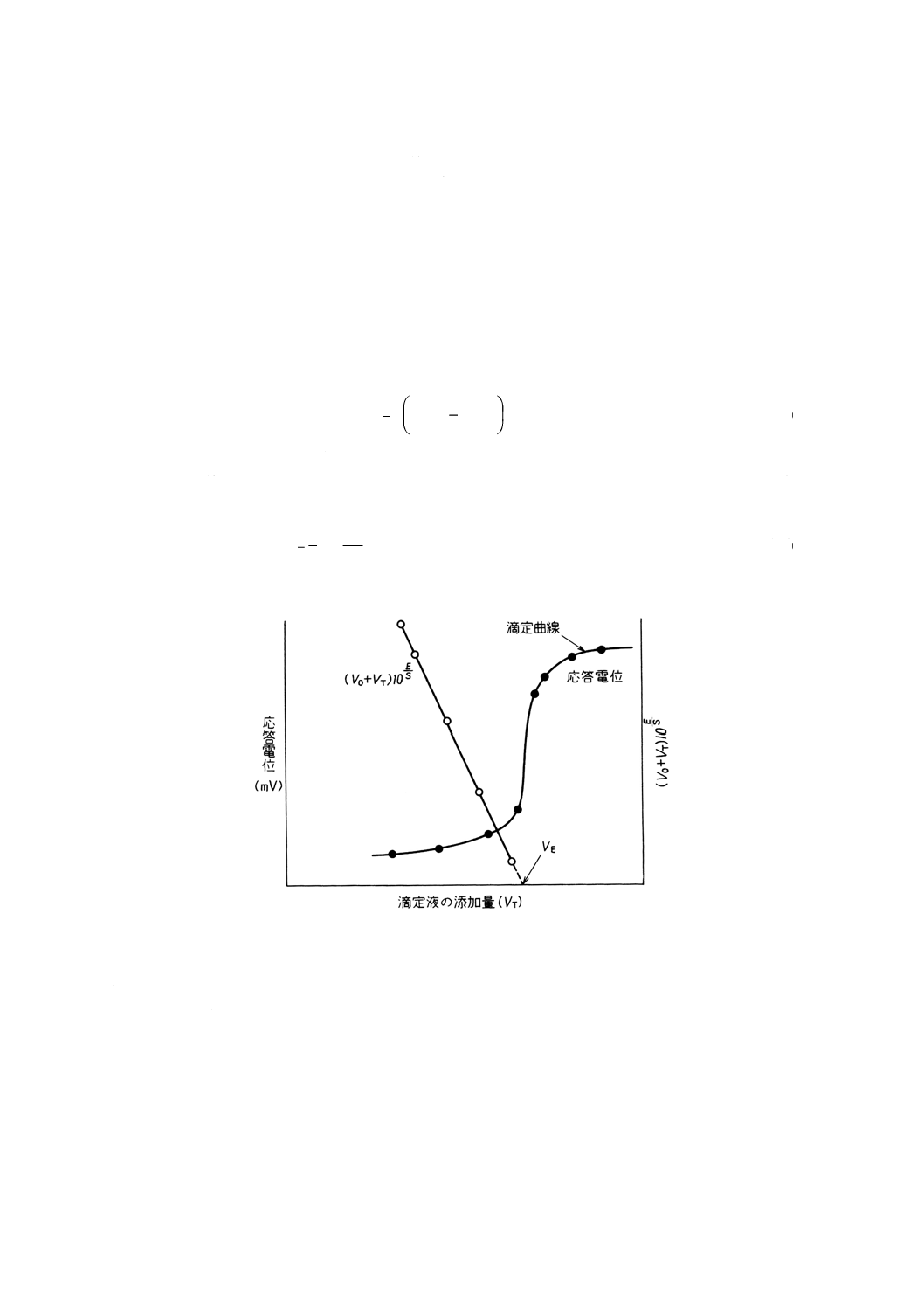
6.4.3
電位差滴定法
(1) 一般法 イオン電極を指示電極として用い,滴定用溶液で滴定し,滴定曲線を作成して終点を決定し,
終点までに要した滴定用溶液の体積から測定対象イオンを定量分析する方法である。イオン選択性の
あるイオン電極を用いるので,一般に終点付近における応答電位の変化率が大きく,終点の決定が容
易である特徴がある。測定操作は,JIS K 0113による。
(2) グランプロット法 自動電位差滴定装置の普及によって使われる機会が少ないが,希薄溶液の電位差
滴定のように,終点付近の応答電位の変化率が小さい場合の終点決定などに使われる。
Iを測定対象イオン,Tを滴定試薬とし,滴定反応をaI+bT=IaTb(a,bは正の整数)とすると,試
料溶液(測定対象イオン濃度x)VOcm3に滴定液(濃度CT)をVTcm3加えたときの応答電位は,次の
式で求められる。
+
−
+
=
T
T
T
V
V
V
C
b
a
xV
S
E
E
0
0
0
log
···················································· (15)
16
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ここに,
E: 応答電位 (mV)
EO: 標準電極電位 (mV)
S: 試料溶液中の応答こう配
x: 測定対象イオン濃度 (mol/dm3)
VO: 試料溶液の量 (cm3)
VT: 滴定液の添加量 (cm3)
CT: 滴定液の濃度 (mol/dm3)
a: 滴定反応における化学量論数
b: 滴定反応における化学量論数
k=10Eo/Sとして式(15)を変形すると
−
=
+
T
T
S
E
T
V
C
b
a
xV
k
V
V
0
/
0
10
)
(
················································ (16)
となる。滴定液の添加量 (VT) と (VO+VT) 10E/Sとの関係を図示すると,これらを結ぶ線は直線とな
る。この直線を延長して横軸と交わる点の値VE (cm3) は終点に相当し,次の式によって測定対象イオ
ン濃度 (x) を求める。
0
V
V
C
b
a
x
E
T
=
··········································································· (17)
図7 グランプロット法の電位差滴定法への応用の一例
7. 測定上の注意
7.1
測定範囲 イオン電極によるイオン濃度の測定範囲は,通常上限は10-1mol/dm3程度から下限は10-4
〜10-7mol/dm3の範囲である。
なお,この方法の適用下限は,イオン電極の種類や構造によって異なるので,標準液を用いて下限近く
における再現性を確認しておかなければならない。
17
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
7.2
イオン強度 活量係数はイオン強度の影響を受けて変動し,測定誤差の原因となるので,試料溶液
のイオン強度を一定に保つ必要がある。その対策としては,測定対象イオンと反応せず応答電位に影響を
与えない,いわゆる無関係塩を添加する方法がある。この無関係塩の種類や添加量は,対象イオンの種類
や濃度によって異なる。
7.3
応答時間 イオン電極の応答時間は,電極の種類,構造,イオンの種類,濃度,イオン強度等によ
って異なる。
イオン濃度が低濃度の測定から高濃度の測定に移る場合の応答時間は比較的に短いが,逆の場合は長く
なる傾向がある。
また,定量下限近くでは,応答時間は一般に長くなり数分間以上を要する。
7.4
pHの影響 イオン電極の種類と構造によって,使用可能なpHの範囲が決まっている。この範囲は,
対象イオン濃度が低くなるにつれて,一般に狭くなる。
また,イオン電極の感応膜の成分が酸や塩基によって溶けたり,検量線が平行移動する場合もある。こ
れらの影響を避けるためには測定時の試料溶液のpHをなるべく一定に保つとよい。
7.5
温度の影響 イオン電極で測定された応答こう配は,試料溶液の液温の影響を受けるので,検量線
作成用の標準液の液温と試料溶液の液温を等しくしておかなければならない。
また,試料溶液がかくはん器のモーターなどの外部の機器から温度の影響を受けないように測定を行う。
7.6
かくはんの影響 試料溶液のかくはん状態は,イオン電極による電位測定に対して,応答電位,応
答速度,定量下限の変化となって影響を与える。この影響を避けるには,測定の妨害とならない範囲で,
一定の速さでかくはんしながら測定することが必要である。
7.7
光の影響 イオン電極の中には,光の影響を受け応答電位が変化するものがあるので,このような
イオン電極を用いるときには,褐色ビーカーなどを用いて光を避けることが必要である。
7.8
共存イオンの影響 イオン電極は,ある特定なイオン種に対して選択的に応答する電極であるが,
すべての共存イオンの影響を受けない理想的な電極はない。したがって,イオン電極方法を利用する場合
には,共存イオンによる妨害の影響を熟知しておく必要がある。共存イオンによって,測定される応答電
位に影響がある場合には,その影響を避ける対策をとらなければならない。
応答電位に与える共存イオンの影響は,イオン感応膜の構成物質と共存イオンの相互作用や反応性から
予想することができる。例えば,固体膜電極の場合には,感応膜の構成物質と難溶性の沈殿物を作ったり,
錯塩を形成するおそれのある共存イオンは,測定の妨害となる。液体膜電極の場合には,感応膜中の成分
と安定なイオン会合体又は錯イオンを形成するおそれのある共存イオンは,測定の妨害となる。
一般に,試料溶液中に含まれる測定対象イオンの応答電位に及ぼす共存イオンの妨害の程度は,選択係
数
)
(
,
potN
M
k
によって表示される。選択係数は,測定対象イオン (M) に対して妨害イオン (N) をどのくらい
選択的にイオン電極が認識するのかを示す指標である。通常,この値の大きさによってイオン電極のイオ
ン選択性に関する性能が評価され,小さい方が妨害イオンの影響を受けにくい。この選択係数
)
(
,
potN
M
k
の求
め方については,参考 イオン電極の性能試験,5.選択係数の項を参照のこと。

18
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
7.9
測定精度 イオン濃度の変化率に対するイオン電極の電位変化の関係は,次の式(18)によって与えら
れる。
1
10
)
/
303
.2
/(
−
=
ZF
RT
ΔE
C
ΔC
·························································· (18)
したがって,1mVの電位変化は,25℃で1価イオンの場合には3.97%,2価イオンの場合には8.22%の
濃度誤差を生じることになるので,イオン電極による測定では少なくとも1mVまで読み取ることのできる
電位差計を使用して電位測定は正確に行う必要がある。
また,ネルンスト式 (1) から計算される応答こう配は,液温が10℃変化すると,測定イオンが1価の場
合には約2mV,測定イオンが2価の場合には約1mV変化するので一定温度で測定する必要がある。以下
にその例を示す。
表4 温度と理論応答こう配の関係
単位mV/10倍濃度変化
温度℃
10
20
25
30
40
50
1価イオン
56.18
58.16
59.16
60.15
62.13
64.11
2価イオン
28.09
29.08
29.58
30.07
31.07
32.06
実際の応答こう配は,理論応答こう配とは多少異なるが,イオン電極測定方法は,わずかな電位変化に
よって誤差を生じやすい測定法であるので十分注意して操作を行う。使用するイオン電極については,標
準液を用いて繰返し性(再現性)を求め,定量上限及び定量下限を確認しておくこと。
なお,得られた測定値の精度は,JIS Z 8402によって求める。
8. 安全衛生 一般の化学分析における安全衛生に準じて,安全衛生の管理を行うこと。
また,標準液や測定後の試料溶液の廃棄に当たっては,法律や条例などを遵守し,環境への影響につい
て十分に配慮すること。
9. 個別規格に記載すべき事項 イオン電極測定方法を定量分析法として採用する個別規格には,次の事
項を記載しなければならない。ただし,必要がなければその一部を省略してもよい。
(1) 定量方法の種類
(2) 測定対象イオン及び適用濃度範囲
(3) イオン電極の種類,感応膜の構成
(4) 比較電極の種類及び液絡部の形状と液絡方法
(5) 試料溶液の調製方法(共存妨害イオンとその影響の除去方法,イオン強度調整溶液及びpH調整溶液
の種類と添加の量など)
(6) 測定条件(かくはんの有無,測定温度など)
(7) 使用した標準液と調製方法
(8) 分析結果の表示(イオン名,定量値。定量値は,g/dm3,mg/dm3,μg/dm3,mol/dm3,mmol/dm3などで
表示)
(9) その他必要とする事項
19
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
付表1 引用規格
JIS K 0050 化学分析方法通則
JIS K 0094 工業用水・工場排水の試料採取方法
JIS K 0113 電位差・電流・電量・カールフィッシャー滴定方法通則
JIS K 0211 分析化学用語(基礎部門)
JIS K 0213 分析化学用語(電気化学部門)
JIS K 0215 分析化学用語(分析機器部門)
JIS K 0557 化学分析用の水
JIS Z 8402 分析・試験の許容差通則
JIS Z 8802 pH測定方法
JIS Z 8805 pH測定用ガラス電極
20
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考 イオン電極の性能試験
以下に示すイオン電極の性能試験は電位差計を用いて行う。
1. 応答こう配 2種の濃度の標準液を,それぞれビーカーにとり,イオン電極と比較電極を浸して応答
電位の変化量∆Eを電位差計で測定し,次の式から1けた濃度が異なる標準液の濃度差に等しい電位を計算
して求める。
)
/
(
log
/
1
2C
C
ΔE
S=
··································································· (1)
ここに,
S: 応答こう配(mV/10倍濃度変化)
∆E: 応答電位の変化量 (mV)
C1: 低濃度側の標準液の濃度 (mol/dm3)
C2: 高濃度側の標準液の濃度 (mol/dm3)
一般的には,C1,C2の濃度は10-4mol/dm3から10-1mol/dm3の濃度範囲で適当に設定された2種類の標準
液を用いて求める。
2. 繰返し精度 濃度比が1けた異なる2種類の濃度の標準液にイオン電極と比較電極を浸して応答電位
を電位差計で測定する。この測定を,薄い標準液と濃い標準液について,交互にそれぞれ3回以上繰り返
し,測定した結果から標準偏差及び変動係数を求める。
3. 応答時間 濃度が1けた異なる2種類の濃度の標準液を,それぞれビーカーにとり,初めに薄い標準
液にイオン電極と比較電極を浸して応答電位を電位差計で測定し,指示が安定してから両電極を濃い標準
液に入れ,安定した一定指示値に達するまで数秒又は数10秒おきに電位差計の指示を記録する。記録した
データから,一定指示値(100%応答時間)の90%又は95%に達するまでの時間を90%応答時間又は95%
応答時間として求める。
4. 絶縁抵抗 イオン電極からの導電線と絶縁被覆間又は電極キャップ間の抵抗値を絶縁抵抗計を用いて
求める。測定温度は室温でよい。
5. 選択係数 イオン電極のイオン選択性は,一般に選択係数
)
(
,
potN
M
k
によって表示される。選択係数は,
測定対象イオン (M) に対して共存イオン (N) がどれだけ応答電位に影響を与えるのかを示す数値である。
通常,この値の大きさによってイオン電極のイオン選択性に関する性能が評価される。
選択係数
)
(
,
potN
M
k
とイオンの活量及び電極電位の間には,次の式(2)で示される関係があり,これをニコル
スキー・アイセンマン (Nicolsky−Eisenman) 式という。
]
log[
303
.2
)
/
(
,
0
N
M
N
Z
Z
a
potN
M
M
k
aM
F
Z
RT
E
E
+
+
=
····································· (2)
ここで,ZM及びZNはそれぞれ測定対象イオンM及び共存イオンNの価数を表す。
21
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
選択係数の値を決定するための測定法は,大別して,2種のイオンを含む混合溶液中で行う方法(混合
溶液法)及び別々の溶液で行う方法(単独溶液法)があり,その代表的な算出法を次に示す。選択係数は
活量aで算出すべきであるが,活量未知の溶液においては濃度Cで代用する。
5.1
混合溶液法
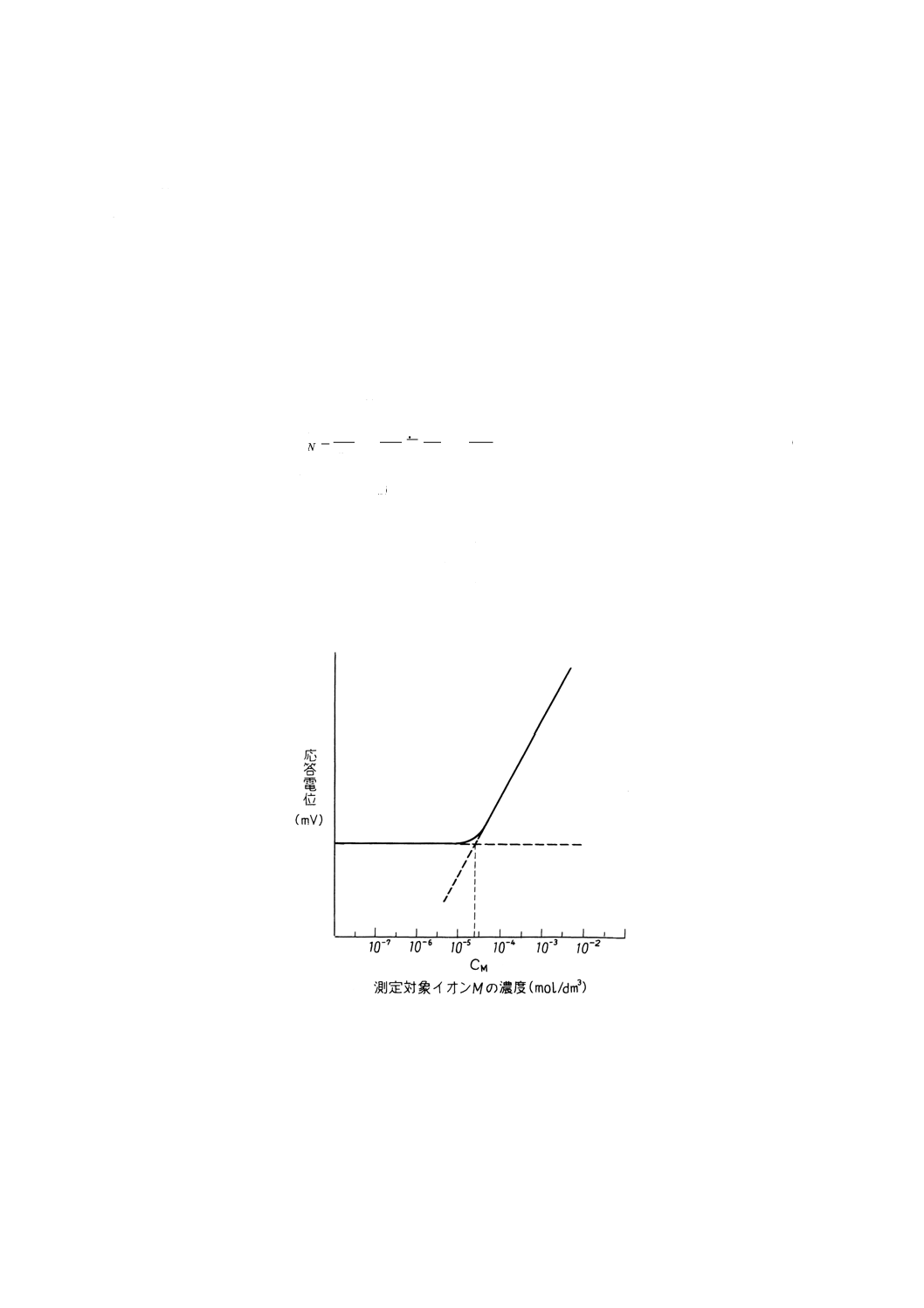
(1) 共存イオン濃度を一定にし,測定対象イオン濃度を変化させる測定法 一定濃度の共存イオンNを含
む溶液中で測定対象イオンMの濃度を増加させていくと,参考図1に示すように最初は共存イオンの
影響で応答電位は変化しないが,測定対象イオンの濃度が一定濃度以上になると応答電位は測定対象
イオン濃度に比例して変化するようになる。共存イオン濃度の影響を受けて応答電位が変化しない濃
度領域における直線的応答部分の延長線と測定対象イオン濃度に比例して変化する濃度領域における
直線的応答部分の延長線との交点から測定対象イオン濃度CMを求め,そのときの共存イオン濃度CN
から選択係数を次の式(3)によって算出する。
)
/
(
)
/
(
,
N
M
N
M
Z
Z
N
M
Z
Z
N
M
potN
M
C
C
a
a
k
≒
=
···················································· (3)
ここに,
potN
M
k,: 選択係数
aM: 測定対象イオンMの活量
aN: 共存イオンNの活量
ZM: 測定対象イオンMのイオン価数
ZN: 共存イオンNのイオン価数
CM: 測定対象イオンMの濃度 (mol/dm3)
CN: 共存イオンNの濃度 (mol/dm3)
参考図1 選択係数の決定(共存イオン濃度を一定にする場合)の一例
備考 実際には,CM以下の濃度では電位が一定ではなく,またドリフトがみられることが多いので,
測定対象イオン濃度に比例して変化する濃度領域における応答曲線の延長線と実測値との差が
18/ZMmVになったときの濃度をCMとしてもよい。
22
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
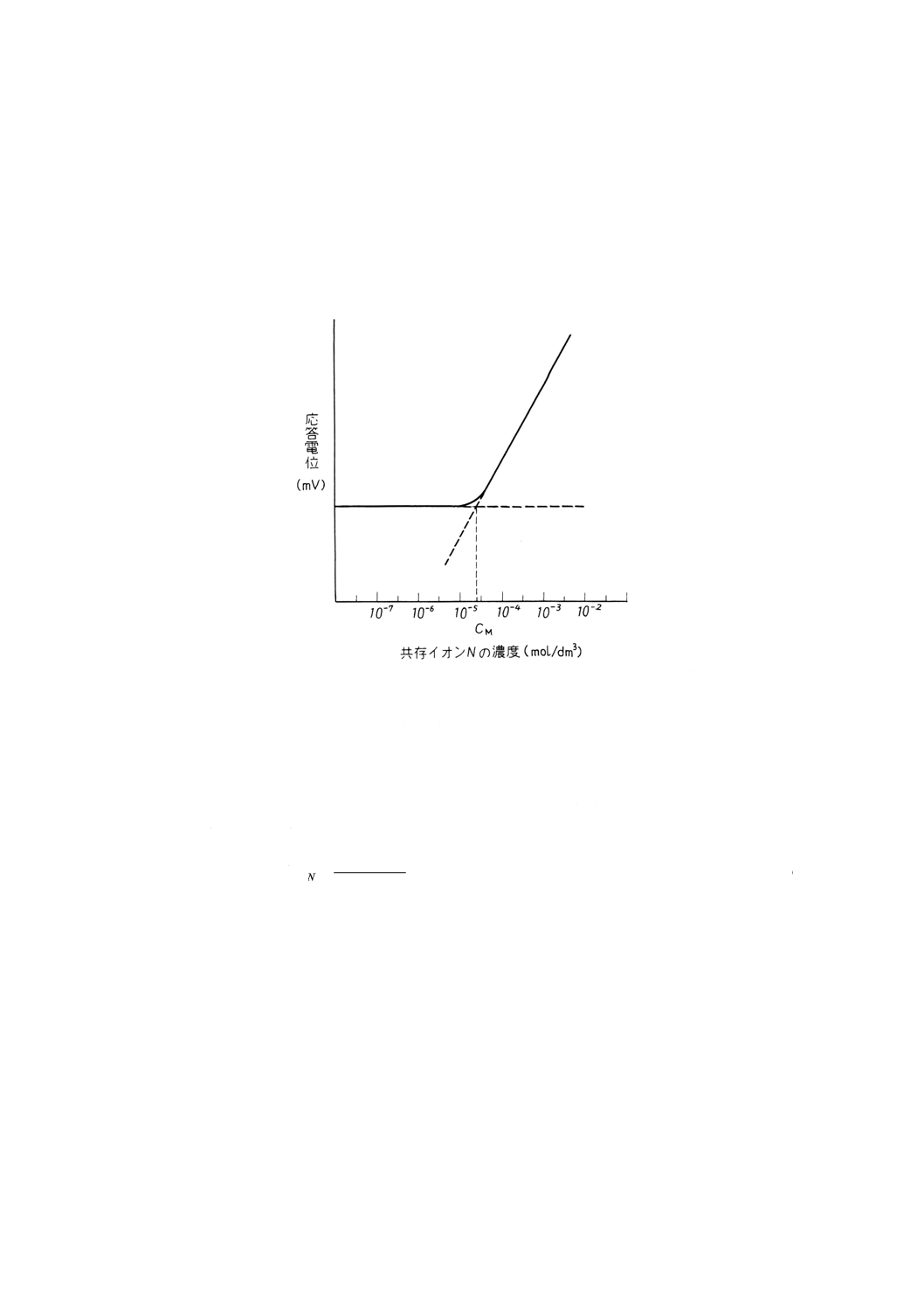
(2) 測定対象イオン濃度を一定にし,共存イオン濃度を変化させる測定法 一定濃度の測定対象イオン濃
度Mを含む溶液中で共存イオンNの濃度を変化させていくと参考図2に示すように,初めは全く影響
がないが,共存イオン濃度が増加するに従って徐々に妨害が現れ,共存イオン濃度に比例して応答電
位が変化するようになる。共存イオン濃度の影響を受けて応答電位が変化しない濃度領域における直
線的応答部分の延長線と測定対象イオン濃度に比例して変化する濃度領域における直線的応答部分の
延長線との交点から共存イオン濃度CNを求めて(3)の式によって選択係数を求める。
参考図2 選択係数の決定(測定対象イオン濃度を一定にする場合)の一例
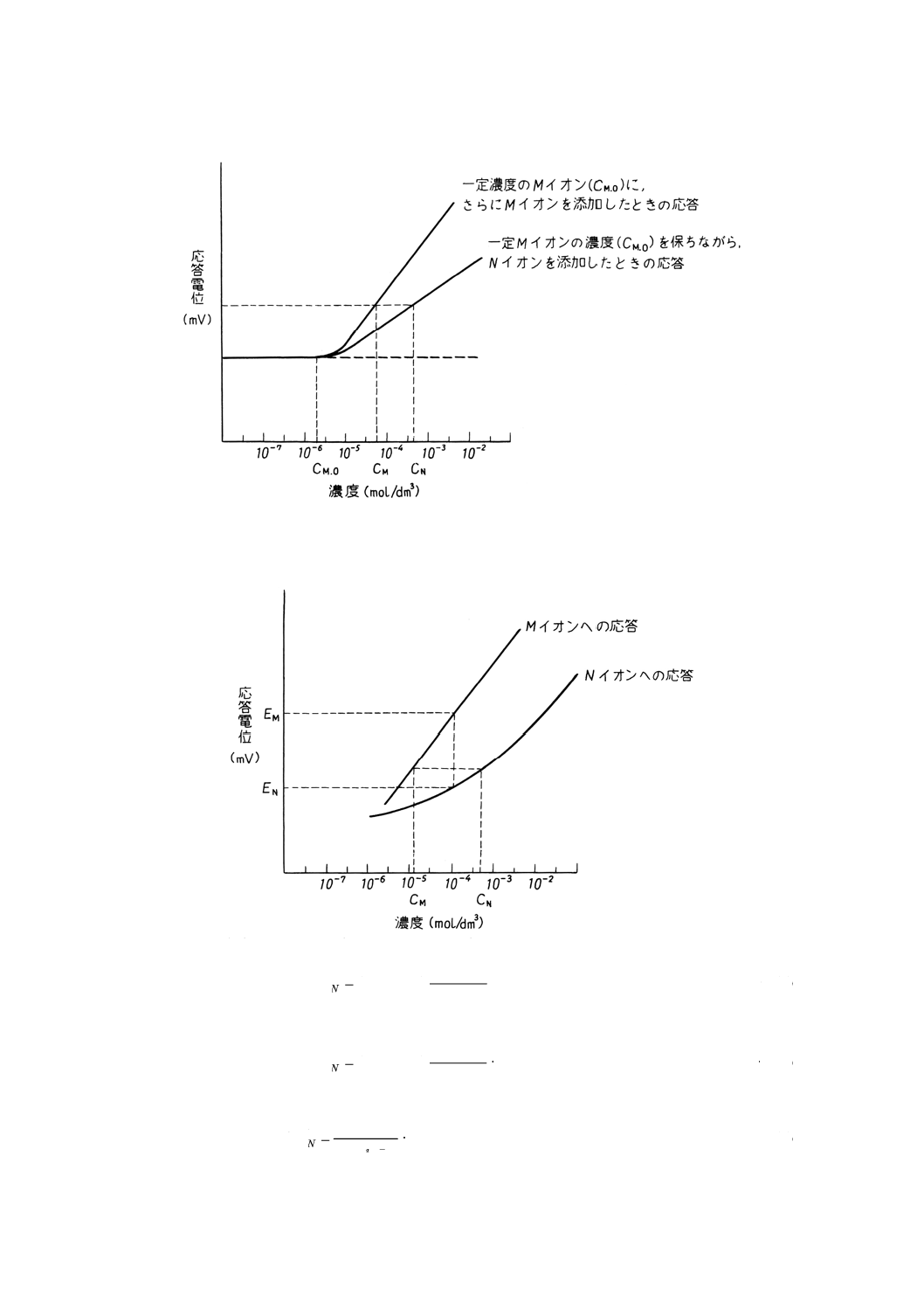
(3) 共存イオンと測定対象イオンをそれぞれ別々に添加する測定法 一定濃度 (CM, O) の測定対象イオン
Mを含む溶液中に,更に測定対象イオンMを添加して応答電位を測定する。
また,これとは別に一定濃度 (CM, O) の測定対象イオンを含む溶液中に,このイオン濃度を
一定に保ちつつ共存イオンNを添加して応答電位を測定すると参考図3のような二つの応答曲
線が得られる。
ここで,変化した電位が同じ値である共存イオン濃度 (CN) と,添加した濃度に対応する測
定対象イオン濃度 (CM−CM, O) から選択係数を次の式(4)によって求める。
N
M
M
potN
M
C
C
C
k
0,
,
−
=
····································································· (4)
23
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考図3 選択係数の決定(共存イオンと測定対象イオンを別々に添加する場合)の一例
5.2
単独溶液法 測定対象イオンの濃度変化に対する応答電位と共存イオンの濃度変化に対する応答電
位を,参考図4のようにそれぞれ別々に測定する。
参考図4 異種イオン溶液方法による選択係数の決定の一例
このとき,同じ濃度のMイオン溶液及びNイオン溶液に対する応答電位をEM及びENとすると
N
N
M
Z
Z
Z
M
M
M
N
potN
M
C
RT
F
Z
E
E
k
/)
(
,
log
303
.2
)
(
log
−
−
−
=
···························· (5)
ZM=ZNのときは
RT
F
Z
E
E
k
M
M
N
potN
M
303
.2
)
(
log
,
−
=
······················································ (6)
また,等しい応答電位を与えるMイオン溶液及びNイオン溶液の濃度をCM及びCNとすると
N
MZ
Z
N
M
potN
M
C
C
k
/
,
=
······································································· (7)
24
K 0122-1997
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ZM=ZNのときは
N
M
potN
M
C
C
k
=
,
·············································································· (8)
選択係数の測定法や算出式は上記のほかにもいくつか提案されているが,測定法の違いや測定濃度の違
いによって求められる値が多少異なることが指摘されている。
イオン電極測定方法通則JIS改正原案作成委員会 構成表
氏名
所属
(委員長)
鈴 木 繁 喬
東京都立大学名誉教授
○ 岡 林 哲 夫
工業技術院標準部繊維化学規格課
池 谷 浩之輔
通商産業省計量行政室
◎ 鈴 木 孝 治
慶應義塾大学理工学部
○ 中 村 進
工業技術院物質工学工業技術研究所
加 山 英 男
財団法人日本規格協会
嶋 貫 孝
社団法人日本分析化学会
○ 野々村 誠
東京都立工業技術センター
米 倉 茂 男
東京都鍍金工業組合
橋 場 常 雄
株式会社環境管理センター
○ 半 沢 修
東京都下水道局
○ 大 澤 辰 夫
株式会社イオン電極研究所
○ 尾 林 正 信
京都電子工業株式会社
○ 伊 東 哲
電気化学計器株式会社
○ 菅 原 研 之
株式会社日立製作所
○ 大 川 浩 美
株式会社堀場製作所
○ 鈴 木 寛
東亜電波工業株式会社
○ 池 田 久 幸
社団法人日本分析機器工業会(横河アナリティカルシス
テムズ株式会社)
○ 宮 川 清 孝
社団法人日本分析機器工業会
備考 ◎印は,小委員会委員長,○印は,小委員会委員を兼ねる。