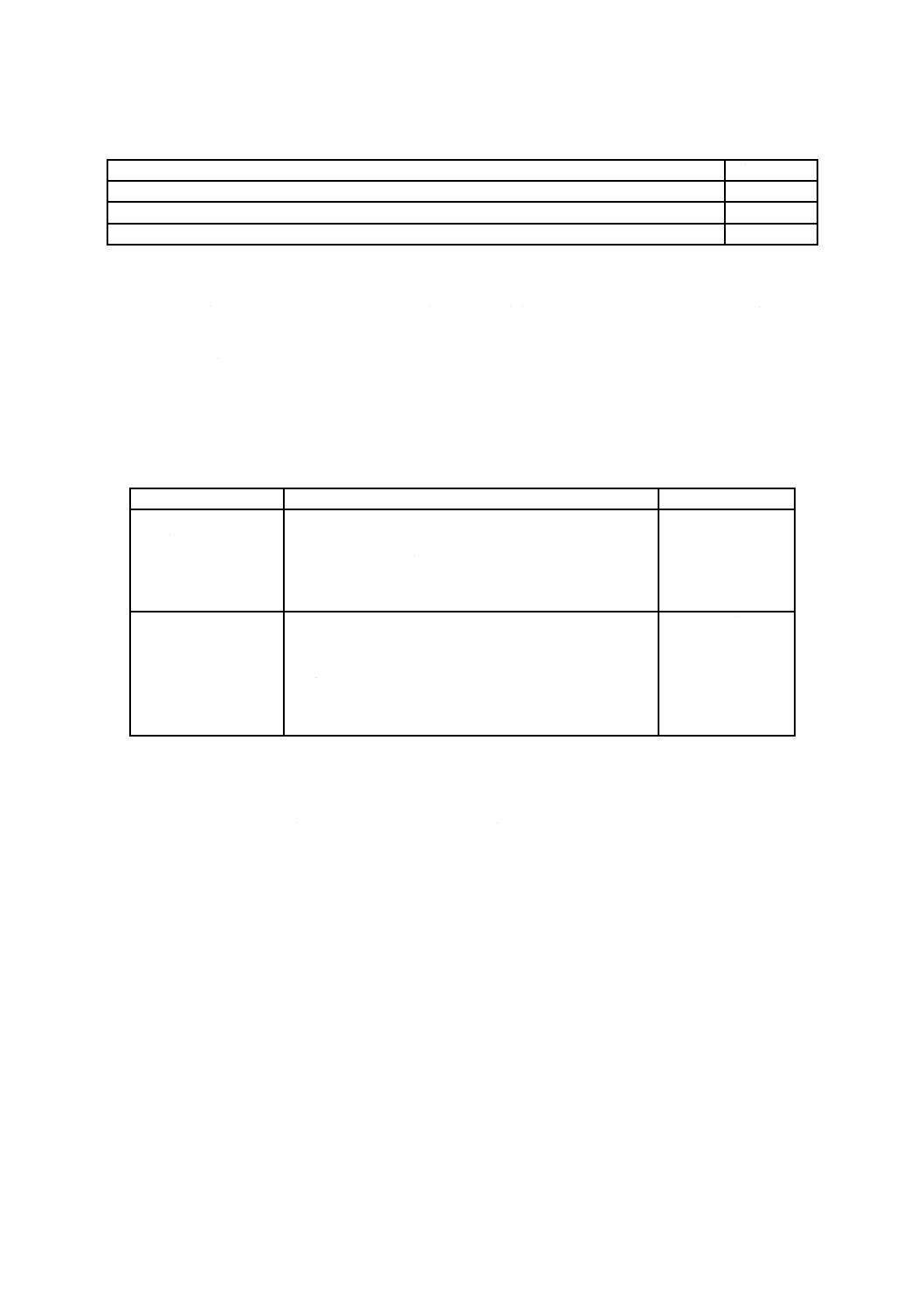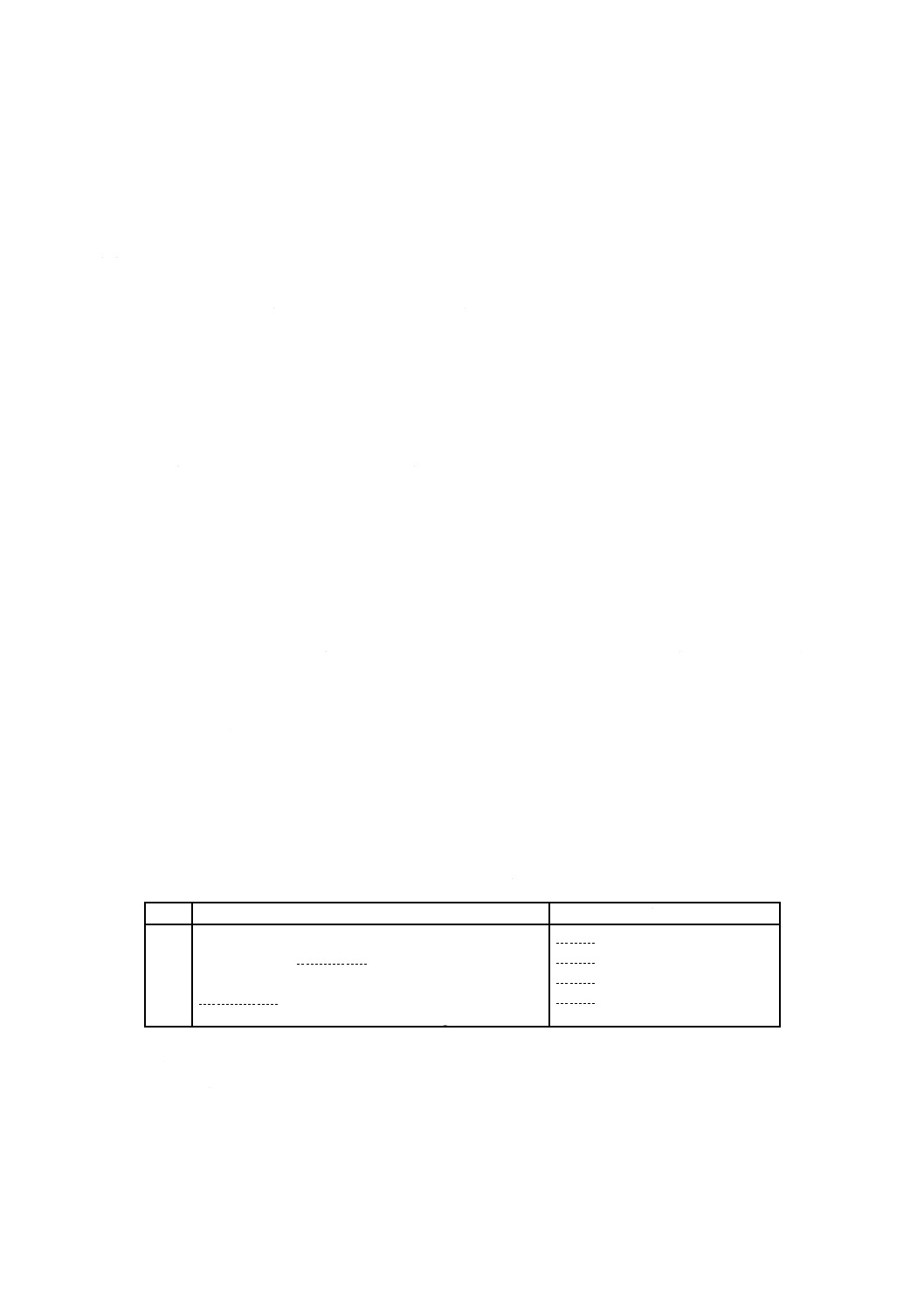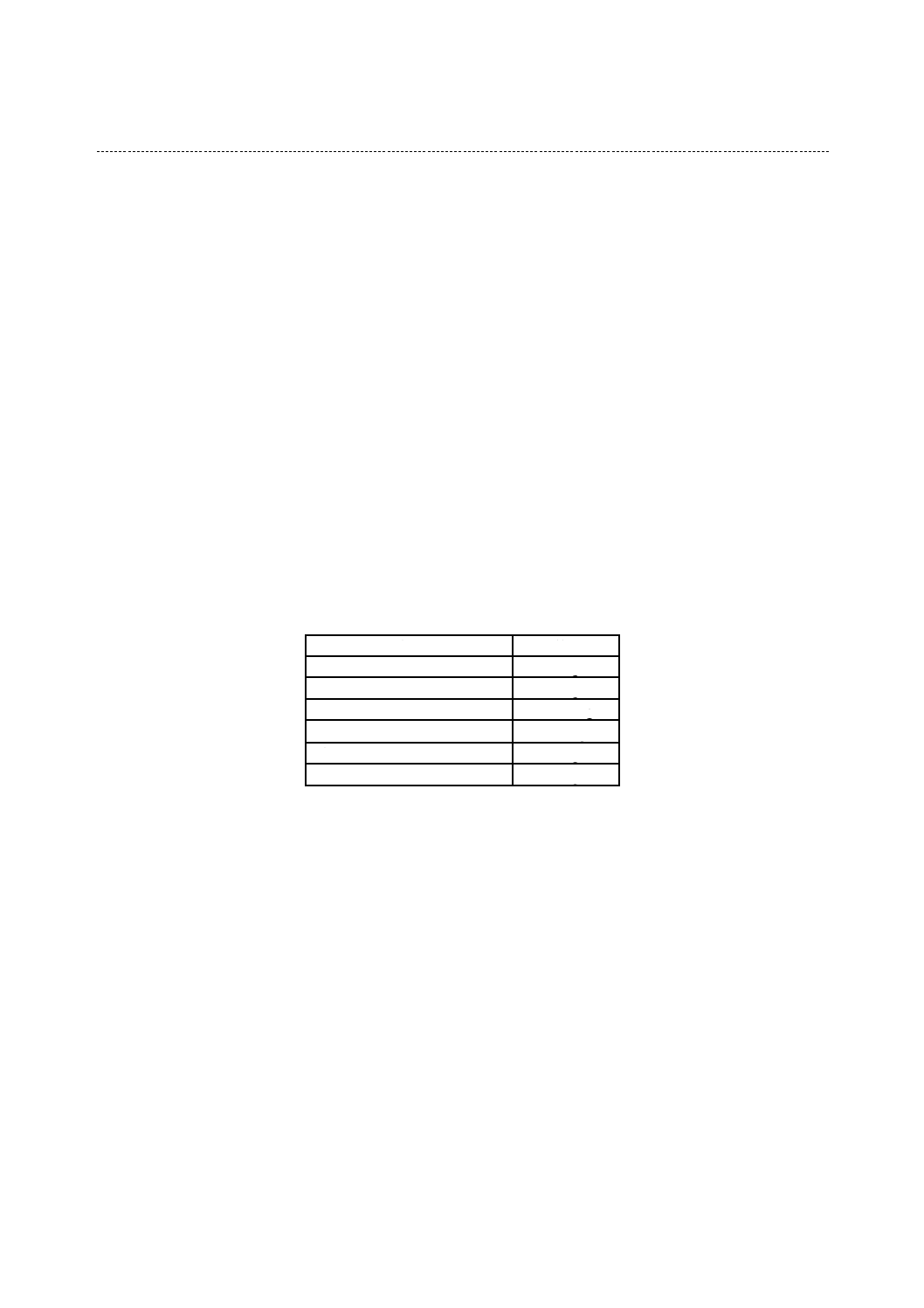Z 2911:2018
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 試験に用いるかびの種類 ···································································································· 2
4 試験の準備 ······················································································································ 2
4.1 薬品及び材料 ················································································································ 2
4.2 装置及び器具 ················································································································ 3
4.3 滅菌方法 ······················································································································ 3
4.4 培地 ···························································································································· 4
4.5 かびの保存及び使用 ······································································································· 4
4.6 胞子懸濁液 ··················································································································· 4
5 試験の通則 ······················································································································ 5
5.1 試料・器具・材料の取扱い方法 ························································································ 5
5.2 試料の清浄化 ················································································································ 5
5.3 培養試験 ······················································································································ 5
5.4 かび発育状態の判定 ······································································································· 5
6 一般工業製品の試験 ·········································································································· 6
7 繊維製品の試験 ················································································································ 6
8 塗料の試験 ······················································································································ 8
9 皮革及び皮革製品の試験 ···································································································· 9
附属書A(規定)プラスチック製品の試験 ··············································································· 10
附属書B(規定)電気製品・電子製品の試験············································································· 17
附属書C(規定)光学機器・光通信機器の試験 ········································································· 24
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 29
Z 2911:2018
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本防菌防黴学会
(SAAAJ)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した日本工業規格である。こ
れによって,JIS Z 2911:2010は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本工業規格 JIS
Z 2911:2018
かび抵抗性試験方法
Methods of test for fungus resistance
序文
この規格は,1997年に第2版として発行されたISO 846,2005年に第6版として発行されたIEC
60068-2-10及び2015年に第2版として発行されたISO 9022-11を基とし,技術的内容を変更して作成した
日本工業規格である。ISO・IECに対応する工業製品・工業材料のうちプラスチック製品,電気製品・電
子製品,及び光学機器・光通信機器の試験については,対応国際規格を翻訳し,技術的内容を変更して附
属書A〜附属書Cに規定した。対応国際規格に規定されていない一般工業製品のうち計測機器,木竹製品
及びガラス製品,繊維製品,塗料並びに皮革及び皮革製品の試験については,箇条2〜箇条9に規定した。
なお,この規格の適用範囲及び附属書A〜附属書Cで点線の下線を施してある箇所は,対応国際規格を
変更している事項である。変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,特にかび抵抗性を必要とする工業製品又は工業材料のかびに対する抵抗性の試験方法につ
いて規定する。
なお,プラスチック製品,電気製品・電子製品,及び光学機器・光通信機器の試験については,それぞ
れ附属書A,附属書B及び附属書Cに規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 846:1997,Plastics−Evaluation of the action of microorganisms
ISO 9022-11:2015,Optics and photonics−Environmental test methods−Part 11: Mould growth
IEC 60068-2-10:2005,Environmental testing−Part 2-10: Tests−Test J and guidance: Mould growth
(全体評価:MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0557 用水・排水の試験に用いる水
JIS K 8121 塩化カリウム(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8545 硝酸アンモニウム(試薬)
JIS K 8576 水酸化ナトリウム(試薬)
2
Z 2911:2018
JIS K 8978 硫酸鉄(II)七水和物(試薬)
JIS K 8995 硫酸マグネシウム七水和物(試薬)
JIS K 9006 りん酸二水素アンモニウム(試薬)
JIS K 9007 りん酸二水素カリウム(試薬)
3
試験に用いるかびの種類
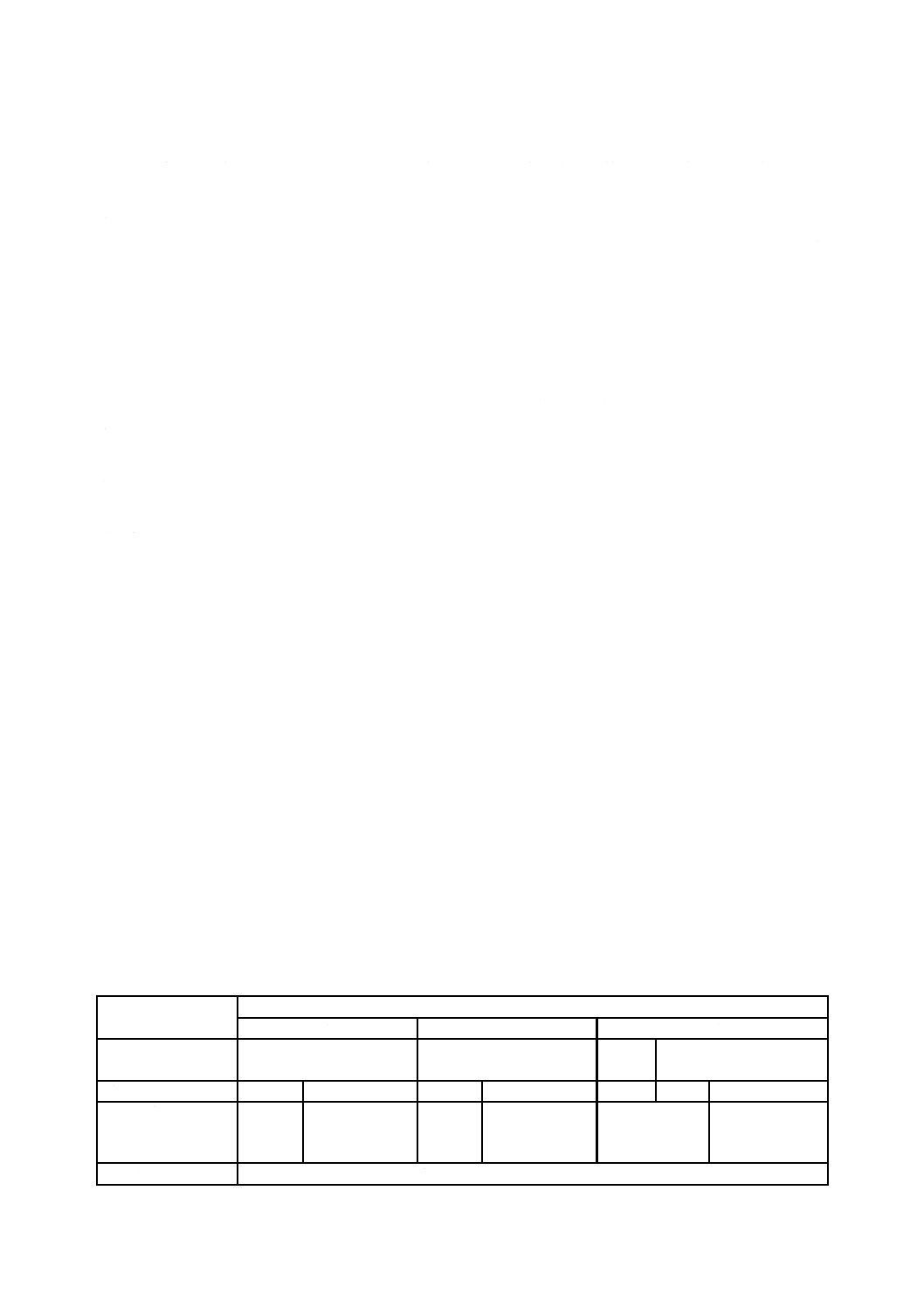
試験に用いるかび(以下,試験用のかびという。)の種類は,表1による。
これら試験用のかびの菌株は,独立行政法人製品評価技術基盤機構が分譲している菌株とする。ただし,
世界微生物株保存連盟(WFCC)又は日本微生物資源学会に加盟している機関において保存されている同
一系統の菌株を使用することができる(表1参照)。
表1−試験用のかび及びこれらと同一系統の菌株一覧
番号
試験用のかびの菌株
同一系統のかびの菌株
1
アスペルギルス ニゲル NBRC 105649
(Aspergillus niger NBRC 105649)
ATCC 6275,CBS 769.97,IMI 45551,JCM 16264,NRRL 334
2
ユーロチウム トノヒルム NBRC 8157
(Eurotium tonophilum NBRC 8157)
ATCC 16440,IMI 108299ii
3
ペニシリウム シトリナム NBRC 6352
(Penicillium citrinum NBRC 6352)
ATCC 9849,CBS 342.61,IMI 61272,JCM 22607,NRRL 756
4
ペニシリウム ピノヒルム NBRC 6345
(Penicillium pinophilum NBRC 6345)
ATCC 9644,CBS 170.60,IMI 87160,JCM 5593,NRRL 3503
5
リゾープス オリゼ NBRC 31005
(Rhizopus oryzae NBRC 31005)
ATCC 10404,IMI 61269,JCM 14556
6
クラドスポリウム スファエロスペルマム
NBRC 6348
(Cladosporium sphaerospermum NBRC 6348)
JCM 22444
7
オーレオバシジウム プルランス
NBRC 6353
(Aureobasidium pullulans NBRC 6353)
JCM 22445
8
トリコデルマ ビレンス NBRC 6355
(Trichoderma virens NBRC 6355)
ATCC 9645,CBS 430.54,IMI 45553ii,JCM 22446
9
ケトミウム グロボスム NBRC 6347
(Chaetomium globosum NBRC 6347)
ATCC 6205,CBS 148.51,IMI 45550iii,JCM 22615,NRRL 1870
10
ミロテシウム ベルカリア NBRC 6113
(Myrothecium verrucaria NBRC 6113)
ATCC 9095,CBS 328.52,JCM 22448,NRRL 2003
微生物保存機関の略号の説明
NBRC 独立行政法人製品評価技術基盤機構バイオテクノロジーセンター,千葉県木更津市
ATCC American Type Culture Collection, Rockville, Maryland, U.S.A
CBS Westerdijk Fungal Biodiversity Institute, the Netherlands
IMI CABI Genetic Resource Collection, Egham, Surrey, U.K.
JCM 国立研究開発法人理化学研究所バイオリソースセンター,茨城県つくば市
NRRL Agricultural Research Service, U.S. Department of Agriculture, Peoria, Illinois, U.S.A.
4
試験の準備
4.1
薬品及び材料
この規格で用いる薬品及び材料は,特に指定がない限り,次による。
3
Z 2911:2018
塩化カリウム
JIS K 8121に規定するもの
塩酸
JIS K 8180に規定するもの
水酸化ナトリウム
JIS K 8576に規定するもの
硝酸アンモニウム
JIS K 8545に規定するもの
精製水
JIS K 0557に規定するA2〜A4の水
硫酸鉄(II)七水和物
JIS K 8978に規定するもの
硫酸マグネシウム七水和物
JIS K 8995に規定するもの
りん酸二水素アンモニウム
JIS K 9006に規定するもの
りん酸二水素カリウム
JIS K 9007に規定するもの
寒天
微生物試験用
酵母エキス
微生物試験用
スクロース
微生物試験用
麦芽エキス
微生物試験用
グルコース
微生物試験用
ペプトン
微生物試験用
4.2
装置及び器具
この規格で用いる装置及び器具は,次による。
オートクレーブ(高圧蒸気滅菌器) 温度を121±2 ℃(圧力103±5 kPa)に保てるもの
乾燥器
温度を80〜85 ℃に保てるもの
乾熱滅菌器
温度を160〜170 ℃に保てるもの
恒温器
温度を設定温度±2 ℃に保てるもの
冷蔵庫
温度を2〜8 ℃に保てるもの
シャーレ
ガラス製又は樹脂製で微生物試験用のもの
綿栓
青梅綿を使用した栓又は通気性のあるシリコーン樹脂製栓など
4.3
滅菌方法
4.3.1
一般
器具,培地などの滅菌対象物の滅菌方法は,4.3.2〜4.3.5のいずれか一つの方法又は複数の方法によって
行う。
4.3.2
乾熱滅菌
滅菌対象物を乾熱滅菌器に入れ,160 ℃の場合は120分間以上加熱し,170 ℃の場合は60分間以上加熱
する。
4.3.3
高圧蒸気滅菌
滅菌対象物をオートクレーブに入れ,121±2 ℃(103±5 kPaと同等)で15〜20分間加熱する。
4.3.4
火炎滅菌
滅菌対象物をガス又はアルコールの火炎に当てる。白金線又は白金耳の場合は,十分に赤熱させ,試験
管の場合は,回しながら試験管口の全体を2〜3秒間火炎に当てる。
4.3.5
薬液消毒
滅菌対象物を消毒用エタノール,塩化ベンザルコニウム溶液 (1〜10 g/L)などの薬液を用いて消毒す
る。
4
Z 2911:2018
4.4
培地
4.4.1
一般
ユーロチウム トノヒルム以外のかびを培養/又は保存する場合は,4.4.2に示すポテト・デキストロー
ス寒天培地を用いて4.4.4及び4.4.5に示す形状に調製する。ユーロチウム トノヒルムを培養及び/又は
保存する場合は,4.4.3に示す好乾性かび用の培地を用い,4.4.4及び4.4.5に示す形状に調製する。また,
類似の組成のものであれば,市販品を用いることができる。
4.4.2
ポテト・デキストロース寒天培地(PDA培地)
ジャガイモは皮をむ(剝)き,芽の部分は深くえぐって取り除き,約10 mmのさいの目に切る。その
200 gを精製水1 000 mLで20分間煮る。内容物を直ちにガーゼでろ別し,精製水を加えて1 000 mLとし,
グルコース20 g及び寒天20 gを加え,かくはん・加熱して溶解した後,高圧蒸気滅菌する。高圧蒸気滅菌
後のpHが25 ℃で5.4〜5.8になるように塩酸溶液又は水酸化ナトリウム溶液で調整する。
4.4.3
好乾性かび用の培地
PDA培地の組成のうち,グルコースを20 gから200 gと改変した培地を用いるか,又はM40Y寒天培地
を用いる。M40Y寒天培地の組成は,次による。
スクロース
400 g
麦芽エキス
20 g
酵母エキス
5 g
寒天
20 g
精製水
1 000 mL
4.4.4
斜面培地
試験管の中に,あらかじめ加熱溶解した寒天培地を注ぎ,綿栓をして高圧蒸気滅菌する。
滅菌後,試験管を水平面と約15度傾けて置き,培地を固化させる。
斜面培地は,固化してから1か月以上経過したものは,用いてはならない。
4.4.5
平板培地
高圧蒸気滅菌後の培地を滅菌済みシャーレに入れ,水平に置いて培地を固化させる。
平板培地は,固化してから1か月以上経過したものは,用いてはならない。
4.5
かびの保存及び使用
4.5.1
かびの保存
斜面培地に移植したかびは,26±2 ℃の恒温器で7〜20日間培養し,十分に胞子を産生していることを
確認した後,冷蔵庫で保存する。
移植してから3か月間以内に培養斜面から移植して培養保存し,3か月間以内ごとに移植を繰り返す。
移植してから3か月間以上経過したものは,次の移植に用いてはならない。
4.5.2
かびの使用
4.6の胞子懸濁液に用いるかびの培養は,冷蔵庫に保存されたかびを新しい斜面培地に移植し,26±2 ℃
の恒温器に入れ,ユーロチウム トノヒルムについては10〜20日間,ケトミウム グロボスムについては
14日間,その他については7〜10日間行う。培養後の斜面培地は冷蔵庫に保存し,ユーロチウム トノヒ
ルムについては30日間以内に,その他については10日間以内に使用する。
4.6
胞子懸濁液
4.6.1
湿潤剤添加滅菌水の調製
スルホこはく酸ジオクチルナトリウム(Dioctyl sodium sulfosuccinate)50 mgを精製水に溶かして1 000 mL
5
Z 2911:2018
とした後,試験管などに小分けして,高圧蒸気滅菌する。
4.6.2
単一胞子懸濁液の調製
4.5.2によって調製し,十分に胞子形成が認められた各かびの斜面培地に,4.6.1の湿潤剤添加滅菌水を適
量加える。滅菌した白金耳などで培養面を軽くこすって胞子を離脱させる。胞子を十分に分散させるよう
試験管を振った後,内容物を滅菌したガーゼ,脱脂綿,ガラスウールなどでろ過し,菌糸を取り除く。こ
の懸濁液を,血球計算盤などを用いて胞子濃度約104〜106個/mLになるように調製する。調製した後,24
時間以上経過した単一胞子懸濁液は,試験に用いてはならない。
4.6.3
混合胞子懸濁液の調製
4.6.2の単一胞子懸濁液を等容量ずつ混合して,これを混合胞子懸濁液とする。
単一胞子懸濁液を調製した後,24時間以上経過した混合胞子懸濁液は,試験に用いてはならない。
4.6.4
胞子懸濁液の確認
試験のときには,4.4.2のポテト・デキストロース寒天培地又は4.4.3の好乾性かび用の培地を用いて平
板培地を作り,その試験用のかびの単一及び混合胞子懸濁液1 mLを培養面に均等に塗布し,蓋をして試
料又は試験片と同じ温度に保った場所に置いて培養する。ユーロチウム トノヒルムの単一胞子懸濁液に
ついては10〜20日間,その他のかびの単一又は混合胞子懸濁液(ユーロチウム トノヒルムを含むものを
含む。)については10〜14日間後に培養面を調べ,菌糸が全面に密に発育していない場合は,この胞子懸
濁液を用いて行った試験は,無効とする。
確認試験において菌糸が発育していないなどの異常が認められた場合には,別の培養面の胞子で胞子懸
濁液を調製し,再試験を行う。
5
試験の通則
5.1
試料・器具・材料の取扱い方法
この試験に用いる試料又は試験片・器具・材料は,清浄なピンセット又は手で取り扱い,汚れ,きずな
どを付けないように十分に注意しなければならない。
5.2
試料の清浄化
試料表面の有機物などの汚れの付着によって,試験結果に影響を及ぼすと判断される場合,製品が劣化
しない適切な方法(例えば,エタノールによる処理など)で清浄化処理を行う。
5.3
培養試験
5.3.1
接種
30 mm×30 mmの試料又は試験片にかび胞子懸濁液0.5 mLを接種するには,胞子懸濁液をクロマトグラ
ム用噴霧器又はピペットで,試料又は試験片の表面に均等に吹き付ける。ただし,繊維製品の乾式法につ
いては,箇条7のa)及びb)に規定した方法による。試験の繰返し数(n)は,3とする。
5.3.2
培養
試料又は試験片を規定に従って処理し,規定のかびを接種した後,規定の条件に保って培養する。
5.4
かび発育状態の判定
5.3.2の培養の結果,試料又は試験片の表面に生じた菌糸の発育状態を肉眼で調べる。
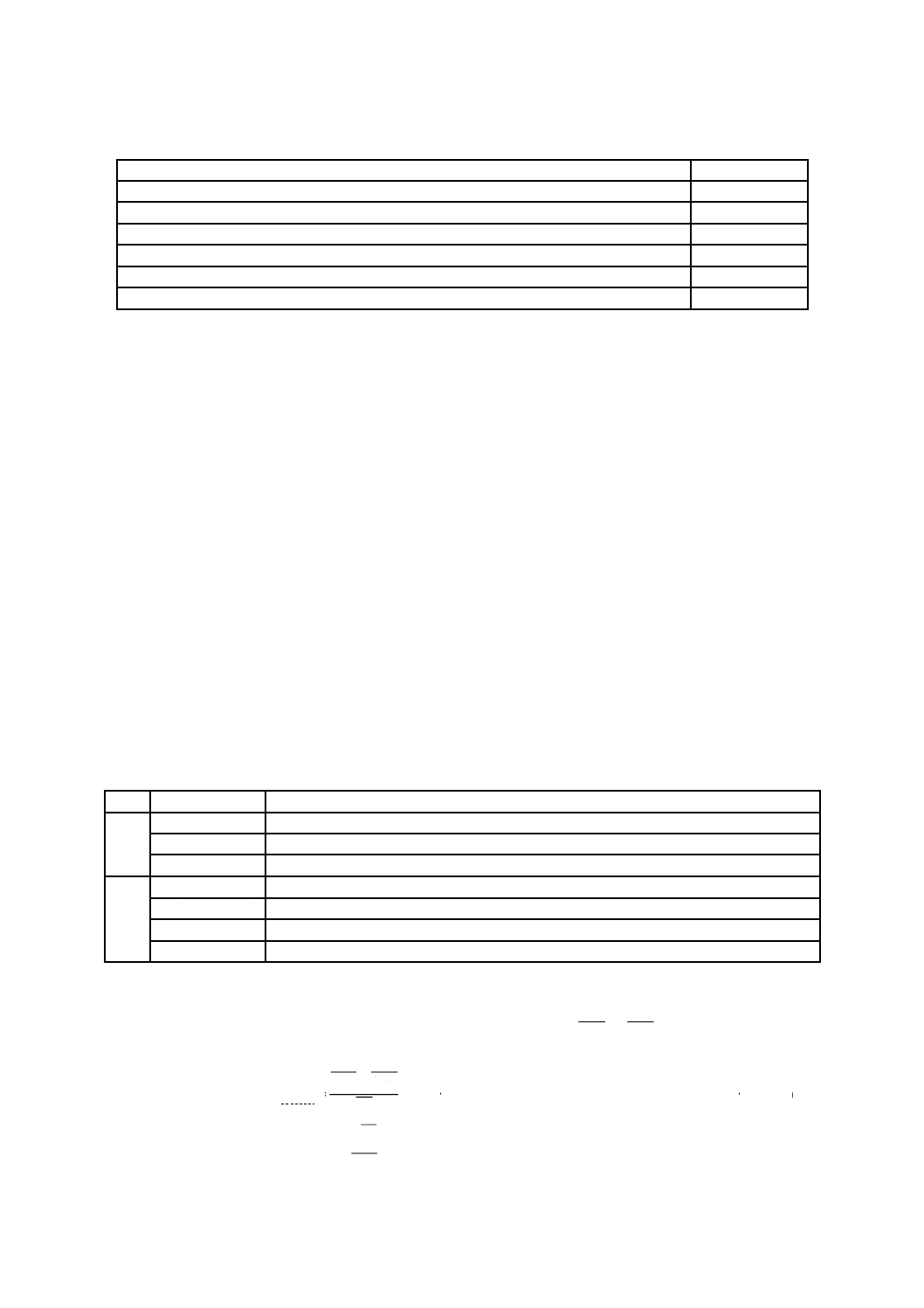
発育状態の判定方法は,表2による。
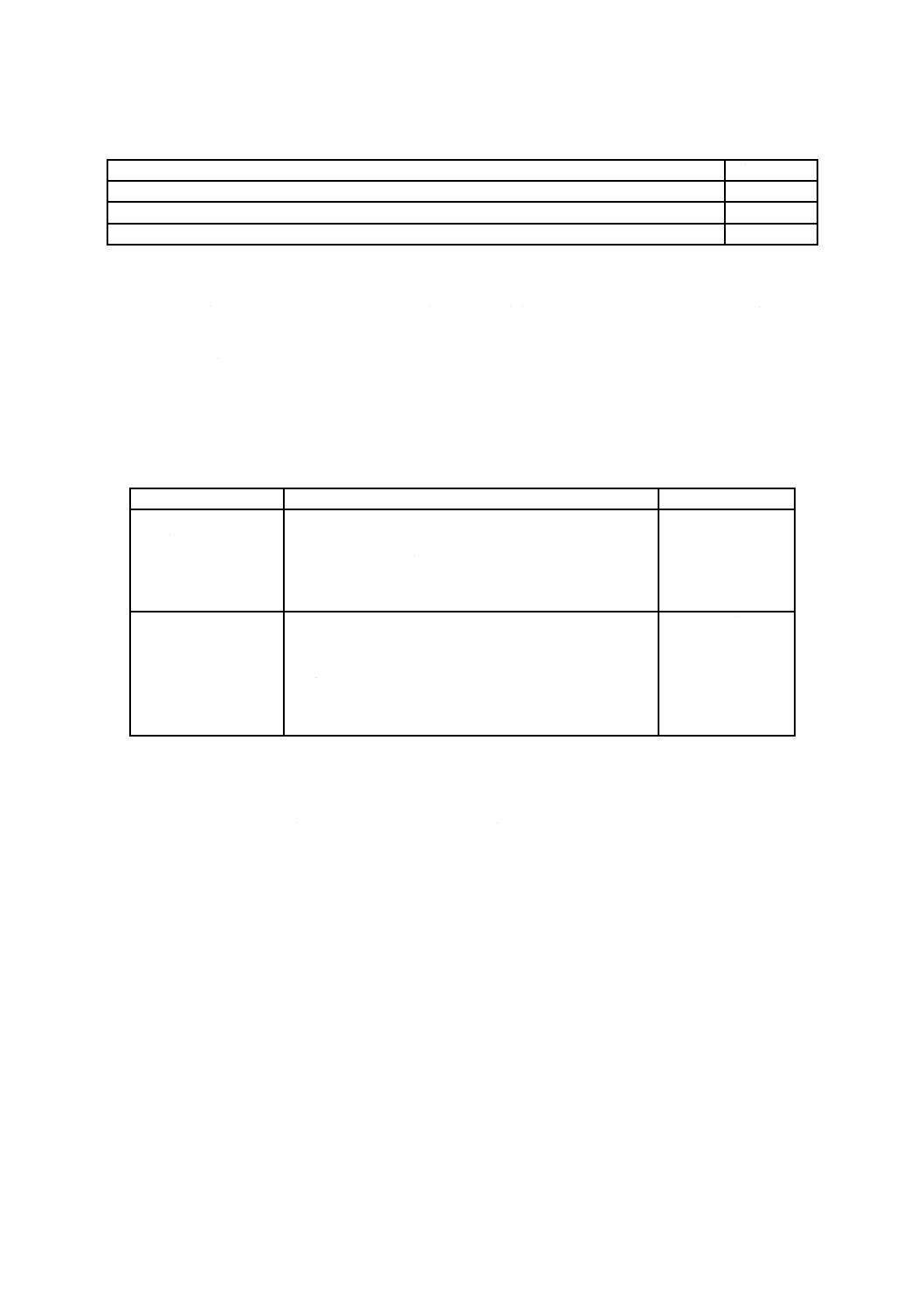
6
Z 2911:2018
表2−かび発育状態の判定方法
菌糸の発育
結果の表示
試料又は試験片の接種した部分に菌糸の発育が認められない。
0
試料又は試験片の接種した部分に認められる菌糸の発育部分の面積は,全面積の1/3を超えない。
1
試料又は試験片の接種した部分に認められる菌糸の発育部分の面積は,全面積の1/3を超える。
2
6
一般工業製品の試験
次に示す工業製品のかび抵抗性を試験する場合は,この箇条によって試験を行い,a)〜c) による。
− 計測機器:圧力計・測量機械・精密測定器など
− 木竹製品:ざる・かご・すだれ・建材など
− ガラス製品:ガラス・瓶など
a) 試験用のかび及び培養期間 試験に用いる混合胞子懸濁液のかびの種類及び培養期間は,表3による。
表3−一般工業製品の試験用のかびの種類及び培養期間
種別
かびの種類
培養期間
計測機器
木竹製品
アスペルギルス ニゲル NBRC 105649
ペニシリウム シトリナム NBRC 6352
リゾープス オリゼ NBRC 31005
クラドスポリウム スファエロスペルマム NBRC 6348
ケトミウム グロボスム NBRC 6347
4週間
ガラス製品
アスペルギルス ニゲル NBRC 105649
ユーロチウム トノヒルム NBRC 8157
ペニシリウム シトリナム NBRC 6352
リゾープス オリゼ NBRC 31005
クラドスポリウム スファエロスペルマム NBRC 6348
ケトミウム グロボスム NBRC 6347
4週間
b) 試験方法 試料をそのまま又はこれを部品に解体した後,その全表面又は指定した部分に,4.6.3に規
定する混合胞子懸濁液を吹き付ける。吹き付ける量は,試料の見掛けの表面積30 mm×30 mmに対し,
0.5 mLの割合とする。吹き付けた後,26±2 ℃,湿度95 %〜99 %に保った恒温器などの中に置き,
表3に規定した期間培養する。
c) かび発育状態の判定 5.4による。
7
繊維製品の試験
織物,メリヤス,網,糸,ひも,索,綱などの繊維製品のかび抵抗性を試験する場合は,この箇条によ
って試験を行う。
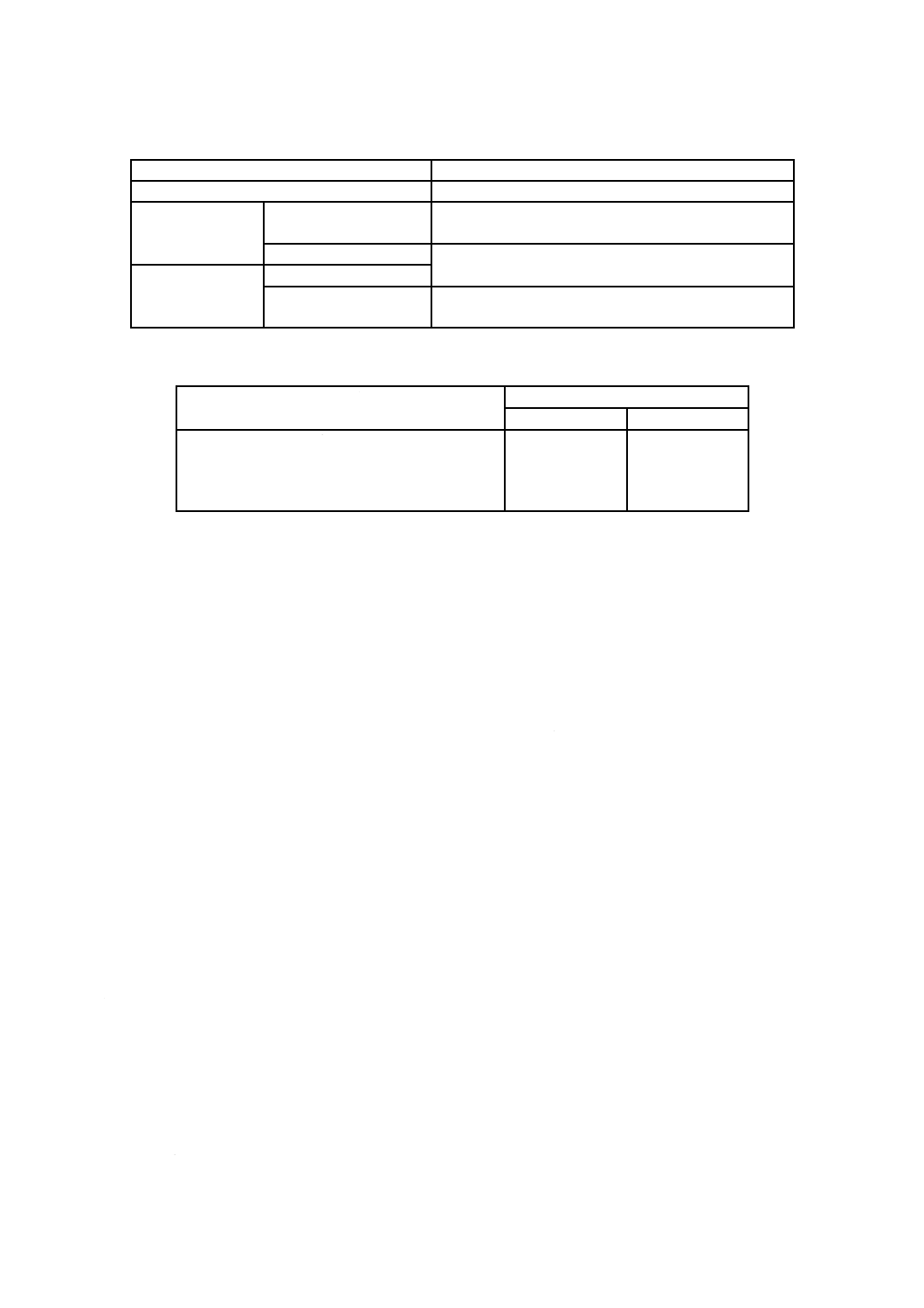
a) 試験片の大きさ,試験用のかび及び培養期間 この試験に用いる試験片の大きさは,表4による。混
合胞子懸濁液のかびの種類及び培養期間は,表5による。
7
Z 2911:2018
表4−繊維製品の試験に用いる試験片の大きさ
種別
試験片の大きさ
織物,メリヤスなど
50 mm×50 mm
網
糸の径3 mm未満のもの 上から見てほぼ隙間がないように重ねて,その大きさを
50 mm×50 mmとする。
糸の径3 mm以上のもの 糸,ひもなどがお互いに接するように横に並べ,上から
見て,その大きさを50 mm×50 mmとする。
糸,ひも,索,綱
糸の径3 mm以上のもの
糸の径3 mm未満のもの ガラス板又は磁製板に巻いて,その大きさを50 mm×50
mmとする。
表5−繊維製品の試験用のかびの種類及び培養期間
かびの種類
培養期間
乾式法
湿式法
アスペルギルス ニゲル NBRC 105649
ペニシリウム シトリナム NBRC 6352
ケトミウム グロボスム NBRC 6347
ミロテシウム ベルカリア NBRC 6113
4週間
2週間
b) 乾式法 この方法は,普通の衣料用,屋内用,衣装用の繊維製品などに適用し,次による。
1) 試験容器 試験容器は,デシケータを用い,底部にりん酸二水素アンモニウム溶液(飽和)を内部
容積の約5 %入れる。
2) 胞子担体 滅菌したろ紙(直径約12 mm)又は磁器製の素焼ふるいを,混合胞子懸濁液中に浸す。
これを取り出し,乾熱滅菌したガラス製のシャーレに入れて乾燥し,直ちに試験に用いる。
3) 試験操作 乾熱滅菌したガラス製のシャーレ(直径約90 mm)の中央に,表4に規定した方法で調
製した試験片を平らに置き,その試験片の中央に2)の胞子担体1個を胞子が散らないように注意し
て載せ,更にその上に乾燥したガラス板50 mm×50 mmを載せて,蓋をする。
このシャーレを1)の試験容器の中板上に置き,試験容器の蓋をして26±2 ℃に保った場所に置き,
表5に規定する期間培養する。
4) 試験の有効性 4.4.2のポテト・デキストロース寒天培地を用いて調製した平板培地の中央に,胞子
担体1個を載せ,蓋をして試験片と同一温度に保った場所に置いて4週間培養する。培養期間の終
わりに培養面を調べ,胞子担体の周囲に菌糸が密に発育していない場合は,この胞子担体を用いて
行った試験は,無効とする。
確認試験において菌糸が発育していないなどの異常がみられた場合には,別の斜面培地の胞子で
作った胞子懸濁液を用いて胞子担体を作り,再試験を行う。
5) かび発育状態の判定 5.4による。
c) 湿式法 この方法は,屋外,水中などで使用するために,特にかび抵抗性を必要とする繊維製品に適
用する。ただし,必要によって乾式法も併用する。
1) 培地 この試験に用いる培地は,4.4.5に規定する平板培地とし,組成は,次による。
硝酸アンモニウム
3 g
りん酸二水素カリウム
1 g
硫酸マグネシウム七水和物
0.5 g
塩化カリウム
0.25 g

8
Z 2911:2018
硫酸鉄(II)七水和物
0.002 g
寒天
20 g
精製水
1 000 mL
2) 試験操作 試料を表4に規定する試験片の大きさよりも大きめに作製して,容量1 000 mLのビーカ
ーに入れ,ビーカーの底にゴム管などを差し入れ,これを通して水道水を流量500〜1 000 mL/ min
で連続して24時間注ぎ込む。試料を取り出し,表4に規定する大きさに試料を調製して試験片とす
る。これを精製水1 000 mLを入れたビーカー中でよく洗い,更に精製水を取り替えてよく洗う。試
験片を取り出して水を切り,平板培地の培養面の中央に密着するように置く。混合胞子懸濁液1 mL
を培養面と試験片の上面とに均等に吹き付け,蓋をして26±2 ℃に保った場所に置いて,表5に規
定する期間培養する。
試験片がシャーレ(直径約90 mm)に入れにくいときには,適切な大きさのシャーレに調製した
培地を用いてもよい。その場合,培地及び吹き付ける混合胞子懸濁液の量は,単位面積当たりの割
合が,シャーレ(直径約90 mm)の平板培地の場合と同様になるようにする。
3) かび発育状態の判定 5.4による。
8
塗料の試験
塗料のかび抵抗性を試験する場合は,この箇条によって試験を行う。
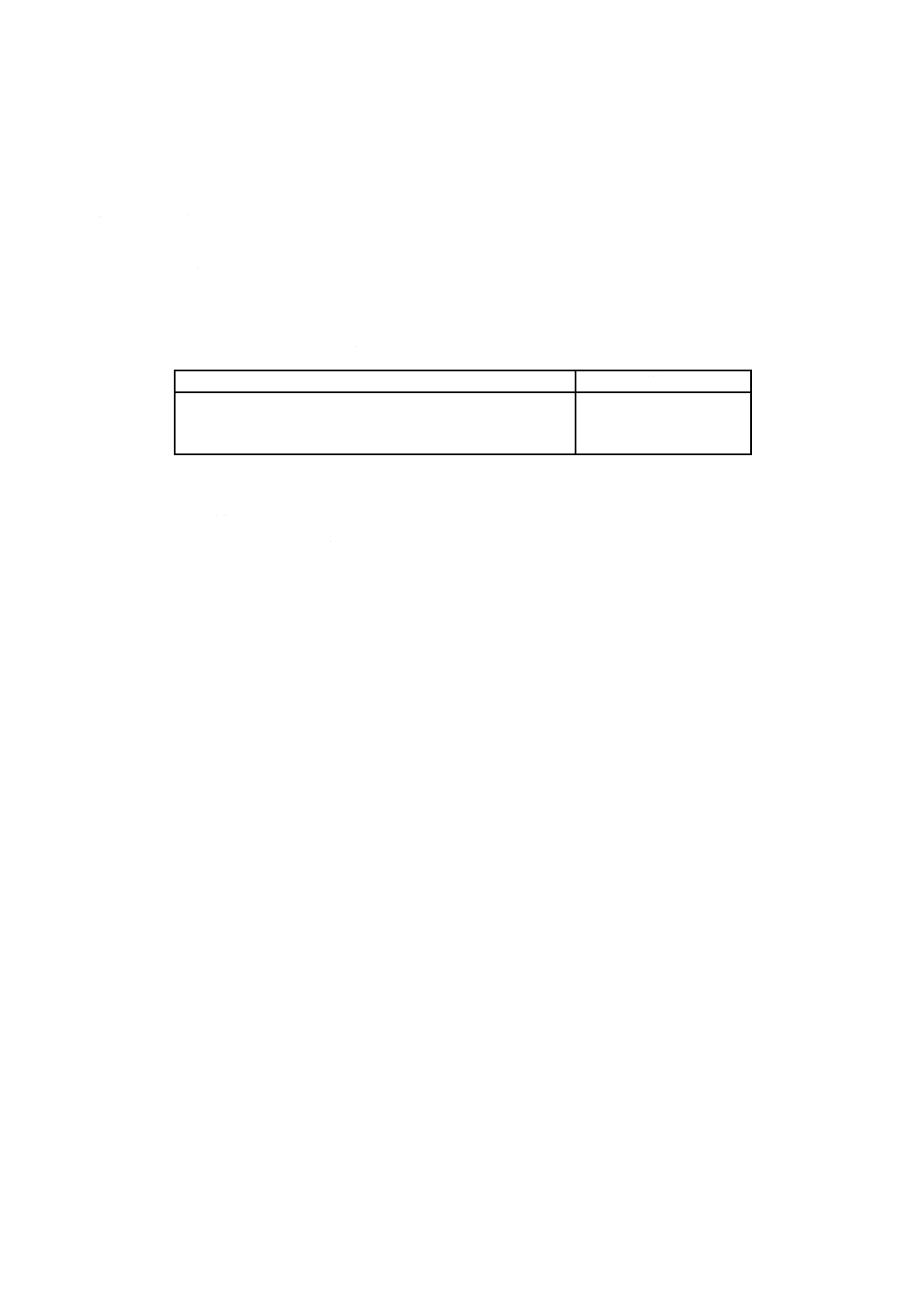
a) 試験用のかび この試験に用いる混合胞子懸濁液のかびの種類は,表6による。
表6−塗料の試験用のかびの種類及び培養期間
かびの種類
培養期間
アスペルギルス ニゲル NBRC 105649
ペニシリウム ピノヒルム NBRC 6345
クラドスポリウム スファエロスペルマムNBRC 6348
オーレオバシジウム プルランス NBRC 6353
トリコデルマ ビレンス NBRC 6355
7日間
b) 培地 この試験に用いる培地は,4.4.5に規定する平板培地とし,組成は,次による。
グルコース
40 g
ペプトン
10 g
寒天
20 g
精製水
1 000 mL
c) 試験片の準備 試料を薄めて濃度を調節しておく。あらかじめ質量を測定したろ紙に浸して引き上げ,
試料を均等に付けてから約20 ℃,湿度約75 %のチャンバ内につる(吊)して48時間置く。濃度の
調節は,塗膜の厚さが均等で,質量がろ紙の質量の90 %〜110 %になるようにする。このろ紙を直径
が30 mmの円形に切り取り,試験片とする。この場合,チャンバの底に塩化ナトリウム溶液(飽和)
を張っておくとよい。
d) 試験方法 試験片1個について容量200 mLのビーカーを1個ずつ用意し,ビーカーに精製水200 mL
を入れ約20 ℃に保ち,その中に試験片を浸して18時間静置する。試験片を取り出し,室内につる(吊)
して2時間置き,更に80〜85 ℃に保った乾燥器の中に2時間つる(吊)して置く。試験片を取り出
してb)の平板培地の培養面の中央にはり付ける。混合胞子懸濁液1 mLを培養面と試験片の上面とに
9
Z 2911:2018
均等に吹き付け,シャーレに蓋をして26±2 ℃に保った場所に置いて表6に規定する期間培養する。
e) かび発育状態の判定 5.4による。
9
皮革及び皮革製品の試験
薄物革,厚物革,ベルト,靴,かばん(鞄),袋物類などの皮革及び皮革製品のうち,特にかび抵抗性を
必要とする場合は,この箇条によって試験を行い,a)〜d)による。
a) 試験用のかび この試験に用いる混合胞子懸濁液のかびの種類は,表7による。
表7−皮革及び皮革製品の試験用のかびの種類及び培養期間
かびの種類
培養期間
アスペルギルス ニゲル NBRC 105649
ペニシリウム シトリナム NBRC 6352
クラドスポリウム スファエロスペルマム NBRC 6348
7日間
b) 試験片の準備 試料から直径30 mmの試験片を切り取り,20倍量の精製水に室温で18時間浸した後,
取り出して精製水約20 mLで更に1回洗い,付着している水をろ紙で軽く拭い取る。
c) 試験方法 4.4.2のポテト・デキストロース寒天培地を用いて調製した平板培地の表面に,b)の試験片
を接着させ,かびの混合胞子懸濁液1 mLを試験片及び培地の表面に均等に吹き付け,シャーレに蓋
をして26±2 ℃に保った場所に置いて,表7に規定する期間培養する。
d) かび発育状態の判定 5.4による。
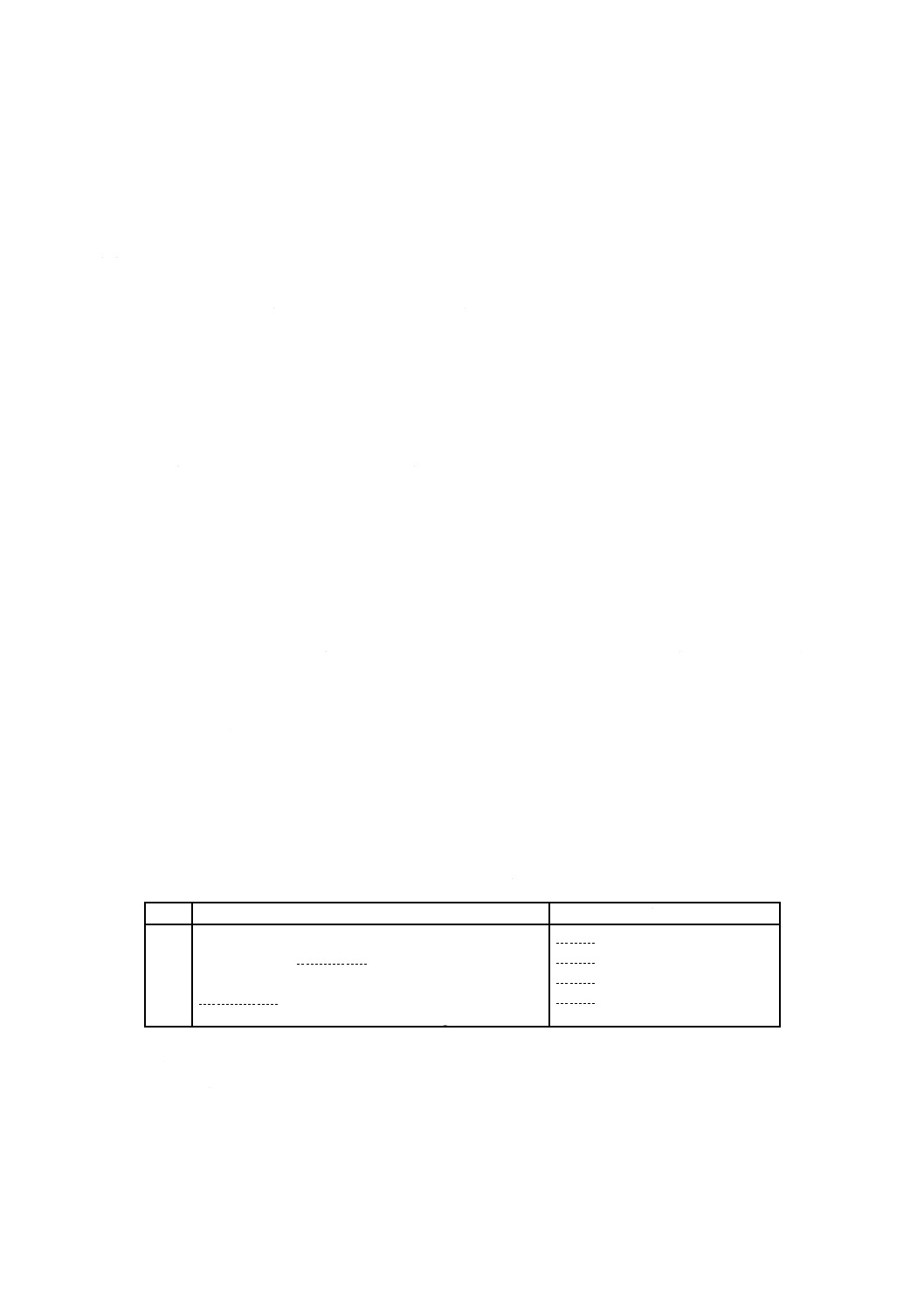
10
Z 2911:2018
附属書A
(規定)
プラスチック製品の試験
A.1 原理
A.1.1 かび発育試験(方法A)
方法Aでは,炭素源を含まない“不完全な”培地存在下で,混合したかび胞子懸濁液を試料に接種する。
かびは,試料そのものの素材だけを栄養源として発育できる。試料に栄養成分が含まれていない場合,か
びは,菌糸を伸長させることができず,プラスチック(試料)の劣化は生じない。
方法Aは,試料以外に有機物が存在しない状況下におけるかびの侵食に対するプラスチック(試料)そ
のものの抵抗性を評価する試験方法である。
方法Aを実施する場合,結果の解釈を補足するために方法B及び方法B'も行うことを推奨する。
A.1.2 かび発育抑制効果の測定(方法B及び方法B')
方法B及び方法B'では,炭素源を含む“完全な”培地存在下で,混合したかび胞子懸濁液を試料に接種
する。試料に栄養成分が含まれていない場合でも,かびは,試料上に発育でき,その代謝物は試料を侵食
する。
試料表面又は培地中にかびの発育阻止が認められた場合,プラスチック(試料)は,かび発育抑制力又
は殺かび力をもつと評価できる。
方法B'では,培地上にかびが十分発育してから試料を置く。
方法B及び方法B'は,表面汚染が予想される場合に行う。時間短縮及び結果(現象)のよりよい理解の
ために,二つの方法を同時に行うことを推奨する。
A.2 試験用のかびの種類
試験用のかびの種類は,表A.1による。
これら試験用のかびの菌株は,独立行政法人製品評価技術基盤機構が分譲している菌株とする。ただし,
世界微生物株保存連盟(WFCC)又は日本微生物資源学会に加盟している機関において保存されている同
一系統の菌株を使用することができる(保存機関は,表1参照)。
表A.1−試験用のかびの種類
番号
種類
基準株
1
アスペルギルス ニゲル(Aspergillus niger)
NBRC 105649(ATCC 6275)
2
ペニシリウム ピノヒルム(Penicillium pinophilum)
NBRC 100533(ATCC 36839)
3
ペシロミセス バリオッチ(Paecilomyces variotii)
NBRC 107725(ATCC 18502)
4
トリコデルマ ビレンス(Trichoderma virens)
NBRC 6355(ATCC 9645)
5
ケトミウム グロボスム(Chaetomium globosum)
NBRC 6347(ATCC 6205)
A.3 試験の準備
A.3.1 器具及び装置
この規格で用いる器具及び装置は,次による。
デシケータ
内部を標準的な温度・湿度条件(23 ℃,湿度50 %)に維持できるもの
天びん
0.1 mgを正確にひょう量できるもの
11
Z 2911:2018
実体顕微鏡
倍率を約50倍に調整できるもの
A.3.2 かびの保存及び使用
かびは,次の培地を用い,斜面培地で保存する。類似組成の市販乾燥培地に必要な成分を加え調製して
もよい。
オートミール
20 g
麦芽エキス
10 g
寒天
20 g
精製水
1 000 mL
121±1 ℃で20分間高圧蒸気滅菌する。
培養は,29±1 ℃又は24±1 ℃で行うが,この温度で4週間以上保存してはならない。また,培養中の
遺伝的変異及び生理的変異を防ぐため,継代回数を最小限にするための措置を講じる(凍結乾燥,4 ℃保
存,液体窒素保存など)。
A.3.3 試液及び培地
試液及び培地は,次による。
a) 殺菌剤
1) 70 %エタノール エタノールと精製水を質量比7:3で混合する。
2) ο-フェニルフェノール 90 %エタノール50 mLにο-フェニルフェノール1 gを溶解し,これを精製
水で1 000 mLにメスアップした後,乳酸でpHを3.5に調整する。
b) 無機塩溶液
硝酸ナトリウム
2.0 g
りん酸二水素カリウム
0.7 g
りん酸水素二カリウム
0.3 g
塩化カリウム
0.5 g
硫酸マグネシウム七水和物
0.5 g
硫酸鉄(II)七水和物
0.01 g
精製水
1 000 mL
pH
6.0〜6.5(滅菌0.01 mol/L水酸化ナトリウム溶液で調整)
c) 湿潤剤添加無機塩溶液 無機塩溶液[b)]に,N-メチルタウリン又はポリグリコールエーテルなどの,
かびの発育に影響を与えない湿潤剤を0.1 g/Lになるように添加し,121±1 ℃で20分間高圧蒸気滅菌
する。
d) グルコース添加無機塩溶液 無機塩溶液[b)]にグルコースを30±1 g/Lの割合で添加し,115±1 ℃
で30分間高圧蒸気滅菌する。
e) 無機塩寒天培地 無機塩溶液[b)]に寒天を20 g/Lの割合で添加して加熱溶解し,121±1 ℃で20分
間高圧蒸気滅菌する。高圧蒸気滅菌後のpHが6.0〜6.5になるように0.01 mol/L水酸化ナトリウム溶
液で調整する。
f)
グルコース添加無機塩寒天培地 無機塩寒天培地[e)]にグルコースを30±1 g/Lの割合で添加して加
熱溶解し,115±1 ℃で30分間高圧蒸気滅菌する。高圧蒸気滅菌後のpHが6.0〜6.5になるように0.01
mol/L水酸化ナトリウム溶液で調整する。
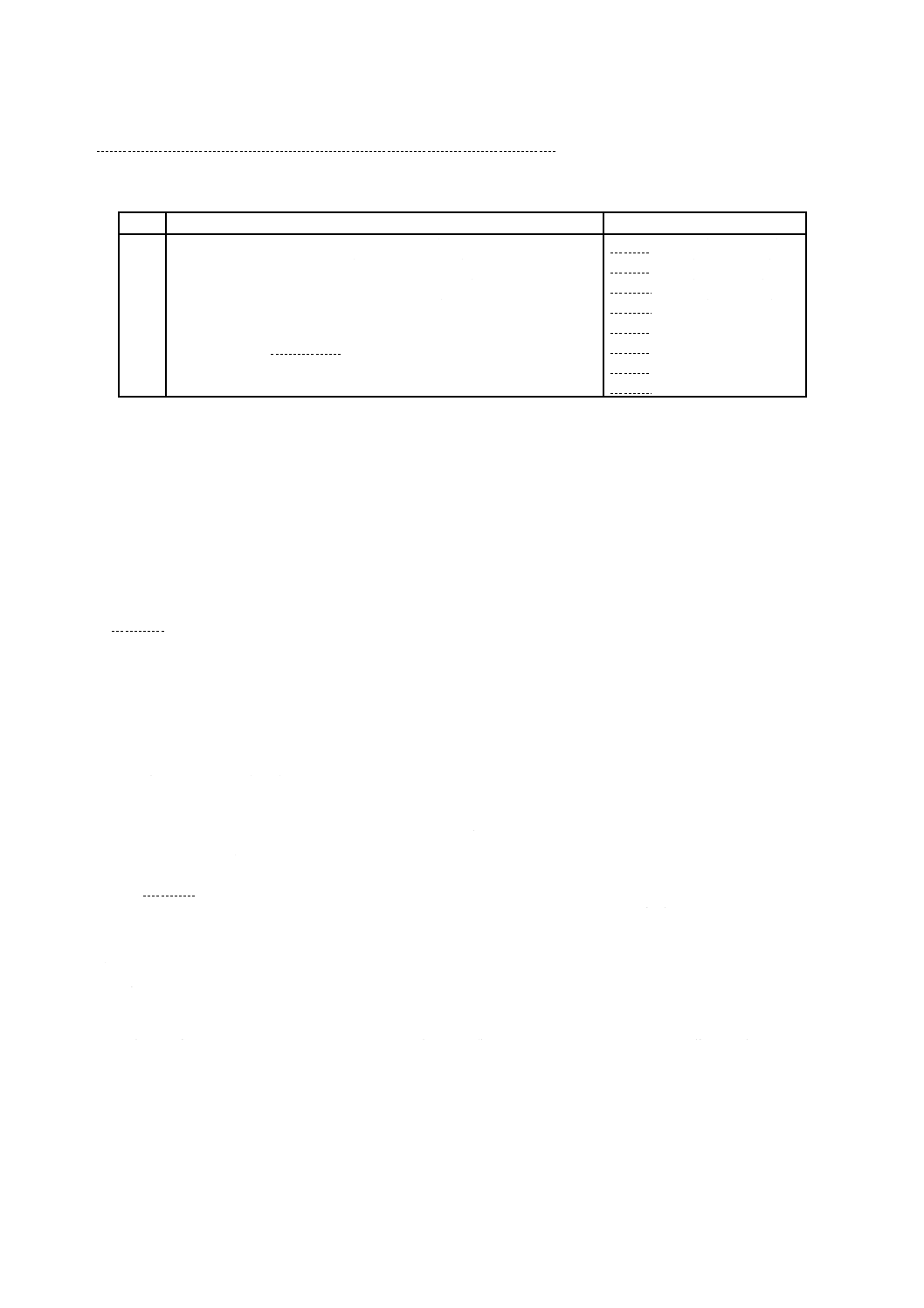
A.3.4 試料の調製
試料の形状及び大きさは,かびばく(曝)露後の評価法によって規定する。また,プラスチック表面に
12
Z 2911:2018
おけるかび抵抗性を試験するため,評価は同じ大きさの試料を比較することによって行う。
a) 厚さ変化の評価には,現物から切り出した試料を用いる。成型前の材質について試験する場合,0.5 mm
以下の厚さの試料を用いる。
b) 質量変化の評価には,正方形(一辺が30〜60 mm)で厚さ2 mm以下の試料を用いる。
c) 目視による外観変化の評価では,試料の大きさは重要ではないが,厚さは0.5〜2 mmであることが望
ましい。
A.3.5 試料数
次の三つのグループの試料を準備する。
グループ0(ゼロ対比):実験室にそのまま保存する。
グループI(接種区分):かびを接種し,培養する。
グループS(殺菌区分):殺菌後の試料をグループIと同一条件で保存する。
a) 目視による評価には,少なくとも各グループ5個,計15個の試料を準備する。
b) 質量変化の評価には,各グループ6個,計18個の試料を準備する。
c) 他の諸性質の評価には,関連規格で定められた試料数に従う。
各評価ごとに試料を用意するが,質量又はほかの物理的な性質の評価は,目視による評価用の試料と共
通でもよい。
A.3.6 試料の清浄化
方法Aで試験する場合,試料を70 %エタノールに約1分間浸した後,45 ℃で4時間乾燥する。試料が
エタノールによって劣化する場合,清浄化を行ってはならない。
方法B及び方法B'で試験する試料は,清浄化を行ってはならない。
A.3.7 試料のひょう量
質量変化の測定に用いる試料は,各試料の質量が0.1 mgの範囲で恒量になるまでデシケータ中で乾燥す
る(通常48時間)。恒量になったら,各試料の質量を記録する(m1,m2など)。特別な要求がない限り,
目視評価及び/又は質量以外の物理的な性質の評価では,この操作を行う必要はない。
A.4 試験操作
A.4.1 試験温度
試料の調製及び測定における標準的な条件は,23±1 ℃,湿度(50±3)%とする。試料の培養は,24
±1 ℃又は29±1 ℃,湿度95 %以上で行う。
A.4.2 試験操作の概要
試験操作の概要を,表A.2に規定する。
表A.2−試験操作の概要
方法
A
B
B'
試料を載せる培地
無機塩寒天培地
グルコース添加
無機塩寒天培地
なし
グルコース添加
無機塩寒天培地
試料区分
I
S
I
S
I2
I
S
試料に噴霧する溶液
胞子
懸濁液
70 %エタノール
又はο-フェニル
フェノール
胞子
懸濁液
70 %エタノール
又はο-フェニル
フェノール
胞子懸濁液
70 %エタノール
又はο-フェニル
フェノール
培養条件
24±1 ℃又は29±1 ℃,湿度95 %以上,4週間又はそれ以上培養
13
Z 2911:2018
A.4.3 方法A
A.4.3.1 試験用寒天平板培地の調製
シャーレに無機塩寒天培地を,培地の厚さが約5 mmとなるように無菌的に分注し,放冷して固化させ
る。
A.4.3.2 試料の設置
試料を可能な限り水平に試験用寒天平板培地上に置く。このとき,試料同士が触れ合ったり,シャーレ
の壁に触れないようにする。
A.4.3.3 胞子懸濁液の調製
胞子懸濁液の調製は,次による。
a) 単一胞子懸濁液の調製 十分に胞子形成が認められた各かびの斜面培地に5 mLの湿潤剤添加無機塩
溶液を加え,滅菌した白金線で表面の胞子を静かにこすり,試験管を静かに振って溶液中に胞子を分
散させる。この操作を同じかびの試験管で3回繰り返す。これらの溶液に滅菌したガラスビーズを入
れ,試験管を振った後,滅菌した木綿(例えば,ガーゼ,脱脂綿など)又はガラスウールでろ過し,
菌糸を取り除く。ろ液を遠心分離(例えば,約2 000 G,5分間)して上澄みを捨て,残留物を無機塩
溶液25 mLに懸濁させ,再び遠心分離する。残留物を無機塩溶液50 mLに懸濁させる(繰り返し洗浄
することによって,ある種のプラスチックではひび割れの原因となる界面活性剤を取り除く。)。
この懸濁液を血球計算盤又は濁度計を用いて,懸濁液1 mL当たりの胞子数が約106個になるように
調製する。
b) 混合胞子懸濁液の調製 各かびの単一胞子懸濁液を同量ずつ混合し,混合胞子懸濁液とする。この混
合胞子懸濁液は調製後,6時間以内に使用する。
A.4.3.4 胞子の活性の確認
グルコース添加無機塩寒天培地を分注した2枚の寒天平板培地表面に,単一胞子懸濁液1滴をそれぞれ
接種し,24±1 ℃又は29±1 ℃で3〜4日間培養し,菌糸の発育を確認する。菌糸の多量の発育が認めら
れない場合は,新たに胞子懸濁液を調製し,再試験を行う。
A.4.3.5 試料へのかびの接種又は試料の殺菌
グループIの試料については,試料及び寒天平板培地表面に混合胞子懸濁液0.1 mLを均等に噴霧,又は
ピペットで均等に滴下する。グループSの試料については,殺菌剤(70 %エタノール又はο-フェニルフェ
ノール)3 mLをピペットで試料に滴下する。
A.4.3.6 培養
試験用寒天平板培地の蓋をして,24±1 ℃又は29±1 ℃,湿度95 %以上で,4週間又は必要に応じてそ
れ以上培養する。このとき,試料表面に水滴が落ちないように注意する。4週間以上培養する場合,4週間
ごとに混合胞子懸濁液を再接種する。
目視による試験については,4週間の培養期間中に肉眼ではっきりとかびの発育が認められる場合,試
験は完了したと判断してもよい。
A.4.4 方法B
A.4.4.1 試験用寒天平板培地の調製
シャーレにグルコース添加無機塩寒天培地を,培地の厚さが約5 mmとなるように無菌的に分注し,放
冷して固化させる。
A.4.4.2 試料の設置
A.4.3.2と同様に設置する。試料の清浄化は,行ってはならない。
14
Z 2911:2018
A.4.4.3 胞子懸濁液の調製
A.4.3.3と同様に行い,遠心分離して洗浄した後の胞子懸濁液の調製は,グルコース添加無機塩溶液を用
いて行う。
A.4.4.4 胞子の活性の確認
A.4.3.4と同様に行う。
A.4.4.5 試料へのかびの接種又は試料の殺菌
グループIの試料については,試料及び寒天平板培地表面に混合胞子懸濁液を適切量を均等に噴霧,又
はピペットで均等に滴下する。グループSの試料については,殺菌剤(70 %エタノール又はο-フェニルフ
ェノール)を適当量ピペットで試料に滴下する。
A.4.4.6 培養
A.4.3.6と同様に行う。4週間以上培養する場合,4週間ごとに少量のグルコース添加無機塩溶液を試料
上に噴霧,又はピペットで滴下する。
A.4.5 方法B'
A.4.5.1 試験用寒天平板培地の調製
A.4.4.1と同様に行う。
A.4.5.2 試料の設置
試料の半分を試験用寒天平板培地の上に置き,これをグループSとする。試料を置いていない試験用寒
天平板培地をグループIとする。残り半分の試料は,寒天培地を分注していないシャーレに入れ,グルー
プI2とする。
A.4.5.3 胞子懸濁液の調製
A.4.4.3と同様に行う。
A.4.5.4 胞子の活性の確認
A.4.4.4と同様に行う。
A.4.5.5 試料へのかびの接種又は試料の殺菌
A.4.4.5と同様の操作によって混合胞子懸濁液の接種又は試料の殺菌を行う。
A.4.5.6 培養
グループSはA.4.4.6と同様に行う。グループIの寒天平板培地に菌糸が十分に発育し,胞子形成が認め
られない間(培養2〜3日間)にグループI2の試料を,シャーレからグループIの寒天平板培地上に移し,
A.4.4.6と同様に培養する。
A.5 評価
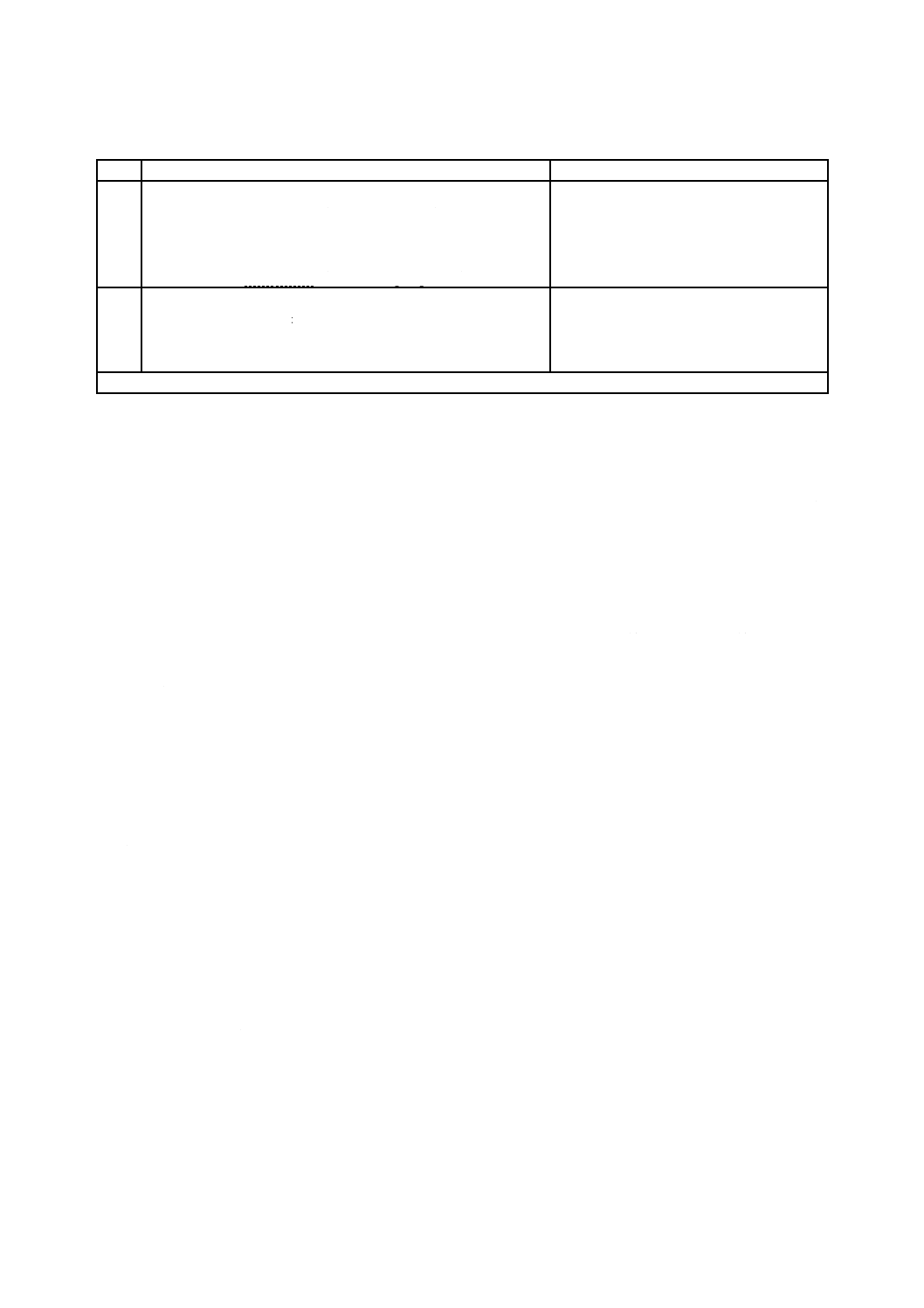
A.5.1 かび発育状態の評価
試験に用いた試料(グループI及びグループS)は,最初は肉眼によって観察し,必要に応じて実体顕
微鏡(倍率約50倍)で観察する。かびの発育状態の評価方法は,表A.3による1)。
同じグループの試料の目視による評価結果が3段階以上異なる場合は,新たな試料で再試験することが
望ましい。
清浄後の試料[A.5.2.a)]の評価結果の方が有用な情報が得られる場合がある。目視による試験結果の補
助手段としてカラー写真の撮影は,有効である。
注1) 評価の精確さを上げるために試料表面に格子を置き,かび発育面積の割合を評価可能にする方
法もある。
15
Z 2911:2018
表A.3−かび発育の評価
菌糸の発育評価
かび発育状態
肉眼及び実体顕微鏡下でかびの発育は認められない。
0
肉眼ではかびの発育が認められないが,実体顕微鏡下では明らかに確認できる。
1
肉眼でかびの発育が認められ,発育部分の面積は試料の全面積の25 %未満
2
肉眼でかびの発育が認められ,発育部分の面積は試料の全面積の25 %以上50 %未満
3
菌糸はよく発育し,発育部分の面積は試料の全面積の50 %以上
4
菌糸の発育は激しく,試料全面を覆っている。
5
A.5.2 質量又は他の物性変化の測定
質量又は他の物性変化の測定は,次による。
a) 試料の清浄化 培養後の試料を培地から取り出し,70 %エタノールに5分間浸した後,流水中でよく
すすぐ。余分な水分をろ紙で拭き取り,室温で一夜乾燥する。
b) 質量変化の測定 清浄化した試料をデシケータ中に置き,各試料の質量が0.1 mgの範囲で恒量になる
まで乾燥する(通常,48時間)。恒量になったら,各試料の質量を記録する(m'1,m'2など)。
かび接種前の試料と培養後の試料との質量の差を求める。質量変化の測定を行う場合,かび接種試
料と殺菌対照試料とは,同じ大きさでなければならない。
c) 他の物性変化の測定 かび接種前及び培養後の試料の物性を,可能であれば同時に測定する。測定方
法は,関連する試験方法による。
A.6 結果の表示
A.6.1 目視による評価
各試料のかび発育割合の評価結果を,表A.3によって表示する。必要に応じ,追加評価として,清浄後
の試料(A.5.1)についても同様に得られた結果を表示する。結果の解釈は,表A.4による。
表A.4−結果の解釈
方法 かびの発育状態
試料の評価
A
0
材質は,かびの栄養源とはならない(かびの発育に影響を与えないか抑制する)。
1
材質は,かびを僅かに発育させる程度の栄養源となる物質を含むか,汚染されている。
2〜5
材質は,かびに対して抵抗力がなく,かびの発育に適切な栄養源を含む。
B又
はB'
0
強力なかび発育抑制効果
0(阻止帯あり) 拡散性の物質による強力なかび発育抑制効果
1
不完全なかび発育抑制効果
2〜5
徐々にかび発育抑制効果は減少し,完全になくなる。
A.6.2 質量の変化
各試料の質量変化Δm(=m'−m)を測定し,各グループの算術平均
I
m
∆
,
S
m
∆
を計算し,記録する。質
量の変化の平均百分率(ΔM)を,式(A.1)によって,小数点以下1位まで計算する。
M
Δ
100
Δ
Δ
e
S
I
×
−
=
m
m
m
····························································· (A.1)
ここに,
e
m: 試験開始時の試料の平均質量
I
Δm: かび接種試料の平均質量
16
Z 2911:2018
S
Δm: 殺菌対照試料の平均質量
スチューデントのt検定のような統計解析によって,試料の質量変化の有意差(信頼限界99 %)を判定
する。
式(A.1)は,グループIの試料及びグループSの試料が同じ大きさで,かび接種前の質量との比較をする
場合だけ適応できる。
A.6.3 他の物性の変化
各グループの試料(0,I及びS)の物性変化の平均値を計算し,
0v, Iv及び Svとする。物性の変化は,
式(A.2)に従って,殺菌した試料の物性変化に対するかびを接種した試料の物性変化の百分率(ΔPS)で計
算する。
S
ΔP
100
S
I×
=vv
········································································ (A.2)
ここに,
Iv: かび接種試料の物性変化の平均値
Sv: 殺菌対照試料の物性変化の平均値
また,式(A.3)に従って,対比試料の物性変化に対するかびを接種した試料の物性変化の百分率(ΔPC)
を計算する。
C
ΔP
100
0
I×
=vv
········································································ (A.3)
ここに,
0v: かび未接種試料の物性変化の平均値
式(A.2)によって計算した値の方が式(A.3)によって計算した値に比べ,かび抵抗性をより特徴付ける値で
ある。
17
Z 2911:2018
附属書B
(規定)
電気製品・電子製品の試験
B.1
概説
この試験方法は,かびの選定及び胞子の接種から培養条件及び培養期間に至るまで含めている。
ここでは,異なる2種類の試験方法について規定する。方法1は,栄養分を含まない条件でかび胞子を
接種するのに対し,方法2は,かびの発育を支持する栄養液にかび胞子を懸濁させて接種する方法である。
かび発育による損傷に対するぜい(脆)弱さを評価する場合,プラスチックを対象として規定されている
ISO 846のような試験手順を用いることが望ましい。
表面汚染は,ほこり,はね水,凝縮した揮発性の栄養分又は油脂の形をとって製品上に堆積する。保管
中,使用中又は輸送中の製品の空気(雰囲気)へのばく露又は保護カバーなしでの接触によってもたらさ
れるこれらの表面汚染は,かびの定着を促進し,かびの著しい発育及び製品の損傷を引き起こす。方法2
を適用することによって,このような汚染による影響を評価する。
大きな複合製品を評価する場合,製品を入れることができるほど大きなチャンバ内において,必要な条
件を維持することは困難であるため,通常は幾つかのサブユニットに分けて試験する。類似した構造のサ
ブユニットであれば,代表する一つについて試験することによって,コストを最小限に抑える。
B.2
方法の概要
B.2.1 方法1
28日間培養後に測定する事項は,次による。
a) 目視検査によるかび発育の度合い
b) かび発育による物理的損傷
c) 関連仕様書に要求がある場合,かび発育による機能及び/又は電気的性能への影響
関連仕様書に要求がある場合,機能の確認及び/又は電気的性能の測定の前の全培養期間を56日間まで
延ばす。
B.2.2 方法2
栄養分による擬似汚染を伴う28日間培養後に測定する事項は,次による。
a) 目視検査によるかび発育の度合い
b) かび発育による物理的損傷
c) 関連仕様書に要求がある場合,かび発育による機能及び/又は電気的性能への影響
かびの発育なしに,擬似汚染物質として用いた栄養分の塗布が試料表面の耐性を弱めることがあるため,
機能の確認及び/又は電気的性能の測定を行う場合は,この影響について考慮することが望ましい。
栄養分の塗布によってかびは発育する。発育しない場合は殺かび効果について考慮する。
B.3
試験用のかびの種類
試験用のかびの種類は,表B.1による。
これら試験用のかびの菌株は,独立行政法人製品評価技術基盤機構が分譲している菌株とする。ただし,
世界微生物株保存連盟(WFCC)又は日本微生物資源学会に加盟している機関において保存されている同
18
Z 2911:2018
一系統の菌株を使用することができる(保存機関は,表1参照)。
表B.1−試験用のかびの種類
番号
種類
基準株
1
アスペルギルス ニゲル(Aspergillus niger)
NBRC 105649(ATCC 6275)
2
アスペルギルス テレウス(Aspergillus terreus)
NBRC 6346(ATCC 10690)
3
ケトミウム グロボスム(Chaetomium globosum)
NBRC 6347(ATCC 6205)
4
ホルモコニス レジネ(Hormoconis resinae)
NBRC 100535(DSM 1203)
5
ペシロミセス バリオッチ(Paecilomyces variotii)
NBRC 107725(ATCC 18502)
6
ペニシリウム ピノヒルム(Penicillium pinophilum)
NBRC 100533(ATCC 36839)
7
スコプラリオプシス ブレビカウリス(Scopulariopsis brevicaulis)
NBRC 100536(ATCC 36840)
8
トリコデルマ ビレンス(Trichoderma virens)
NBRC 6355(ATCC 9645)
B.4
試験の準備
B.4.1 試液及び培地
試液及び培地は次による。
a) 麦芽エキス寒天培地
麦芽エキス
25 g
寒天
15〜20 g
精製水
1 000 mL
121±1 ℃,15分間高圧蒸気滅菌する。
b) 無機塩溶液
りん酸二水素カリウム(KH2PO4)
0.7 g
りん酸水素二カリウム(K2HPO4)
0.3 g
硫酸マグネシウム七水和物(MgSO4・7H2O) 0.5 g
硝酸ナトリウム(NaNO3)
2.0 g
塩化カリウム(KCl)
0.5 g
硫酸鉄(II)七水和物(FeSO4・7H2O)
0.01 g
精製水
1 000 mL
pH 6.0〜6.5(0.01 mol/L水酸化ナトリウム溶液で調整)
121±1 ℃,20分間高圧蒸気滅菌する。
c) スクロース添加無機塩溶液 無機塩溶液[b)]に,スクロースを30 g/Lの割合で添加し,121±1 ℃,
20分間高圧蒸気滅菌する。
d) スクロース添加無機塩寒天培地 スクロース添加無機塩培地[c)]に,寒天を15〜20 g/Lの割合で添
加し,121±1 ℃,15分間高圧蒸気滅菌する。
e) 湿潤剤溶液 N-メチルタウリン又はポリグリコールエーテルなどの,かびの発育を支持又は抑制する
成分を含まない湿潤剤の0.005 %〜0.01 %溶液を調製し,121±1 ℃,20分間高圧蒸気滅菌する。
各かびの培養には表B.2に示した培地を用いることが望ましい。
19
Z 2911:2018
表B.2−推奨される培地
番号
かび
培地
1
アスペルギルス ニゲル(Aspergillus niger)
麦芽エキス寒天培地[B.4.1 a)]
2
アスペルギルス テレウス(Aspergillus terreus)
4
ホルモコニス レジネ(Hormoconis resinae)
5
ペシロミセス バリオッチ(Paecilomyces variotii)
6
ペニシリウム ピノヒルム(Penicillium pinophilum)
3
ケトミウム グロボスム(Chaetomium globosum)
スクロース添加無機塩寒天培地[B.4.1 d)]
7
スコプラリオプシス ブレビカウリス(Scopulariopsis
brevicaulis)
8
トリコデルマ ビレンス(Trichoderma virens)
ケトミウム グロボスムの培養においては,培地表面に滅菌したろ紙小片を載せる。
胞子懸濁液の調製は,十分に胞子形成が認められた菌株について行う。多くの場合,29±1 ℃で7〜14
日間培養すれば十分胞子形成する。菌株分譲機関は胞子形成を促進させるために別の培養条件を推奨する
場合がある。培養した菌株をすぐに使用しない場合は,5〜10 ℃の冷蔵庫で保管する。その場合の保管期
間は,6週間を超えてはならず,接種日から14日間に満たない菌株及び28日間を超えた菌株を冷蔵保管
してはならない。
菌株を培養した容器の蓋は,胞子懸濁液の調製を行うまで開けてはならない。
B.4.2 胞子懸濁液の調製
B.4.2.1 一般
培養後の菌株に湿潤剤溶液[B.4.1 e)]10 mLを静かに加え,滅菌した白金線又はニクロム線で培地表面
を静かにこすり,胞子を分散させる。この液を軽く混ぜ,菌糸から胞子を剝した後,滅菌したガラスウー
ル又は孔径40〜100 μmのフィルターで静かにろ過する。ろ液を遠心分離して上澄みを捨て,残留物を10
mL以上の滅菌精製水に懸濁させ,再び遠心分離する。この洗浄操作を3回繰り返す。
B.4.2.2 方法1
B.4.2.1で3回遠心分離した後の残留物(胞子)を無機塩溶液[B.4.1 b)]に懸濁させる。この懸濁液は目
視検査において使用する。
B.4.2.1で3回遠心分離した後の残留物(胞子)を滅菌精製水に懸濁させる。この懸濁液は機能の確認及
び/又は電気的性能の測定において使用する。
これらの懸濁液を血球計算盤又は濁度計を用いて,胞子濃度が1×106〜2×106個/mLとなるように調製
する。各かびの単一胞子懸濁液を同量ずつ混合し,接種用の混合胞子懸濁液とする。無機塩溶液を用いて
調製した混合胞子懸濁液は,調製後48時間以内に使用しなければならない。滅菌精製水を用いて調製した
混合胞子懸濁液は,調製後6時間以内に使用しなければならない。
B.4.2.3 方法2
B.4.2.1で3回遠心分離した後の残留物(胞子)をスクロース添加無機塩溶液[B.4.1 c)]に懸濁させる。
この懸濁液を血球計算盤又は濁度計を用いて,胞子濃度が1×106〜2×106個/mLとなるように調製する。
各かびの単一胞子懸濁液を同量ずつ混合し,接種用の混合胞子懸濁液とする。この混合胞子懸濁液は調製
後6時間以内に使用しなければならない。
B.4.3 対照試験片
純白ろ紙又は無処理の綿布を対照試験片とする。対照試験片をスクロース添加無機塩溶液[B.4.1 c)]に
浸せき(漬)後,取り出してしずくが落ちないようにする。調製した対照試験片は速やかに試験に用いる。
20
Z 2911:2018
B.4.4 試験装置
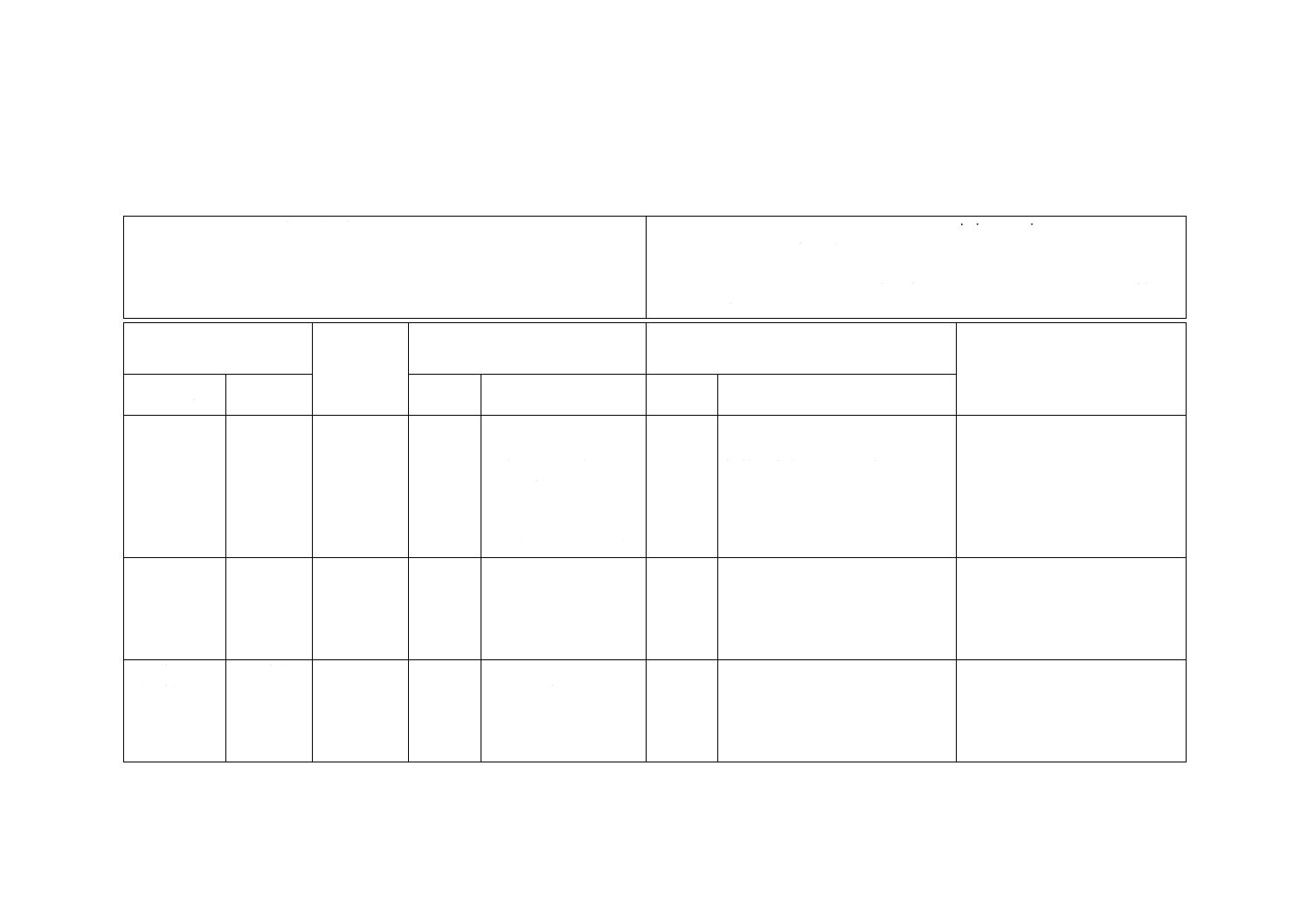
B.4.4.1 噴霧による接種
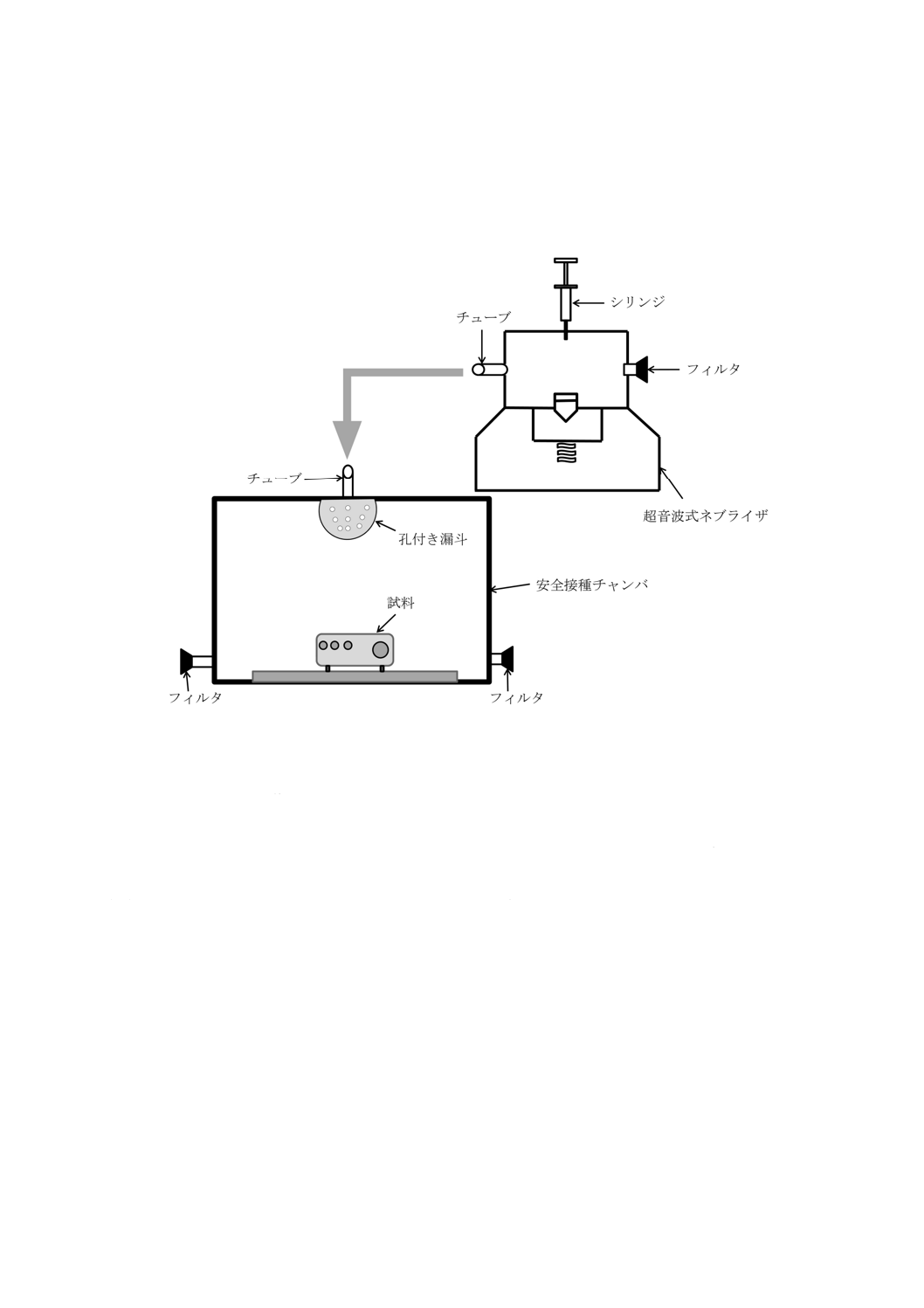
医療用の超音波式ネブライザを安全接種チャンバと連結して使用することが望ましい(図B.1参照)。
図B.1−噴霧による接種装置(例)
B.4.4.2 小さな試料の培養
試料及び対照試験片を載せるか又はつ(吊)るす装置を備えた,ガラス製又はプラスチック製の蓋付き
容器(以下,容器という。)を使用する。この容器は,内部の湿度が常時90 %以上に維持できるように,
底に貯めた水の表面積が十分な大きさになるような形状とする。試料及び対照試験片を載せるか又はつ
(吊)るす装置は,試料及び対照試験片が水に触れたり水滴が飛び跳ねないようにする。試料及び対照試
験片を入れた容器を28〜30 ℃に維持した恒温器内に設置する。恒温器のサーモスタットによる温度サイ
クルの幅は,1 ℃/hを超えてはならない。
B.4.4.3 大きな試料の培養
B.4.4.2で規定する容器に対して大きすぎる試料の培養には,適切な恒温恒湿器を用いる。この恒温恒湿
器には,外部空気の出入りを防ぐための密閉できる扉が必要である。また,湿度を90 %以上に維持し,庫
内の壁又は天井から試料又は対照試験片に結露が落ちないようにする。庫内の温度は28〜30 ℃に維持し,
サーモスタットによる温度サイクルの幅は1 ℃/hを超えてはならない。温湿度を一定に保つために空気を
強制的に循環させる場合,その流速は試料表面で1 m/sを超えてはならない。
21
Z 2911:2018
B.5
初期試験
試料の目視検査並びに電気的及び機械的な検査を行い,関連仕様書の要求に適合していることを確認す
る。
B.6
前処理
B.6.1 清浄化
試料は,“受け入れた”状態で供試して,通常,特別な清浄化を行わない。関連仕様書に従って清浄化を
行う場合,半分数の試料についてエタノール又は洗浄剤による洗浄並びに精製水によるすすぎを行う。残
りの半分数の試料については清浄化を行わず,“受け入れた”状態で供試する。これによって,かびの発育
が,製品を構成する部品の不適切な材質によるものなのか,表面汚染によるものなのかを見分ける。方法
1における評価“0”を要求する関連仕様書では,試料の汚染がかびの発育を促進する可能性があるため,
試料の清浄化の必要性を考慮することが望ましい。
B.6.2 高湿保管
混合胞子懸濁液を接種する4時間以上前に,試料を29±1 ℃,湿度90 %〜100 %で保管する。
B.7
試験条件
B.7.1 方法1
関連仕様書で機能の確認,及び/又は電気的性能の測定が要求される場合,次の二つのグループに分け
て行う。
a) グループ1 試料に胞子懸濁液を接種し,培養する。
b) グループ2 グループ1と同様の方法で噴霧,塗布又は浸せきによって,滅菌精製水を接種した試料
を陰性対照試料とし,殺菌した環境下においてグループ1と同様の温湿度条件で保管する。陰性対照
試料は,胞子懸濁液を接種した試料とは別のチャンバで保管する。陰性対照試料でかびの発育が認め
られないことを確実にするために,チャンバ内を適切な薬剤で殺菌する。関連仕様書で機能の確認及
び/又は電気的性能の測定が要求されない場合は,グループ1だけ行う。
B.7.2 方法2
次の二つのグループに分けて行う。
a) グループ1 栄養液に懸濁させた胞子を試料に接種し,培養する。試料に胞子懸濁液を接種し,培養
する。
b) グループ2 B.7.1 b)のグループ2と同様に行う。
B.8
接種
関連仕様書に別の規定がなければ,試料及び対照試験片(B.4.3)への胞子懸濁液(B.4.2)の接種は,噴
霧によって行う。試料の大きさ,デザイン又は他の特性によって噴霧が適切でない場合,関連仕様書の規
定に従って,浸せき又は塗布によって胞子懸濁液を接種してもよい。
B.9
培養
培養条件は,29±1 ℃,湿度90 %〜100 %とする。培養期間は,B.2による。この条件は,小さな試料
の場合は容器(B.4.4.2)内で,大きな試料の場合は恒温恒湿器(B.4.4.3)で維持する。
小さな試料の場合,接種直後速やかに,少なくとも3個の対照試験片とともに容器内に設置する。この
22
Z 2911:2018
とき,規定された湿度が保たれるように十分な間隔をあけて配置し,この容器を恒温器に入れる。適切性
という点から,陰性対照試料は,胞子懸濁液を接種した試料を設置した容器と同様の形状で,更に殺菌し
た別の容器内に対照試験片とは別に設置する。
大きな試料の場合,適切な数の対照試験片とともに恒温恒湿器内に設置する。陰性対照試料は,庫内を
殺菌した別の恒温恒湿器に設置する。このとき,陰性対照試料だけを入れることが望ましい。
容器又は恒温恒湿器は次の場合にだけ開け,開放時間は数分間だけとする。
a) 対照試験片の検査によって,胞子の生残及び7日後の培養条件が維持されていることを確かめる場合
b) 規定された培養期間が終了するまで,7日ごとに容器内に空気(酸素)を入れる場合
c) 中間の目視検査を行う場合
7日間培養後,全ての対照試験片に肉眼で1種類以上のかびの発育が確認できなければならない。そう
でない場合,試験は無効とみなし再試験を行う。再試験には同じ試料を用いてもよい。
関連仕様書で要求される場合,目視検査のときだけ,10分間以内であれば培養の中断は許容される。培
養期間内に行う目視検査は2回以内とし,目視検査に費やす時間について関連仕様書に規定する。
B.10 最終試験
B.10.1 目視試験
かびの発育状態は乾燥によって変化することがあるため,試料の確認及び/又は写真撮影(関連仕様書
の要求がある場合)は,容器又は恒温恒湿器から取り出してすぐに行う。
目視試験及びかびの発育評価の後,70 %エタノールを用いて試料表面から菌糸を取り除き,顕微鏡を用
いて状態及び侵食(例えば腐食)の広がりを評価する。
B.10.2 発育の影響
関連仕様書に高湿状態(培養後)での電気的及び/又は機械的確認が規定されている場合,確認が終了
するまで試料周囲の湿度が過度に低下しないようにする。そのため,小さな試料の確認は容器の蓋を閉め,
水分にさら(曝)された状態のまま行う。大きな試料の場合,恒温恒湿器に中に入れたまま確認を行う。
混合胞子懸濁液及び滅菌精製水を接種した試料についても同様に確認する。二つのグループに明らかな
相違が認められた場合,高湿度に加えてかびの発育が原因となっていると考えられるため,これらの確認
の後,試料を取り出し,目視試験を行い,最後に侵食の確認を行う。
関連仕様書で回復後の確認が規定されている場合,試料を容器又は恒温恒湿器から取り出し,目視試験
を行い,その後,回復のための特定条件に更に24時間さら(曝)した後に確認を行う。
B.10.3 発育度合い
試料の検査はまず肉眼で行い,必要であれば表示倍率50倍の実体顕微鏡を用いる。発育の程度は次によ
って評価する。
0:表示倍率50倍の観察で発育が認められない。
1:顕微鏡ではかび発育の痕跡が明白に見える。
2a:肉眼におけるまばらな発育及び/又は顕微鏡下における僅かな散在又は少しの局在が認められ,発
育面積は試料表面の5 %を超えない。
2b:肉眼における明白な発育及び/又は顕微鏡下における多くの箇所での多少均一な広がりが認められ,
発育面積は試料表面の25 %を超えない。
3:肉眼で発育が明白に見え,発育面積は試料表面の25 %を超える。
試料の構成部品によって発育度合いに違いがある場合,それらは別々に評価することが望ましい。
23
Z 2911:2018
なお,方法2における評価“0”は,発育抑制を確認する場合にだけ要求することが望ましい。
24
Z 2911:2018
附属書C
(規定)
光学機器・光通信機器の試験
C.1 試験方法
C.1.1 試験用のかびの種類
試験用のかびの種類は,表C.1による。
これら試験用のかびの菌株は,独立行政法人製品評価技術基盤機構が分譲している菌株とする。ただし,
世界微生物株保存連盟(WFCC)又は日本微生物資源学会に加盟している機関において保存されている同
一系統の菌株を使用することができる(保存機関は,表1参照)。
表C.1−試験用のかびの種類
番号
種類
基準株
1
アスペルギルス ニゲル(Aspergillus niger)
NBRC 105649
2
アスペルギルス フラブス(Aspergillus flavus)
NBRC 6343,又はNBRC 4295
3
アスペルギルス ベルシコロル(Aspergillus versicolor)
NBRC 33027
4
トリコデルマ ビレンス(Trichoderma virens)
NBRC 6355
5
ペニシリウム ピノヒルム(Penicillium pinophilum)
NBRC 6345,又はNBRC 100533
6
ペニシリウム シトリナム(Penicillium citrinum)
NBRC 6352
7
ペシロミセス バリオッチ(Paecilomyces variotii)
NBRC 30539,又はNBRC 107725
8
ケトミウム グロボスム(Chaetomium globosum)
NBRC 6347
9
ユーロチウム トノヒルム(Eurotium tonophilum)
NBRC 8157
10
アスペルギルス ペニシリオイデス(Aspergillus penicillioides) NBRC 33024
C.1.2 かびの保存及び使用
表C.1で規定するそれぞれのかびの菌株は,適切な斜面培地(例えば,C.2.1.1のポテト・デキストロー
ス寒天培地)で保存する。
胞子懸濁液の調製に用いるかびは,26±2 ℃で10〜20日間培養する。ユーロチウム トノヒルム
(Eurotium tonophilum)とアスペルギルス ペニシリオイデス(Aspergillus penicillioides)は,好乾性のか
びのため,培養にはC.2.1.2のM40Y寒天培地を用いる。また,培養は胞子が十分に着生するまで行う。
培養期間以上を経過した古いもの及び胞子懸濁液の調製に一度使用したものは,用いてはならない。
C.2 試験の準備
C.2.1 試薬及び培地
C.2.1.1 ポテト・デキストロース寒天培地(PDA培地)
ジャガイモは皮をむ(剝)き,芽の部分は深くえぐって取り除き,約10 mmのさいの目に切る。その
200 gを精製水1 000 mLで20分煮る。内容物を直ちにガーゼでろ別し,精製水を加えて1 000 mLとし,
グルコース20 g及び寒天20 gを加え,かくはん,加熱して溶解した後,121 ℃で20分間高圧蒸気滅菌す
る。高圧蒸気滅菌後のpHが25 ℃で5.4〜5.8になるように塩酸溶液又は水酸化ナトリウム溶液で調整する。
なお,類似組成の市販乾燥培地をそれぞれの調製方法に従って用いてもよい。

25
Z 2911:2018
C.2.1.2 M40Y寒天培地
M40Y寒天培地の組成は,次による。
スクロース
400 g
麦芽エキス
20 g
酵母エキス
5 g
寒天
20 g
精製水
1 000 mL
C.2.1.3 湿潤剤溶液
スルホこはく酸ジオクチルナトリウム50 mgを精製水1 000 mLに溶かした後,121 ℃で20分間高圧蒸
気滅菌する。
C.2.2 単一胞子懸濁液
C.2.2.1 単一胞子懸濁液の調製
C.1.2で培養した各々のかび寒天培地に,湿潤剤溶液10 mLを注ぎ込む。滅菌した白金耳又はその他の
適切な器具を用いて,胞子を注意深くこすり取る。このとき,培地の寒天片を削り取らないように注意す
る。湿潤剤溶液45 mLの入った滅菌した三角フラスコにこの胞子液を入れる。これに滅菌したガラスビー
ズを加えて激しく振り,分生子柄から胞子を引き離し,かつ,胞子の塊(クラスタ)を壊す。滅菌したガ
ラスウールで分散したかび胞子懸濁液をろ過し,混入した菌糸の破片を取り除く。
ろ液を遠心分離し,上澄みは捨てる。沈殿物を再度湿潤剤溶液50 mLに懸濁して,遠心分離する。この
方法を3回繰り返して胞子を洗浄する。
最終的に得られた沈殿物を,表C.2に規定する無機塩溶液でそれぞれの胞子懸濁液が血球計算盤又は濁
度計を用いて1 mL当たり0.8×106〜1.2×106個の胞子を含むように希釈する。
表C.2−胞子懸濁液に用いる無機塩溶液
成分
質量
りん酸二水素カリウム
0.7 g
りん酸水素二カリウム
0.7 g
硫酸マグネシウム七水和物
0.7 g
硝酸アンモニウム
1.0 g
塩化ナトリウム
0.005 g
硫酸鉄(II)七水和物
0.002 g
硫酸亜鉛七水和物
0.002 g
硫酸マンガン一水和物
0.001 g
精製水
1 000.0 g
121 ℃で20分間,高圧蒸気滅菌する。
滅菌後のpHを0.01 mol/Lの水酸化ナトリウム溶
液で6.0〜6.5に調節する。
C.2.2.2 胞子懸濁液の確認
適切な寒天培地(例えば,C.2.1.1のポテト・デキストロース寒天培地)を入れたシャーレ10枚にそれ
ぞれの菌株の胞子懸濁液を接種して直ちに培養し,1週間後のかびの発育能力を調べる。ユーロチウム ト
ノヒルム(Eurotium tonophilum)とアスペルギルス ペニシリオイデス(Aspergillus penicillioides)では,
C.2.1.2のM40Y寒天培地を入れたシャーレを用い,20日間後の時点で発育能力を調べる。いずれかの菌
26
Z 2911:2018
株の発育が認められない場合は,これらの胞子を用いて行った全ての試験結果は,無効とする。新たに培
養した胞子で胞子懸濁液を調製し,再試験を行う。
C.2.3 混合胞子懸濁液
C.2.2.1で調製した10種類の単一胞子懸濁液を等量ずつとり,混合してこれを混合胞子懸濁液とする。
各々のかび培養から調製した単一胞子懸濁液,混合胞子懸濁液は,調製後24時間以上経過したものは試験
に用いてはならない。
C.2.4 対照試験片
培養器又は恒温恒湿槽が最適な暴露条件であることを確認するため,試料とともに少なくとも3個の対
照試験片を入れる。試料があらかじめ防かび剤で処理されている場合は,揮発性防かび剤のために対照試
験片のかびの発育が妨げられることがあるため対照試験片は使わない。この場合,同一の環境条件である
別の培養器又は恒温恒湿槽で,各々の単一胞子懸濁液を別個の対照試験片に接種培養し,その結果を対照
として使う。
対照試験片は,白の滅菌ろ紙を用い,C.2.5に規定する試料と同じ寸法にする。対照試験片を表C.3に規
定した栄養液に浸して無菌的な環境中につる(吊)して乾燥する。栄養液は対照試験片を浸す直前に新し
く調製する。対照試験片は,調製後,24時間以内に使用する。
栄養液は,内容物をよく溶かした後,121 ℃で20分間滅菌し,滅菌後のpHが5.3になるように塩酸溶
液又は水酸化ナトリウム溶液で調整する。
表C.3−対照試験片浸せき用栄養液
成分
質量
りん酸二水素カリウム
0.1 g
硝酸アンモニウム
0.1 g
硫酸マグネシウム七水和物
0.025 g
酵母エキス
0.05 g
グリセリン
10.0 g
精製水
90.0 g
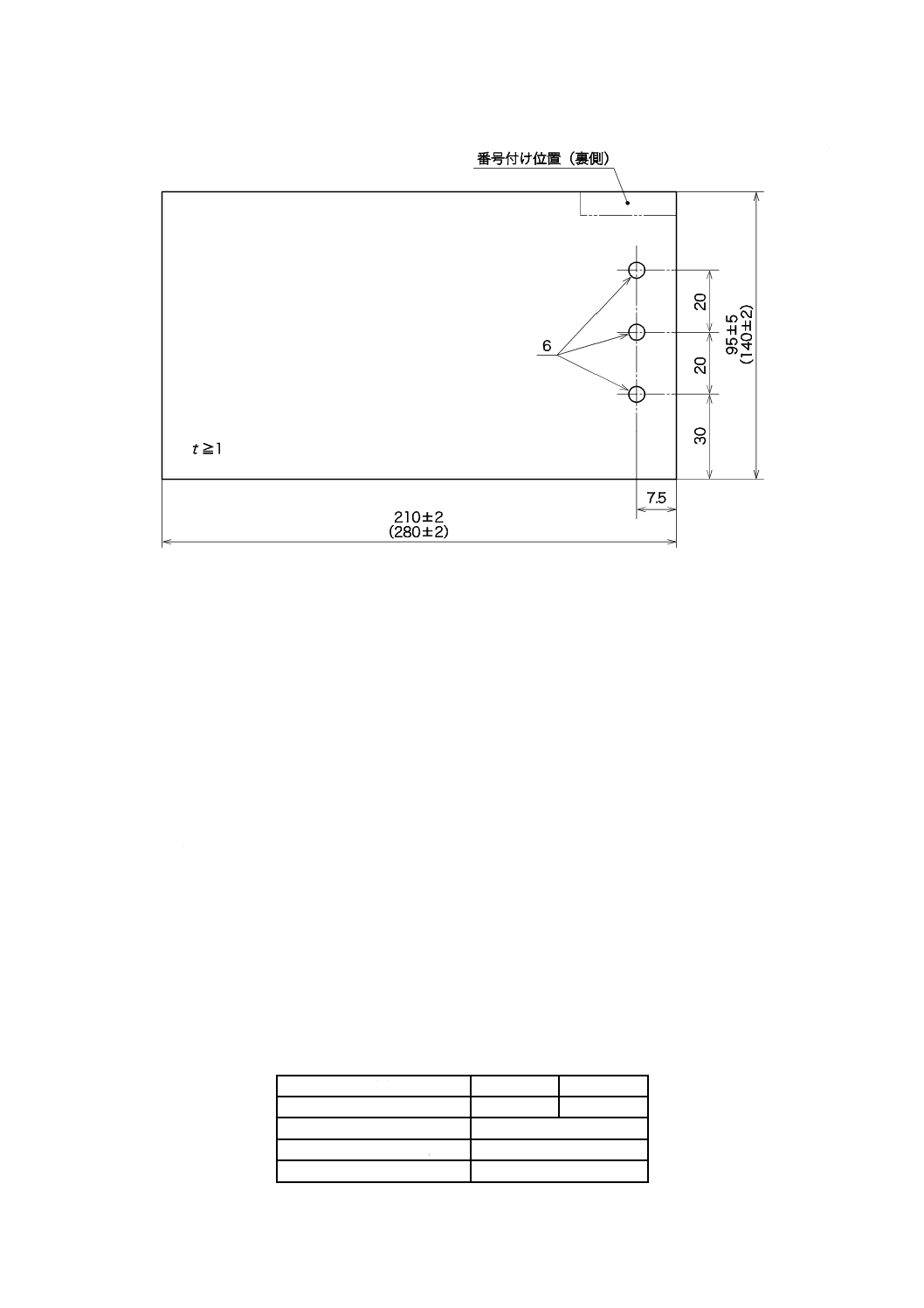
C.2.5 試料の調製
機器全体又は部品がこの規格の試験に必要とされる場合を除き,代表的な試料を用いてこの試験を行う。
試験片の大きさは,図C.1による。非金属の被覆剤又は潤滑剤の試験の場合は,少なくとも厚さ(t)が1
mmのものを用いて試験する。
試験に用いる被覆剤(例えば,ワニス)は,その機器又はその機器の部品に使用される被覆剤と同じ組
成でなければならない。
被覆剤を施す前に,実際の機器を製造するときに行うのと同じ方法で試料の表面を処理する。試料は,
とりわけその端,角及び穴の端などを覆うように周囲を完全に被覆する。番号付けなどのときに破損しな
いように,番号,その他は被覆を施す前に付けておく。試料を180〜200 ℃の温度で滅菌し,その後,片
面にだけ薄膜になるように被覆する。
培養装置,恒温恒湿装置中に試料をつる(吊)す場合には,ジグ[ガラス製のかぎ(鉤)又はポリアミ
ド製のひも(紐)]を使用する。
27
Z 2911:2018
単位 mm
図C.1−試料片の例(寸法は,括弧内に示したものを使用してもよい)
C.2.6 培養装置及び恒温恒湿装置
培養装置又は恒温恒湿装置は,29±1 ℃に調節し,この温度は±0.5 ℃/hの範囲内で変動してもよい。
培養装置又は恒温恒湿装置は,防湿性のあるものを用い,ばく露中にこれらの槽内に圧力が発生しないよ
うに圧力を逃がす細管又は弁を設置しておく。
通常,ばく露中は装置内の空気は循環させない。空気を循環させることが規格に含まれる場合,流速は
0.5 m/s以下とする。
加湿には精製水を使用するか,又は硫酸カリウム飽和溶液(十分な量の結晶が残留していること)をデ
シケータの底全体に入れて,必要な湿度(溶液上では96 %に達する)を維持してもよい。
試料に接種した混合胞子懸濁液が,洗い流されないように試料の表面に結露させない。同じ理由で,槽
の壁から水滴が試料上に落ちないようにする。
試料を支持するジグの接触面積は,できる限り小さくする。
試験装置の大きさと試料の並べ方は,全ての試料が均一の条件,かつ,通気性を保つよう配置する。必
要がある場合,ばく露中の試験装置の温度と湿度とを連続的に記録する。
C.3 ばく露試験条件
ばく露試験の条件は,表C.4による。
表C.4−暴露試験条件
過酷度
01
02
ばく露期間 日
28
84
温度 ℃
29±1
湿度 %
96±2
試料表面の胞子数 個/cm2
1.2×104〜1.8×104
28
Z 2911:2018
C.4 試験操作
C.4.1 試料の洗浄
特別に規定がない限り,試料は湿潤剤溶液(C.2.1.3)で洗浄後,つる(吊)して乾燥する。試料の洗浄
中,(布又は脱脂綿のような)洗浄材料の破片が残らないように注意する。
試験前及び試験中は,指紋,その他で試料を汚さないように取り扱う。試料に潤滑剤などを塗布する場
合,ばく露直前に行う(C.2.5)。
C.4.2 接種
試料と少なくとも三つ以上の対照試験片(C.2.4)に混合胞子懸濁液(C.2.3)を接種する。噴霧器を使っ
て混合胞子懸濁液を噴霧し,試料及び対照試験片上の胞子が平均で1.2×104〜1.8×104 個/cm2になるよう
にする。
C.4.3 培養
試料及び対照試験片は,接種後15分間以内に培養装置又は恒温恒湿装置に入れる。培養装置又は恒温恒
湿装置は,試料の培養を始める少なくとも4時間前から所定の条件になるように調節し,作動しておく。
試験中,空気の入替えのために,培養装置又は恒温恒湿装置を1週間に1度,数秒間だけ開ける。
かびの発育評価だけでなく,かびの発育によって生じる腐食,光学機器の透過度測定評価を行う場合,
接種試料と同数の非接種試料を別の同じ条件の培養装置又は恒温恒湿装置でばく露する。この方法によっ
て,試料に生じた損傷がかびの発育による損傷なのか,又は環境条件による損傷なのかを区別する。
C.4.4 試験条件下でのかびの発育確認
培養7日間後にかびの発育を調べ,もし,対照試験片又はシャーレ(C.2.2.2)上のかびの発育が極めて
僅かか,又は全く発育がない場合には,全ての試験は無効であり,再試験を行う。
試験終了後,対照試験片上のかびの発育(コロニー)が7日間後の検査の状態より十分濃くなっていな
ければ,その試験は無効であり,再試験を行う。
C.4.5 判定
特別に明確な規定がない限り,試験終了時の判定は,試料を乾燥させずに行う。かびの発育を判定する
前に試料を洗浄してはならない。腐食評価を行うときは,かびの発育を判定した後に,水と柔らかい布と
を用いて,注意深く菌糸を取り除いて非接種試料と比較する。
C.4.6 発育程度の評価
C.4.3の培養の結果,試料の表面上に生じた菌糸の発育状態を肉眼及び倍率50倍の実体顕微鏡で観察す
る。発育程度の評価は,表C.5による。
表C.5−発育程度の評価方法
結果の表示
菌糸の発育面積比
発育程度
0a)
0 %
試料にかびは発育していない。
1a)
10 %未満
かびの発育はまばらか,又は限定されている(痕跡)。
2
10 %以上 30 %未満
試料表面にかびの集落が間欠的又はまばらに伸びている(裸眼で見える)。
3
30 %以上 70 %未満
かびの発育量は多い(容易に見える)。
4
70 %以上
大量のかびが発育
注a) これらの菌糸の発育量を評価するときは,適切な照明下において倍率50倍で観察する。
C.4.7 評価
C.4.6による試験結果の表示に基づいて,かびの成長度が2又はそれ以下であった場合,試験試料は,適
切なかび抵抗性をもっているとする。
29
Z 2911:2018
附属書JA
(参考)
JISと対応国際規格との対比表
JIS Z 2911:2018 かび抵抗性試験方法
ISO 846:1997,Plastics−Evaluation of the action of microorganisms
ISO 9022-11:2015,Optics and photonics−Environmental test methods−Part 11: Mould
growth
IEC 60068-2-10:2005,Environmental testing−Part 2-10: Tests−Test J and guidance:
Mould growth
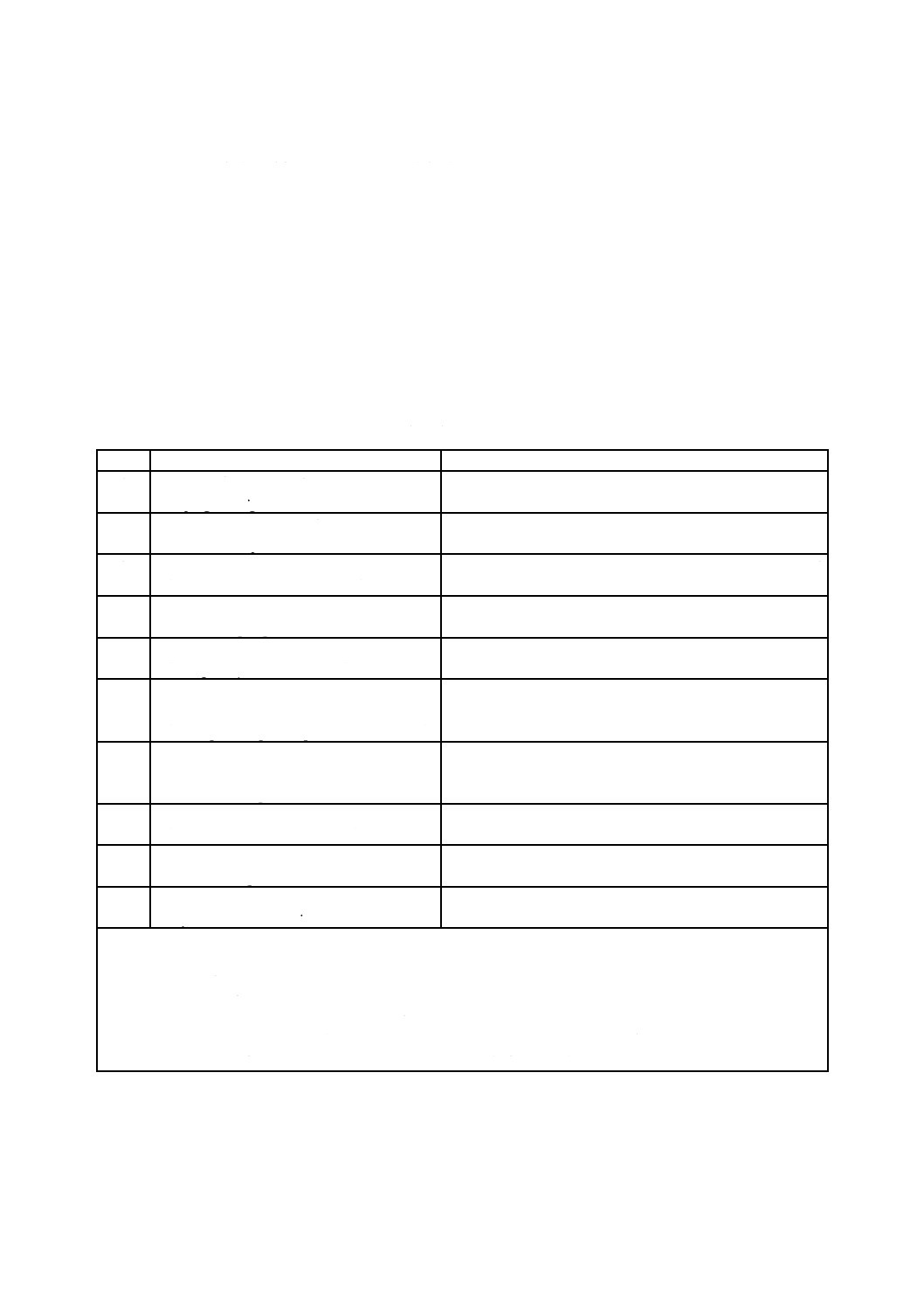
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲
ISO 846
ISO 9022-11
IEC
60068-2-10
1
1
1
プラスチック製品のか
び抵抗性について規定
光学機器・光通信機器の
かび抵抗性について規
定
電気製品・電子製品のか
び抵抗性について規定
追加
計測機器,木竹製品,ガラス製品,
繊維製品,塗料及び皮革製品のかび
抵抗性試験に,ISO規格及びIEC
規格を追加して全ての工業製品・工
業材料のかび抵抗性を規定
2 引用規格〜
9 皮革及び皮
革製品の試験
−
−
−
追加
対応国際規格に規定されていない
一般工業製品のうち計測機器,木材
製品及びガラス製品,繊維製品,塗
料並びに皮革製品の試験を,日本工
業規格として追加
附属書A
(規定)
プラスチック
製品の試験
A.2 試験用
のかびの種
類
ISO 846
5.2.1
試験用のかびの菌株に
ついて規定
変更
JISでは,試験用のかびの菌株を,
国内でも入手しやすいNBRC株を
主とし,世界微生物株保存連盟又は
日本微生物資源学会に保存されて
いる同一系統の菌株を規定
ISO 846では,アメリカ(ATCC)
及びイギリス(CMI)株を主とし,
オランダ(CBS),ドイツ(DSM),
日本(旧IFO,現NBRC)などの
菌株を規定
3
Z
2
9
11
:
2
0
1
8
30
Z 2911:2018
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書A
(規定)
プラスチック
製品の試験
(続き)
A.3.2 かび
の保存及び
使用
ISO 846
5.2.2
かびの保存及び使用に
ついて規定
変更
JISでは類似組成の市販乾燥培地の
使用について規定
高圧蒸気滅菌の温度をISO 836で
は120 ℃±1 ℃と規定しているが,
JISでは国内で一般に行われいる
121±1 ℃と規定
国内における技術的な事情による
もので,実質的な差異はない。
A.3.3 試液
及び培地
5.2.3
試液及び培地の調製方
法について規定
変更
高圧蒸気滅菌の温度をISO 836で
は120 ℃±1 ℃と規定しているが,
JISでは国内で一般に行われいる
121±1 ℃と規定
国内における技術的な事情による
もので,実質的な差異はない。
A.4.2 試験
操作の概要
(表A.2)
8.2
(Table 3)
試験方法について規定
削除
JISでは,細菌及び土壌の試験を削
除し,かびの試験だけを規定
ISO 846では,かびの試験のほか
に細菌及び土壌を用いた試験も規
定
A.6.2 質量
の変化
10.2
質量の変化について規
定
追加
式に記号を追加
式の理解を助けるためのもので,
実質的な差異はない。
12
報告書の書き方につい
て規定
削除
JISでは,報告書の書き方について
規定していない
ISO 846では,報告書の詳細な書
き方を規定
附属書B
(規定)
電気製品・電
子製品の試験
B.3 試験用
のかびの種
類
IEC
60068-2-10
6.1
試験用のかびの菌株に
ついて規定
変更
JISでは,試験用のかびの菌株を,
国内でも入手しやすいNBRC株を
主とし,世界微生物株保存連盟又は
日本微生物資源学会に保存されて
いる同一系統の菌株を規定
IEC 60068-2-10では,アメリカ
(ATCC)を主とし,イギリス
(CMI)オランダ(CBS),ドイツ
(DSM),日本(NBRC,IAM)な
どの菌株を規定
B.4.1 試液
及び培地
6.3
AnnexE
E.2
試液及び培地の調製方
法について規定
変更
高圧蒸気滅菌の温度をIEC
60068-2-10では(120±1)℃と規定
しているが,JISでは国内で一般に
行われいる121±1 ℃と規定
国内における技術的な事情による
もので,実質的な差異はない。
3
Z
2
9
11
:
2
0
1
8
31
Z 2911:2018
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書C
(規定)
光学機器・光
通信機器の試
験
C.1.1 試験
用のかびの
種類
ISO 9022-11
3.1
試験用のかび種につい
て規定
追加
JISでは,試験用のかびの菌株を,
国内でも入手しやすいNBRC株を
主とし,世界微生物株保存連盟又は
日本微生物資源学会に保存されて
いる同一系統の菌株を規定
ISO 9022-11では,菌株を規定して
いない。
C.1.2 かび
の保存及び
使用
3.2.1
かび用培地及び培養条
件を規定
変更
JISでは,PDA培地を推奨,好乾性
かびの培地としてM40Y寒天培地
を指定し,培養条件などを詳細に規
定
ISO 9022-11では,かび用培地とし
て麦芽寒天培地が推奨され,培養
条件が詳細に規定されていない。
C.2.1.1 ポ
テト・デキ
ストロース
寒天培地
C.2.1.2
M40Y寒天
培地
3.2.1
かび用培地及び培養条
件を規定
追加
JISでは,PDA培地の調製法及び
M40Y寒天培地の組成を規定
ISO 9022-11では,培地に関する詳
細は規定されていない。
C.2.1.3 湿
潤剤溶液
3.2.2
胞子懸濁液について規
定
変更
JISでは,湿潤剤としてスルホこは
く酸ジオクチルナトリウムを規定
ISO 9022-11では,湿潤剤としてス
ルホこはく酸ジオクチルナトリウ
ム及びラウリル硫酸ナトリウムを
推奨
C.2.2.1 単
一胞子懸濁
液の調製
3.2.2
胞子懸濁液について規
定
変更
高圧蒸気滅菌の温度をISO 9022-11
では120 ℃と規定しているが,JIS
では国内で一般に行われいる
121 ℃と規定
国内における技術的な事情による
もので,実質的な差異はない。
C.2.2.2 胞
子懸濁液の
確認
3.2.2
胞子懸濁液について規
定
変更
JISでは,胞子の発育能力の調査方
法について,詳細に規定
ISO 9022-11では,胞子の発育能力
の調査方法を,詳細に規定してい
ない。
JISと国際規格との対応の程度の全体評価:(ISO 846:1997,ISO 9022-11:2015,IEC 60068-2-10:2005,MOD)
3
Z
2
9
11
:
2
0
1
8

32
Z 2911:2018
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
Z
2
9
11
:
2
0
1
8