T 3322:2018
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成······························································································································· 2
5 物理的要求事項 ················································································································ 3
5.1 透明性 ························································································································· 3
5.2 清浄度 ························································································································· 3
5.3 破壊強度 ······················································································································ 3
5.4 漏れ試験 ······················································································································ 3
5.5 おすめす(雄雌)かん(嵌)合部······················································································ 3
5.6 保護キャップ ················································································································ 3
5.7 硬膜外麻酔用フィルタ ···································································································· 3
5.8 ベント ························································································································· 3
6 化学的要求事項 ················································································································ 3
7 生物学的安全性 ················································································································ 4
8 無菌性の保証 ··················································································································· 4
9 エンドトキシン ················································································································ 4
10 製造販売業者が提供する情報 ···························································································· 4
11 包装 ····························································································································· 4
11.1 一次包装 ····················································································································· 4
11.2 二次包装 ····················································································································· 4
12 表示 ····························································································································· 4
12.1 一次包装 ····················································································································· 4
12.2 二次包装 ····················································································································· 4
12.3 図記号の使用 ··············································································································· 5
附属書A(規定)物理試験 ····································································································· 6
附属書B(規定)硬膜外麻酔用フィルタ孔径の評価方法バクテリアチャレンジ試験 ··························· 7
T 3322:2018
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器テクノロジー協会(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具
して日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正
した日本工業規格である。
これによって,JIS T 3322:2011は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本工業規格 JIS
T 3322:2018
滅菌済み硬膜外麻酔用フィルタ
Sterile single use anesthesia filters for use with epidural catheter
序文
この規格は,2011年に制定され,今日に至っている。その後,この規格で引用しているコネクタ規格(ISO
594-1:1986及びISO 594-2:1998)に関して,新たにISO 80369-6が制定されたため,この規格においても
引用規格として追加するよう改正をした。
1
適用範囲
この規格は,硬膜外麻酔用カテーテルと接続し,麻酔薬及び鎮痛薬中の微小異物,細菌及び真菌を除去
するフィルタで,そのまま直ちに使用でき,かつ,1回限りの使用で使い捨てる滅菌済み硬膜外麻酔用フ
ィルタ(以下,硬膜外麻酔用フィルタという。)について規定する。
注記 2021年1月31日までJIS T 3322:2011を適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0307 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
JIS T 3211:2011 滅菌済み輸液セット
JIS T 3219:2011 滅菌済み輸液フィルタ
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
ISO 80369-6:2016,Small bore connectors for liquids and gases in healthcare applications−Part 6: Connectors
for neuraxial applications
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
エンドトキシン試験用水
日本薬局方の第二部医薬品に規定する注射用水又はその他の方法によって製造した水で,エンドトキシ
2
T 3322:2018
ン試験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの(JIS T 3211参照)。
3.2
一次包装
硬膜外麻酔用フィルタを直接に覆う包装。硬膜外麻酔用フィルタの無菌性を保持するためのもので,さ
らに,これが二次包装される場合には,いわゆる“内袋”に該当する。
3.3
二次包装
一次包装を直接に覆う包装。通常,複数の一次包装された硬膜外麻酔用フィルタ,例えば,50本を入れ
た包装。
3.4
おすめす(雄雌)かん(嵌)合部
おす(雄)又はめす(雌)のかん(嵌)合部が,テーパ又は他の構造によって,器具と器具との接続及
び離脱が可能な部分(JIS T 3211参照)。
3.5
保護キャップ
おすめす(雄雌)かん(嵌)合部が,直接外気に触れることを防ぐためのキャップ。
3.6
硬膜外麻酔用フィルタ
硬膜外麻酔用カテーテルと接続し,麻酔薬及び鎮痛薬中の微小異物,細菌並びに真菌を除去するフィル
タ。
3.7
ベント
硬膜外麻酔用フィルタの容器内から空気を排出する装置。
3.8
バクテリアチャレンジ試験
硬膜外麻酔用フィルタの一次側から指標となる菌を含む試験液を注入し,二次側から出てきた試験液を
培養することで,硬膜外麻酔用フィルタの菌補捉性能を評価し,指標菌の大きさから硬膜外麻酔用フィル
タの孔径を確認する試験。
4
構成
硬膜外麻酔用フィルタは,フィルタ本体及びおすめす(雄雌)かん(嵌)合部からなり,また,これら
に保護キャップを附属してもよい。一般的な硬膜外麻酔用フィルタの構成及び各部の名称を,図1に例示
する。
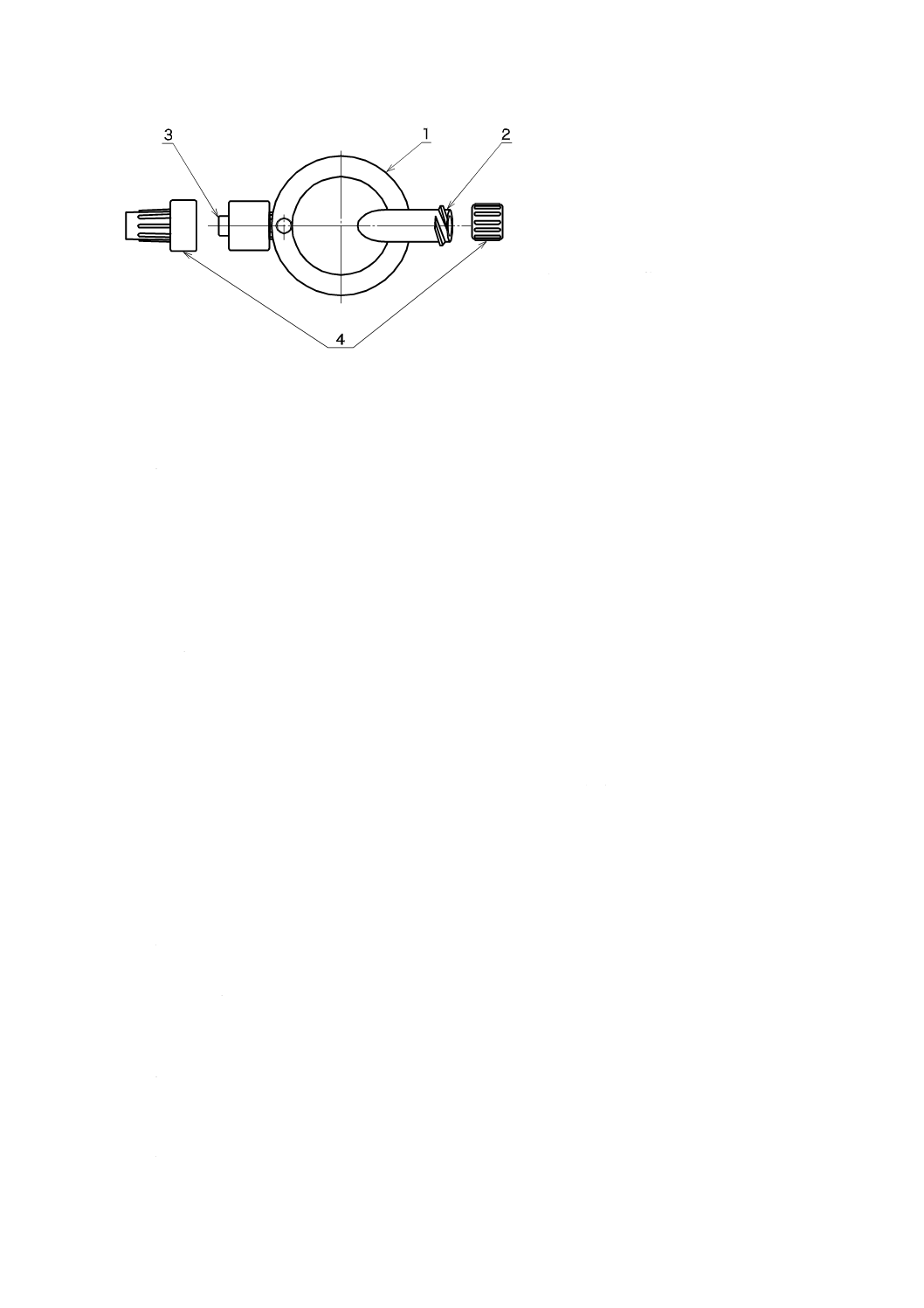
3
T 3322:2018
1
フィルタ本体
2
めす(雌)かん(嵌)合部(一次側)
3
おす(雄)かん(嵌)合部(二次側)
4
保護キャップ
図1−硬膜外麻酔用フィルタの構成及び各部の名称例
5
物理的要求事項
5.1
透明性
JIS T 3219の5.1による。
5.2
清浄度
JIS T 3211の5.1による。
5.3
破壊強度
硬膜外麻酔用フィルタは,A.1によって試験したとき,15 Nの力で15秒間の引張りに耐える強度をもた
なければならない。
5.4
漏れ試験
硬膜外麻酔用フィルタは,微生物の侵入を防止する気密性をもたなければならない。また,A.2によっ
て試験したとき,水漏れがあってはならない。
5.5
おすめす(雄雌)かん(嵌)合部
おすめす(雄雌)かん(嵌)合部は,ISO 594-1:1986,ISO 594-2:1998又はISO 80369-6に適合しなけれ
ばならない。また,A.3によって試験したとき,かん(嵌)合部から水漏れがあってはならない。
注記 ISO 80369-6の適用範囲に該当する製品がISO 594-1:1986及びISO 594-2:1998を適用できる期
間については,“神経麻酔分野の小口径コネクタ製品の切替えについて”(平成29年12月27
日付け医政総発1227第1号,薬生薬審発1227第1号,薬生機審発1227第1号,薬生安発1227
第1号厚生労働省医政局総務課長,医薬・生活衛生局医薬品審査管理課長,同医療機器審査管
理課長,同医薬安全対策課長連名通知)に示されている。
5.6
保護キャップ
JIS T 3211の5.12による。
5.7
硬膜外麻酔用フィルタ
5.7.1
硬膜外麻酔用フィルタの孔径は,0.2 μmとする。
5.7.2
附属書Bによって硬膜外麻酔用フィルタの孔径を確認する。
5.8
ベント
JIS T 3219の5.8による。
6
化学的要求事項
JIS T 3211の箇条6による。
4
T 3322:2018
7
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
8
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
9
エンドトキシン
硬膜外麻酔用フィルタ10本を試料としてとり,エンドトキシンフリーの輸液セットなどの硬膜外麻酔用
フィルタ内部へ液を注入できる器具を用い,各硬膜外麻酔用フィルタの内部にエンドトキシン試験用水40
mLを約10 mL/minの速さで流し,その液を合わせて試験液とし,日本薬局方のエンドトキシン試験法に
よって試験を行ったとき,エンドトキシンは,0.5 EU/mL未満でなければならない。
10 製造販売業者が提供する情報
製造販売業者は,注射筒で注入する場合の硬膜外麻酔用フィルタの耐圧に関する情報,及び急激な圧力
をかけない旨を,添付文書などで情報提供しなければならない。
11 包装
11.1 一次包装
一次包装は,微生物の侵入を防止することができ,かつ,通常の取扱い,輸送及び保管中に,内容製品
を適切に保護できなければならない。また,一次包装は,一度開封したならば,簡単に再シールできず,
開封したことが明確に分からなければならない。
11.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもたなければならない。
12 表示
12.1 一次包装
一次包装には,次の事項を表示する。
a) 硬膜外麻酔用フィルタ孔径(μm)
b) “滅菌済み”の旨
c) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
d) 製造番号又は製造記号
12.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合には,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 認証又は承認番号
c) 販売名

5
T 3322:2018
d) 硬膜外麻酔用フィルタ孔径(μm)
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) 製造番号又は製造記号
i)
滅菌年月
j)
ISO 80369-6をかん(嵌)合部に用いた場合には,識別表示を行う。識別は“ISO 80369-6”の文字又
はISO 80369-6に適合した製品であること等を表示する。
12.3 図記号の使用
12.1及び12.2の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよ
い。
注記 JIS T 0307に規定する主な図記号の例を,表1に示す。
表1−JIS T 0307に規定する主な図記号の例(参考)
6
T 3322:2018
附属書A
(規定)
物理試験
この附属書は,箇条5に規定する物理的要求事項の物理試験について規定する。
A.1 破壊強度試験
おす(雄)かん(嵌)合部からめす(雌)かん(嵌)合部方向に15秒間,15 Nの静的引張力を加える。
接続部が,適用した試験の力に耐えるかどうかを調べる。
A.2 漏れ試験
20〜30 ℃で,硬膜外麻酔用フィルタに水を充塡し,圧縮空気供給装置に接続し,他の開口部を閉じ,300
kPaの圧力を15秒間加えたとき,水漏れがあってはならない。
A.3 おすめす(雄雌)かん(嵌)合部に関する漏れ試験
20〜30 ℃で,おすめす(雄雌)かん(嵌)合部は,ISO 594-1:1986,ISO 594-2:1998又はISO 80369-6
に規定したリファレンスコネクタで密封し,そのかん(嵌)合部は水を満たして300 kPaの圧力を15秒間
加え,かん(嵌)合部に水漏れがないか調べる。
注記 ISO 80369-6の適用範囲に該当する製品がISO 594-1:1986及びISO 594-2:1998を適用できる期
間については,“神経麻酔分野の小口径コネクタ製品の切替えについて”(平成29年12月27
日付け医政総発1227第1号,薬生薬審発1227第1号,薬生機審発1227第1号,薬生安発1227
第1号厚生労働省医政局総務課長,医薬・生活衛生局医薬品審査管理課長,同医療機器審査管
理課長,同医薬安全対策課長連名通知)に示されている。

7
T 3322:2018
附属書B
(規定)
硬膜外麻酔用フィルタ孔径の評価方法
バクテリアチャレンジ試験
この附属書は,硬膜外麻酔用フィルタ孔径の評価方法について規定する。
B.1
試験液の調製
Brevundimonas diminuta ATCC 19146 1)を日本薬局方無菌試験用チオグリコール酸培地IIを用いて,30〜
32 ℃で24時間培養後,この培養液2 mLをとり,滅菌した加乳糖ブイヨン1 000 mLに入れ,30〜32 ℃
で24時間培養する2)。この培養液を生理食塩水で希釈し試験液とする。最終の希釈は,同培地を用いて希
釈する3)。ただし,この試験液1 mLに含まれる菌数は約106個とする。
注1) Brevundimonas diminuta ATCC 19146は,この種のメンブレンフィルタの菌捕捉性能評価試験に
一般的に用いられている細菌で,公益財団法人発酵研究所にも同じものがIFO 14213として保
存されている。
2) 加乳糖ブイヨンの調製法は,ASTM F838-83に準じて行うことができる。
3) 最終の希釈を培地で行う理由は,試験液のろ過液をそのまま培養するため,ろ過液が菌の発育
に十分な栄養状態である必要からである。
B.2
操作
試験液15 mLを注射筒にとり,注射筒の先端に硬膜外麻酔用フィルタを付け,試験液をゆっくりと,ほ
とんど全て押し出し,この流出液を試験管にとる。流出液の入った試験管を30〜32 ℃で少なくとも7日
間培養する。このとき,硬膜外麻酔用フィルタ内に残った試験液は,注射筒を用いて空気圧で押し出す。
B.3
判定
この培養液について,肉眼で菌の発育を認めたときは,不適合とする。
参考文献 ASTM F838-83,Standard Test Method for Determining Bacterial Retention Of Membrane Filters
Utilized For Liquid Filtration


