T 3308:2012
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 物理的要求事項 ················································································································ 3
5.1 材料 ···························································································································· 3
5.2 外観及び清浄度 ············································································································· 3
5.3 針先 ···························································································································· 4
5.4 内針 ···························································································································· 4
5.5 外針の寸法の許容差 ······································································································· 4
5.6 外針針基のテーパの合致 ································································································· 4
5.7 引抜強さ ······················································································································ 4
5.8 漏れ ···························································································································· 5
5.9 弾性 ···························································································································· 5
5.10 曲げ強さ ····················································································································· 6
5.11 刃面マーク ·················································································································· 6
5.12 誘導針 ························································································································ 6
5.13 三方活栓 ····················································································································· 6
6 化学的要求事項 ················································································································ 6
6.1 試験液及び空試験液の調製 ······························································································ 6
6.2 pH ······························································································································ 7
6.3 溶出金属の制限 ············································································································· 7
7 無菌性の保証 ··················································································································· 7
8 生物学的安全性 ················································································································ 7
9 エンドトキシン ················································································································ 7
9.1 せき(脊)髄くも膜下麻酔針 ··························································································· 7
9.2 誘導針 ························································································································· 7
10 包装 ····························································································································· 7
10.1 一次包装 ····················································································································· 7
10.2 二次包装 ····················································································································· 7
11 表示 ····························································································································· 8
11.1 一次包装 ····················································································································· 8
11.2 二次包装 ····················································································································· 8
11.3 図記号の使用 ··············································································································· 8
T 3308:2012
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3308:2006は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3308:2012
せき(脊)髄くも膜下麻酔針
Sterile single-use needles for spinal anesthesia
序文
この規格は,2006年に制定され,今日に至っている。今回,使用者の利便性のため用語,文書構成など
の内容を変更して改正した日本工業規格である。
なお,対応国際規格は現時点で制定されていない。
1
適用範囲
この規格は,くも膜下くう(腔)への麻酔,鎮痛薬の投与及び/又は髄液の採取に用いる鋭利な先端を
もつ滅菌済みのせん(穿)刺針で,そのまま直ちに使用でき,かつ,単回使用するせき(脊)髄くも膜下
麻酔針について規定する。
なお,平成27年6月30日までJIS T 3308:2006は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS G 4305:2005 冷間圧延ステンレス鋼板及び鋼帯
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
JIS T 3210:2011 滅菌済み注射筒
JIS T 3321:2008 誘導針
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices及びAmendment 1:2001
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
外針
麻酔又は鎮痛薬を投与する目的でくも膜下くう(腔)にせん(穿)刺挿入する,単くう(腔)の針管と
外針針基とからなる器具。針管は円筒形のものと非円筒形のものとがあり,また,針管表面に目安として
2
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目盛が付されているものもある。
3.2
内針
髄液流出などを防止することを目的として,外針内くう(腔)に挿入してあり,くも膜下くう(腔)ヘ
達したとき,外針から簡単に引き抜くことができるつまみの付いた器具。
3.3
外針針基
外針の針先の反対側に,注射筒などを接続するために接合されている金属製又は樹脂製の部品。
3.4
つまみ
内針を引き抜くことを目的とした,内針の針先と反対側に取り付けてある指でつまむ部品。
3.5
三方活栓
流路切替えが可能な部品。外針針基に付ける。
3.6
誘導針
せき(脊)髄くも膜下麻酔針をせん(穿)刺する部位に,あらかじめせん(穿)刺しせき(脊)髄くも
膜下麻酔針のせん(穿)刺のガイドをする注射針。
3.7
公称外径
せき(脊)髄くも膜下麻酔針の包装又は容器に表示された針管の外径の寸法。非円筒形のものは,最大
径及び最小径を表示する。
3.8
公称長さ
せき(脊)髄くも膜下麻酔針の包装又は容器に表示された針管の長さの寸法(図1参照)。
3.9
精製水
日本薬局方(以下,“日局”という。)の医薬品各条に規定する“精製水”又はこれと同等以上の水。
3.10
エンドトキシン試験用水
日局の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキシン試
験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3.11
一次包装
せき(脊)髄くも膜下麻酔針を直接に覆う包装。せき(脊)髄くも膜下麻酔針の無菌性を保持するため
のものをいう。さらに,これを二次包装する場合には,“内袋”に該当する。
3.12
二次包装
一次包装を直接に覆う包装で,通常,複数の一次包装されたせき(脊)髄くも膜下麻酔針,例えば,100
本を入れた包装。
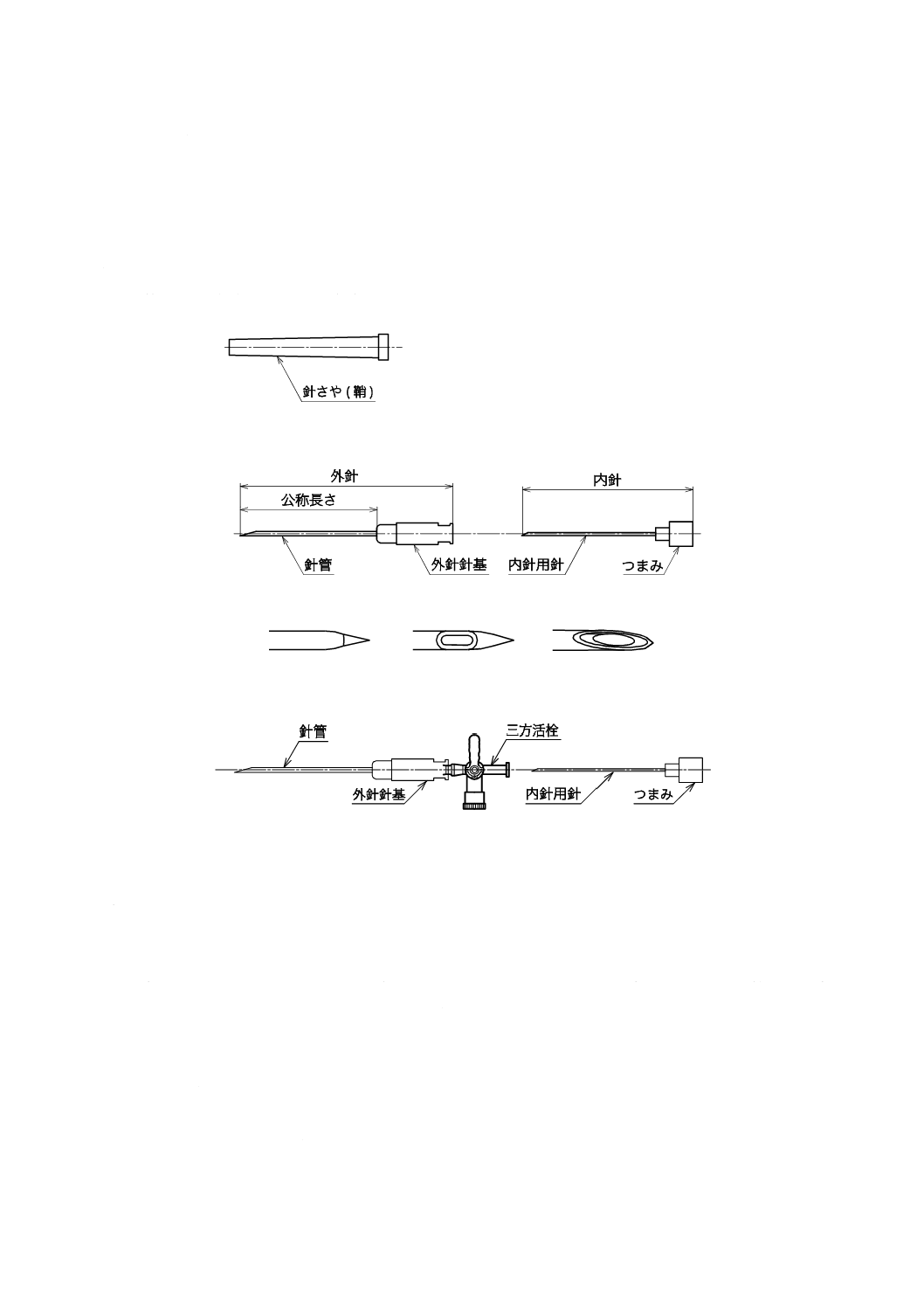
3
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
構成及び各部の名称
せき(脊)髄くも膜下麻酔針は,主として針管及び外針針基からなる外針と,内針用針及びつまみから
なる内針とで構成する。場合によって三方活栓が付くものもある。針先は,鋭利で,斜めにカットしたも
のとペンシルポイント形のものとがあり,外針の針先の先端が開口していないものは外針の針先部の近い
ところに孔をあけたものがある。また,針刺し事故防止装置が付くもの,せん(穿)刺の補助具として誘
導針がキットとして附属するものもある。
一般的なせき(脊)髄くも膜下麻酔針の例を,図1〜図3に示す。
図1−せき(脊)髄くも膜下麻酔針例
a)
b)
c)
図2−針先の形状例
図3−三方活栓付きの形状例
5
物理的要求事項
5.1
材料
針管及び内針用針の材料は,JIS G 4305に規定するSUS304,SUS304L若しくはSUS321,又はISO 9626
の材料の項に適合するステンレス鋼とする。
潤滑剤としてシリコーン油を用いる場合,シリコーン油は,シリコーン油基準又はこれと同等以上の基
準に適合しなければならない。潤滑油の量は,針管の表面に液滴を認めたり,内面にたまりを認める量で
あってはならない。
注記 シリコーン油基準には,厚生労働省が定めたシリコーン油基準がある。
5.2
外観及び清浄度
外観及び清浄度は,次による。
a) 目視で検査したとき,針管及び内針用針の外面はきずがなく,仕上げ面が滑らかで,表面に微粒子又
は異物の付着があってはならない。
4
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 目視で検査したとき,針管の内面には,有害な酸化物,切り粉などの微粒子又は異物の付着がなく,
外針針基の内面には微粒子又は異物の付着があってはならない。
c) 目視で検査したとき,外針は真っすぐであり,正常な切断面又は針先で,針管は正常な厚さでなけれ
ばならない。
d) 針先の形状が図2のc) に該当するものは,外針の刃面向きと内針の刃面向きは一致しなければなら
ない。
5.3
針先
針先は,鋭利に研磨してあり,目視で分かるばり,ささくれなどがあってはならない。
5.4
内針
針先の形状が図2のc) に該当するものは,針先が外針の刃面と合うなどのコアリングを防止する構造
とする。
5.5
外針の寸法の許容差
外針の寸法の許容差は,次による。
a) 外針の外径の公称外径に対する許容差は,−3 %〜+8 %とするか,又はISO 9626の規定による。
b) 外針の長さの公称長さに対する許容差は,10 mm以下のものは±20 %,10 mmを超え20 mm未満のも
のは±8 %,20 mm以上40 mm未満のものは±7 %,40 mm以上60 mm未満のものは±5 %,及び60 mm
以上のものは±3 %とする。
5.6
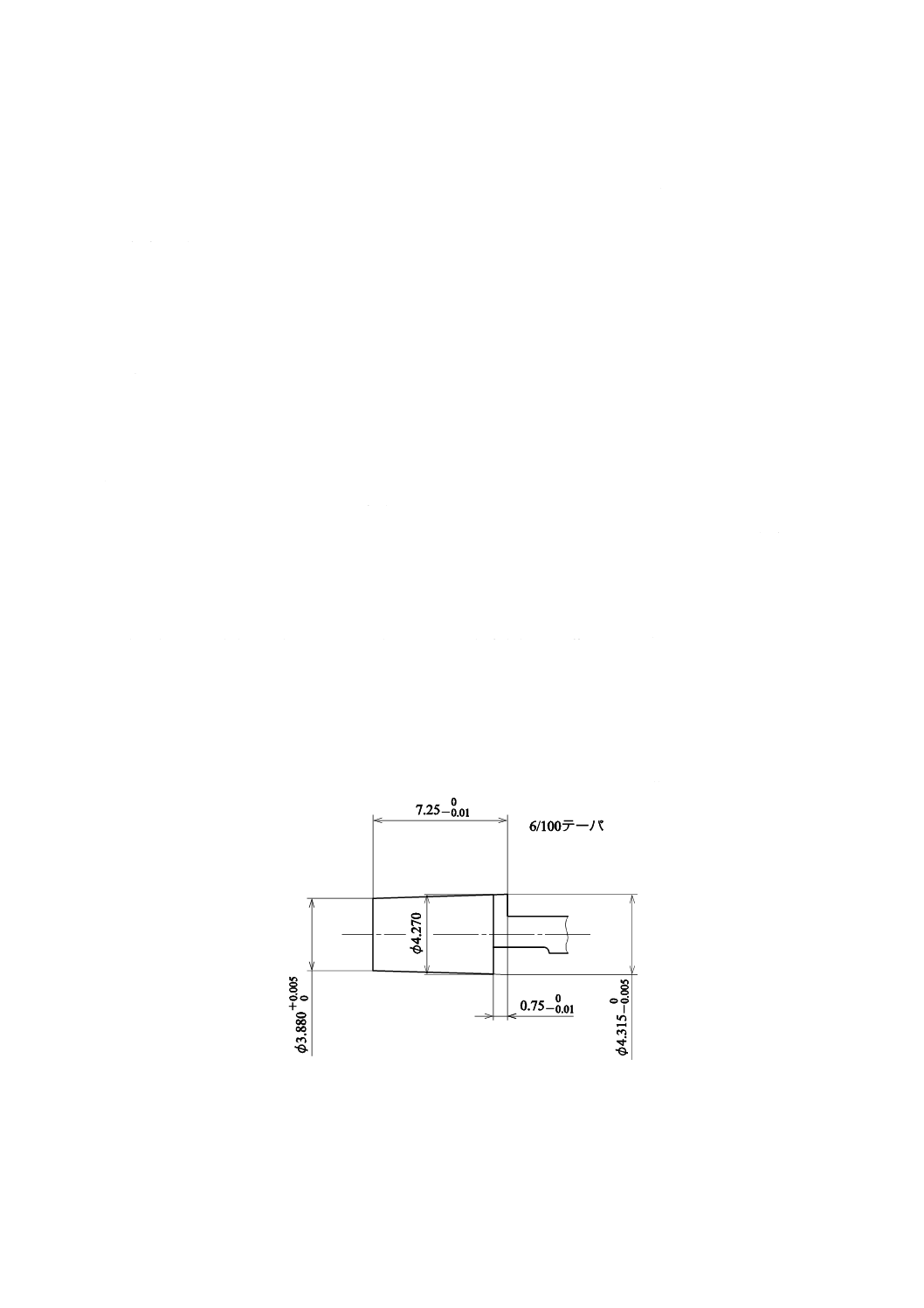
外針針基のテーパの合致
図4のISO 594-1に規定するおす(雄)・ルアーテーパ検査ゲージ[ISO 594-1のFigure 3−Gauges for testing
6 % (Luer) conical fittings c) Gauge for testing female conical fittings of all materials参照]を使用できる構造の
せき(脊)髄くも膜下麻酔針は,外針針基を5 Nの力でゲージに入れたとき,外針針基のめす(雌)・ルア
ーテーパとゲージのテーパとは合致し,かつ,外針針基の先端は,ゲージの限度内でなければならない。
また,図4に示す検査ゲージを使用できない構造のせき(脊)髄くも膜下麻酔針(ロック接合)は,ISO 594-2
に規定する検査ゲージを用いる。
単位 mm
図4−おす(雄)・ルアーテーパ検査ゲージ
5.7
引抜強さ
外針の公称外径に応じて,外針の中心軸方向に表1の力で引っ張ったとき,針管は外針針基から引き抜
けてはならない。
5
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1−引抜強さ
針管の公称外径
mm
力
N
0.3
0.33
0.36
0.4
0.45
0.5
0.55
0.6
0.65
0.7
0.8
0.9
1.1
1.2以上
22
22
22
22
22
22
34
34
34
40
44
54
69
69
5.8
漏れ
次のいずれかの方法によって試験をしたとき,これに適合しなければならない。
a) 第1法 内針を取り外し,外針の針基[三方活栓付きにあっては内針を引き抜いた三方活栓のめす(雌)
かん(嵌)合部]をJIS T 3210に適合した注射筒の筒先に27.5 Nの力ではめ合わせる。このとき少し
ねじってもよい。注射筒のファーストライン(JIS T 3210参照)を5 mLの目盛に合わせ,針の先端に
ゴム栓を刺し,針先から空気が漏れないようにした後,針先から針基(三方活栓付きは,三方活栓ま
で)を水中に没する。注射筒のファーストラインを2 mLの目盛まで押し,15秒間観察する。この間,
針と針基との接合部(三方活栓付きは,外針針基と三方活栓との接合部も含める。)及び針基(又は三
方活栓)と試験用注射筒の筒先とのはめ合わせ部から連続した気泡の発生を認めてはならない。
b) 第2法 内針を取り外し,外針の針基[三方活栓付きにあっては内針を引き抜いた三方活栓のめす(雌)
かん(嵌)合部]を,水圧試験装置に取り付けられたISO 594-1で規定する標準おす(雄)かん(嵌)
合具(Reference steel male conical fitting)に,27.5 Nの力ではめ合わせる。このとき少しねじってもよ
い。次に針の先端にゴム栓を刺し,針先から水が漏れないようにした後,0.2 MPaのゲージ圧で水を
送り込み,15秒間観察する。この間,針管と外針針基との接合部(三方活栓付きは,外針針基と三方
活栓との接合部又は接続部も含める。)及び外針針基(又は三方活栓)と標準おす(雄)かん(嵌)合
具とのはめ合わせ部から,水滴となって落ちるような水漏れを認めてはならない。
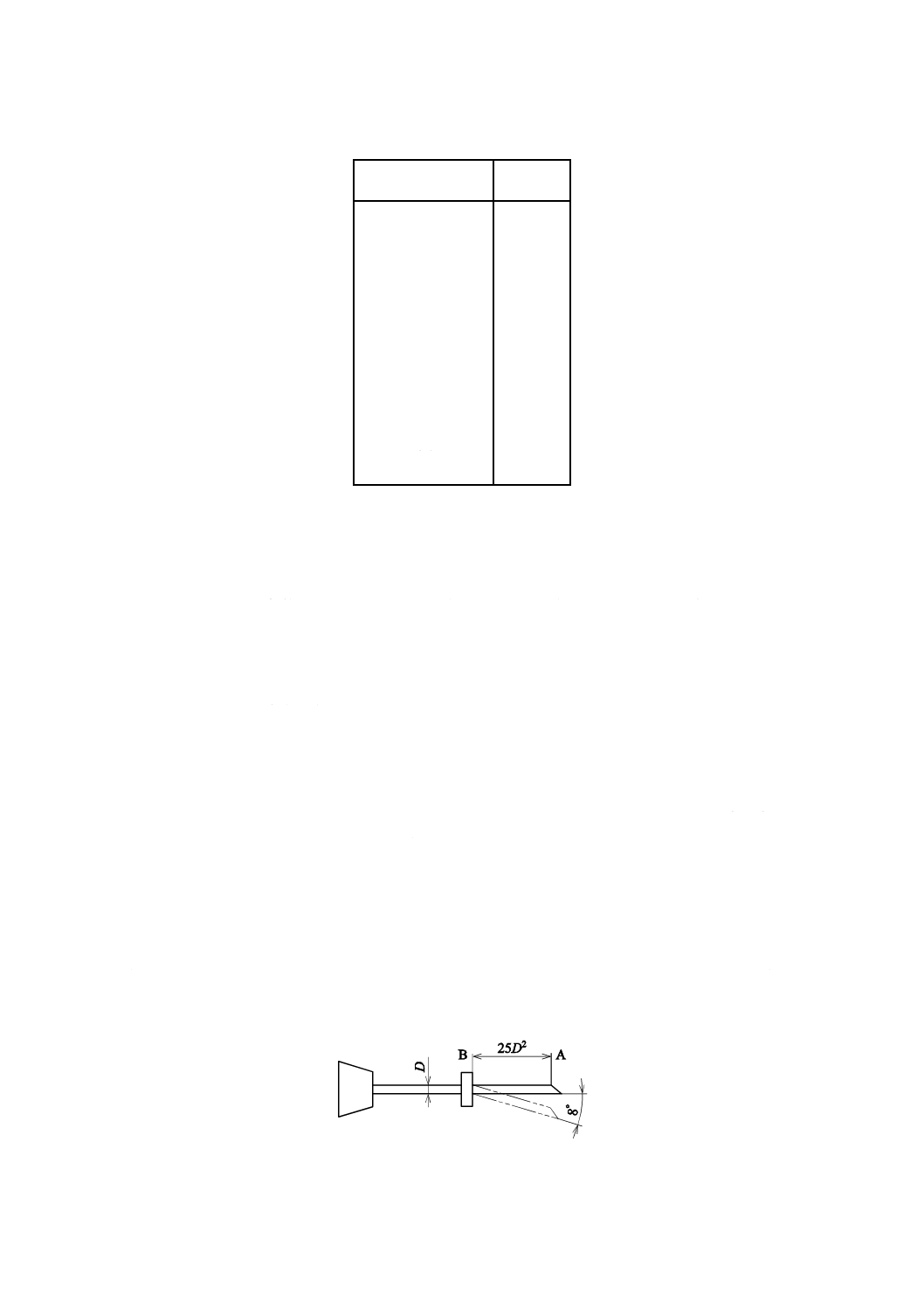
5.9
弾性
針管の公称外径(図5のD)が1.0 mm以下のものは,図5のように針管の先端の一点Aから25D2離れ
た針管上の点Bを固定し,Aに力を加え,8度曲げて1分間保った後,放して目視したとき,針管は,元
の位置に戻らなければならない。
図5−弾性
6
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
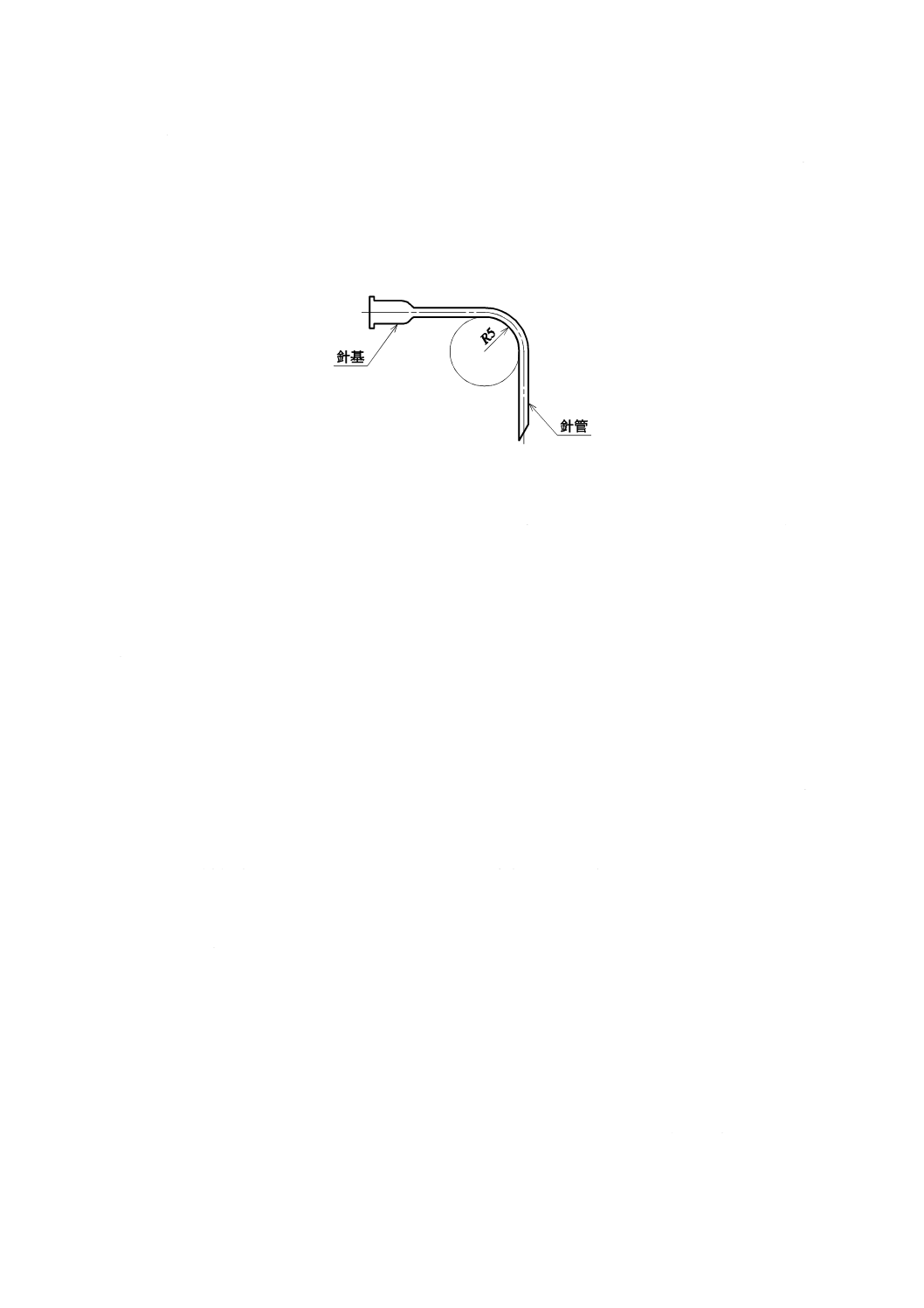
5.10 曲げ強さ
針管の公称外径が1.0 mm以下で,公称長さが12 mm以上のものは,図6のように針管を5 mmの曲率
半径で90度曲げたとき,折れてはならない。
なお,針管の公称外径が1.0 mmを超えるか,又は公称長さが12 mm未満のものには,この試験は適用
しない。
単位 mm
図6−曲げ強さ
5.11 刃面マーク
針先の形状が図2のb)(側孔をもつもの)及び図2のc)に該当するものの外針針基は,外針を人体へせ
ん(穿)刺した状態で,外針の側孔の向き若しくは外針の刃面の向きが分かる構造であるか,又は外針の
側孔の向き若しくは外針の刃面の向きが分かる印が付けられていなければならない。
5.12 誘導針
誘導針を附属するものにあっては,誘導針はJIS T 3321の箇条4(構成),5.1(材料),5.2(外観及び清
浄度),5.3(刃先),5.4(寸法の許容差),5.5(針基のテーパの合致),5.6(引抜強さ),5.7(漏れ),5.8
(弾性)及び5.9(曲げ強さ)に適合しなければならない。
5.13 三方活栓
三方活栓をもつものの三方活栓は,セット品として5.8の試験に適合し,次の試験をしたとき,これに
適合しなければならない。
三方活栓は,そのプラグの回転軸方向に15 N以上の力で15秒間引っ張ったとき,これに耐える強度を
もち,プラグと活栓本体との間の接続部はどのプラグの位置においてもこの力に耐える強度をもたなけれ
ばならない。また,いずれのプラグ位置においてもしっかり固定されていなければならない。
接続用かん(嵌)合部は,ISO 594-1又はISO 594-2に適合しなければならない。
6
化学的要求事項
6.1
試験液及び空試験液の調製
6.1.1
せき(脊)髄くも膜下麻酔針の試験液及び空試験液
せき(脊)髄くも膜下麻酔針の試験液及び空試験液は,次による。
a) 試験液 25本のせき(脊)髄くも膜下麻酔針(三方活栓付きは,三方活栓を含み,三方活栓は細片と
する。)を,内針を取り除いた状態で,ほうけい酸ガラスでできた適切な容器へ入れ,250 mLの精製
水に浸せき(漬)する(針の全表面を針管の内側を含めて,精製水に接触するようにする。)。
3
0
37+℃
で60±2分間加温した後,室温になるまで冷却し,針(三方活栓付きは,三方活栓の細片も含む。)の
内外面から全ての水を容器に戻すようにして針(三方活栓付きは,三方活栓の細片も含む。)を取り除
き,この液を試験液とする。
7
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 空試験液 同時に針を入れない精製水を同様の方法で操作し空試験液を調製する。
6.1.2
誘導針の試験液及び空試験液
誘導針を附属するものにあっては,JIS T 3321の箇条6(化学的要求事項)に従い試験液及び空試験液
を調製する。
6.2
pH
試験液及び空試験液のpHを日局の一般試験法のpH測定法で測定したとき,両液のpHの差は1以下で
なければならない。
6.3
溶出金属の制限
原子吸光光度法又は同等以上の微量分析法によって試験液及び空試験液を分析し,試験液の測定値を空
試験液の測定値で補正したとき,試験液中の鉛,亜鉛及び鉄の合計は5 mg/L以下で,かつ,試験液のカド
ミウム測定値を空試験液のカドミウム測定値で補正したとき,試験液のカドミウム含量は,0.1 mg/L以下
でなければならない。
7
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
8
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
9
エンドトキシン
9.1
せき(脊)髄くも膜下麻酔針
せき(脊)髄くも膜下麻酔針(三方活栓付きは,三方活栓を含む。)を10本とり,内針を引き抜き,外
針及び内針を同じ硬質ガラスの容器に入れ,エンドトキシン試験用水30 mLを加え,溶封又は適切な栓で
密封してよく振り混ぜた後,室温で60分間放置し,この液を試験液とする。この試験液調製方法で検体全
体を試験用水に浸せき(漬)できない場合は,せき(脊)髄くも膜下麻酔針(三方活栓付きは,三方活栓
を含む。)を10本とり,内針を引き抜き,各管内にエンドトキシン試験用水40 mLを1分間約10 mLの速
さで流し,その液で針管及び内針をよく洗い,洗液を合わせて試験液とする。試験液について,日局のエ
ンドトキシン試験法によって試験したとき,エンドトキシンの濃度は0.5 EU/mL未満でなければならない。
9.2
誘導針
誘導針を附属するものにあっては,誘導針は,JIS T 3321の箇条9(エンドトキシン)に適合しなけれ
ばならない。
10 包装
10.1 一次包装
一次包装は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に,内容製品を適切に保護できるものでなければならない。また,一度開封したら包装は
簡単に再シールできず,開封されたことが明確に分かるものでなければならない。
10.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもつものでなければならな
8
T 3308:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
い。
11 表示
11.1 一次包装
一次包装には,次の事項を表示する。
a) 外針の外径(mm)及び長さ(mm)
b) “滅菌済み”の旨
c) 製造番号又は製造記号
11.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合は,改めて滅菌年月の表示をする必要はない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 承認番号
c) 販売名
d) 外針の外径(mm)及び長さ(mm)
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) 製造番号又は製造記号
i)
滅菌年月
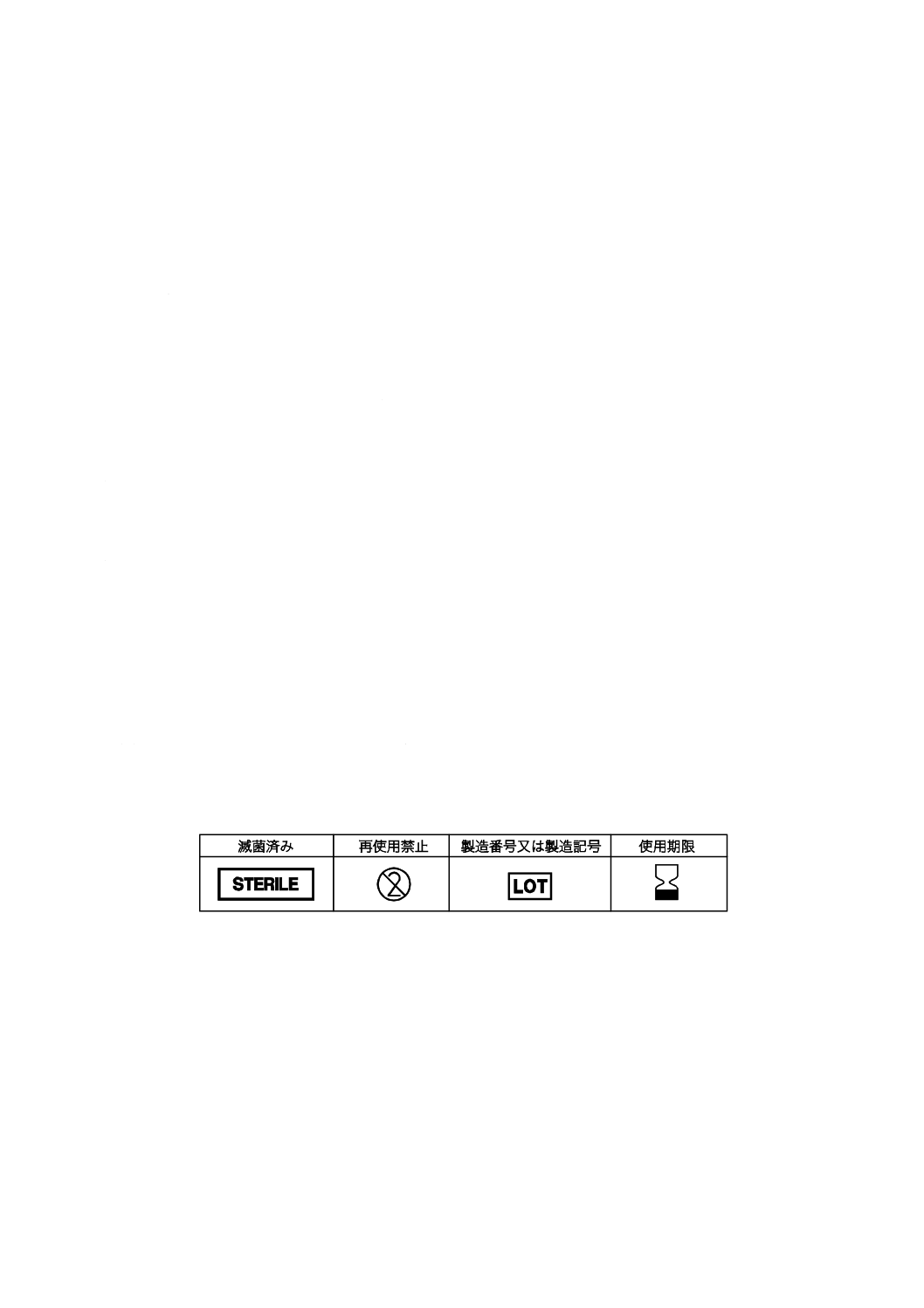
11.3 図記号の使用
箇条11の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な図記号の例を,表2に示す。
表2−JIS T 0307に規定する図記号の例




