T 3262:2017
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 2
5 要求事項························································································································· 3
5.1 一般 ···························································································································· 3
5.2 表面 ···························································································································· 3
5.3 腐食抵抗性 ··················································································································· 3
5.4 せん(穿)刺針の要求事項 ······························································································ 3
5.5 外とう(套)管の要求事項 ······························································································ 3
6 生物学的安全性 ················································································································ 5
7 無菌性の保証 ··················································································································· 5
8 エンドトキシン ················································································································ 5
9 包装······························································································································· 5
9.1 一次包装 ······················································································································ 5
9.2 二次包装 ······················································································································ 5
10 表示 ····························································································································· 5
10.1 一次包装 ····················································································································· 5
10.2 二次包装 ····················································································································· 5
10.3 図記号の使用 ··············································································································· 6
附属書A(規定)腐食抵抗性に関する試験方法 ·········································································· 7
附属書B(規定)外とう(套)管の最大引張強度の測定方法 ························································· 8
附属書C(規定)針管と針基との接合強度の測定 ······································································· 9
参考文献 ···························································································································· 10
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 11
T 3262:2017
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器テクノロジー協会(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具
して日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正
した日本工業規格である。
これによって,JIS T 3262:2012は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本工業規格 JIS
T 3262:2017
イントロデューサ針
Introducer needles and introducer catheters
序文
この規格は,2014年に第2版として発行されたISO 11070を基とし,国内事情に合わせるため,一部の
技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,カテーテル及びガイドワイヤの配置及び操作を目的として身体に通すために用いる単回使
用の血管用又は非血管用イントロデューサ針について規定する。ただし,薬液注入及び排液に用いられる
もの又は直接の処置に用いられるものは除く。
注記1 2020年10月31日までJIS T 3262:2012を適用することができる。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 11070:2014,Sterile single-use intravascular introducers, dilators and guidewires(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0307 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and
testing within a risk management process
ISO 594-1:1986,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 80369-7,Small-bore connectors for liquids and gases in healthcare applications−Part 7: Connectors for
intravascular or hypodermic applications
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
T 3262:2017
3.1
患者側端(patient end)
患者に挿入する側の器具の先端。
3.2
有効長(effective length)
身体に挿入できる器具の長さ。
3.3
カテーテルハブ(catheter hub)
外とう(套)管のカテーテルと一体をなす接続端。
3.4
外とう(套)管(introducer catheter)
典型的にはせん(穿)刺針にかぶせてあり,せん(穿)刺針を除去した後にカテーテル又はガイドワイ
ヤを身体に挿入できる,短い管。
3.5
せん(穿)刺針(introducer needle)
せん(穿)刺機能をもった先のとがった硬直な針。
3.6
チップ(tip)
器具の患者側先端。
3.7
エンドトキシン試験用水(water for bacterial endotoxins test)
日本薬局方の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキ
シン試験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
4
構成及び各部の名称
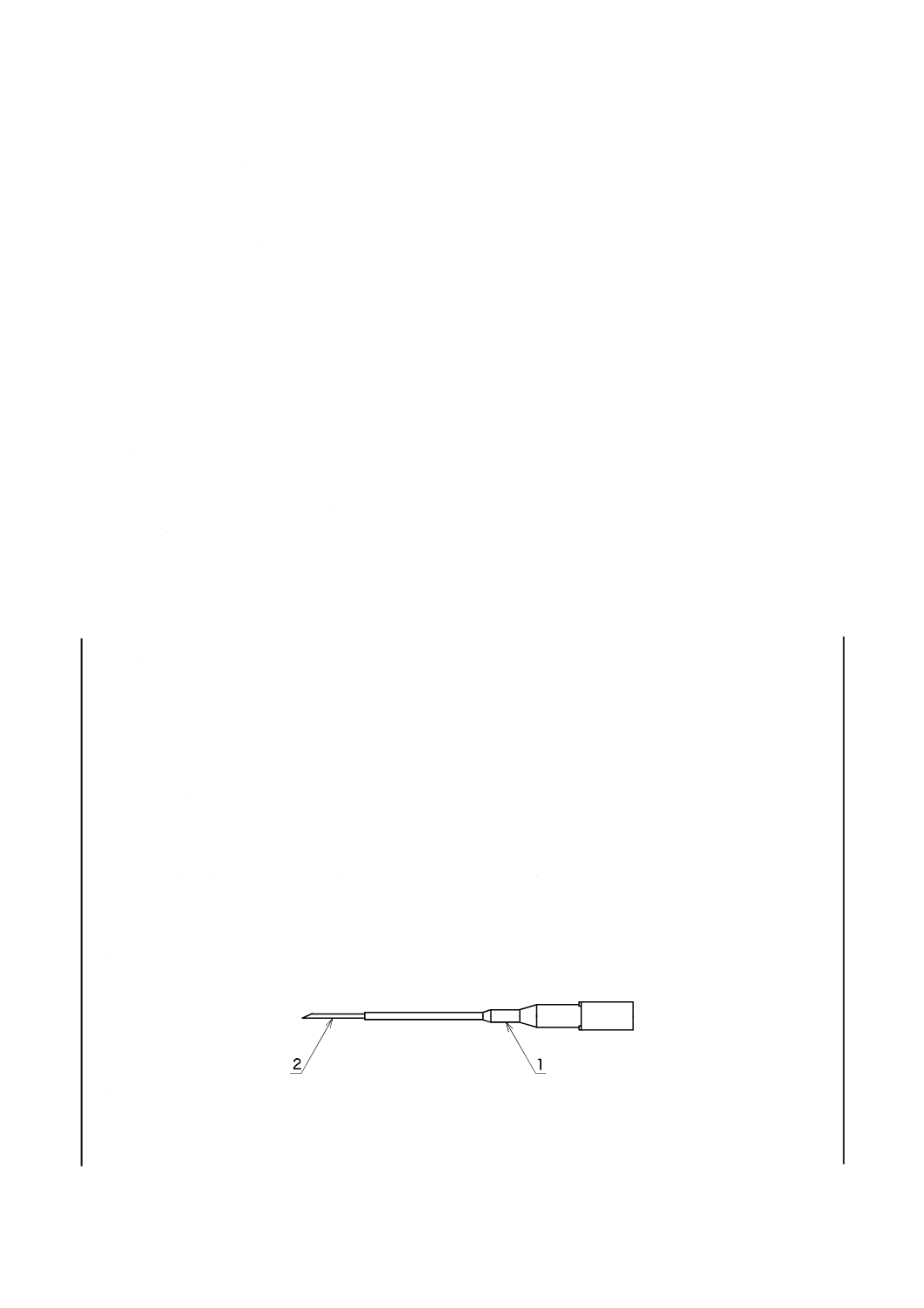
イントロデューサ針は,せん(穿)刺針と外とう(套)管とで構成する(図1参照)。せん(穿)刺針と
外とう(套)管とを組み合わせて使用する場合とせん(穿)刺針だけで使用する場合とがある。図2は,
外とう(套)管及びせん(穿)刺針の一般的な例である。
外とう(套)管にカテーテルハブが付いていないもの,金属製のもの,止血弁が付いているもの及びカ
テーテルが分割できるピールオフタイプのものがある。また,せん(穿)刺針にはスタイレットを具備し
たもの,針基にシリンジが付いているもの,及び使用時又は使用後の針刺し事故防止機能付きのものもあ
る。
1
外とう(套)管
2
せん(穿)刺針
図1−イントロデューサ針の構成及び各部の名称(例)
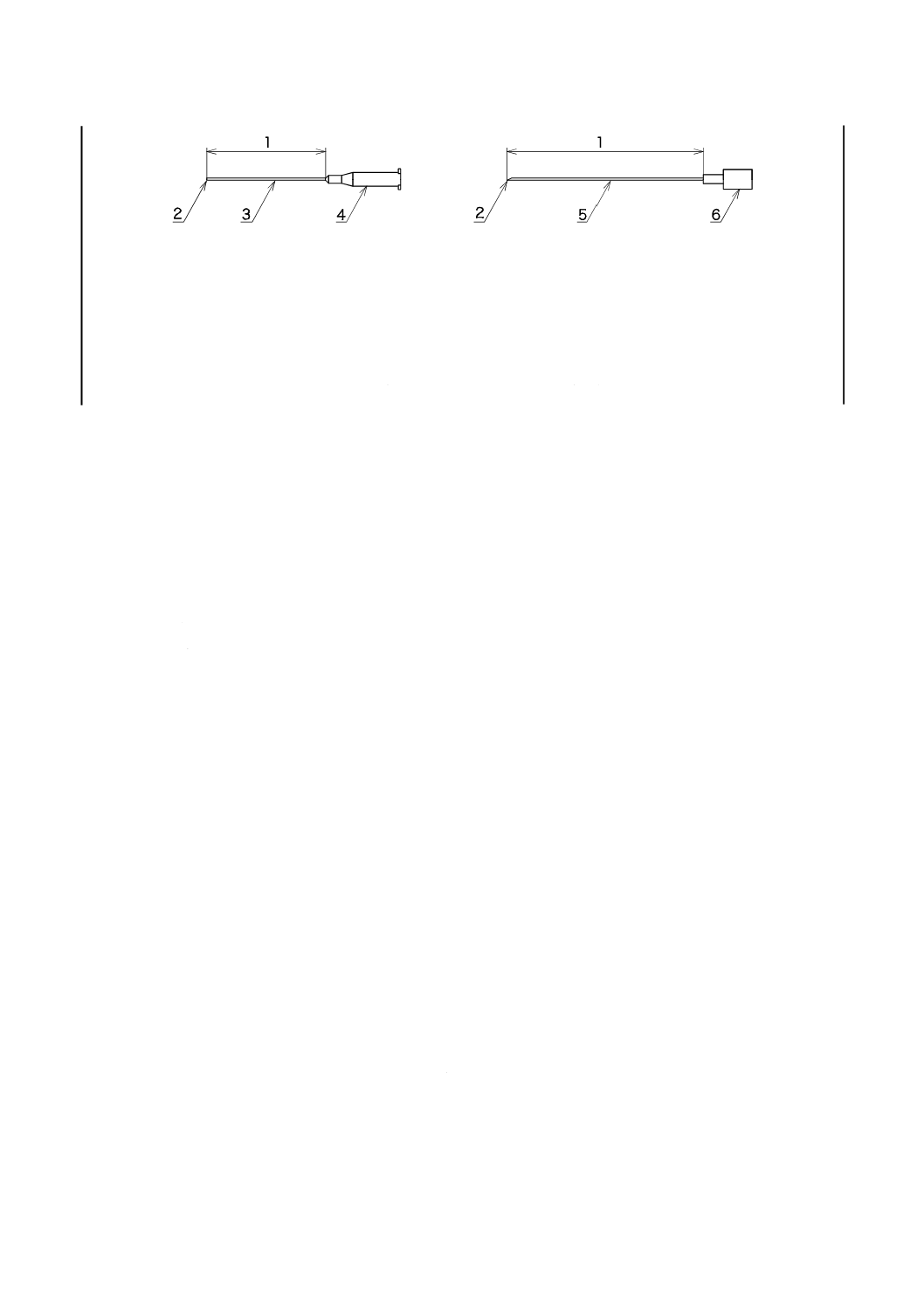
3
T 3262:2017
a) 外とう(套)管
b) せん(穿)刺針
1
有効長
2
チップ
3
カテーテル
4
カテーテルハブ(任意)
5
針管
6
針基
図2−外とう(套)管及びせん(穿)刺針の構成並びに各部の名称(例)
5
要求事項
5.1
一般
イントロデューサ針は,バリデーションされた方法で滅菌し,滅菌後の状態において5.2〜5.5及び箇条
6の規定に適合しなければならない。
5.2
表面
目視又は2.5倍に拡大して試験したとき,イントロデューサ針の外表面にきずなどの異常があってはな
らない。患者側端を含む各器具の有効長箇所の外表面は,製造工程での欠陥がなく,かつ,使用中に身体
に対する損傷を最小限にするものでなければならない。
イントロデューサ針に潤滑剤処理が施されている場合には,目視などで試験したとき,外表面にその液
滴があってはならない。
5.3
腐食抵抗性
血管用として使用するイントロデューサ針に金属材料を使用し,かつ,その部位が間接的又は直接的に
薬液又は血液に接触する場合,附属書Aによって試験したとき,金属部分に腐食の兆候があった場合,用
途及びリスクアセスメントについて腐食の程度を評価して,製品の性能・安全性に影響がないことを確認
しなければならない。
5.4
せん(穿)刺針の要求事項
5.4.1
刃先
2.5倍に拡大して試験したとき,刃先は鋭利であり,ばり及び曲りがあってはならない(ISO 7864参照)。
5.4.2
針基
5.4.2.1
かん(嵌)合
針基をもち,かつ,他の機器との接続を意図する場合,針基は,ISO 594-1:1986又はISO 80369-7に適
合するめす6 %ルアーテーパかん(嵌)合ができるものでなければならない。
5.4.2.2
針管と針基との接合強度
附属書Cに規定する方法で試験したとき,針管と針基との接合部は,公称外径0.6 mm未満の針の場合
では10 Nの力で,公称外径0.6 mm以上の針の場合では20 Nの力で,緩むことがあってはならない。
5.5
外とう(套)管の要求事項
5.5.1
先端
せん(穿)刺針が外とう(套)管に十分に挿入されて供給された場合,外とう(套)管先端は刃面のあ
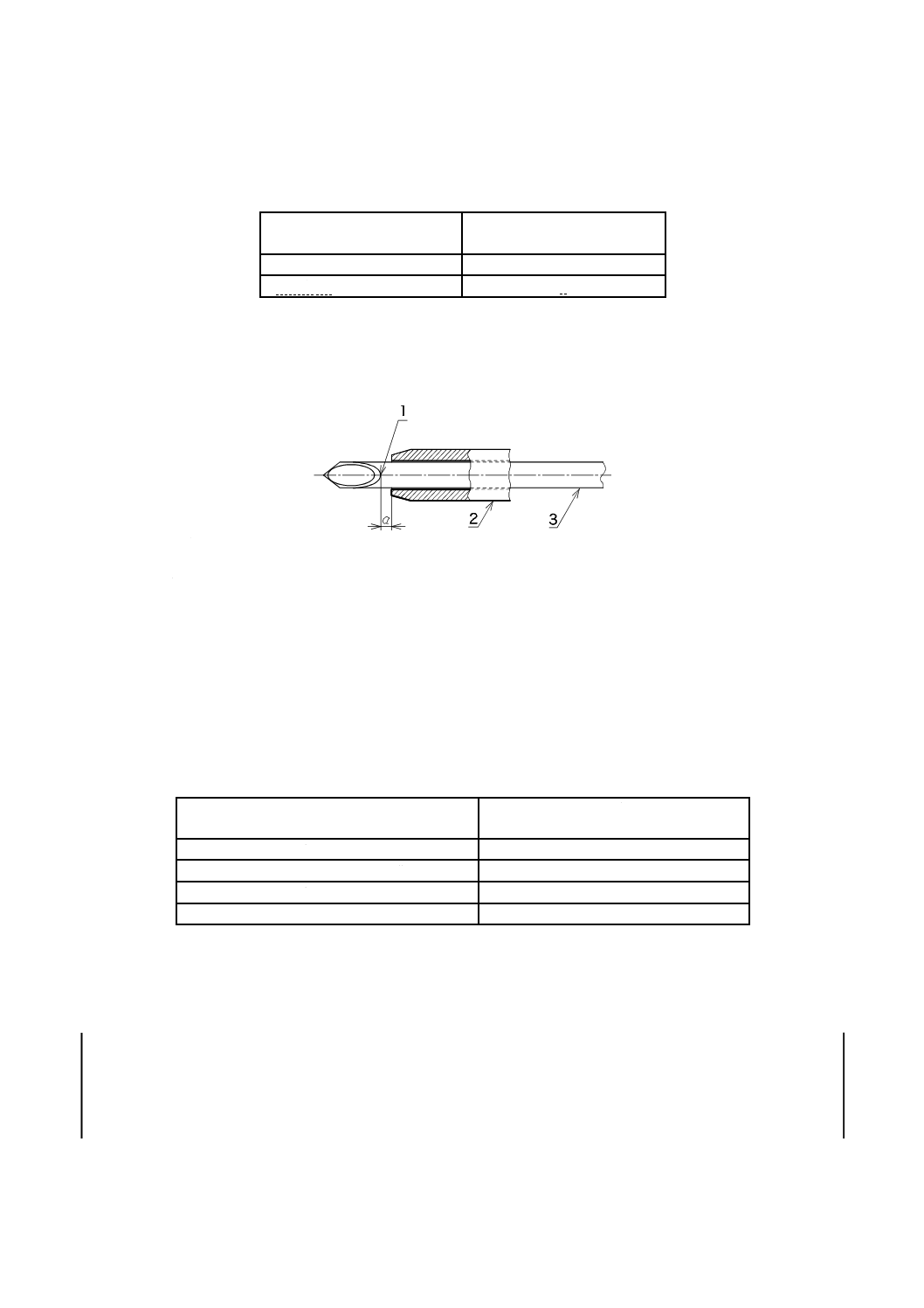
4
T 3262:2017
ご部を越えたり,図3のaの長さが表1の値を超えてはならない。
表1−刃面のあご部と外とう(套)管先端との長さa
用途
図3のaの長さ
mm
血管用
1
非血管用
2
外とう(套)管のチップは,挿入が容易で,最小限の損傷となるよう設計し,針管に密着していなけれ
ばならない。
1
刃面のあご部
2
外とう(套)管
3
せん(穿)刺針
図3−せん(穿)刺針の刃先及び外とう(套)管先端の例
5.5.2
最大引張強度
附属書Bによって試験したとき,外とう(套)管及び外とう(套)管とカテーテルハブとの接合部の最
大引張強度は,表2による。
表2−外とう(套)管の最大引張強度
最小外径
mm
最大引張強度の下限値
N
0.550以上
0.750未満
3
0.750以上
1.150未満
5
1.150以上
1.850未満
10
1.850以上
15
5.5.3
カテーテルハブ
カテーテルハブをもつ場合,カテーテルハブはISO 594-1:1986又はISO 80369-7に適合するめす6 %ル
アーテーパかん(嵌)合できるものでなければならない。
5.5.4
製造販売業者から提供する情報
血管用のイントロデューサ針については,外とう(套)管がせん(穿)刺針とともに供給された場合に
は,一部又は完全に引き抜かれたせん(穿)刺針の外とう(套)管への再挿入に対して警告しなければな
らない。
5
T 3262:2017
6
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行わなければならない。
7
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行わな
ければならない。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
8
エンドトキシン
血管又は中枢神経に使用するイントロデューサ針は,次のいずれかでなければならない。
a) 10セットをとり,各セットの管内にエンドトキシン試験用水40 mLを約10 mL/minの速さで流し,そ
の液で針管をよく洗い,洗液を合わせて試験液とし,日本薬局方のエンドトキシン試験法によって試
験を行ったとき,エンドトキシンは0.5 EU/mL未満でなければならない。
b) 発熱性物質の有無を適切な試験によって評価し,発熱性のないことを確認しなければならない。
9
包装
9.1
一次包装
一次包装は,微生物の侵入を防止することができ,かつ,通常の取扱い,輸送及び保管中に,内容製品
を適切に保護できるものでなければならない。また,一次包装は,一度開封したならば,簡単に再シール
できず,開封したことが明確に分からなければならない。
9.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもたなければならない。
10 表示
10.1 一次包装
一次包装には,次を表示する。
a) イントロデューサ針のサイズ 外径(mm)又は内径(mm)及び有効長(mm又はcm)。ただし,外
径及び内径をミリメートル(mm)で示すほか,ゲージを参考で併記してもよい。有効長はミリメー
トル(mm)又はセンチメートル(cm)で示すほか,インチの呼称を参考に併記してもよい。
注記 ゲージは,Gなどで表記するのがよい。
b) “滅菌済み”の旨
c) 使用期限
d) 製造番号又は製造記号
e) “再使用禁止”の旨(“ディスポーザブル”の表現は,使用しない。)
10.2 二次包装
二次包装には次を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装として用
いる場合には,次を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示は必要としない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所

6
T 3262:2017
b) 販売名
c) 医療機器の認証番号
d) イントロデューサ針のサイズ 外径(mm)又は内径(mm)及び有効長(mm又はcm)。ただし,外
径及び内径をミリメートル(mm)で示すほか,ゲージを参考で併記してもよい。有効長はミリメー
トル(mm)又はセンチメートル(cm)で示すほか,インチの呼称を参考に併記してもよい。
注記 ゲージは,Gなどで表記するのがよい。
e) 製造番号又は製造記号
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は,使用しない。)
h) 数量(入り数)
i)
滅菌年月
10.3 図記号の使用
10.1及び10.2の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよ
い。
注記 JIS T 0307に規定する主な図記号の例を,表3に示す。
表3−JIS T 0307に規定する主な図記号の例
7
T 3262:2017
附属書A
(規定)
腐食抵抗性に関する試験方法
A.1 概要
試料を生理食塩水に,次いで沸騰する蒸留水又は脱イオン水中に浸せき(漬)する。その後,目視で腐
食の有無を確認する。
A.2 試験溶液
A.2.1 生理食塩水 分析用試薬グレードの塩化ナトリウムを,新たに精製した蒸留水又は脱イオン水に溶
解させた溶液[c(NaCl)=0.15 mol/L]
A.2.2 蒸留水又は脱イオン水
A.3 器具
A.3.1 ほうけい酸ガラス製ビーカー
A.4 手順
A.4.1 ほうけい酸ガラス製ビーカー(A.3.1)に入れた生理食塩水(A.2.1)中に,試料を室温22±5 ℃で
5時間浸せき(漬)する。
A.4.2 試料を取り出し,沸騰する蒸留水又は脱イオン水(A.2.2)中に30分間浸せき(漬)する。
A.4.3 水と試料とを37±2 ℃まで冷却後,この温度で48時間放置する。
A.4.4 試料を取り出し,室温で乾燥させる。
A.4.5 使用時に分離することを意図した二つ以上の構成部品から成る試料は,分解する。金属部分のコー
ティングについては,剝ぎ取ってはならない。腐食の状況を目視で確認する。
適切なリスクを元にした臨床上の理由を用いて,別の期間及び温度を使った追加試験を実施することが
できる。
A.5 試験報告書
試験報告書には,次の情報を記載する。
a) イントロデューサ針の識別
b) 腐食の発生の有無
8
T 3262:2017
附属書B
(規定)
外とう(套)管の最大引張強度の測定方法
B.1
概要
外とう(套)管の試験片は,カテーテル部分及びカテーテルハブとカテーテルとの接合部が試験できる
よう選択する。試料が破断又は接合部が外れるまで各試料に引張力を加える。
B.2
装置
B.2.1 引張試験機 15 N以上の引張力を加えることができるもの。
B.3
手順
B.3.1 試料を選択する。該当する場合,試料にはハブを含める。
B.3.2 37±2 ℃の水中に臨床上適切な時間,試料を浸せき(漬)調整する。その後,直ちに試験を行う。
B.3.3 引張試験機に試料をセットする。ハブがある場合には,ハブの変形を避けるため適切な器具を使用
する。
B.3.4 試料のゲージ長,すなわち,引張試験機のつかみ具間の距離又は該当する場合には,ハブと試料の
他方の端を保持するつかみ具との間の距離を測定する。
B.3.5 試料が二つ以上に破断するか,又は表2の規定値まで,ゲージ長1 mm当たり20 mm/minの単位ひ
ずみ速度で引張力を加える(表B.1参照)。
破断したときの引張力,又は規定値以上の引張力をニュートンで表し,この値を最大引張強度として記
録する。
B.3.6 異なる外径の部分をもつチューブ単体によって構成される器具を試験する場合は,試料は最小外径
を含めなければならない。
B.3.7 一つの試料に対して2回以上の試験を行ってはならない。
表B.1−ゲージ長1 mm当たり20 mm/minの単位ひずみ速度を生じる引張速度の例
ゲージ長
mm
引張速度
mm/min
10
200
20
400
25
500
B.4
試験報告書
試験報告書には,次の情報を記載する。
a) イントロデューサ針の識別
b) 各試料の最大引張強度(単位:N)
c) 破断した箇所

9
T 3262:2017
附属書C
(規定)
針管と針基との接合強度の測定
C.1 概要
針管及び針基に(連続的に引張力及び圧縮力で)力を加え,針管と針基との接合部の緩みについて調査
する。
C.2 装置
C.2.1 引張試験機 ±1 %の精度で20 Nの力を加えることができるもの。
C.3 手順
C.3.1 試験を行う2時間前からせん(穿)刺針を40 %〜60 %の相対湿度及び22±2 ℃の温度の条件下に
置く。
C.3.2 針管及び針基を引張試験機のつかみ部分でクランプし,連続的にそれぞれ100 mm/minの速度で引
張力及び圧縮力を加える(表C.1参照)。
C.3.3 針管と針基との接合部を調査し,針管が緩んだかどうかを記録する。
表C.1−引張速度
針管の公称外径
mm
引張力及び圧縮力
N
0.6未満
10
0.6以上
20
C.4 試験報告書
試験報告書には,次の情報を記載する。
a) せん(穿)刺針の識別
b) せん(穿)刺針の外径,mmで示す。
c) 加えられた力(10 N又は20 N)
d) 針管が針基の中で緩んだかどうか。
10
T 3262:2017
参考文献
[1] ISO 7864:2016,Sterile hypodermic needles for single use−Requirements and test methods
[2] ISO 9626:2016,Stainless steel needle tubing for the manufacture of medical devices−Requirements and test
methods
[3] ISO 10555-1:2013,Intravascular catheters−Sterile and single-use catheters−Part 1: General requirements
[4] ISO 10555-3:2013,Intravascular catheters−Sterile and single-use catheters−Part 3: Central venous catheters
[5] ISO 10555-4:2013,Intravascular catheters−Sterile and single-use catheters−Part 4: Balloon dilatation
catheters
[6] ISO 10555-5:2013,Intravascular catheters−Sterile and single-use catheters−Part 5: Over-needle peripheral
catheters
[7] ISO 11135:2014,Sterilization of health-care products−Ethylene oxide−Requirements for the development,
validation and routine control of a sterilization process for medical devices
[8] ISO 11137-1:2006,Sterilization of health care products−Radiation−Part 1: Requirements for development,
validation and routine control of a sterilization process for medical devices, Amd 1:2013
[9] ISO 11137-2:2013,Sterilization of health care products−Radiation−Part 2: Establishing the sterilization dose
[10] ISO 11137-3:2006,Sterilization of health care products−Radiation−Part 3: Guidance on dosimetric aspects
[11] ISO 15223-1:2016,Medical devices−Symbols to be used with medical device labels, labelling and information
to be supplied−Part 1: General requirements
[12] ISO 17665-1:2006,Sterilization of health care products−Moist heat−Part 1: Requirements for the
development, validation and routine control of a sterilization process for medical devices
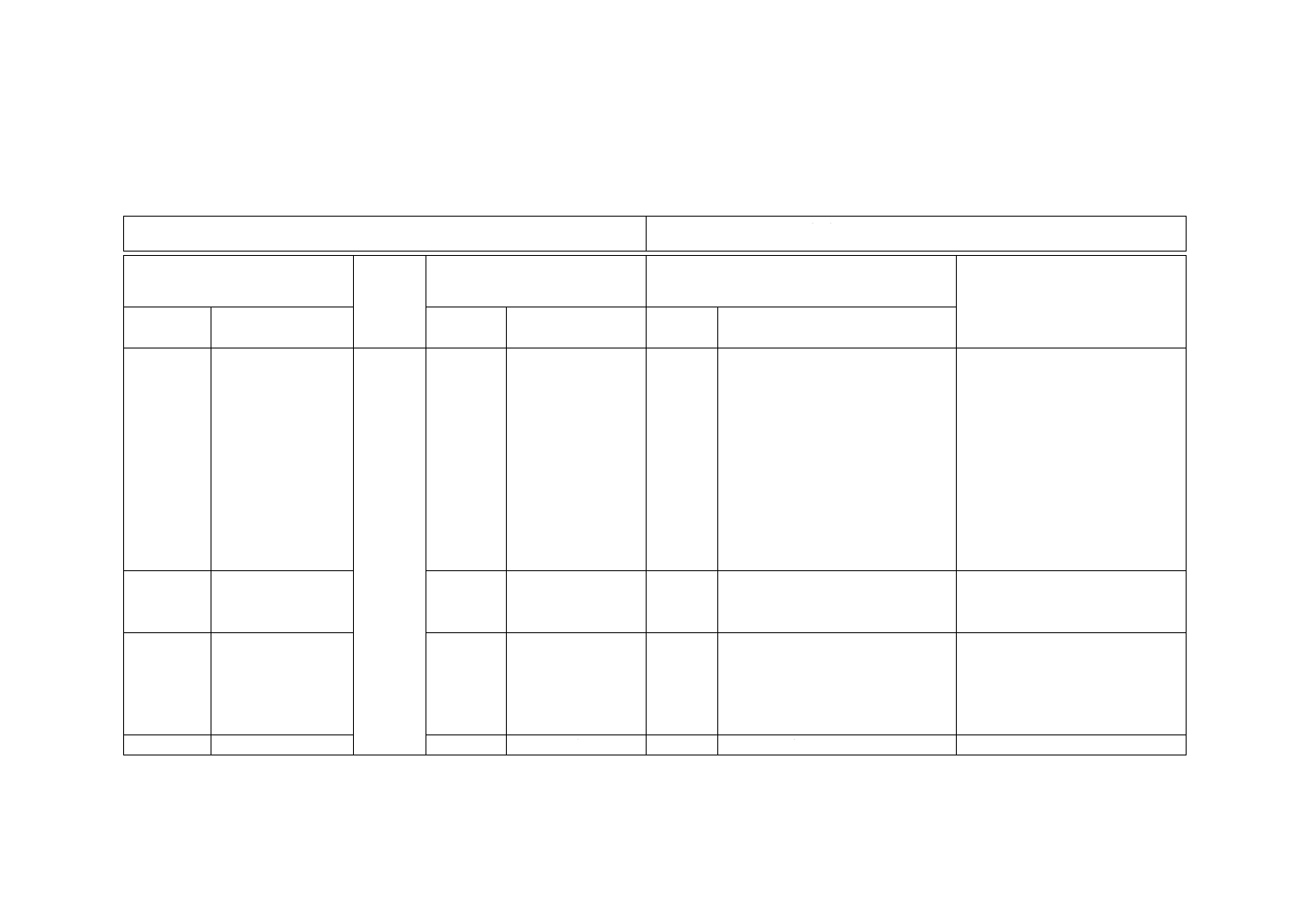
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3262:2017 イントロデューサ針
ISO 11070:2014,Sterile single-use intravascular introducers, dilators and guidewires
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 イントロデューサ
針について規定。
1
血管用カテーテル
と使用する,1回使
用を目的としたイ
ントロデューサニ
ードル,イントロデ
ューサカテーテル,
シースイントロデ
ューサ,ガイドワイ
ヤ及びダイレータ
の要求事項につい
て規定。
変更
ISO 11070の適用範囲は血管用だ
が,範囲を非血管用まで拡大した。
また,イントロデューサ針(イント
ロデューサニードル及びイントロ
デューサカテーテル)に限定した。
また,JIS T 3229とのす(棲)み分
けを明確にするため,ただし書を追
記した。
非血管用イントロデューサ針は,
対応する国際規格がないため,適
用範囲が血管用であるが,ISO規
格を基礎として用いた。
国内事情であるため特に提案など
はしない。
3 用語及び
定義
3
JISとほぼ同じ
変更・追
加
適用範囲を非血管用にまで拡大し
たため修正した。また,3.7の用語
を追加している。
用語の追加・修正であるため実質
的な差異はない。
4 構成及び
各部の名称
図1,図2
−
−
追加
変更
図1を追加し構成を記載。また,金
属製の外とう(套)管又はスタイレ
ットを具備したせん(穿)刺針もあ
るため追記した。
図1を図2とした。
利用者の利便性のため。実質的な
差異はない。
5 要求事項 5.1 一般
4.1
JISとほぼ同じ
変更
イントロデューサ針に限定した。
1 適用範囲と同じ。
3
T
3
2
6
2
:
2
0
1
7
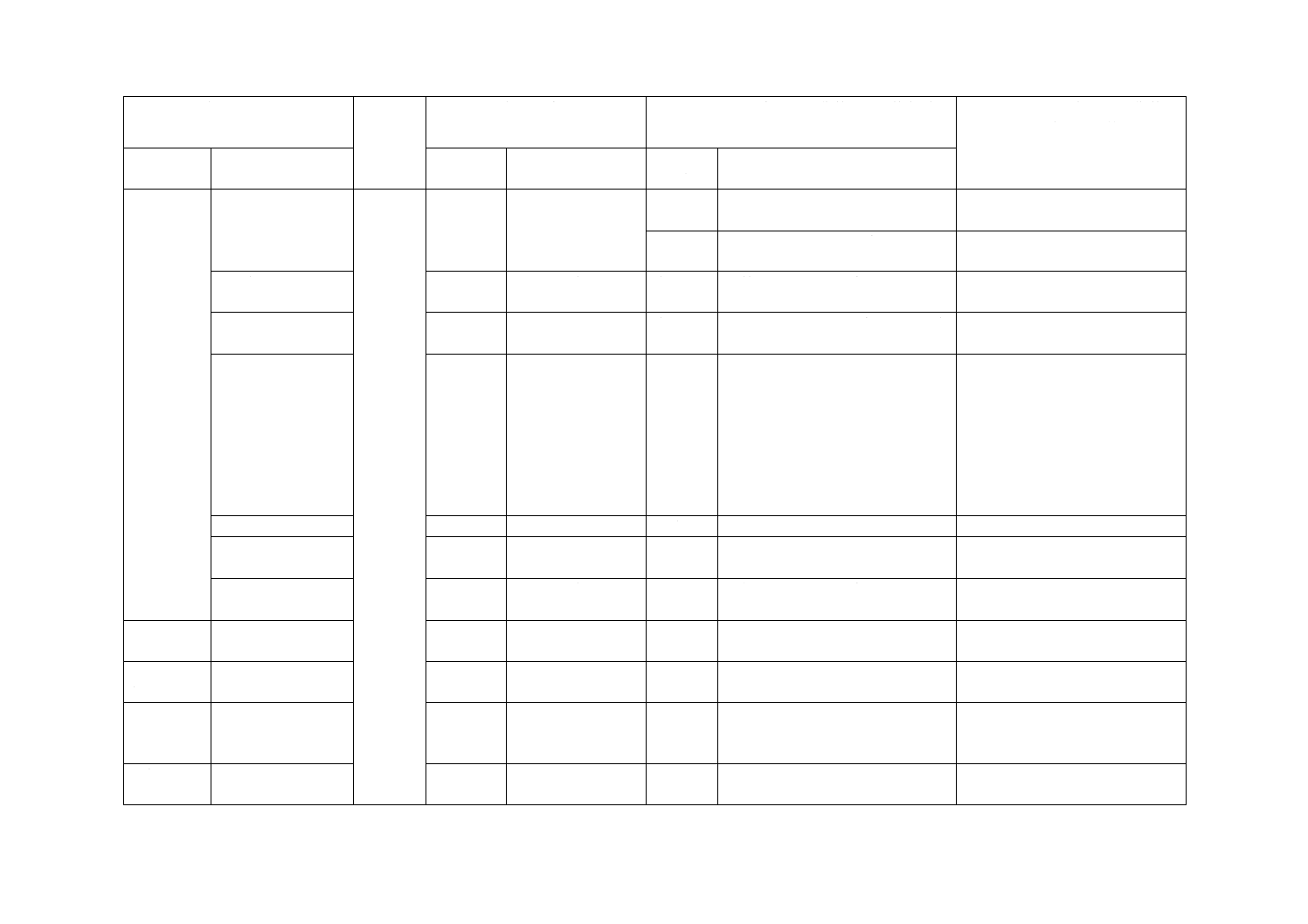
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5 要求事項 5.2 表面
4.3
JISとほぼ同じ
変更
適用範囲を非血管用にまで拡大し
た。
1 適用範囲と同じ。
削除
カテーテルイントロデューサに関
する記載は削除した。
1 適用範囲と同じ。
5.3 腐食抵抗性
4.4
JISとほぼ同じ
変更
血管用のイントロデューサ針に限
定した。
1 適用範囲と同じ。
5.4 せん(穿)刺針
の要求事項
5
JISとほぼ同じ
変更
他の機器との接続を意図する場合
に限定した。
国内での流通を考慮。
5.5 外とう(套)管
の要求事項
5.5.1 先端
6.1
6.2
JISとほぼ同じ
変更
非血管用のニードルと外とう(套)
管との差について追記した。
血管の構造上,ニードルと外とう
(套)管との差は1 mm未満であ
ることが必須だと考えられるが,
非血管用の場合は,ニードルと外
とう(套)管とが目的部位を目指
してせん(穿)刺できればよく,
図3のaの長さが1 mm未満でな
くても問題がないため。
5.5.2 最大引張強度
6.3
一致
5.5.3 カテーテルハ
ブ
6.4
一致
5.5.4 製造販売業者
から提供する情報
6.6
JISとほぼ同じ
変更
血管用のイントロデューサ針に限
定した。
1 適用範囲と同じ。
6 生物学的
安全性
生物学的安全性
4.2
一致
−
7 無菌性の
保証
無菌性の保証
4.1
JISとほぼ同じ
変更
ISO規格と同等の基準であり,我が
国で実績のある基準を記載した。
滅菌バリデーション基準について
明記。技術的な差異はない。
8 エンドト
キシン
エンドトキシン
−
−
追加
エンドトキシン試験を追加した。
血管用として使用するイントロデ
ューサ針の要求事項として必要な
ため追加した。
9 包装
9.1 一次包装
9.2 二次包装
−
−
追加
一次包装及び二次包装に区分した。 国内事情のため。
3
T
3
2
6
2
:
2
0
1
7
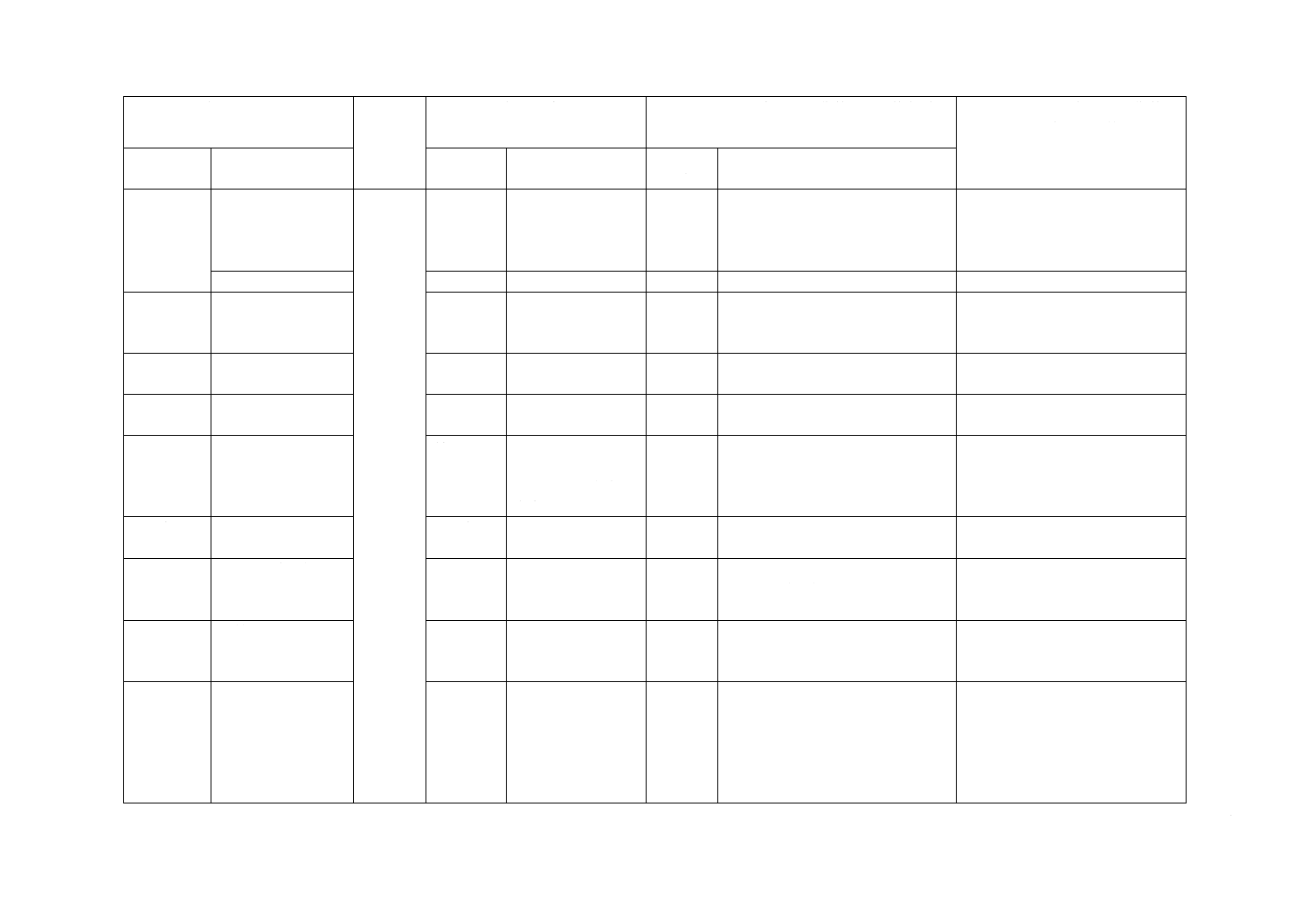
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
10 表示
10.1 一次包装
10.2 二次包装
4.6
5.2
5.5
6.5
製造販売業者が提
供する情報
変更
一次包装及び二次包装に区分した。 表示に関する規定をこの項に集約
した。国内事情のため。
10.3 図記号の使用
−
−
追加
図記号の使用について規定を追加。 国内事情のため。
−
−
7
シースイントロデ
ューサの付加要求
事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
8
ガイドワイヤの付
加要求事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
9
ダイレータの付加
要求事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
10
規定する器具の組
合せを含むキット
についての付加要
求事項
削除
この規格の適用範囲外のため。
国内事情のため。
附属書A
(規定)
腐食抵抗性に関す
る試験方法
附属書B
(規定)
変更
附属書番号の変更
実質的な差異はない。
附属書B
(規定)
外とう(套)管の最
大引張強度の測定
方法
附属書C
(規定)
変更
附属書番号の変更
外とう(套)管に限定した。
国内事情のため。
附属書C
(規定)
針管と針基との接
合強度の測定
附属書I
(規定)
変更
附属書番号の変更
実質的な差異はない。
−
−
附属書A
(参考)及
び附属書
D(規定)
〜附属書
H(規定)
−
削除
当該規格の適用範囲外のため。
国内事情のため。
3
T
3
2
6
2
:
2
0
1
7

JISと国際規格との対応の程度の全体評価:ISO 11070:2014,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ················ 技術的差異がない。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
T
3
2
6
2
:
2
0
1
7









