T 3260:2017
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 2
5 要求事項························································································································· 2
5.1 一般 ···························································································································· 2
5.2 表面 ···························································································································· 2
5.3 腐食抵抗性 ··················································································································· 2
5.4 ハブ ···························································································································· 3
5.5 ガイドワイヤの通過性 ···································································································· 3
5.6 無菌性の保証 ················································································································ 3
5.7 生物学的安全性 ············································································································· 4
6 包装······························································································································· 4
6.1 一次包装 ······················································································································ 4
6.2 二次包装 ······················································································································ 4
7 表示······························································································································· 4
7.1 一次包装 ······················································································································ 4
7.2 二次包装 ······················································································································ 4
7.3 図記号の使用 ················································································································ 5
附属書A(参考)材料及び設計に関するガイダンス ···································································· 6
附属書B(規定)腐食抵抗性に関する試験方法 ··········································································· 7
附属書C(規定)カテーテル拡張器の最大引張強度の測定方法······················································ 8
参考文献 ····························································································································· 9
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 10
T 3260:2017
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器テクノロジー協会(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具
して日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正
した日本工業規格である。
これによって,JIS T 3260:2012は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本工業規格 JIS
T 3260:2017
カテーテル拡張器
Dilators
序文
この規格は,2014年に第2版として発行されたISO 11070を基とし,我が国の実情に合わせるため,一
部の技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,そのまま直ちに使用でき,かつ,単回使用として用いる血管用又は非血管用のカテーテル
拡張器について規定する。カテーテル拡張器は,ガイドワイヤ若しくはカテーテルの導入又は操作のため
に,くう(腔)又は開口部を拡張若しくは拡大するために用いる。また,あらかじめシースが装着されて
いる場合がある。
注記1 材料及び設計に関するガイダンスを,附属書Aに示す。
注記2 2020年10月31日までJIS T 3260:2012を適用することができる。
注記3 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 11070:2014,Sterile single-use intravascular introducers, dilators and guidewires(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0307 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
ISO 594-1:1986,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 80369-7,Small-bore connectors for liquids and gases in healthcare applications−Part 7: Connectors for
intravascular or hypodermic applications
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
T 3260:2017
3.1
カテーテル拡張器(dilator)
くう(腔)又は開口部を拡張又は拡大するために用いる器具。ダイレータともいう。
3.2
患者側端(patient end)
患者に挿入する側の器具の先端。
3.3
有効長(effective length)
身体に挿入できる器具の長さ。
3.4
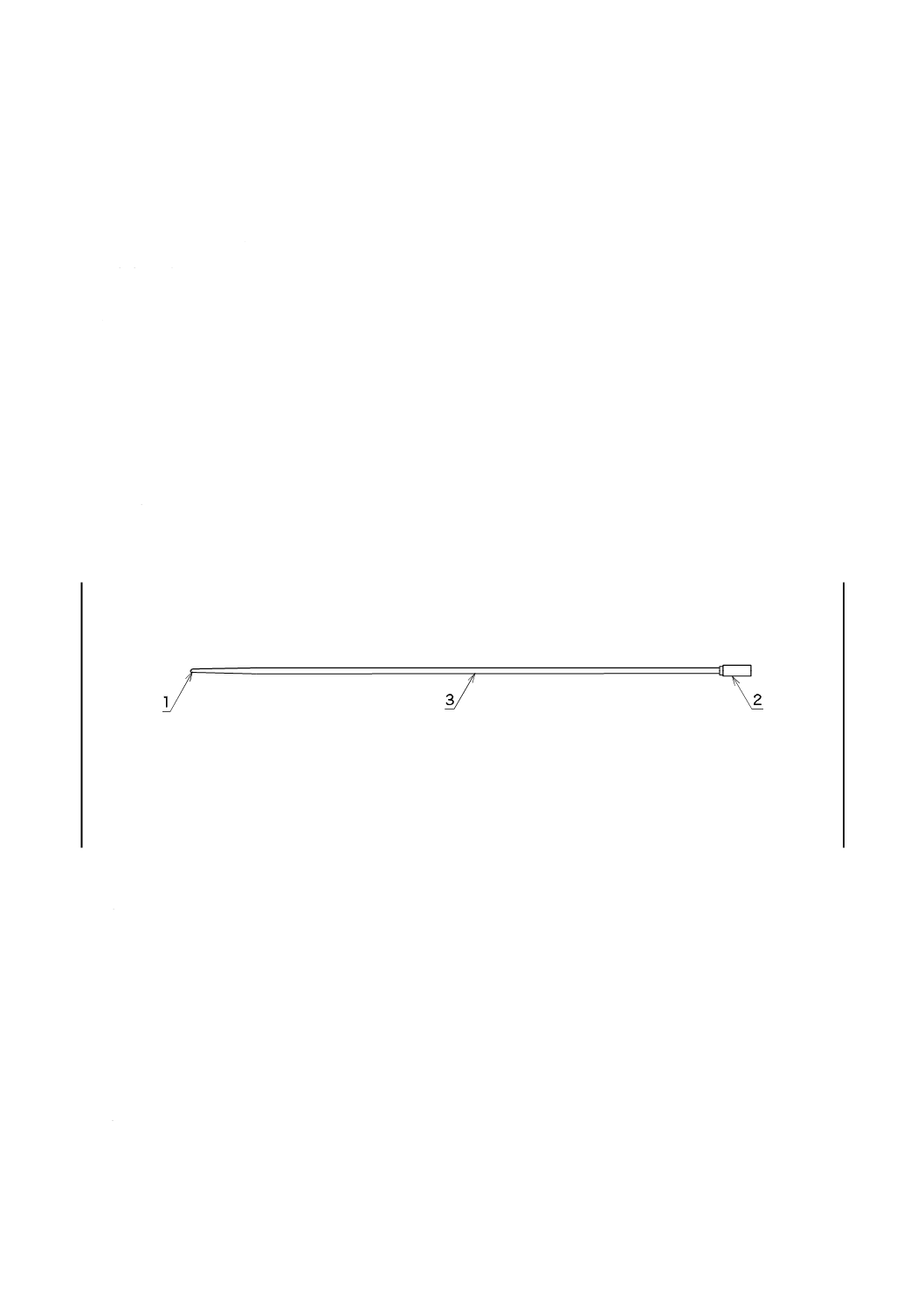
ハブ(hub)
カテーテル拡張器と一体をなす,又はカテーテル拡張器の手元端で固定する,カテーテル拡張器の手元
端にある接続端(図1参照)。
3.5
チップ(tip)
器具の患者側先端(図1参照)。
4
構成及び各部の名称
カテーテル拡張器の構成及び各部の名称の例を図1に示す。
1
チップ
2
ハブ
3
本体
注記 ハブのないものもある。
図1−カテーテル拡張器例
5
要求事項
5.1
一般
カテーテル拡張器は,バリデーションされた方法で滅菌し,滅菌後の状態において5.2〜5.5の規定に適
合しなければならない。
5.2
表面
目視又は2.5倍に拡大して試験したとき,カテーテル拡張器の外表面にきずなどの異常があってはなら
ない。患者側端を含む各器具の有効長箇所の外表面は,製造工程での欠陥がなく,かつ,使用中に身体に
対する損傷を最小限にするものでなければならない。また,カテーテル拡張器に潤滑剤処理が施されてい
る場合には,目視などで試験したとき,外表面にその液滴があってはならない。
5.3
腐食抵抗性
血管用カテーテル拡張器に金属材料を使用し,かつ,その部位が間接的又は直接的に薬液又は血液に接
3
T 3260:2017
触する場合は,附属書Bによって試験したとき,金属部分に腐食の兆候があった場合,用途及びリスクア
セスメントによって腐食の程度を評価して,製品の性能・安全性に影響がないことを確認しなければなら
ない。
5.4
ハブ
5.4.1
一般
カテーテル拡張器にハブが付いていないものは,5.4.2及び5.4.4に適合しなければならない。
カテーテル拡張器にハブが付いているものは,5.4.3及び5.4.4に適合しなければならない。
5.4.2
全長
カテーテル拡張器にハブが付いていないものの全長は,表1による。表1に規定した適用部位以外は,
ハブが付いていなければならない。
表1−全長
単位 mm
適用部位
全長
頭部外科用・胃ろう(瘻)用
150 以上
胆道ろう(瘻)孔用・腎ろう(瘻)用
200 以上
鎖骨下・末しょう(梢)血管用
110 以上
大たい(腿)血管用
150 以上
5.4.3
かん(嵌)合
ハブがめす6 %ルアーテーパかん(嵌)合である場合には,かん(嵌)合はISO 594-1:1986又はISO 80369-7
に適合しなければならない。
5.4.4
最大引張強度
附属書Cによって試験したとき,本体の最大引張強度及び本体とハブ(該当する場合)との接合部の最
大引張強度の下限値は,表2による。
表2−最大引張強度
最小外径
mm
最大引張強度の下限値
N
0.550以上 0.750未満
3
0.750以上 1.150未満
5
1.150以上 1.850未満
10
1.850以上
15
5.5
ガイドワイヤの通過性
ガイドワイヤとの併用を意図して設計されたものは,推奨するガイドワイヤがカテーテル拡張器の内く
う(腔)を通過できなければならない。
5.6
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行わな
ければならない。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
4
T 3260:2017
5.7
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行わなければならない。
6
包装
6.1
一次包装
一次包装は,微生物の侵入を防止することができ,かつ,通常の取扱い,輸送及び保管中に,内容製品
を適切に保護できるものでなければならない。また,一次包装は,一度開封したならば,簡単に再シール
できず,開封したことが明確に分からなければならない。
6.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもたなければならない。
7
表示
7.1
一次包装
一次包装には,次を表示する。
a) カテーテル拡張器の外径(mm)及び有効長(mm又はcm)。ただし,外径をミリメートル(mm)で
示すほか,フレンチ(シャリエール)又はゲージを参考で併記してもよい。
注記 フレンチ(シャリエール)は,F(Ch)などで表記するのがよい。1 mmが3 F(Ch)に相当
し,1/3 mm刻みで表記する。ゲージは,Gなどで表記するのがよい。
b) “滅菌済み”の旨
c) 使用期限
d) 製造番号又は製造記号
e) “再使用禁止”の旨(“ディスポーザブル”の表現は,使用しない。)
7.2
二次包装
二次包装には,次を表示する。ただし,二次包装を用いず,一次包装を最小販売単位の包装として用い
る場合は,次を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示は必要としない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 販売名
c) 医療機器の認証番号
d) カテーテル拡張器の外径(mm)及び有効長(mm又はcm)。ただし,外径はミリメートル(mm)で
示すほか,フレンチ(シャリエール)又はゲージを参考で併記してもよい。
注記 フレンチ(シャリエール)は,F(Ch)などで表記するのがよい。1 mmが3 F(Ch)に相当
1/3 mm刻みで表記する。ゲージは,Gなどで表記するのがよい。
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は,使用しない。)
h) 天然ゴムを使用しているものは,その旨
i)
製造番号又は製造記号
j)
滅菌年月

5
T 3260:2017
7.3
図記号の使用
7.1及び7.2の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な図記号の例を,表3に示す。
表3−JIS T 0307に規定する主な図記号の例
6
T 3260:2017
附属書A
(参考)
材料及び設計に関するガイダンス
カテーテル拡張器は,ある程度柔軟性をもつことが必要であるが,身体開口部,又はくう(腔)を拡張
するために十分な堅ろう(牢)性も必要である。チップは身体組織に挿入するとき,めくれを最小限とす
るよう設計する。
7
T 3260:2017
附属書B
(規定)
腐食抵抗性に関する試験方法
B.1
概要
試料を生理食塩水に,次いで沸騰する蒸留水又は脱イオン水中に浸せき(漬)する。その後,目視で腐
食の有無を確認する。
B.2
試験溶液
B.2.1 生理食塩水 分析用試薬グレードの塩化ナトリウムを,新たに精製した蒸留水又は脱イオン水に溶
解させた溶液[c (NaCl)=0.15 mol/L]
B.2.2 蒸留水又は脱イオン水
B.3
器具
B.3.1 ほうけい酸ガラス製ビーカー
B.4
手順
B.4.1 ほうけい酸ガラス製ビーカー(B.3.1)に入れた生理食塩水(B.2.1)中に,試料を室温22±5 ℃で
5時間浸せき(漬)する。
B.4.2 試料を取り出し,沸騰する蒸留水又は脱イオン水(B.2.2)中に30分間浸せき(漬)する。
B.4.3 水と試料とを37±2 ℃まで冷却後,この温度で48時間放置する。
B.4.4 試料を取り出し,室温で乾燥させる。
B.4.5 使用時に分離することを意図した二つ以上の構成部品から成る試料は,分解する。金属部分のコー
ティングについては,剝ぎ取ってはならない。腐食の状況を目視で確認する。
適切なリスクを元にした臨床上の理由によって,別の期間及び温度を使った追加試験を実施することが
できる。
B.5
試験報告書
試験報告書には,次の情報を記載する。
a) カテーテル拡張器の識別
b) 腐食の発生の有無
8
T 3260:2017
附属書C
(規定)
カテーテル拡張器の最大引張強度の測定方法
C.1 概要
カテーテル拡張器の試料は,本体,又は本体とハブとの接合部について試験するよう選択する。試料が
破断又は接合部が外れるまで各試料に引張力を加える。
C.2 装置
C.2.1 引張試験機 15 N以上の引張力を加えることができるもの。
C.3 手順
C.3.1 カテーテル拡張器から試料を選択する。該当する場合,試料にはハブを含める。
C.3.2 37±2 ℃の水中に臨床上適切な時間,試料を浸せき(漬)調整する。その後,直ちに試験を行う。
C.3.3 引張試験機に試料をセットする。ハブがある場合には,ハブの変形を避けるため適切な器具を使用
する。
C.3.4 試料のゲージ長,すなわち,引張試験機のつかみ具間の距離又は該当する場合には,ハブと試料の
他方の端を保持するつかみ具との間の距離を測定する。
C.3.5 試料が二つ以上に破断するか,又は表2の規定値まで,ゲージ長1 mm当たり20 mm/minの単位ひ
ずみ速度で引張力を加える(表C.1参照)。
破断したときの引張力,又は規定値以上の引張力をニュートンで表し,この値を最大引張強度として記
録する。
C.3.6 異なる外径の部分をもつ本体単体によって構成される器具を試験する場合は,試料は最小外径を含
めなければならない。
C.3.7 各試料について2回以上の試験を行ってはならない。
表C.1−ゲージ長1 mm当たり20 mm/minの単位ひずみ速度を生じる引張速度の例
ゲージ長
mm
引張速度
mm/min
10
200
20
400
25
500
C.4 試験報告書
試験報告書には,次の情報を記載する。
a) カテーテル拡張器の識別
b) 各試料の最大引張強度(単位:N)
c) 破断した箇所
9
T 3260:2017
参考文献
[1] ISO 7864:1993,Sterile hypodermic needles for single use
[2] ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices, Amd 1:2001
[3] ISO 10555-1:2013,Intravascular catheters−Sterile and single-use catheters−Part 1: General requirements
[4] ISO 10555-3:2013,Intravascular catheters−Sterile and single-use catheters−Part 3: Central venous catheters
[5] ISO 10555-4:2013,Intravascular catheters−Sterile and single-use catheters−Part 4: Balloon dilatation
catheters
[6] ISO 10555-5:2013,Intravascular catheters−Sterile and single-use catheters−Part 5: Over-needle peripheral
catheters
[7] ISO 11135:2014,Sterilization of health-care products−Ethylene oxide−Requirements for the development,
validation and routine control of a sterilization process for medical devices
[8] ISO 11137-1:2006,Sterilization of health care products−Radiation−Part 1: Requirements for development,
validation and routine control of a sterilization process for medical devices, Amd 1:2013
[9] ISO 11137-2:2013,Sterilization of health care products−Radiation−Part 2: Establishing the sterilization dose
[10] ISO 11137-3:2006,Sterilization of health care products−Radiation−Part 3: Guidance on dosimetric aspects
[11] ISO 15223-1:2012,Medical devices−Symbols to be used with medical device labels, labelling and information
to be supplied−Part 1: General requirements
[12] ISO 17665-1:2006,Sterilization of health care products−Moist heat−Part 1: Requirements for the
development, validation and routine control of a sterilization process for medical devices
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3260:2017 カテーテル拡張器
ISO 11070:2014,Sterile single-use intravascular introducers, dilators and guidewires
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 カテーテル拡張器
について規定した。
1
血管用カテーテルと
使用する,1回使用を
目的としたイントロ
デューサニードル,
イントロデューサカ
テーテル,シースイ
ントロデューサ,ガ
イドワイヤ及びダイ
レータの要求事項に
ついて規定する。
変更
ISO 11070の適用範囲は血管用だ
が,範囲を非血管用まで拡大した。
また,カテーテル拡張器に限定し
た。
非血管用カテーテル拡張器は,対
応する国際規格がないため,適用
範囲が血管用であるが,ISO規格
を基礎として用いた。
国内事情のため。
3 用語及び
定義
3.1 カテーテル拡
張器
3.3
ダイレータの定義
変更
技術的な差異はない。
理解を容易とする。
3.2 患者側端
3.4
一致
−
3.3 有効長
3.5
JISとほぼ同じ
変更
適用範囲を非血管用にまで拡大し
た。
1 適用範囲の項目と同じ。
3.4 ハブ
3.7
JISとほぼ同じ
変更
カテーテル拡張器に限定した。
1 適用範囲の項目と同じ。
3.5 チップ
3.14
JISとほぼ同じ
変更
図を参照した。
理解を容易とする。
4 構成及び
各部の名称
構成について,例図
を示した。
−
−
追加
構成を記載。
規格使用者の利便性を考慮し,追
加。技術的差異はない。
2
T
3
2
6
0
:
2
0
1
7
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
5 要求事項 5.1 一般
4.1
一致
−
5.2 表面
4.3
JISとほぼ同じ
変更
適用範囲を非血管用にまで拡大し
た。
1 適用範囲の項目と同じ。
5.3 腐食抵抗性
4.4
JISとほぼ同じ
変更
血管用のカテーテル拡張器に限定
した。
1 適用範囲の項目と同じ。
5.4.1 一般
9.3.1
ハブ付きの要求事項
追加
ハブが付いてないものに対する要
求事項を追加した。
国内事情のため。
5.4.2 全長
−
−
追加
ハブが付いてないものに対する要
求事項を追加した。
国内事情のため。
5.4.3 かん(嵌)合
9.3.2
一致
−
5.4.4最大引張強度
9.3.3
JISとほぼ同じ
変更
ハブが付いている場合について記
載した。
国内事情のため。
5.5 ガイドワイヤ
の通過性
−
−
追加
ガイドワイヤとの併用を意図して
設計されたものについて,要求事項
を追加した。
推奨ガイドワイヤと併用する場合
についての確認をする試験であ
る。国内事情のため。
5.6 無菌性の保証
4.1
9.1
JISとほぼ同じ
変更
ISO規格と同等の基準であり,我が
国で実績のある基準を記載した。
滅菌バリデーション基準について
明記。技術的差異はない。
5.7 生物学的安全
性
4.2
一致
−
6 包装
6.1 一次包装
6.2 二次包装
−
−
追加
一次包装及び二次包装に区分した。 国内事情のため。
7 表示
7.1 一次包装
7.2 二次包装
4.6
9.2
9.4
製造販売業者が提供
する情報
変更
一次包装及び二次包装に区分した。 国内事情のため。
7.3 図記号の使用
−
−
追加
図記号の使用について追加。
国内事情のため。
−
−
4.5
放射線による検知性
の付加要求事項
削除
カテーテル拡張器に限定した。カテ
ーテル拡張器には,エックス線不透
過を施してはいない。
1 適用範囲の項目と同じ。
2
T
3
2
6
0
:
2
0
1
7
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
−
−
5
イントロデューサニ
ードルの付加要求事
項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
6
イントロデューサカ
テーテルの付加要求
事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
7
シースイントロデュ
ーサの付加要求事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
8
ガイドワイヤの付加
要求事項
削除
この規格の適用範囲外のため。
国内事情のため。
−
−
10
規定する器具の組合
せを含むキットにつ
いての付加要求事項
削除
この規格の適用範囲外のため。
国内事情のため。
附属書A
(参考)
材料及び設計に関
するガイダンス
附属書A
(参考)
JISとほぼ同じ
変更
カテーテル拡張器に限定した。ま
た,血管用に限定しないようにし
た。
カテーテル拡張器に限定し,血管
用・非血管用を対象とした。技術
的差異はない。国内事情のため。
附属書B
(規定)
腐食抵抗性に関す
る試験方法
附属書B
(規定)
一致
−
附属書C
(規定)
カテーテル拡張器
の最大引張強度の
測定方法
附属書C
(規定)
イントロデューサカ
テーテル,シースイ
ントロデューサ及び
ダイレータの最大引
張強度の測定
変更
カテーテル拡張器に限定した。
技術的差異はない。
国内事情のため。
−
−
附属書D
(規定)
−
削除
適用範囲外のため。
国内事情のため。
−
−
附属書E
(規定)
−
削除
適用範囲外のため。
国内事情のため。
−
−
附属書F
(規定)
−
削除
適用範囲外のため。
国内事情のため。
2
T
3
2
6
0
:
2
0
1
7
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
−
−
附属書G
(規定)
−
削除
適用範囲外のため。
国内事情のため。
−
−
附属書H
(規定)
−
削除
適用範囲外のため。
国内事情のため。
−
−
附属書I
(規定)
−
削除
適用範囲外のため。
国内事情のため。
JISと国際規格との対応の程度の全体評価:ISO 11070:2014,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ················ 技術的差異がない。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
T
3
2
6
0
:
2
0
1
7







