T 3249:2016
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 要求事項························································································································· 4
4.1 一般的要求事項 ············································································································· 4
4.2 化学的要求事項 ············································································································· 5
4.3 エックス線探知性 ·········································································································· 5
4.4 生物学的安全性 ············································································································· 5
4.5 エンドトキシン ············································································································· 5
4.6 表面 ···························································································································· 5
4.7 腐食抵抗性 ··················································································································· 5
4.8 最大引張強度 ················································································································ 6
4.9 気密性 ························································································································· 6
4.10 カテーテルハブ及びコネクタ ·························································································· 6
4.11 流量 ··························································································································· 6
4.12 側孔(サイドホール) ··································································································· 6
4.13 患者側先端 ·················································································································· 6
4.14 多くう(腔)管カテーテル ····························································································· 6
4.15 物理的要求事項 ············································································································ 6
5 公称サイズの表示 ············································································································· 7
5.1 外径 ···························································································································· 7
5.2 有効長 ························································································································· 7
6 包装······························································································································· 7
6.1 一次包装 ······················································································································ 7
6.2 二次包装 ······················································································································ 7
7 製造販売業者から提供される情報 ························································································ 7
7.1 一般事項 ······················································································································ 7
7.2 製品本体及び/又は一次包装の表示··················································································· 8
7.3 添付文書 ······················································································································ 8
7.4 二次包装の表示 ············································································································· 8
附属書A(規定)腐食抵抗性に関する試験方法 ·········································································· 9
附属書B(規定)最大引張強度の測定方法················································································ 10
附属書C(規定)加圧条件下での漏れ試験方法 ········································································· 12
附属書D(規定)留置針本体への吸引中の空気混入の試験方法····················································· 13
T 3249:2016 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
附属書E(参考)流量の試験方法 ··························································································· 14
附属書F(参考)測定系の単位の追加 ······················································································ 16
附属書G(規定)内針針基及び内針の接合強度の測定方法 ·························································· 17
附属書H(参考)針先 ·········································································································· 18
附属書I(規定)止血栓からの液漏れの測定方法 ······································································· 19
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 21
T 3249:2016
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器テクノロジー協会(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具
して日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正
した日本工業規格である。
これによって,JIS T 3249:2011は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3249:2016
血液透析用留置針
Sterile indwelling cannulas with needle and catheter for hemodialysis
序文
この規格は,2013年に第2版として発行されたISO 10555-1及びISO 10555-5を基とし,我が国の実情
に合わせるため,一部の技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,血液透析を含む血液浄化療法に用いる滅菌済みの単回使用の留置針について規定する。
注記1 平成31年9月30日までJIS T 3249:2011を適用することができる。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 10555-1:2013,Intravascular catheters−Sterile and single-use catheters−Part 1: General
requirements
ISO 10555-5:2013,Intravascular catheters−Sterile and single-use catheters−Part 5: Over-needle
peripheral catheters(全体評価:MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS G 4305 冷間圧延ステンレス鋼板及び鋼帯
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
ISO 594-1,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical equipment
−Part 1: General requirements
ISO 594-2,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical equipment−
Part 2: Lock fittings
ISO 6009,Hypodermic needles for single use−Colour coding for identification
ISO 7886-1,Sterile hypodermic syringes for single use−Part 1: Syringes for manual use
ISO 9626,Stainless steel needle tubing for the manufacture of medical devices,Amendment 1:2001
ISO 15223-1,Medical devices−Symbols to be used with medical device labels, labelling and information to be
supplied−Part 1: General requirements
2
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
留置針
血管系を通じて,液体を導入又は引き出すために設計されたとう(套)管針カテーテル及び翼付針。
3.2
針(needle)
内針と内針針基とから構成される組立部品(図1参照)。
3.3
内針(needle tube)
体内組織への進入を可能にするために一方の端が鋭利になっている,とう(套)管針カテーテルの硬質
の針。ただし,ボタンホールせん(穿)刺法のための鈍針もある。
3.4
針管
体内組織への進入を可能にするために一方の端が鋭利になっている翼付針の硬質の針。ただし,ボタン
ホールせん(穿)刺法のための鈍針もある。
3.5
内針針基(needle hub)
内針に取り付けられ,その内くう(腔)に接続している部品。
3.6
針基
針管に取り付けられ,その内くう(腔)に接続している部品。
3.7
止血栓(vent fitting)
血液の流出を抑制するために使用する,固定された又は取り外すことができる部品。通気性のあるもの
とないものとがある。
3.8
留置針本体(catheter unit)
カテーテル,カテーテルハブ及びその他の部品から成る集合体。又は止血栓を除いた翼付針全体(図1
及び図2参照)。
3.9
フラッシュバック(flashback)
内針又はカテーテルが血管内に到達したときに発生する血液の流入。
3.10
遠位端(distal end)
留置針の患者に挿入する側の端。
3.11
近位端(proximal end, access end)
留置針の医療機器と接続する側の端。操作する術者側の端。
3
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.12
カテーテルハブ(hub)
カテーテルと一体性をもつコネクタ又はカテーテルの近位端に確実に接続できるカテーテル近位部との
コネクタ。ロックタイプであり,翼付針のコネクタも含む。
3.13
有効長(l1)(effective length)
体内に挿入できるカテーテルの長さ又は針管の長さ(図1及び図2参照)。
3.14
外径(l2)(outside diameter)
血管内に挿入できるカテーテルの最大径又は針管の最大径(図1及び図2参照)。
3.15
分岐部(junction)
臨床使用中の張力又は圧縮力に耐える構造をもつ,1本又は複数のチューブを連結させている接合部分。
3.16
精製水
日本薬局方の医薬品各条に規定する“精製水”又は同等以上の水。
3.17
エンドトキシン試験用水
日本薬局方の医薬品各条に規定する“注射用水”又は精製水,その他の方法によって製造した水で,エ
ンドトキシン試験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3.18
一次包装(primary packaging)
医療機器に直接接触している包装,及び/又は製品の無菌性を維持している包装。
3.19
二次包装(secondary packaging)
一次包装品を1個以上入れるように設計された包装。
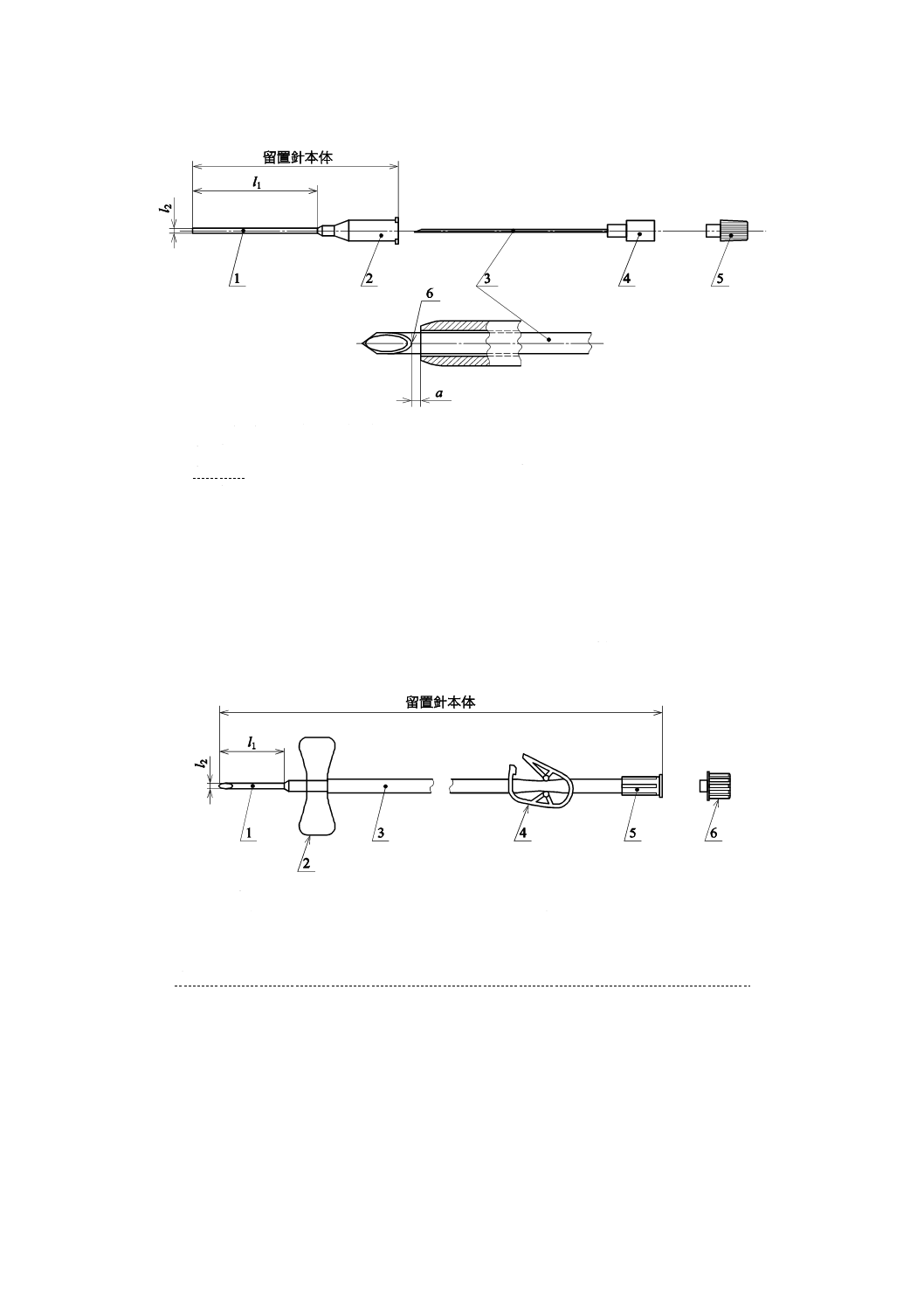
4
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
a 0<a<1 mm(4.15.2参照)
l1 有効長
l2 外径
1 カテーテル
2 カテーテルハブ
3 内針
4 内針針基
5 止血栓
6 刃面のヒール部
注記 図1に示す以外に,翼付き,カテーテルハブに付随した注入口のあるもの,通液部と接する取付具が付
いているもの,カテーテル先端に側孔が付くもの,カテーテルハブにクランプするためのチューブが付
いているもの,カテーテルハブに導液チューブの付いているもの,内針に内くう(腔)がないもの,カ
テーテルハブに逆流防止弁が接続されているもの,止血栓の代わりに注射筒が付くもの,針刺し事故防
止装置が付いているものなどがある。カテーテルは,単管のものと多くう(腔)管のものとがある。
図1−血液透析用とう(套)管針カテーテルの構成及び各部の名称の例
l1 有効長
l2 外径
1 針管
2 針基
3 チューブ
4 クランプ
5 コネクタ
6 止血栓
注記 図2に示す以外に針管先端に側孔が付くもの,チューブが二股に分かれているもの,
針刺し事故防止装置が付いているものなどがある。
図2−血液透析用翼付針の構成及び各部の名称の例
4
要求事項
4.1
一般的要求事項
留置針はバリデーションされた方法で滅菌し,滅菌された状態において4.2〜4.15に適合しなければなら
ない。滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。

5
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
4.2
化学的要求事項
4.2.1
一般
4.2.2,4.2.3及び4.2.4によって試験したときこれに適合するか,又はこれと同等以上の外国の基準で試
験したとき,その基準に適合しなければならない。
4.2.2
試験液及び空試験液の調製
試験液及び空試験液の調製は,次による。
a) 試験液 留置針本体5本を,ほうけい酸ガラスでできた適切な容器に入れ,250 mLの精製水を加え留
置針本体を浸せき(漬)し(カテーテル及びカテーテルハブの内側を含めた全表面が精製水に接触す
るようにする。)3703
+ ℃で24±2時間加温した後,室温になるまで冷却し,留置針本体の内外面から
全ての水を容器に戻して留置針本体を取り除き,この液を試験液とする。
b) 空試験液 同時に留置針本体を入れない精製水を同様の方法で操作し,空試験液を調製する。
4.2.3
pH
試験液及び空試験液のpHを日本薬局方の一般試験法のpH測定法で測定したとき,両液のpHの差は1
以内でなければならない。
4.2.4
溶出金属の制限
原子吸光光度法又はこれと同等以上の微量分析法によって試験液及び空試験液を分析し,試験液の測定
値を空試験液の測定値で補正したとき,試験液の鉛,亜鉛及び鉄の含量の合計は,5 mg/L以下で,かつ,
試験液のカドミウム測定値を空試験液のカドミウム測定値で補正したとき,試験液のカドミウム含量は,
0.1 mg/L以下でなければならない。
4.3
エックス線探知性
リスク評価によって必要と判断される場合,カテーテルには,エックス線不透過性処理が施されていな
ければならない。適合性はASTM F640-12,DIN 13273-7などの適切な試験方法によって実証するのがよい。
4.4
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
4.5
エンドトキシン
留置針本体を5本取り,留置針本体の管内にエンドトキシン試験用水40 mLを約10 mL/minで流し,そ
の液で内針,及びカテーテルの外面又は針管の外面をよく洗い,洗液を合わせて試験液とし,日本薬局方
の一般試験法のエンドトキシン試験法によって試験したとき,0.5 EU/mL未満とする。又はこれと同等以
上の基準に適合しなければならない。
4.6
表面
正常視力又は矯正視力で最小2.5倍に拡大して検査したとき,留置針有効長の外表面には異物があって
はならない。遠位端を含むカテーテル及び針管有効長の外表面は製造工程上での異常及び欠陥がなく,使
用中の血管に対する損傷は,最小限でなければならない。
カテーテルにコーティングが施されている場合には,カテーテルを目視などで検査したとき,外表面に
潤滑剤の液滴があってはならない。
4.7
腐食抵抗性
附属書Aによって試験したとき,通液部との接触を意図した留置針本体を構成する金属部分に腐食があ
ってはならない。
6
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4.8
最大引張強度
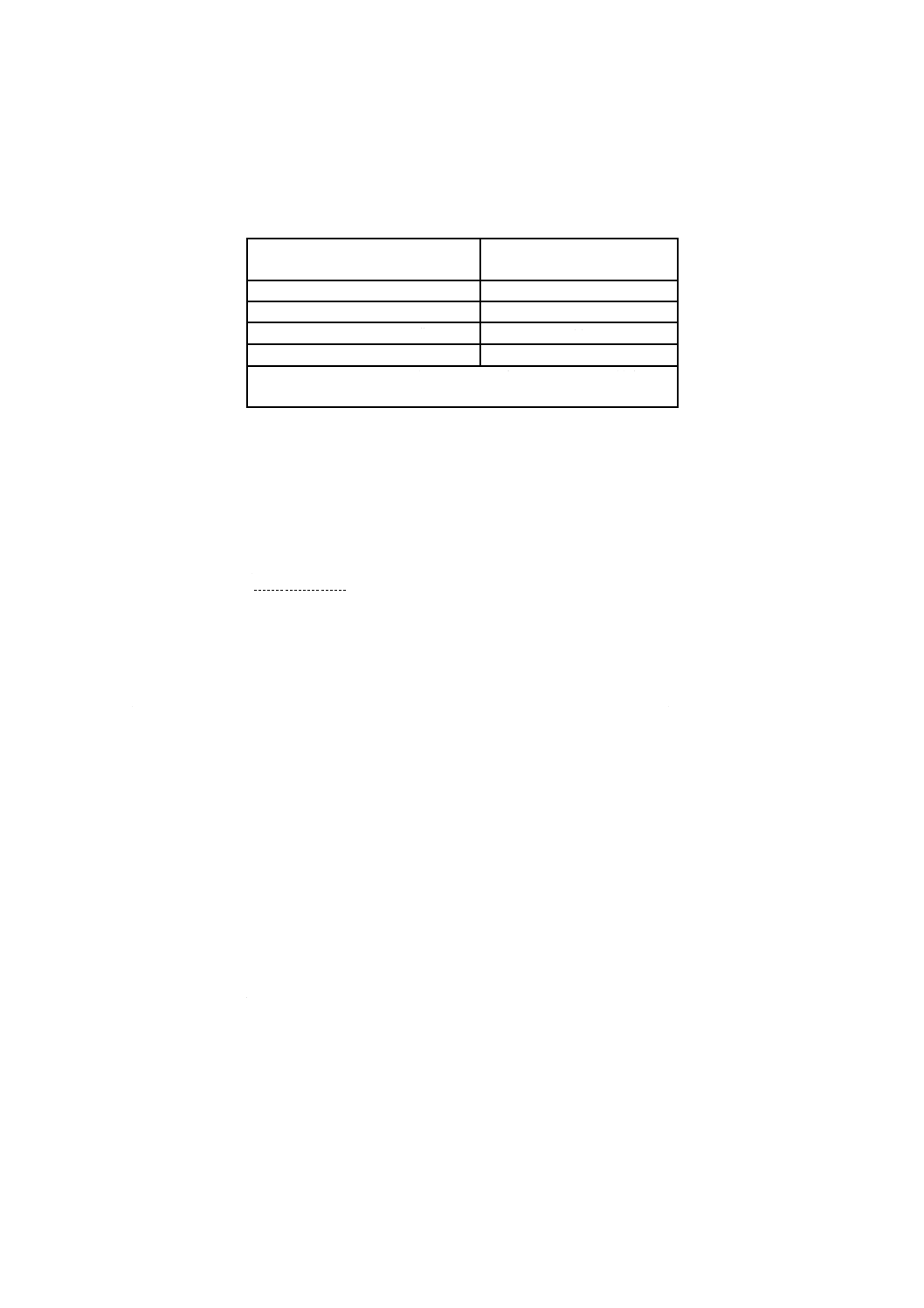
附属書Bによって試験をしたとき,各試料の最大引張強度は,表1による。
表1−留置針試料の最大引張強度
留置針試料の最小外径
mm
最大引張強度の最小値
N
0.55以上 0.75未満
3
0.75以上 1.15未満
5
1.15以上 1.85未満
10
1.85以上
15
注記 ISO 10555-1では外径0.55 mm未満のカテーテルの最大引張
強度についての必要要件が規定されていない。
4.9
気密性
4.9.1
加圧時の漏れ
留置針本体は,附属書Cによって試験したとき,1滴以上の液漏れがあってはならない。
4.9.2
吸引時の漏れ
附属書Dによって試験したとき,吸引中に留置針本体の中に空気が混入してはならない。
4.10
カテーテルハブ及びコネクタ
カテーテルハブがカテーテルと一体形又は分離形であっても,いずれもめす(雌)ハブであり,ISO 594-2
に適合しなければならない。コネクタも同様に適合しなければならない。
4.11
流量
流量の規定がある医療機器については,附属書Eによって試験を行うとき,各くう(腔)の流量は,公
称外径が1.0 mm未満のカテーテルでは製造販売業者の設定値の80 %以上,公称外径が1.0 mm以上のカテ
ーテルでは製造販売業者の設定値の90 %以上でなければならない。
4.12
側孔(サイドホール)
側孔の設計,数及び位置は,カテーテルへの悪影響と組織への傷害を最小限に抑えなければならない。
4.13
患者側先端
使用時に血管への傷害を最小限にするため,カテーテルの患者側先端は,滑らかで,丸みを帯び,テー
パ状であるか,又は同様に仕上げられていなければならない。
4.14
多くう(腔)管カテーテル
多くう(腔)管カテーテルについては,使用者が各管を明確に特定できるようになっていなければなら
ない。
4.15
物理的要求事項
4.15.1
カラーコード
留置針本体は,カテーテル及び針管の公称外径を示すため,ISO 6009に規定するカラーコードによって
カラーコード化されていなければならない。
4.15.2
留置針本体
留置針本体がとう(套)管針カテーテルの場合は,カテーテルの遠位端は挿入を容易にするために先が
細くなり,内針に密着して接続されていなければならない。内針が完全に留置針本体内に挿入されたとき
に,カテーテル先端は,内針のヒール部を超えてはならない。また,針の刃面のヒール部から1 mmを超
7
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
えて離れていてはならない(図1のa参照)。
4.15.3
内針及び針管
4.15.3.1 材料
ステンレス管を使用する場合は,ISO 9626又はJIS G 4305に適合しなければならない。
4.15.3.2 内針及び針管の針先
正常視力又は矯正視力で2.5倍に拡大して検査したとき,針先は鋭角で,そぎ端,ばり及びささくれが
あってはならない。
注記 針先はコアリングしないように設計されていることが望ましい。附属書Hに代表的な針先の形
状を示す。
4.15.3.3 内針針基及び針基
内針の内くう(腔)を利用してフラッシュバックを検知する場合,内針針基,その他の相当する部品は,
フラッシュバックが検知されるような構造をとり,内針の内くう(腔)に接続されていなければならない。
内針針基に取外しのできる止血栓が付いている場合,内針針基の内部は,ISO 594-1に規定するめす(雌)
コネクタになっていなければならない。
4.15.3.4 内針針基及び内針,針基及び針管の接合強度
附属書Gによって試験したとき,内針は内針針基の中で緩んではならない。同様に針管も針基の中で緩
んではならない。
4.15.4
止血栓
必要に応じて,止血栓を付ける。附属書Iによって試験したとき,15秒以内に止血栓から漏れがあって
はならない。
5
公称サイズの表示
留置針の公称サイズは,次の規定に従って表示しなければならない。
5.1
外径
特殊なカテーテルで他の国際規格で規定されない場合には,外径はミリメートル(mm)で表し,小数
点以下2桁目を四捨五入する。
5.2
有効長
有効長は,ミリメートル(mm)で表す。
6
包装
6.1
一次包装
一次包装には,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱
い,輸送及び保管中に内容製品を適切に保護できるものでなければならない。また,一度開封したら,包
装は簡単に再シールできず,開封されたことが容易に分からなければならない。
6.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護するために十分な強度をもつものでなけ
ればならない。
7
製造販売業者から提供される情報
7.1
一般事項
8
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
各医療機器には,安全かつ適切に使用するために必要な情報が添付される。全ての寸法は国際単位系(SI)
で表示する。必要に応じて,ISO 15223-1に規定する単位系も使用することができる。
7.2
製品本体及び/又は一次包装の表示
製品本体及び/又は一次包装には,次の事項を表示する。
注記 一次包装の多くは透明である。したがって,この箇条は,包装を通して目に見える製品表示,
及び一次包装の包装表示,又はその両方の組合せを考慮している。
一次包装への表示が技術的に困難である場合は,二次包装の表示に代えてもよい。
a) 製造販売業者及び/又は正式代表者の名称又は商号,及び住所
b) 製品の識別に必要な情報(箇条5で規定している公称寸法を含む。)及びこん(梱)包の内容
c) “滅菌済み”の文言又はISO 15223-1に規定しているシンボル
d) 滅菌方法
e) バッチコード,又はロット番号,シリアル番号,又はISO 15223-1に規定しているシンボル
f)
使用期限として製品が安全に使用できる年月日を記載。ただし年月でもよい(例 YYYY-MM)。
g) “再使用禁止”の旨
h) 保管及び/又は取扱条件
i)
製品の使用目的 ユーザに対して用途が明確でない場合(ただし,添付文書が別添されている場合,
この項目は一次包装から省略する。)
j)
必要に応じて,添付文書を参照する旨
k) 各管くう(腔)の流量
l)
一部又は全体を引き抜いた針を再挿入するときの警告
m) 製品の色が包装を通して見えない場合は,4.15.1に規定するカラーコード,及び外径
注記 ISO 10555に規定していない単位系を併記しても差し支えない。
7.3
添付文書
添付文書には,最低限次の情報を含まなければならない。
a) 7.2に規定する項目。ただし,d),e),f) 及びj) は除く。
b) 注意事項及び警告(例 洗浄剤)
c) 使用目的に応じて製品を他の医療機器又は周辺機器と接続する場合,安全に接続するために,正しい
製品が特定できる製品特性の詳細
d) 添加剤又はコーティング剤の説明
e) d) を考慮して,製品の廃棄に関する特別要求事項
f)
必要に応じて,添加剤又はコーティング剤の使用による影響
− 添加剤又はコーティング剤の原材料の説明
− 使用において影響がある期間
− 添加剤又はコーティング剤の原材料に基づく禁忌,警告及び注意
g) 必要に応じて,留置針本体と核磁気共鳴画像法(MRI)との既知の反応
h) 添付文書の発行日又は最新版の番号
7.4
二次包装の表示
製品が二次包装にて供給される場合,二次包装の表示には7.2の情報を,必要に応じて含める。
9
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
腐食抵抗性に関する試験方法
A.1 概要
留置針本体は,塩化ナトリウム溶液に浸せきし,次に沸騰した水の中に浸せきする。その後,目視で腐
食の有無を確認する。
A.2 試験溶液
A.2.1 生理食塩水(塩化ナトリウム溶液)
分析用試薬グレードの塩化ナトリウムを,新たに精製した蒸留水に溶解させた溶液[c(NaCl)=0.15
mol/L]
A.2.2 水
蒸留水又は脱イオン水
A.3 試験器具
A.3.1 ほうけい酸ガラスビーカー
A.4 手順
ガラスビーカー(A.3.1)に入れた塩化ナトリウム溶液(A.2.1)中に留置針本体を室温で5時間,浸せき
する。
試料を取り出し,30分間,沸騰した水の中(A.2.2)に浸せきする。水と試料とを37 ℃まで冷却後,こ
の温度で48時間保持する。試料を取り出し,室温で乾燥させる。使用時に二つ以上に分離するような試料
を取り外す。金属部品のコーティング剤を剝離したり又は切ったりしてはならない。腐食の有無を目視で
検査する。
A.5 試験報告書
試験報告書には,次の情報を記載する。
a) 留置針本体の識別
b) 試験中に腐食が発生したかどうかの記載

10
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
最大引張強度の測定方法
B.1
概要
留置針本体の各接合部が試験できるように試料を選択する。カテーテルの破断又は接合部の外れが発生
するまで各試料に引張力を加える。
B.2
機器
B.2.1 引張試験機 15 Nを超える引張力をもつもの。
B.3
手順
B.3.1 製造販売業者の指示に従い留置針本体を準備する。カテーテルハブ又はコネクタがある場合には,
それらを試料に加え,さらに,カテーテルとカテーテル先端部との間で接合しているようなものがあれば,
それも試料に加える。遠位部先端から3 mm未満の部分は,試料から除外する。
B.3.2 B.3.1によって準備した試料を,温度37±2 ℃の適切な水媒体に,臨床的に適切な時間浸せきする。
浸せき後,直ちにB.3.3〜B.3.8に従って試験する。
B.3.3 引張試験機に試料をセットする。カテーテルハブ又はコネクタがある場合には,カテーテルハブ又
はコネクタの変形を避けるため,適切な器具を使用する。
B.3.4 試料のゲージ長,すなわち,引張試験機のつかみ具間の距離,若しくは該当する場合には,試料の
カテーテルハブ又はコネクタと他方の端を保持するつかみ具間との距離を測定する。
B.3.5 試料が二つ以上に分離するまで,ゲージ長1 mm当たり20 mm/minのひずみ速度(表B.1参照)で
引っ張る。破断が起きたとき,又はその前の最大引張強度力(単位:N)の値を書きとめ,この値を最大
引張強度として記録する。
B.3.6 同一カテーテルで異なる外径部分を試験する場合には,試料は最小外径を含めることが望ましい。
B.3.7 1個以上のサイドアームをもつ試料について試験する場合には,次の手順による。
a) 各サイドアームに関して,B.3.2〜B.3.5の手順を繰り返す。
b) サイドアームと身体に差し込むことを意図したカテーテルとの隣接部分の接合部を含む試料について
は,B.3.2〜B.3.5の手順を繰り返す。
c) 各接続部について,b) の手順を繰り返す。
B.3.8 どの試料も2回以上の試験を行わない。
表B.1−ゲージ長1 mm当たり20 mm/minのひずみ速度を生じる引張速度例
ゲージ長
mm
試験速度
mm/min
10
20
25
200
400
500
11
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.4
試験報告書
試験報告書には,次の情報を記載する。
a) 留置針本体の識別
b) 最大引張強度(ニュートン単位)
c) 破断の箇所
12
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(規定)
加圧条件下での漏れ試験方法
C.1 概要
漏れ防止接続具を介して留置針本体を注射筒又は圧力装置に接続する。留置針本体と取付け形のハブ(該
当する場合)に水圧を加え,留置針本体からの漏れを検査する。
C.2 試験溶液
C.2.1 水
蒸留水又は脱イオン水
C.3 器具
C.3.1 漏れ防止コネクタ 留置針本体を注射筒又は圧力装置(C.3.2)に接続するためのものであり,少
なくとも300 kPaの圧力まで測定できるゲージを取り付けることができ,内部の容量が小さなもの。
C.3.2 注射筒(適切サイズ) ISO 7886-1に規定する押子と先端チップとの漏れ試験に適合したもの,又
はそれと同等の器具。
C.3.3 試料を閉塞する器具
例 締め具(クランプ)
C.4 手順
C.4.1 1個以上の留置針本体で試験を行うとき,必要に応じて,製造販売業者の指示に従って取付け形の
ハブを接続する。接続部から漏れないように,カテーテルハブを液漏れ防止コネクタ(C.3.1)に接続する。
C.4.2 注射筒又は圧力装置(C.3.2)に22±5 ℃の水(C.2.1)を満たし,空気を除去する。公称目盛付容
量まで注射筒内の水の容量を調整する。可能な限り患者側先端で試料を閉鎖する(C.3.3)。
C.4.3 注射筒と留置針本体との接続が水平となるように位置決めを行う。押子と外筒との相互作用で最低
150 kPaの圧力が発生するように,注射筒に軸方向の力を加える。この圧力を15分間維持する。ハブ組立
品がある場合には,これを検査し,留置針本体からの漏れを検査する。すなわち,1滴以上の水滴がある
かどうかを検査し,漏れ発生の有無を確認する。
C.5 試験報告書
試験報告書には,次の情報を記載する。
a) 留置針本体の識別
b) 取付け形のハブ(該当する場合)又は留置針本体からの漏れの有無についての記載
13
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(規定)
留置針本体への吸引中の空気混入の試験方法
D.1 概要
留置針本体のカテーテルハブ又はコネクタ(以下,コネクタという。)を水を一部入れた注射筒に接続す
る。注射筒の押子を引き,陰圧を留置針本体及び標準かん合ジグに加える。注射筒における気泡の発生を
目視で検査する。
D.2 試験溶液
D.2.1 水
脱気済み蒸留水又は脱イオン水
D.3 器具
D.3.1 注射筒(10 mL) ISO 7886-1に規定する押子と先端チップとの漏れ試験に適合したもの,又はそ
れと同等の器具
D.3.2 試料を塞ぐ手段 例えば,クランプなど。
D.4 手順
D.4.1 製造販売業者の指示に従い,取付け形ハブを組み立てる。コネクタを試験用の注射筒(D.3.1)に
漏れないように接続する。開通させることを目的とした全てのバルブを吸引中には閉じておく。
D.4.2 試料及び標準かん合ジグを介して,注射筒にシリンジ目盛容量の25 %を超える22±5 ℃の水
(D.2.1)を吸引する。コネクタと標準かん合ジグとの接合部を湿らせない。
D.4.3 機器から小気泡以外の空気を除去する。注射筒内の水の容量を目盛容量の25 %に調整する。可能
な限りコネクタに近接させて試料を閉じる(D.3.2)。
D.4.4 注射筒先端チップを下向きにして,最大目盛容量まで押子を引く。気泡が生じない十分な時間維持
し,さらに,10秒間待ち,試料から漏れがないか確認する。
注記 このほかの吸引方法を用いる場合,吸引圧力は2.67 kPaに設定するのがよい。
D.5 試験報告書
試験報告書には,次の情報を記載する。
a) 留置針本体の識別
b) 試験結果の合否。漏れがあった場合,漏れが起こった箇所が特定できればその箇所。
14
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E
(参考)
流量の試験方法
E.1
概要
留置針に水を通し,その水量を容積及び質量から測定する。
E.2
試験溶液
蒸留水,脱イオン水又はその他の臨床的関連媒体
E.3
装置
E.3.1 定水位槽 給水管及びISO 594-1に規定するおす(雄)かん合になっている部品を備え,被検留置
針本体を取り付けていないときの流量が,525±25 mL/minであり,静水水頭高さが1 000±5 mmである水
槽
適切な装置の例を,図E.1に示す。
E.3.2 留置針流出水を収集し,量を決定するための装置 精度±1 %
E.3.3 タイマ 収集時間を測定するための装置
E.4
試験手順
E.4.1 定水位槽(E.3.1)に水温22±2 ℃の試験溶液を入れる。試験用留置針をおす(雄)かん合部には
める。
E.4.2 留置針本体に試験溶液を通す。測定時間内(30秒以上)に流出した水を,適切な容器に収集し,
メスシリンダを用いて容積を測定する,又は試験溶液の密度を考慮してその質量を測定する。
E.4.3 留置針の管ごとに容積を3回ずつ算出する。
E.5
試験結果の表記方法
3回の測定結果の平均値を計算し,その値を留置針を通過した試験溶液の流量としてミリリットル/分
(mL/min)で表す。算出した平均値をミリリットルの整数の近似値まで丸める。
E.6
試験報告書
試験報告書には,次の情報を記載する。
a) 留置針の識別番号
b) 各管の平均流量(mL/min)
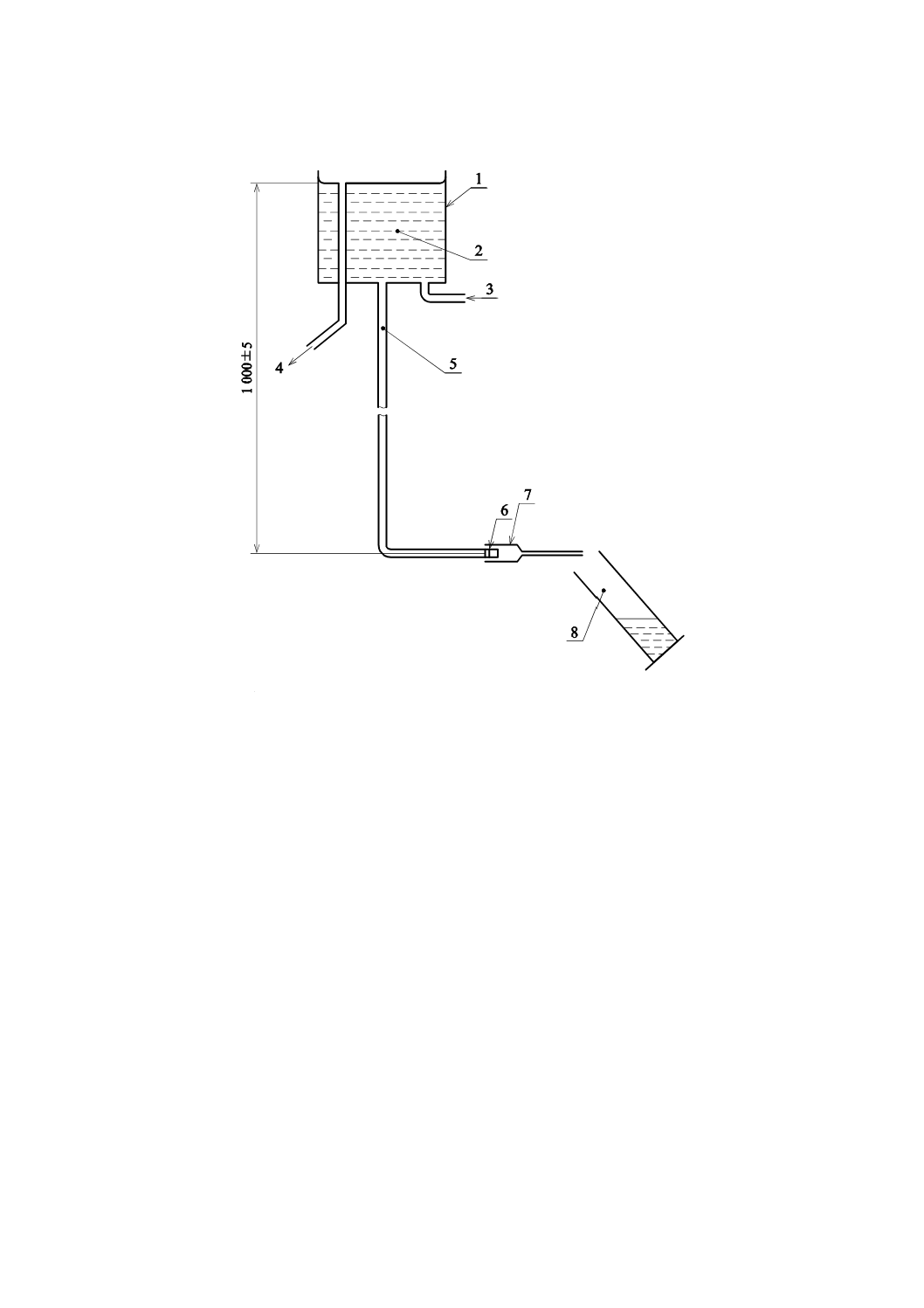
15
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
単位 mm
1 定水位槽
2 試験溶液
3 取水口
4 オーバーフロー管
5 給水管
6 6 %の(ルアー)テーパ付きおす(雄)かん合部
7 試験用留置針
8 収集/測定容器
図E.1−留置針を通る流量を決定するための装置例
16
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書F
(参考)
測定系の単位の追加
この附属書に記載されている以外の測定系の単位を追加して使用してもよい。
F.1
針ゲージ
内針又は針管の外径を表す。ゲージ番号が大きいほど,内針又は針管の外径は小さくなる。
17
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書G
(規定)
内針針基及び内針の接合強度の測定方法
G.1
概要
内針針基及び内針並びに針基及び針管に力を加え(連続的な引張力及び圧縮力),緩みがないかどうかを
点検し,内針針基及び内針並びに針基及び針管の接合部を検査する。
G.2
装置
G.2.1 引張強度試験機 精度±1 %で20 Nまでの力を加えることができる装置
G.3
試験手順
G.3.1 針又は留置針本体を,状態調節するために,試験の直前,温度22±2 ℃で相対湿度40〜60 %の大
気中に2時間置く。
G.3.2 内針針基及び内針を,又は針基及び針管を,引張試験装置のつかみ具に締め具で固定し,100
mm/minの移動速度で次の引張力と圧縮力とを1回ずつ加える。
− 外径が0.6 mm未満の針の場合は,10 N
− 外径が0.6 mm以上の針の場合は,20 N
G.3.3 内針針基及び内針,針基及び針管の接合部を検査し,内針針基部又は針基部が緩んだかどうかを記
録する。
G.4
試験報告書
試験報告書には,次の情報を記載する。
a) 針又は留置針本体の識別番号
b) 内針又は針管の外径(mm)
c) 加えられた荷重力(例えば,10 N又は20 N)
d) 内針針基部又は針基部が緩んだかどうかの記載
18
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書H
(参考)
針先
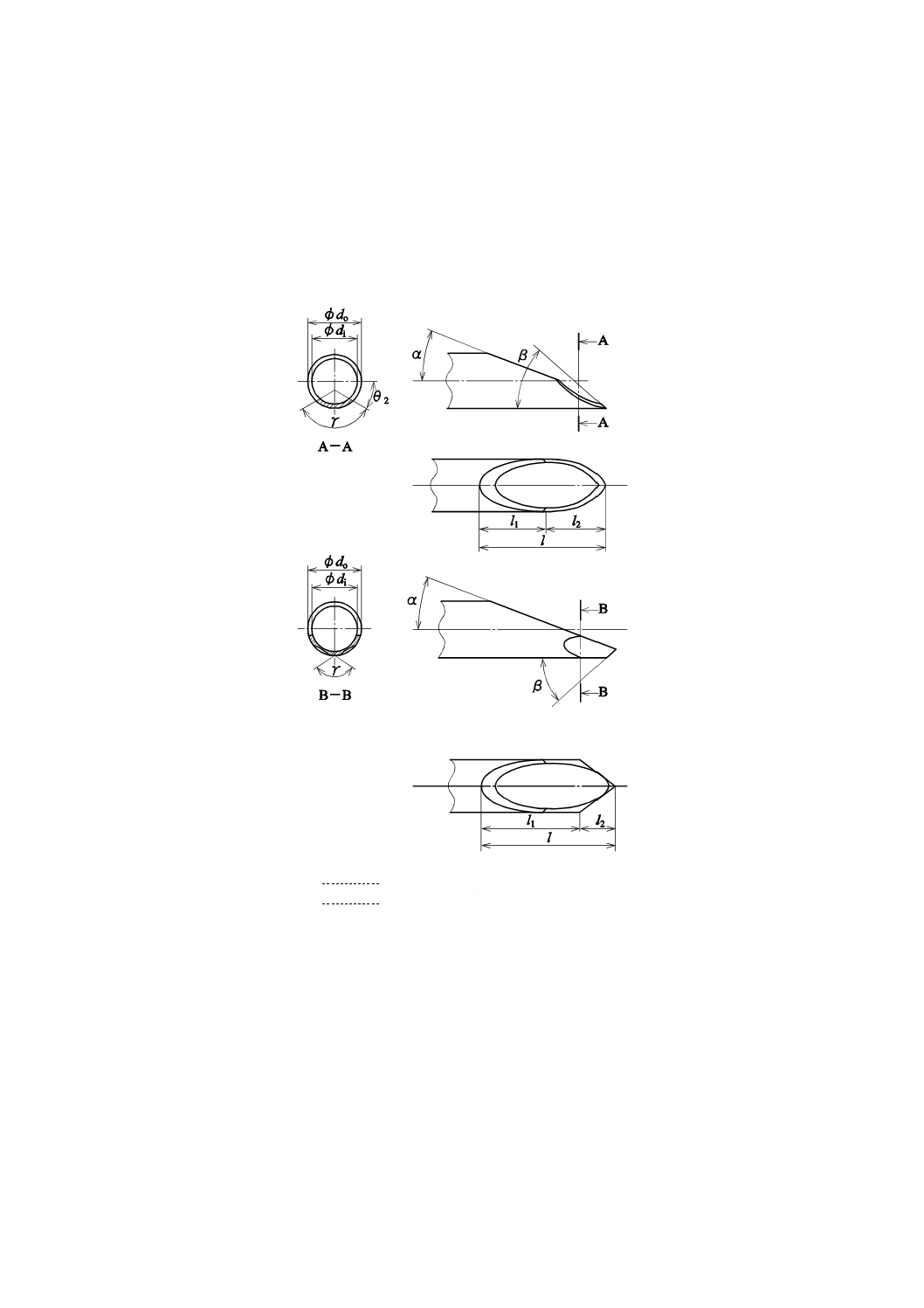
代表的な針先形状を図H.1に示す。
do 内針又は針管の外径
di 内針又は針管の内径
l
針先の長さ
l1
第1刃面長さ
l2
第2刃面長さ
α
第1刃面角度
β
先端角
θ2 第2刃面回転角
γ
第2刃面複合角
図H.1−代表的な針先の形状
19
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書I
(規定)
止血栓からの液漏れの測定方法
I.1
概要
針を静水圧下にて擬似血液源の水槽と接続する。針に液体が流れるようにして止血栓から液漏れが起き
るまでの時間を計測する。
I.2
試験液
I.2.1
蒸留水又は脱イオン水に試薬用塩化ナトリウム9 gを溶解させて1 Lの塩化ナトリウム溶液[0.9 %
(m/V)]を調製する。
I.2.2
塩化ナトリウム溶液(I.2.1)550 mLとUSP等級以上のグリセロール450 mLとを混ぜて試験液を
調製する。
注記 視認性をよくするために,赤又は青の食用色素を試験液に混ぜてもよい。
I.3
装置
I.3.1
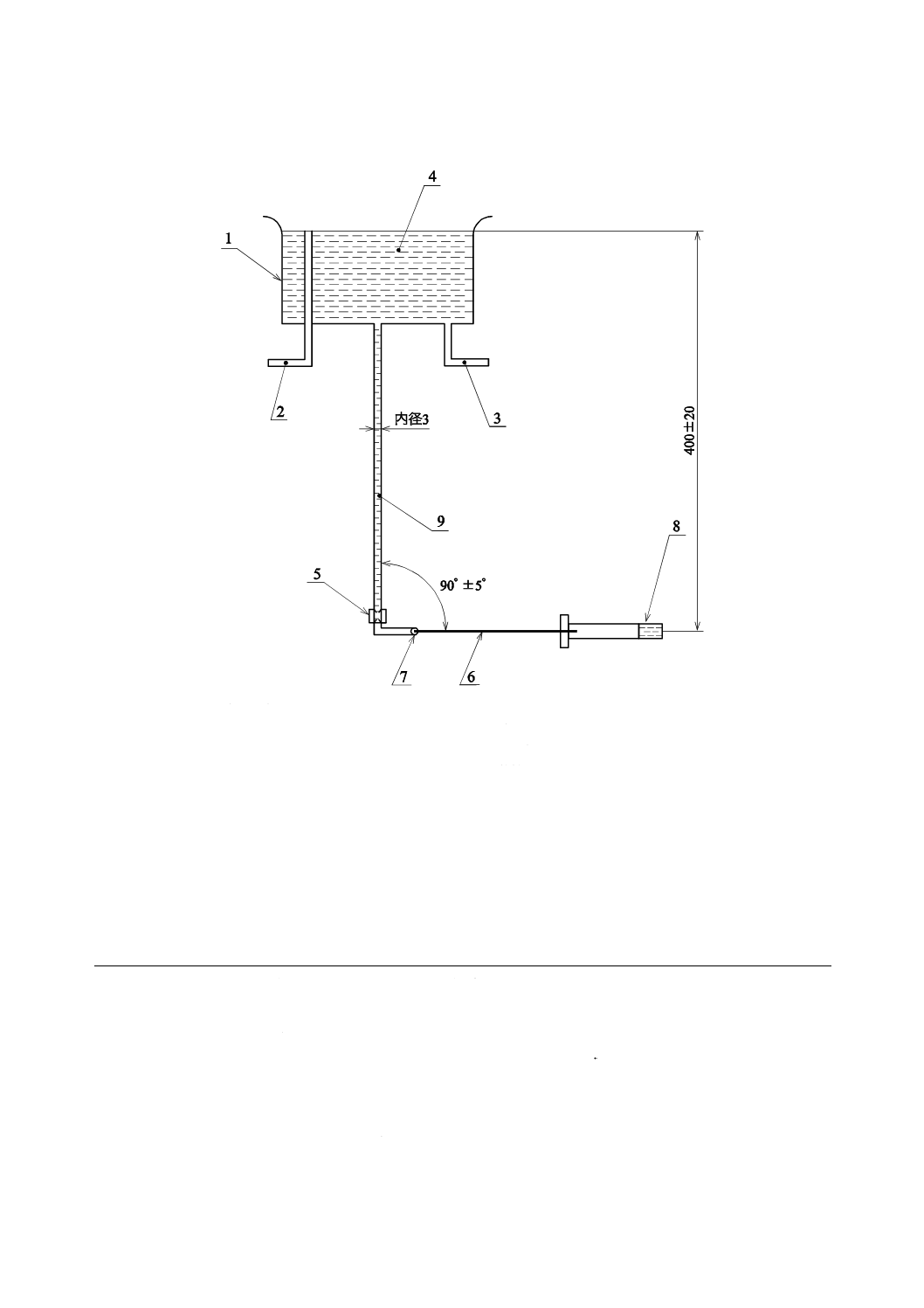
定水位槽 静水水頭高さが400±20 mmであり,内径3 mm以上でクランプ又は弁が付いていて,
先端にせん(穿)刺可能な膜(例 ゴムキャップ)をもつ導管が付いた水槽(図I.1の装置例参照)。
I.3.2
ストップウォッチ又は類似の装置
I.4
手順
I.4.1
定水位槽(I.3.1)に23±2 ℃に温めた試験液(I.2)を入れる。
I.4.2
プライミングを行い,導管の空気を完全に抜いた後クランプ又は弁を閉じる。
I.4.3
内針又は針管を水平線から±5°以内に保持して,膜にせん(穿)刺する。
I.4.4
内針又は針管に試験液が流れるよう,クランプ又は弁を開ける。止血栓の後方から最初に試験液が
落ちるまでの時間を計測する。
I.5
試験報告書
試験報告書には,次の情報を記載する。
a) 針の識別番号
b) 最初に試験液が落ちるまでの時間(s)
20
T 3249:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
単位 mm
1
定水位槽
2
排水管
3
給水管
4
試験液
5
クランプ又は弁
6
内針又は針管
7
膜
8
止血栓
9
導管
図I.1−止血栓からの液漏れの測定のための装置例
参考文献 ISO 7864,Sterile hypodermic needles for single use
ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and testing within a risk
management process
ISO 80369-6,Small bore connectors for liquids and gases in healthcare applications−Part 6:
Connectors for neuraxial applications
ASTM F640-12,Standard Test Methods for Determining Radiopacity for Medical Use
DIN 13273-7,Katheter für den medizinischen Bereich−Teil 7: Bestimmung der
Röntgenstrahlenschwächung von Kathetern; Anforderungen und Prüfung
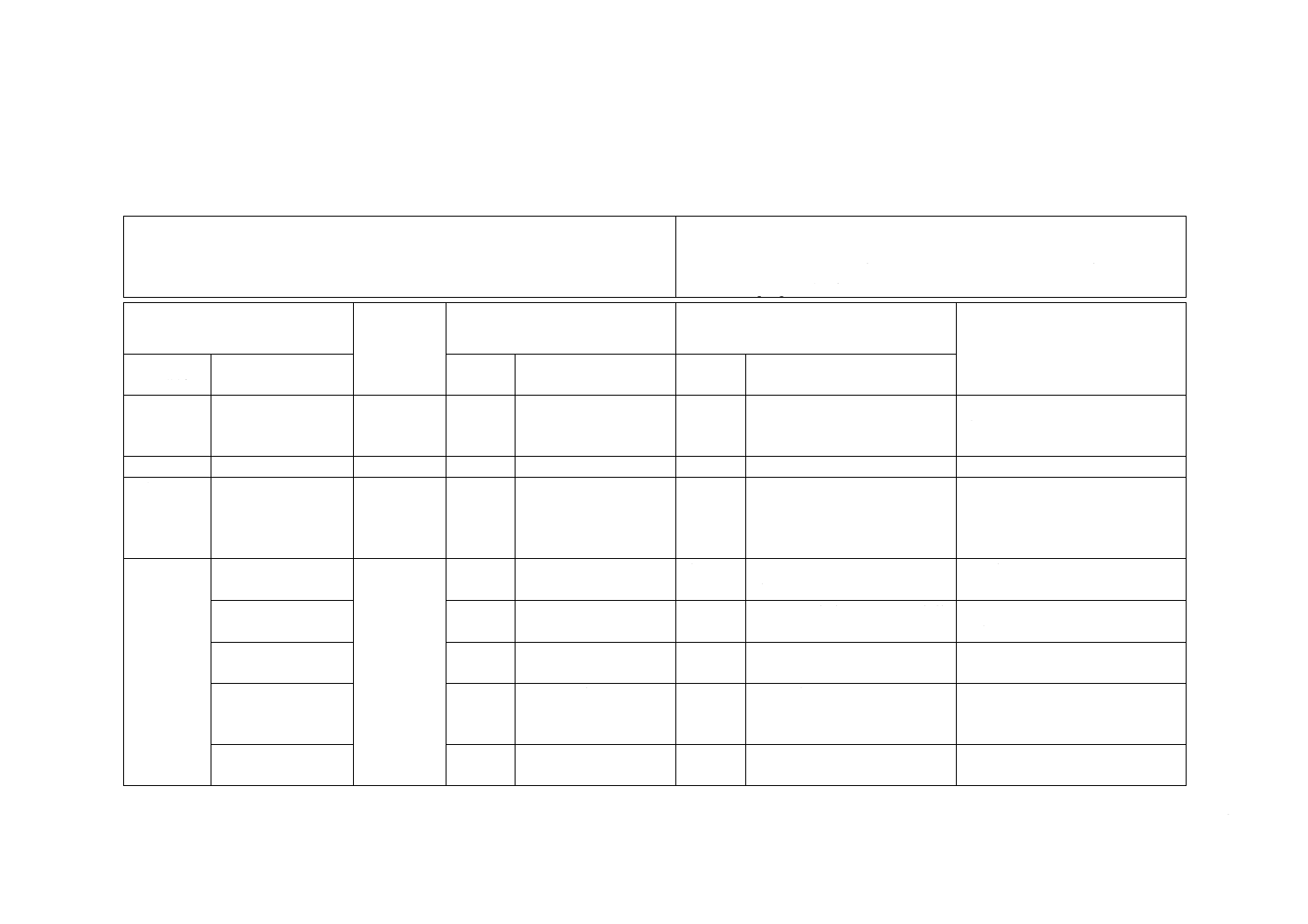
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3249:2016 血液透析用留置針
ISO 10555-1:2013,Intravascular catheters−Sterile and single-use catheters−Part 1:
General requirements
ISO 10555-5:2013,Intravascular catheters−Sterile and single-use catheters−Part 5:
Over-needle peripheral catheters
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇
条ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 血液浄化療法に用
いる留置針につい
て規定
ISO 10555-1
ISO 10555-5
1
末しょう(梢)血管用
留置針について規定
変更
用途を変更した。
血液透析用留置針の国際規格はな
く,ISO 10555-5を基礎に用いたこ
とによる。
2 引用規格
3 用語及び
定義
19項目の用語の定
義を規定
ISO 10555-1
ISO 10555-5
3
3
15項目の用語の定義を
規定
7項目の用語の定義を
規定
追加
翼付針に関係する用語を追加,
精製水及びエンドトキシン試
験用水を追加
利用者の利便性のため。実質的な
差異はない。
4 要求事項 4.1 一般的要求事項
ISO 10555-1
4.1
追加
バリデーション基準の説明を
追加
利用者の利便性のため。実質的な
差異はない。
4.2 化学的要求事項
−
−
追加
我が国で実施している化学的
要求事項を追加
JIS T 3209(滅菌済み注射針)を
参考にした。
4.5 エンドトキシン
−
−
追加
我が国で実績のある方法を追
加。
ISO規格は4.3で評価しており,
実質的な差異はない。
4.9 気密性
4.7
JISとほぼ同じ
変更
JISは輸液セット基準の試験条
件を準用して設定した。
ISO規格は造影用カテーテルを含
むが,JISは透析用留置針に応じ
た条件とした。
4.10 カテーテルハ
ブ及びコネクタ
4.8
JISとほぼ同じ
変更
ISO 594-1は削除し,ISO 594-2
だけを採用
安全面を考慮してロックタイプだ
けを採用
2
T
3
2
4
9
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
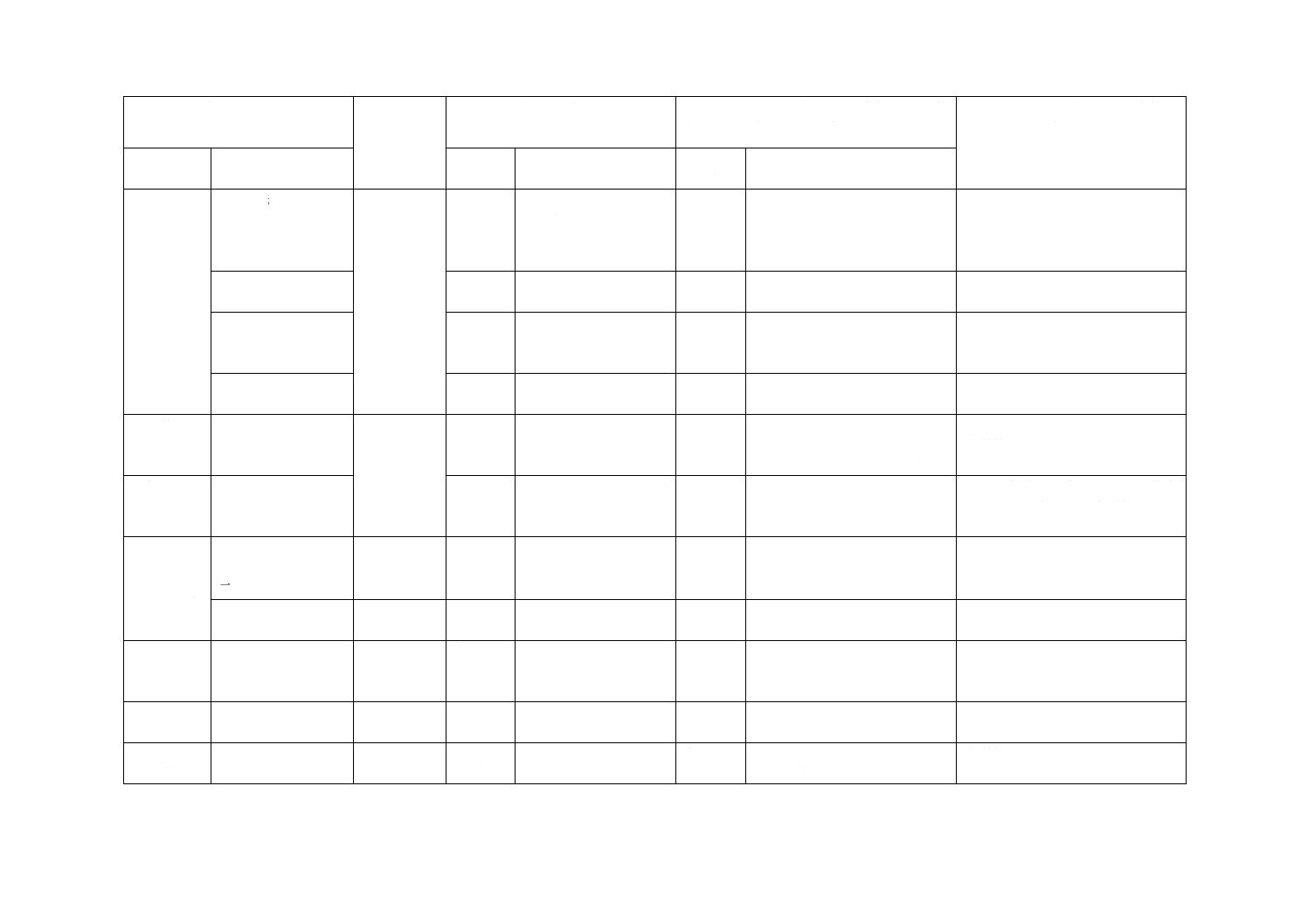
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇
条ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
4 要求事項
(続き)
4.15.1 カラーコー
ド
ISO 10555-5
4.3.1
末しょう(梢)血管用
留置針のカラーコード
を規定
変更
ISO 6009の滅菌済み使い捨て
皮下注射針のカラーコードを
採用
国内外の製品においてカラーコー
ドは統一されておらず,ISO 6009
のカラーコードの方が適している
ため。
4.15.3.1 材料
4.3.3.1
JISとほぼ同じ
選択
JISはJIS G 4305を追加
実績のあるJIS独自の素材も選択
可能とした。
4.15.3.4 内針針基及
び内針,針基及び針
管の接合強度
4.3.3.4
追加
“同様に針管も針基の中で緩ん
ではならない”を追加
利用者の利便性のため。実質的な
差異はない。
4.15.4 止血栓
4.3.4
追加
“必要に応じて”を追加
利用者の利便性のため。実質的な
差異はない。
5 公称サイ
ズの表示
カテーテル及び針
管の公称サイズの
表示方法を規定
ISO 10555-1
5
JISとほぼ同じ
変更
小数点以下2桁目を四捨五入
を追加
センチメートル表示は削除
ミリメートル表示に統一のため。
実質的な差異はない。
6 包装
一次包装及び二次
包装を規定
−
−
追加
JISは包装について規定
他の滅菌済み医療機器JISと整合
するため規定した。実質的差異は
ない。
7 製造販売
業者から提
供される情
報
7.2 製品本体及び/
又は一次包装の表
示
ISO 10555-1
ISO 10555-5
6.1
6.2
4.4
11項目の規定
3項目の規定
変更
透析用留置針に関する規定だ
けを設定した。
実質的差異はない。
7.3 添付文書
ISO 10555-1
6.3
9項目の規定
変更
透析用留置針に関する規定だ
けを設定した。
実質的差異はない。
附属書C
(規定)
加圧条件下での漏
れ試験方法
ISO 10555-1
Annex C
(規定)
加圧条件下での漏れ試
験方法
変更
JISは輸液セット基準の試験条
件を準用して設定した。
ISO規格は造影用カテーテルを含
むが,JISは透析用留置針に応じ
た条件とした。
附属書E
(参考)
流量の試験方法
ISO 10555-1
Annex E
(規定)
カテーテル流量の決定
方法
変更
JISは参考とした。
附属書以外の試験方法も選択可能
とするため。
附属書F
(参考)
測定系の単位の追
加
ISO 10555-1
Annex H
(参考)
変更
透析用留置針に関する規定だ
けを設定した。
実質的差異はない。
2
T
3
2
4
9
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
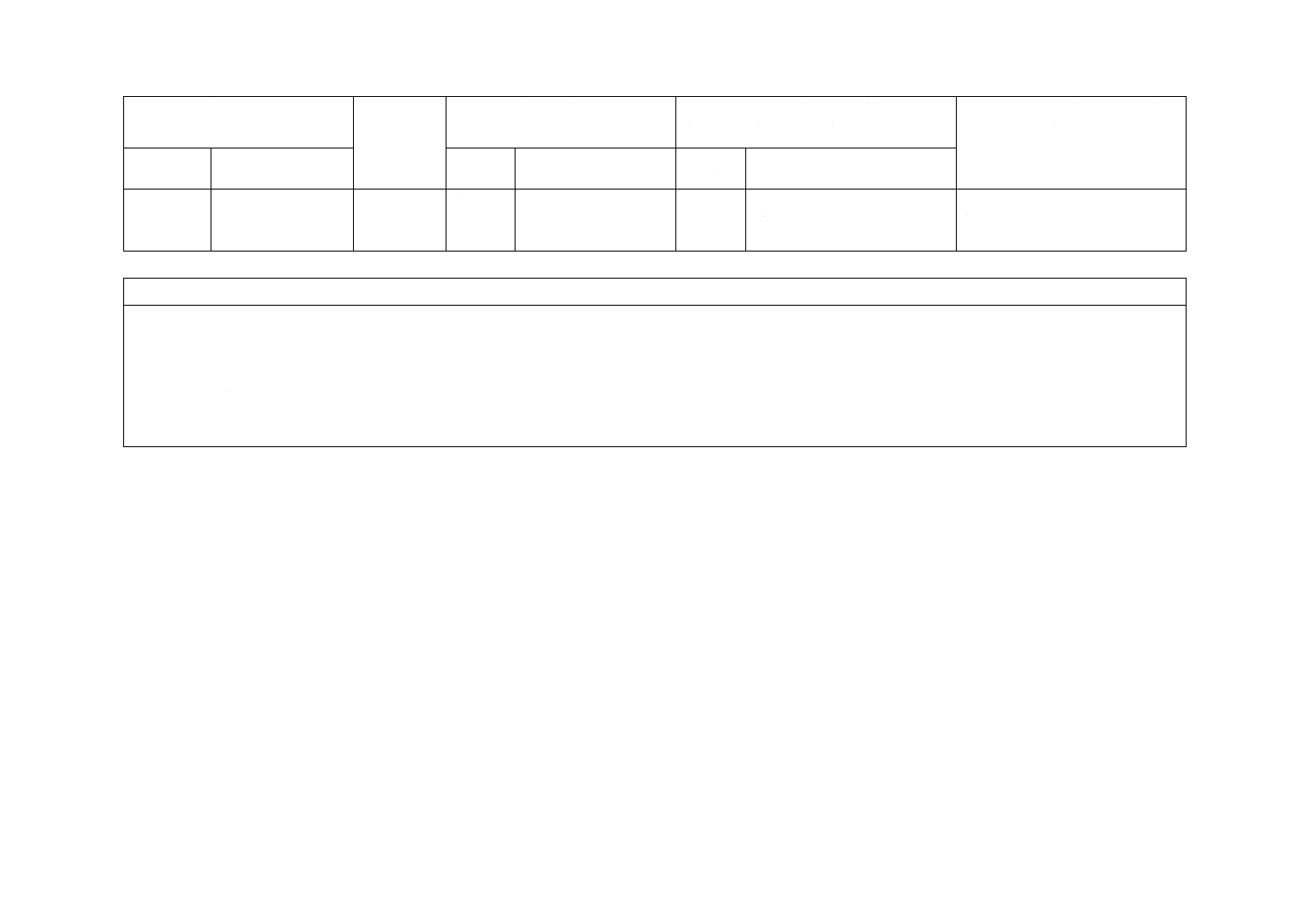
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇
条ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
−
−
ISO 10555-5
Annex B
(参考)
不透過処理を施したカ
テーテルハブの色分け
削除
ISO 10555-5のカラーコードと
ISO 6009のカラーコードとは
異なる。
JISはISO 6009のカラーコードを
採用するため。
JISと国際規格との対応の程度の全体評価:(ISO 10555-1:2013,ISO 10555-5:2013,MOD)
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
T
3
2
4
9
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。









