T 3241:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 1
5 要求事項 ························································································································· 2
5.1 外径 ···························································································································· 2
5.2 引張強さ ······················································································································ 2
5.3 外観及び清浄度 ············································································································· 2
5.4 生物学的安全性 ············································································································· 2
5.5 無菌性の保証 ················································································································ 2
6 包装······························································································································· 2
6.1 一次包装 ······················································································································ 2
6.2 二次包装 ······················································································································ 2
7 表示······························································································································· 2
7.1 一次包装 ······················································································································ 2
7.2 二次包装 ······················································································································ 3
7.3 記号の使用 ··················································································································· 3
T 3241:2011
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべきと
の申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3241:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3241:2011
内視鏡用オーバチューブ
Sterile over tube for single use
序文
この規格は,2005年に制定されたJIS T 3241の見直しにおいて,使用者の利便性のため,用語,文書構
成などの内容を変更して改正した日本工業規格である。
1
適用範囲
この規格は,体内への内視鏡の挿入を容易にするために,及び内視鏡治療の補助として使用する内視鏡
用オーバチューブ(以下,オーバチューブという。)について規定する。
なお,平成26年7月28日までJIS T 3241:2005は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2005 医療機器の生物学的評価−第1部:評価及び試験
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
内視鏡用オーバチューブ
内視鏡が通過する本体部分。
3.2
キャップ
オーバチューブの口側部分。グリップ又はファネルともいう。
3.3
マウスピース
患者の口部に挿入し,固定する部分。
4
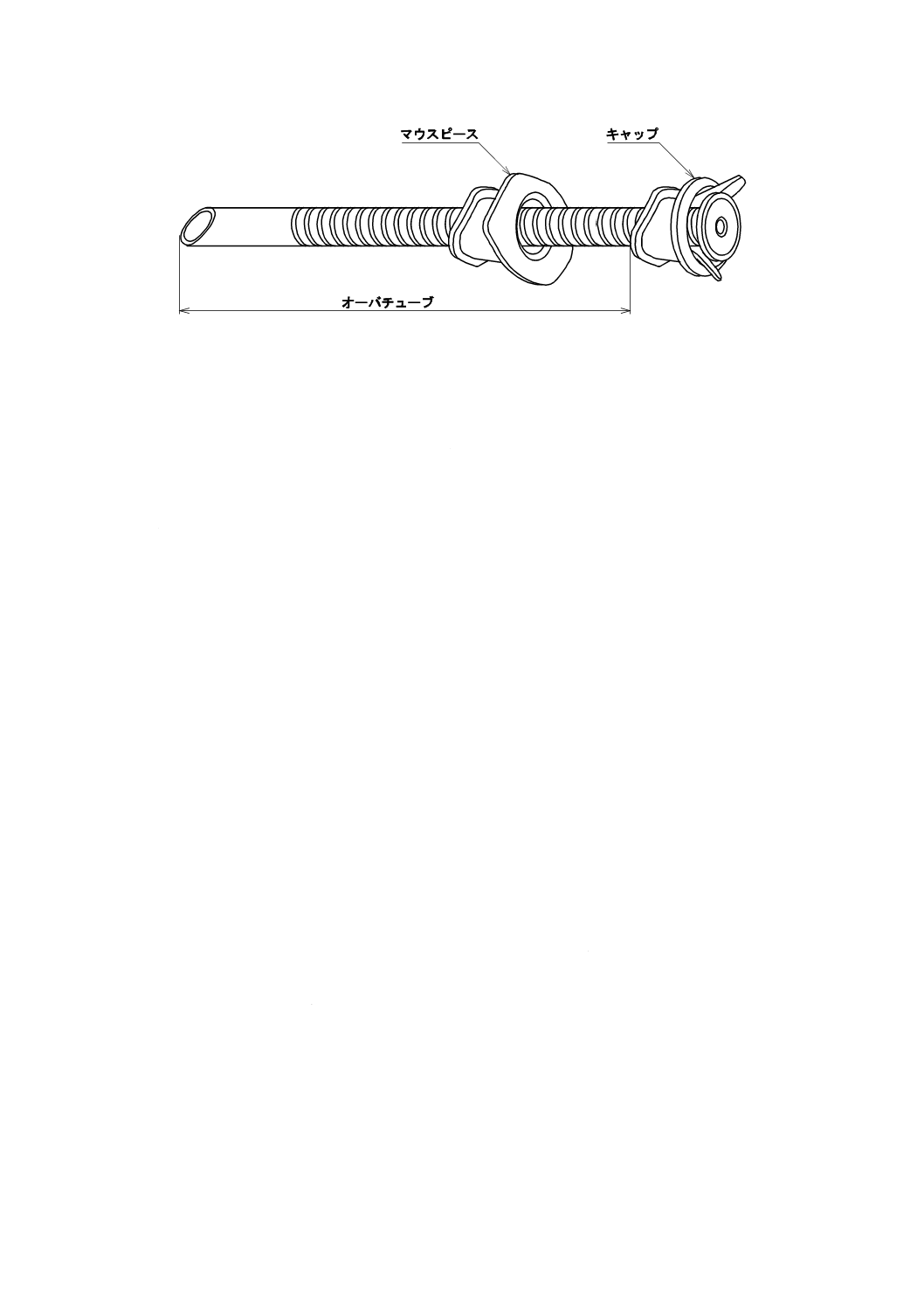
構成及び各部の名称
一般的なオーバチューブの構成及び各部の名称は,図1による。ただし,図1は,オーバチューブの構
成及び各部の名称の例である。
2
T 3241:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記1 マウスピースはないものもある。
注記2 バルーンが付いているものもある。
注記3 孔付きのものもある。
注記4 多くう(腔)式のものもある。
注記5 空気の逆流防止機構(弁又はバルーン)がキャップに付加されているものもある。
図1−オーバチューブの構成及び各部の名称例
5
要求事項
5.1
外径
オーバチューブの外径は,7.1 d)の表示値の±10 %以内とする。
5.2
引張強さ
オーバチューブの先端部から手元部にかけての2か所を把持して,9.8 Nの引張力を加えたとき,破断し
てはならない。
5.3
外観及び清浄度
目視で検査したとき,きず,ばり又は異物の付着があってはならない。
5.4
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
5.5
無菌性の保証
“滅菌済み”の旨を表示するものは,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無
菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
6
包装
6.1
一次包装
一次包装は,微生物の侵入を防止することができ,通常の取扱い,輸送及び保管中に,内容製品を適切
に保護できるものでなければならない。一次包装は,一度開封したら,簡単に再シールできず,開封され
たことが明確に分からなければならない。
6.2
二次包装
二次包装は,通常の取扱い,輸送及び保管中に,内容製品を保護できる強度をもつものとする。
7
表示
7.1
一次包装
一次包装には,次の事項を表示する。

3
T 3241:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
なお,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名
d) オーバチューブの外径(mm)及び長さ(mm又はcm)。ただし,外径をミリメートル(mm)で示す
ほか,フレンチ(シャリエール)又はゲージを参考で併記してもよい。
注記 フレンチ(シャリエール)は,F(Ch)などで表記する。1 mmが3 F(Ch)に相当し,1/3 mm
刻みで表記する。ゲージは,Gなどで表記する。
e) 滅菌済みである場合は,“滅菌済み”の旨
f)
“再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
g) 製造番号又は製造記号
h) 滅菌年月
7.2
二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いず,一次包装を最小販売単位の包装とし
て用いる場合は,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名
d) オーバチューブの外径(mm)及び長さ(mm又はcm)。ただし,外径をミリメートル(mm)で示す
ほか,フレンチ(シャリエール)又はゲージを参考で併記してもよい。
注記 フレンチ(シャリエール)は,F(Ch)などで表記する。1 mmが3 F(Ch)に相当し,1/3 mm
刻みで表記する。ゲージは,Gなどで表記する。
e) 数量(入り数)
f)
滅菌済みである場合は,“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) 製造番号又は製造記号
i)
滅菌年月
7.3
記号の使用
7.1及び7.2は,JIS T 0307に規定する適切な記号を使用することによって,これに替えてもよい。
注記 JIS T 0307に規定する主な記号の例を,表1に示す。
表1−JIS T 0307に規定する主な記号の例

