5
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
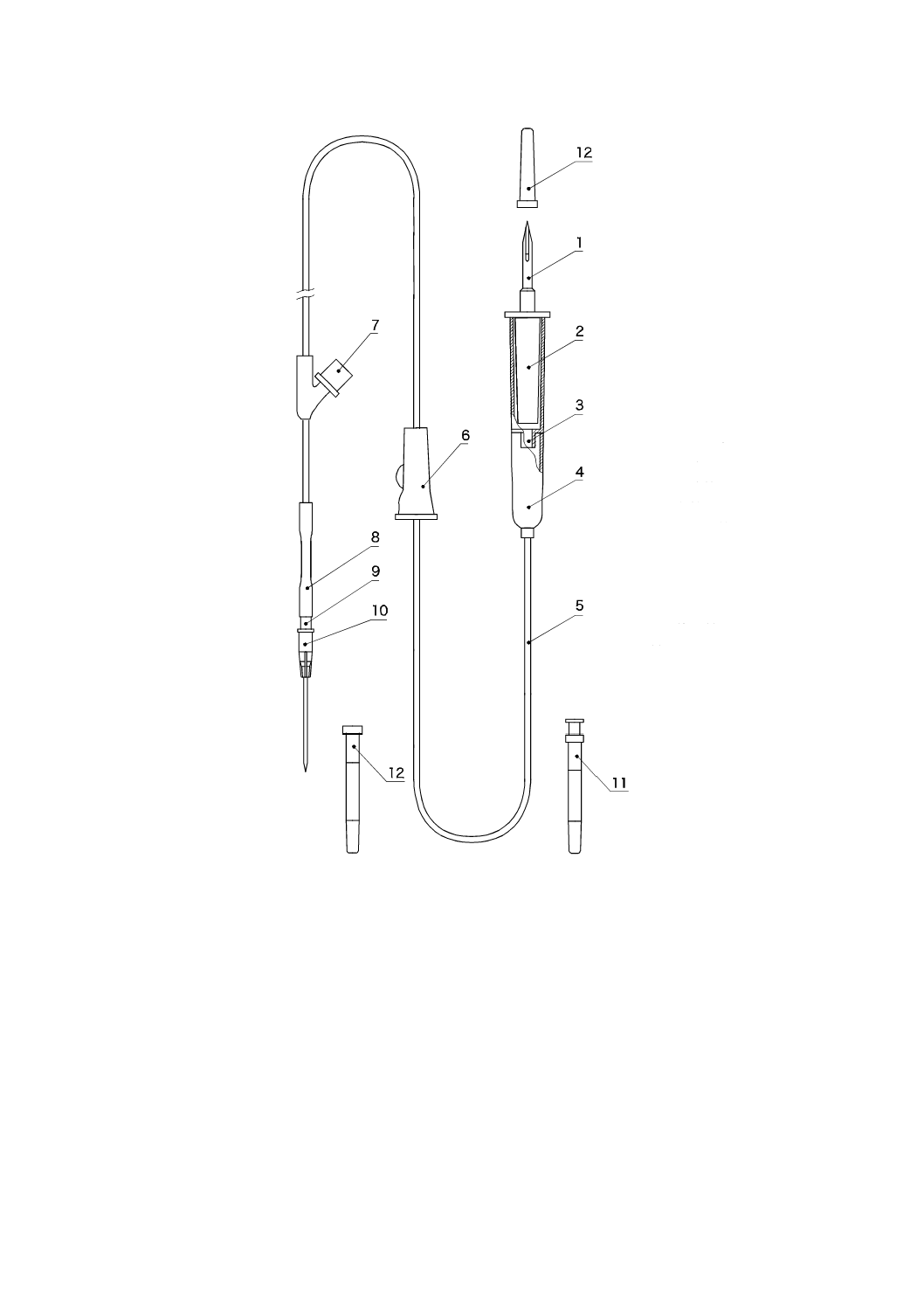
図1−一般的な輸血セットの構成(例)
1
びん針
2
フィルタ
3
点滴口
4
点滴筒
5
導管
6
流量調節器
7
混注部
8
継ぎ管
9
おす(雄)か
ん(嵌)合部
10 静脈針
11 通気装置
12 保護キャップ
T 3212:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 2
4 構成······························································································································· 4
5 物理的要求事項 ················································································································ 8
5.1 清浄度 ························································································································· 8
5.2 気密性 ························································································································· 8
5.3 おすめす(雄雌)かん(嵌)合部,混注部,継ぎ管及び導管の接合部 ······································ 8
5.4 びん針 ························································································································· 8
5.5 通気装置及び通気フィルタ······························································································· 8
5.6 導管 ···························································································································· 8
5.7 フィルタ ······················································································································ 8
5.8 点滴筒及び点滴口 ·········································································································· 8
5.9 流量調節器 ··················································································································· 8
5.10 混注部 ························································································································ 9
5.11 おすめす(雄雌)かん(嵌)合部 ···················································································· 9
5.12 保護キャップ ··············································································································· 9
5.13 静脈針 ························································································································ 9
5.14 定量筒 ························································································································ 9
5.15 活栓 ·························································································································· 10
5.16 逆止弁 ······················································································································· 10
5.17 翼付針 ······················································································································· 10
5.18 潤滑剤 ······················································································································· 10
6 化学的要求事項 ··············································································································· 10
6.1 溶出物 ························································································································ 10
7 生物学的安全性 ··············································································································· 11
8 無菌性の保証 ·················································································································· 11
9 エンドトキシン ··············································································································· 11
10 包装 ···························································································································· 12
10.1 一次包装 ···················································································································· 12
10.2 二次包装 ···················································································································· 12
11 表示 ···························································································································· 12
11.1 一次包装 ···················································································································· 12
11.2 二次包装 ···················································································································· 12
T 3212:2011 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
11.3 記号の使用 ················································································································· 12
附属書A(規定)物理試験 ···································································································· 14
附属書B(規定)溶出物試験第二法························································································· 15
附属書C(参考)参考文献 ···································································································· 16
附属書JA(参考)JISと対応する国際規格との対比表 ································································ 17
T 3212:2011
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべきとの申
出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによってJIS T 3212:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
T 3212:2011
(4)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
白 紙
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3212:2011
滅菌済み輸血セット
Sterile blood transfusion set
序文
この規格は,2004年に第3版として発行されたISO 1135-4を基に作成した日本工業規格であるが,我が
国の実情を反映するため技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,保存血液など血液製剤を輸血するための滅菌済み輸血セット(以下,輸血セットという。)
で,そのまま直ちに使用でき,かつ,1回限りの使用で使い捨てる輸血セットについて規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 1135-4:2004,Transfusion equipment for medical use−Part 4: Transfusion sets for single use
(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
なお,平成26年7月28日までJIS T 3212:2005は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0307 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
注記 対応国際規格:ISO 15223,Medical devices−Symbols to be used with medical device labels,
labelling and information to be supplied及びAmendment 1 (IDT)
JIS T 0993-1 医療機器の生物学的評価−第1部:評価及び試験
注記 対応国際規格:ISO 10993-1:2003,Biological evaluation of medical devices−Part 1: Evaluation
and testing (IDT)
JIS T 3209:2011 滅菌済み注射針
注記 対応国際規格:ISO 7864:1993,Sterile hypodermic needles for single use (MOD)
JIS T 3222:2011 滅菌済み翼付針
JIS T 3320:2011 滅菌済み活栓
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
2
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
equipment−Part 1: General requirements
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
ISO 3696:1987,Water for analytical laboratory use−Specification and test methods
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
公称滴数
輸血セットの被包又は容器に表示された1 mLに相当する滴数。
3.2
再シール性
混注部に針を刺通し,その後,針を抜いたとき,液が漏れない性質。針不使用式混注部は,製造販売業
者が定めるおす(雄)側器具を抜き去った後のバルブシール性。
3.3
精製水
日本薬局方の第二部医薬品に規定する精製水又はこれと同等以上の精製水。
3.4
エンドトキシン試験用水
日本薬局方の第二部医薬品に規定する注射用水又はその他の方法によって製造した水で,エンドトキシ
ン試験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3.5
一次包装
輸血セットを直接に覆う包装。輸血セットの無菌性を保持するためのもので,更に,これが二次包装さ
れる場合には,いわゆる内袋に該当する。ただし,無菌性を保持しないものもあり,その場合には,保護
キャップで輸血セット内部の無菌性を保持する。
3.6
二次包装
一次包装を直接に覆う包装。通常,複数の一次包装された輸血セット。例えば,50セットを入れた包装。
3.7
びん針
血液製剤容器に刺通する針。
3.8
フィルタ
血液製剤をろ過するフィルタ。
3.9
点滴筒
点滴を観察する筒。
3.10
点滴口
3
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
点滴筒内に液滴が滴下する部分。
3.11
定量筒
輸血製剤を一定量計量・貯蔵できる無色透明の硬い又は硬めのプラスチック製の筒。
3.12
導管
血液製剤を体内に導く管。
3.13
おすめす(雄雌)かん(嵌)合部
おす(雄)又はめす(雌)のかん(嵌)合部が,テーパ又は他の構造によって,器具と器具との接続及
び離脱が可能な部分。
3.14
保護キャップ
びん針,おす(雄)かん(嵌)合部が直接外部に触れることを防ぐためのキャップ。
3.15
通気装置
硬質容器の血液製剤の場合,空気を血液製剤容器内に導入する針。
3.16
流量調節器
輸血速度を調節する部材。
3.17
開閉器
導管内を開放又は閉そく(塞)状態にする部材。
3.18
混注部
輸血時の薬剤混注部位。
3.19
継ぎ管
導管,おすめす(雄雌)かん(嵌)合部などの部材をつなぐ部材。
3.20
三方活栓
流路切替えが可能な薬剤混注部位。輸血セットにかん(嵌)合又はその他の方法で接続されているもの。
3.21
多連活栓
流路切替えが可能な薬剤混注部位を複数もつもの。輸血セットにかん(嵌)合又はその他の方法で接続
されているもの。
3.22
逆止弁
血液製剤の逆流を防止する弁体。
4
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.23
静脈針
血管にせん(穿)刺し血液製剤を投与する針。
3.24
翼付針
血管にせん(穿)刺し血液製剤を投与する翼付きの針。輸血セットにかん(嵌)合又はその他の方法で
接続されているもの。
3.25
延長チューブ
導管を長くする目的で使う管状部材。輸血セットにかん(嵌)合又はその他の方法で接続されているも
の。
4
構成
輸血セットは,主としてびん針,点滴筒(びん針と一体のもの,定量筒付きのものもある。),導管,流
量調節器,おす(雄)かん(嵌)合部及び保護キャップで構成する。また,これらに通気装置(びん針と
一体のものもある。),フィルタ,混注部(針を用いずに混注できる針不使用式のものもある。),三方活栓,
多連活栓,逆止弁,静脈針(翼付針を含む。),延長チューブなどを附属してもよい。
なお,輸血セットは,自然落下によって輸血を行うものと,ポンプによって輸血を行うものとがある。
一般的な輸血セットの例を図1に,一般的な輸血セットの構成品の例を図2に,及び一般的な定量筒の
例を図3に示す。

5
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図1−一般的な輸血セットの構成(例)
1
びん針
2
フィルタ
3
点滴口
4
点滴筒
5
導管
6
流量調節器
7
混注部
8
継ぎ管
9
おす(雄)か
ん(嵌)合部
10 静脈針
11 通気装置
12 保護キャップ
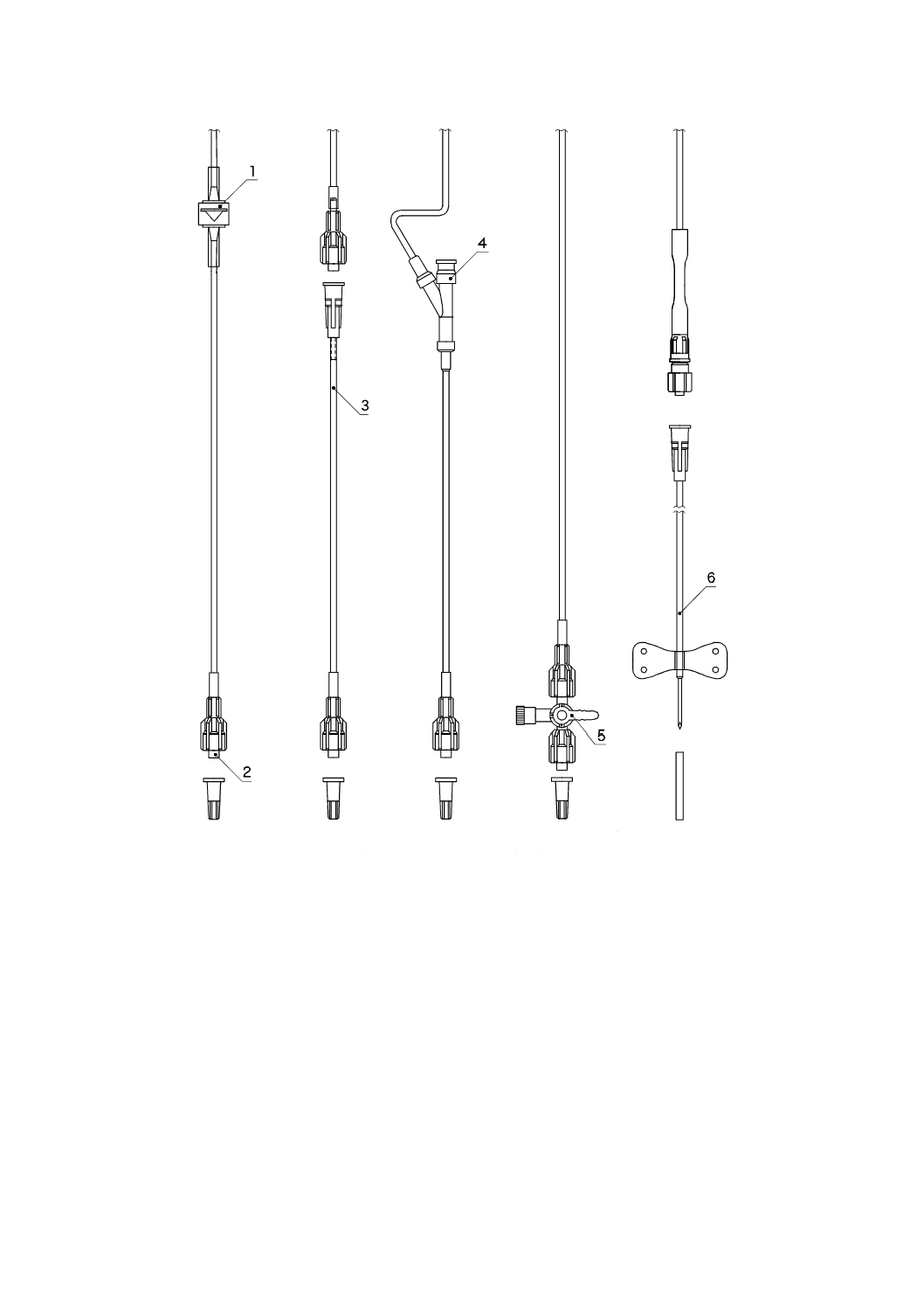
6
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
逆止弁
2
おす(雄)かん(嵌)合部
3
延長チューブ
4
混注部(針不使用式)
5
三方活栓
6
翼付針
図2−構成品(例)
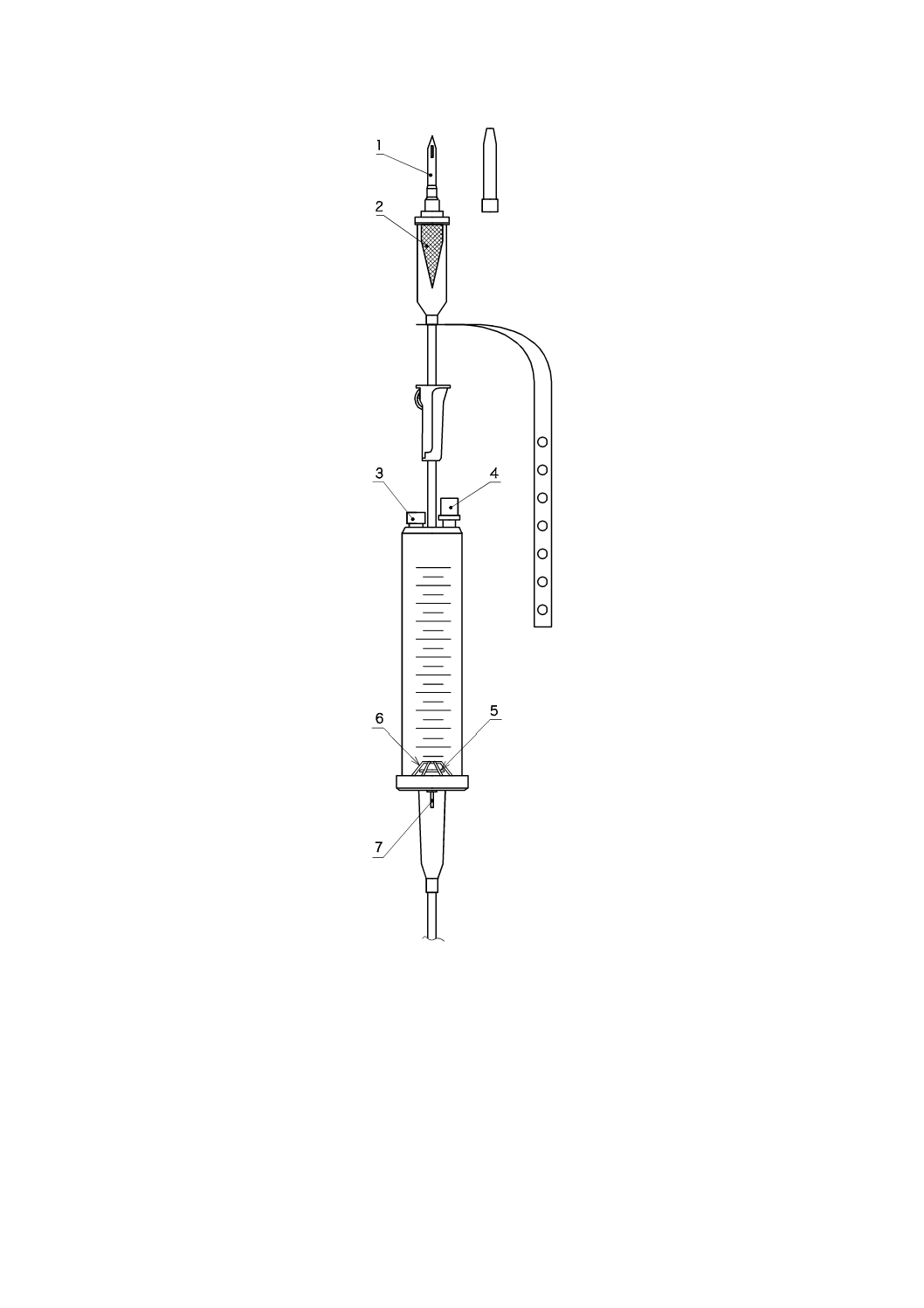
7
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図3−一般的な定量筒(例)
1
びん針
2
フィルタ
3
通気フィルタ
4
混注口
5
閉そく(塞)弁
6
閉そく(塞)弁押さえ
7
点滴口
8
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5
物理的要求事項
5.1
清浄度
目視で検査したとき,内面に微粒子又は異物の付着があってはならない。
5.2
気密性
輸血セットの先端を閉じた後,20〜30 ℃の水中に入れ,びん針の先端から内圧50 kPaで15秒間空気を
送り込んだとき,空気漏れがあってはならない。また,ポンプ用輸血セットは,微生物の侵入を防止する
気密性をもち,A.1.1及びA.1.3によって試験したとき,空気及び水漏れがなく,かつ,A.1.2によって試
験したとき,空気が入ってはならない。
5.3
おすめす(雄雌)かん(嵌)合部,混注部,継ぎ管及び導管の接合部
各接続部は,15 N以上の力で15秒間以上引っ張ったとき,緩んではならない。また,ポンプ用輸血セ
ットは,A.2によって試験したとき,接続部から水漏れがあってはならない。ただし,静脈針など脱着使
用する部品とのかん(嵌)合部は除く。
5.4
びん針
a) びん針の金属製針管の外面には,凹凸及びきずがなく,仕上げ面が滑らかで,かつ,金属製以外の針
管の外面は,きずがなく,仕上げ面が滑らかでなければならない。
b) びん針は,予備せん(穿)通なしで血液製剤容器の栓をせん(穿)通できなければならない。
5.5
通気装置及び通気フィルタ
通気装置をもつものの通気装置は,次の規定に適合しなければならない。
a) 通気装置は,微生物の通過を防止する通気フィルタをもたなければならない。
b) 通気装置がびん針と一体になっているものは,通気装置が血液製剤容器に差し込まれたとき,入って
いく空気は,流出する液に入り込まない。
c) 通気フィルタは,血液製剤容器中に入る全ての空気が通り,かつ,輸血の流量を妨げるものであって
はならない。
d) 通気装置は,予備せん(穿)通なしで血液製剤容器の栓をせん(穿)通できる。
5.6
導管
導管は,透明又は気泡が検出できる程度に透明でなければならない。
5.7
フィルタ
フィルタをもつものは,その網の目の大きさは210 μmより細かく,網の目は均一でなければならない。
5.8
点滴筒及び点滴口
点滴筒をもつものの点滴筒は,次の規定に適合しなければならない。
a) 点滴筒は,血液製剤をた(溜)めることができ,血液製剤の滴下が観察できるものでなければならな
い。
b) 点滴口は,23±2 ℃の蒸留水を50±10滴/分の流速で流すとき,公称滴数が20滴の仕様のものは滴
下した20滴の液量が1±0.1 mL (1±0.1 g),公称滴数が60滴の仕様のものは滴下した60滴の液量が1
±0.1 mL (1±0.1 g)でなければならない。
5.9
流量調節器
流量調節器をもつものの流量調節器は,次の規定に適合しなければならない。
a) 流量調節器は,ゼロから最大までの調節ができなければならない。
b) 流量調節器は,血液製剤の投与中連続して使用でき,かつ,導管を損傷してはならない。流量調節器
と導管とが接触して保管されている間に,有害な反応が発生してはならない。
9
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.10 混注部
混注部をもつものの混注部は,次の規定に適合しなければならない。
a) 金属針を用いて混注し,再シール性をもつものの混注部は,外径0.8 mmの針で15秒間刺通後,針を
抜いて水圧50 kPaを1分間加えたとき,内容液の漏れがあってはならない。また,ポンプ用輸血セッ
トは,同様の試験を水圧150 kPaで行うとき,1滴を超える漏れがあってはならない。
b) 針不使用式の混注部は,規定のおす(雄)側器具を用いて10分間接続後,離脱する操作を10回行っ
た後,水圧50 kPaを15秒間加えたとき,漏れがあってはならない。また,ポンプ用輸血セットは,
同様の試験を水圧150 kPaで行うとき1滴を超える漏れがあってはならない。
5.11 おすめす(雄雌)かん(嵌)合部
おすめす(雄雌)かん(嵌)合部は,ISO 594-1又はISO 594-2に適合しなければならない。ただし,脱
着可能な翼付針のめす(雌)かん(嵌)合部は,ISO 594-1若しくはISO 594-2に適合するか又は,JIS T 3222
の11.3 b)に適合しなければならない。
5.12 保護キャップ
保護キャップは,確実に装着でき,かつ,容易に外せるものでなければならない。
5.13 静脈針
静脈針をもつものの静脈針は,JIS T 3209の4.1,箇条8,箇条9,11.2,11.3,11.4,箇条12,13.1,13.3
及び13.4に適合しなければならない。
5.14 定量筒
定量筒をもつものの定量筒は,次の規定に適合しなければならない。
a) 定量筒は,最上目盛より上に,通気用のフィルタをもつものでなければならない。
b) 定量筒は,血液製剤容器から血液製剤を受け入れ,閉鎖することが可能であり,かつ,通気構造をも
つ貯蔵容器としても機能しなければならない。
c) 目盛は,次による。
1) 定量筒の目盛は,表1に示す間隔とする。
表1−定量筒の目盛
定量筒の公称容量
mL
最大目盛間隔
mL
最大数値目盛間隔
mL
公称容量の1/2を超える目盛容量
における許容誤差 %
≦50
>50
1
5
5
10
±4
2) 目盛線は,均一な太さで,明瞭で,読み取りやすく,かつ,耐久性があり,均等に配置され,定量
筒の軸方向に対して直角方向に水平に引かれていなければならない。
3) 目盛線の長さは,図4に示す長さとする。
4) 数字を付ける目盛線を,図4に示す。数字は,読みやすく,耐久性があり,数字と関連する目盛線
の近傍で,かつ,目盛線に触れない位置とする。
5) 0位置を表す目盛線は,閉そく(塞)弁,定量筒の底部の血液製剤出口の位置及び,その他定量筒
底部キャップの形などの目盛の読取りに影響を及ぼす可能性のある容量を補償できる位置とする。
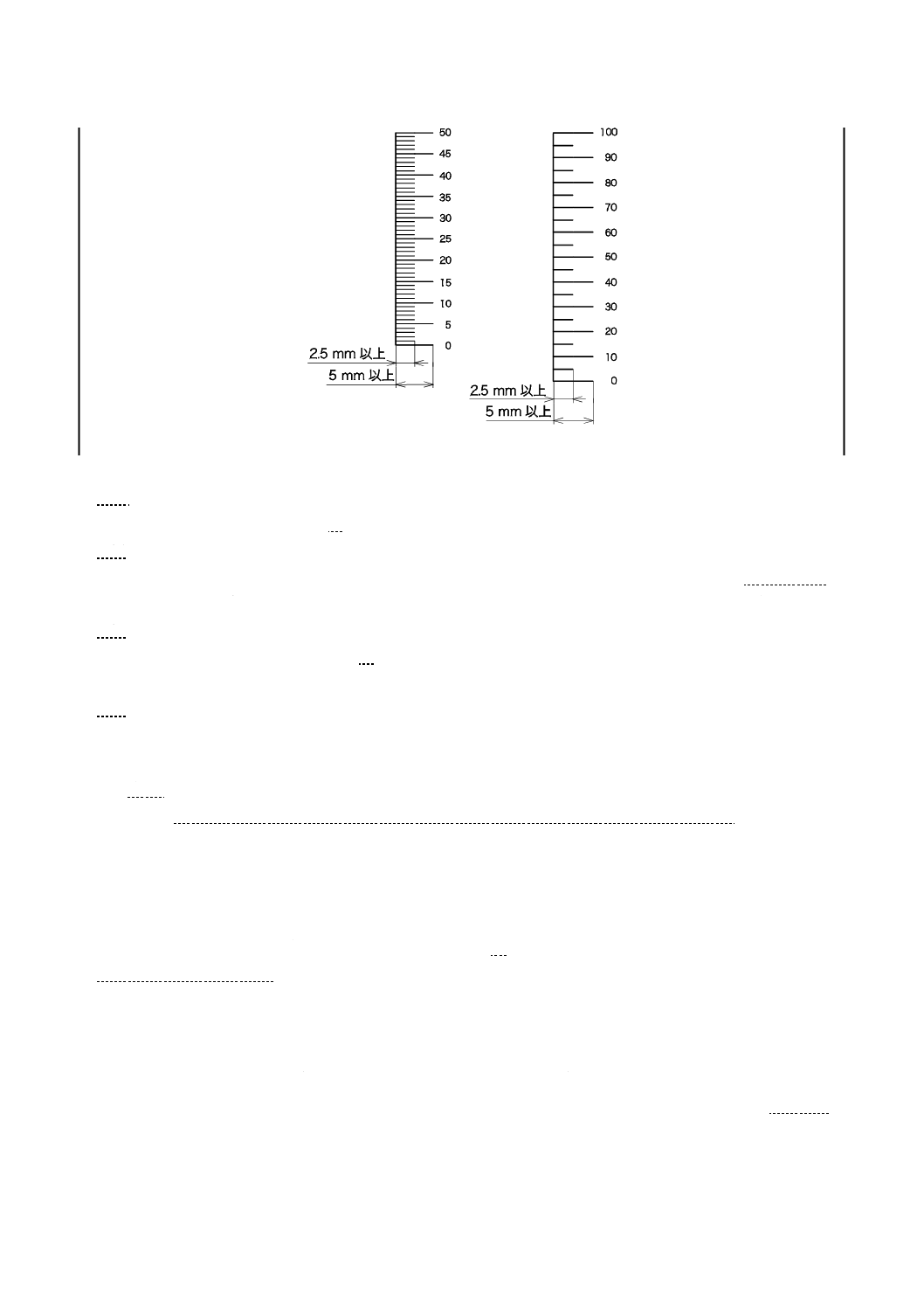
10
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図4−目盛線の長さ
5.15 活栓
活栓をもつものの活栓は,JIS T 3320の5.2,5.3及び5.4に適合しなければならない。
5.16 逆止弁
逆止弁をもつものは,輸血セットを水で満たし,逆止弁が閉そく(塞)動作する側から,50 kPaの圧力
を加え,15秒間観察したとき,逆止弁を通して逆流してはならない。ただし,最初の1秒間は無視する。
5.17 翼付針
翼付針をもつものの翼付針は,JIS T 3222の5.2,5.3,6.1,6.4,6.5,11.1及び11.2に適合しなければな
らない。
5.18 潤滑剤
潤滑剤としてシリコーン油を用いる場合,シリコーン油は,シリコーン油基準の(Ⅰ)又は(Ⅱ)に適
合するか,これと同等以上の基準に適合するものとする。
注記 シリコーン油基準は,平成7年12月20日薬機第327号厚生省薬務局医療機器開発課長通知“注
射針及び注射筒等に潤滑剤として用いるシリコーン油の基準について”による。
6
化学的要求事項
6.1
溶出物
溶出物は,次に示す二方法のいずれかによって試験を行ったとき,それぞれの規定に適合しなければな
らない(ただし,静脈針は除く。)。また,静脈針は,JIS T 3209の箇条5に適合しなければならない。
6.1.1
溶出物試験第一法
溶出物試験第一法は,プラスチック製の材料10 gをとり,また,ゴム製の材料1.0 gをとり,細片とし,
精製水約100 mLで30分間煮沸した後,精製水を加えて正確に100 mLとする。この液を試験液として,
次の試験を行い,これに適合しなければならない。
なお,空試験液は,別に精製水を用いて同様の方法で操作して調製する。
a) pH 試験液及び空試験液20 mLずつをとり,これらに塩化カリウム1.0 gを精製水に溶かして1 000 mL
とした液を1.0 mLずつを加え,日本薬局方(以下,日局という。)一般試験法のpH測定法によって
試験を行ったとき,両液のpHの差は,2.0以下でなければならない。
11
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 重金属 試験液10 mLをとり,比較液に鉛標準液2.0 mLを加え,日局の重金属試験法の第一法によ
って試験を行ったとき,重金属は2.0 ppm以下でなければならない。
c) 過マンガン酸カリウム還元性物質 試験液10 mLを共栓三角フラスコにとり,0.002 mol/L過マンガン
酸カリウム液20.0 mL及び日局一般試験法の試薬・試液で規定する希硫酸1 mLを加え,3分間煮沸し,
冷却後,これによう化カリウム0.10 gを加えて密栓し,振り混ぜて10分間放置した後,0.01 mol/Lチ
オ硫酸ナトリウム液で滴定する(指示薬:日局一般試験法の試薬・試液で規定するでんぷん試液5滴)。
別に空試験液10 mLを用い,同様に操作する。試験液及び空試験液の0.002 mol/L過マンガン酸カリ
ウム液の消費量の差は,2.0 mL以下でなければならない。
d) 蒸発残留物 試験液10 mLを水浴上で蒸発乾固し,残留物を105 ℃で1時間乾燥させた後,その質量
は1.0 mg以下でなければならない。
6.1.2
溶出物試験第ニ法
溶出物試験第二法は,次による。
a) 酸性又はアルカリ性 B.2によって試験したとき,標準液が1 mL未満で色が灰色にならなければなら
ない。
b) 金属イオン 抽出液は,バリウム,クロム,銅,鉛及びすずの合計が1 μg/mL以下であり,カドミウ
ムは0.1 μg/mL以下とする(原子吸光光度法又は同等の分析方法で)。B.3によって試験したとき,試
験溶液の色は,標準液[濃度ρ (Pb2+)=1 μg/mL]の色より濃くなってはならない。
c) 還元性物質 B.4によって試験したとき,0.002 mol/L過マンガン酸カリウム溶液の消費量は2.0 mLを
超えてはならない。
d) 蒸発残留物 B.5によって試験したとき,残留物は5 mg以下でなければならない。
e) 紫外線吸収度 B.6によって試験したとき,抽出液S1の吸光度は,0.1以下でなければならない。
7
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
8
無菌性の保証
滅菌バリデーション基準若しくはこれと同等以上の基準に基づき,無菌性の担保を行う。又は単位容器
に入った輸血セットは,バリデートされた方法で滅菌済みであることを確認する(附属書Cを参考)。
注記 滅菌バリデーション基準は,“平成17年3月30日付け薬食監麻第0330001号 薬事法及び採血
及び供血あつせん業取締法の一部を改正する法律の施行に伴う医薬品,医療機器等の製造管理
及び品質管理(GMP/QMS)に係る省令及び告示の制定及び改廃について第4章 第4滅菌バリデ
ーション基準”による。
9
エンドトキシン
輸血セット10セットを試料としてとり,各セットの管内にエンドトキシン試験用水40 mLを1分間約
10 mLの速さで流して,静脈針をもつものはその液で針管をよく洗い,洗液を合わせて試験液として,日
本薬局方のエンドトキシン試験法によって試験を行ったとき,エンドトキシンは,0.5 EU/mL未満でなけ
ればならない。又は輸血セットは,発熱性物質の有無を適切な試験によって評価し,発熱性のないことを
確認しなければならない。
12
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
10 包装
10.1 一次包装
一次包装は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に内容製品を適切に保護できなければならない。ただし,無菌性を保証しないものもあり,
その場合は,保護キャップで輸血セット内部の無菌性を保証する。また,一度開封したら,包装は簡単に
再シールできず,また,開封されたことが明確に分かるものとする。
10.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもたなければならない。
11 表示
11.1 一次包装
一次包装には,次の事項を表示する。
a) 公称滴数
b) “滅菌済み”の旨
c) 再使用禁止の旨(“ディスポーザブル”の表現は使用しない。)
d) ポンプ用輸血セットの試験に適合しないものは,“輸血ポンプ用に使用できない”旨,又は,特定の輸
血ポンプと組合せ使用で安全が保証される場合にはその輸血ポンプの機種名
e) 製造番号又は製造記号
f)
天然ゴムを原材料として用いているものはその旨
g) 一次包装で無菌性を保証しないものはその旨
11.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合には,改めて滅菌年月の表示をする必要はな
い。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 認証又は承認番号
c) 販売名
d) 公称滴数
e) 数量(入り数)
f)
“滅菌済み”の旨
g) 再使用禁止の旨(“ディスポーザブル”の表現は使用しない。)
h) ポンプ用輸血セットの試験に適合しないものは,“輸血ポンプ用に使用できない”旨,又は,特定の輸
血ポンプと組合せ使用で安全が保証される場合にはその輸血ポンプの機種名
i)
製造番号又は製造記号
j)
滅菌年月
k) 使用方法及び使用上の注意
11.3 記号の使用
11.1及び11.2の要件は,JIS T 0307に規定する適切な記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な記号の例を,表2に示す。

13
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表2−JIS T 0307に規定する記号の例(参考)
滅菌済み
再使用禁止
製造番号又は製造記号
使用期限
14
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
物理試験
序文
この附属書は,箇条5で規定する物理的要求事項の物理試験について規定する。
A.1 気密度試験(ポンプ用)
A.1.1 輸血セットを空気供給装置に接続する。その後,他の開口部全てを閉じ,23±1 ℃及び40±1 ℃
で空気を輸血セット内に送り50 kPaの圧力を15秒間加え,空気漏れがないかを調べる。
A.1.2 脱気した蒸留水を輸血セット内に満たしてから,輸血セットを真空装置に接続し,他の開口部全て
を閉じ,23±1 ℃及び40±1 ℃で20 kPaで15秒間減圧し,輸血セット内に空気の侵入があるかを調べる。
A.1.3 ポンプ加圧部より下流の輸血セットの水充塡部分について,23±1 ℃及び40±1 ℃で150 kPaの圧
力を15分間加え,水漏れの有無を調べる。
A.2 おす(雄)かん(嵌)合部に関する気密度試験(ポンプ用)
おす(雄)かん(嵌)合部は,ISO 594-2の5.1に規定するリファレンスコネクタで密封し,そのかん(嵌)
合部を蒸留水で満たし,23±1 ℃及び40±1 ℃で150 kPaの圧力を15分間加え,接続部に水漏れがないか
を調べる。
15
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
溶出物試験第二法
序文
この附属書は,箇条6で規定する化学的要求事項の溶出物試験第二法について規定する。
B.1
抽出液S1及び空試験液S0の調製
B.1.1 抽出液S1
滅菌済み輸血セット3本及び300 mLのほうけい酸ガラスフラスコで,クローズドサーキュレイション
システムを作る。フラスコ中の液を37±1 ℃に維持できるようなサーモスタット装置をフラスコに取り付
ける。できるだけ短い適切なシリコンチューブにペリスタリックポンプを用いるなどの方法で,ISO 3696
グレード1又はグレード2に適合する水250 mLを,流量1 L/hで2時間循環させる。循環液を集めて冷ま
す。
B.1.2 空試験液S0
輸血セットを付けないで同様に循環させ,空試験液S0とする。このS1及びS0を化学試験に用いる。
B.2
酸性又はアルカリ性の滴定試験
滴定フラスコに入れたS1 20 mLに,タシロ指示薬0.1 mLを加える。色が紫色の場合は水酸化ナトリウ
ム溶液(0.01 mol/L)を,緑色の場合は塩酸(0.01 mol/L)を,灰色が現れるまで加える。
B.3
金属イオンの試験
10 mLのS1を用いて日本薬局方によって金属イオンの試験を行う。呈色度を調べる。
B.4
還元性物質の試験
10 mLのS1に0.002 mol/Lの過マンガン酸カリウム溶液10 mL及び1 mol/Lの硫酸溶液1 mLを加え,か
くはんし,室温で15分間反応させる。よう化カリウム0.1 gを加え,0.005 mol/Lのチオ硫酸ナトリウム溶
液で液がうす茶色になるまで滴定した後に,5滴のでんぷん溶液を加え,青色が消えるまで滴定する。空
試験液についても同様に行う。0.002 mol/L過マンガン酸カリウム溶液消費量(mL)を空試験液との差によっ
て計算する。
B.5
蒸発残留物の試験
50 mLのS1を,質量を量った蒸発皿に入れ,沸点近くの温度で蒸発乾固する。105 ℃で質量が一定とな
るまで乾燥させる。50 mLのS0についても同様な操作を行う。S1とS0との蒸発残留物の差をmgで表す。
B.6
吸光度の試験
S1を0.45 μmのメンブランフィルタでろ過する。5時間以内にS0を入れたセルをリファレンスとして,1
cmの石英セルに入れた液を走査紫外分光光度計にかけ,波長250〜320 nmのスペクトルを記録する。吸光
度と波長との関係をグラフ化する。
16
T 3212:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(参考)
参考文献
序文
この附属書は,本体及び附属書(規定)に関連する事柄を補足するもので,規定の一部ではない。
参考文献
[1] ISO 11134:1994,Sterilization of health care products−Requirements for validation and routine control−
Industrial moist heat sterilization
注記 ISO 11134:1994は,2006.08.17に廃止され,ISO 17665-1:2006,Sterilization of health care products
−Moist heat−Part 1: Requirements for the development, validation and routine control of a
sterilization process for medical devicesに置き換えられた。
[2] ISO 11135:1994,Medical devices−Validation and routine control of ethylene oxide sterilization
注記 ISO 11135:1994は,2007.04.27に改定され,ISO 11135-1:2007,Sterilization of health care products
−Ethylene oxide−Part 1: Requirements for development, validation and routine control of a
sterilization process for medical devicesに置き換えられた。
[3] ISO 11137:1995,Sterilization of health care products−Requirements for validation and routine control−
Radiation sterilization
注記 ISO 11137:1995は,2006.04.19に改定され,ISO 11137-1:2006,Sterilization of health care products
−Radiation−Part 1: Requirements for development, validation and routine control of a sterilization
process for medical devices,ISO 11137-2:2006,Sterilization of health care products−Radiation−
Part 2: Establishing the sterilization dose及びISO 11137-3:2006,Sterilization of health care products
−Radiation−Part 3: Guidance on dosimetric aspectsに置き換えられた。
1
7
T
3
2
1
2
:
2
0
11
1
7
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応する国際規格との対比表
JIS T 3212:2011 滅菌済み輸血セット
ISO 1135-4:2004,Transfusion equipment for medical use−Part 4: Transfusion sets for
single use
(Ⅰ)JISの規定
(Ⅱ)
国際
規格
番号
(Ⅲ)国際規格の規定
(Ⅳ)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範
囲
保存血液など血液製剤
を輸血するための滅菌
済み輸血セットについ
て規定。
1
一致
−
−
2 引用規
格
3 用語及
び定義
25項目の用語の定義を
規定。
−
−
−
追加
ISO規格は用語の定義はない。 利用者の利便性のため,実質的な
差異はない。
4 構成
輸血セットの構成品の
名称を規定し,一般的な
形状を図によって例示。
3
一般的要求
3.1 図及び名称
3.2 無菌性の維持
3.3 表記
一致
変更
変更
−
−
−
−
JISは10.1一次包装に規定。実質
的な差異はない。
JISは箇条11で必要な表示事項を
規定。実質的な差異はない。
5 物理的
要求事項
5.1 清浄度:内面に微粒
子又は異物が付着して
いないこと(目視検査)。
5.1
許容する微粒子付着数を定
量的に設定。試験は,A.1に
よる。
変更
ISO規格は試験を実施し清浄度
を確認し,一定量以下の異物付
着を容認しているが,JISは定
性的な確認で,目視できる異物
は認めない。
JISの規定内容で十分実績がある。
また,目視できる異物が容認され
る規格は日本の実情に合わないの
で,日本の実情に合わせた。実質
的な差異はない。

1
8
T
3
2
1
2
:
2
0
11
1
8
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(Ⅰ)JISの規定
(Ⅱ)
国際
規格
番号
(Ⅲ)国際規格の規定
(Ⅳ)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5 物理的
要求事項
(続き)
5.2 気密性:①自然落下
式輸血セット及び②ポ
ンプ用輸血セットにつ
いて規定。
A.1の試験をする。
5.2
JISの自然落下式輸血セット
と同じ。
追加
JISは,ISO規格にはない,ポ
ンプ用輸血セットの気密性に
ついても規定。
日本の現状に合わせ,ポンプ用輸
血セットについても規定。実質的
な差異はない。
5.3 おすめす(雄雌)か
ん(嵌)合部,混注部,
継ぎ管及び導管の接合
部
5.3
一致
−
−
5.4 びん針:外面の状態
及び輸液容器へのせん
(穿)通について規定。
5.4
寸法及び輸液容器へのせん
(穿)通について規定。
変更
寸法の規定を削除。
外面状態の規定を追加。
技術の進歩で,現在市場に流通し
ている輸血セットのびん針の多様
性を考慮すると,寸法を規定する
のは実際的でない。ISO規格の次
回見直し時に修正提案することを
検討する。
5.5 通気装置及び通気
フィルタ:通気装置及び
通気フィルタの要件に
ついて規定。
5.5
流量測定試験を除きJISと同
じ(流量測定試験は, A.4
による)。
変更
JISは,流量確認のための試験
法は規定を削除。他の規定内容
はISO規格と同じ。
輸血セットの流量を使用時に規制
しているのは,人体とのアクセス
部分であり,通気フィルタとして
はJISの規定内容で十分実績があ
る。実質的な差異はない。
5.6 導管:導管の要件に
ついて規定。
5.6
JISとほぼ同じ。
変更
JISは,導管の長さの規定をし
ていない。
現在市場に流通している輸血セッ
トの導管の長さの多様性を考慮す
ると,長さ規定は,実際的でない。
ISO規格の次回見直し時に修正提
案することを検討する。
1
9
T
3
2
1
2
:
2
0
11
1
9
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(Ⅰ)JISの規定
(Ⅱ)
国際
規格
番号
(Ⅲ)国際規格の規定
(Ⅳ)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5 物理的
要求事項
(続き)
5.7 フィルタ:網目につ
いて規定。
5.7
JISとほぼ同じ。
変更
JISは,具体的な網目の寸法で
規定。
ISO規格は,フィルタの網目を具
体的な寸法ではなく,標準フィル
タとの人血のろ過性能の比較で規
定しているが,JISは,ISO規格の
標準フィルタの網目の寸法をその
まま規格値とし,人血を使用する
試験を感染防止の観点から削除。
実質的な差異はない。
5.8 点滴筒及び点滴
口:点滴筒及び点滴口の
要件について規定。
5.8
JISとほぼ同じ。
変更
JISは,点滴筒の寸法の規定を
削除。他の規定内容はISO規格
と同じ。
JISの規定内容で十分実績がある。
現在市場に流通している輸血セッ
トの点滴筒の寸法は一律に規定さ
れていないこと及び,使用上の安
全性に関わることではないので削
除した。実質的な差異はない。
5.9 流量調節器:流量の
要件について規定。
5.9
一致
−
−
−
5.10
輸血の流量:輸血セットの最
低流量を規定。
削除
JISは,ISO規格にある最低流
量についての規定を削除。
JISの規定内容で十分実績がある。
ISO規格の次回見直し時に修正提
案することを検討する。
5.10 混注部:①自然落
下式輸血セット及び②
ポンプ用輸血セットに
ついて規定。
5.11
JISの自然落下式輸血セット
と同じ。
追加
JISは,ISO規格にはない,ポ
ンプ用輸血セットの混注部に
ついても規定。
日本の現状に合わせ,ポンプ用輸
血セットについても規定。実質的
な差異はない。
5.11 おすめす(雄雌)
かん(嵌)合部:
①自然落下式輸血セッ
トISO 594-1又はISO
594-2に適合したもの。
②ポンプ輸血セット
ISO 594-2に適合したも
の。
5.12
一致
−
−
ISO 594-2に適合。
変更
JISは,選択肢としてISO 594-1
を追加。
旧規格と同じ。実質的な差異はな
い。

2
0
T
3
2
1
2
:
2
0
11
2
0
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(Ⅰ)JISの規定
(Ⅱ)
国際
規格
番号
(Ⅲ)国際規格の規定
(Ⅳ)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5 物理的
要求事項
(続き)
5.12 保護キャップ:確
実に装着でき,かつ,容
易に外せるもの。
5.13
JISとほぼ同じ。
変更
JISは,無菌維持についての規
定を削除。
JISは個包装で無菌維持性を規定。
実質的な差異はない。
5.13 静脈針
−
−
追加
JISは,静脈針について規定。
ISO規格にはない。
日本には,針付きが存在する。
5.14 定量筒
−
−
追加
JISは,定量筒について規定。
ISO規格にはない。
日本には,定量筒付きが存在する。
5.15 活栓
−
−
追加
JISは,活栓について規定。ISO
規格にはない。
日本には,活栓付きが存在する。
5.16 逆止弁
−
−
追加
JISは,逆止弁について規定。
ISO規格にはない。
日本には,逆止弁付きが存在する。
5.17翼付針
−
−
追加
JISは,翼付針について規定。
ISO規格にはない。
日本には,翼付針付きが存在する。
5.18潤滑剤
−
−
追加
JISは,潤滑剤について規定。
ISO規格にはない。
日本では,活栓などに潤滑剤が使
用される。
6 化学的
要求事項
試験法[溶出物試験第一
法又は溶出物試験第二
法(ISO規格法)]のい
ずれか及び許容値を規
定。
6
JISとほぼ同じ。
選択
JISは第一法を選択として追
加。
実績のあるJIS独自の方法(溶出
物試験第一法)も選択可能とした。
実質的な差異はない。
7 生物学
的安全性
JIS T 0993-1で評価
7.1
ISO 10993-1による(Annex
C)。
一致
−
JIS T 0993-1はISO 10993-1の翻訳
JIS。

2
1
T
3
2
1
2
:
2
0
11
2
1
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(Ⅰ)JISの規定
(Ⅱ)
国際
規格
番号
(Ⅲ)国際規格の規定
(Ⅳ)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(Ⅴ)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び名称
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
8 無菌性
の保証
我が国の基準の方法で
確認する。又は附属書C
の方法で評価し,滅菌済
みであることを確認す
る。
7.2
参考文献参照
(ISO 11134,11135,11137
ほか)
一致
ただし,JISは国内の基準を,
注記として,“平成17年3月30
日付け薬食監麻第0330001号
[薬事法及び採血及び供血あ
つせん業取締法の一部を改正
する法律の施行に伴う医薬品,
医療機器等の製造管理及び品
質管理(GMP/QMS)に係る省
令及び告示の制定及び改廃に
ついて]第4章 第4滅菌バリ
デーション基準”を追加した。
我が国のバリデーション基準は
ISO 11134,11135及び11137を翻
訳したもの。
9 エンド
トキシン
エンドトキシン試験を
実施し確認する,又は
ISO規格に規定の方法
で評価し,発熱性のない
ことを確認する。
7.3
発熱物質がないことを評価
する。方法は各国局方に従
い,エンドトキシン又は発
熱性物質試験で行う。
変更
ISO規格は,通気装置単独で販
売されることを想定している
ため削除。
我が国の薬事法に従う。
10 包装
包装に必要な事項を規
定。
9
JISとほぼ同じ。
変更
JISはJIS共通表現へ整合した。 実質的な差異はない。
11 表示
必要な表示項目を規定。
8
JISとほぼ同じ。
変更
JISはJIS共通表現へ整合した。 実質的な差異はない。
JIS T 0307の記号の使
用を規定。
8
JISとほぼ同じ。
追加
JISはJIS共通表現へ整合し,
記号の使用を単独の項とした。
実質的な差異はない。
附属書A
(規定)
物理試験
Annex
A
JISとほぼ同じ。
変更
−
JISはAnnex Aの内容を附属書A
とJIS本体に分け規定した。実質
的な差異はない。
附属書B
(規定)
溶出物試験第二法
Annex
B
一致
−
−
−
−
Annex
C
生物試験
削除
−
JISは,本体へ記載。
附属書C
(参考)
参考文献

2
2
T
3
2
1
2
:
2
0
11
2
2
T
3
2
1
2
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JISと国際規格との対応の程度の全体評価:ISO 1135-4:2004:MOD
被引用法規
薬事法
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ··············· 技術的差異がない。
− 削除 ··············· 国際規格の規定項目又は規定内容を削除している。
− 追加 ··············· 国際規格にない規定項目又は規定内容を追加している。
− 変更 ··············· 国際規格の規定内容を変更している。
− 選択 ··············· 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD··············· 国際規格を修正している。