T 3210:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 物理的要求事項 ················································································································ 3
5.1 外観及び清浄度 ············································································································· 3
6 化学的要求事項 ················································································································ 3
6.1 試験液及び空試験液の調製······························································································· 3
6.2 pH ······························································································································ 3
6.3 溶出金属の制限 ············································································································· 3
7 潤滑剤···························································································································· 3
7.1 材料 ···························································································································· 3
7.2 潤滑剤の量 ··················································································································· 4
8 公称容量の許容差 ············································································································· 4
9 目盛······························································································································· 4
9.1 目盛線 ························································································································· 4
9.2 目盛数字 ······················································································································ 4
9.3 目盛の最低長 ················································································································ 5
9.4 ゼロ目盛 ······················································································································ 5
10 外筒 ····························································································································· 5
10.1 寸法 ··························································································································· 5
10.2 フランジ ····················································································································· 5
11 押子 ····························································································································· 6
11.1 設計 ··························································································································· 6
11.2 ファーストライン ········································································································· 6
12 筒先 ····························································································································· 6
12.1 テーパの合致 ··············································································································· 6
12.2 位置 ··························································································································· 6
12.3 内くう(腔) ··············································································································· 6
13 性能 ····························································································································· 6
13.1 デッドスペース ············································································································ 6
13.2 漏れ ··························································································································· 7
13.3 気密性 ························································································································ 7
14 無菌性の保証 ················································································································· 7
T 3210:2011 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
15 エンドトキシン ·············································································································· 7
16 包装 ····························································································································· 7
16.1 一次包装 ····················································································································· 7
16.2 二次包装 ····················································································································· 7
17 表示 ····························································································································· 8
17.1 一次包装 ····················································································································· 8
17.2 二次包装 ····················································································································· 8
17.3 記号の使用 ·················································································································· 8
附属書A(規定)デッドスペースの測定法 ················································································ 9
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 10
T 3210:2011
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべきと
の申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3210:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
T 3210:2011
(4)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
白 紙
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3210:2011
滅菌済み注射筒
Sterile injection syringes
序文
この規格は,1993年に第1版として発行されたISO 7886-1及びTECHNICAL CORRIGENDUM 1 (1995)
を基とし,我が国の実情に合わせるため,一部の技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,滅菌済みのプラスチック製の注射筒(以下,注射筒という。)であって,そのまま直ちに使
用でき,かつ,単回使用する注射筒の要求事項について規定する。
なお,ここでいう注射筒とは,JIS T 3209に適合した注射針をあらかじめはめ合わせた注射筒を含み,
インスリン用注射筒,ガラス製単回使用の注射筒,針が取り外しできない構造の注射針付き注射筒,医薬
品を既に充塡したキット製品の注射筒及びシリンジポンプ用専用注射筒は含まない。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 7886-1:1993,Sterile hypodermic syringes for single use−Part 1: Syringes for manual use及び
Cor.1:1995(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
なお,平成26年7月28日までJIS T 3210:2005は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 3209:2011 滅菌済み注射針
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 594-2:1991,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.1
公称容量(nominal capacity)
注射筒の被包又は容器に表示された注射筒の容量。
3.2
公称容量目盛
公称容量を示す目盛。
3.3
サービス目盛
公称容量目盛を超えて付けられた目盛。
3.4
主目盛線
公称容量に応じた一定の容量ごとに,目盛数字を付す目盛線。
3.5
副目盛線
主目盛線と次の主目盛線との間に引かれた目盛線。
3.6
目盛の最低長
ゼロ目盛から公称容量目盛までの長さ。
3.7
ファーストライン(fiducial line)
外筒の目盛に合わせる押子の,先端の最初のピークのライン。
3.8
使用最大容量(maximum usable capacity)
注射筒として機能する最大容量。
3.9
デッドスペース
押子が完全に挿入されている状態で,外筒及び筒先に残る液体の量。
3.10
精製水
日本薬局方(以下,日局という。)の医薬品各条に規定する“精製水”又はこれと同等以上の水。
3.11
エンドトキシン試験用水
日局の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキシン試
験に用いるライセート(LAL)試薬の検出限界で反応しないもの。
3.12
一次包装
注射筒を直接に覆う包装で,注射筒の無菌性を保持するためのもの。さらに,これが二次包装される場
合には,“内袋”に該当する。
3.13
二次包装
3
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
一次包装を直接に覆う包装。通常,複数の一次包装された注射筒,例えば100本を入れた包装。
4
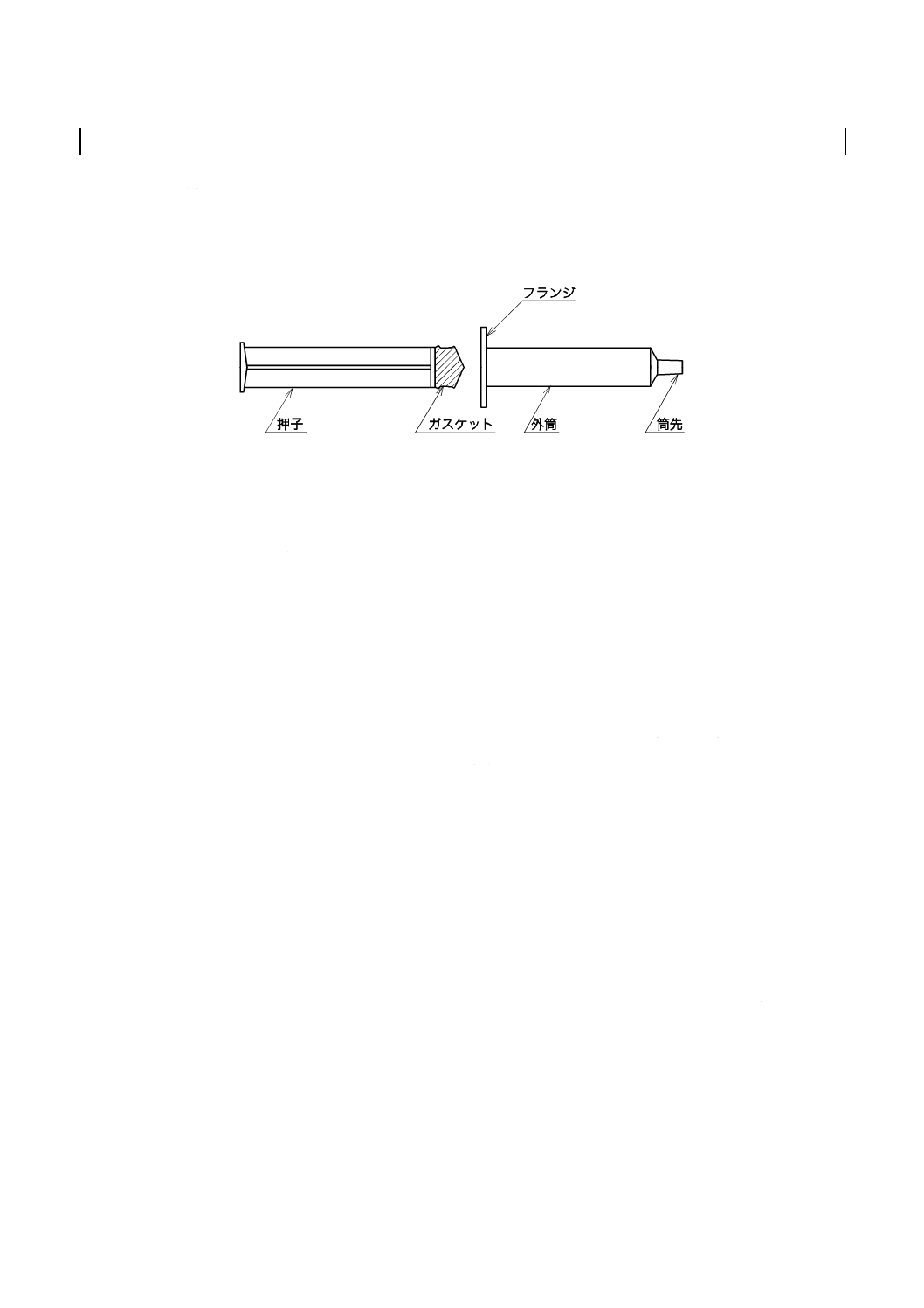
構成及び各部の名称
注射筒は,主として外筒及び押子で構成する(図1参照)。ただし図1は,一般的な注射筒を例示したも
のであり,要求事項ではない。
図1−注射筒の構成及び各部の名称例
5
物理的要求事項
5.1
外観及び清浄度
目視で検査したとき,注射筒の外筒の内面は,凹凸及びきずがなく,仕上げ面が滑らかでなければなら
ない。また,通常の使用で,注射液などと接触する部分には,微粒子又は異物の付着があってはならない。
6
化学的要求事項
6.1
試験液及び空試験液の調製
6.1.1
試験液
6.2及び6.3の試験に必要な試験液の量がとれる数(ただし,最低3本は使用する。)の注射筒に公称容
量目盛の位置まで精製水を満たし気泡を排除する。その注射筒を
3
0
37+ ℃で,8時間〜8時間15分間保っ
た後,ほうけい酸ガラスでできた容器にそれぞれの注射筒の内容液を排出し,合わせて,この液を試験液
とする。
6.1.2
空試験液
精製水を用いる。
6.2
pH
試験液及び空試験液のpHを日局の一般試験法のpH測定法で測定したとき,両液のpHの差は,1以下
でなければならない。
6.3
溶出金属の制限
原子吸光光度法又は同等以上の微量分析法によって,試験液及び空試験液を分析し,試験液の測定値を
空試験液の測定値で補正したとき,試験液中の鉛,亜鉛及び鉄の合計は5 mg/L以下で,かつ,試験液のカ
ドミウム測定値を空試験液のカドミウム測定値で補正したとき,試験液のカドミウム含量は0.1 mg/L以下
でなければならない。
7
潤滑剤
7.1
材料
潤滑剤としてシリコーン油を用いる場合,シリコーン油は,シリコーン油基準又はこれと同等以上の基

4
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
準に適合するものでなければならない。また,シリコーン油のほか,ISO 7886-1の箇条8(潤滑剤)に規
定するエルカ酸及び/又はオレイン酸の脂肪酸アミドを用いることができる。
注記 シリコーン油基準には,厚生労働省が定めたシリコーン油基準がある。
7.2
潤滑剤の量
注射筒2本(ただし,容量20 mL以上の注射筒の場合は1本)をとり,公称容量目盛の位置までn-ヘキ
サンを吸い入れ,各注射筒のそれぞれの筒先に金属製の針基をもつ注射針をはめ合わせ,1分間穏やかに
振った後,筒内のn-ヘキサンを,適切な容量のビーカーに排出して集める。
この操作を2〜3回繰り返し,集めたn-ヘキサンを水浴上で蒸発乾固し,残留物を105 ℃で1時間乾燥
したとき,注射筒1本当たりの残留物の質量は,表1に示すシリコーン油の量以下でなければならない。
この値を超えた場合には,残留物を適量の4-メチル-2-ペンタノン(メチルイソブチルケトン)に溶かし,
原子吸光光度法又はこれと同等の微量分析法によって波長251.6 nmを用いてけい素(Si)を定量し,その
値からシリコーン油の量を算出したとき,表1の値以下でなければならない。また,公称容量100 mL以
上の注射筒の場合は,内表面積(注射液などに接触する部分の面積)1 cm2当たり0.25 mg以下でなければ
ならない。又はISO 7886-1の箇条8(潤滑剤)の規定に適合しなければならない。
表1−シリコーン油の量
公称容量
mL
シリコーン油の量
mg/本
5未満
5以上 20未満
20以上 50未満
50以上 100未満
8
15
30
50
8
公称容量の許容差
注射筒の公称容量目盛まで水を吸い入れた後,ゼロ目盛まで押し出して得た水の量の公称容量に対する
許容差は,公称容量5 mL未満のものは±5 %,及び公称容量5 mL以上のものは±4 %とする。
9
目盛
9.1
目盛線
目盛線は,次に適合しなければならない。
a) 注射筒の外筒には,目盛線及び容量の単位を,明瞭に,かつ,容易に消えないように付けなければな
らない。
b) サービス目盛を付ける場合は,他の目盛と容易に区別できなければならない。また,副目盛線がある
場合には,主目盛線と容易に区別できなければならない。
c) 目盛線の太さ及び長さは,一定でなければならない。副目盛線がある場合には,主目盛線及び副目盛
線のそれぞれの太さ及び長さが一定でなければならない。目盛線は,注射筒の中心軸に対し直角で,
かつ,互いに平行でなければならない。
d) 目盛線の間隔は,ゼロ目盛から公称容量目盛まで均等でなければならない。
e) 副目盛線の長さは,主目盛線の長さの約半分とする。
9.2
目盛数字
目盛数字は,次による。
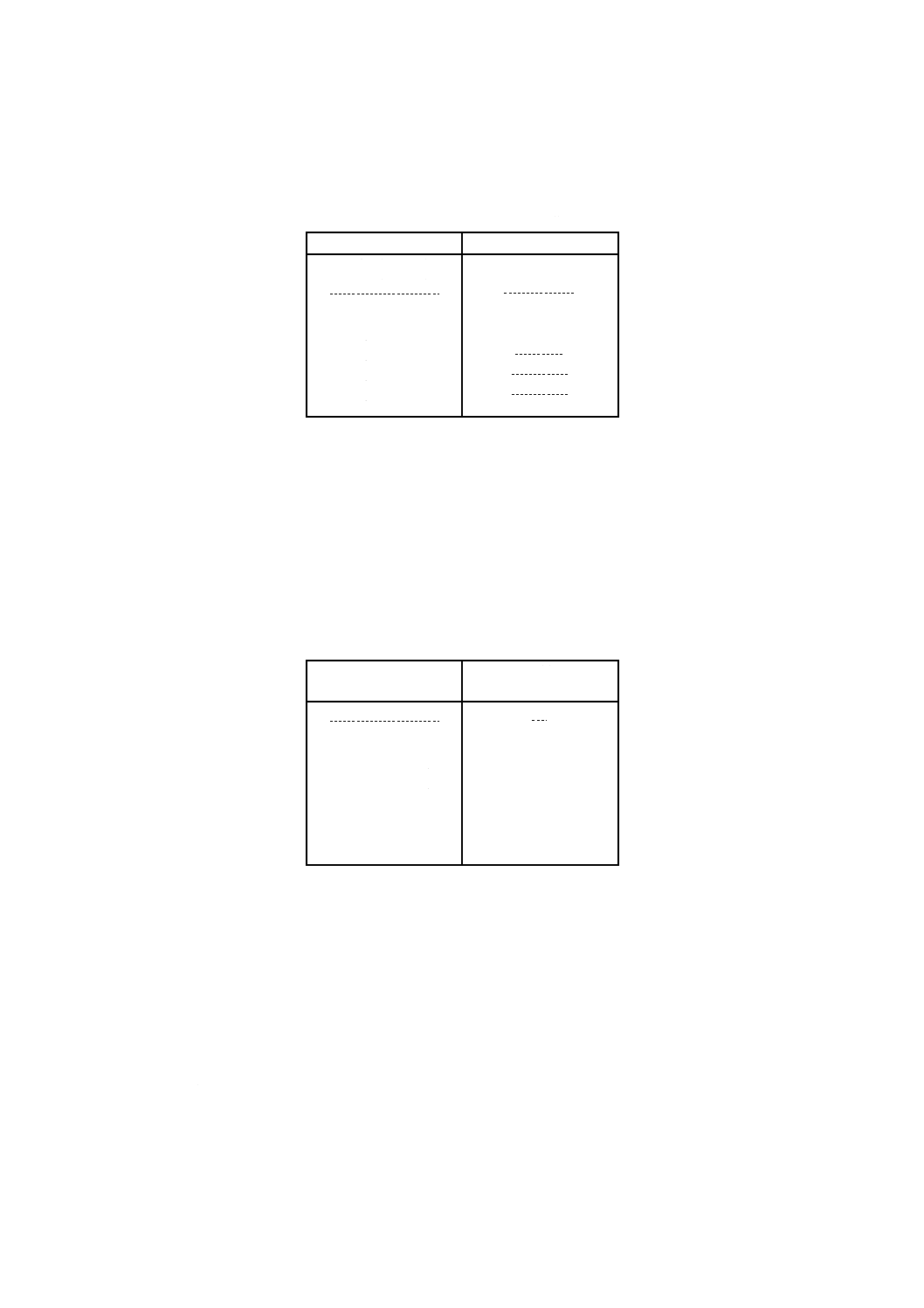
5
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
a) 目盛には,注射筒の公称容量に応じ,表2に示す容量ごとに,目盛数字を付けなければならない。
表2−目盛数字
単位 mL
公称容量
増加容量
2未満(一般用)
2未満(微量用)
2以上
5未満
5以上 10未満
10以上 20未満
20以上 30未満
30以上 50未満
50以上
0.1,0.2,0.3又は0.5
0.1又は0.2
0.5又は1
1
1又は5
5又は10
5又は10
10
2 mL未満(一般用)のものは,0.1,0.2,0.3又は0.5の,目盛数字間隔を組み合わせて付けること
ができる。
b) 目盛数字は,どの目盛線に対するものであるかが明瞭に分かり,紛らわしいものであってはならない。
また,目盛数字は,明瞭に,かつ,容易に消えないように付けなければならない。
9.3
目盛の最低長
目盛の最低長は,公称容量に応じ,表3に示す長さを超えるものでなければならない。
表3−目盛の最低長
公称容量
mL
目盛の最低長
mm
2未満(一般用)
2未満(微量用)
2以上
5未満
5以上 10未満
10以上 20未満
20以上 30未満
30以上 50未満
50以上
25
57
27
36
44
52
67
75
9.4
ゼロ目盛
押子の先端をゼロ目盛まで押し込んだとき,ファーストラインとゼロ目盛とは,ほぼ一致しなければな
らない。
10 外筒
10.1 寸法
外筒の長さは,公称容量より少なくとも10 %多い使用最大容量を確保できる長さでなければならない。
10.2 フランジ
外筒の開放端にはフランジがなければならない。注射筒を水平面に対して10゜の角度を付けた平たんな
面に置いたとき,180゜以上回転してはならない。フランジの表面は,滑らかに仕上げ,ばりがあってはな
らない。また,適切なサイズ,形状及び強度であり,注射筒を使用中安全に保持できるよう把持しやすい
6
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ものでなければならない。
11 押子
11.1 設計
押子は,片手での操作がしやすく,外筒から容易に引き抜けて分離してはならない。
押子の先端をゼロ目盛まで押し込んだとき,フランジと押子の末端との距離の長さは,8 mm以上ある
ことが望ましい。
11.2 ファーストライン
ファーストラインは,明瞭に見え,外筒の内面に接触していなければならない。
12 筒先
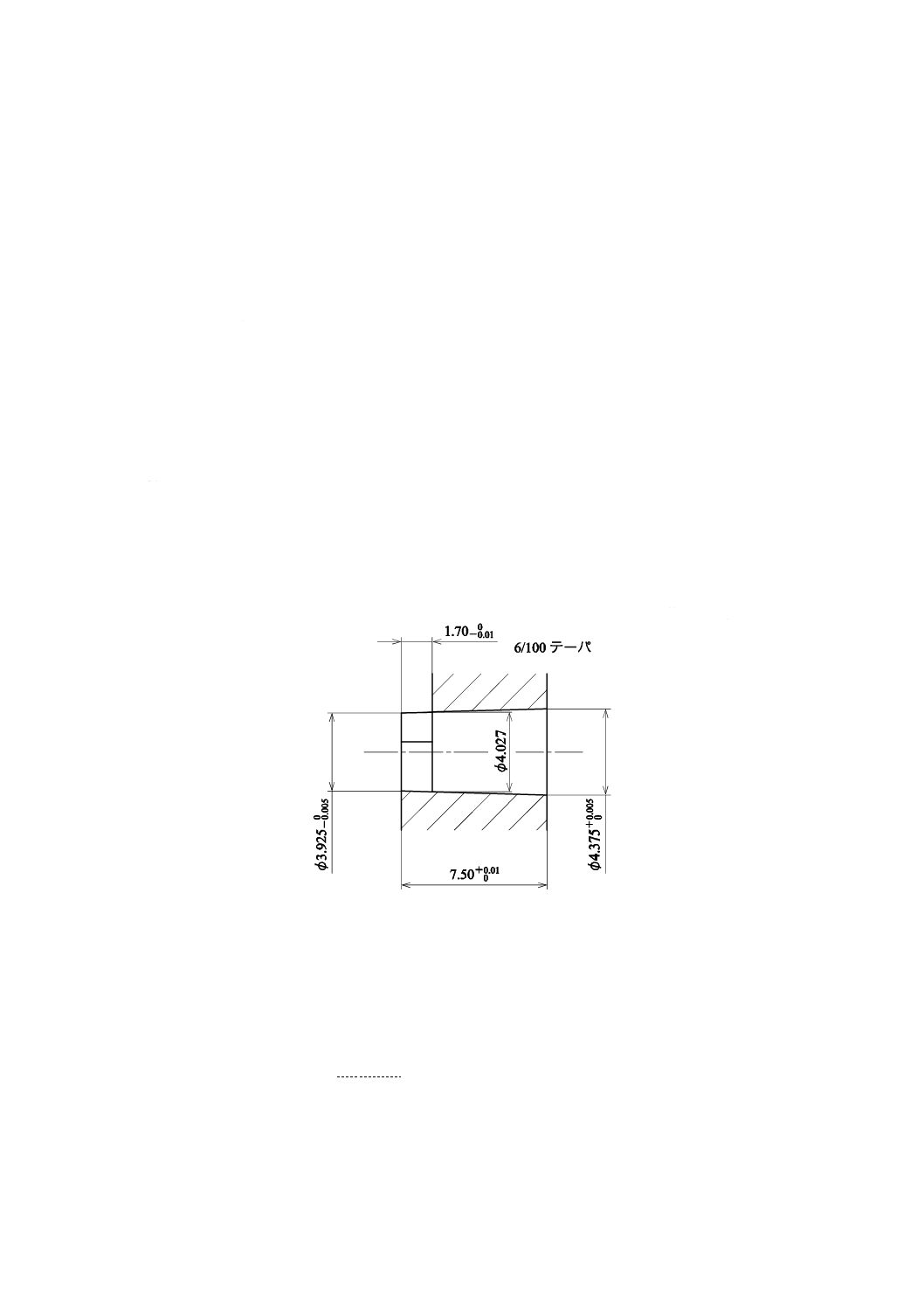
12.1 テーパの合致
筒先が図2に示すISO 594-1で規定するめす・ルアーテーパ検査ゲージ[ISO 594-1のFigure 3−Gauges for
testing 6 % (Luer) conical fittingsのb) Gauge for testing semi-rigid male conical fittings参照]を使用できる構造
のものは,筒先を5 Nの力でゲージに入れたとき,筒先のおす・ルアーテーパとゲージのテーパとが合致
し,かつ,筒先の先端は,ゲージの限度内になければならない。また,筒先が図2に示す検査ゲージを使
用できない構造のものは(ロック接合),ISO 594-2に規定する検査ゲージを用いて行う。
単位 mm
図2−めす・ルアーテーパ検査ゲージ
12.2 位置
筒先は,横口のものを除き,注射筒の中心線に同軸になければならない。横口のものは,注射筒の中心
線と平行又は中心線寄りにやや傾斜していなければならない。
12.3 内くう(腔)
筒先の内くう(腔)は,直径1.0 mm以上とする。
13 性能
13.1 デッドスペース
附属書Aの測定法によって測定したとき,デッドスペースの容量は,公称容量の10 %以下でなければ

7
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ならない。
13.2 漏れ
十分水を拭き取った注射筒に,その公称容量目盛,公称容量目盛の3/4及び公称容量目盛の1/2の位置
まで水を吸い入れ,これを水平に固定して水が筒口から出ないようにした後,筒口に表4に示す圧力を10
秒間加えたとき,はめ合わせ部から水滴が落ちてはならない。ただし,この方法によることができないと
きは,外筒を固定して水が筒口から出ないようにした後,押子に圧力を加えることによって行う。又はISO
7886-1の14.2(ピストンからの空気及び液体の漏れ)に適合しなければならない。
表4−試験圧力
区分
公称容量
mL
圧力
kPa
一般用
3未満
3以上 10未満
10以上 20未満
20以上 30未満
30以上
392
343
294
245
196
微量用
2未満
2以上
490
392
13.3 気密性
注射筒の公称容量目盛の1/4の位置まで水を吸い入れ,筒口を密封した後,押子を公称容量目盛の位置
まで引いたとき,はめ合わせ部から連続した気泡が認められてはならない。又はISO 7886-1の14.2(ピス
トンからの空気及び液体の漏れ)に適合しなければならない。
14 無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
15 エンドトキシン
注射筒10本をとり,公称容量目盛の位置までエンドトキシン試験用水を吸い入れ,各注射筒のそれぞれ
の筒口を密封してよく振り混ぜた後,室温で1時間放置し,この液を試験液とし,日局のエンドトキシン
試験法によって試験したとき,エンドトキシンは0.5 EU/mL未満でなければならない。
16 包装
16.1 一次包装
一次包装は,使用前に容易に破れる可能性がなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に,内容製品を適切に保護できるものでなければならない。一度開封したら包装は簡単に
再シールできず,開封されたことが容易に分かるものでなければならない。
16.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に,内容製品を保護できる強度をもたなければならない。

8
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
17 表示
17.1 一次包装
一次包装には,次の事項を表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合は,改めて滅菌年月の表示をする必要はない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 注射筒の容量(mL)
b) “滅菌済み”の旨
c) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
d) 製造番号又は製造記号
e) 滅菌年月
17.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合は,改めて滅菌年月の表示をする必要はない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名
d) 注射筒の容量(mL)
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) 製造番号又は製造記号
i)
滅菌年月
17.3 記号の使用
17.1及び17.2は,JIS T 0307に規定する適切な記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な記号の例を,表5に示す。
表5−JIS T 0307に規定する主な記号の例
9
T 3210:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
デッドスペースの測定法
A.1 概要
この附属書は,13.1で規定するデッドスペースの測定方法について規定する。
デッドスペースの測定は,注射筒の乾燥重量を測定し,水を満たし,排出する。デッドスペースは残留
した水の質量を容積に換算する。
A.2 装置及び試薬
A.2.1 天びん
A.2.2 水:蒸留水又はイオン交換水
A.3 操作
A.3.1 空の注射筒の重量を測定する。
A.3.2 A.2.2の水を公称容量目盛まで注射筒に満たす。その場合,注意して全ての気泡を除き,水を押し
出して,水面を筒先内くう(腔)の端部になるようにする。
A.3.3 押子を完全に押し込み,水を排出する。注射筒外面の水を拭き,乾燥する。
A.3.4 注射筒の質量を測定する。
A.4 測定結果の換算
水を排出した後の注射筒の質量から空の注射筒の質量を減じて,注射筒に残っている水の質量をグラム
(g)で表す。水の密度を1 000 kg/m3として,質量をmLに換算しデッドスペースとして記録する。
A.5 試験報告
次の事項を記録する。
a) 注射筒の識別及び公称容量
b) デッドスペースをmLで表示
c) 試験年月日
注記 参考情報として次の確認をする。押子の移動試験は,注射筒の外筒を固定し,押子の先端を
ゼロ目盛の位置に合わせ,筒先に表A.1に示す圧力を加えたとき,押子が,外筒内面を滑ら
かに移動することを確認する。
表A.1−押子の移動に要する最大圧力
注射筒の公称容量
mL
押子の移動に要する最大圧力
kPa
2未満
2以上
5未満
5以上 10未満
10以上
245
172
147
98
1
0
T
3
2
1
0
:
2
0
11
1
0
T
3
2
1
0
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3210:2011 滅菌済み注射筒
ISO 7886-1:1993 Sterile hypodermic syringes for single use−Part 1: Syringes for
manual use及びCor.1:1995
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 滅菌済みのプラスチッ
ク製の注射筒について
規定。
1
JISと同じ。
一致
−
−
2 引用規格
3 用語及び
定義
13項目の用語及び定義
を規定。
3
5項目の用語及び定義
を規定。
追加
JISは,必要な用語及び定義を追加。 利用者の利便性のため。実質的な
差異はない。
4 構成及び
各部の名称
注射筒の構成を規定。
4
JISとほぼ同じ。
変更
JISは,必要最低限の要素だけを規
定。
実質的な差異はない。
5 物理的要
求事項
外観及び清浄度を規定。
5
清浄度を規定。
追加
JISは,外観についての規定を追加。 実質的な差異はない。
6 化学的要
求事項
6.1試験液及び空試験液
の調製
A.3
JISと同じ。
一致
−
−
6.2 pH
6
JISと同じ。
一致
−
−
6.3 溶出金属の制限
7
JISと同じ。
一致
−
−
7 潤滑剤
7.1 材料
8
JISと同じ。
一致
−
−
7.2 潤滑剤の量
8
JISとほぼ同じ。
選択
JIS独自の方法又はISO規格の方法
のいずれかを選択できる。
試験法は異なるが,正常な注射筒
はいずれの試験にも適合する。
8 公称容量
の許容差
許容差を規定。
8
JISと同じ。
一致
−
−
9 目盛
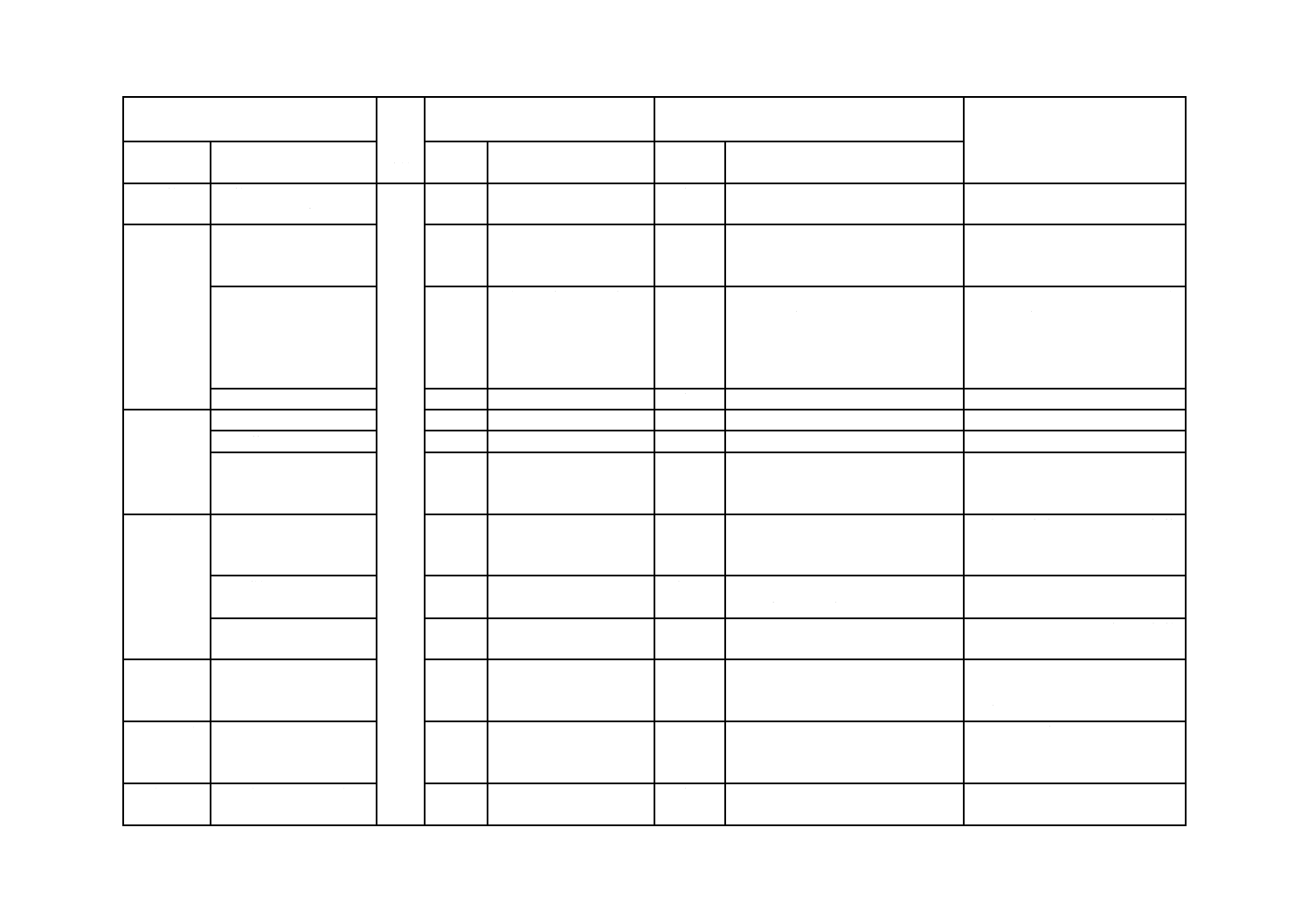
9.1 目盛線
10.1
JISと同じ。
一致
−
−
9.2 目盛数字
10.2
JISとほぼ同じ。
変更
長さの短い注射筒を追加。
ISO規格の修正を提案する予定。
9.3 目盛の最低長
10.3
JISとほぼ同じ。
変更
公称容量2 mL未満(一般用)を追加。ISO規格の修正を提案する予定。
9.4 ゼロ目盛
10.4
JISと同じ。
一致
−
−
11
T
3
2
1
0
:
2
0
11
11
T
3
2
1
0
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
10 外筒
外筒の寸法及びフラン
ジについて規定。
11
JISと同じ。
一致
−
−
11 押子
11.1 設計
12.1
JISとほぼ同じ。
変更
押子の先端をゼロ目盛まで押し込
んだとき,フランジと押子の末端と
の距離の長さの規定値が異なる。
実質的な差異はない。
−
12.2
外筒内の押子の密着
削除
JISは,本体でなく,附属書Aの注
記にある押子の移動試験で確認す
る。
ISO規格に規定の,水を入れた自
重では,押子は動かない。
JISは,移動のための最大圧力を
参考規定している。ISO規格の修
正を提案する予定。
11.2 ファーストライン
12.3
JISと同じ。
一致
−
−
12 筒先
12.1 テーパの合致
13.1
JISと同じ。
一致
−
−
12.2 位置
13.2
JISと同じ。
一致
−
−
12.3 内くう(腔)
13.3
JISとほぼ同じ。
変更
JISは筒先の内くう(腔)の直径を,
ISO規格の寸法1.2 mm以上から,
1.0 mm以上に変更。
ISO規格の寸法では,微少容量の
場合,技術的に難しい。
ISO規格の修正を提案する予定。
13 性能
13.1 デッドスペース
14.1
表1による。
変更
測定方法は同じ。デッドスペースの
容量の規定値が異なる。
小容量と大容量とでISOの規格
値幅が大きすぎるので,中間値
10 %を規格値とした。
13.2 漏れ
14.2
JISとほぼ同じ。試験方
法は附属書Dによる。
選択
JIS独自の方法又はISO規格の方法
のいずれかを選択できる。
試験法は異なるが,正常な注射筒
はいずれの試験にも適合する。
13.3 気密性
14.2
JISとほぼ同じ。試験方
法は附属書Bによる。
選択
JIS独自の方法又はISO規格の方法
のいずれかを選択できる。
試験法は異なるが,正常な注射筒
はいずれの試験にも適合する。
14 無菌性
の保証
−
−
−
追加
我が国で実績のある方法を追加。
滅菌済み注射筒として必要な項
目。ISO規格への追加を提案する
予定。
15 エンド
トキシン
−
−
−
追加
我が国で実績のある方法を追加。
滅菌済み注射筒として必要な項
目。ISO規格への追加を提案する
予定。
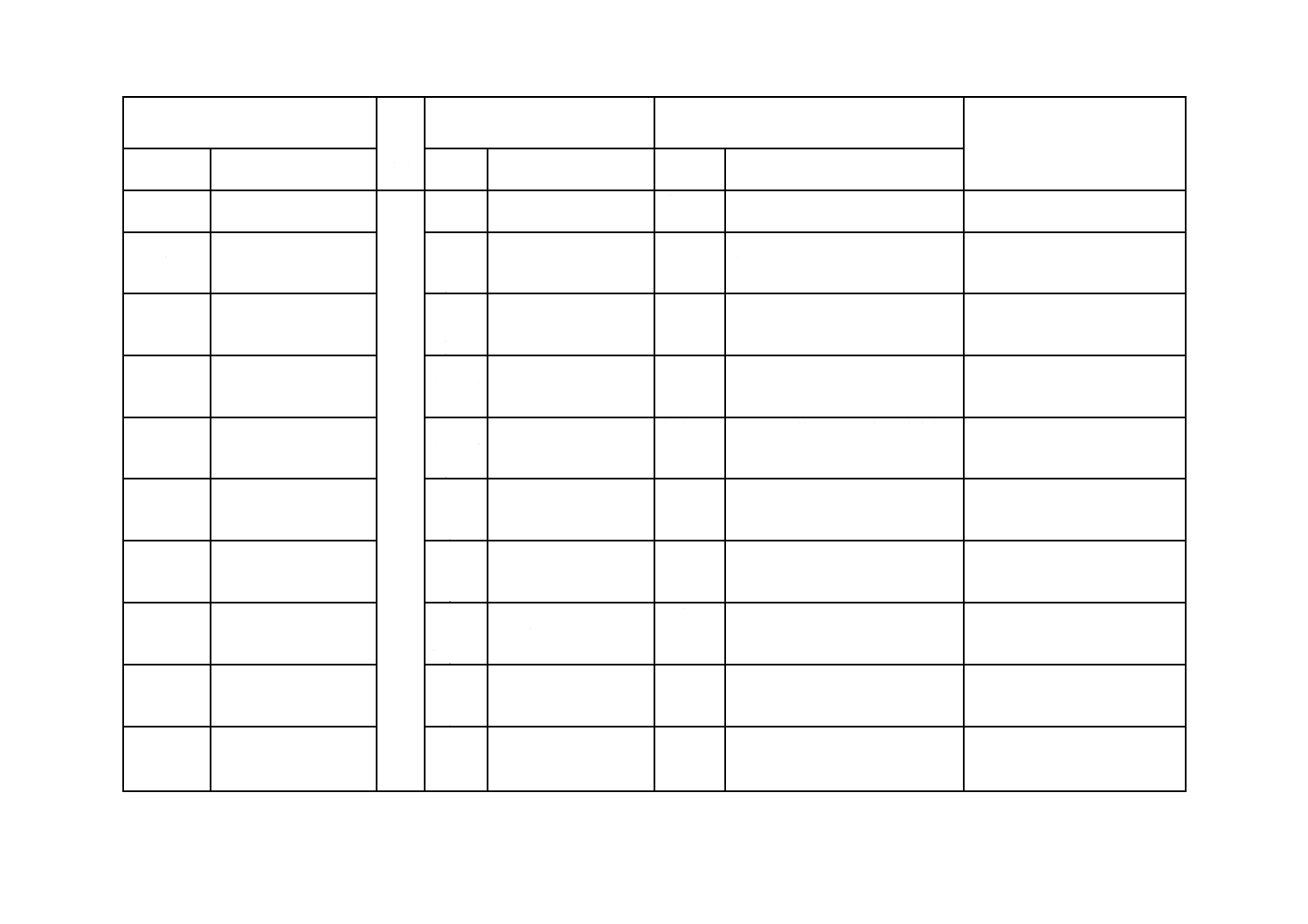
16 包装
一次包装及び二次包装
を規定。
15
JISと同じ。
一致
−
−
1
2
T
3
2
1
0
:
2
0
11
1
2
T
3
2
1
0
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
17 表示
一次包装及び二次包装
を規定。
16
JISとほぼ同じ。
追加
具体的に規定するため,JIS T 0307
を追加した。
実質的な差異はない。
附属書A
(規定)
デッドスペースの測定
法
Annex C
(normati
ve)
デッドスペースの測定
法
追加
注記としての押子の移動試験を追
加。
実質的な差異はない。
−
−
Annex A
(normati
ve)
抽出物の準備方法
削除
JISは,附属書内容を本体で規定。 実質的な差異はない。
−
−
Annex B
(normati
ve)
空気漏れ試験方法
削除
JISは,本体でISO規格の試験方法
を引用。
実質的な差異はない。
−
−
Annex D
(normati
ve)
空気漏れ試験方法
削除
JISは,本体でISO規格の試験方法
を引用。
実質的な差異はない。
−
−
Annex E
(informat
ive)
材料指針
削除
−
−
−
−
Annex F
(informat
ive)
削除
−
−
−
−
Annex G
(informat
ive)
押子操作に必要な力の
試験方法
削除
−
−
−
−
Annex H
(informat
ive)
“再使用禁止”の印
削除
−
−
−
−
Annex J
(informat
ive)
参考文献
削除
−
−

1
3
T
3
2
1
0
:
2
0
11
1
3
T
3
2
1
0
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JISと国際規格との対応の程度の全体評価:ISO 7886-1:1993,Cor.1:1995,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ················ 技術的差異がない。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。