T 0806-2:2014
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 2
3 用語,定義及び略語 ·········································································································· 2
3.1 用語及び定義 ················································································································ 2
3.2 略語 ···························································································································· 5
4 線量設定,線量実証及び滅菌線量監査のための製品ファミリーの定義及び維持 ···························· 7
4.1 一般 ···························································································································· 7
4.2 製品ファミリーの定義 ···································································································· 7
4.3 検定線量試験又は滅菌線量監査に使用する製品ファミリーを代表する製品の指定 ······················· 8
4.4 製品ファミリーの維持 ···································································································· 9
4.5 滅菌線量の確立又は滅菌線量監査の不合格が製品ファミリーに及ぼす影響 ································ 9
5 滅菌線量の確立のための製品の選択及び試験 ········································································· 9
5.1 製品の性質 ··················································································································· 9
5.2 分割試料(SIP) ··········································································································· 10
5.3 サンプル採取の方法 ······································································································ 11
5.4 微生物試験 ·················································································································· 11
5.5 照射 ··························································································································· 11
6 線量確立の方法 ··············································································································· 12
7 方法1:バイオバーデン情報を用いる線量設定法 ··································································· 12
7.1 理論的根拠 ·················································································································· 12
7.2 平均バイオバーデンが1.0以上の複数製造バッチの製品に方法1を適用する手順 ······················· 13
7.3 平均バイオバーデンが1.0以上の単一製造バッチの製品に方法1を適用する手順 ······················· 18
7.4 平均バイオバーデンが0.1〜0.9の複数又は単一製造バッチの製品に方法1を適用する手順 ·········· 20
8 方法2:外挿係数決定のための累加線量照射によって得られる陽性率の情報を用いる線量設定法 ···· 20
8.1 理論的根拠 ·················································································································· 20
8.2 方法2Aの手順 ············································································································· 21
8.3 方法2Bの手順 ············································································································· 24
9 VDmax法−滅菌線量としての25 kGy又は15 kGyの実証 ························································· 27
9.1 理論的根拠 ·················································································································· 27
9.2 複数製造バッチにVDmax25法を適用する手順······································································· 28
9.3 単一製造バッチにVDmax25法を適用する手順······································································· 32
9.4 複数バッチにVDmax15法を適用する手順 ············································································ 34
9.5 単一製造バッチにVDmax15法を適用する手順······································································· 37
T 0806-2:2014 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
9A VDmaxSD法−滅菌線量としての17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,
30 kGy,32.5 kGy又は35 kGyの実証 ················································································ 39
10 滅菌線量監査 ················································································································ 39
10.1 目的及び頻度 ·············································································································· 39
10.2 方法1,方法2A又は方法2Bを用いて確立した滅菌線量監査の手順 ······································ 40
10.3 VDmax25法又はVDmax15法を用いて実証した滅菌線量監査の手順 ············································ 42
10.4 滅菌線量監査の不合格 ·································································································· 46
10A VDmaxSD法を用いて実証したプロセスの有効性の維持 ························································· 46
11 実施例 ························································································································· 46
11.1 方法1の実施例 ··········································································································· 46
11.2 方法2の実施例 ··········································································································· 48
11.3 VDmax法の実施例 ········································································································· 56
11.4 方法1を用いて確立した滅菌線量監査で滅菌線量の増加が必要となる場合の実施例 ·················· 58
11.5 方法2Aを用いて確立した滅菌線量監査で滅菌線量の増加が必要となる場合の実施例 ··············· 59
11.6 VDmax25法で実証した滅菌線量監査の実施例 ······································································ 60
11A VDmaxSD法で実証した滅菌線量監査の実施例 ····································································· 60
附属書JA(規定)VDmaxSD法 ································································································· 61
参考文献 ···························································································································· 89
附属書JB(参考)JISと対応国際規格との対比表 ······································································ 91
T 0806-2:2014
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器学会(JSMI)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格
を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格
である。
これによって,JIS T 0806-2:2010は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
JIS T 0806の規格群には,次に示す部編成がある。
JIS T 0806-1 第1部:医療機器の滅菌プロセスの開発,バリデーション及び日常管理の要求事項
JIS T 0806-2 第2部:滅菌線量の確立
JIS T 0806-3 第3部:線量測定にかかわる指針
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 0806-2:2014
ヘルスケア製品の滅菌−放射線−
第2部:滅菌線量の確立
Sterilization of health care products-Radiation-
Part 2: Establishing the sterilization dose
序文
この規格は,2013年に第3版として発行されたISO 11137-2を基とし,技術的内容及び構成を変更して
作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JBに示す。また,附属書JAには対応国際規格にない滅菌線量実証法で
あるVDmaxSD法を規定した。
この規格は,JIS T 0806-1の8.2.2で規定する二つのアプローチa)及びb),並びに附属書JAで規定する
方法c)について規定している。
a) 製品固有の滅菌線量を求めるための線量設定
b) VDmax25法による25 kGy及びVDmax15法による15 kGyの滅菌線量としての実証
c) VDmaxSD法による17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy及び35 kGyの滅菌線量と
しての実証
この規格は,JIS T 0806-1の箇条12によって滅菌線量監査を行う方法についても規定している。滅菌線
量の確立後は,滅菌線量監査を定期的に実施して,その滅菌線量が必要なSAL(Sterility Assurance Level,
無菌性保証水準)を継続して達成していることの確認を規定している。
1
適用範囲
この規格は,あらかじめ定めたSALを達成するのに必要な最低線量を決定する方法,SAL 10−6以下を
達成するための滅菌線量としての15 kGy・25 kGy及び17.5 kGy・20 kGy・22.5 kGy・27.5 kGy・30 kGy・
32.5 kGy・35 kGyを実証する方法並びに滅菌線量が継続して有効であることを立証するための滅菌線量監
査の方法について規定する。また,この規格は,滅菌線量の確立及び滅菌線量監査のための製品ファミリ
ーについても規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す
ISO 11137-2:2013,Sterilization of health care products−Radiation−Part 2: Establishing the
sterilization dose(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0806-1:2010 ヘルスケア製品の滅菌−放射線−第1部:医療機器の滅菌プロセスの開発,バリ
デーション及び日常管理の要求事項
注記 対応国際規格:ISO 11137-1:2006,Sterilization of health care products−Radiation−Part
1:Requirements for development, validation and routine control of a sterilization process for medical
devices(IDT)
JIS T 11737-1 医療機器の滅菌−微生物学的方法−第1部:製品上の微生物群の測定方法
注記 対応国際規格:ISO 11737-1,Sterilization of medical devices−Microbiological methods−Part 1:
Determination of a population of microorganisms on products(IDT)
JIS T 11737-2 医療機器の滅菌−微生物学的方法−第2部:滅菌プロセスの定義,バリデーション及
び維持において実施する無菌性の試験
注記 対応国際規格:ISO 11737-2,Sterilization of medical devices−Microbiological methods−Part 2:
Tests of sterility performed in the definition, validation and maintenance of a sterilization process
(IDT)
3
用語,定義及び略語
この規格で用いる,用語及び定義は,JIS T 0806-1によるほか,次による。
3.1
用語及び定義
3.1.1
バッチ(batch)
定められた製造プロセスで生産され,特性及び品質が均一であることを意図したもの,又はみなすこと
ができる定められた量の製品(ISO/TS 11139:2006の2.1)。
3.1.2
バイオバーデン(bioburden)
製品及び/又は無菌バリアシステムの上又は内部に存在する生育可能な微生物群(ISO/TS 11139:2006
の2.2)。
3.1.3
偽陽性(false positive)
製品試料又はその一部分が無菌性の試験で陽性を示し,その試験結果が外部からの微生物汚染に起因す
るか又は濁りが製品試料若しくはその一部分が培地との反応によって生じた試験結果。
3.1.4
陽性率(fraction positive)
無菌性の試験の陽性数を分子とし,試験実施数を分母とした場合の商。
3.1.5
累加線量(incremental dose)
滅菌線量の確立又は滅菌線量の確認のために製品試料又はその一部分に照射する一連の線量。
3
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.1.6
陰性の無菌性の試験(negative test of sterility)
無菌性の試験を実施した製品試料又はその一部分に,検出可能な微生物の生育を認めない試験結果。
3.1.7
包装システム(packaging system)
無菌バリアシステムと保護包装との組合せ(ISO/TS 11139:2006の2.28)。
3.1.8
陽性の無菌性の試験(positive test of sterility)
無菌性の試験を実施した製品試料又はその一部分に,検出可能な微生物の生育を認める試験結果。
3.1.9
分割試料,SIP(sample item portion)
試験を行うヘルスケア製品のうちの定義した一部分。
3.1.10
標準抵抗性分布,SDR(standard distribution of resistances)
微生物群の抵抗性とそれに対応する存在確率との一連の関係。
3.1.11
無菌バリアシステム(sterile barrier system)
微生物の侵入を防ぎ,使用時点で製品の無菌性を保つために最低限必要な包装。
3.1.12
無菌性保証水準,SAL(Sterility Assurance Level)
滅菌後に,一つの製品上に生育可能な微生物が1個存在する確率。
注記 SALは定量値として一般的に,10−3又は10−6と表す。この定量値を無菌性保証に適用すると
きは,SAL 10−6の方がより小さい数値であるが,SAL 10−3よりも高い無菌性保証である(ISO/TS
11139:2006の2.46)。
3.1.13
滅菌線量監査(sterilization dose audit)
確立した滅菌線量の妥当性を確認するために実施する試験。
3.1.14
無菌性の試験(test of sterility)
製品又はその一部に生育可能な微生物の存在の有無を判定するために行う試験で,開発,バリデーショ
ン又は適格性の再確認の一部として実施する技術的操作(ISO/TS 11139:2006の2.54)。
3.1.15
検定線量(verification dose)
滅菌線量を確立するためにあらかじめ決定したSALが10−2以下を与える放射線量。
注記 附属書JAでは,あらかじめ決定したSALは10−1である。
3.1.16
修正(correction)
検出された不適合を除去するための処置。
注記 是正処置(3.1.17)と合わせて,修正が行われることもある。
(JIS Q 9000:2006の3.6.6を修正)
4
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.1.17
是正処置(corrective action)
検出された不適合又はその他の検出された望ましくない状況の原因を除去するための処置。
注記1 不適合の原因は,一つ以上のことがある。
注記2 予防処置は,発生を未然に防止するためにとるのに対し,“是正処置”は,再発を防止するた
めにとる。
注記3 修正と是正処置とは異なる。
(JIS Q 9000:2006の3.6.5)
3.1.18
線量(dose),吸収線量(absorbed dose)
規定された物質の単位質量当たりに付与された吸収エネルギーの量。
注記1 吸収線量の単位は,グレイ(Gy)。1 Gyは1 J/kgの吸収に相当する。
注記2 この規格では,線量は“吸収線量”の意味で使用する。
(JIS T 0806-1:2010の3.1を修正)
3.1.19
線量分布評価(dose mapping)
あらかじめ定めた条件下で,照射した物質中の線量分布及び変動を測定し,評価すること。
(JIS T 0806-1:2010の3.10を修正)
3.1.20
ヘルスケア製品[health care product(s)]
体外診断用医療機器を含む医療機器又は生物製剤を含む医薬品。
(ISO/TS 11139:2006の2.20を修正)
3.1.21
医療機器(medical device)
あらゆる計器,器械,用具,機械,器具,埋込み用具,体外診断薬,検定物質,ソフトウェア,材料又
はその他の同類のもの若しくは関連する物質であって,単独使用か組合せ使用かを問わず,製造業者が人
体への使用を意図し,その使用目的が次の一つ以上であり,
− 疾病の診断,予防,監視,治療又は緩和
− 負傷の診断,監視,治療,緩和又は補助
− 解剖学的若しくは生理学的なプロセスの検査,代替又は修復
− 生命支援又は維持
− 受胎調整
− 医療機器の殺菌
− 人体から採取される標本の体外試験法による医療目的のための情報提供
薬学,免疫学,又は新陳代謝の手段によって体内又は体表において意図したその主機能を達成すること
はないが,それらの手段によって機能の実現を補助するものである(JIS Q 13485:2005 定義3.7参照)。
3.1.22
VDmax法(Method VDmax)
選択した滅菌線量でSAL 10−6を達成するために所定のバイオバーデンに対して最大の検定線量を用い
る滅菌線量の実証の手順。
5
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記 実証方法は,通例VDmaxSD法と呼ばれる。ここで,SDは選択した滅菌線量のことである。
3.1.23
微生物(microorganism)
細菌,真菌,原虫及びウィルスを包含する微小体。
注記 ある種の規格によっては,滅菌プロセスのバリデーション及び/又は日常管理において,上記
で定義した全てのタイプの微生物の不活化の滅菌プロセスの有効性を立証することを要求しな
いこともある。
(ISO/TS 11139:2006の2.26)
3.1.24
製品(product)
プロセスの結果。
注記 この規格においては,製品は有形のものであり,原料,中間品,半組立品及びヘルスケア製品
でもあり得る。
(JIS Q 9000:2006の3.4.2を修正)
3.1.25
無菌性(sterility)
生育可能な微生物が存在しない状態。
注記 実際には,そのような微生物が存在しない絶対的な状態を証明することはできない[3.1.26(滅
菌)参照]。
(ISO/TS 11139:2006の2.45)
3.1.26
滅菌(sterilization)
製品を生育可能な微生物が存在しない状態にするために用いる,バリデートされたプロセス。
注記 滅菌プロセスでは,微生物の不活化は,指数関数で表現される。したがって,個々の製品に存
在する生育可能な微生物は,確率論の観点から表現が可能である。この確率は,非常に低い数
に減らすことはできるが,決してゼロに低減することはできない[3.1.12(無菌性保証水準)参
照]。
(ISO/TS 11139:2006の2.47)
3.1.27
滅菌線量,SD(sterilization dose)
無菌性のためにあらかじめ定めた要求事項を達成するための選択した線量。
(JIS T 0806-1の3.40を修正)
3.2
略語
3.2.1
A
ffp中央値を下方修正してFFPとするための線量。
3.2.2
D*
線量設定法の方法2の検定線量試験で照射した100個の製品試料で個別に実施して得られた無菌性の試
験の陽性数。
6
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.2.3
d*
あらかじめ定めた製造バッチから取り出した製品試料に実施した累加線量試験で得られた線量。
3.2.4
CD*
製品試料にSAL 10−2与える初期推定線量値。
注記 通常,この値はあらかじめ定めた製品試料から導き出された三つのd*値の中央値となる。
3.2.5
D**
製品試料にSAL 10−2を与える最終推定線量値。滅菌線量の計算に用いる。
3.2.6
DD*
線量設定法の方法2の検定線量試験で得られた最大線量。
3.2.7
DS
DD*を照射した後の製品試料に存在する微生物の推定D10値。
3.2.8
D値,D10値
定められた条件下で,試験に用いる微生物数の90 %を不活化するのに要する時間又は放射線量(ISO/TS
11139:2006の2.11)。
注記 この規格では,D10値は時間ではなく放射線量だけを適用する。
3.2.9
ffp(first fraction positive dose)
あらかじめ定めた製造バッチから取り出した製品試料に実施した一連の累加線量試験で,20の無菌性の
試験で,少なくとも一つの試験が陰性となる最小線量。
3.2.10
FFP(First Fraction Positive dose)
20の無菌性の試験で,19が陽性となる推定線量。三つのffpの中央値からAを減じて算出する。
3.2.11
FNP(First No Positive dose)
製品試料にSAL 10−2を与える推定線量。DSの計算に使用する。
3.2.12
VDmax15
あらかじめ定めたバイオバーデンに対して,15 kGyの規定滅菌線量でSAL 10−6の達成に相当する最大
検定線量。
3.2.13
VDmax25
あらかじめ定めたバイオバーデンに対して,25 kGyの規定滅菌線量でSAL 10−6の達成に相当する最大
検定線量。
7
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.2.14
VDmaxSD(VDmaxSD)
VDmaxSD法を使用する際に得られる特定の選択した滅菌線量(SD)に対する最大の検定線量。
4
線量設定,線量実証及び滅菌線量監査のための製品ファミリーの定義及び維持
4.1
一般
滅菌線量の確立及び滅菌線量監査の実施は,プロセスの定義(JIS T 0806-1:2010の箇条8参照)及びプ
ロセスの有効性の維持(JIS T 0806-1:2010の箇条12)の作業の一部をなすものである。これらの作業のた
めに,製品を製品ファミリーにまとめてもよい。製品ファミリーは,主に製品上又は内部に存在する微生
物の数及びタイプ(バイオバーデン)に従って定義する。このうち微生物のタイプは,放射線抵抗性を示
す。密度又は包装システム内の製品構成といった変動要因は,バイオバーデンに影響を及ぼす因子ではな
いため製品ファミリーの確立においては考慮しない。
滅菌線量の確立及び滅菌線量監査に製品ファミリーを用いる場合は,滅菌の有効性に影響を与える製造
プロセス内の不測の変化を検出する能力の低下を認識することが重要である。さらに,製品ファミリーを
代表する製品として,単一の製品を使用することは,製品ファミリーに属する他の製品メンバに何らかの
変化が生じた場合に,その変化を検知できない可能性がある。製品ファミリーに属する他の製品メンバに
生じる変化を検知する能力の低下に関わるリスクを評価し,作業を進めるに先立って製品ファミリーを維
持する計画を作成し,実行することが望ましい。
注記 リスクマネジメントについては,JIS T 14971を指針として参照。
4.2
製品ファミリーの定義
4.2.1
製品ファミリーを定義するための基準を文書化しなければならない。製品をこれらの基準に従って
評価し,製品ファミリーのメンバとなる可能性のある製品間の類似性を検討しなければならない。この検
討においては,製品のバイオバーデンに影響を及ぼす製品に関わる全ての変動要因を検討しなければなら
ない。この変動要因の例を次に示すが,これらに限定されるものではない。
a) 原材料の性質及び供給源,複数の供給源のある場合は,供給源の違いによる影響
b) 構成部品
c) 製品設計及び寸法
d) 製造プロセス
e) 製造機器
f)
製造環境
g) 製造場所
評価及び検討の結果は,記録しなければならない(JIS T 0806-1:2010の4.1.2参照)。
4.2.2
製品をある製品ファミリーに含めるには,製品に関連した変動要因(4.2.1参照)が類似し,それ
を適切に管理している場合だけでなければならない。
4.2.3
製品をある製品ファミリーに加えるには,バイオバーデンが類似の微生物の数及びタイプから構成
されていることを立証しなければならない。
4.2.4
2か所以上の製造場所で製造した製品を製品ファミリーに含める場合は,明確な根拠を示し,その
記録を残さなければならない(JIS T 0806-1:2010の4.1.2参照)。
バイオバーデンに及ぼす影響については,次の事項を考慮しなければならない。
a) 製造場所間の地理的及び/又は気候的な差異
8
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 製造プロセス又は環境の管理の差異
c) 原材料の供給源及び生産副資材(例えば,水)
4.3
検定線量試験又は滅菌線量監査に使用する製品ファミリーを代表する製品の指定
4.3.1
製品ファミリーを代表する製品
4.3.1.1
製品ファミリーを代表する製品を選定する場合は,製品上又は内部に存在する微生物の数及びタ
イプを基準としなければならない。
4.3.1.2
製品ファミリーは,次のいずれかで代表しなければならない。
a) マスタ製品(4.3.2参照)
b) 類似製品(4.3.3参照)
c) 模擬製品(4.3.4参照)
4.3.1.3
4.3.1.2に規定する三つの代表製品の候補のうち,いずれが適切であるかを決定するには,文書化
した手順に従って評価しなければならない。この評価は,次の事項に留意しなければならない。
a) バイオバーデンを構成する微生物の数
b) バイオバーデンを構成する微生物のタイプ
c) 微生物が発生する環境
d) 製品寸法
e) 構成部品の数
f)
製品の複雑さ
g) 製品製造の自動化の程度
h) 製造環境
4.3.2
マスタ製品
製品ファミリーに属するあるメンバ製品が,評価(4.3.1.3参照)で同じ製品ファミリーに属する他のメ
ンバ製品よりも大きな耐滅菌性をもつことが認められた場合だけマスタ製品とみなすことができる。状況
によっては,製品ファミリーに属する複数の製品を,マスタ製品とみなすこともできる。その場合は,次
のいずれか一つを製品ファミリーを代表するマスタ製品として選択してもよい。
a) 無作為に選ぶ。
b) マスタ製品とみなすことのできる異なる製品を含むように文書化された手順に従って選ぶ。
4.3.3
類似製品
評価(4.3.1.3参照)で製品グループのメンバが同一の滅菌線量を示している場合だけ,その製品グルー
プを類似製品とみなすことができる。類似製品の選定は,次のいずれかでなければならない。
a) 無作為に選ぶ。
b) 製品ファミリーの異なる製品メンバを含むように文書化された手順に従って選ぶ。
製品ファミリーを代表する類似製品を選定する場合は,製品の生産量及び入手のしやすさを考慮するこ
とが望ましい。
4.3.4
模擬製品
模擬製品は,その製品が滅菌プロセスに対し他の製品の耐滅菌性と同等以上の場合にだけ,製品ファミ
リーを代表できる。模擬製品は,実際の製品に使用する材料及び方法で包装しなければならない。
注記 模擬製品は,臨床用を意図して造られたものではなく,滅菌線量の確立又は維持のためだけに
作製する。
模擬製品とは,次のいずれかである。
9
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
a) 材料及び寸法が実際の製品に類似し,類似の製造プロセスを経たもの。例えば,全製造プロセスを経
たインプラントとして使用する材料の一部。
b) 使用時には通常組み合わせることのない,製品ファミリー内の他の製品の構成部品の組合せ。例えば,
製品ファミリー内の他の製品の構成部品である複数のフィルタ,クランプ及び止栓を含むチューブセ
ット。
4.4
製品ファミリーの維持
4.4.1
定期的レビュー
それぞれの製品ファミリーを代表して使用している製品ファミリー及び製品が妥当性を維持しているこ
とを確実にするため,あらかじめ定めた頻度で定期的にレビューしなければならない。製品ファミリーの
メンバへの帰属に影響を与える製品及び/又はプロセスのレビューに関わる責任は,有資格者が負わなけ
ればならない。このレビューは,少なくとも年1回実施しなければならない。レビューの結果は,JIS T
0806-1:2010の4.1.2に従って記録しなければならない。
4.4.2
製品及び/又は製造プロセスの変更
原材料(性質及び入手先),構成部品,製品設計(寸法を含む。)などの製品の変更及び/又は設備,環
境又は場所といった製造プロセスの変更は,文書化された変更管理システムに従って評価しなければなら
ない。これらの変更は,製品ファミリーを定義した基準又は製品ファミリーを代表する製品を選定した基
準に変更を及ぼす可能性がある。重大な変更がある場合は,新しい製品ファミリーの定義又は別の代表製
品の選定が必要となる。
4.4.3
記録
製品ファミリーに関わる記録は,保管しなければならない(JIS T 0806-1:2010の4.1.2参照)。
4.5
滅菌線量の確立又は滅菌線量監査の不合格が製品ファミリーに及ぼす影響
製品ファミリーの滅菌線量の確立又は滅菌線量監査が不合格の場合は,その製品ファミリーの全ての製
品を不合格としなければならない。その後の処置については,製品ファミリーに属する全ての製品に適用
する。
5
滅菌線量の確立のための製品の選択及び試験
5.1
製品の性質
5.1.1
滅菌用の製品は,次のもので構成することができる。
a) 包装システム内の個々のヘルスケア製品
b) 使用時に必要な附属品とともにヘルスケア製品を組み立てるために使用する包装システム内の構成部
品のセット
c) 包装システム内の複数の同一のヘルスケア製品
d) 治療手順に応じた各種ヘルスケア製品のキット
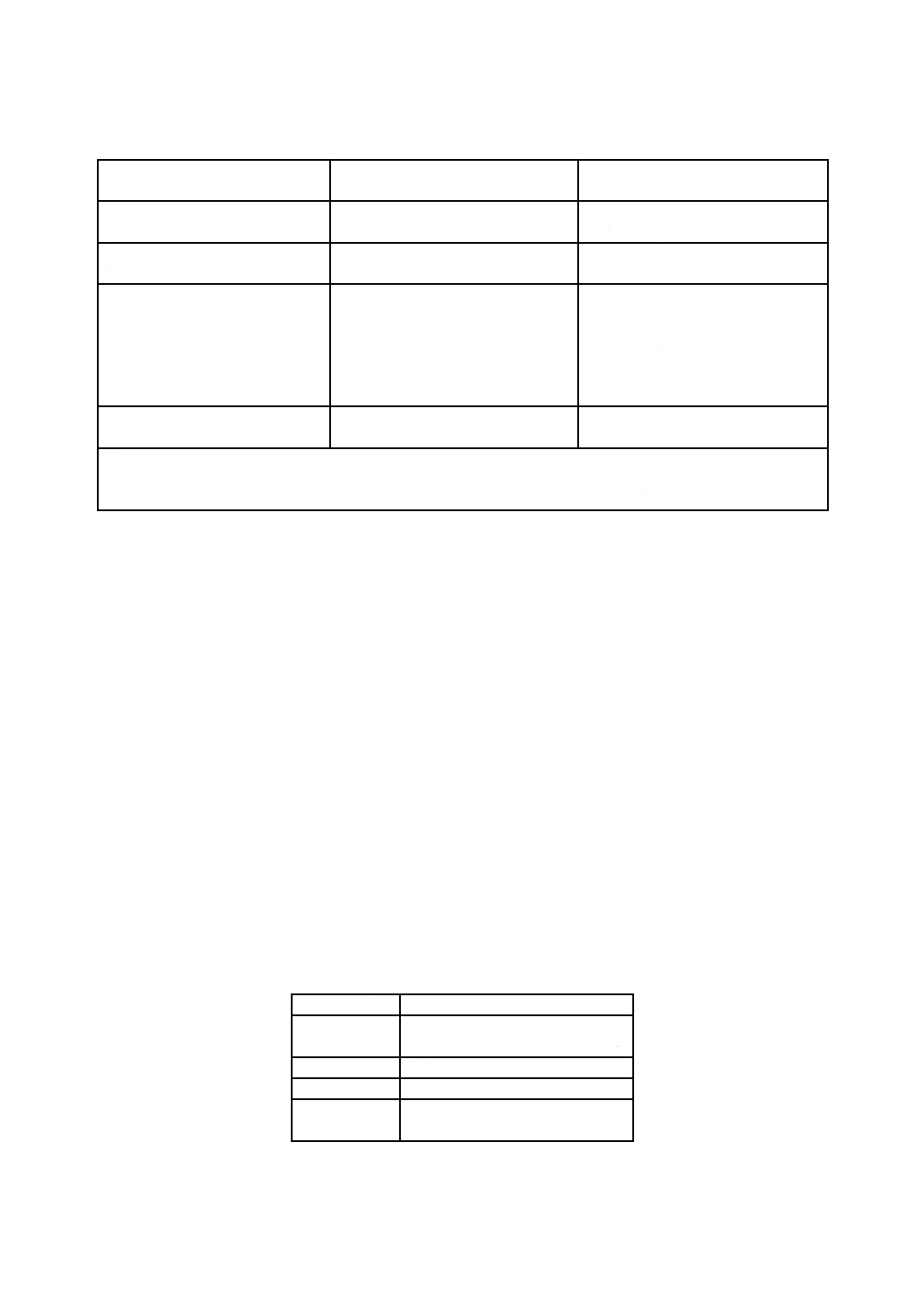
滅菌線量の確立のための製品試料の採取は,表1に従って実施しなければならない。
10
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1−滅菌線量の確立のための製品試料の性質
製品の種類
バイオバーデン評価,検定及び/又は
累加線量試験に使用する製品試料
根拠
包装システム内の個々のヘルスケ
ア製品
個々のヘルスケア製品
各ヘルスケア製品は臨床では独立し
て使用する。
包装システム内の構成部品のセッ
ト
製品の全構成部品の組合せ
構成部品は製品に組み立てて,臨床で
使用する。
包装システム内の複数の同一のヘ
ルスケア製品
包装システム内から取り出した一つ
のヘルスケア製品
各ヘルスケア製品は,臨床用では独立
して使用する。包装システム内の個々
のヘルスケア製品のSALは,選定し
たSALに適合するが,包装システム
のSALは,そのSALより高くなるこ
とがある。
治療手順に応じた各種ヘルスケア
製品のキットa)
キットを構成する個々のヘルスケア
製品
個々のヘルスケア製品は,臨床では独
立して使用する。
注記1 5.1.1 b)で特性を定める製品に対するSIP 適用の指針については,5.2を参照。
注記2 5.1.1 d)で特性を定める製品に対する製品ファミリーの適用については,箇条4を参照。
注a) 線量設定では,最大の滅菌線量を必要とするヘルスケア製品を基準として滅菌線量を選ぶ。
5.1.2
製品の一部分だけについて無菌を要求する場合は,滅菌線量の確立はその部分だけについて行って
よい。
例 液体の流路だけの無菌を要求する製品は,液体の流路についてのバイオバーデンの決定及び無菌
性の試験の結果に基づいて滅菌線量を確立してもよい。
5.2
分割試料(SIP)
5.2.1
平均バイオバーデンが1.0以上の製品は,実施可能な限り表1に従って製品全体(SIPは1.0)を用
いることが望ましい。製品全体の使用が困難な場合は,製品の一部分(分割試料)を選択し代用してもよ
い。SIPは可能な限り大きく,かつ,試験中の操作が可能な大きさであることが望ましい。
5.2.2
平均バイオバーデンが0.9以下の製品は,表1に従って製品全体(SIPは1.0)を用いなければなら
ない。
5.2.3
試料上及び/又は内部にバイオバーデンが均等に分布している場合は,SIPは試料のいずれの部分
から選んでもよい。バイオバーデンが均等に分布していない場合は,SIPは次のいずれかでなければなら
ない。
a) 製品を構成する各部材の構成比率に応じて,無作為に選んだ製品の一部分とする。
b) 滅菌プロセスに対して最大の耐滅菌性をもつとみなせる製品の一部分とする。
SIPの値は,長さ,質量,容積又は表面積からも計算が可能である(例は,表2参照)。
表2−SIPの計算要素の例
SIPの要素
製品
長さ
チューブ(一定の口径)
ばん(絆)創こう(膏)のロール
質量
粉体,ガウン
容積
液体
表面積
サージカルドレープ
チューブ(多様な口径)
5.2.4
SIPの準備及び包装は,バイオバーデンの変化を最小とする条件の下で実施しなければならない。
11
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
SIPの準備は,管理した環境条件で実施し,包装材料は可能な限り最終製品に使用するものと同じもので
あることが望ましい。
5.2.5
選定したSIPの妥当性を立証しなければならない。SIPのバイオバーデンは,20個の未照射SIPに
ついて無菌性の試験を行い,少なくとも17個の無菌性の試験が陽性になるか,又は20個以上のSIPにつ
いて少なくとも85 %で1以上のバイオバーデンが見付からなければならない。これらの基準に適合しない
場合は,当初試験したSIPを変えて上記基準の一つを満たすSIPを使用しなければならない。製品全体(SIP
は1.0)を試験する場合は,上記の基準を満たす必要はない。
5.2.6
検定線量試験を実施するときの無菌性の試験におけるSIPと,検定線量を得るためのバイオバーデ
ンの決定におけるSIPとは,同じSIPを使用することが望ましい。
注記 無菌性の試験におけるSIPと,バイオバーデンの決定におけるSIPが異なる場合は,検定線量,
滅菌線量を選択するとき及びSIP VDmaxSDを計算するときに注意が必要である。これら二つを実
施する場合には,二つの別々のバイオバーデンの決定が必要である。一つは,滅菌線量の選択
において適用される製品全体のバイオバーデンを得るために使用されるSIPを用いるものであ
り,もう一つは検定線量試験において適用されるSIP VDmaxSDの値を得るために使用されるSIP
を用いるものである。
5.3
サンプル採取の方法
5.3.1
滅菌線量の確立又は滅菌線量監査のための製品は,通常のプロセス及び条件を経たものでなければ
ならない。バイオバーデンの決定又は無菌性の試験に使用する製品試料は,別の包装システムから取り出
すことが望ましい。
5.3.2
製造後の製品の採取から検定線量試験までの経過時間は,製品の最終製造プロセスが完了してから
滅菌までにかかる時間を反映することが望ましい。製品試料は,製造プロセスで不合格となった製品の中
から選んでもよいが,その製品が残りの製品と同じプロセス及び条件を経たものであることが必要である。
5.4
微生物試験
5.4.1
バイオバーデンの決定及び無菌性の試験は,それぞれJIS T 11737-1及びJIS T 11737-2に従って行
わなければならない。
無菌性の試験に単一の培地を使用する場合は,培養温度30±2 ℃,培養期間14日間の条件でソイビー
ンカゼインダイジェストブロス培地を用いるのが望ましい。この培地及び温度が存在する微生物の生育に
十分でないと疑われる理由がある場合は,他の適切な培地及び培養条件を用いることが望ましい([9],[12]
及び[14]参照)。
照射に先立って,バイオバーデンの変動又は微生物の放射線感受性に影響を与えるような変更(すなわ
ち,微生物近辺の化学的環境,特に酸素濃度の変化)は,認められない。実施可能な場合,検定線量試験
のための製品はできる限り製品と同じ形状及び包装で照射するのが望ましいが,無菌性の試験での偽陽性
の可能性を減らすために,照射に先立って製品を分解し,再包装してもよい。照射用の再包装材料は,照
射線量及び照射後の取扱いに耐えるものを使用し,汚染の可能性を最小限にしなければならない。
5.4.2
バイオバーデンの決定は,包装プロセスを経た製品で実施しなければならない。
注記 バイオバーデンの決定は,通常,包装システムから取り出した製品で実施し,包装システムを
その決定から除外しても問題ない。
5.5
照射
5.5.1
滅菌線量の確立のための製品の照射は,JIS T 0806-1に従って据付適格性の確認,運転適格性の確
認及び稼働性能適格性の確認に適合した照射設備で実施しなければならない。
12
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.5.2
線量測定及び放射線源の使用は,JIS T 0806-1に従わなければならない。
5.5.3
検定線量試験又は累加線量試験の実施に当たっては,製品への最大線量及び最小線量を特定するた
めに十分な線量分布評価を実施しなければならない。
注記 放射線滅菌の線量測定に関わる指針は,JIS T 0806-3を参照。
6
線量確立の方法
6.1
JIS T 0806-1:2010の8.2.2 a)(製品固有の滅菌線量)に従って滅菌線量を確立する場合は,次のいず
れかで設定しなければならない。
a) 複数バッチ及び単一バッチについての方法1(箇条7参照)
b) 方法2A及び方法2B(箇条8参照)
c) 無菌性について特定の要求事項を達成する上で上記のa)又はb)と同等の保証を与える方法
6.2
JIS T 0806-1:2010の8.2.2 b)(滅菌線量の実証)に従って25 kGyの滅菌線量を確立する場合は,次の
いずれかで実証しなければならない。
a) VDmax25法(9.2及び9.3参照):平均バイオバーデンが1 000以下の製品の場合
b) 方法1(箇条7参照):滅菌線量が25 kGy以下で最大SAL 10−6を達成する場合
c) 方法2(箇条8参照):滅菌線量が25 kGy以下でSAL 10−6を達成する場合
d) 最大SAL 10−6を達成する上で,上記のa),b)又はc)と同等の保証を与える方法
6.3
JIS T 0806-1:2010の8.2.2 b)(滅菌線量の実証)に従って15 kGyの滅菌線量を確立する場合は,次の
いずれかで実証しなければならない。
a) VDmax15法(9.4及び9.5参照):平均バイオバーデンが1.5以下の製品の場合
b) 方法1(箇条7参照):滅菌線量が15 kGy以下で最大SAL 10−6を達成する場合
c) 方法2(箇条8参照):滅菌線量が15 kGy以下でSAL 10−6を達成する場合
d) 最大SAL 10−6を達成する上で,上記のa),b)又はc)と同等の保証を与える方法
7
方法1:バイオバーデン情報を用いる線量設定法
7.1
理論的根拠
滅菌線量を確立するこの方法は,バイオバーデンの放射線抵抗性が標準抵抗性分布(SDR)をもつ微生
物群の抵抗性に比べて同等以下であるという実験的検証に基づいている。
SDRは,論理的に選択されたものである。SDRはD10値で微生物の抵抗性を規定し,かつ,全体の微生
物群における存在確率を規定している(表3参照)。また,SDRをもった微生物群の平均バイオバーデン
が増えた場合,10−2,10−3,10−4,10−5及び10−6のSALを達成するために必要となる線量が計算されて
いる。平均バイオバーデンに対する滅菌線量の計算値を表5及び表6に示す。
注記 方法1の検定線量及び滅菌線量を与えるISO 11137:1995の表B.1では,規則正しく増加する線
量に対応するように増加した平均バイオバーデンを示すように作成されていた。線量は0.1 kGy
刻みで増加していたが,平均バイオバーデンは不規則に増加し,整数及び小数を含んでいた(例
えば,104,112.6,121.9,131.9など)。この版では使いやすく,かつ,理解しやすいようにこ
の表を改良して,表5では平均バイオバーデンを規則的に増加する整数で表している。バイオ
バーデンの増加は,検定線量が約0.1 kGyの増加となるように選び,検定線量は,小数点以下1
桁で丸めた。平均バイオバーデン値の規則的な増加は,表6でも同様である。
13
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
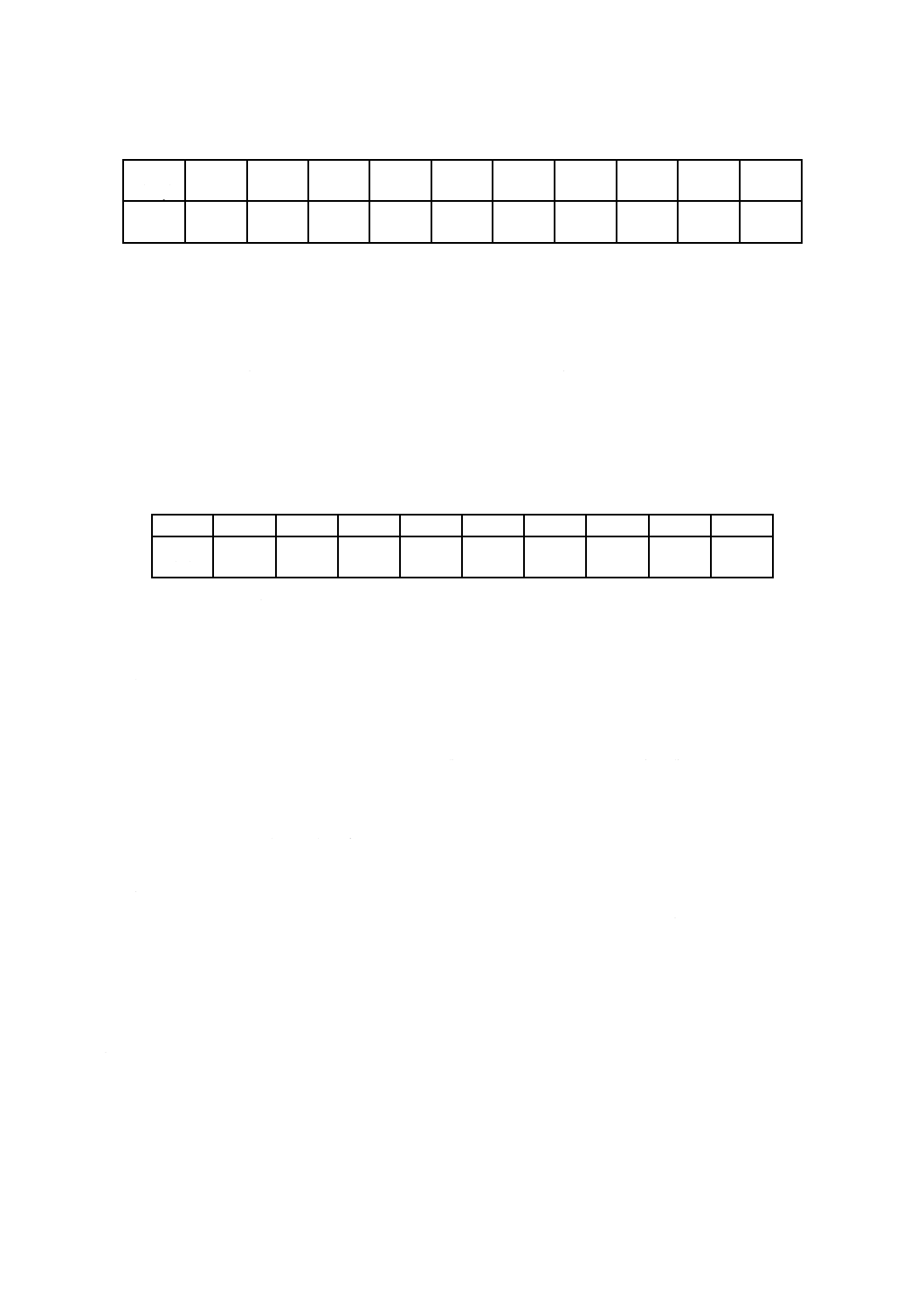
表3−方法1で使用する標準抵抗性分布(SDR)([10]参照)
D10値
(kGy)
1.0
1.5
2.0
2.5
2.8
3.1
3.4
3.7
4.0
4.2
確率
(%)
65.487
22.493
6.302
3.179
1.213
0.786
0.350
0.111
0.072
0.007
実際に適用するには,まず平均バイオバーデンの決定を行い,この平均バイオバーデンでSAL 10−2を与
える線量を表5又は表6から読み取る。この線量を検定線量とするが,これはSDRをもつ微生物群をSAL
10−2のレベルまで減少させる線量に相当する。得られた検定線量で100個の製品試料を照射し,個別に無
菌性の試験を行う。100個の無菌性の試験で3以上の陽性が見いだされなければ,再び表5又は表6を用
いて平均バイオバーデンに対して必要とするSALに相当する滅菌線量を得る。
二つの陽性を許すという理論的根拠は,陽性数の発生する確率がポワソン分布となり,平均一つの陽性
の近傍に分布するという前提に基づいている。この分布では0,1又は2の陽性が発生する確率は92 %と
なる(表4参照)。
表4−平均数1の近傍でポアソン分布によって求めた陽性数の発生確率
陽性数
0
1
2
3
4
5
6
7
8
確率
(%)
36.6
37.0
18.5
6.1
1.5
0.3
0.05
0.006
0.000 7
7.2
平均バイオバーデンが1.0以上の複数製造バッチの製品に方法1を適用する手順
7.2.1
一般
方法1を適用するには,次の6段階の手順を実施しなければならない。
注記 実施例は,11.1を参照。
7.2.2
第1段階:SALの選択及び製品サンプルの入手
7.2.2.1
製品の使用目的に必要なSALを記録する。
7.2.2.2
5.1,5.2及び5.3に従って,独立した三つの製造バッチからそれぞれ10個の製品試料を採取する。
注記 SIPが1未満の場合は,その妥当性を検証するために,追加の製品が必要になることがある(5.2.5
参照)。
7.2.3
第2段階:平均バイオバーデンの決定
7.2.3.1
バイオバーデンの決定に補正係数を適用するか否かを決定する。
注記 JIS T 11737-1では,製品からの微生物の不完全な回収を補正するためにバイオバーデン測定の
バリデーションから得られた補正係数を適用する。方法1を用いて滅菌線量を確立する場合は,
補正係数を適用しないでバイオバーデンを決定してもよい。補正係数を適用しない場合には,
バイオバーデンを過少に見積もることがあり,検定線量試験が不合格となる可能性が増加する。
7.2.3.2
採取した製品試料のバイオバーデンを決定し,次を計算する。
a) 三つの製品バッチのそれぞれについての製品試料の平均バイオバーデン(バッチ平均バイオバーデン)。
b) 全ての製品試料の平均バイオバーデン(全平均バイオバーデン)。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,バッチ平均バイオバーデンの決定のため10個の製品試料をまと
めてもよい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろ
より大きなSIPを選ぶことが望ましい(5.2.5参照)。
14
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
7.2.3.3
三つのバッチ平均バイオバーデンと全平均バイオバーデンとを比較して,バッチ平均バイオバー
デンのいずれかが全平均バイオバーデンの2倍以上であるかを調べる。
7.2.4
第3段階:検定線量の取得
次のいずれかを用いて,表5から平均バイオバーデンに対応するSAL 10−2の線量を求める。
a) バッチ平均バイオバーデンのいずれか一つが,全平均バイオバーデンの2倍以上の場合は,バッチ平
均バイオバーデンの最大値を用いる。
b) それぞれのバッチ平均バイオバーデンが,全平均バイオバーデンの2倍未満の場合は,全平均バイオ
バーデンを用いる。
平均バイオバーデンが表5にない場合は,平均バイオバーデンより大きく,表にある最も近い値を用い
る。
これから得られる線量を検定線量とする。
SIPを用いて無菌性の試験を実施する場合は,SIPバッチ平均バイオバーデンの最大値又はSIP全平均バ
イオバーデンのいずれか適切な方で検定線量を求める。
7.2.5
第4段階:検定線量試験の実施
7.2.5.1
単一製造バッチの製品から100個の製品試料を採取する。第4段階で実施するための100個の製
品試料は,第2段階のバイオバーデンの決定に使用したバッチの一つから採取するか又は通常の生産条件
で製造した第4のバッチから採取してもよい(5.3参照)。
7.2.5.2
これらの製品試料を検定線量で照射する。
製品試料に照射した最大線量は,検定線量からその10 %を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,検定線量の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,検定線量からその10 %を超えた場合は,検定線量試験をやり直さなけ
ればならない。
製品試料に照射した最大線量と最小線量との算術平均が,検定線量の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量が検定線量の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(7.2.6.1参照)には,検定線量試験をやり直す必要はない。
7.2.5.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
7.2.6
第5段階:結果の判定
7.2.6.1
実施した100個の無菌性の試験で陽性数が2以下の場合は,検定線量試験は合格である。
7.2.6.2
無菌性の試験の陽性数が3以上の場合は,検定線量試験は不合格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
検定線量の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に100
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当する検定線量(7.2.4)を使用する。平均バイオバーデンの
評価を変更しなかった場合には,不合格となった検定線量試験と同じ検定線量を使用する。やり直した検
定線量試験の結果は,7.2.6に従って判定する。
15
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
検定線量の照射又は特定のバイオバーデンに関連する原因でない場合には,この線量設定法は有効ではな
く,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
7.2.7
第6段階:滅菌線量の確立
7.2.7.1
製品全体を使用して検定線量試験に合格した場合は,第3段階で用いた平均バイオバーデンと同
じ平均バイオバーデンを表5から読み取り,製品の滅菌線量を得る。平均バイオバーデンが表5にない場
合は,平均バイオバーデンよりも大きく,表にある最も近い値を用いて,必要とするSALを達成するため
に必要な線量を読み取り,滅菌線量を得る。
7.2.7.2
1.0未満のSIPを使用して検定線量試験に合格した場合は,最大のSIPバッチ平均バイオバーデン
又はSIP全平均バイオバーデンのいずれか適切な方をSIPで除して,製品全体の平均バイオバーデンを求
める。製品全体の平均バイオバーデンと同じ平均バイオバーデンを表5から読み取り,製品の滅菌線量を
得る。平均バイオバーデンが表5にない場合は,製品全体の平均バイオバーデンよりも大きく,表にある
最も近い値を用いて,必要とするSALを達成するために必要な線量を読み取り,滅菌線量を得る。

16
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
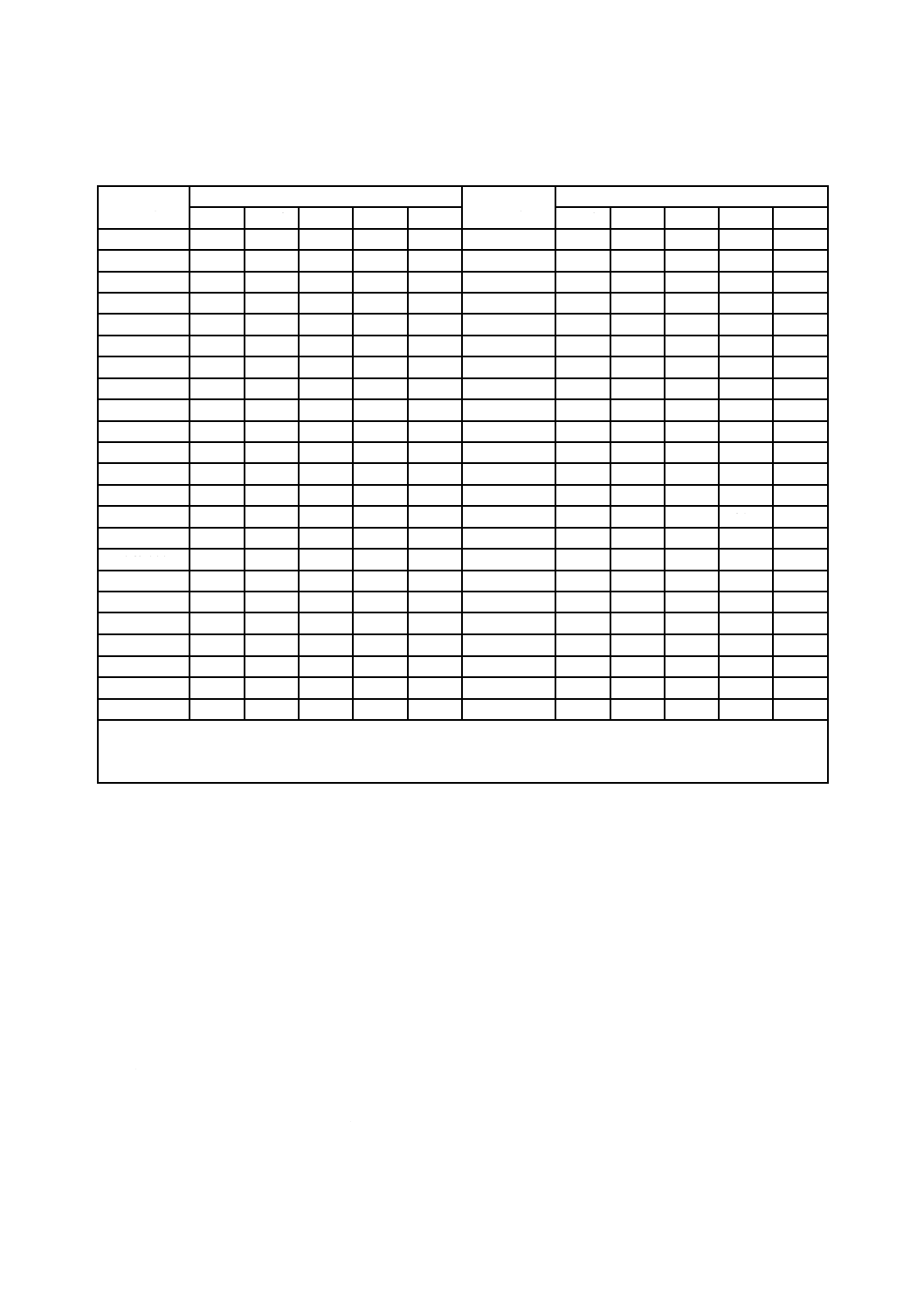
表5−標準抵抗性分布(SDR)をもち,平均バイオバーデンが1.0以上であらかじめ定めた
SALを達成するために必要な放射線量(kGy)
平均バイオ
バーデン
無菌性保証水準 SAL
平均バイオ
バーデン
無菌性保証水準 SAL
10−2
10−3
10−4
10−5
10−6
10−2
10−3
10−4
10−5
10−6
1.0
3.0
5.2
8.0
11.0
14.2
55
7.2
10.2
13.4
16.7
20.3
1.5
3.3
5.7
8.5
11.5
14.8
60
7.3
10.3
13.5
16.9
20.4
2.0
3.6
6.0
8.8
11.9
15.2
65
7.4
10.4
13.6
17.0
20.5
2.5
3.8
6.3
9.1
12.2
15.6
70
7.5
10.5
13.7
17.1
20.6
3.0
4.0
6.5
9.4
12.5
15.8
75
7.6
10.6
13.8
17.2
20.7
3.5
4.1
6.7
9.6
12.7
16.1
80
7.7
10.7
13.9
17.3
20.8
4.0
4.3
6.8
9.7
12.9
16.2
85
7.7
10.8
14.0
17.4
20.9
4.5
4.4
7.0
9.9
13.1
16.4
90
7.8
10.8
14.1
17.5
21.0
5.0
4.5
7.1
10.0
13.2
16.6
95
7.9
10.9
14.1
17.5
21.1
5.5
4.6
7.2
10.2
13.4
16.7
100
8.0
11.0
14.2
17.6
21.2
6.0
4.7
7.3
10.3
13.5
16.9
110
8.1
11.1
14.3
17.8
21.3
6.5
4.8
7.4
10.4
13.6
17.0
120
8.2
11.2
14.5
17.9
21.5
7.0
4.8
7.5
10.5
13.7
17.1
130
8.3
11.3
14.6
18.0
21.6
7.5
4.9
7.6
10.6
13.8
17.2
140
8.4
11.4
14.7
18.1
21.7
8.0
5.0
7.7
10.7
13.9
17.3
150
8.5
11.5
14.8
18.2
21.8
8.5
5.1
7.8
10.8
14.0
17.4
160
8.5
11.6
14.9
18.3
21.9
9.0
5.1
7.8
10.8
14.1
17.5
170
8.6
11.7
15.0
18.4
22.0
9.5
5.2
7.9
10.9
14.1
17.6
180
8.7
11.8
15.1
18.5
22.1
10
5.2
8.0
11.0
14.2
17.6
190
8.8
11.9
15.1
18.6
22.2
11
5.3
8.1
11.1
14.3
17.8
200
8.8
11.9
15.2
18.7
22.3
12
5.4
8.2
11.2
14.5
17.9
220
9.0
12.1
15.4
18.8
22.4
13
5.5
8.3
11.3
14.6
18.0
240
9.1
12.2
15.5
19.0
22.6
14
5.6
8.4
11.4
14.7
18.1
260
9.2
12.3
15.6
19.1
22.7
15
5.7
8.5
11.5
14.8
18.2
280
9.3
12.4
15.7
19.2
22.8
16
5.8
8.5
11.6
14.9
18.3
300
9.4
12.5
15.8
19.3
22.9
17
5.8
8.6
11.7
15.0
18.4
325
9.5
12.6
15.9
19.4
23.1
18
5.9
8.7
11.8
15.1
18.5
350
9.6
12.7
16.0
19.5
23.2
19
5.9
8.8
11.9
15.1
18.6
375
9.7
12.8
16.2
19.7
23.3
20
6.0
8.8
11.9
15.2
18.7
400
9.7
12.9
16.2
19.8
23.4
22
6.1
9.0
12.1
15.4
18.8
425
9.8
13.0
16.3
19.8
23.5
24
6.2
9.1
12.2
15.5
19.0
450
9.9
13.1
16.4
19.9
23.6
26
6.3
9.2
12.3
15.6
19.1
475
10.0
13.1
16.5
20.0
23.7
28
6.4
9.3
12.4
15.7
19.2
500
10.0
13.2
16.6
20.1
23.7
30
6.5
9.4
12.5
15.8
19.3
525
10.1
13.3
16.7
20.2
23.8
32
6.6
9.4
12.6
15.9
19.4
550
10.2
13.4
16.7
20.3
23.9
34
6.6
9.5
12.7
16.0
19.5
575
10.2
13.4
16.8
20.3
24.0
36
6.7
9.6
12.8
16.1
19.6
600
10.3
13.5
16.9
20.4
24.0
38
6.8
9.7
12.8
16.2
19.7
650
10.4
13.6
17.0
20.5
24.2
40
6.8
9.7
12.9
16.2
19.8
700
10.5
13.7
17.1
20.6
24.3
42
6.9
9.8
13.0
16.3
19.8
750
10.6
13.8
17.2
20.7
24.4
44
6.9
9.9
13.0
16.4
19.9
800
10.7
13.9
17.3
20.8
24.5
46
7.0
9.9
13.1
16.5
20.0
850
10.8
14.0
17.4
20.9
24.6
48
7.0
10.0
13.2
16.5
20.0
900
10.8
14.1
17.5
21.0
24.7
50
7.1
10.0
13.2
16.6
20.1
950
10.9
14.1
17.5
21.1
24.8

17
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5−標準抵抗性分布(SDR)をもち,平均バイオバーデンが1.0以上であらかじめ定めた
SALを達成するために必要な放射線量(kGy)(続き)
平均バイオ
バーデン
無菌性保証水準 SAL
平均バイオ
バーデン
無菌性保証水準 SAL
10−2
10−3
10−4
10−5
10−6
10−2
10−3
10−4
10−5
10−6
1 000
11.0
14.2
17.6
21.2
24.9
6 200
13.5
16.9
20.4
24.1
27.8
1 050
11.0
14.3
17.7
21.3
24.9
6 500
13.6
17.0
20.5
24.2
27.9
1 100
11.1
14.4
17.8
21.3
25.0
6 800
13.7
17.0
20.6
24.2
28.0
1 150
11.2
14.4
17.8
21.4
25.1
7 100
13.7
17.1
20.7
24.3
28.1
1 200
11.2
14.5
17.9
21.5
25.2
7 400
13.8
17.2
20.7
24.4
28.1
1 250
11.3
14.5
18.0
21.5
25.2
7 700
13.8
17.2
20.8
24.4
28.2
1 300
11.3
14.6
18.0
21.6
25.3
8 000
13.9
17.3
20.8
24.5
28.3
1 350
11.4
14.6
18.1
21.7
25.3
8 500
14.0
17.4
20.9
24.6
28.4
1 400
11.4
14.7
18.1
21.7
25.4
9 000
14.1
17.5
21.0
24.7
28.5
1 450
11.5
14.8
18.2
21.8
25.5
9 500
14.1
17.6
21.1
24.8
28.5
1 500
11.5
14.8
18.2
21.8
25.5
10 000
14.2
17.6
21.2
24.9
28.6
1 550
11.6
14.9
18.3
21.9
25.6
10 500
14.3
17.7
21.3
24.9
28.7
1 600
11.6
14.9
18.3
21.9
25.6
11 000
14.4
17.8
21.3
25.0
28.8
1 650
11.7
14.9
18.4
22.0
25.7
11 500
14.4
17.8
21.4
25.1
28.9
1 700
11.7
15.0
18.4
22.0
25.7
12 000
14.5
17.9
21.5
25.2
28.9
1 750
11.7
15.0
18.5
22.1
25.8
13 000
14.6
18.0
21.6
25.3
29.1
1 800
11.8
15.1
18.5
22.1
25.8
14 000
14.7
18.1
21.7
25.4
29.2
1 850
11.8
15.1
18.6
22.2
25.9
15 000
14.8
18.2
21.8
25.5
29.3
1 900
11.9
15.1
18.6
22.2
25.9
16 000
14.9
18.3
21.9
25.6
29.4
1 950
11.9
15.2
18.6
22.2
25.9
17 000
15.0
18.4
22.0
25.7
29.5
2 000
11.9
15.2
18.7
22.3
26.0
18 000
15.1
18.5
22.1
25.8
29.6
2 100
12.0
15.3
18.8
22.4
26.1
19 000
15.1
18.6
22.2
25.9
29.7
2 200
12.1
15.4
18.8
22.4
26.1
20 000
15.2
18.7
22.3
26.0
29.8
2 300
12.1
15.4
18.9
22.5
26.2
21 000
15.3
18.8
22.4
26.1
29.9
2 400
12.2
15.5
19.0
22.6
26.3
22 000
15.4
18.8
22.4
26.1
29.9
2 500
12.2
15.6
19.0
22.6
26.4
23 000
15.4
18.9
22.5
26.2
30.0
2 600
12.3
15.6
19.1
22.7
26.4
24 000
15.5
19.0
22.6
26.3
30.1
2 700
12.3
15.7
19.1
22.8
26.5
25 000
15.6
19.0
22.6
26.4
30.1
2 800
12.4
15.7
19.2
22.8
26.5
26 000
15.6
19.1
22.7
26.4
30.2
2 900
12.4
15.8
19.3
22.9
26.6
27 000
15.7
19.1
22.8
26.5
30.3
3 000
12.5
15.8
19.3
22.9
26.6
28 000
15.7
19.2
22.8
26.5
30.3
3 200
12.6
15.9
19.4
23.0
26.8
29 000
15.8
19.3
22.9
26.6
30.4
3 400
12.7
16.0
19.5
23.1
26.9
30 000
15.8
19.3
22.9
26.6
30.4
3 600
12.8
16.1
19.6
23.2
26.9
32 000
15.9
19.4
23.0
26.8
30.6
3 800
12.8
16.2
19.7
23.3
27.0
34 000
16.0
19.5
23.1
26.9
30.7
4 000
12.9
16.3
19.8
23.4
27.1
36 000
16.1
19.6
23.2
26.9
30.8
4 200
13.0
16.3
19.8
23.5
27.2
38 000
16.2
19.7
23.3
27.0
30.8
4 400
13.0
16.4
19.9
23.5
27.3
40 000
16.3
19.8
23.4
27.1
30.9
4 600
13.1
16.5
20.0
23.6
27.3
42 000
16.3
19.8
23.5
27.2
31.0
4 800
13.2
16.5
20.0
23.7
27.4
44 000
16.4
19.9
23.5
27.3
31.1
5 000
13.2
16.6
20.1
23.7
27.5
46 000
16.5
20.0
23.6
27.3
31.2
5 300
13.3
16.7
20.2
23.8
27.6
48 000
16.5
20.0
23.7
27.4
31.2
5 600
13.4
16.8
20.3
23.9
27.7
50 000
16.6
20.1
23.7
27.5
31.3
5 900
13.5
16.8
20.4
24.0
27.8
54 000
16.7
20.2
23.9
27.6
31.4
18
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5−標準抵抗性分布(SDR)をもち,平均バイオバーデンが1.0以上であらかじめ定めた
SALを達成するために必要な放射線量(kGy)(続き)
平均バイオ
バーデン
無菌性保証水準 SAL
平均バイオ
バーデン
無菌性保証水準 SAL
10−2
10−3
10−4
10−5
10−6
10−2
10−3
10−4
10−5
10−6
58 000
16.8
20.3
24.0
27.7
31.5
280 000
19.2
22.8
26.5
30.3
34.2
62 000
16.9
20.4
24.1
27.8
31.7
300 000
19.3
22.9
26.6
30.4
34.3
66 000
17.0
20.5
24.2
27.9
31.8
320 000
19.4
23.0
26.8
30.6
34.4
70 000
17.1
20.6
24.3
28.0
31.9
340 000
19.5
23.1
26.9
30.7
34.5
75 000
17.2
20.7
24.4
28.2
32.0
360 000
19.6
23.2
26.9
30.8
34.6
80 000
17.3
20.8
24.5
28.3
32.1
380 000
19.7
23.3
27.0
30.8
34.7
85 000
17.4
20.9
24.6
28.4
32.2
400 000
19.8
23.4
27.1
30.9
34.8
90 000
17.5
21.0
24.7
28.5
32.3
420 000
19.8
23.5
27.2
31.0
34.9
95 000
17.6
21.1
24.8
28.5
32.4
440 000
19.9
23.5
27.3
31.1
35.0
100 000
17.6
21.2
24.9
28.6
32.5
460 000
20.0
23.6
27.3
31.2
35.0
110 000
17.8
21.3
25.0
28.8
32.6
480 000
20.0
23.7
27.4
31.2
35.1
120 000
17.9
21.5
25.2
28.9
32.8
500 000
20.1
23.7
27.5
31.3
35.2
130 000
18.0
21.6
25.3
29.1
32.9
540 000
20.2
23.9
27.6
31.4
35.3
140 000
18.1
21.7
25.4
29.2
33.0
580 000
20.3
24.0
27.7
31.5
35.4
150 000
18.2
21.8
25.5
29.3
33.1
620 000
20.4
24.1
27.8
31.7
35.5
160 000
18.3
21.9
25.6
29.4
33.3
660 000
20.5
24.2
27.9
31.8
35.6
170 000
18.4
22.0
25.7
29.5
33.4
700 000
20.6
24.3
28.0
31.9
35.7
180 000
18.5
22.1
25.8
29.6
33.4
750 000
20.7
24.4
28.2
32.0
35.9
190 000
18.6
22.2
25.9
29.7
33.5
800 000
20.8
24.5
28.3
32.1
36.0
200 000
18.7
22.3
26.0
29.8
33.6
850 000
20.9
24.6
28.4
32.2
36.1
220 000
18.8
22.4
26.1
29.9
33.8
900 000
21.0
24.7
28.5
32.3
36.2
240 000
19.0
22.6
26.3
30.1
33.9
950 000
21.1
24.8
28.5
32.4
36.3
260 000
19.1
22.7
26.4
30.2
34.1
1000 000
21.2
24.9
28.6
32.5
36.3
注記1 この表には,高水準のバイオバーデンが示されているが,このような水準が普通に存在することを意味
するものではない。
注記2 表に記載する数値は,方法1の第3,第4及び第6段階で用いる。
7.3
平均バイオバーデンが1.0以上の単一製造バッチの製品に方法1を適用する手順
7.3.1
理論的根拠
この方法は,7.2の複数製造バッチに対する方法1の変法であり,単一製造バッチの滅菌線量の確立だけ
に用いることを目的としている。この方法は,バイオバーデンの放射性抵抗性がSDRの微生物群の抵抗性
以下であるという実験的検証に基づいて滅菌線量を確立する方法である。
7.3.2
一般
この方法1の変法を適用するには,次の6段階の手順を実施しなければならない。
7.3.3
第1段階:SALの選択及び製品サンプルの入手
7.3.3.1
製品の使用目的に必要なSALを記録する。
7.3.3.2
5.1,5.2及び5.3に従って,単一バッチから10個の製品試料を採取する。
注記 SIPが1未満の場合は,その妥当性を検証するために,追加の製品が必要になることがある(5.2.5
参照)。
7.3.4
第2段階:平均バイオバーデンの決定
7.3.4.1
バイオバーデンの決定に補正係数を適用するか否かを決定する。
19
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記 方法1を用いて滅菌線量を確立する場合は,補正係数を適用しないでバイオバーデンを決定し
てもよい。補正係数を適用しない場合には,バイオバーデンを過少に見積もることがあり,検
定線量試験が不合格となるリスクが増加する可能性がある。
7.3.4.2
採取した製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,平均バイオバーデンの決定のため10個の製品試料をまとめても
よい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろより大
きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
7.3.5
第3段階:検定線量の取得
表5から平均バイオバーデンに対応するSAL 10−2の線量を得る。
平均バイオバーデンが表5にない場合は,平均バイオバーデンより大きく,表にある最も近い値を用い
る。
これから得られる線量を検定線量とする。
SIPを用いて無菌性の試験を実施する場合は,SIP平均バイオバーデンを用いて検定線量を求める。
7.3.6
第4段階:検定線量試験の実施
7.3.6.1
単一製造バッチの製品から100個の製品試料を採取する。
7.3.6.2
これらの製品試料を検定線量で照射する。
製品試料に照射した最大線量は,検定線量からその10 %を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,検定線量の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,検定線量からその10 %を超えた場合は,検定線量試験をやり直さなけ
ればならない。
製品試料に照射した最大線量と最小線量との算術平均が,検定線量の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量が検定線量の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(7.3.7.1参照)には,検定線量試験をやり直す必要はない。
7.3.6.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
7.3.7
第5段階:結果の判定
7.3.7.1
実施した100個の無菌性の試験で陽性数が2以下の場合は,検定線量試験は合格である。
7.3.7.2
無菌性の試験の陽性数が3以上の場合は,検定線量試験は不合格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
検定線量の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に100
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当する検定線量(7.3.5)を使用する。平均バイオバーデンの
評価を変更しなかった場合には,不合格となった検定線量試験と同じ検定線量を使用する。やり直した検
定線量試験の結果は,7.3.7に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
20
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
検定線量の照射又は特定のバイオバーデンに関連する原因でない場合には,この線量設定法は有効ではな
く,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
7.3.8
第6段階:滅菌線量の確立
7.3.8.1
製品全体を使用して検定線量試験に合格した場合は,第3段階で用いた平均バイオバーデンと同
じ平均バイオバーデンを表5から読み取り,製品の滅菌線量を得る。平均バイオバーデンが表5にない場
合は,平均バイオバーデンよりも大きく,表にある最も近い値を用いて,必要とするSALを達成するため
に必要な線量を読み取り,滅菌線量を得る。
7.3.8.2
1.0未満のSIPを使用して検定線量試験に合格した場合は,SIP平均バイオバーデンをSIPで除し
て,製品全体の平均バイオバーデンを求める。製品全体の平均バイオバーデンと同じ平均バイオバーデン
を表5から読み取り,製品の滅菌線量を得る。平均バイオバーデンが表5にない場合は,製品全体の平均
バイオバーデンよりも大きく,表にある最も近い値を用いて,必要とするSALを達成するために必要な線
量を読み取り,滅菌線量を得る。
7.4
平均バイオバーデンが0.1〜0.9の複数又は単一製造バッチの製品に方法1を適用する手順
平均バイオバーデンが0.1〜0.9の製品は,次の事項を除いて複数バッチ(7.2参照)又は単一バッチ(7.3
参照)の方法1の滅菌線量確立の手順に従わなければならない。
a) 表1に従い製品全体を使用しなければならない。
b) バイオバーデンの決定には,補正係数を使用しなければならない。
c) SAL 10−2(検定線量)及び必要とするSALに対応する滅菌線量を得るため,表6を用いなければなら
ない。
注記1 表6の数値は,方法1の線量設定法の第3,第4及び第6段階で使用する。
注記2 実施例は,11.1を参照。
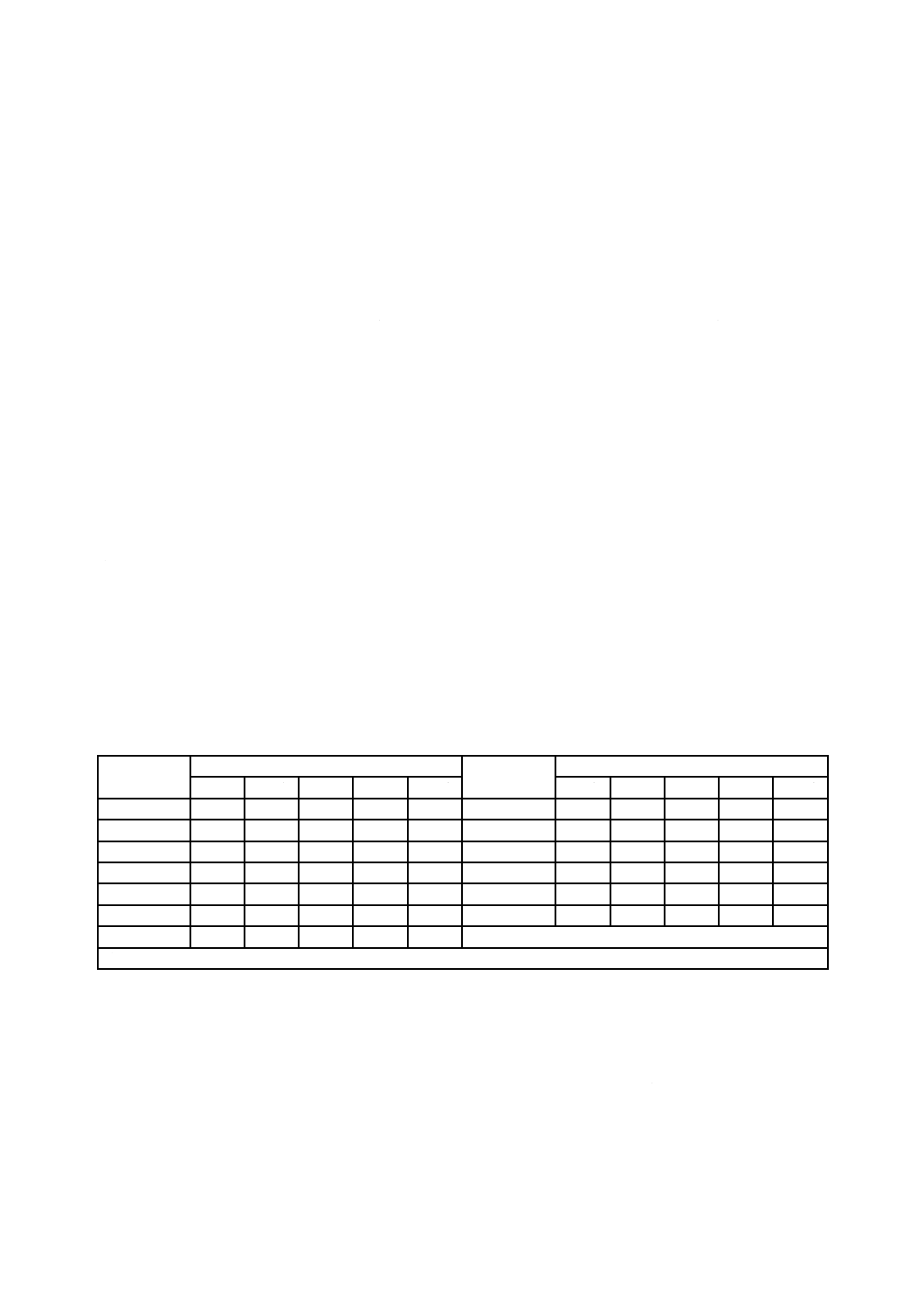
表6−標準抵抗性分布(SDR)をもち,平均バイオバーデンが0.1〜0.9であらかじめ定めた
SALを達成するために必要な放射線量(kGy)
平均バイオ
バーデン
無菌性保証水準 SAL
平均バイオ
バーデン
無菌性保証水準 SAL
10−2
10−3
10−4
10−5
10−6
10−2
10−3
10−4
10−5
10−6
0.10
1.3
3.0
5.2
8.0
11.0
0.45
2.3
4.4
7.0
9.9
13.1
0.15
1.5
3.3
5.7
8.5
11.5
0.50
2.4
4.5
7.1
10.0
13.2
0.20
1.7
3.6
6.0
8.8
11.9
0.60
2.5
4.7
7.3
10.3
13.5
0.25
1.9
3.8
6.3
9.1
12.2
0.70
2.7
4.8
7.5
10.5
13.7
0.30
2.0
4.0
6.5
9.4
12.5
0.80
2.8
5.0
7.7
10.7
13.9
0.35
2.1
4.1
6.7
9.6
12.7
0.90
2.9
5.1
7.8
10.8
14.1
0.40
2.2
4.3
6.8
9.7
12.9
注記 0.9<平均バイオバーデン<1.0の範囲にある場合には,表5の平均バイオバーデン1.0を適用する。
8
方法2:外挿係数決定のための累加線量照射によって得られる陽性率の情報を用いる線量設定法
8.1
理論的根拠
方法2は,微生物が製品に存在する状態での放射線抵抗性に関わる情報を取得することから始まる。こ
の方法は,100個の製品試料のうち1個が無菌でない(すなわち,SAL 10−2)線量を推定するために,一
連の累加線量を照射した製品試料の無菌性の試験の結果を利用する。このような線量を照射した後に生残
する微生物は,初期のバイオバーデンより均一なD10値をもつと推定できる。累加線量試験からこのD10
値を推定し,滅菌線量を決定するため10−2よりも小さいSALへ外挿するのにこの値を用いる。
21
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
滅菌線量の計算値の有効性は,通常,SAL 10−2を達成する線量を超える部分に対する外挿の有効性に依
存する。製品上に存在する微生物の不活化についてのコンピュータシミュレーションを使用した実験プロ
トコルの広範な試験では,実験的に確立された抵抗性分布をもつ微生物群に対してこのような外挿法の妥
当性が確認されている。上記の理論的根拠の詳細及びコンピュータシミュレーションの結果は,参考文献
[11]に示されている。
次に二つの手順,方法2A及び方法2Bについて記載する。
方法2Aは一般的に用いられている方法であるが,方法2Bは非常に低いバイオバーデンで,かつ,変動
の少ない製品に適用するために開発された方法である。方法2Bを適用するための条件は,8.3.1.1にある
規定に適合しなければならない。
注記1 方法2Bは,製品全体(SIPは1.0)を使用することが要求されているが,方法2Aは製品全
体又は製品の一部分(SIPは1.0未満)のいずれでもよい。
方法2を用いて滅菌線量を確立する場合は,バイオバーデンの決定の必要はない。ただし,日常の製品
監視の一部としてバイオバーデンの決定が必要になる(JIS T 0806-1:2010の7.3及び12.1参照)。
A,DS及び滅菌線量の計算は,方法2A及び方法2Bで異なる。したがって,適切な式を間違いなく使用
するよう十分注意を払う必要がある。
線量計算は,小数点以下1位までのデータが望ましい。滅菌線量は,小数点第2位を四捨五入するとよ
い(標準的な丸めの方法)。
注記2 次の手順及び例では,単一製造バッチから取り出した製品から導いた結果を示す場合は,記
号を小文字で示す。三つの製造バッチ全てから取り出した製品から導いた結果を示す場合は,
記号を大文字で示す。
8.2
方法2Aの手順
8.2.1
一般
方法2Aを適用するには,次の5段階の手順を実施しなければならない。
注記 実施例は,11.2.2及び11.2.3を参照。
8.2.2
第1段階:SALの選択及び製品サンプルの入手
8.2.2.1
製品の使用目的に必要なSALを記録する。
8.2.2.2
5.1,5.2及び5.3に従って,独立した三つの製造バッチからそれぞれ280個の製品試料を採取す
る。
注記 SIPが1未満の場合は,その妥当性を検証するために,追加の製品が必要になることがある(5.2.5
参照)。
8.2.3
第2段階:累加線量試験の実施
8.2.3.1
一般
8.2.3.1.1
三つの製造バッチそれぞれについて,20個ずつの製品試料を最初の線量を2 kGyとして,2 kGy
刻みで増加する少なくとも9水準の一連の線量で照射する。
累加線量試験で製品試料に照射した最大線量は,目標累加線量からその10 %又は1.0 kGyのいずれか大
きい線量を超えてはならない。
累加線量試験で製品試料に照射した最大線量と最小線量との算術平均は,目標累加線量の90 %又は1.0
kGyを減じた線量のいずれか小さい方の線量未満であってはならない。
それぞれの累加線量の線量を測定する(5.5参照)。
累加線量試験で製品試料に照射した最大線量が,目標累加線量からその10 %又は1.0 kGyのいずれか大
22
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
きい線量を超えた場合は,該当する累加線量で更に20個の製品試料を照射しなければならない。
累加線量試験で製品試料に照射した最大線量と最小線量との算術平均が,目標累加線量の90 %又は1.0
kGyを減じた線量のいずれか小さい方の線量未満の場合には,該当する累加線量で更に20個の製品試料を
照射しなければならない。
8.2.3.1.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,累加線量ごとの無菌性の試験の
陽性数を記録する。
8.2.3.1.3
この試験結果から,次を求める。
a) A及びFFP(8.2.3.2参照)
b) D*(8.2.3.3参照)
c) CD*バッチ(8.2.3.4参照)
8.2.3.2
A及びFFP
8.2.3.2.1
三つの製造バッチのそれぞれから20個の無菌性の試験のうち少なくとも一つの試験が陰性と
なる一連の累加線量試験の最小線量を決める。この線量をバッチのffpとし,更にその三つのffpから中央
値を求める。二つ又は三つの製造バッチが同じffpを示す場合は,ffp中央値として陽性数が多い又は最大
の陽性数を示すバッチを選択する。
8.2.3.2.2
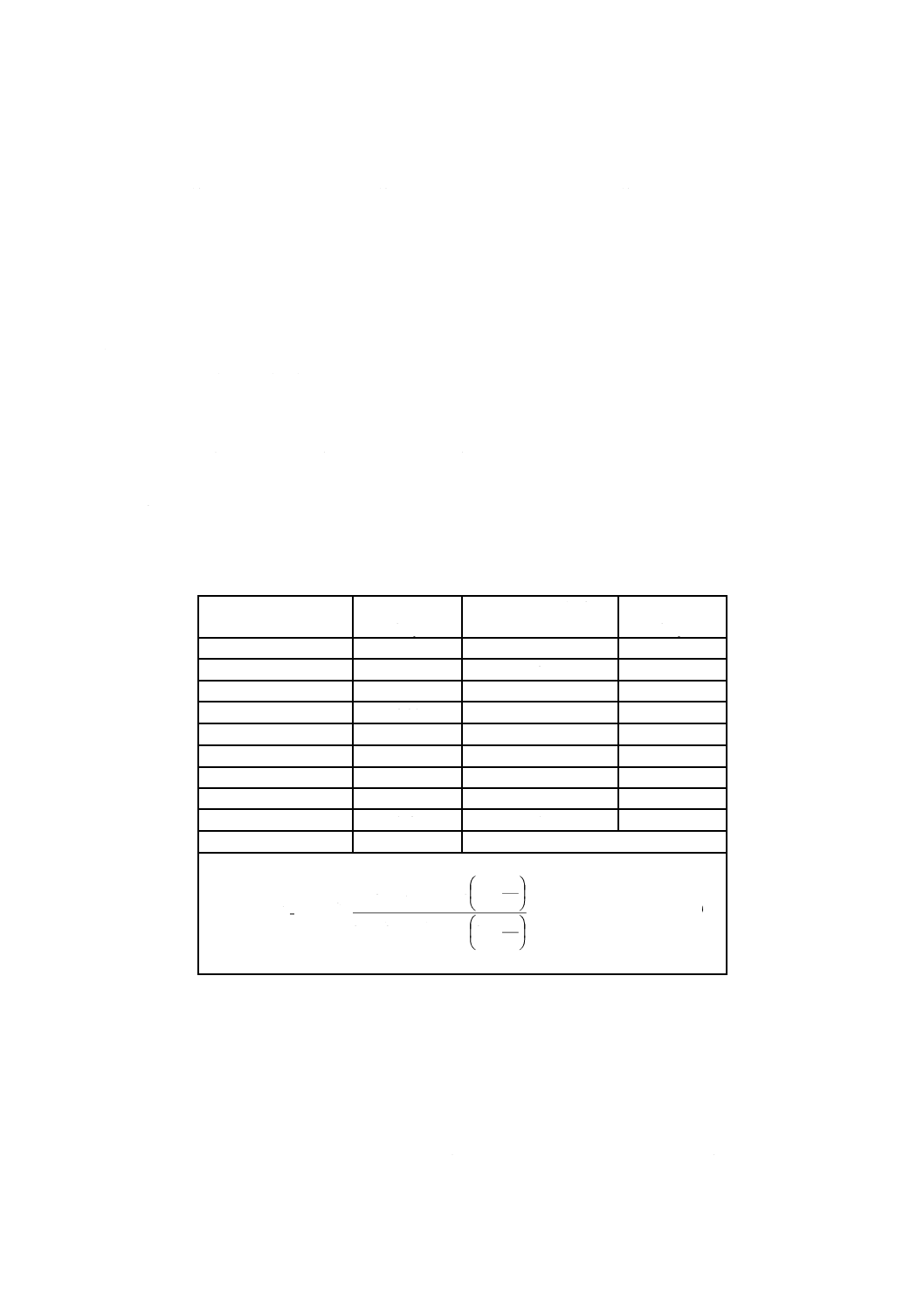
ffp中央値での無菌性の試験の陽性数を用いて表7からAの値を求める。
表7−ffp中央値での無菌性の試験の陽性数に対するAの値(方法2A)
ffp中央値での無菌性
の試験の陽性数
A
kGy
ffp中央値での無菌性
の試験の陽性数
A
kGy
19
0.00
9
0.79
18
0.13
8
0.87
17
0.22
7
0.95
16
0.31
6
1.05
15
0.38
5
1.15
14
0.45
4
1.28
13
0.52
3
1.43
12
0.58
2
1.65
11
0.65
1
2.00
10
0.72
注記 Aは式(1)を用いて求める。
(
)
(
)
(
)
−
−
×
=
19
20
log
log
20
log
log
20
log
log
20
log
log
kGy
2
e
10
e
10
e
10
e
10
n
A
······························· (1)
ここに,n:陰性となる無菌性の試験の数[10]
8.2.3.2.3
FFPは,式(2)を用いて求める。
FFP=ffp中央値−A ···································································· (2)
8.2.3.3
D*
8.2.3.3.1
三つの製造バッチそれぞれについて,次のいずれかでd*を求める。
a) 一連の累加線量試験において,全ての無菌性の試験の結果が陰性となる二つの連続した線量の低い方
の線量で,それ以後の累加線量試験で二つ以上の陽性のないものを見付ける。
b) 20個の無菌性の試験のうち一つが陽性となる線量で,全ての試験が陰性となる累加線量がその直前に
23
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
あり,全ての試験が陰性となる累加線量が直後にあるものを見付ける。
8.2.3.3.2
三つの製造バッチのいずれもが8.2.3.3.1 a)又はb)に適合しない場合は,累加線量試験は無効で
ある。この場合は,試験方法が適切であるか否かを調査し,是正処置を行った後に累加線量試験をやり直
してもよい。
8.2.3.3.3
次のいずれかに従ってD*を決定する。
a) バッチd*の最大値とバッチd*の中央値との差が5 kGy未満の場合は,バッチd*の中央値をD*とする。
b) バッチd*の最大値とバッチd*の中央値との差が5 kGy以上の場合は,バッチd*の最大値をD*とする。
8.2.3.4
CD*バッチ
d*とD*とが同じとなるバッチを求め,これをCD*バッチとする。D*とd*とが等しくなるバッチが複数
ある場合は,そのバッチの中から無作為に一つを選択しCD*バッチとする。CD*バッチのうち残った製品
試料は,方法2Aの第3段階で用いる。三つの製造バッチから選んで残った製品を保管する場合は,製品
の微生物の生育を支持する能力を考慮することが望ましい。必要な場合は,第4のバッチをCD*バッチと
してもよい。
8.2.4
第3段階:検定線量試験の実施
8.2.4.1
CD*バッチから100個の製品試料を採取し,D*の線量で照射する。
製品試料に照射した最大線量は,D*からその10 %又は1 kGyのいずれか大きい線量を超えないことが
望ましい。
製品試料に照射した最大線量と最小線量との算術平均は,D*の90 %又はD*から1.0 kGyを減じた線量
のいずれか小さい方の線量未満ではない方がよい。
線量を測定する(5.5参照)。照射された最大線量をDD*とする。
注記 線量が上限又は下限を超えたときは,CD*の値によって措置が異なる(8.2.4.2参照)。
8.2.4.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
この値をCD*とする。
注記1 CD*はFNP(8.2.5参照)及びDS(8.2.6参照)を決定するために用いる。
CD*が0で,かつ,DD*がD*からその10 %又は1.0 kGyのいずれか大きい線量を超えた場合は,検定線
量試験をやり直さなければならない。
CD*が1〜15で,かつ,DD*がD*からその10 %又は1.0 kGyのいずれか大きい線量を超えた場合には,
検定線量試験をやり直す必要はない。
注記2 最初に測定したDD*に比べ低いFNP及びDS値となる可能性のある,より小さいDD*を得る
目的のために検定線量試験をやり直してもよい。
注記3 1〜15のCD*は,DD*と相まってSAL 10−2を達成する推定線量を与える。D*からその10 %
又は1.0 kGyのいずれか大きい線量を超えるDD*を用いることは,FNP及びDSが安全側の
D**及び滅菌線量を与えるので許容している。
CD*が16以上で,かつ,製品試料に照射したDD*と最小線量との算術平均が,D*の90 %又はD*から
1.0 kGyを減じた線量のいずれか小さい方の線量未満の場合は,検定線量試験をやり直してもよい。この算
術平均が,D*の90 %又はD*から1.0 kGyを減じた線量のいずれか小さい方の線量未満でない場合には,
無菌性の試験で16以上の陽性が出た原因を究明し,是正措置を講じ,D*を再決定する。
8.2.5
第4段階:結果の判定
この試験結果から,次のいずれかによってFNPを求める。
a) CD*≦2の場合は,FNP=DD*
24
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 3≦CD*≦9の場合は,FNP=DD*+2.0 kGy
c) 10≦CD*≦15の場合は,FNP=DD*+4.0 kGy
d) 16≦CD*の場合は,原因を究明し,是正処置を講じ,D*を再決定する。
8.2.6
第5段階:滅菌線量の確立
8.2.6.1
FNPとFFPとの差の値に応じて,式(3)又は式(4)を用いてFFP及びFNPからDSを求める。
(FNP−FFP)<10 kGyの場合は,式(3)を用いる。
DS=2+0.2×(FNP−FFP) ···························································· (3)
注記 式(3)において(FNP−FFP)<0の場合は,(FNP−FFP)=0とする。
(FNP−FFP)≧10 kGyの場合は,式(4)を用いる。
DS=0.4×(FNP−FFP) ································································· (4)
8.2.6.2
式(5)を用いてD**を求める。
D**=DD*+[log (CD*)]×DS ························································ (5)
注記 CD*=0の場合は,[log (CD*)]=0とする。
8.2.6.3
滅菌線量は,式(6)を用いて求める。
滅菌線量=D**+[−log (SAL)−log (SIP)−2]×DS ···························· (6)
ここに, D**: SAL 10−2を与える最終推定線量値
SAL: あらかじめ定めた製品のSAL
SIP: D**及びDSを求めるのに使用した製品の一部分(分割試料)
DS: DD*で生残する微生物の90 %を不活化するのに必要な線量の
推定値
線量計算は,小数点以下1位までのデータが望ましい。滅菌線量は,小数第2位を四捨五入するとよい
(標準的な丸めの方法)。
注記 式(6)のlog (SIP)は,線量設定に使用している製品の一部分に対する補正係数である。
8.3
方法2Bの手順
8.3.1
一般
8.3.1.1
方法2Bを適用するには,次の三つの要求事項に適合しなければならない。
a) 製品試料全体を使用する(SIPは1.0)。
b) いずれの累加線量を照射した後でも,無菌性の試験で陽性数が14を超えない。
c) FNPが5.5 kGyを超えない。
8.3.1.2
方法2Bを適用するには,次の5段階の手順を実施しなければならない。
注記 実施例は,11.2.4を参照。
8.3.2
第1段階:SALの選択及び製品サンプルの入手
8.3.2.1
製品の使用目的に必要なSALを記録する。
8.3.2.2
5.1及び5.3に従って,独立した三つの製造バッチからそれぞれ260個の製品試料を採取する。
8.3.3
第2段階:累加線量試験の実施
8.3.3.1
一般
8.3.3.1.1
三つの製造バッチそれぞれについて,20個ずつの製品試料を最初の線量を1 kGyとして,1 kGy
刻みで増加する少なくとも8水準の一連の線量で照射する。
1 kGyの目標累加線量で製品試料に照射した最大線量は,1.2 kGyを超えてはならない。また,他の目標
累加線量では,最大線量が目標累加線量からその10 %又は0.5 kGyのいずれか大きい線量を超えてはなら
ない。
25
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 kGyの目標累加線量で最大線量と最小線量との算術平均は0.8 kGy未満,他の目標累加線量では,この
平均線量が目標累加線量の90 %又は0.5 kGyを減じた線量のいずれか小さい方の線量未満であってはなら
ない。
それぞれの累加線量の線量を測定する(5.5参照)。
1 kGyの目標累加線量で製品試料に照射した最大線量が1.2 kGyを超え,他の目標累加線量では,最大線
量が目標累加線量からその10 %又は0.5 kGyのいずれか大きい線量を超えた場合には,該当する累加線量
で更に20個の製品試料を照射しなければならない。
1 kGyの目標累加線量で最大線量と最小線量との算術平均は0.8 kGy未満,他の目標累加線量では,この
平均線量が目標累加線量の90 %又は0.5 kGyを減じた線量のいずれか小さい方の線量未満の場合には,該
当する累加線量で更に20個の製品試料を照射しなければならない。
8.3.3.1.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,累加線量ごとの無菌性の試験の
陽性数を記録する。
8.3.3.1.3
この試験結果から,次を求める。
a) A及びFFP(8.3.3.2参照)
b) D*(8.3.3.3参照)
c) CD*バッチ(8.3.3.4参照)
8.3.3.2
A及びFFP
8.3.3.2.1
三つの製造バッチのそれぞれから20個の無菌性の試験のうち少なくとも一つの試験が陰性と
なる一連の累加線量試験の最小線量を求める。この線量をバッチのffpとし,更にその三つのffpから中央
値を求める。二つ又は三つの製造バッチが同じffpを示す場合は,ffp中央値として陽性数が多い又は最大
の陽性数を示すバッチを選択する。
8.3.3.2.2
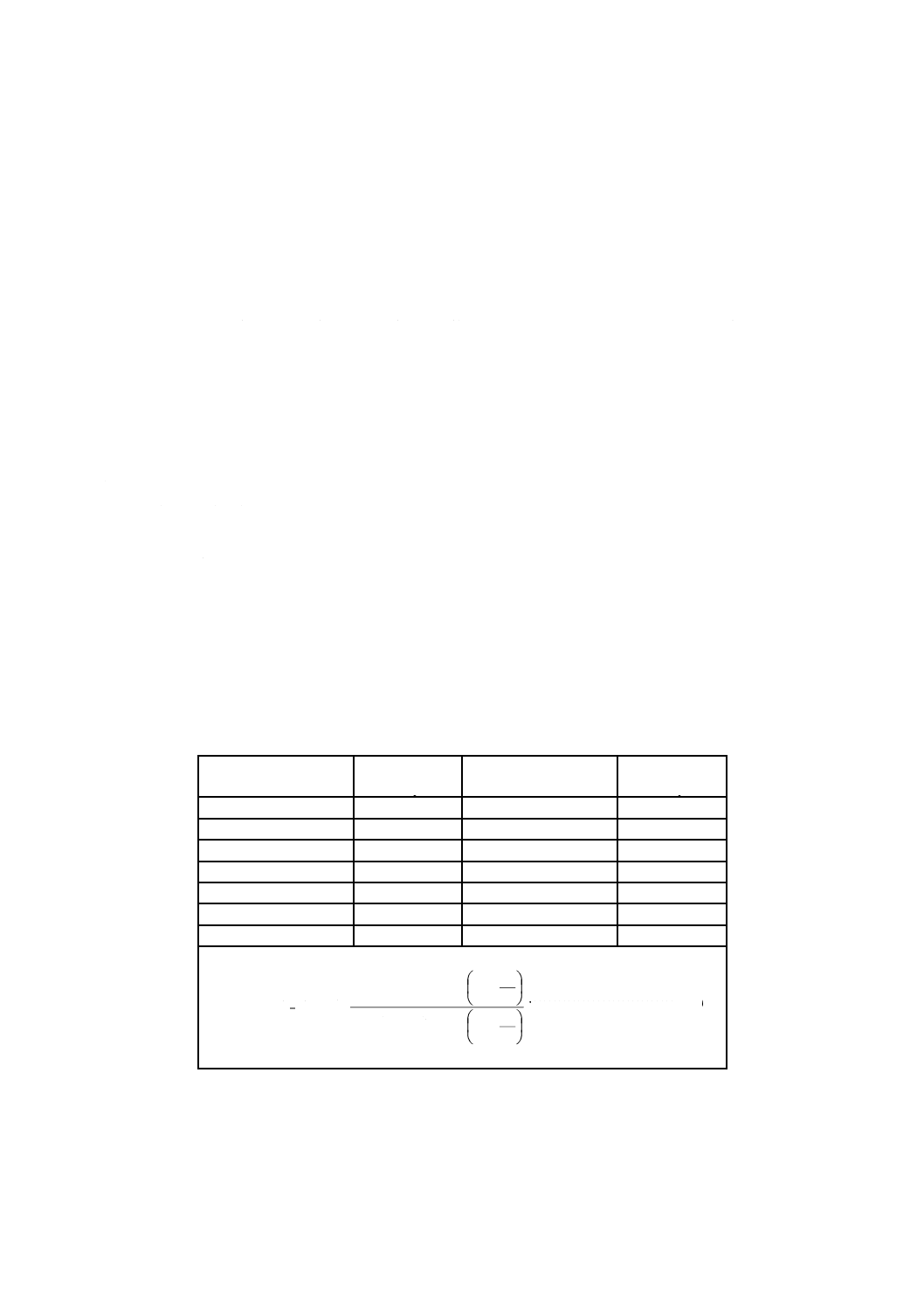
ffp中央値での無菌性の試験の陽性数を用いて表8からAの値を求める。
表8−ffp中央値での無菌性の試験の陽性数に対するAの値(方法2B)
ffp中央値での無菌性
の試験の陽性数
A
kGy
ffp中央値での無菌性
の試験の陽性数
A
kGy
14
0.22
7
0.48
13
0.26
6
0.52
12
0.29
5
0.58
11
0.32
4
0.64
10
0.36
3
0.72
9
0.40
2
0.82
8
0.44
1
1.00
注記 Aは式(7)を用いて求める。
(
)
(
)
(
)
−
−
×
=
19
20
log
log
20
log
log
20
log
log
20
log
log
kGy
1
e
10
e
10
e
10
e
10
n
A
································ (7)
ここに,n:陰性となる無菌性の試験の数[10]
8.3.3.2.3
FFPは,式(2)を用いて求める(8.2.3.2.3参照)。
8.3.3.3
D*
8.3.3.3.1
三つの製造バッチそれぞれについて,次のいずれかでd*を求める。
26
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
a) 一連の累加線量試験において,全ての無菌性の試験の結果が陰性となる二つの連続した線量の低い方
の線量で,それ以後の累加線量試験で二つ以上の陽性のないものを見付ける。
b) 20個の無菌性の試験のうち一つが陽性となる線量で,全ての試験が陰性となる累加線量がその直前に
あり,全ての試験が陰性となる累加線量が直後にあるものを見付ける。
8.3.3.3.2
三つの製造バッチのいずれもが8.3.3.3.1 a)又はb)に適合しない場合は,累加線量試験は無効で
ある。この場合は,試験方法が適切であるか否かを調査し,是正処置を行った後に累加線量試験をやり直
してもよい。
8.3.3.3.3
次のいずれかに従ってD*を決定する。
a) バッチd*の最大値とバッチd*の中央値との差が5 kGy未満の場合は,バッチd*の中央値をD*とする。
b) バッチd*の最大値とバッチd*の中央値との差が5 kGy以上の場合は,バッチd*の最大値をD*とする。
8.3.3.4
CD*バッチ
d*とD*とが同じとなるバッチを求め,これをCD*バッチとする。D*とd*とが等しくなるバッチが複数
ある場合は,そのバッチの中から無作為に一つを選択しCD*バッチとする。CD*バッチのうち残った製品
試料は,方法2Bの第3段階で用いる。三つの製造バッチから選んで残った製品を保管する場合は,製品
の微生物の生育を支持する能力を考慮することが望ましい。必要な場合は,第4のバッチをCD*バッチと
してもよい。
8.3.4
第3段階:検定線量試験の実施
8.3.4.1
CD*バッチから100個の製品試料を採取し,D*の線量で照射する。
製品試料に照射した最大線量は,D*からその10 %又は1.0 kGyのいずれか大きい線量を超えないことが
望ましい。
製品試料に照射した最大線量と最小線量との算術平均は,D*の90 %又はD*から1.0 kGyを減じた線量
のいずれか小さい方の線量未満ではない方がよい。
線量を測定する(5.5参照)。照射された最大線量をDD*とする。
注記 線量が上限又は下限を超えたときは,CD*の値によって措置が異なる(8.3.4.2参照)。
8.3.4.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
この値をCD*とする。
注記1 CD*は,FNP(8.3.5参照)及びDS(8.3.6参照)を決定するために用いる。
CD*が0で,かつ,DD*がD*からその10 %又は1.0 kGyのいずれか大きい線量を超えた場合は,検定線
量試験をやり直さなければならない。
CD*が1〜15で,かつ,DD*がD*からその10 %又は1.0 kGyのいずれか大きい線量を超えた場合には,
検定線量試験をやり直す必要はない。
注記2 最初に測定したDD*に比べ低いFNP及びDS値となる可能性のある,より小さいDD*を得る
目的のために検定線量試験をやり直してもよい。
注記3 1〜15のCD*は,DD*と相まってSAL 10−2を達成する推定線量を与える。D*からその10 %
又は1.0 kGyのいずれか大きい線量を超えるDD*を用いることは,FNP及びDSが安全側の
D**及び滅菌線量を与えるので許容している。
CD*が16以上で,かつ,製品試料に照射したDD*と最小線量との算術平均が,D*の90 %又はD*から
1.0 kGyを減じた線量のいずれか小さい方の線量未満の場合は,検定線量試験をやり直してもよい。この算
術平均が,D*の90 %又はD*から1.0 kGyを減じた線量のいずれか小さい方の線量未満でない場合には,
無菌性の試験で16以上の陽性が出た原因を究明し,是正措置を講じ,D*を再決定する。
27
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
8.3.5
第4段階:結果の判定
この試験結果から,次のいずれかによってFNPを求める。
a) CD*≦2の場合は,FNP=DD*
b) 3≦CD*≦9の場合は,FNP=DD*+2.0 kGy
c) 10≦CD*≦15の場合は,FNP=DD*+4.0 kGy
d) 16≦CD*の場合は,原因を究明し,是正処置を講じ,D*を再決定する。
8.3.6
第5段階:滅菌線量の確立
8.3.6.1
式(8)を用いてFFP及びFNPからDS を求める。
DS=1.6+0.2×(FNP−FFP) ·························································· (8)
注記 式(8)において(FNP−FFP)<0の場合は,(FNP−FFP)=0とする。
8.3.6.2
式(5)を用いてD**を求める(8.2.6.2参照)。
8.3.6.3
滅菌線量は,式(9)を用いて求める。
滅菌線量=D**+[−log (SAL)−2]×DS ·········································· (9)
ここに, D**: SAL 10−2を与える最終推定線量値
SAL: あらかじめ定めた製品のSAL
DS: DD*で生残する微生物の90 %を不活化するのに必要な線量の
推定値
線量計算は,小数点以下1位までのデータが望ましい。滅菌線量は,小数第2位を四捨五入するとよい
(標準的な丸めの方法)。
9
VDmax法−滅菌線量としての25 kGy又は15 kGyの実証
9.1
理論的根拠
選択した滅菌線量の実証方法は,実施面では線量設定法の方法1(箇条7参照)と類似している。この
方法の場合もバイオバーデンの決定及び検定線量試験を実施する必要がある。
滅菌線量の実証を行うこの方法では,滅菌前の製品に存在するバイオバーデンが,選択した滅菌線量で
SAL 10−6を達成するのに相当する最大抵抗性をもつ微生物群より,小さい放射線抵抗性を示すことを検証
する。検証は,検定線量試験で照射した10個の製品試料を用いSAL 10−1で行う。この抵抗性をもつ微生
物群に対してSAL 10−1での線量(最大検定線量,VDmax)は,バイオバーデン,滅菌線量及び関連する最
大抵抗性に特有なものである。ある特定のバイオバーデン及び滅菌線量における最大抵抗性を確立する場
合は,方法1の基礎となるSDR(表3参照)の様々な抵抗性の構成要素について考慮されている。SAL 10 − 6
の達成に重大な影響を及ぼすSDRの高抵抗性の構成要素は,この実証法の基礎になる最大抵抗性を定義す
るために用いられる。このような方法でSDR及び方法1における安全度を維持している(参考文献[15],
[16]及び[17]参照)。
具体的には,まず平均バイオバーデンを決定し,この平均バイオバーデンに対応するVDmax線量を表か
ら読み取る。この値が,検定線量試験を実施するときの線量となる。10個の製品試料又は分割試料にVDmax
線量を照射し,各々の製品試料を個別に無菌性の試験を行う。10個の無菌性の試験のうち陽性数が1以下
の場合は,あらかじめ選択した滅菌線量を実証したことになる。
この規格で示すVDmax法は,選択した25 kGy及び15 kGyの滅菌線量についてのものである。25 kGyの
方法は,平均バイオバーデンが1 000以下(9.2,9.3及び表9参照)の製品に適用し,15 kGyはバイオバ
ーデンが1.5以下(9.4,9.5及び表10参照)の製品だけに用いる。15 kGyをVDmax法に含めることは,低
28
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
い平均バイオバーデンの製品の滅菌線量確立に使用する方法1の代替法となる。二つのVDmax法の適用及
びそれらに関連する一連の検定線量値を区別するために,VDmaxに“25”又は“15”を上付文字として加
えて,VDmax25及びVDmax15と表記する。
注記 表9に示す様々な平均バイオバーデンに対するVDmax25の値を検討すると,バイオバーデンと
VDmaxの値との関係に変化があることが分かる。バイオバーデンが80に達するまで増加するに
従い,VDmaxは当然想定されるように徐々に増加する。しかし,バイオバーデンが80のとき
VDmax25は最大となり,これより大きいバイオバーデンでは,対応するVDmax値は減少する。
VDmax15の値でも増加してから減少に転ずるという類似の挙動が見られる(表10参照)。この挙
動はVDmax値の表又は計算の誤りではなく,VDmax法に方法1と同等の安全度を見込んだため
生じた必然的な結果である(参考文献[17]参照)。
9.2
複数製造バッチにVDmax25法を適用する手順
9.2.1
一般
9.2.1.1
この方法は,製品のバッチ平均バイオバーデンが1 000以下の場合だけに適用しなければならな
い。
注記 三つのバッチ平均バイオバーデン(9.2.3.2参照)の全てが1 000以下でなければならない。
9.2.1.2
平均バイオバーデンが0.9以下の製品試料にVDmax25法を適用する場合は,表1に従って製品試料
全体を用いなければならないが,平均バイオバーデンが0.9を超える製品については,SIPを用いてもよい
(5.2.5参照)。
9.2.1.3
VDmax25法を適用するには,次の5段階の手順を実施しなければならない。
注記 実施例は,11.3を参照。
9.2.2
第1段階:製品サンプルの入手
5.1,5.2及び5.3に従って,独立した三つの製造バッチからそれぞれ10個の製品試料を採取する。
注記 SIPが1未満の場合は,その妥当性を検証するために,追加の製品が必要になることがある(5.2.5
参照)。
9.2.3
第2段階:平均バイオバーデンの決定
9.2.3.1
バイオバーデンの決定には,補正係数(JIS T 11737-1参照)を適用する。
9.2.3.2
採取した製品試料のバイオバーデンを決定し,次を計算する。
a) 三つの製品バッチのそれぞれについての製品試料の平均バイオバーデン(バッチ平均バイオバーデン)
b) 全ての製品試料の平均バイオバーデン(全平均バイオバーデン)
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,バッチ平均バイオバーデンの決定のため10個の製品試料をまと
めてもよい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろ
より大きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
9.2.3.3
三つのバッチ平均バイオバーデンと全平均バイオバーデンとを比較して,バッチ平均バイオバー
デンのいずれかが全平均バイオバーデンの2倍以上であるかを調べる。
29
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.2.4
第3段階:VDmax25の取得
次のいずれかを用いて,表9から平均バイオバーデンに対応するSIP=1.0 VDmax25を求める。
a) バッチ平均バイオバーデンのいずれか一つが,全平均バイオバーデンの2倍以上の場合は,バッチ平
均バイオバーデンの最大値を用いる。
b) それぞれのバッチ平均バイオバーデンが,全平均バイオバーデンの2倍未満の場合は,全平均バイオ
バーデンを用いる。
SIPが1.0で平均バイオバーデンが表9にない場合は,平均バイオバーデンよりも大きく,表にある最も
近い値を用いる。
SIPが1.0未満の場合は,SIP平均バイオバーデンをSIPで除して製品試料全体(SIPは1.0)に対する平
均バイオバーデンを計算する。平均バイオバーデンが表9にない場合は,SIP=1.0 VDmax25を求めるために,
平均バイオバーデンより大きく,表にある最も近い値を用い,かつ,対応するSIP線量減少係数を用いる。
注記 平均バイオバーデンが0.9以下の製品には,1.0未満のSIPを使用してはならない(9.2.1.2参照)。
式(10)を用いてSIP VDmax25を計算する(参考文献[17]参照)。
SIP VDmax25線量=(SIP=1.0 VDmax25)+(SIP線量減少係数)×log(SIP) ··· (10)

30
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表9−平均バイオバーデンが1 000以下の場合のVDmax25及びSIP線量減少係数の値
平均バイオ
バーデン
SIP=1.0 VDmax25
kGy
SIP線量減少係数
kGy
平均バイオ
バーデン
SIP=1.0 VDmax25
kGy
SIP線量減少係数
kGy
≦0.1
0.0
a)
40
8.6
3.29
0.15
0.9
a)
45
8.7
3.27
0.20
1.4
a)
50
8.8
3.25
0.25
1.8
a)
55
8.9
3.23
0.30
2.2
a)
60
8.9
3.21
0.35
2.5
a)
65
9.0
3.20
0.40
2.7
a)
70
9.1
3.19
0.45
2.9
a)
75
9.1
3.17
0.50
3.1
a)
80
9.2
3.15
0.60
3.4
a)
85
9.1
3.11
0.70
3.6
a)
90
9.1
3.08
0.80
3.8
a)
95
9.1
3.05
0.90
4.0
a)
100
9.0
3.01
1.0
4.2
4.17
110
9.0
2.96
1.5
4.8
4.05
120
9.0
2.91
2.0
5.2
3.97
130
8.9
2.86
2.5
5.5
3.91
140
8.9
2.83
3.0
5.7
3.86
150
8.9
2.79
3.5
5.9
3.82
160
8.8
2.76
4.0
6.1
3.79
170
8.8
2.72
4.5
6.2
3.76
180
8.8
2.69
5.0
6.3
3.73
190
8.7
2.67
5.5
6.5
3.71
200
8.7
2.64
6.0
6.6
3.69
220
8.7
2.60
6.5
6.7
3.67
240
8.6
2.56
7.0
6.7
3.65
260
8.6
2.52
7.5
6.8
3.64
280
8.6
2.49
8.0
6.9
3.62
300
8.6
2.46
8.5
7.0
3.61
325
8.5
2.43
9.0
7.0
3.59
350
8.5
2.40
9.5
7.1
3.58
375
8.5
2.37
10
7.1
3.57
400
8.4
2.34
11
7.2
3.55
425
8.4
2.32
12
7.3
3.53
450
8.4
2.30
13
7.4
3.51
475
8.4
2.28
14
7.5
3.50
500
8.4
2.26
15
7.6
3.48
525
8.3
2.24
16
7.6
3.47
550
8.3
2.22
17
7.7
3.46
575
8.3
2.21
18
7.8
3.45
600
8.3
2.19
19
7.8
3.43
650
8.3
2.16
20
7.9
3.42
700
8.2
2.14
22
8.0
3.40
750
8.2
2.12
24
8.1
3.39
800
8.2
2.09
26
8.1
3.37
850
8.2
2.07
28
8.2
3.36
900
8.1
2.05
30
8.3
3.34
950
8.1
2.04
35
8.4
3.31
1000
8.1
2.02
注記 SIP=1.0 VDmax25が0.0 kGyの場合には,製品試料は照射しない。
注a) 適用せず。平均バイオバーデンが0.9以下では,製品全体(SIPは1.0)を用いるのでSIP減少係数はない。
31
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.2.5
第4段階:検定線量試験の実施
9.2.5.1
単一製造バッチの製品から10個の製品試料を採取する。第4段階で実施するための10個の製品
試料は,第2段階のバイオバーデンの決定に使用したバッチの一つから採取するか又は通常の生産条件で
製造した第4のバッチから採取してもよい(5.3参照)。
9.2.5.2
表9から得たVDmax25又は式(10)で求めたVDmax25のうち適切な方でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax25からその10 %を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25からその10 %を超えた場合は,検定線量試験をやり直さなけ
ればならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量がVDmax25の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(9.2.6.1参照)には,検定線量試験をやり直す必要はない。
9.2.5.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
9.2.6
第5段階:結果の判定
9.2.6.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり滅菌線量
として25 kGyは実証されたものとする。
9.2.6.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(9.2.7参照)を実施する。
9.2.6.3
無菌性の試験で陽性数が3以上の場合は,滅菌線量は不十分な可能性があり検定線量試験は不合
格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax25の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当するVDmax25(9.2.4)を使用する。平均バイオバーデンの評
価を変更しなかった場合には,不合格となった検定線量試験と同じVDmax25を使用する。やり直した検定
線量試験の結果は,9.2.6に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax25の照射又は特定のバイオバーデンに関連する原因でない場合には,選択した25 kGyの滅菌線量は
実証されないため,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
9.2.7
確認検定線量試験
9.2.7.1
一般
確認検定線量試験(9.2.6.2参照)を実施するには,次の3段階の手順を実施しなければならない。
9.2.7.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。確認検定線量試験を実施するための10個の製
品試料は,第2段階(9.2.3参照)のバイオバーデンの決定に使用したバッチの一つから採取するか又は第
4段階(9.2.5参照)で用いた第4のバッチ若しくは通常の生産条件で製造したバッチから採取してもよい
(5.3参照)。
9.2.7.3
第2段階:確認検定線量試験の実施
9.2.7.3.1
9.2.4で求めたVDmax25でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax25からその10 %を超えてはならない。
32
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25からその10 %を超えた場合は,確認検定線量試験をやり直さ
なければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25の90 %未満の場合は,確認検定線量
試験をやり直してもよい。この平均線量がVDmax25の90 %未満で,無菌性の試験を実施して合格の結果が
得られた場合(9.2.7.4.1参照)には,確認検定線量試験をやり直す必要はない。
9.2.7.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録す
る。
9.2.7.4
第3段階:結果の判定
9.2.7.4.1
実施した10個の無菌性の試験で陽性がなく,25 kGyを実証するために実施した検定線量試験
及び確認検定線量試験で得られた無菌性の試験の陽性数の合計が2の場合は,確認検定線量試験は合格で
あり滅菌線量として25 kGyは実証されたものとする。
9.2.7.4.2
無菌性の試験で陽性が得られた場合は,滅菌線量は不十分な可能性があり確認検定線量試験は
不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25の照射又は特定のバイオ
バーデンに関連する原因による場合は,是正処置を行った後に,更に10個の製品試料を使用して最初と同
じVDmax25を用いて確認検定線量試験をやり直す。やり直した確認検定線量試験の結果は,9.2.7.4に従っ
て判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25の照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した25 kGyの滅菌線量は実証されないため,他の方法で滅
菌線量を確立しなければならない(箇条6参照)。
9.3
単一製造バッチにVDmax25法を適用する手順
9.3.1
理論的根拠
この方法はVDmax25法の変法であり,単一製造バッチの滅菌線量としての25 kGyの実証だけに用いるこ
とを目的としている。
9.3.2
一般
9.3.2.1
この方法は,製品の平均バイオバーデンが1 000以下の場合だけに適用しなければならない。
9.3.2.2
平均バイオバーデンが0.9以下の製品試料にVDmax25法を適用する場合は,表1に従って製品試料
全体を用いなければならないが,平均バイオバーデンが0.9を超える製品については,SIPを用いてもよい
(5.2.5参照)。
9.3.2.3
このVDmax25法の変法を適用するには,次の5段階の手順を実施しなければならない。
9.3.3
第1段階:製品サンプルの入手
5.1,5.2及び5.3に従って,単一バッチから10個の製品試料を採取する。
注記 SIPが1未満の場合は,その妥当性を検証するために,追加の製品が必要になることがある(5.2.5
参照)。
9.3.4
第2段階:平均バイオバーデンの決定
9.3.4.1
バイオバーデンの決定には,補正係数(JIS T 11737-1参照)を適用する。
9.3.4.2
採取した製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
33
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
合(例えば,10未満)は,平均バイオバーデンの決定のため10個の製品試料をまとめても
よい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろより大
きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
9.3.5
第3段階:VDmax25の取得
表9から平均バイオバーデンに対応するSIP=1.0 VDmax25を求める。
SIPが1.0で平均バイオバーデンが表9にない場合は,平均バイオバーデンよりも大きく,表にある最も
近い値を用いる。
SIPが1.0未満の場合は,SIP平均バイオバーデンをSIPで除して製品試料全体(SIPは1.0)に対する平
均バイオバーデンを計算する。平均バイオバーデンが表9にない場合は,SIP=1.0VDmax25を求めるために,
平均バイオバーデンより大きく,表にある最も近い値を用い,かつ,対応するSIP線量減少係数を用いる。
注記 平均バイオバーデンが0.9以下の製品には,1.0未満のSIPを使用してはならない(9.3.2.2参照)。
式(10)を用いてSIP VDmax25を計算する(9.2.4参照)。
9.3.6
第4段階:検定線量試験の実施
9.3.6.1
単一製造バッチの製品から10個の製品試料を採取する。
9.3.6.2
表9から得たVDmax25又は式(10)で求めたVDmax25のうち適切な方でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax25からその10 %を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25からその10 %を超えた場合は,検定線量試験をやり直さなけ
ればならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量がVDmax25の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(9.3.7.1参照)には,検定線量試験をやり直す必要はない。
9.3.6.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
9.3.7
第5段階:結果の判定
9.3.7.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり滅菌線量
として25 kGyは実証されたものとする。
9.3.7.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(9.3.8参照)を実施する。
9.3.7.3
無菌性の試験で陽性数が3以上の場合は,滅菌線量は不十分な可能性があり検定線量試験は不合
格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax25の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当するVDmax25(9.3.5)を使用する。平均バイオバーデンの評
価を変更しなかった場合には,不合格となった検定線量試験と同じVDmax25を使用する。やり直した検定
線量試験の結果は,9.3.7に従って判定する。
34
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax25の照射又は特定のバイオバーデンに関連する原因でない場合には,選択した25 kGyの滅菌線量は
実証されないため,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
9.3.8
確認検定線量試験
9.3.8.1
一般
確認検定線量試験(9.3.7.2参照)を実施するには,次の3段階の手順を実施しなければならない。
9.3.8.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。
この単一バッチを保管する場合は,製品の微生物の生育を支持する能力を考慮することが望ましい。
9.3.8.3
第2段階:確認検定線量試験の実施
9.3.8.3.1
9.3.5で求めたVDmax25でこれらの製品試料を照射する。
製品試料に照射した最大線量はVDmax25からその10 %を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25からその10 %を超えた場合は,確認検定線量試験をやり直さ
なければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25の90 %未満の場合は,確認検定線量
試験をやり直してもよい。この平均線量がVDmax25の90 %未満で,無菌性の試験を実施して合格の結果が
得られた場合(9.3.8.4.1参照)には,検定線量試験をやり直す必要はない。
9.3.8.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録す
る。
9.3.8.4
第3段階:結果の判定
9.3.8.4.1
実施した10個の無菌性の試験で陽性がなく,25 kGyを実証するために実施した検定線量試験
及び確認検定線量試験で得られた無菌性の試験の陽性数の合計が2の場合は,確認検定線量試験は合格で
あり滅菌線量として25 kGyは実証されたものとする。
9.3.8.4.2
無菌性の試験で陽性が得られた場合は,滅菌線量は不十分な可能性があり確認検定線量試験は
不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25の照射又は特定のバイオ
バーデンに関連する原因による場合は,是正処置を行った後に,更に10個の製品試料を使用して最初と同
じVDmax25を用いて確認検定線量試験をやり直す。やり直した確認検定線量試験の結果は,9.3.8.4に従っ
て判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25の照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した25 kGyの滅菌線量は実証されないため,他の方法で滅
菌線量を確立しなければならない(箇条6参照)。
9.4
複数バッチにVDmax15法を適用する手順
9.4.1
一般
9.4.1.1
この方法は,製品のバッチ平均バイオバーデンが1.5以下の場合だけに適用しなければならない。
注記 三つのバッチ平均バイオバーデン(9.4.3.2参照)の全てが1.5以下でなければならない。
9.4.1.2
VDmax15法を適用する場合は,表1に従って製品試料全体(SIPは1.0)を使用しなければならな
い。

35
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.4.1.3
VDmax15法を適用するには,次の5段階の手順を実施しなければならない。
注記 実施例は,11.3を参照。
9.4.2
第1段階:製品サンプルの入手
5.1及び5.3に従って,独立した三つの製造バッチからそれぞれ10個の製品試料を採取する。
9.4.3
第2段階:平均バイオバーデンの決定
9.4.3.1
バイオバーデンの決定には,補正係数(JIS T 11737-1参照)を適用する。
9.4.3.2
採取した製品試料のバイオバーデンを決定し,次を計算する。
a) 三つのバッチのそれぞれについての製品試料の平均バイオバーデン(バッチ平均バイオバーデン)。
b) 全ての製品試料の平均バイオバーデン(全平均バイオバーデン)。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,VDmax15では1.5未満)は,バッチ平均バイオバーデンの決定のため10個の製
品試料をまとめてもよい。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用すると,
真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験の検証
に影響することがある。
9.4.3.3
三つのバッチ平均バイオバーデンと全平均バイオバーデンとを比較して,バッチ平均バイオバー
デンのいずれかが全平均バイオバーデンの2倍以上であるかを調べる。
9.4.4
第3段階:VDmax15の取得
次のいずれかを用いて,表10から平均バイオバーデンに対応するSIP=1.0 VDmax15を求める。
a) バッチ平均バイオバーデンのいずれか一つが,全平均バイオバーデンの2倍以上の場合は,バッチ平
均バイオバーデンの最大値を用いる。
b) それぞれのバッチ平均バイオバーデンが,全平均バイオバーデンの2倍未満の場合は,全平均バイオ
バーデンを用いる。
平均バイオバーデンが表10にない場合は,平均バイオバーデンよりも大きく,表にある最も近い値を用
いる。
表10−平均バイオバーデンが1.5以下の場合のVDmax15の値
平均バイオバーデン
SIP=1.0 VDmax15
kGy
平均バイオバーデン
SIP=1.0 VDmax15
kGy
≦0.1
0.0
0.50
1.8
0.15
0.5
0.60
2.0
0.20
0.9
0.70
2.2
0.25
1.1
0.80
2.3
0.30
1.3
0.90
2.2
0.35
1.5
1.0
2.1
0.40
1.6
1.5
1.7
0.45
1.7
注記 SIP=1.0 VDmax15が0.0 kGyの場合には,製品試料は照射しない。
9.4.5
第4段階:検定線量試験の実施
9.4.5.1
単一製造バッチの製品から10個の製品試料を採取する。第4段階で実施するための10個の製品
36
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
試料は,第2段階のバイオバーデンの決定に使用したバッチの一つから採取するか又は通常の生産条件で
製造した第4のバッチから採取してもよい(5.3参照)。
9.4.5.2
表10から得たVDmax15でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えてはな
らない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax15の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えた場合
は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax15の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量がVDmax15の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(9.4.6.1参照)には,検定線量試験をやり直す必要はない。
9.4.5.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
9.4.6
第5段階:結果の判定
9.4.6.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり滅菌線量
として15 kGyは実証されたものとする。
9.4.6.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(9.4.7参照)を実施する。
9.4.6.3
無菌性の試験で陽性数が3以上の場合は,滅菌線量は不十分な可能性があり検定線量試験は不合
格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax15の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当するVDmax15(9.4.4)を使用する。平均バイオバーデンの評
価を変更しなかった場合には,不合格となった検定線量試験と同じVDmax15を使用する。やり直した検定
線量試験の結果は,9.4.6に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax15の照射又は特定のバイオバーデンに関連する原因でない場合には,選択した15 kGyの滅菌線量は
実証されないため,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
9.4.7
確認検定線量試験
9.4.7.1
一般
確認検定線量試験(9.4.6.2参照)を実施するには,次の3段階の手順を実施しなければならない。
9.4.7.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。確認検定線量試験を実施するための10個の製
品試料は,第2段階(9.4.3参照)のバイオバーデンの決定に使用したバッチの一つから採取するか又は第
4段階(9.4.5参照)で用いた第4のバッチ若しくは通常の生産条件で製造したバッチから採取してもよい
(5.3参照)。
9.4.7.3
第2段階:確認検定線量試験の実施
9.4.7.3.1
9.4.4で求めたVDmax15でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えてはな
らない。
37
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax15の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えた場合
は,確認検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax15の90 %未満の場合は,確認検定線量
をやり直してもよい。この平均線量がVDmax15の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(9.4.7.4.1参照)には,確認検定線量試験をやり直す必要はない。
9.4.7.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録す
る。
9.4.7.4
第3段階:結果の判定
9.4.7.4.1
実施した10個の無菌性の試験で陽性がなく,15 kGyを実証するために実施した検定線量試験
及び確認検定線量試験で得られた無菌性の試験の陽性数の合計が2の場合は,確認検定線量試験は合格で
あり滅菌線量として15 kGyは実証されたものとする。
9.4.7.4.2
無菌性の試験で陽性が得られた場合は,滅菌線量は不十分な可能性があり確認検定線量試験は
不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax15の照射又は特定のバイオ
バーデンに関連する原因による場合は,是正処置を行った後に,更に10個の製品試料を使用して最初に用
いたのと同じVDmax15で確認検定線量試験をやり直す。やり直した確認検定線量試験の結果は,9.4.7.4に
従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax15の照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した15 kGyの滅菌線量は実証されないため,他の方法で滅
菌線量を確立しなければならない(箇条6参照)。
9.5
単一製造バッチにVDmax15法を適用する手順
9.5.1
理論的根拠
この方法はVDmax15法の変法であり,単一製造バッチの滅菌線量としての15 kGyの実証だけに用いるこ
とを目的としている。
9.5.2
一般
9.5.2.1
この方法は,製品の平均バイオバーデンが1.5以下の場合だけに適用しなければならない。
9.5.2.2
VDmax15法を適用する場合は,表1に従って製品試料全体(SIPは1.0)を用いなければならない。
9.5.2.3
このVDmax15法の変法を適用するには,次の5段階の手順を実施しなければならない。
9.5.3
第1段階:製品サンプルの入手
5.1及び5.3に従って,単一バッチから10個の製品試料を採取する。
9.5.4
第2段階:平均バイオバーデンの決定
9.5.4.1
バイオバーデンの決定には,補正係数(JIS T 11737-1参照)を適用する。
9.5.4.2
採取した製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,VDmax15では1.5未満)は,平均バイオバーデンの決定のため10個の製品試料
をまとめてもよい。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
38
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
9.5.5
第3段階:VDmax15の取得
表10から平均バイオバーデンに対応するSIP=1.0VDmax15を求める。
平均バイオバーデンが表10にない場合は,平均バイオバーデンよりも大きく,表にある最も近い値を用
いる。
9.5.6
第4段階:検定線量試験の実施
9.5.6.1
単一製造バッチの製品から10個の製品試料を採取する。
9.5.6.2
表10から得たVDmax15でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えてはな
らない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax15の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えた場合
は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax15の90 %未満の場合は,検定線量試験
をやり直してもよい。この平均線量がVDmax15の90 %未満で,無菌性の試験を実施して合格の結果が得ら
れた場合(9.5.7.1参照)には,検定線量試験をやり直す必要はない。
9.5.6.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
9.5.7
第5段階:結果の判定
9.5.7.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり滅菌線量
として15 kGyは実証されたものとする。
9.5.7.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(9.5.8参照)を実施する。
9.5.7.3
無菌性の試験で陽性数が3以上の場合は,滅菌線量は不十分な可能性があり検定線量試験は不合
格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax15の照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して検定線量試験をやり直す。是正処置の結果,平均バイオバーデンの評価を変更し
た場合は,変更後の平均バイオバーデンに相当するVDmax15(9.5.5)を使用する。平均バイオバーデンの評
価を変更しなかった場合には,不合格となった検定線量試験と同じVDmax15を使用する。やり直した検定
線量試験の結果は,9.5.7に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmax15の照射又は特定のバイオバーデンに関連する原因でない場合には,選択した15 kGyの滅菌線量は
実証されないため,他の方法で滅菌線量を確立しなければならない(箇条6参照)。
9.5.8
確認検定線量試験
9.5.8.1
一般
確認検定線量試験(9.5.7.2参照)を実施するには,次の3段階の手順を実施しなければならない。
9.5.8.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。
この単一バッチを保管する場合は,製品の微生物の生育を支持する能力を考慮することが望ましい。
39
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.5.8.3
第2段階:確認検定線量試験の実施
9.5.8.3.1
9.5.5で求めたVDmax15でこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えてはな
らない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax15の90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax15からその10 %又は0.1 kGyのいずれか大きい線量を超えた場合
は,確認検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax15の90 %未満の場合は,確認検定線量
試験をやり直してもよい。この平均線量がVDmax15の90 %未満で,無菌性の試験を実施して合格の結果が
得られた場合(9.5.8.4.1参照)には,確認検定線量試験をやり直す必要はない。
9.5.8.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録す
る。
9.5.8.4
第3段階:結果の判定
9.5.8.4.1
実施した10個の無菌性の試験で陽性がなく,15 kGyを実証するために実施した検定線量試験
及び確認検定線量試験で得られた無菌性の試験の陽性数の合計が2の場合は,確認検定線量試験は合格で
あり滅菌線量として15 kGyは実証されたものとする。
9.5.8.4.2
無菌性の試験で陽性が得られた場合は,滅菌線量は不十分な可能性があり確認検定線量試験は
不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax15の照射又は特定のバイオ
バーデンに関連する原因による場合は,是正処置を行った後に,更に10個の製品試料を使用して最初に用
いたのと同じVDmax15で確認検定線量試験をやり直す。やり直した確認検定線量試験の結果は,9.5.8.4に
従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax15の照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した15 kGyの滅菌線量は実証されないため,他の方法で滅
菌線量を確立しなければならない(箇条6参照)。
9A VDmaxSD法−滅菌線量としての17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy又は35 kGy
の実証
VDmaxSD法による滅菌線量の実証は,JA.2及びJA.3による。
10 滅菌線量監査
10.1 目的及び頻度
滅菌線量が確立した後は,滅菌線量の継続した妥当性を確認するため定期的に滅菌線量監査を実施しな
ければならない。滅菌線量監査の全ての結果は,製品ファミリーを構成する全ての製品に適用しなければ
ならない(箇条4参照)。
滅菌線量監査の実施頻度は,JIS T 0806-1:2010の12.1に従わなければならない。製品を製造していない
期間の滅菌線量監査は必要ではない。また,滅菌線量監査と同時に,バイオバーデンの決定及び環境並び
に製造管理のレビューを実施することが望ましい。このレビューで管理が不十分であると認められた場合
は,適切な処置を講じるのが望ましい。
40
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
10.2 方法1,方法2A又は方法2Bを用いて確立した滅菌線量監査の手順
10.2.1 一般
10.2.1.1 方法1又は方法2Aを用いて確立した滅菌線量に対する滅菌線量監査を実施する場合は,最初の
滅菌線量を確立したときと同一のSIPを使用する。
注記 方法2Bは,製品試料全体を使用することが要求される[8.3.1.1 a)参照]。
10.2.1.2 滅菌線量監査を適用するには,次の4段階の手順を実施しなければならない。
注記 実施例は,11.4及び11.5を参照。
10.2.2 第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチ製品から110個の製品試料を採取する。
10.2.3 第2段階:平均バイオバーデンの決定
10個の製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。最初の滅菌線量の確立に
補正係数(JIS T 11737-1参照)を適用した場合は,バイオバーデン決定の最新のバリデーションで得られ
た補正係数を用いる。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,平均バイオバーデン決定のため10個の製品試料をまとめてもよ
い。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろより大き
なSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
注記3 バイオバーデンのデータは,滅菌線量監査のための検定線量を得ることを目的としているの
ではなく,プロセスの監視及び管理のために使用する(例えば,トレンド分析,滅菌線量監
査で不合格となった場合の調査又は滅菌線量監査の頻度の削減)。
10.2.4 第3段階:検定線量試験の実施
10.2.4.1 100個の製品試料を最新の線量設定試験で得られた検定線量又はD**,又は該当する場合,滅菌
線量の増加の結果による最新の滅菌線量監査で得られた調整線量(10.2.6.4参照)で照射する。適用可能
な場合,滅菌線量が再確立するまで,調整線量を使用する。
方法1で確立した滅菌線量監査では,製品試料に照射した最大線量は,検定線量からその10 %を超えて
はならない。方法2A又は2Bで確立した滅菌線量監査では,製品試料に照射した最大線量は,D**からそ
の10 %又は1.0 kGyのいずれか大きい線量を超えてはならない。
方法1で確立した滅菌線量監査では,製品試料に照射した最大線量と最小線量との算術平均は,検定線
量の90 %未満ではない方がよい。方法2A又は2Bで確立した滅菌線量監査では,この平均線量はD**の
90 %又はD**から1.0 kGyを減じた線量のいずれか小さい方の線量未満ではない方がよい。
線量を測定する(5.5参照)。
方法1で確立した滅菌線量監査では,製品試料に照射した最大線量が,検定線量からその10 %を超えた
場合,又は方法2A若しくは2Bで確立した滅菌線量監査では,製品試料に照射した最大線量が,D**から
その10 %又は1.0 kGyのいずれか大きい線量を超えた場合は,検定線量試験をやり直さなければならない。
方法1で確立した滅菌線量監査では,製品試料に照射した最大線量と最小線量との算術平均が検定線量
の90 %未満,又は方法2A若しくは2Bで確立した滅菌線量監査では,この平均線量が90 %又はD**から
41
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1.0 kGyを減じた線量のいずれか小さい方の線量未満の場合は,検定線量試験をやり直してもよい。この検
定線量試験のやり直しの条件が適用できても,無菌性の試験を実施して合格の結果が得られた場合
(10.2.5.1参照)には,検定線量試験をやり直す必要はない。
10.2.4.2 照射した製品試料を最初の滅菌線量の確立で使用した培地及び培養条件で個別に無菌性の試験
(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
10.2.5 第4段階:結果の判定
10.2.5.1 実施した100個の無菌性の試験で陽性数が2以下の場合は,滅菌線量監査は合格である。
10.2.5.2 無菌性の試験の陽性数が3以上の場合は,滅菌線量は不十分であり滅菌線量監査は不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切な検定線量又はD**の照射又は特定
のバイオバーデンに関連する原因による場合は,是正処置を行った後,できる限り早く100個の製品試料
を用いて,不合格となった滅菌線量監査で用いたのと同じ検定線量又はD**で検定線量試験をやり直す。
やり直した検定線量試験の結果は,10.2.5に従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切な検定線量又はD**の照射又は特定
のバイオバーデンに関連する原因でない場合は,次による。
a) 無菌性の試験の陽性数が3又は4の場合は,直ちに線量を増加する(10.2.6参照)。更に100個の製品
試料を用いて,不合格となった滅菌線量監査で用いたのと同じ検定線量又はD**で検定線量試験をや
り直す。やり直した検定線量試験の結果は,10.2.5.3に従って判定する。
b) 無菌性の試験の陽性数が5以上,15以下の場合は,直ちに線量を増加(10.2.6参照)し,できる限り
早く最初の線量設定法,又は他の線量設定法で滅菌線量を再確立する(10.4参照)。滅菌線量を再確立
するまで,増加した滅菌線量を継続して使用する。
c) 無菌性の試験で陽性数が16以上の場合は,既に確立している滅菌線量での滅菌を中止する(10.4参照)。
滅菌線量の増加はしてはならず,他の方法(箇条6参照)で滅菌線量を再確立するまで滅菌を再開し
てはならない。
10.2.5.3 10.2.5.2 a)に従って実施したやり直した検定線量試験の結果の判定は,次のとおりである。
a) 実施した100個の無菌性の試験で陽性数が2以下で,環境及び製造状態の管理であらかじめ規定した
仕様を外れる数値がなく,かつ,バイオバーデンの決定の結果で規定したバイオバーデンの限度を外
れる数値がない場合は,既に確立されている滅菌線量を使用して再開する。数値が仕様を超えた場合
は,原因を調査し,是正し,既に確立されている滅菌線量を使用して再開する。
b) 無菌性の試験で陽性数が3又は4の場合は,直ちに最初の線量設定法,又は他の線量設定法で滅菌線
量を再確立する(10.4参照)。滅菌線量を再確立するまで,増加した滅菌線量を継続して使用する(箇
条6参照)。
c) 無菌性の試験で陽性数が5以上,15以下の場合は,直ちに他の方法(箇条6参照)で滅菌線量を再確
立する(10.4参照)。やり直した検定線量試験による結果を用いて滅菌線量を増加し,滅菌線量を再確
立するまで,増加した滅菌線量を継続して使用する。
d) 無菌性の試験で陽性数が16以上の場合は,直ちに滅菌を中止し,他の方法(箇条6参照)で滅菌線量
を再確立する(10.4参照)。滅菌線量を再確立するまで滅菌を再開してはならない。
10.2.6 方法1,方法2A又は方法2Bを用いて確立した滅菌線量の増加
10.2.6.1 一般
方法1,方法2A又は方法2Bを用いて確立した滅菌線量を増加する方法は,Herring 1999[13]によって提
唱された。この方法は,不合格となった滅菌線量監査で得た情報及び方法2の基礎となっている原理並び
42
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
に製品に存在する最も高い放射線抵抗性をもつ微生物群の抵抗性を安全側に見積もった推定値を併用する
ものである。
滅菌線量の増加を実施するには,次の4段階を実施しなければならない。
10.2.6.2 第1段階:不合格となった滅菌線量監査から得られたデータの解析
a) 滅菌線量監査を実施して測定された最大線量を見付け,この値を“最大監査線量”とする。
b) 滅菌線量監査で認められた無菌性の試験の陽性数を記録し(10.2.5.2及び10.2.5.3参照),この数を“監
査陽性数”とする。
10.2.6.3 第2段階:外挿係数の決定
a) 監査陽性数に応じて,式(11)又は式(12)を適用してEの値を決定する。
監査陽性数が3以上,9以下の場合は,式(11)を用いる。
E=“最大監査線量”+2 kGy······················································(11)
監査陽性数が10以上,15以下の場合は,式(12)を用いる。
E=“最大監査線量”+4 kGy····················································· (12)
b) (E−1)の値に応じて,式(13)又は式(14)を用い外挿係数を計算する。
(E−1)≦9の場合は,式(13)を用いる。
外挿係数=2+0.2×(E−1) ························································· (13)
9<(E−1)の場合は,式(14)を用いる。
外挿係数=0.4×(E−1) ······························································ (14)
式(13)又は式(14)を用いて計算した値が4.2 kGyを超える場合は,外挿係数を4.2 kGyとする。
10.2.6.4 第3段階:調整線量(SAL 10−2を達成する線量)の計算
式(15)を用いて,調整線量を計算する。
調整線量=“最大監査線量”+[log(監査陽性数)]×(外挿係数) ·········· (15)
10.2.6.5 第4段階:増加滅菌線量の計算
方法1及び方法2Aの場合は,式(16)を用いて増加滅菌線量を求める。
増加滅菌線量=調整線量+[−log (SAL)−log (SIP)−2]×(外挿係数) ··· (16)
方法2Bの場合は,式(17)を用いて増加滅菌線量を求める。
増加滅菌線量=調整線量+[−log (SAL)−2]×(外挿係数) ················· (17)
10.3 VDmax25法又はVDmax15法を用いて実証した滅菌線量監査の手順
10.3.1 一般
10.3.1.1 VDmax25法又はVDmax15法を用いて確立した滅菌線量に対する滅菌線量監査を実施する場合は,最
初の滅菌線量を実証したときと同一のSIPを使用する。
注記 VDmax15法は,製品試料全体を使用することが要求される(9.4.1.2及び9.5.2.2参照)。
10.3.1.2 滅菌線量監査を適用するには,次の4段階の手順を実施しなければならない。
注記 実施例は,11.6を参照。
10.3.2 第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチの製品から20個の製品試料を採取する。
10.3.3 第2段階:平均バイオバーデンの決定
10.3.3.1 バイオバーデン決定の最新のバリデーションで得られた補正係数を用いる。
10.3.3.2 10個の製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
43
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
合(例えば,VDmax25法の場合は10未満,VDmax15法の場合は1.5未満)は,平均バイオバー
デンの決定のため10個の製品試料をまとめてもよい。この方法は,SIPには適用するもので
はない。SIPはまとめてはならず,むしろより大きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。
注記3 バイオバーデンのデータは,滅菌線量監査のための検定線量を得ることを目的としているの
ではなく,プロセスの監視及び管理のために使用する(例えば,トレンド分析,滅菌線量監
査で不合格となった場合の調査又は滅菌線量監査の頻度の削減)。
10.3.4 第3段階:検定線量試験の実施
10.3.4.1 最初の滅菌線量の実証試験で得られたVDmax25又はVDmax15の該当する方で10個の製品試料を照
射する。
製品試料に照射した最大線量は,VDmax25の場合はその10 %,VDmax15の場合はその10 %又は0.1 kGyの
いずれか大きい線量を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25又はVDmax15の90 %未満ではない方が
よい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25の場合はその10 %,VDmax15の場合はその10 %又は0.1 kGyの
いずれか大きい線量を超えた場合は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25又はVDmax15の90 %未満の場合には,
検定線量試験をやり直してもよい。この平均線量が,VDmax25又はVDmax15の90 %未満で,無菌性の試験を
実施して合格の結果が得られた場合(10.3.5.1参照)には,検定線量試験をやり直す必要はない。
10.3.4.2 照射した製品試料を最初の滅菌線量の実証試験で使用した培地及び培養条件で個別に無菌性の
試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
10.3.5 第4段階:結果の判定
10.3.5.1 実施した10個の無菌性の試験で陽性数が1以下の場合は,滅菌線量監査は合格である。
10.3.5.2 無菌性の試験で陽性数が2の場合は,確認滅菌線量監査(10.3.6参照)を実施する。
10.3.5.3 無菌性の試験で陽性数が3以上の場合は,滅菌線量は不十分な可能性があり滅菌線量監査は不合
格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25又はVDmax15の照射又は特
定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,できる限り早く更に10個の製
品試料を用いて不合格となった滅菌線量監査で用いたのと同じVDmax25又はVDmax15で検定線量試験をやり
直す。やり直した検定線量試験の結果は,10.3.5に従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmax25又はVDmax15の照射又は特
定のバイオバーデンに関連する原因でない場合には,次による。
a) 無菌性の試験の陽性数が3以上,6以下の場合は,直ちに線量を増加し(10.3.7参照),できる限り早
く他の方法(箇条6参照)で滅菌線量を再確立(10.4参照)する。滅菌線量を再確立するまで,増加
した滅菌線量を継続して使用する。
b) 無菌性の試験で陽性数が7以上の場合は,既に確立している滅菌線量での滅菌を中止する(10.4参照)。
44
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
滅菌線量の増加はしてはならず,他の方法(箇条6参照)で滅菌線量を再確立するまで滅菌を再開し
てはならない。
10.3.6 確認滅菌線量監査
10.3.6.1 一般
10.3.6.1.1 VDmax25法又はVDmax15法を用いて確立した滅菌線量に対する確認滅菌線量監査を実施する場合
は,最初の滅菌線量を実証したときと同一のSIPを使用する。
注記 VDmax15法は,製品試料全体を使用することが要求される(9.4.1.2及び9.5.2.2参照)。
10.3.6.1.2 確認滅菌線量監査を実施する場合は,次の3段階の手順を実施しなければならない。
10.3.6.2 第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチの製品から10個の製品試料を採取する。
確認滅菌線量監査に使用する10個の製品試料は,最初の滅菌線量監査(10.3.2参照)で実施した検定線
量試験で使用したバッチ又は通常の生産条件で製造された二つ目のバッチのいずれから採取してもよい
(5.3参照)。
10.3.6.3 第2段階:確認検定線量試験の実施
10.3.6.3.1 最初の滅菌線量の実証試験で得られたVDmax25又はVDmax15の該当する方で,これらの製品試料
を照射する(9.2.4又は9.4.4参照)。
製品試料に照射した最大線量は,VDmax25の場合はその10 %,VDmax15の場合はその10 %又は0.1 kGyの
いずれか大きい線量を超えてはならない。
製品試料に照射した最大線量と最小線量との算術平均は,VDmax25又はVDmax15の90 %未満ではない方が
よい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmax25の場合はその10 %,VDmax15の場合はその10 %又は0.1 kGyの
いずれか大きい線量を超えた場合は,確認検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均が,VDmax25又はVDmax15の90 %未満の場合は,確
認検定線量試験をやり直してもよい。この平均線量が,VDmax25又はVDmax15の90 %未満で,無菌性の試験
を実施して合格の結果が得られた場合(10.3.6.4参照)には,確認検定線量試験をやり直す必要はない。
10.3.6.3.2 照射した製品試料を最初の滅菌線量の実証試験で使用した培地及び培養条件で個別に無菌性の
試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
10.3.6.4 第3段階:結果の判定
10.3.5.2に従って実施した確認検定線量監査の結果の判定は,次による。
a) 実施した10個の無菌性の試験で陽性がなく,滅菌線量監査で実施した検定線量試験及び確認検定線量
試験の合計の陽性数が2の場合は,滅菌線量監査は合格である。
b) 無菌性の試験で陽性数が1以上,4以下の場合は,直ちに滅菌線量を増加し(10.3.7参照),他の方法
(箇条6参照)で滅菌線量を再確立する(10.4参照)。滅菌線量を再確立するまで,増加した滅菌線量
を継続して使用する。
c) 無菌性の試験で陽性数が5以上の場合は,既に確立している滅菌線量での滅菌を中止する(10.4参照)。
滅菌線量の増加はしてはならず,他の方法(箇条6参照)で滅菌線量を再確立するまで滅菌を再開し
てはならない。
無菌性の試験で陽性数が1以上で,不適切な無菌性の試験の実施,不適切なVDmax25又はVDmax15の照射
又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後,更に10個の製品試料を使
45
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
用して最初の滅菌線量の実証試験で用いたのと同じVDmax25又はVDmax15で確認滅菌線量監査(10.3.6.3参
照)をやり直す。結果は,上記のa)〜c)に従って判定する。
10.3.7 VDmax25法又はVDmax15法を用いて実証した滅菌線量の増加
10.3.7.1 VDmax25法
表11から,10.3.3に従って決定した平均バイオバーデンに対応する線量増加値を求める。平均バイオバ
ーデンが表11にない場合は,平均バイオバーデンよりも大きく,表にある最も近い値を用いて線量増加値
を求める。この線量増加値を用いて,式(18)で増加滅菌線量を計算する。
増加滅菌線量(kGy)=25 kGy+線量増加値 ································· (18)
表11−平均バイオバーデンが1 000以下のVDmax25法の線量増加値
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
≦0.1
5.0
6.5
3.7
40
3.3
240
3.3
0.15
4.8
7.0
3.7
45
3.3
260
3.3
0.20
4.7
7.5
3.6
50
3.2
280
3.3
0.25
4.6
8.0
3.6
55
3.2
300
3.3
0.30
4.6
8.5
3.6
60
3.2
325
3.3
0.35
4.5
9.0
3.6
65
3.2
350
3.3
0.40
4.5
9.5
3.6
70
3.2
375
3.3
0.45
4.4
10
3.6
75
3.2
400
3.3
0.50
4.4
11
3.6
80
3.2
425
3.3
0.60
4.3
12
3.5
85
3.2
450
3.3
0.70
4.3
13
3.5
90
3.2
475
3.3
0.80
4.2
14
3.5
95
3.2
500
3.3
0.90
4.2
15
3.5
100
3.2
525
3.3
1.0
4.2
16
3.5
110
3.2
550
3.3
1.5
4.0
17
3.5
120
3.2
575
3.3
2.0
4.0
18
3.4
130
3.2
600
3.3
2.5
3.9
19
3.4
140
3.2
650
3.4
3.0
3.9
20
3.4
150
3.2
700
3.4
3.5
3.8
22
3.4
160
3.2
750
3.4
4.0
3.8
24
3.4
170
3.2
800
3.4
4.5
3.8
26
3.4
180
3.2
850
3.4
5.0
3.7
28
3.4
190
3.3
900
3.4
5.5
3.7
30
3.3
200
3.3
950
3.4
6.0
3.7
35
3.3
220
3.3
1000
3.4
10.3.7.2 VDmax15法
表12から,10.3.3に従って決定した平均バイオバーデンに対応する線量増加値を求める。平均バイオバ
ーデンが表12にない場合は,平均バイオバーデンよりも大きく,表にある最も近い値を用いて線量増加
値を求める。この線量増加値を用いて,式(19)で増加滅菌線量を計算する。
増加滅菌線量(kGy)=15 kGy+線量増加値 ································· (19)
46
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表12−平均バイオバーデンが1.5以下のVDmax15法の線量増加値
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
平均バイオ
バーデン
線量増加値
kGy
≦0.1
3.0
0.30
2.7
0.50
2.6
0.90
2.6
0.15
2.9
0.35
2.7
0.60
2.6
1.0
2.6
0.20
2.8
0.40
2.7
0.70
2.6
1.5
2.7
0.25
2.8
0.45
2.7
0.80
2.6
10.4 滅菌線量監査の不合格
滅菌線量監査が不合格で滅菌線量の再確立が必要となった場合は,不合格の原因を調査し,修正及び/
又は是正措置を講じなければならない(JIS T 0806-1:2010の4.4参照)。調査の要素として,既に生産した
製品に対して規定したSALの達成について,滅菌線量監査で不合格となった滅菌線量で生産した製品の影
響を考慮し,その使用の適合性についてリスク評価しなければならない。調査及びその後の活動は,記録
しなければならない(JIS T 0806-1:2010の4.1.2参照)。
注記 滅菌線量が再確立されるまで,当該SALの達成に対する影響を決定するのは不可能なことがあ
る。
10A VDmaxSD法を用いて実証したプロセスの有効性の維持
VDmaxSD法を用いて実証したプロセスの有効性の維持は,JA.4による。
11 実施例
11.1 方法1の実施例
方法1については,三つの例を示している。最初はSAL 10−3の製品で,製品試料全体(SIPは1.0)を
検定線量試験に使用した例(表13参照)である。2番目はSAL 10−6の製品で,製品が大きいためその一
部分(SIPは1.0未満)を用いた例(表14参照)である。3番目はSAL 10−6の製品で,バイオバーデンが
1.0未満で製品試料全体(SIPは1.0)を試験に使用した例(表15参照)である。
表13−滅菌線量の決定(方法1,SIPは1.0)
用語
数値
説明
第1段階
SAL
10−3
この例では,最終使用時に要求されるSALは10−3である。
SIP
1.0
バイオバーデン決定及び検定線量試験では,製品全体を使用した。
第2段階
平均バイオ
バーデン
382
試験を行った3バッチのバッチ平均バイオバーデンは,108,80,382であった。
− 全平均バイオバーデンは190であった。
− バッチ平均バイオバーデンの最大値は382であった。
バッチ平均バイオバーデンの最大値382は,全平均バイオバーデンの2倍以上なの
で382を用いて検定線量を求めた。
第3段階
検定線量
9.7 kGy
表5には平均バイオバーデン382の記載がないので,表中にある次に大きな値の
400を用いた。
第4段階
検定線量試験
9.4 kGy〜
10.4 kGy
検定線量試験において製品試料への線量は,9.4 kGy〜10.4 kGyであった。
47
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表13−滅菌線量の決定(方法1,SIPは1.0)(続き)
用語
数値
説明
第5段階
結果の判定
陽性数
1
製品試料への最大線量は,上限(10.7 kGy)を超えておらず,最大線量と最小線量
との算術平均9.9 kGyは,検定線量の90 %未満ではなかった(9.7 kGyの90 %は8.7
kGy)。
線量は限度内であり,無菌性の試験の結果は,合格(すなわち,陽性数は2以下)
であり検定は合格であった。
第6段階
SAL 10−3の
滅菌線量
12.9 kGy
表5 a)から平均バイオバーデンの最大値が382の場合,SAL 10−3に対する滅菌線量
は12.9 kGyであった。
注a) 平均バイオバーデン382は表5に記載がないので,次に大きな値のバイオバーデン400を用いた。
表14−滅菌線量の決定(方法1,SIPは1.0未満)
用語
数値
説明
第1段階
SAL
10−6
この例では,最終使用時に要求されるSALは10−6である。
SIP
0.05
この製品は無菌性の試験には製品が大きすぎるため,線量設定には製品の1/20の
部分を使用した。
第2段階
平均バイオ
バーデン
59
試験を行った3バッチのSIPバッチ平均バイオバーデンは,50,62,65であった。
製品試料の85 %でSIP当たりの菌数は2 cfu以上となりSIPの妥当性が立証された。
− SIP全平均バイオバーデンは59であった。
− SIPバッチ平均バイオバーデンの最大値は65であった。
SIPバッチ平均バイオバーデンの最大値65は,SIP全平均バイオバーデンの2倍未
満のため,59を用いて検定線量を求めた。
第3段階
検定線量
7.3 kGy
表5には平均バイオバーデン59の記載がないので,表中にある次に大きな値の60
を用いた。
第4段階
検定線量試験
6.5 kGy〜
7.7 kGy
検定線量試験において製品試料への線量は,6.5 kGy〜7.7 kGyであった。
第5段階
結果の判定
陽性数
2
製品試料への最大線量は,上限(8.0 kGy)を超えておらず,最大線量と最小線量
との算術平均7.1 kGyは,検定線量の90 %未満ではなかった(7.3 kGyの90 %は6.6
kGy)。
線量は限度内であり,無菌性の試験の結果は,合格(すなわち,陽性数は2以下)
であり検定は合格であった。
第6段階
製品全体の
平均バイオ
バーデン
1 180
製品全体の平均バイオバーデンは,次のように計算した。
59/0.05=1 180
SAL 10−6の
滅菌線量
25.2 kGy
表5 a)から製品全体の平均バイオバーデンが1 180の場合,SAL 10−6に対する滅菌
線量は25.2 kGyであった。
注a) 平均バイオバーデン1 180は表5に記載がないので,次に大きな値のバイオバーデン1 200を用いた。
48
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表15−滅菌線量の決定(方法1,SIPは1.0,バイオバーデンは1.0未満)
用語
数値
説明
第1段階
SAL
10−6
この例では,最終使用時に要求されるSALは10−6である。
SIP
1.0
バイオバーデンが1.0未満の場合,バイオバーデン決定及び検定線量試験には製品
全体を使用する必要がある。
第2段階
平均バイオ
バーデン
0.63
試験を行った3バッチのバッチ平均バイオバーデンは,0.6,0.6,0.7であった。
− 全平均バイオバーデンは0.63であった。
− バッチ平均バイオバーデンの最大値は0.7であった。
バッチ平均バイオバーデンの最大値0.7は,全平均バイオバーデンの2倍未満のた
め,0.63を用いて検定線量を求めた。
第3段階
検定線量
2.7 kGy
表6には平均バイオバーデン0.63の記載がないので,表中にある次に大きな値の
0.70を用いた。
第4段階
検定線量
試験
2.0 kGy〜
2.6 kGy
検定線量試験において製品試料への線量は,2.0 kGy〜2.6 kGyであった。
第5段階
結果の判定
陽性数
2
製品試料への最大線量は,上限(3.0 kGy)を超えておらず,最大線量と最小線量
との算術平均2.3 kGyは,検定線量の90 %未満であった(2.7 kGyの90 %は2.4 kGy)。
この算術平均は下限未満であるが,無菌性の試験の結果は,合格(すなわち,陽性
数は2以下)であり検定は合格であった。
第6段階
SAL 10−6の
滅菌線量
13.7 kGy
表6 a)から平均バイオバーデンが0.63の場合,SAL 10−6に対する滅菌線量は13.7
kGyであった。
注a) 平均バイオバーデン0.63は表6に記載がないので,次に大きな値のバイオバーデン0.70を用いた。
11.2 方法2の実施例
11.2.1 一般
方法2Aについては,二つの例を示している。1番目は表16〜表20に示した製品試料全体(SIPは1.0)
を用いて試験する例で,2番目は表21〜表25に示した製品試料の一部分(SIPは1.0未満)を用いた例で
ある。方法2Bでは,製品試料全体だけを使用することが条件の一つであるため,表26〜表30に記載する
例だけを示す。
次の実施例では,単一製造バッチの製品から得られた結果を示す場合には小文字の表記を,三つの製造
バッチの製品から得られた結果を示す場合には大文字の表記を採用している。
11.2.2 方法2A(SIPは1.0)の実施例
11.2.2.1 第1段階:SALの選択及び製品サンプルの入手
11.2.2.1.1 製品のSALは10−6を選択した。線量設定には製品試料全体(SIPは1.0)を使用することがで
き,三つのバッチからそれぞれ280個の製品試料を無作為に採取した。
11.2.2.1.2 累加線量試験に使用する製品試料の配分を,表16に示す。
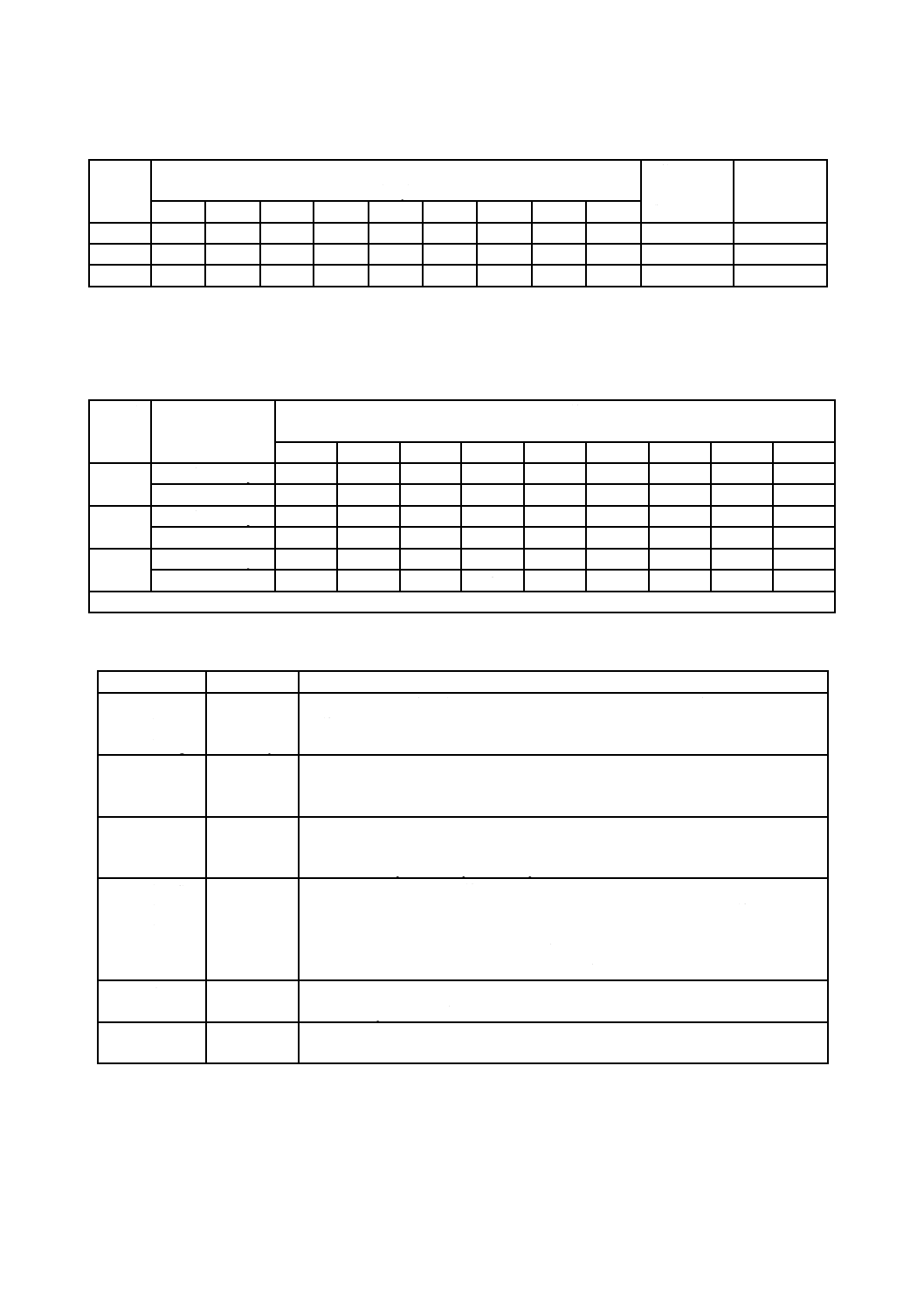
49
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表16−累加線量ごとの照射に必要な製品試料数
バッチ
No.
目標累加線量
(kGy)
第3段階
試験用の
製品試料数
必要な製品
試料総数
2
4
6
8
10
12
14
16
18
1
20
20
20
20
20
20
20
20
20
100
280
2
20
20
20
20
20
20
20
20
20
100
280
3
20
20
20
20
20
20
20
20
20
100
280
11.2.2.2 第2段階:累加線量試験の実施
表17に一連の累加線量試験で得られたデータの例を,表18にその試験で得られた値を示す。
表17−累加線量試験で得られた代表的なデータ(20個の製品試料から得られた無菌性の試験の陽性数)
バッチ
No.
目標累加線量
(kGy)
2
4
6
8
10
12
14
16
18
1
最大線量(kGy)
2.2
5.0
5.3
9.0
9.2
11.6
15.0
16.2
19.3
陽性数
20
5
2
0
0
0
0
0
0
2
最大線量(kGy)
2.6
3.2
6.6
8.0
9.7
13.0
13.8
15.8
17.9
陽性数
11
7
0
0
1
0
0
0
0
3
最大線量(kGy)
2.3
4.2
5.9
7.5
10.7
11.4
13.7
17.5
17.1
陽性数
18
7
2
2
0
0
0
0
0
注記 それぞれの累加線量での最大線量と最小線量との算術平均は,あらかじめ規定した下限よりも高い。
表18−第2段階の計算
用語
数値
説明
バッチ1 ffp
バッチ2 ffp
バッチ3 ffp
5.0 kGy
2.6 kGy
2.3 kGy
バッチffpは,20個の無菌性の試験のうち,少なくとも一つが陰性となる最初の累
加線量である。
A
0.65 kGy
ffp中央値における無菌性の試験の陽性数を求め,表7からAを求める。
例では,ffp中央値(2.6 kGy)における陽性数は11なので,Aは0.65 kGyであっ
た。
FFP
1.95 kGy
FFPは,三つのバッチffpの中央値からAを減じたものである。
例では,
FFP=2.6 kGy−0.65 kGy=1.95 kGy
バッチ1 d*
バッチ2 d*
バッチ3 d*
9.0 kGy
6.6 kGy
10.7 kGy
バッチd*は,a)又はb)の線量である。
a) 2回連続して陽性がなく,それ以後に2以上の陽性がない累加線量のうち,
小さい方の線量。
b) 陽性数が1であり,その直前の線量の無菌性の試験では陽性がなく,かつ,
それ以後は全て陰性となる最初の累加線量。
D*
9.0 kGy
D*は三つのバッチd*の中央値である。ただし,いずれかのバッチd*がd*の中央値
より5.0 kGy以上の場合には,D*はバッチd*の最大値を用いる。
CD*バッチ
バッチ1
CD*バッチは,D*に等しくなるd*をもつバッチである。複数のd*がD*に等しくな
る場合には,一つを無作為に選びCD*バッチとする。
11.2.2.3 第3段階:検定線量試験の実施
表19に第3段階で得られた数値を示す。
50
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表19−第3段階の計算
用語
数値
説明
D*
9.0 kGy
第2段階の試験から
検定線量試験
7.0 kGy〜
8.0 kGy
検定線量試験において製品試料への線量は,7.0 kGy〜8.0 kGyであった。
DD*
8.0 kGy
DD*は,検定線量試験での最大線量である。
線量が上限又は下限を超えたときは,CD*の値によって措置が異なる(8.2.4参照)。
例では,DD*は上限(10.0 kGy)を超えていなかった。
製品へのDD*と最小線量との算術平均(7.5 kGy)は,下限(8.0 kGy)未満であっ
た。
注記 このような状況でCD*が16以上であれば,検定線量試験はやり直してもよ
い。
CD*
2
CD*は,検定線量試験で得られた無菌性の試験の陽性数である。
例では,無菌性の試験で陽性数は2であり,これは合格である。
FNP
8.0 kGy
例では,CD*は2であり,FNPはDD*と等しく8.0 kGyである。
11.2.2.4 第4段階及び第5段階:結果の判定及び滅菌線量の確立
表20に滅菌線量を確立するための計算を示す。
表20−第4段階及び第5段階の滅菌線量を確立するための計算
用語
数値
説明
CD*
2
第3段階の試験から
DD*
8.0 kGy
第3段階の試験から
FNP
8.0 kGy
第3段階の試験から
FFP
1.95 kGy
第2段階の試験から
FNP−FFP
6.05 kGy
例では,
(FNP−FFP)=8.0 kGy−1.95 kGy
=6.05 kGy
注記 (FNP−FFP)<0の場合,(FNP−FFP)=0とする。
DS
3.21 kGy
(FNP−FFP)<10の場合,DS=2+0.2×(FNP−FFP)
[式(3)]
例では,
DS=2 kGy+0.2×(6.05) kGy
=3.21 kGy
D**
9.0 kGy
D**=DD*+[log (CD*)]×DS
[式(5)]
注記 CD*=0の場合,[log (CD*)]=0とする。
例では,
D**=8.0 kGy+[log (2)]×(3.21) kGy
=8.0 kGy+(0.301 0)×(3.21) kGy
=8.97 kGy
=9.0 kGy
SAL
10−6
第1段階での決定
SIP
1.0
第1段階での決定
SAL 10−6の
滅菌線量
21.8 kGy
滅菌線量=D**+[−log (SAL)−log (SIP)−2]×DS
[式(6)]
例では,
滅菌線量=9.0 kGy+(6−0−2)×(3.21) kGy
=9.0 kGy+(4)×(3.21) kGy
=21.8 kGy
51
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.2.3 方法2A(SIPは1.0未満)の実施例
11.2.3.1 第1段階:SALの選択及び製品サンプルの入手
11.2.3.1.1 製品のSALは10−3を選択した。製品は線量設定には大きすぎるため,試験には製品の一部分
(SIPは1.0未満)を使用し,三つのバッチからそれぞれ280個の製品試料を無作為に採取した。
11.2.3.1.2 累加線量試験に使用する製品試料の配分を,表21に示す。
表21−累加線量ごとの照射に必要な製品試料数
バッチ
No.
目標累加線量
(kGy)
第3段階
試験用の
製品試料数
必要な製品
試料総数
0
2
4
6
8
10
12
14
16
18
1
20
20
20
20
20
20
20
20
20
20
100
300
2
20
20
20
20
20
20
20
20
20
20
100
300
3
20
20
20
20
20
20
20
20
20
20
100
300
注記 SIPが1未満の妥当性を検証するために,追加の製品が必要である(5.2.5参照)。
11.2.3.2 第2段階:累加線量試験の実施
表22に一連の累加線量試験で得られたデータの例を,表23にその試験で得られた値を示す。
表22−累加線量試験で得られた代表的なデータ
(20個のSIP試料から得られた無菌性の試験の陽性数)
バッチ
No.
目標累加線量
(kGy)
2
4
6
8
10
12
14
16
18
1
最大線量(kGy)
1.8
3.7
6.3
7.8
10.9
12.8
14.2
15.2
18.0
陽性数
17
1
0
0
0
0
0
0
0
2
最大線量(kGy)
1.5
3.9
5.7
8.5
9.9
11.3
14.5
17.3
18.4
陽性数
20
3
0
0
0
0
0
0
0
3
最大線量(kGy)
2.5
3.5
6.1
7.3
10.2
12.4
12.7
14.8
17.7
陽性数
9
0
1
0
0
0
0
0
0
注記1 3バッチから採取した未照射のSIP試料を個別に無菌性の試験を実施し,各バッチで少なくとも17の陽性が
あった。
注記2 それぞれの累加線量での最大線量と最小線量との算術平均は,あらかじめ規定した下限よりも高い。
52
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表23−第2段階の計算
用語
数値
説明
バッチ1 ffp
バッチ2 ffp
バッチ3 ffp
1.8 kGy
3.9 kGy
2.5 kGy
バッチffpは,20個の無菌性の試験のうち,少なくとも一つが陰性となる最初の累
加線量である。
A
0.79 kGy
ffp中央値における無菌性の試験の陽性数を求め,表7からAを求める。
例では,ffp中央値(2.5 kGy)における陽性数は9なので,Aは0.79 kGyであった。
FFP
1.71 kGy
FFPは三つのバッチffpの中央値からAを減じたものである。
例では,
FFP=2.5 kGy−0.79 kGy=1.71 kGy
バッチ1 d*
バッチ2 d*
バッチ3 d*
6.3 kGy
5.7 kGy
6.1 kGy
バッチd*は,a)又はb)の線量である。
a) 2回連続して陽性がなく,それ以後に2以上の陽性がない累加線量のうち,
小さい方の線量。
b) 陽性数が1であり,その直前の線量の無菌性の試験では陽性がなく,かつ,
それ以後は全て陰性となる最初の累加線量。
D*
6.1 kGy
D*は三つのバッチd*の中央値である。ただし,いずれかのバッチd*がd*の中央値
より5.0 kGy以上の場合には,D*はバッチd*の最大値を用いる。
CD*バッチ
バッチ3
CD*バッチは,D*に等しくなるd*をもつバッチである。複数のd*がD*に等しくな
る場合には,一つを無作為に選びCD*バッチとする。
11.2.3.3 第3段階:検定線量試験の実施
表24に第3段階の試験で得られた数値を示す。
表24−第3段階の計算
用語
数値
説明
D*
6.1 kGy
第2段階の試験から
検定線量試験
5.1 kGy〜
5.5 kGy
検定線量試験において製品試料への線量は,5.1 kGy〜5.5 kGyであった。
DD*
5.5 kGy
DD*は,検定線量試験での最大線量である。
線量が上限又は下限を超えたときは,CD*の値によって措置が異なる(8.2.4参照)。
例では,DD*は上限(7.1 kGy)を超えていなかった。
製品へのDD*と最小線量との算術平均(5.3 kGy)は,下限(5.1 kGy)未満ではな
かった。
CD*
2
CD*は,検定線量試験で得られた無菌性の試験の陽性数である。
例では,無菌性の試験で陽性数は2であり,これは合格である。
FNP
5.5 kGy
例では,CD*は2であり,FNPはDD*と等しく5.5 kGyである。
11.2.3.4 第4段階及び第5段階:結果の判定及び滅菌線量の確立
表25に滅菌線量を確立するための計算を示す。
53
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表25−第4段階及び第5段階の滅菌線量を確立するための計算
用語
数値
説明
CD*
2
第3段階の試験から
DD*
5.5 kGy
第3段階の試験から
FNP
5.5 kGy
第3段階の試験から
FFP
1.71 kGy
第2段階の試験から
FNP−FFP
3.79 kGy
例では,
(FNP−FFP)=5.5 kGy−1.71 kGy
=3.79 kGy
注記 (FNP−FFP)<0の場合,(FNP−FFP)=0とする。
DS
2.76 kGy
(FNP−FFP)<10の場合,DS=2+0.2×(FNP−FFP)
[式(3)]
例では,
DS=2 kGy+0.2×(3.79) kGy
=2.76 kGy
D**
6.3 kGy
D**=DD*+[log (CD*)]×DS
[式(5)]
注記 CD*=0の場合,[log (CD*)]=0とする。
例では,
D**=5.5 kGy+[log (2)]×(2.76) kGy
=5.5 kGy+(0.301 0)×(2.76) kGy
=6.33 kGy
=6.3 kGy
SAL
10−3
第1段階での決定
SIP
0.05
第1段階での決定
SAL 10−3の
滅菌線量
12.7 kGy
滅菌線量=D**+[−log (SAL)−log (SIP)−2]×DS
[式(6)]
例では,
滅菌線量=6.3 kGy+(3+1.301−2)×(2.76) kGy
=6.3 kGy+(2.301)×(2.76) kGy
=12.65 kGy
=12.7 kGy
11.2.4 方法2Bの実施例
11.2.4.1 第1段階:SALの選択及び製品サンプルの入手
11.2.4.1.1 方法2Bでは製品のSALは10−6を選択した。製品試料全体(SIPは1.0)を線量設定に使用する。
第1段階では,三つのバッチからそれぞれ260個の製品試料を無作為に採取した。
11.2.4.1.2 累加線量試験に使用する製品試料の配分を,表26に示す。
表26−累加線量ごとの照射に必要な製品試料数
バッチ
No.
目標累加線量
(kGy)
第3段階
試験用の
製品試料数
必要な製品
試料総数
1
2
3
4
5
6
7
8
1
20
20
20
20
20
20
20
20
100
260
2
20
20
20
20
20
20
20
20
100
260
3
20
20
20
20
20
20
20
20
100
260
11.2.4.2 第2段階:累加線量試験の実施
表27に一連の累加線量試験で得られたデータの例を,表28に計算例を示す。
54
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表27−累加線量のデータ
バッチ
No.
目標累加線量
(kGy)
1
2
3
4
5
6
7
8
1
最大線量(kGy)
1.2
2.4
3.3
4.4
4.6
6.4
6.3
7.8
陽性数
13
2
0
0
0
0
0
0
2
最大線量(kGy)
1.1
1.5
2.6
3.8
5.2
5.9
7.2
8.3
陽性数
8
7
1
0
0
0
0
0
3
最大線量(kGy)
1.0
2.2
2.6
3.7
5.2
6.1
7.7
8.8
陽性数
12
4
0
1
0
0
0
0
注記1 いずれの累加線量も無菌性の陽性数が14を超えないという要求に適合している。
注記2 それぞれの累加線量での最大線量と最小線量との算術平均は,あらかじめ規定した下限よりも高い。
表28−第2段階の計算
用語
数値
説明
バッチ1 ffp
バッチ2 ffp
バッチ3 ffp
1.2 kGy
1.1 kGy
1.0 kGy
バッチffpは,20個の無菌性の試験のうち,少なくとも一つが陰性となる最初の累
加線量である。
A
0.44 kGy
ffp中央値における無菌性の試験の陽性数を求め,表8からAを求める。
例では,ffp中央値(1.1 kGy)における陽性数は8なので,Aは0.44 kGyとなる。
FFP
0.66 kGy
FFPは三つのバッチffpの中央値からAを減じたものである。
例では,
FFP=1.10 kGy−0.44 kGy=0.66 kGy
バッチ1 d*
バッチ2 d*
バッチ3 d*
3.3 kGy
3.8 kGy
3.7 kGy
バッチd*は,a)又はb)の線量である。
a) 2回連続して陽性がなく,それ以後に2以上の陽性がない累加線量のうち,
小さい方の線量。
b) 陽性数が1であり,その直前の線量の無菌性の試験では陽性がなく,かつ,
それ以後は全て陰性となる最初の累加線量。
D*
3.7 kGy
D*は三つのバッチd*の中央値である。
CD*バッチ
バッチ3
CD*バッチは,D*に等しくなるd*をもつバッチである。
11.2.4.3 第3段階:検定線量試験の実施
表29に第3段階の試験で得られた数値を示す。

55
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表29−第3段階の計算
用語
数値
説明
D*
3.7 kGy
第2段階の試験から
検定線量試験
2.6 kGy〜
3.4 kGy
検定線量試験において製品試料への線量は,2.6 kGy〜3.4 kGyであった。
DD*
3.4 kGy
DD*は,検定線量試験での最大線量である。
線量が上限又は下限を超えたときは,CD*の値によって措置が異なる(8.3.4参照)。
例では,DD*は,上限(4.7 kGy)を超えていなかった。
製品へのDD*と最小線量との算術平均(3.0 kGy)は,下限(2.7 kGy)未満ではな
かった。
CD*
3
CD*は,検定線量試験で得られた無菌性の試験の陽性数である。
FNP
5.4 kGy
例では,
CD*は3であり,したがって,
FNP=DD*+2 kGy
=3.4 kGy+2 kGy
=5.4 kGy
注記 FNPは,5.5 kGyを超えてはならない。
11.2.4.4 第4段階及び第5段階:結果の考察及び滅菌線量の確立
表30に滅菌線量を確立するための計算を示す。
表30−第4段階及び第5段階の滅菌線量を確立するための計算
用語
数値
説明
CD*
3
第3段階の試験から
DD*
3.4 kGy
第3段階の試験から
FNP
5.4 kGy
第3段階の試験から
FFP
0.66 kGy
第2段階の試験から
FNP−FFP
4.74 kGy
例では,
(FNP−FFP)=5.4 kGy−0.66 kGy
=4.74 kGy
注記 (FNP−FFP)<0の場合,(FNP−FFP)=0とする。
DS
2.55 kGy
DS=1.6 kGy+0.2×[FNP−FFP]
[式(8)]
例では,
DS=1.6 kGy+0.2×(4.74) kGy
=2.55 kGy
D**
4.6 kGy
D**=DD*+[log (CD*)]×DS
[式(5)]
注記 CD*=0の場合,[log (CD*)]=0とする。
例では,
D**=3.4 kGy+[log (3)]×(2.55) kGy
=3.4 kGy+(0.477 1)×(2.55) kGy
=4.62 kGy
=4.6 kGy
SAL
10−6
第1段階で決定
SIP
1.0
第1段階の要求事項
SAL 10−6の
滅菌線量
14.8 kGy
滅菌線量=D**+[−log(SAL)−2]×DS
[式(9)]
例では,
滅菌線量=4.6 kGy+(6−2)×(2.55) kGy
=4.6 kGy+(4)×(2.55) kGy
=14.8 kGy
56
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.3 VDmax法の実施例
表31にVDmax25法の実施例を示す。実施例では線量実証試験において製品試料が大きすぎるため,製品
試料の一部分(SIPは1.0未満)を使用した。表32に製品試料全体(SIPは1.0)を使用する必要がある
VDmax15法の実施例を示す。
表31−VDmax25の実証(SIPは1.0未満)
用語
数値
説明
第1段階
SAL
10−6
この方法は,最大SAL 10−6を達成するための滅菌線量としての25 kGyを実証する。
SIP
0.5
この製品は,無菌性の試験には大きすぎるため,試験には製品の半分の部分を使用
した。
製品試料数
40
バイオバーデン決定に3バッチからそれぞれ10個及び検定線量試験に10個を採取
した。
第2段階
平均バイオ
バーデン
118
3バッチのSIPバッチ平均バイオバーデンは,50,62,65であった。
各バッチの製品試料全体のバイオバーデンは,次のように計算した。
50/0.5=100
62/0.5=124
65/0.5=130
全平均バイオバーデンは118であった。
バッチ平均バイオバーデンの最大値は130であった。
バッチ平均バイオバーデンの最大値130は,全平均バイオバーデン118の2倍未満
のため,118を用いてSIP=1.0 VDmax25を求めた。
第3段階
SIP検定線量
8.1 kGy
表9からSIP=1.0 VDmax25及びSIP線量減少係数を求める。表にはバイオバーデン
118の記載がないので,表中にある次に大きな値の120を用いた。SIPが0.5のSIP
VDmax25は,次の式を用いて算出した。
SIP VDmax25=(SIP=1.0 VDmax25)+(SIP線量減少係数)×log(SIP)
[式(10)]
SIP VDmax25=9.0 kGy+(2.91×log0.5)
=8.1 kGy
第4段階
検定線量試験
7.1 kGy〜
8.7 kGy
検定線量試験において製品試料への線量は,7.1 kGy〜8.7 kGyであった。
第5段階
結果の判定
陽性数
0
製品試料への最大線量は,上限(8.9 kGy)を超えておらず,最大線量と最小線量
との算術平均7.9 kGyは,検定線量の90 %未満ではなかった(8.1 kGyの90 %は7.3
kGy)。
線量は限度内であり,無菌性の試験の結果は合格(すなわち,陽性数は1以下)で
あり,検定は合格で滅菌線量として25 kGyは実証された。
57
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表32−VDmax15の実証(SIPは1.0)
用語
数値
説明
第1段階
SAL
10−6
この方法は,最大SAL 10−6を達成するための滅菌線量としての15 kGyを実証する。
SIP
1.0
試験のため製品試料全体を使用した。
製品試料数
40
バイオバーデン決定に3バッチからそれぞれ10個及び検定線量試験に10個を採取
した。
第2段階
平均バイオ
バーデン
0.73
3バッチの平均バイオバーデンは,0.8,0.7,0.7であった。
全平均バイオバーデンは0.73であった。
バッチ平均バイオバーデンの最大値は0.8であった。
バッチ平均バイオバーデンの最大値0.8は,全平均バイオバーデン0.73の2倍未満
のため,0.73を用いてSIP=1.0 VDmax15を求めた。
第3段階
検定線量
2.3 kGy
表10から検定線量を求める。表には平均バイオバーデン0.73の記載がないので,
表中にある次に大きな値の0.8を用いた。
第4段階
検定線量試験
2.1 kGy〜
2.5 kGy
検定線量試験において製品試料への線量は,2.1 kGy〜2.5 kGyであった。
第5段階
結果の判定
陽性数
0
製品試料への最大線量は,上限(2.5 kGy)を超えておらず,最大線量と最小線量
との算術平均2.3 kGyは,検定線量の90 %未満ではなかった(2.3 kGyの90 %は2.1
kGy)。
線量は限度内であり,無菌性の試験の結果は合格(すなわち,陽性数は1以下)で
あり,検定は合格で滅菌線量として15 kGyは実証された。
58
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.4 方法1を用いて確立した滅菌線量監査で滅菌線量の増加が必要となる場合の実施例
方法1における滅菌線量監査の手順は,SIPが1.0又は1.0未満にかかわらず同じである。
次の例は,表13に示した例の続きであり,そこではSALは10−3,最初のバリデーションの第2段階で
得られた平均バイオバーデンの最大値は382,第3段階で確定した検定線量は9.7 kGy,第6段階で確立し
た滅菌線量は12.9 kGyであった。
表33は滅菌線量確立後の最初の滅菌線量監査の例である。
表33−滅菌線量の増加が必要となる滅菌線量監査(方法1を用いて確立した滅菌線量)
用語
数値
説明
第1段階
監査陽性数
陽性数
4
滅菌線量監査で得られた無菌性の試験の陽性数。陽性数が3以上であったので,直
ちに滅菌線量を増加する必要がある。
最大監査線量
9.5 kGy
“最大監査線量”は,最初の検定線量からその10 %を超えていない。
第2段階
E
11.5 Gy
E=“最大監査線量”+2 kGy
[式(11)]
例では,
E=9.5 kGy+2 kGy
=11.5 kGy
(E ‒ 1)
10.5 kGy
例では,
11.5 kGy−1.0 kGy=10.5 kGy
外挿係数
4.2 kGy
9<(E−1)の場合,式(14)で外挿係数を求める。
外挿係数=0.4×(E−1)
[式(14)]
例では,
外挿係数=0.4×(10.5 kGy)
=4.2 kGy
第3段階
調整線量
12.0 kGy
調整線量=“最大監査線量”+[log(監査陽性数)]×(外挿係数)
[式(15)]
例では,
調整線量=9.5 kGy+(log 4)×(4.2 kGy)
=12.0 kGy
第4段階
増加滅菌線量
16.2 kGy
増加滅菌線量=調整線量+[−log (SAL)−log(SIP)−2]×(外挿係数)
[式(16)]
例では,
製品に適用されるSALは10−3である。最初の検定線量試験及び滅菌線量監査で
は製品全体を使用した。
増加滅菌線量=12.0 kGy+[−log (10−3)−log (1)−2]×(4.2 kGy)
=16.2 kGy
59
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.5 方法2Aを用いて確立した滅菌線量監査で滅菌線量の増加が必要となる場合の実施例
方法2A(SIP は1.0),方法2A(SIPは1.0未満)及び方法2Bでは,滅菌線量監査の手順は同じである。
表34に示すのは11.2.2の実施例で,方法2Aを用いて当初滅菌線量が21.8 kGyと決定された例である。
最初の線量設定では製品試料全体(SIPは1.0)を使用し,第1段階でSAL 10−6が選択され,第5段階で
9.0 kGyのD**が得られた。
表34−滅菌線量の増加が必要となる滅菌線量監査(方法2Aを用いて確立した滅菌線量)
用語
数値
説明
第1段階
監査陽性数
7
滅菌線量監査で得られた無菌性の試験の陽性数。陽性数が3以上であったので,直
ちに滅菌線量を増加する必要がある。
最大監査線量
8.9 kGy
“最大監査線量”は,最初の検定線量からその10 %を超えていない。
第2段階
E
10.9 kGy
E=“最大監査線量”+2 kGy
[式(11)]
例では,
E=8.9 kGy+2 kGy
=10.9 kGy
(E ‒ 1)
9.9 kGy
10.9 kGy−1.0 kGy=9.9 kGy
外挿係数
4.0 kGy
9<(E−1)の場合,式(14)で外挿係数を求める。
外挿係数=0.4×(E−1)
[式(14)]
例では,
外挿係数=0.4×(9.9 kGy)
=4.0 kGy
第3段階
調整線量
12.3 kGy
調整線量=“最大監査線量”+[log(監査陽性数)]×(外挿係数)
[式(15)]
例では,
調整線量=8.9 kGy+(log 7)×(4.0 kGy)
=12.3 kGy
第4段階
増加滅菌線量
28.3 kGy
増加滅菌線量=調整線量+[−log (SAL)−log (SIP)−2]×(外挿係数)
[式(16)]
例では,
製品に適用されるSALは10−6である。最初の検定線量試験及び滅菌線量監査で
は製品全体を使用した。
増加滅菌線量=12.3 kGy+[−log (10−6)−log (1)−2]×(4.0 kGy)
=28.3 kGy
60
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.6 VDmax25法で実証した滅菌線量監査の実施例
VDmax25法の監査手順は,SIPが1.0又は1.0未満にかかわらず同じである。表35は25 kGyの滅菌線量
が実証された後の最初の滅菌線量監査の例である。
表35−VDmax25の滅菌線量監査(監査不合格で線量増加の場合)
用語
数値
説明
第1段階
製品試料数
20
単一製造バッチから20個の製品試料を採取した。
第2段階
SIP
0.5
最初の25 kGyの実証試験では,SIPは0.5を使用した。
SIP 平均バイ
オバーデン
354
試験した10個のSIPの平均バイオバーデンは354であった。
平均バイオ
バーデン
708
製品試料全体の平均バイオバーデンは,次のように計算した。
354/0.5=708
第3段階
検定線量試験
7.1 kGy〜
8.7 kGy
最初の25 kGyの実証試験は,検定線量8.1 kGyで実施され,10個のSIPはこの線
量で照射した。SIPへの線量は,7.1 kGy〜8.7 kGyであった。
第4段階
結果の判定
陽性数
2
SIPへの最大線量は上限(8.9 kGy)を超えておらず,最大線量と最小線量との算術
平均7.9 kGyは,検定線量の90 %未満ではなかった(8.1 kGyの90 %は7.3 kGy)。
線量は限度内であったが,無菌性の試験で陽性数が2であったため,確認滅菌線量
監査の実施が必要であった。
確認滅菌線量監査
第1段階
製品試料数
10
単一製造バッチから追加で10個の製品試料を採取した。
第2段階
確認検定
線量試験
7.1 kGy〜
8.5 kGy
確認滅菌線量監査の検定線量は,最初の検定線量と同じである。10個のSIPをこ
の線量で照射した。SIPへの線量は,7.1 kGy〜8.5 kGyであった。
第3段階
結果の判定
陽性数
1
SIPへの最大線量は上限(8.9 kGy)を超えておらず,最大線量と最小線量との算術
平均7.8 kGyは,検定線量の90 %未満ではなかった(8.1 kGyの90 %は7.3 kGy)。
線量は限度内であったが,確認滅菌線量監査の無菌性の試験で陽性数が1であった
ので,25 kGyの滅菌線量を直ちに増加し,他の方法で滅菌線量を再確立する。
線量増加
平均バイオ
バーデン
708
滅菌線量監査のために決定した製品試料全体の平均バイオバーデンを用いて増加
滅菌線量を決定した。
線量増加値
3.4 kGy
平均バイオバーデン及び表11から線量増加値を決定した。708が表に記載されて
いないので,表中にある次に大きな値の平均バイオバーデン750を用いた。
増加滅菌線量
28.4 kGy
増加滅菌線量(kGy)=25 kGy+線量増加値(kGy)
[式(18)]
例では,
増加滅菌線量(kGy)=25 kGy+3.4 kGy=28.4 kGy
11A
VDmaxSD法で実証した滅菌線量監査の実施例
VDmaxSD法で実証した滅菌線量監査の実施例は,JA.5による。
61
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(規定)
VDmaxSD法
この附属書は,2013年に初版として発行されたISO/TS 13004を基とし,技術的内容を変更することな
く作成したものである。
JA.1 一般
この附属書は,10−6以下のSAL(Sterility Assurance Level)を達成するための滅菌線量としての17.5 kGy,
20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy又は35 kGyを実証する方法及びこの選択した滅菌線量が
継続して有効であることを立証するための滅菌線量監査の方法について規定する。
JA.2 VDmaxSD法−滅菌線量としての17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy又は35 kGy
の実証
JA.2.1 理論的根拠
選択した滅菌線量の実証方法は,実施面では本体の方法1の線量設定法と類似している。この方法の場
合もバイオバーデンの決定及び検定線量試験を実施する必要がある。
滅菌線量の実証を行うには,滅菌前の製品に存在するバイオバーデンが,選択した滅菌線量でSAL 10−6
を達成するのに相当する最大抵抗性をもつ微生物群より,小さい放射線抵抗性を示すことを検証する。検
証は,検定線量試験で照射した10個の製品試料を用いSAL 10−1で行う。この抵抗性をもつ微生物群に対
してSAL 10−1での線量(最大検定線量,VDmax)は,バイオバーデン,滅菌線量及び関連する最大抵抗性
に特有なものである。ある特定のバイオバーデン及び滅菌線量における最大抵抗性を確立する場合は,方
法1の基礎となる標準抵抗性分布(SDR)の様々な抵抗性の構成要素について考慮されている。SAL 10−6
の達成に重大な影響を及ぼすSDRの高抵抗性の構成要素は,この実証法の基礎になる最大抵抗性を定義す
るために用いられる。このような方法でSDR 及び方法1における安全度を維持している。Kowalski and
Tallentire [16],Kowalski, Aoshuang, and Tallentire [15]及びKowalski and Tallentire[17]参照。
具体的には,決定には平均バイオバーデンを使用する。この平均バイオバーデンを基に,選択した滅菌
線量を適用しようとする平均バイオバーデンの上限が掲載されている表JA.1から滅菌線量を選択する。こ
の上限値が選択した滅菌線量でSAL 10−6の達成に相当する所定の最大抵抗性をもつ微生物数である。選択
した滅菌線量と平均バイオバーデンとに対応するVDmax線量を表JA.3〜表JA.9の平均バイオバーデンの
右欄(SIP=1.0 VDmaxSD)から読み取る。この値が検定線量試験を実施するときの線量となる。10個の製
品試料又は分割試料にVDmax線量を照射し,各々の製品試料を個別に無菌性の試験を行う。10個の無菌性
の試験のうち陽性数が1以下の場合は,あらかじめ選択した滅菌線量を実証したことになる。
この附属書で示すVDmax法は,選択した17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy及び
35 kGyの滅菌線量についてのものである。VDmax法の適用及びそれらに関連する一連の検定線量を区別す
るために,VDmaxに選択した滅菌線量を上付文字として加えてVDmaxSDと表記する。
注記 JA.3の表に示す様々な平均バイオバーデンに対するVDmaxSDの値を検討すると,バイオバーデ
ンとVDmaxSDの値との関係に変化があることが分かる。バイオバーデンがある水準まで増加す
るに従い,その値は当然想定されるように徐々に増加する。しかし,バイオバーデンがある特
62
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
定な数値のときVDmaxSDは最大となり,これより大きいバイオバーデンでは,対応するVDmaxSD
の値は徐々に減少する。例えば,VDmax17.5の場合,バイオバーデンが2.5までは増加するが,
バイオバーデン2.5でVDmax17.5は最大になり,それ以上のバイオバーデンではVDmax17.5は減少
する。他のVDmaxSD法でも同様な増減が見られる。この挙動はVDmaxSDの値の表又は計算の誤
りではなく,VDmax法に方法1と同等の安全度を見込んだため生じた必然的な結果である
(Kowalski and Tallentire [17]参照)。
JA.2.2 複数製造バッチにVDmaxSD法を適用する手順
JA.2.2.1
一般
JA.2.2.1.1
平均バイオバーデンが0.9以下の製品にVDmaxSD法を適用する場合は,製品試料全体を用いな
ければならないが,平均バイオバーデンが0.9を超える製品については,SIPを用いてもよい(5.2.5参照)。
JA.2.2.1.2
VDmaxSD法を適用するには,次の6段階の手順を実施しなければならない。
注記 実施例は,JA.5.1及びJA.5.2を参照。
JA.2.2.2
第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,独立した三つの製造バッチからそれぞれ10個の製品試料
を採取する。
注記 検定線量試験(JA.2.2.6.1参照)を実施するためにも製品が必要である。また,SIPが1未満の
妥当性の検証(5.2.5参照)のため,又は確認検定線量試験(JA.2.2.7及びJA.2.2.8参照)のた
めに追加の製品が必要になることがある。
JA.2.2.3
第2段階:平均バイオバーデンの決定
JA.2.2.3.1
バイオバーデンの決定には,補正係数(JIS T 11737-1参照)を適用する。
JA.2.2.3.2
採取した製品試料のバイオバーデンを決定し,次を計算する。
a) 三つの製品バッチのそれぞれについての製品試料の平均バイオバーデン(バッチ平均バイオバーデン)
b) 全ての製品試料の平均バイオバーデン(全平均バイオバーデン)
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,バッチ平均バイオバーデンの決定のため10個の製品試料をまと
めてもよい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろ
より大きなSIP を選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。過大評価は,高すぎる滅菌線量の選択となり,そのために高
いVDmaxSD線量を選択するため,検定線量試験の検証に影響することがある。低い検出限界
のバイオバーデン測定法を採用することでこのような過大評価を少なくすることができる。
SIPが1.0未満の場合は,三つのバッチのSIP平均バイオバーデン及び全平均バイオバーデンをSIPで除
して,製品試料全体(SIPは1.0)の平均バイオバーデンを計算する。
JA.2.2.4
第3段階:選択した滅菌線量の取得
JA.2.2.4.1
滅菌線量の取得では,製品試料全体(SIPは1.0)の平均バイオバーデンを用いなければなら
ない(JA.2.2.3.2参照)。
JA.2.2.4.2
表JA.1から選択した滅菌線量を取得する。この線量を取得するに当たっては,第2段階で決
定した三つのバッチ平均バイオバーデン(SIPは1.0)全てが表JA.1に示されている該当する平均バイオ
63
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
バーデンの上限以下でなければならない。
JA.2.2.4.3
JA.2.2.4.2の要求に合致する最小線量よりも高い滅菌線量を選択する場合もある。より高い滅
菌線量を選択する理由は,次のような要因に基づく場合がある。
a) 平均バイオバーデンと選択した滅菌線量に該当する上限との差異。
b) バイオバーデンを構成する微生物の数及びタイプの変動に関する利用可能なデータ。
c) 類似製品の微生物学的な特性に関する利用可能なデータ。これには滅菌線量監査の結果を含む。
d) 製品を構成する材料及び材料の微生物学的品質管理。
e) 製造プロセス並びに関連する管理及び監視手順。特にバイオバーデン又はその抵抗性に影響を及ぼす
工程。
f)
製造環境,特に微生物学的管理及び監視手順の範囲,並びに経時的な製造環境の安定性に関する利用
可能なデータ。
表JA.1−滅菌線量を選択するための平均バイオバーデンの上限
平均バイオバーデンの上限
(SIPは1.0)
選択する滅菌線量
(kGy)
9.0
17.5
45
20
220
22.5
5000
27.5
23000
30
100000
32.5
440000
35
JA.2.2.5
第4段階:VDmaxSDの取得
JA.2.2.5.1
表JA.2から選択した滅菌線量に対してSIP=1.0 VDmaxSDの平均バイオバーデンに対応する線
量減少係数及び線量増加値を示すJA.3の表を選定する。
表JA.2−選択した滅菌線量に該当するJA.3の表
選択する滅菌線量
(kGy)
JA.3の対応する表
17.5
表JA.3
20
表JA.4
22.5
表JA.5
27.5
表JA.6
30
表JA.7
32.5
表JA.8
35
表JA.9
JA.2.2.5.2 第2段階で決定した三つのバッチ平均バイオバーデンと全平均バイオバーデンとを比較して,
バッチ平均バイオバーデンのいずれかが全平均バイオバーデンの2倍以上であるかを調べる。
JA.2.2.5.3
選定した表から平均バイオバーデンとして,次のいずれかを用いてSIP=1.0 VDmaxSDを求め
る。
a) バッチ平均バイオバーデンのいずれか一つが,全平均バイオバーデンの2倍以上の場合は,バッチ平
均バイオバーデンの最大値を用いる。
64
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) それぞれのバッチ平均バイオバーデンが,全平均バイオバーデンの2倍未満の場合は,全平均バイオ
バーデンを用いる。
SIPが1.0で平均バイオバーデンがJA.3の表にない場合は,平均バイオバーデンよりも大きく,表にあ
る最も近いSIP=1.0 VDmaxSDの平均バイオバーデンを用いる。
SIPが1.0未満の場合は,JA.3の選定した表を使用するために第2段階(JA.2.2.3.2)で計算した製品試
料全体(SIPは1.0)の平均バイオバーデンを用いる。平均バイオバーデンがJA.3の表にない場合は,平
均バイオバーデンより大きく,表にある最も近いSIP=1.0 VDmaxSDの平均バイオバーデンを用い,かつ,
対応するSIP線量減少係数を用いる。式(JA.1)を用いて,SIP VDmaxSDを計算する(Kowalski and Tallentire [17]
参照)。
SIP VDmaxSD線量=(SIP=1.0 VDmaxSD)+(SIP線量減少係数×log SIP) ····· (JA.1)
注記 平均バイオバーデンが0.9以下の製品には,1.0未満のSIP を使用してはならない(JA.2.2.1.1
参照)。
JA.2.2.6
第5段階:検定線量試験の実施
JA.2.2.6.1
単一製造バッチの製品から10個の製品試料を採取する。第5段階で実施するための10個の
製品試料は,第2段階のバイオバーデンの決定に使用したバッチの一つから採取するか又は通常の生産条
件で製造した第4のバッチから採取してもよい(5.3参照)。
JA.2.2.6.2
JA.3の表から得たVDmaxSD又は式(JA.1)で求めたVDmaxSDのうち適切な方で,これらの製品試
料を照射する。
製品試料に照射した最大線量は,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えては
ならない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合は,検定線量試験を
やり直してもよい。この平均線量がVDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が得られ
た場合(JA.2.2.7参照)には,検定線量試験をやり直す必要はない。
JA.2.2.6.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録
する。
JA.2.2.7
第6段階:結果の判定
JA.2.2.7.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり選択し
た滅菌線量は実証されたものとする。
JA.2.2.7.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(JA.2.2.8参照)を実施する。
JA.2.2.7.3
無菌性の試験で陽性数が3以上の場合は,選択した滅菌線量は不十分な可能性があり検定線
量試験は不合格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmaxSDの照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して,検定線量試験をやり直す。是正措置の結果,平均バイオバーデンの評価を変更
65
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
した場合は,変更後の平均バイオバーデンに相当するVDmaxSDを使用する。平均バイオバーデンの評価を
変更しなかった場合には,不合格となった検定線量試験と同じVDmaxSDを使用する。やり直した検定線量
試験の結果は,JA.2.2.7に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmaxSDの照射又は特定のバイオバーデンに関連する原因でない場合には,選択した滅菌線量は実証され
ないため,他の方法で滅菌線量を確立しなければならない。他の方法には,次のいずれかの方法がある。
a) 第3段階(JA.2.2.4)から始まるVDmaxSD法で不合格となった線量より更に高い滅菌線量の選択及び実
証
b) 方法1
c) 方法2
d) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
JA.2.2.8
確認検定線量試験
JA.2.2.8.1
一般
確認検定線量試験(JA.2.2.7.2参照)を実施するには,次の3段階の手順を実施しなければならない。
JA.2.2.8.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。確認検定線量試験を実施するための10個の製
品試料は,第2段階(JA.2.2.3参照)のバイオバーデンの決定に使用したバッチの一つから採取するか又
は第5段階(JA.2.2.6.1参照)で用いた第4のバッチ若しくは通常の生産条件で製造したバッチから採取し
てもよい(5.3参照)。
JA.2.2.8.3
第2段階:確認検定線量試験の実施
JA.2.2.8.3.1
JA.2.2.5で求めたVDmaxSDでこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えては
ならない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,確認検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合は,確認検定線量試
験をやり直してもよい。この平均線量が,VDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が
得られた場合(JA.2.2.8.4参照)には,確認検定線量試験をやり直す必要はない。
JA.2.2.8.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記
録する。
JA.2.2.8.4
第3段階:結果の判定
JA.2.2.8.4.1
実施した10個の無菌性の試験で陽性がない場合は,確認検定線量試験は合格であり選択し
た滅菌線量は実証されたものとする。
JA.2.2.8.4.2
無菌性の試験で陽性が得られた場合は,選択した滅菌線量は不十分な可能性があり,確認
検定線量試験は不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
66
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
バーデンに関連する原因による場合は,是正処置を行った後に,通常の生産条件で製造したバッチから更
に10個の製品試料を使用して最初と同じVDmaxSDを用いて確認検定線量試験をやり直す。やり直した確認
検定線量試験の結果は,JA.2.2.8.4に従って判定する。
無菌性の試験の陽性結果が,不適正な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した滅菌線量は実証されないため,他の方法で滅菌線量を
確立しなければならない。他の方法には,次のいずれかの方法がある。
a) 第3段階(JA.2.2.4)から始まるVDmaxSD法で不合格となった線量より更に高い滅菌線量の選択及び実
証
b) 方法1
c) 方法2
d) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
JA.2.3 単一製造バッチにVDmaxSDを適用する手順
JA.2.3.1
理論的根拠
この方法はVDmaxSDの変法であり,単一製造バッチの選択した滅菌線量の実証だけに用いることを目的
としている。
JA.2.3.2
一般
JA.2.3.2.1
平均バイオバーデンが0.9以下の製品にVDmaxSD法を適用する場合は,製品試料全体を用いな
ければならないが,平均バイオバーデンが0.9を超える製品については,SIPを用いてもよい(5.2.5参照)。
JA.2.3.2.2
微生物の生育を支持する能力がある製品は,単一製造バッチの生産から滅菌までの間,その
ような生育を抑制する条件下で保管するのが望ましい。
JA.2.3.2.3
VDmaxSD法を適用するには,次の6段階の手順を実施しなければならない。
JA.2.3.3
第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチから10個の製品試料を採取する。
注記 検定線量試験(JA.2.3.7参照)を実施するためにも製品が必要である。また,SIPが1未満の妥
当性の検証(5.2.5参照)のため,又は確認検定線量試験(JA.2.3.9参照)のために追加の製品
が必要になることがある。
JA.2.3.4
第2段階:平均バイオバーデンの決定
JA.2.3.4.1
バイオバーデンの決定には,補正係数(JIS T 0806-1参照)を適用する。
JA.2.3.4.2
採取した製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,平均バイオバーデンの決定のため10個の製品試料をまとめても
よい。この方法は,SIPには適用するものではない。SIPはまとめてはならず,むしろより大
きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。過大評価は,高すぎる滅菌線量の選択となり,そのために高
いVDmaxSD線量を選択するため,検定線量試験の検証に影響することがある。低い検出限界
のバイオバーデン測定法を採用することでこのような過大評価を少なくすることができる。
SIPが1.0未満の場合は,SIP平均バイオバーデンをSIPで除して,製品試料全体(SIPは1.0)の平均バ
67
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
イオバーデンを計算する。
JA.2.3.5
第3段階:選択した滅菌線量の取得
JA.2.3.5.1
滅菌線量の取得では,製品試料全体(SIPは1.0)の平均バイオバーデンを用いなければなら
ない(JA.2.3.4.2参照)。
JA.2.3.5.2
表JA.1から選択した滅菌線量を取得する。この線量を取得するに当たっては,第2段階で決
定したバッチ平均バイオバーデン(SIPは1.0)は,表JA.1に示されている該当する平均バイオバーデン
の上限以下でなければならない。
JA.2.3.5.3
JA.2.3.5.2の要求に合致する最小線量よりも高い滅菌線量を選択する場合もあり得る。より高
い滅菌線量を選択する理由は,次のような要因に基づく場合がある。
a) 平均バイオバーデンと選択した滅菌線量に該当する上限との差異。
b) バイオバーデンを構成する微生物の数及びタイプの変動に関する利用可能なデータ。
c) 類似製品の微生物学的な特性に関する利用可能なデータ。これには滅菌線量監査の結果を含む。
d) 製品を構成する材料及び材料の微生物学的品質管理。
e) 製造プロセス並びに関連する管理及び監視手順。特にバイオバーデン又はその抵抗性に影響を及ぼす
工程。
f)
製造環境,特に微生物学的管理及び監視手順の範囲,並びに経時的な製造環境の安定性に関する利用
可能なデータ。
JA.2.3.6
第4段階:VDmaxSDの取得
JA.2.3.6.1
表JA.2から選択した滅菌線量に対してSIP=1.0 VDmaxSDの平均バイオバーデンに対応する線
量減少係数及び線量増加値を示すJA.3の表を選定する。
JA.2.3.6.2
製品全体(SIP=1.0 VDmaxSD)の平均バイオバーデンを用いて選定した表から,SIP=1.0 VDmaxSD
に対する値を求める。
SIPが1.0で平均バイオバーデンがJA.3の表にない場合は,平均バイオバーデンより大きく,表にある
最も近いSIP=1.0 VDmaxSDの平均バイオバーデンを用いる。
SIP が1.0未満の場合は,JA.3の選定した表を使用するために第2段階(JA.2.3.4.2)で計算した製品試
料全体(SIPは1.0)の平均バイオバーデンを用いる。平均バイオバーデンが表にない場合は,平均バイオ
バーデンより大きく,表にある最も近いSIP=1.0 VDmaxSDの平均バイオバーデンを用い,かつ,対応する
SIP線量減少係数を用いる。式(JA.1)(JA.2.2.5.3参照)を用いて,SIP VDmaxSD を計算する(Kowalski and
Tallentire [17]参照)。
注記 平均バイオバーデンが0.9以下の製品には,1.0未満のSIPを使用してはならない(JA.2.3.2.1
参照)。
JA.2.3.7
第5段階:検定線量試験の実施
JA.2.3.7.1
単一バッチの製品から10個の製品試料を採取する。
JA.2.3.7.2
JA.3の表から得たVDmaxSD又は式(JA.1)で求めたVDmaxSDのうち適切な方で,これらの製品試
料を照射する。
製品試料に照射した最大線量は,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えては
ならない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
68
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合は,検定線量試験を
やり直してもよい。この平均線量がVDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が得られ
た場合(JA.2.3.8参照)には,検定線量試験をやり直す必要はない。
JA.2.3.7.3
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録
する。
JA.2.3.8
第6段階:結果の判定
JA.2.3.8.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,検定線量試験は合格であり選択し
た滅菌線量は実証されたものとする。
JA.2.3.8.2
無菌性の試験で陽性数が2の場合は,確認検定線量試験(JA.2.3.9参照)を実施する。
JA.2.3.8.3
無菌性の試験の陽性数が3以上の場合は,選択した滅菌線量は不十分な可能性があり検定線
量試験は不合格である。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmaxSDの照射又は特定のバイオバーデンに関連する原因による場合は,是正処置を行った後に,更に10
個の製品試料を使用して,検定線量試験をやり直す。是正措置の結果,平均バイオバーデンの評価を変更
した場合は,変更後の平均バイオバーデンに相当するVDmaxSDを使用する。平均バイオバーデンの評価を
変更しなかった場合には,不合格となった検定線量試験と同じVDmaxSDを使用する。やり直した検定線量
試験の結果は,JA.2.3.8に従って判定する。
無菌性の試験の陽性結果が,不適切なバイオバーデンの決定,不適切な無菌性の試験の実施,不適切な
VDmaxSDの照射又は特定のバイオバーデンに関連する原因でない場合には,選択した滅菌線量は実証され
ないため,他の方法で滅菌線量を確立しなければならない。他の方法には,次のいずれかの方法がある。
a) 第3段階(JA.2.3.5)から始まるVDmaxSD法で不合格となった線量より更に高い滅菌線量の選択及び実
証
b) 方法1
c) 方法2
d) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
JA.2.3.9
確認検定線量試験
JA.2.3.9.1
一般
確認検定線量試験(JA.2.3.8.2参照)を実施するには,次の3段階の手順を実施しなければならない。
JA.2.3.9.2
第1段階:製品サンプルの入手
単一製造バッチの製品から10個の製品試料を採取する。
JA.2.3.9.3
第2段階:確認検定線量試験の実施
JA.2.3.9.3.1
JA.2.3.6で求めたVDmaxSDでこれらの製品試料を照射する。
製品試料に照射した最大線量は,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えては
ならない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
69
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,確認検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合は,確認検定線量試
験をやり直してもよい。この平均線量がVDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が得
られた場合(JA.2.3.9.4参照)には,確認検定線量試験をやり直す必要はない。
JA.2.3.9.3.2
照射した製品試料を個別に無菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記
録する。
JA.2.3.9.4
第3段階:結果の判定
JA.2.3.9.4.1
実施した10個の無菌性の試験で陽性がない場合は,確認検定線量試験は合格であり選択し
た滅菌線量は実証されたものとする。
JA.2.3.9.4.2
無菌性の試験で陽性が得られた場合は,選択した滅菌線量は不十分な可能性があり,確認
検定線量試験は不合格である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
バーデンに関連する原因による場合は,是正処置を行った後に,更に10個の製品試料を使用して,最初と
同じVDmaxSDを用いて確認検定線量試験をやり直す。やり直した確認検定線量試験の結果は,JA.2.3.9.4に
従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
バーデンに関連する原因でない場合には,選択した滅菌線量は実証されないため,他の方法で滅菌線量を
確立しなければならない。他の方法には,次のいずれかの方法がある。
a) 第3段階(JA.2.3.5)から始まるVDmaxSD法で不合格となった線量より更に高い滅菌線量の選択及び実
証
b) 方法1
c) 方法2
d) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
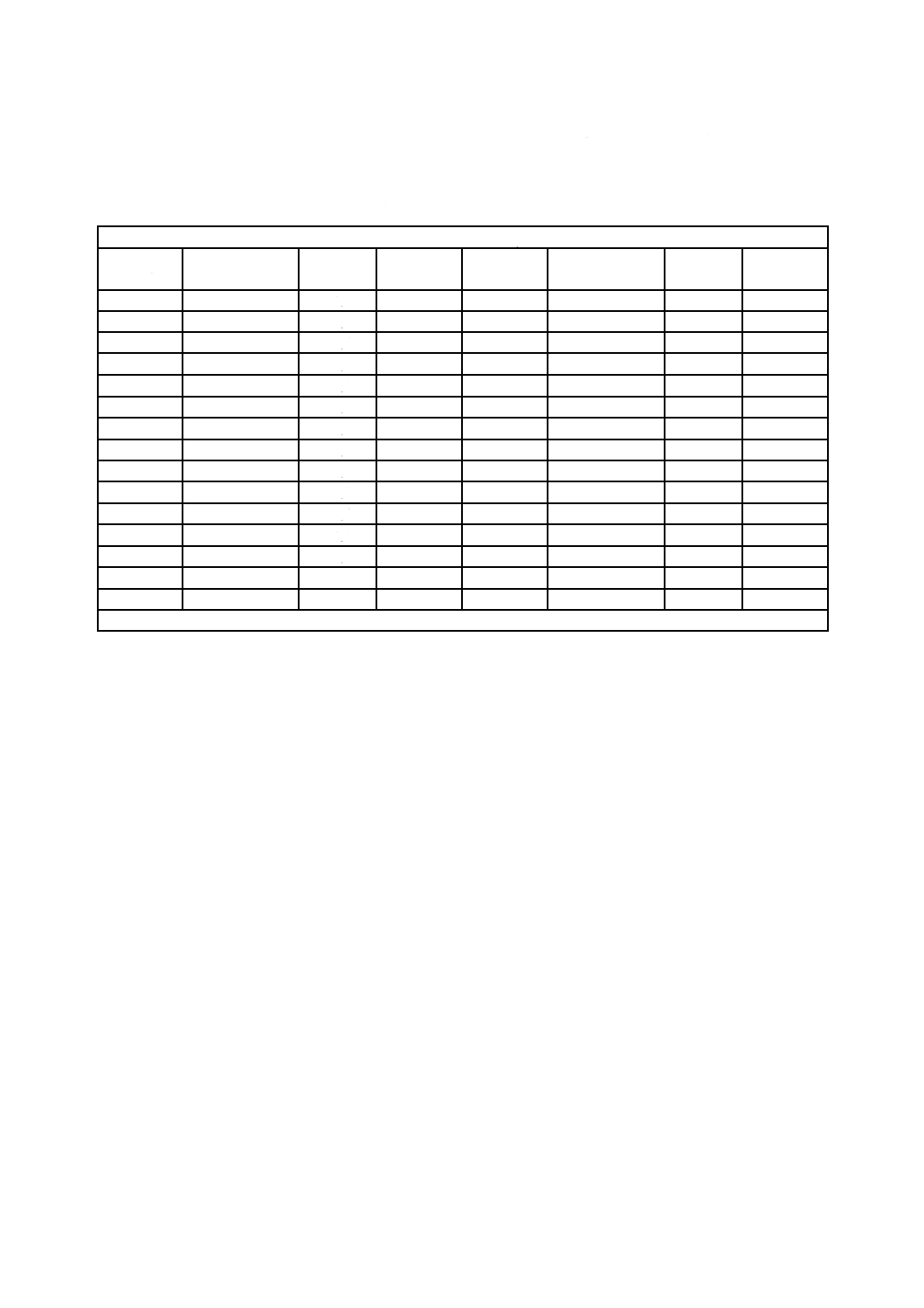
70
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.3 選択した滅菌線量17.5 kGy,20 kGy,22.5 kGy,27.5 kGy,30 kGy,32.5 kGy及び35 kGyに対する
平均バイオバーデンに該当する線量減少係数及び線量増加値のSIP=1.0 VDmaxSDの表
表JA.3−平均バイオバーデンの上限9.0に対し,選択した滅菌線量17.5 kGy
滅菌線量=17.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax17.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax17.5
(kGy)
線量減少
係数
線量増加値
(kGy)
0.1以下
0.0
NA a)
3.5
2.0
3.6
2.78
2.8
0.15
0.6
NA a)
3.4
2.5
3.8
2.74
2.7
0.20
1.0
NA a)
3.3
3.0
3.7
2.50
2.8
0.25
1.3
NA a)
3.2
3.5
3.6
2.32
2.8
0.30
1.5
NA a)
3.2
4.0
3.5
2.17
2.8
0.35
1.7
NA a)
3.2
4.5
3.4
2.05
2.8
0.40
1.9
NA a)
3.1
5.0
3.3
1.95
2.8
0.45
2.0
NA a)
3.1
5.5
3.3
1.87
2.9
0.50
2.1
NA a)
3.1
6.0
3.2
1.79
2.9
0.60
2.4
NA a)
3.0
6.5
3.1
1.73
2.9
0.70
2.5
NA a)
3.0
7.0
3.1
1.67
2.9
0.80
2.7
NA a)
3.0
7.5
3.0
1.62
2.9
0.90
2.8
NA a)
2.9
8.0
3.0
1.57
2.9
1.0
2.9
2.92
2.9
8.5
3.0
1.53
2.9
1.5
3.3
2.83
2.8
9.0
2.9
1.49
2.9
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。

71
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.4−平均バイオバーデンの上限45に対し,選択した滅菌線量20 kGy
滅菌線量=20 kGy
平均バイオ
バーデン
SIP=1.0 VDmax20
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax20
(kGy)
線量減少
係数
線量増加値
(kGy)
0.1以下
0.0
NA a)
4.0
13
5.2
2.44
3.0
0.15
0.7
NA a)
3.9
14
5.1
2.39
3.0
0.20
1.1
NA a)
3.8
15
5.1
2.33
3.0
0.25
1.5
NA a)
3.7
16
5.0
2.28
3.0
0.30
1.7
NA a)
3.7
17
5.0
2.24
3.0
0.35
2.0
NA a)
3.6
18
5.0
2.20
3.0
0.40
2.1
NA a)
3.6
19
4.9
2.16
3.0
0.45
2.3
NA a)
3.5
20
4.9
2.13
3.0
0.50
2.5
NA a)
3.5
21
4.9
2.10
3.0
0.60
2.7
NA a)
3.5
22
4.8
2.07
3.0
0.70
2.9
NA a)
3.4
23
4.8
2.04
3.0
0.80
3.1
NA a)
3.4
24
4.8
2.01
3.0
0.90
3.2
NA a)
3.4
25
4.8
1.99
3.0
1.0
3.3
3.33
3.3
26
4.8
1.97
3.1
1.5
3.8
3.24
3.2
27
4.7
1.94
3.1
2.0
4.1
3.17
3.2
28
4.7
1.92
3.1
2.5
4.4
3.13
3.1
29
4.7
1.90
3.1
3.0
4.6
3.09
3.1
30
4.7
1.89
3.1
3.5
4.7
3.06
3.1
31
4.7
1.87
3.1
4.0
4.9
3.03
3.0
32
4.6
1.85
3.1
4.5
5.0
3.01
3.0
33
4.6
1.83
3.1
5.0
5.1
2.99
3.0
34
4.6
1.81
3.1
5.5
5.2
2.97
3.0
35
4.6
1.80
3.1
6.0
5.2
2.95
3.0
36
4.6
1.78
3.1
6.5
5.3
2.94
2.9
37
4.6
1.77
3.1
7.0
5.4
2.92
2.9
38
4.5
1.76
3.1
7.5
5.5
2.91
2.9
39
4.5
1.74
3.1
8.0
5.5
2.88
2.9
40
4.5
1.73
3.1
8.5
5.5
2.82
2.9
41
4.5
1.72
3.1
9.0
5.4
2.77
2.9
42
4.5
1.71
3.1
9.5
5.4
2.72
2.9
43
4.5
1.70
3.1
10
5.3
2.67
2.9
44
4.5
1.68
3.1
11
5.3
2.58
2.9
45
4.4
1.67
3.1
12
5.2
2.51
3.0
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。

72
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.5−平均バイオバーデンの上限220に対し,選択した滅菌線量22.5 kGy
滅菌線量=22.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax22.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax22.5
(kGy)
線量減少
係数
線量増加値
(kGy)
0.1以下
0.0
NA a)
4.5
26
7.3
3.00
3.1
0.15
0.8
NA a)
4.3
27
7.2
2.97
3.1
0.20
1.3
NA a)
4.2
28
7.2
2.94
3.1
0.25
1.7
NA a)
4.2
29
7.2
2.92
3.1
0.30
2.0
NA a)
4.1
30
7.2
2.89
3.1
0.35
2.2
NA a)
4.1
31
7.2
2.87
3.1
0.40
2.4
NA a)
4.0
32
7.1
2.85
3.1
0.45
2.6
NA a)
4.0
33
7.1
2.82
3.1
0.50
2.8
NA a)
3.9
34
7.1
2.80
3.1
0.60
3.0
NA a)
3.9
35
7.1
2.78
3.1
0.70
3.3
NA a)
3.8
36
7.1
2.74
3.1
0.80
3.4
NA a)
3.8
37
7.1
2.74
3.1
0.90
3.6
NA a)
3.8
38
7.0
2.73
3.1
1.0
3.8
3.75
3.8
39
7.0
2.71
3.1
1.5
4.3
3.64
3.6
40
7.0
2.69
3.1
2.0
4.6
3.57
3.6
41
7.0
2.68
3.1
2.5
4.9
3.52
3.5
42
7.0
2.66
3.1
3.0
5.1
3.47
3.5
43
7.0
2.65
3.1
3.5
5.3
3.44
3.4
44
7.0
2.63
3.1
4.0
5.5
3.41
3.4
45
6.9
2.62
3.1
4.5
5.6
3.38
3.4
46
6.9
2.60
3.1
5.0
5.7
3.36
3.4
47
6.9
2.59
3.1
5.5
5.8
3.34
3.3
48
6.9
2.58
3.1
6.0
5.9
3.32
3.3
49
6.9
2.56
3.1
6.5
6.0
3.30
3.3
50
6.9
2.55
3.1
7.0
6.1
3.29
3.3
55
6.8
2.50
3.1
7.5
6.1
3.27
3.3
60
6.8
2.44
3.1
8.0
6.2
3.26
3.3
65
6.8
2.40
3.2
8.5
6.3
3.25
3.2
70
6.7
2.36
3.2
9.0
6.3
3.24
3.2
75
6.7
2.32
3.2
9.5
6.4
3.22
3.2
80
6.7
2.29
3.2
10
6.4
3.21
3.2
85
6.6
2.26
3.2
11
6.5
3.20
3.2
90
6.6
2.23
3.2
12
6.6
3.18
3.2
95
6.6
2.21
3.2
13
6.7
3.16
3.2
100
6.5
2.18
3.2
14
6.8
3.15
3.1
110
6.5
2.14
3.2
15
6.8
3.14
3.1
120
6.5
2.09
3.2
16
6.9
3.12
3.1
130
6.4
2.06
3.2
17
6.9
3.11
3.1
140
6.4
2.03
3.2
18
7.0
3.10
3.1
150
6.4
2.00
3.2
19
7.0
3.09
3.1
160
6.3
1.98
3.2
20
7.1
3.08
3.1
170
6.3
1.95
3.2
21
7.1
3.07
3.1
180
6.3
1.93
3.2
22
7.2
3.06
3.1
190
6.2
1.90
3.3
23
7.2
3.06
3.1
200
6.2
1.88
3.3
24
7.3
3.05
3.0
220
6.2
1.85
3.3
25
7.3
3.03
3.0
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。

73
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.6−平均バイオバーデンの上限5 000に対し,選択した滅菌線量27.5 kGy
滅菌線量=27.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax27.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax27.5
(kGy)
線量減少
係数
線量増加値
(kGy)
0.10以下
0.0
NA a)
5.5
33
9.2
3.66
3.7
0.15
0.9
NA a)
5.3
34
9.2
3.65
3.7
0.20
1.6
NA a)
5.2
35
9.3
3.65
3.6
0.25
2.0
NA a)
5.1
36
9.3
3.64
3.6
0.30
2.4
NA a)
5.0
37
9.3
3.63
3.6
0.35
2.7
NA a)
5.0
38
9.4
3.63
3.6
0.40
3.0
NA a)
4.9
39
9.4
3.62
3.6
0.45
3.2
NA a)
4.9
40
9.4
3.62
3.6
0.50
3.4
NA a)
4.8
41
9.4
3.61
3.6
0.60
3.7
NA a)
4.8
42
9.5
3.61
3.6
0.70
4.0
NA a)
4.7
43
9.5
3.60
3.6
0.80
4.2
NA a)
4.7
44
9.5
3.60
3.6
0.90
4.4
NA a)
4.6
45
9.5
3.59
3.6
1.0
4.6
4.58
4.6
46
9.6
3.59
3.6
2.0
5.7
4.36
4.4
47
9.6
3.58
3.6
3.0
6.3
4.25
4.2
48
9.6
3.58
3.6
4.0
6.7
4.17
4.2
49
9.6
3.58
3.6
5.0
7.0
4.11
4.1
50
9.6
3.57
3.6
6.0
7.2
4.06
4.1
55
9.7
3.55
3.6
7.0
7.4
4.02
4.0
60
9.8
3.54
3.5
8.0
7.6
3.98
4.0
65
9.9
3.52
3.5
9.0
7.7
3.95
4.0
70
10.0
3.51
3.5
10
7.9
3.93
3.9
75
10.0
3.49
3.5
11
8.0
3.91
3.9
80
10.1
3.48
3.5
12
8.1
3.88
3.9
85
10.2
3.47
3.5
13
8.2
3.87
3.9
90
10.2
3.46
3.5
14
8.3
3.85
3.8
95
10.3
3.45
3.4
15
8.3
3.83
3.8
100
10.3
3.44
3.4
16
8.4
3.82
3.8
110
10.4
3.42
3.4
17
8.5
3.80
3.8
120
10.5
3.40
3.4
18
8.5
3.79
3.8
130
10.6
3.39
3.4
19
8.6
3.78
3.8
140
10.6
3.38
3.4
20
8.7
3.77
3.8
150
10.7
3.36
3.4
21
8.7
3.76
3.8
160
10.7
3.35
3.4
22
8.8
3.75
3.7
170
10.8
3.34
3.3
23
8.8
3.74
3.7
180
10.8
3.33
3.3
24
8.9
3.73
3.7
190
10.9
3.32
3.3
25
8.9
3.72
3.7
200
10.9
3.31
3.3
26
9.0
3.71
3.7
220
11.0
3.30
3.3
27
9.0
3.70
3.7
240
11.1
3.28
3.3
28
9.0
3.69
3.7
260
11.1
3.26
3.3
29
9.1
3.69
3.7
280
11.1
3.21
3.3
30
9.1
3.68
3.7
300
11.1
3.18
3.3
31
9.1
3.67
3.7
325
11.0
3.14
3.3
32
9.2
3.66
3.7
350
11.0
3.10
3.3

74
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.6−平均バイオバーデンの上限5 000に対し,選択した滅菌線量27.5 kGy(続き)
滅菌線量=27.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax27.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax27.5
(kGy)
線量減少
係数
線量増加値
(kGy)
375
11.0
3.07
3.3
1600
10.4
2.48
3.4
400
10.9
3.04
3.3
1650
10.4
2.47
3.4
425
10.9
3.01
3.3
1700
10.4
2.46
3.4
450
10.9
2.98
3.3
1750
10.4
2.45
3.4
475
10.9
2.96
3.3
1800
10.4
2.44
3.4
500
10.9
2.93
3.3
1850
10.4
2.43
3.4
525
10.8
2.91
3.3
1900
10.4
2.42
3.4
550
10.8
2.89
3.3
1950
10.4
2.41
3.4
575
10.8
2.87
3.3
2000
10.4
2.41
3.4
600
10.8
2.85
3.3
2100
10.3
2.39
3.4
650
10.8
2.82
3.4
2200
10.3
2.37
3.4
700
10.7
2.79
3.4
2300
10.3
2.36
3.4
750
10.7
2.76
3.4
2400
10.3
2.35
3.4
800
10.7
2.73
3.4
2500
10.3
2.34
3.4
850
10.7
2.71
3.4
2600
10.3
2.32
3.4
900
10.6
2.69
3.4
2700
10.3
2.31
3.5
950
10.6
2.67
3.4
2800
10.2
2.30
3.5
1000
10.6
2.65
3.4
2900
10.2
2.29
3.5
1050
10.6
2.63
3.4
3000
10.2
2.28
3.5
1100
10.6
2.61
3.4
3200
10.2
2.26
3.5
1150
10.6
2.60
3.4
3400
10.2
2.24
3.5
1200
10.5
2.58
3.4
3600
10.2
2.23
3.5
1250
10.5
2.57
3.4
3800
10.1
2.21
3.5
1300
10.5
2.55
3.4
4000
10.1
2.20
3.5
1350
10.5
2.54
3.4
4200
10.1
2.19
3.5
1400
10.5
2.53
3.4
4400
10.1
2.17
3.5
1450
10.5
2.51
3.4
4600
10.1
2.16
3.5
1500
10.5
2.50
3.4
4800
10.1
2.15
3.5
1550
10.4
2.49
3.4
5000
10.1
2.14
3.5
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。

75
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.7−平均バイオバーデンの上限23 000に対し,選択した滅菌線量30 kGy
滅菌線量=30 kGy
平均バイオ
バーデン
SIP=1.0 VDmax30
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax30
(kGy)
線量減少
係数
線量増加値
(kGy)
0.10以下
0.0
NA a)
6.0
33
10.0
3.99
4.0
0.15
1.0
NA a)
5.8
34
10.1
3.98
4.0
0.20
1.7
NA a)
5.7
35
10.1
3.98
4.0
0.25
2.2
NA a)
5.6
36
10.1
3.97
4.0
0.30
2.6
NA a)
5.5
37
10.2
3.96
4.0
0.35
2.9
NA a)
5.4
38
10.2
3.96
4.0
0.40
3.2
NA a)
5.4
39
10.2
3.95
4.0
0.45
3.5
NA a)
5.3
40
10.3
3.95
3.9
0.50
3.7
NA a)
5.3
41
10.3
3.94
3.9
0.60
4.0
NA a)
5.2
42
10.3
3.94
3.9
0.70
4.3
NA a)
5.1
43
10.3
3.93
3.9
0.80
4.6
NA a)
5.1
44
10.4
3.92
3.9
0.90
4.8
NA a)
5.0
45
10.4
3.92
3.9
1.0
5.0
5.00
5.0
46
10.4
3.92
3.9
2.0
6.2
4.76
4.8
47
10.4
3.91
3.9
3.0
6.8
4.63
4.6
48
10.5
3.91
3.9
4.0
7.3
4.54
4.5
49
10.5
3.90
3.9
5.0
7.6
4.48
4.5
50
10.5
3.90
3.9
6.0
7.9
4.43
4.4
55
10.6
3.88
3.9
7.0
8.1
4.38
4.4
60
10.7
3.86
3.9
8.0
8.3
4.35
4.3
65
10.8
3.84
3.8
9.0
8.4
4.31
4.3
70
10.9
3.82
3.8
10
8.6
4.29
4.3
75
11.0
3.81
3.8
11
8.7
4.26
4.3
80
11.0
3.80
3.8
12
8.8
4.24
4.2
85
11.1
3.78
3.8
13
8.9
4.22
4.2
90
11.1
3.77
3.8
14
9.0
4.20
4.2
95
11.2
3.76
3.8
15
9.1
4.18
4.2
100
11.3
3.75
3.8
16
9.2
4.16
4.2
110
11.3
3.73
3.7
17
9.3
4.15
4.1
120
11.4
3.71
3.7
18
9.3
4.13
4.1
130
11.5
3.70
3.7
19
9.4
4.12
4.1
140
11.6
3.68
3.7
20
9.5
4.11
4.1
150
11.7
3.67
3.7
21
9.5
4.10
4.1
160
11.7
3.66
3.7
22
9.6
4.09
4.1
170
11.8
3.65
3.6
23
9.6
4.08
4.1
180
11.8
3.63
3.6
24
9.7
4.06
4.1
190
11.9
3.62
3.6
25
9.7
4.06
4.1
200
11.9
3.61
3.6
26
9.8
4.05
4.0
220
12.0
3.60
3.6
27
9.8
4.04
4.0
240
12.1
3.58
3.6
28
9.9
4.03
4.0
260
12.2
3.57
3.6
29
9.9
4.02
4.0
280
12.2
3.55
3.6
30
9.9
4.01
4.0
300
12.3
3.54
3.5
31
10.0
4.00
4.0
325
12.4
3.52
3.5
32
10.0
4.00
4.0
350
12.4
3.51
3.5

76
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.7−平均バイオバーデンの上限23 000に対し,選択した滅菌線量30 kGy(続き)
滅菌線量=30 kGy
平均バイオ
バーデン
SIP=1.0 VDmax30
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax30
(kGy)
線量減少
係数
線量増加値
(kGy)
375
12.5
3.50
3.5
2700
12.8
2.88
3.5
400
12.6
3.49
3.5
2800
12.7
2.86
3.5
425
12.6
3.48
3.5
2900
12.7
2.85
3.5
450
12.7
3.47
3.5
3000
12.7
2.84
3.5
475
12.7
3.46
3.5
3200
12.7
2.82
3.5
500
12.8
3.45
3.4
3400
12.7
2.80
3.5
525
12.8
3.44
3.4
3600
12.7
2.78
3.5
550
12.8
3.43
3.4
3800
12.6
2.76
3.5
575
12.9
3.42
3.4
4000
12.6
2.74
3.5
600
12.9
3.42
3.4
4200
12.6
2.73
3.5
650
13.0
3.40
3.4
4400
12.6
2.71
3.5
700
13.0
3.39
3.4
4600
12.6
2.70
3.5
750
13.1
3.38
3.4
4800
12.6
2.69
3.5
800
13.2
3.37
3.4
5000
12.6
2.67
3.5
850
13.2
3.35
3.4
5300
12.5
2.65
3.5
900
13.1
3.32
3.4
5600
12.5
2.63
3.5
950
13.1
3.30
3.4
5900
12.5
2.62
3.5
1000
13.1
3.27
3.4
6200
12.5
2.61
3.5
1050
13.1
3.25
3.4
6500
12.5
2.59
3.5
1100
13.1
3.23
3.4
6800
12.5
2.58
3.5
1150
13.0
3.21
3.4
7100
12.4
2.56
3.5
1200
13.0
3.19
3.4
7400
12.4
2.55
3.5
1250
13.0
3.18
3.4
7700
12.4
2.54
3.5
1300
13.0
3.16
3.4
8000
12.4
2.53
3.5
1350
13.0
3.14
3.4
8500
12.4
2.52
3.5
1400
13.0
3.13
3.4
9000
12.4
2.50
3.5
1450
13.0
3.11
3.4
9500
12.4
2.48
3.5
1500
13.0
3.10
3.4
10000
12.4
2.47
3.5
1550
12.9
3.09
3.4
10500
12.3
2.46
3.5
1600
12.9
3.07
3.4
11000
12.3
2.44
3.5
1650
12.9
3.06
3.4
11500
12.3
2.43
3.5
1700
12.9
3.05
3.4
12000
12.3
2.42
3.5
1750
12.9
3.04
3.4
13000
12.3
2.40
3.5
1800
12.9
3.03
3.4
14000
12.3
2.38
3.6
1850
12.9
3.02
3.4
15000
12.2
2.36
3.6
1900
12.9
3.01
3.4
16000
12.2
2.35
3.6
1950
12.9
3.00
3.4
17000
12.2
2.33
3.6
2000
12.9
2.99
3.4
18000
12.2
2.32
3.6
2100
12.8
2.97
3.4
19000
12.2
2.31
3.6
2200
12.8
2.95
3.4
20000
12.2
2.29
3.6
2300
12.8
2.93
3.4
21000
12.1
2.28
3.6
2400
12.8
2.92
3.4
22000
12.1
2.27
3.6
2500
12.8
2.90
3.4
23000
12.1
2.26
3.6
2600
12.8
2.89
3.4
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。

77
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.8−平均バイオバーデンの上限100 000に対し,選択した滅菌線量32.5 kGy
滅菌線量=32.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
0.10以下
0.0
NA a)
6.5
33
10.9
4.32
4.3
0.15
1.1
NA a)
6.3
34
10.9
4.32
4.3
0.20
1.8
NA a)
6.1
35
11.0
4.31
4.3
0.25
2.4
NA a)
6.0
36
11.0
4.30
4.3
0.30
2.8
NA a)
5.9
37
11.0
4.29
4.3
0.35
3.2
NA a)
5.9
38
11.1
4.29
4.3
0.40
3.5
NA a)
5.8
39
11.1
4.28
4.3
0.45
3.8
NA a)
5.7
40
11.1
4.28
4.3
0.50
4.0
NA a)
5.7
41
11.2
4.27
4.3
0.60
4.4
NA a)
5.6
42
11.2
4.26
4.3
0.70
4.7
NA a)
5.6
43
11.2
4.26
4.3
0.80
5.0
NA a)
5.5
44
11.2
4.25
4.3
0.90
5.2
NA a)
5.5
45
11.3
4.25
4.2
1.0
5.4
5.42
5.4
46
11.3
4.24
4.2
2.0
6.7
4.16
5.2
47
11.3
4.24
4.2
3.0
7.4
5.02
5.0
48
11.3
4.23
4.2
4.0
7.9
4.92
4.9
49
11.4
4.23
4.2
5.0
8.2
4.85
4.9
50
11.4
4.22
4.2
6.0
8.5
4.79
4.8
55
11.5
4.20
4.2
7.0
8.8
4.75
4.7
60
11.6
4.18
4.2
8.0
9.0
4.71
4.7
65
11.7
4.16
4.2
9.0
9.1
4.67
4.7
70
11.8
4.14
4.1
10
9.3
4.64
4.6
75
11.9
4.13
4.1
11
9.4
4.62
4.6
80
11.9
4.11
4.1
12
9.5
4.59
4.6
85
12.0
4.10
4.1
13
9.7
4.57
4.6
90
12.1
4.09
4.1
14
9.8
4.55
4.5
95
12.1
4.07
4.1
15
9.9
4.53
4.5
100
12.2
4.06
4.1
16
9.9
4.51
4.5
110
12.3
4.04
4.0
17
10.0
4.49
4.5
120
12.4
4.02
4.0
18
10.1
4.48
4.5
130
12.5
4.01
4.0
19
10.2
4.47
4.5
140
12.6
3.99
4.0
20
10.2
4.45
4.5
150
12.6
3.98
4.0
21
10.3
4.44
4.4
160
12.7
3.96
4.0
22
10.4
4.43
4.4
170
12.8
3.95
3.9
23
10.4
4.41
4.4
180
12.8
3.94
3.9
24
10.5
4.40
4.4
190
12.9
3.93
3.9
25
10.5
4.39
4.4
200
12.9
3.92
3.9
26
10.6
4.38
4.4
220
13.0
3.90
3.9
27
10.6
4.37
4.4
240
13.1
3.88
3.9
28
10.7
4.36
4.4
260
13.2
3.86
3.9
29
10.7
4.36
4.4
280
13.3
3.85
3.8
30
10.8
4.35
4.3
300
13.3
3.83
3.8
31
10.8
4.34
4.3
325
13.4
3.82
3.8
32
10.8
4.33
4.3
350
13.5
3.80
3.8

78
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.8−平均バイオバーデンの上限100 000に対し,選択した滅菌線量32.5 kGy(続き)
滅菌線量=32.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
375
13.5
3.79
3.8
2800
15.2
3.43
3.5
400
13.6
3.78
3.8
2900
15.2
3.41
3.5
425
13.7
3.77
3.8
3000
15.2
3.40
3.5
450
13.7
3.76
3.8
3200
15.2
3.37
3.5
475
13.8
3.75
3.7
3400
15.2
3.35
3.5
500
13.8
3.74
3.7
3600
15.2
3.33
3.5
525
13.9
3.73
3.7
3800
15.1
3.31
3.5
550
13.9
3.72
3.7
4000
15.1
3.29
3.5
575
13.9
3.71
3.7
4200
15.1
3.27
3.5
600
14.0
3.70
3.7
4400
15.1
3.25
3.5
650
14.1
3.69
3.7
4600
15.1
3.23
3.5
700
14.1
3.67
3.7
4800
15.1
3.22
3.5
750
14.2
3.66
3.7
5000
15.1
3.20
3.5
800
14.2
3.65
3.7
5300
15.0
3.18
3.5
850
14.3
3.64
3.6
5600
15.0
3.16
3.5
900
14.4
3.63
3.6
5900
15.0
3.14
3.5
950
14.4
3.62
3.6
6200
15.0
3.13
3.5
1000
14.4
3.61
3.6
6500
15.0
3.11
3.5
1050
14.5
3.60
3.6
6800
15.0
3.09
3.5
1100
14.5
3.59
3.6
7100
14.9
3.08
3.5
1150
14.6
3.59
3.6
7400
14.9
3.07
3.5
1200
14.6
3.58
3.6
7700
14.9
3.05
3.5
1250
14.6
3.57
3.6
8000
14.9
3.04
3.5
1300
14.7
3.57
3.6
8500
14.9
3.02
3.5
1350
14.7
3.56
3.6
9000
14.9
3.00
3.5
1400
14.7
3.55
3.6
9500
14.9
2.99
3.5
1450
14.8
3.55
3.5
10000
14.9
2.97
3.5
1500
14.8
3.54
3.5
10500
14.8
2.95
3.5
1550
14.8
3.54
3.5
11000
14.8
2.94
3.5
1600
14.8
3.53
3.5
11500
14.8
2.93
3.5
1650
14.9
3.53
3.5
12000
14.8
2.91
3.5
1700
14.9
3.52
3.5
13000
14.8
2.89
3.5
1750
14.9
3.52
3.5
14000
14.8
2.87
3.6
1800
14.9
3.51
3.5
15000
14.7
2.85
3.6
1850
15.0
3.51
3.5
16000
14.7
2.83
3.6
1900
15.0
3.50
3.5
17000
14.7
2.81
3.6
1950
15.0
3.50
3.5
18000
14.7
2.79
3.6
2000
15.0
3.49
3.5
19000
14.7
2.78
3.6
2100
15.1
3.49
3.5
20000
14.7
2.76
3.6
2200
15.1
3.48
3.5
21000
14.6
2.75
3.6
2300
15.1
3.47
3.5
22000
14.6
2.74
3.6
2400
15.2
3.46
3.5
23000
14.6
2.73
3.6
2500
15.2
3.46
3.5
24000
14.6
2.72
3.6
2600
15.2
3.45
3.5
25000
14.6
2.70
3.6
2700
15.3
3.44
3.5
26000
14.6
2.69
3.6
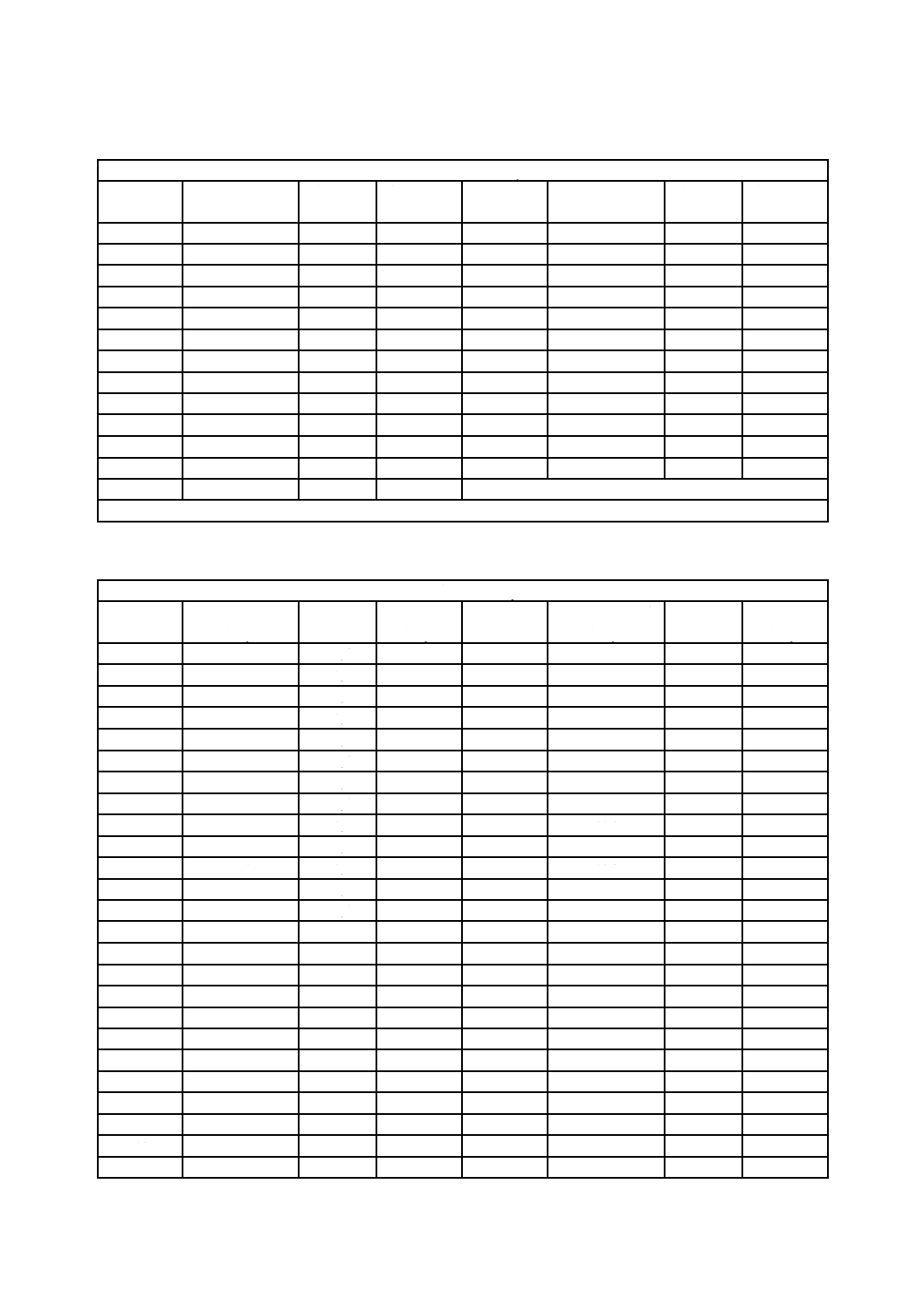
79
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.8−平均バイオバーデンの上限100 000に対し,選択した滅菌線量32.5 kGy(続き)
滅菌線量=32.5 kGy
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax32.5
(kGy)
線量減少
係数
線量増加値
(kGy)
27000
14.6
2.68
3.6
50000
14.4
2.53
3.6
28000
14.6
2.67
3.6
54000
14.4
2.51
3.6
29000
14.6
2.66
3.6
58000
14.4
2.50
3.6
30000
14.6
2.66
3.6
62000
14.4
2.48
3.6
32000
14.5
2.64
3.6
66000
14.4
2.47
3.6
34000
14.5
2.62
3.6
70000
14.3
2.45
3.6
36000
14.5
2.61
3.6
75000
14.3
2.44
3.6
38000
14.5
2.60
3.6
80000
14.3
2.42
3.6
40000
14.5
2.58
3.6
85000
14.3
2.41
3.6
42000
14.5
2.57
3.6
90000
14.3
2.40
3.6
44000
14.5
2.56
3.6
95000
14.3
2.39
3.6
46000
14.4
2.55
3.6
100000
14.3
2.38
3.6
48000
14.4
2.54
3.6
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。
表JA.9−平均バイオバーデンの上限440 000に対し,選択した滅菌線量35 kGy
滅菌線量=35 kGy
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
0.10以下
0.0
NA a)
7.0
13
10.4
4.92
4.9
0.15
1.2
NA a)
6.8
14
10.5
4.90
4.9
0.20
2.0
NA a)
6.6
15
10.6
4.88
4.9
0.25
2.6
NA a)
6.5
16
10.7
4.86
4.9
0.30
3.0
NA a)
6.4
17
10.8
4.84
4.8
0.35
3.4
NA a)
6.3
18
10.9
4.82
4.8
0.40
3.8
NA a)
6.2
19
11.0
4.81
4.8
0.45
4.0
NA a)
6.2
20
11.0
4.79
4.8
0.50
4.3
NA a)
6.1
21
11.1
4.78
4.8
0.60
4.7
NA a)
6.1
22
11.2
4.77
4.8
0.70
5.1
NA a)
6.0
23
11.2
4.75
4.8
0.80
5.4
NA a)
5.9
24
11.3
4.74
4.7
0.90
5.6
NA a)
5.9
25
11.3
4.73
4.7
1.0
5.8
5.83
5.8
26
11.4
4.72
4.7
2.0
7.2
5.55
5.6
27
11.5
4.71
4.7
3.0
8.0
5.40
5.4
28
11.5
4.70
4.7
4.0
8.5
5.30
5.3
29
11.5
4.69
4.7
5.0
8.9
5.22
5.2
30
11.6
4.68
4.7
6.0
9.2
5.16
5.2
31
11.6
4.67
4.7
7.0
9.4
5.11
5.1
32
11.7
4.66
4.7
8.0
9.6
5.07
5.1
33
11.7
4.66
4.7
9.0
9.8
5.03
5.0
34
11.8
4.65
4.6
10
10.0
5.00
5.0
35
11.8
4.64
4.6
11
10.1
4.97
5.0
36
11.8
4.63
4.6
12
10.3
4.94
4.9
37
11.9
4.62
4.6

80
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.9−平均バイオバーデンの上限440 000に対し,選択した滅菌線量35 kGy(続き)
滅菌線量=35 kGy
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
38
11.9
4.62
4.6
500
14.9
4.02
4.0
39
11.9
4.61
4.6
525
14.9
4.01
4.0
40
12.0
4.60
4.6
550
15.0
4.00
4.0
41
12.0
4.60
4.6
575
15.0
4.00
4.0
42
12.0
4.59
4.6
600
15.1
3.99
4.0
43
12.1
4.59
4.6
650
15.1
3.97
4.0
44
12.1
4.58
4.6
700
15.2
3.96
4.0
45
12.1
4.57
4.6
750
15.3
3.94
3.9
46
12.2
4.57
4.6
800
15.3
3.93
3.9
47
12.2
4.56
4.6
850
15.4
3.92
3.9
48
12.2
4.56
4.6
900
15.5
3.91
3.9
49
12.2
4.55
4.6
950
15.5
3.90
3.9
50
12.3
4.55
4.5
1000
15.6
3.89
3.9
55
12.4
4.52
4.5
1050
15.6
3.88
3.9
60
12.5
4.50
4.5
1100
15.6
3.87
3.9
65
12.6
4.48
4.5
1150
15.7
3.86
3.9
70
12.7
4.46
4.5
1200
15.7
3.85
3.9
75
12.8
4.44
4.4
1250
15.8
3.85
3.8
80
12.9
4.43
4.4
1300
15.8
3.84
3.8
85
12.9
4.41
4.4
1350
15.8
3.83
3.8
90
13.0
4.40
4.4
1400
15.9
3.83
3.8
95
13.1
4.39
4.4
1450
15.9
3.82
3.8
100
13.1
4.38
4.4
1500
15.9
3.81
3.8
110
13.2
4.35
4.4
1550
16.0
3.81
3.8
120
13.3
4.33
4.3
1600
16.0
3.80
3.8
130
13.4
4.31
4.3
1650
16.0
3.80
3.8
140
13.5
4.30
4.3
1700
16.0
3.79
3.8
150
13.6
4.28
4.3
1750
16.1
3.79
3.8
160
13.7
4.27
4.3
1800
16.1
3.78
3.8
170
13.7
4.25
4.3
1850
16.1
3.78
3.8
180
13.8
4.24
4.2
1900
16.1
3.77
3.8
190
13.9
4.23
4.2
1950
16.2
3.77
3.8
200
13.9
4.22
4.2
2000
16.2
3.76
3.8
220
14.0
4.20
4.2
2100
16.2
3.75
3.8
240
14.1
4.18
4.2
2200
16.3
3.75
3.7
260
14.2
4.16
4.2
2300
16.3
3.74
3.7
280
14.3
4.14
4.1
2400
16.3
3.73
3.7
300
14.4
4.13
4.1
2500
16.4
3.72
3.7
325
14.4
4.11
4.1
2600
16.4
3.72
3.7
350
14.5
4.10
4.1
2700
16.4
3.71
3.7
375
14.6
4.08
4.1
2800
16.5
3.70
3.7
400
14.7
4.07
4.1
2900
16.5
3.70
3.7
425
14.7
4.06
4.1
3000
16.5
3.69
3.7
450
14.8
4.04
4.0
3200
16.6
3.68
3.7
475
14.8
4.03
4.0
3400
16.6
3.67
3.7

81
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表JA.9−平均バイオバーデンの上限440 000に対し,選択した滅菌線量35 kGy(続き)
滅菌線量=35 kGy
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
平均バイオ
バーデン
SIP=1.0 VDmax35
(kGy)
線量減少
係数
線量増加値
(kGy)
3600
16.7
3.66
3.7
32000
17.0
3.09
3.6
3800
16.7
3.65
3.7
34000
17.0
3.08
3.6
4000
16.8
3.65
3.6
36000
17.0
3.06
3.6
4200
16.8
3.64
3.6
38000
17.0
3.04
3.6
4400
16.9
3.63
3.6
40000
17.0
3.03
3.6
4600
16.9
3.62
3.6
42000
17.0
3.02
3.6
4800
16.9
3.62
3.6
44000
17.0
3.00
3.6
5000
17.0
3.61
3.6
46000
16.9
2.99
3.6
5300
17.0
3.60
3.6
48000
16.9
2.98
3.6
5600
17.0
3.59
3.6
50000
16.9
2.97
3.6
5900
17.1
3.58
3.6
54000
16.9
2.95
3.6
6200
17.1
3.57
3.6
58000
16.9
2.93
3.6
6500
17.2
3.57
3.6
62000
16.9
2.91
3.6
6800
17.2
3.56
3.6
66000
16.9
2.90
3.6
7100
17.2
3.55
3.6
70000
16.8
2.88
3.6
7400
17.3
3.55
3.5
75000
16.8
2.86
3.6
7700
17.3
3.54
3.5
80000
16.8
2.85
3.6
8000
17.3
3.53
3.5
85000
16.8
2.83
3.6
8500
17.4
3.52
3.5
90000
16.8
2.82
3.6
9000
17.4
3.51
3.5
95000
16.8
2.80
3.6
9500
17.4
3.49
3.5
100000
16.8
2.79
3.6
10000
17.4
3.47
3.5
110000
16.7
2.77
3.7
10500
17.3
3.45
3.5
120000
16.7
2.75
3.7
11000
17.3
3.44
3.5
130000
16.7
2.73
3.7
11500
17.3
3.42
3.5
140000
16.7
2.71
3.7
12000
17.3
3.41
3.5
150000
16.7
2.70
3.7
13000
17.3
3.38
3.5
160000
16.7
2.68
3.7
14000
17.3
3.35
3.6
170000
16.6
2.67
3.7
15000
17.2
3.33
3.6
180000
16.6
2.66
3.7
16000
17.2
3.31
3.6
190000
16.6
2.65
3.7
17000
17.2
3.29
3.6
200000
16.6
2.63
3.7
18000
17.2
3.27
3.6
220000
16.6
2.61
3.7
19000
17.2
3.25
3.6
240000
16.6
2.60
3.7
20000
17.2
3.24
3.6
260000
16.5
2.58
3.7
21000
17.1
3.22
3.6
280000
16.5
2.56
3.7
22000
17.1
3.20
3.6
300000
16.5
2.55
3.7
23000
17.1
3.19
3.6
320000
16.5
2.54
3.7
24000
17.1
3.18
3.6
340000
16.5
2.52
3.7
25000
17.1
3.17
3.6
360000
16.5
2.51
3.7
26000
17.1
3.16
3.6
380000
16.5
2.50
3.7
27000
17.1
3.14
3.6
400000
16.5
2.49
3.7
28000
17.1
3.13
3.6
420000
16.5
2.48
3.7
29000
17.1
3.12
3.6
440000
16.4
2.47
3.7
30000
17.1
3.11
3.6
注a) 適用外。SIPは1.0が必要とされる。JA.2.2.1.1及びJA.2.3.2.1参照。
82
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.4 プロセスの有効性の維持
JA.4.1 一般
複数製造バッチとして生産した製品の場合,滅菌線量の確立の継続的な有効性を確認するため,定期的
なバイオバーデンの決定及び滅菌線量監査を実施する。
JIS T 0806-1の箇条12に記載しているプロセスの有効性を維持するための要求事項は,次に記載する
VDmaxSD法に特有の要求事項(JA.4.2.2参照)とともに,VDmaxSD法を使用して選択した滅菌線量の実証に
も適用する。単一製造バッチで製造する製品には,これらの要求事項は適用しない。
JA.4.2 バイオバーデンの決定
JA.4.2.1
決定の頻度のための背景
JIS T 0806-1:2010は,次の事項を要求している。
a) バイオバーデンが1.5以上の製品については,バイオバーデンの決定の最大間隔は,3か月である(JIS
T 0806-1:2010の12.1.2.1参照)。
b) バイオバーデンが1.5未満で滅菌線量を方法2又はVDmax25法で確立した製品については,バイオバー
デンの決定の最大間隔は,3か月である(JIS T 0806-1:2010の12.1.2.2参照)。
c) バイオバーデンが1.5未満で滅菌線量を方法1又はVDmax15法で確立した製品については,バイオバー
デンの決定の最大間隔は,1か月である(JIS T 0806-1:2010の12.1.2.3参照)。
JIS T 0806-1:2010の12.1.2.3に記載してある頻繁なバイオバーデンの決定の要求事項は,低バイオバー
デン製品に時々発生する製品試料上のバイオバーデン分布の大きな変動を考慮して規定している。測定の
頻度が変更となるバイオバーデン値の1.5という値は,VDmax15法のバイオバーデンの上限であるところか
ら決定した。また,頻繁なバイオバーデンの決定は,この附属書のVDmax17.5法でも規定している。
JA.4.2.2
VDmaxSD法に特有な決定の頻度
JA.4.2.2.1
平均バイオバーデンが10以上の製品で,かつ,選択した滅菌線量がVDmaxSD法で実証されて
いる場合,バイオバーデンの決定の最大間隔は,3か月としなければならない。
JA.4.2.2.2
平均バイオバーデンが10未満の製品で,かつ,選択した滅菌線量がVDmax17.5法で実証されて
いる場合,バイオバーデンの決定の最大間隔は,1か月としなければならない。
注記 これらのことから,この附属書では1.5以上,10未満の平均バイオバーデンでは,JIS T 0806-1
で記載された最大間隔よりも短い間隔を規定している。
JA.4.3 滅菌線量監査
JA.4.3.1
頻度
滅菌線量監査の頻度は,JIS T 0806-1:2010の12.1に従って実施しなければならない。製品を製造してい
ない期間の滅菌線量監査は必要ない。また,滅菌線量監査と同時に,バイオバーデンの決定及び環境並び
に製造管理のレビューを実施するのが望ましい。このレビューで管理が不十分であると認められた場合に
は,適切な処置を講じなければならない。
JA.4.3.2
結果
滅菌線量監査の結果に基づく対処法は,製品ファミリーを構成する全ての製品に適用しなければならな
い(箇条4参照)。
JA.4.3.3
VDmaxSD法を使用して実証した滅菌線量監査の手順
JA.4.3.3.1
一般
JA.4.3.3.1.1
VDmaxSD法を用いて実証した滅菌線量に対する滅菌線量監査を実施する場合は,最初の滅菌
線量を実証したときと同一のSIPを使用する。
83
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.4.3.3.1.2
滅菌線量監査を適用するには,次の4段階の手順を実施しなければならない。
注記 実施例は,JA.5.3を参照。
JA.4.3.3.2
第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチの製品から20個の製品試料を採取する。
JA.4.3.3.3
第2段階:平均バイオバーデンの決定
JA.4.3.3.3.1
バイオバーデン決定の最近のバリデーションで得られた補正係数を用いる。
JA.4.3.3.3.2
10個の製品試料のバイオバーデンを決定し,平均バイオバーデンを計算する。
注記1 バイオバーデンは,通常,個別の製品試料について決定するが,バイオバーデンが小さい場
合(例えば,10未満)は,平均バイオバーデンの決定のため10個の製品試料をまとめても
よい。この方法は,SIPには適用するものではない。SIPをまとめてはならず,むしろより大
きなSIPを選ぶことが望ましい(5.2.5参照)。
注記2 バイオバーデンの決定においてコロニーが観察されない場合は,検出限界以下と表現される
ことがある。平均バイオバーデンの計算において,バイオバーデンの検出限界を使用するこ
とは,真のバイオバーデンに対して過大評価になることがある。過大評価は,検定線量試験
の検証に影響することがある。低い検出限界のバイオバーデン測定法を採用することで,こ
のような過大評価を少なくすることができる。
注記3 バイオバーデンのデータは,滅菌線量監査のためのSIP=1.0 VDmaxSD値を得ることを目的と
しているのではなく,プロセスの監視及び管理(例えば,トレンド分析),滅菌線量監査で不
合格となった場合の調査及び線量増加値を得るために用いる。
JA.4.3.3.4
第3段階:検定線量試験の実施
JA.4.3.3.4.1
選択した滅菌線量の最新の実証試験で合格となったVDmaxSDで10個の製品試料を照射する。
製品試料に照射した最大線量は,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えては
ならない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,検定線量試験をやり直さなければならない。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合には,検定線量試験
をやり直してもよい。この平均線量が,VDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が得
られた場合(JA.4.3.3.5参照)には,検定線量試験をやり直す必要はない。
JA.4.3.3.4.2
照射した製品試料を最初の滅菌線量の実証試験で使用した培地及び培養条件で個別に無菌
性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
JA.4.3.3.5
第4段階:結果の判定
JA.4.3.3.5.1
実施した10個の無菌性の試験で陽性数が1以下の場合は,滅菌線量監査は合格である。
JA.4.3.3.5.2
無菌性の試験で陽性数が2の場合は,確認滅菌線量監査(JA.4.3.3.6参照)を実施する。
JA.4.3.3.5.3
無菌性の試験の陽性数が3以上の場合は,滅菌線量は不十分であり滅菌線量監査は不合格
である。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
84
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
バーデンに関連する原因による場合は,是正処置を行った後に,できる限り早く更に10個の製品試料を用
いて不合格となった滅菌線量監査で用いたのと同じVDmaxSDで検定線量試験をやり直す。やり直した検定
線量試験の結果は,JA.4.3.3.5に従って判定する。
無菌性の試験の陽性結果が,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定のバイオ
バーデンに関連する原因でない場合には,次による。
a) 無菌性の試験の陽性数が3以上,6以下の場合は,直ちに選択した滅菌線量を増加(JA.4.3.3.7参照)
し,できる限り早く他の方法で滅菌線量を再確立する。他の方法には,次のいずれかの方法がある。
1) 第1段階(JA.2.2.2又はJA.2.3.3の適切な方)から始まるVDmaxSD法で不合格となった線量より更に
高い滅菌線量の選択及び実証
2) 方法1
3) 方法2
4) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
滅菌線量の再確立が完了するまで増加した滅菌線量を続ける。
b) 無菌性の試験で陽性数が7以上の場合は,選択した滅菌線量での滅菌を中止する。選択した滅菌線量
の増加はしてはならず,他の方法によって滅菌線量を再確立するまで滅菌を再開してはならない。他
の方法には,次のいずれかの方法がある。
1) 第1段階(JA.2.2.2又はJA.2.3.3の適切な方)から始まるVDmaxSD法で不合格となった線量より更に
高い滅菌線量の選択及び実証
2) 方法1
3) 方法2
4) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
JA.4.3.3.6
確認滅菌線量監査
JA.4.3.3.6.1
一般
JA.4.3.3.6.1.1
VDmaxSD法を用いて確立した滅菌線量に対する確認滅菌線量監査を実施する場合は,最初
の滅菌線量を実証したときと同一のSIPを使用する。
JA.4.3.3.6.1.2
確認滅菌線量監査を実施するには,次の3段階の手順を実施しなければならない。
JA.4.3.3.6.2
第1段階:製品サンプルの入手
5.1,5.2(該当する場合)及び5.3に従って,単一製造バッチから10個の製品試料を採取する。確認滅
菌線量監査に使用する10個の製品試料は,最初の滅菌線量監査(JA.4.3.3参照)で実施した検定線量試験
で使用したバッチ又は通常の生産条件で製造した二つ目のバッチのいずれから採取してもよい(5.3参照)。
JA.4.3.3.6.3
第2段階:確認検定線量試験の実施
JA.4.3.3.6.3.1
最初の滅菌線量の実証試験で得られたVDmaxSDでこれらの製品試料を照射する。
製品試料に照射した最大線量はVDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えてはな
らない。
注記 0.1 kGyの許容誤差は,1.0 kGy未満のVDmaxSDを照射し,測定を行う照射施設の能力及び実現
性を考慮したものである。
製品試料に照射した最大線量と最小線量との算術平均は,VDmaxSDの90 %未満ではない方がよい。
線量を測定する(5.5参照)。
製品試料に照射した最大線量が,VDmaxSDからその10 %又は0.1 kGyのいずれか大きい線量を超えた場
合は,確認検定線量試験をやり直さなければならない。
85
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
製品試料に照射した最大線量と最小線量との算術平均がVDmaxSDの90 %未満の場合は,確認検定線量試
験をやり直してもよい。この平均線量がVDmaxSDの90 %未満で,無菌性の試験を実施して合格の結果が得
られた場合(JA.4.3.3.6.4参照)には,確認検定線量試験をやり直す必要はない。
JA.4.3.3.6.3.2
照射した製品試料を最初の滅菌線量の実証試験で使用した培地及び培養条件で個別に無
菌性の試験(5.4.1参照)を行い,無菌性の試験の陽性数を記録する。
JA.4.3.3.6.4
第3段階:結果の判定
JA.4.3.3.6に従って実施した確認検定線量試験の結果の判定は,次による。
a) 実施した10個の無菌性の試験で陽性がない場合は,滅菌線量監査は合格である。
b) 無菌性の試験で陽性数が1以上,4以下の場合は,直ちに選択した滅菌線量を増加し(JA.4.3.3.7参照),
できる限り早く他の方法で滅菌線量を再確立する。他の方法には,次のいずれかの方法がある。
1) 第1段階(JA.2.2.2又はJA.2.3.3の適切な方)から始まるVDmaxSD法で不合格となった線量より更に
高い滅菌線量の選択及び実証
2) 方法1
3) 方法2
4) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
滅菌線量の再確立が完了するまで増加した滅菌線量を続ける。
c) 無菌性の試験で陽性数が5以上の場合は,滅菌線量監査は不合格である。選択した滅菌線量での滅菌
は中止する。選択した滅菌線量の増加はしてはならず,他の方法によって滅菌線量を再確立するまで
滅菌を再開してはならない。他の方法には,次のいずれかの方法がある。
1) 第1段階(JA.2.2.2又はJA.2.3.3の適切な方)から始まるVDmaxSD法で不合格となった線量より更に
高い滅菌線量の選択及び実証
2) 方法1
3) 方法2
4) SAL 10−6を達成することで上記の方法と同等の保証を与えることができる方法
無菌性の試験の陽性数が1以上で,不適切な無菌性の試験の実施,不適切なVDmaxSDの照射又は特定の
バイオバーデンに関連する原因である場合は,是正処置を行った後に,通常の生産条件で製造したバッチ
から更に10個の製品試料を使用して最初の滅菌線量実証試験で用いたのと同じVDmaxSDで確認滅菌線量監
査(JA.4.3.3.6参照)をやり直す。
結果は,上記のa)〜c)に従って判定する。
JA.4.3.3.7
VDmaxSD法を用いて実証した滅菌線量の増加
前に選択した滅菌線量に対してJA.3で選定した表から,VDmaxSD及びJA.4.3.3.3に従って決定した平均
バイオバーデン(SIPは1.0)に対応する線量増加値を求める。表に平均バイオバーデンの記載がない場合
には,平均バイオバーデンより大きく,表にある最も近い値を用いて線量増加値を求める。この線量増加
値を用いて,式(JA.2)で増加滅菌線量を計算する。
増加滅菌線量(kGy)=選択した滅菌線量+線量増加値 ················ (JA.2)
JA.4.3.4
滅菌線量監査の不合格
滅菌線量監査が不合格で滅菌線量の再確立が必要となった場合は,不合格の原因を調査し,修正及び/
又は是正措置を講じなければならない(JIS T 0806-1:2010の4.4参照)
調査の要素として,既に生産した製品に対しては,規定したSALの達成について,滅菌線量監査で不合
格となった滅菌線量で生産した製品の影響を考慮し,その使用の適合性についてリスク評価をしなければ
86
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ならない。調査及びその後の活動は,記録しなければならない(JIS T 0806-1:2010の4.1.2参照)。
注記 滅菌線量が再確立されるまで,該当SALの達成に対する影響を決定するのは不可能な場合があ
る。
JA.5 実施例
JA.5.1 選択した滅菌線量17.5 kGyの実証(SIPは1.0未満)
表JA.10にVDmax17.5法の実施例を示す。実施例では複数製造バッチ製品であり,線量実証試験において
製品試料が大きすぎるため,製品試料の一部分(SIPは1.0未満)を使用した。
表JA.10−VDmax17.5法の実証(SIPは1.0未満)
用語
数値
説明
第1段階
SAL
10−6
この方法は,最大SAL 10−6を達成するための滅菌線量としての17.5 kGyを実証す
る。
SIP
0.5
製品は,無菌性の試験には大きすぎるため,試験には製品の半分の部分を使用した。
製品試料数
40
バイオバーデン決定に3バッチからそれぞれ10個及び検定線量試験に10個を採取
した。
第2段階
平均バイオ
バーデン
6
3バッチのSIPバッチ平均バイオバーデンは2,3,4であった。
各バッチの製品試料全体のバイオバーデンは,次のように計算した。
2/0.5=4
3/0.5=6
4/0.5=8
全平均バイオバーデンは6であった。
バッチ平均バイオバーデンの最大値は8であった。
バッチ平均バイオバーデンの最大値8は,全平均バイオバーデン6の2倍未満のた
め,6を用いてSIP=1.0 VDmax17.5を求めた。
第3段階
選択した
滅菌線量
17.5 kGy
3バッチのバッチ平均バイオバーデンの全て及び全平均バイオバーデンは9.0以下
である。
第4段階
SIP検定線量
2.7 kGy
表JA.3からSIP=1.0 VDmax17.5及び平均バイオバーデン6に対するSIP線量減少係
数を求める。SIPが0.5のSIP VDmax17.5は,式(JA.1)を用いて算出した。
SIP VDmax17.5=(SIP=1.0 VDmax17.5)+(SIP線量減少係数×log SIP)
[式(JA.1)]
例では,
SIP VDmax17.5=3.2 kGy+(1.79×log 0.5)=2.7 kGy
第5段階
検定線量試験
2.3 kGy〜
2.9 kGy
検定線量試験においてSIPへの線量は,2.3 kGy〜2.9 kGyであった。
製品試料への最大線量は,上限(3.0 kGy)を超えておらず,最大線量と最小線量
との算術平均2.6 kGyは,検定線量の90 %未満ではなかった(2.7 kGyの90 %は2.4
kGy)。
第6段階
結果の判定
陽性数
0
線量は限度内であり,無菌性の試験の結果は合格(すなわち,陽性数1以下)であ
り,検定は合格で滅菌線量として17.5 kGyは実証された。
87
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.5.2 選択した滅菌線量30 kGyの実証(SIPは1.0)
表JA.11にVDmax30法の実施例を示す。実施例では複数製造バッチ製品であり,線量実証試験において
製品試料の全体(SIPは1.0)を使用した。
表JA.11−VDmax30法の実証(SIPは1.0)
用語
数値
説明
第1段階
SAL
10−6
この方法は,最大SAL 10−6を達成するための滅菌線量としての30 kGyを実証する。
SIP
1.0
試験のため製品試料全体を使用した。
製品試料数
40
バイオバーデン決定に3バッチからそれぞれ10個及び検定線量試験に10個を採取
した。
第2段階
平均バイオ
バーデン
5 643
3バッチの平均バイオバーデンは5 030,5 700,6 200であった。
バッチ平均バイオバーデンの最大値は6 200であった。
バッチ平均バイオバーデンの最大値6 200は,全平均バイオバーデン5 643の2倍
未満のため,5 643を用いてSIP=1.0 VDmax30を求めた。
第3段階
選択した
滅菌線量
30 kGy
3バッチのバッチ平均バイオバーデンの全て及び全平均バイオバーデンは23 000以
下である。
第4段階
検定線量
12.5 kGy
表JA.7には平均バイオバーデン5 643の記載がないので,表中にある次に大きな
値の5 900を用いてSIP=1.0 VDmax30を算出した。
第5段階
検定線量試験
11.4 kGy〜
13.0 kGy
検定線量試験において製品試料への線量は,11.4 kGy〜13.0 kGyであった。
製品試料への最大線量は,上限(13.8 kGy)を超えておらず,最大線量と最小線量
との算術平均12.2 kGyは,検定線量の90 %未満ではなかった(12.5 kGyの90 %は
11.3 kGy)。
第6段階
結果の判定
陽性数
0
線量は限度内であり,無菌性の試験の結果は合格(すなわち,陽性数1以下)であ
り,検定は合格で滅菌線量として30 kGyは実証された。
88
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JA.5.3 VDmax22.5法を使用して実証した滅菌線量の滅菌線量監査で線量増加が必要となる場合
表JA.12にVDmax22.5法を使用して実証した滅菌線量に対して,滅菌線量の増加が必要となる滅菌線量監
査の実施例を示す。
表JA.12−滅菌線量の増加が必要となる滅菌線量監査
(VDmax22.5法を使用して実証された選択した滅菌線量)
用語
数値
説明
滅菌線量監査
第1段階
製品試料数
20
単一製造バッチから20個の製品試料を採取した。
第2段階
SIP
0.5
最初の22.5 kGyの実証試験では,SIPは0.5を使用した。
SIP平均バイオ
バーデン
99
試験した10個のSIPの平均バイオバーデンは99であった。
平均バイオ
バーデン
198
製品試料全体の平均バイオバーデンは,次のように計算した。
99/0.5=198
第3段階
検定線量試験
5.2 kGy〜
6.0 kGy
最初の22.5 kGyの実証試験は,検定線量5.6 kGyで実施され,10個のSIPはこの線
量で照射した。SIPへの線量は,5.2 kGy〜6.0 kGyであった。製品試料への最大線
量は,上限(6.2 kGy)を超えておらず,最大線量と最小線量との算術平均5.6 kGy
は,検定線量の90 %未満ではなかった(5.6 kGyの90 %は5.0 kGy)。
第4段階
結果の判定
陽性数
2
線量は限度内であったが,無菌性の試験で陽性数が2であったため,確認滅菌線量
監査の実施が必要であった。
確認滅菌線量監査
第1段階
製品試料数
10
単一製造バッチから追加で10個の製品試料を採取した。
第2段階
確認検定
線量試験
5.1 kGy〜
5.9 kGy
確認滅菌線量監査の検定線量は,最初の検定線量と同じである。10個のSIPをこ
の線量で照射した。確認滅菌線量監査のSIPへの線量は,5.1 kGy〜5.9 kGyであっ
た。SIPへの最大線量は上限(6.2 kGy)を超えておらず,最大線量と最小線量との
算術平均5.5 kGyは,検定線量の90 %未満ではなかった(5.6 kGyの90 %は5.0 kGy)。
第3段階
結果の判定
陽性数
1
線量は限度内であったが,確認滅菌線量監査の無菌性の試験で陽性数が1であった
ので,22.5 kGyの滅菌線量を直ちに増加し,他の方法で滅菌線量を再確立する。
線量増加
平均バイオ
バーデン
198
滅菌線量監査のために決定した製品試料全体の平均バイオバーデンを用いて増加
滅菌線量を決定した。
線量増加値
3.3 kGy
平均バイオバーデン及び表JA.5から線量増加値を決定した。198が表に記載され
ていないので,表中にある次に大きな値の平均バイオバーデン200を用いた。
増加滅菌線量
25.8 kGy
増加滅菌線量(kGy)=22.5 kGy+線量増加値(kGy)
[式(JA.2)]
例では,
増加滅菌線量(kGy)=22.5 kGy+3.3 kGy=25.8 kGy
89
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] ISO 11137:1995,Sterilization of health care products−Requirements for validation and routine control−
Radiation sterilization
[2] JIS T 0806-3:2010 ヘルスケア製品の滅菌−放射線−第3部:線量測定にかかわる指針
注記 対応国際規格:ISO 11137-3:2006,Sterilization of health care products−Radiation−Part 3:
Guidance on dosimetric aspects(IDT)
[3] ISO/TS 11139:2006,Sterilization of health care products−Vocabulary
[4] JIS Q 13485:2005 医療機器−品質マネジメントシステム−規制目的のための要求事項
注記 対応国際規格:ISO 13485:2003,Medical devices−Quality management systems−Requirements for
regulatory purposes(IDT)
[5] JIS T 14971:2012 医療機器−リスクマネジメントの医療機器への適用
注記 対応国際規格:ISO 14971:2007,Medical devices−Application of risk management to medical
devices(IDT)
[6] AAMI Recommended Practice, RS:1984, Process control guidelines for gamma radiation. Sterilization of
medical devices, Arlington, VA, AAMI, 1984
[7] AAMI TIR27:2001,Sterilization of Health Care Products−Radiation Sterilization−Substantiation of 25 kGy
as a Sterilization Dose−Method VDmax, Arlington, VA
[8] ANSI/AAMI ST32:1991,second edition of AAMI RS Guideline for Gamma Radiation Sterilization, Arlington,
VA
[9] NHB 5340.1A, October 1968,Standard Procedures for the Microbiological Examination of Space Hardware,
National Aeronautics and Space Administration, Washington, DC 20546
[10] DAVIS, K.W., STRAWDERMAN, W.E., MASEFIELD, J. and WHITBY, J.L. DS gamma radiation dose setting
and auditing strategies for sterilizing medical devices. In: Gaughran, E.R.L. and Morrissey, R.F. (eds.),
Sterilization of medical products, Vol. 2, Montreal: Multiscience Publications Ltd., 1981, pp. 34-102
[11] DAVIS, K.W., STRAWDERMAN, W.E. and WHITBY, J.L. The rationale and computer evaluation of a gamma
sterilization dose determination method for medical devices using a substerilization incremental dose sterility
test protocol, J. Appl. Bact., 1984, 57, pp. 31-50
[12] FAVERO, M. Microbiologic Assay of Space Hardware, Environmental Biology and Medicine, 1971, 1, pp.
27-36
[13] HERRING, C. Dose audit failures and dose augmentation, Radiat. Phys. Chem., 1999, 54, pp. 77-81
[14] HERRING, C., BRANDSBERG, J., OXBORROW, G. and PULEO, J. Comparison of media for detection of
fungi on spacecraft, Applied Microbiology, 1974, 27(3), pp. 566-569
[15] KOWALSKI, J., AOSHUANG, Y. and TALLENTIRE, A. Radiation sterilization−Evaluation of a new method
for substantiation of 25 kGy, Radiat. Phys. Chem., 2000, 58, pp. 77-86
[16] KOWALSKI, J. and TALLENTIRE, A. Substantiation of 25 kGy as a sterilization dose: A rational approach to
establishing verification dose, Radiat. Phys. Chem., 1999, 54, pp. 55-64
[17] KOWALSKI, J. and TALLENTIRE, A. Aspects of putting into practice VDmax, Radiat. Phys. Chem., 2003, 67,
pp. 137-141
90
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
[18] KOWALSKI, J. et al. Field evaluations of the VDmax approach for substantiation of a 25 kGy sterilization dose
and its application to other preselected doses, Radiat. Phys. Chem., 2002, 64, pp. 411-416
[19] TALLENTIRE, A. Aspects of microbiological control of radiation sterilization, J. Rad. Ster., 1973, 1, pp.
85-103
[20] TALLENTIRE, A., DWYER, J. and LEY, F.J. Microbiological control of sterilized products. Evaluation of
model relating frequency of contaminated items with increasing radiation treatment, J. Appl. Bact., 1971, 34, pp.
521-34
[21] TALLENTIRE, A. and KHAN, A.A. The sub-process dose in defining the degree of sterility assurance. In:
Gaughran, E.R.L and GOUDIE, A.J. (eds.), Sterilization by ionizing radiation, Vol. 2. Montreal: Multiscience
Publications Ltd., 1978, pp. 65-80
[22] JIS Q 9000:2006 品質マネジメントシステム−基本及び用語
[23] Kowalski, J.B. and Tallentire, A. VDmax−A new method for substantiating 25 kGy, Med. Device. Technol.,
2000, 11, pp. 22-25
[24] Kowalski J.B., Patel, J., Arscott, E. and Tallentire, A. Computer and field evaluations in support of Method
VDmax15, Radiat. Phys. Chem., 2006, 75, pp. 1107-1112
[25] Kowalski, J.B. and Tallentire, A. Computer and field evaluations in support of the VDmax approach for selected
doses greater than 25 kGy, Radiat. Phys. Chem., 2010, 79, pp. 1005-1011
91
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JB
(参考)
JISと対応国際規格との対比表
JIS T 0806-2:2014 ヘルスケア製品の滅菌−放射線−第2部:滅菌線量の確立
ISO 11137-2:2013 Sterilization of health care products−Radiation−Part 2: Establishing
the sterilization dose
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的
差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 15 kGy・25 kGy及び17.5 kGy・
20 kGy・22.5 kGy・27.5 kGy・
30 kGy・32.5 kGy・35 kGyを
実証する方法並びに減菌線量
の監査方法について規定。
1
25 kGy及び15 kGyを実
証する方法並びに減菌
線量の監査方法につい
て規定。
選択
ISO/TS 13004で規定されている
17.5 kGy,20 kGy,22.5 kGy,27.5
kGy,30 kGy,32.5 kGy及び35
kGyを実証する方法を追加し,い
ずれかを選択することとした。
ISO 11137-2を補完するISO/TS
13004が次回改正でISO 11137-2
に吸収統合されることが国際
委員会で決定されている。改正
後はJISの内容になる。
2 引用規格
3 用語,定
義及び略語
3.1.16〜3.1.27及び3.2.14を追
加した。
3
JISとほぼ同じ
追加
3.1.16〜3.1.27及び3.2.14を追加
した。
ISO/TS 13004の用語,定義及び
略語を追加したが実質的な差
異はない。
5.2.6
注記
注意すべき具体的事項が明確
に記載されている。
5.2.6
JISとほぼ同じ
追加
注意すべき具体的事項が明確に
記載されている。
ISO/TS 13004に記載されてい
る注意すべき事項を明確に記
載した。
9A
VDmaxSD法を用いた場合
−
−
追加
17.5 kGy,20 kGy,22.5 kGy,27.5
kGy,30 kGy,32.5 kGy及び35
kGyの実証方法を追加規定した。
上記の適用範囲と同じ
10A
VDmaxSD法を用いた場合
−
−
追加
9Aと同じ
上記の適用範囲と同じ
11A
VDmaxSD法を用いた場合
−
−
追加
9Aと同じ
上記の適用範囲と同じ
附属書JA
(規定)
VDmaxSD法
−
−
追加
ISO/TS 13004を技術的変更なし
に記載した。
上記の適用範囲と同じ
JISと国際規格との対応の程度の全体評価:ISO 11137-2:2013,MOD
2
T
0
8
0
6
-2
:
2
0
1
4
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

92
T 0806-2:2014
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
T
0
8
0
6
-2
:
2
0
1
4
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。











































