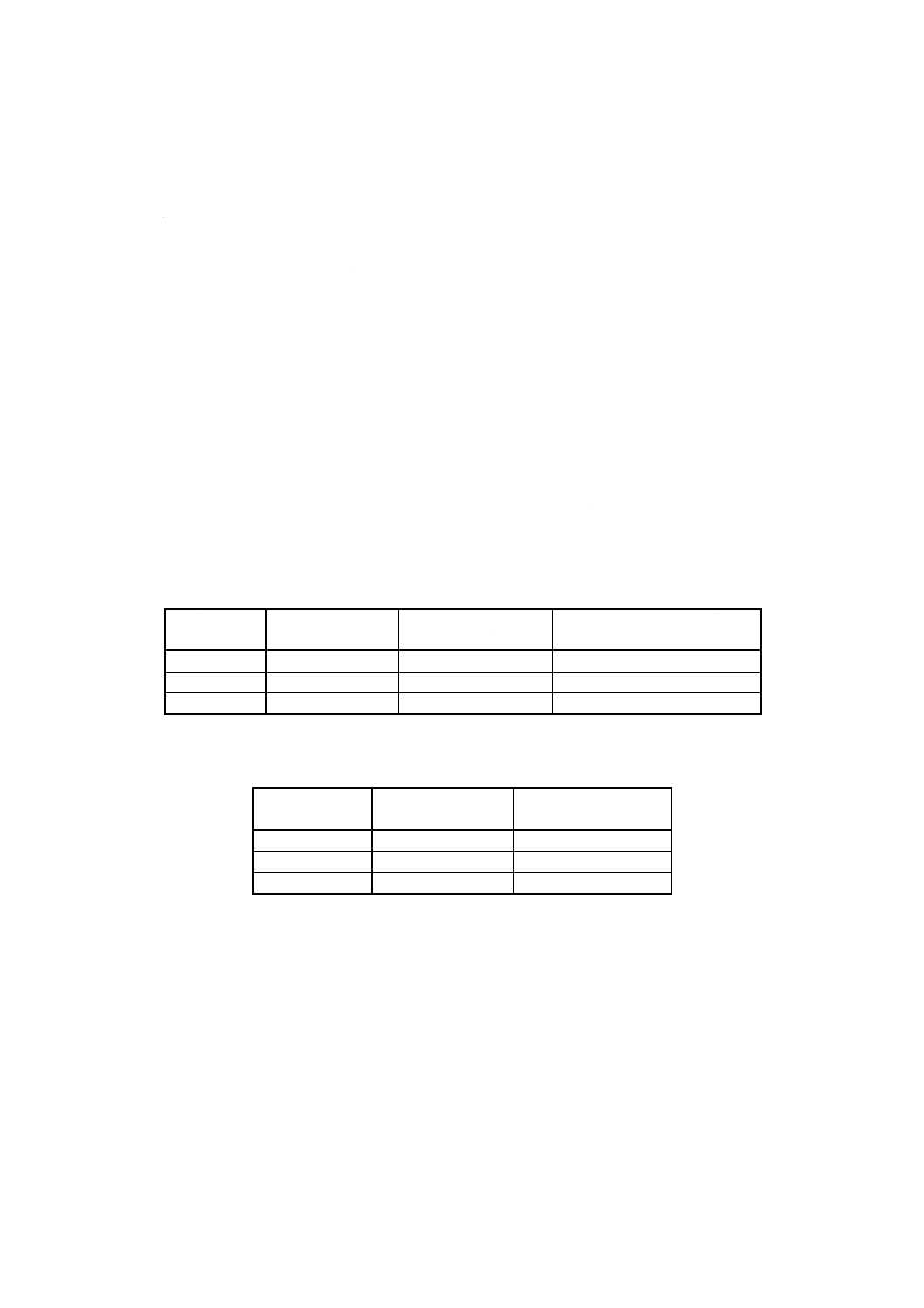T 0301 : 2000
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,財団法人日本規格協会 (JSA) から工業標準
案を具して日本工業規格を制定すべきとの申出があり,日本工業標準調査会の審議を経て,通商産業大臣
及び厚生大臣が制定した日本工業規格である。
JIS T 0301には,次の附属書がある。
附属書1(参考) 細胞バンクのWWWホームページアドレス一覧
附属書2(参考) MC3T3-E1及びV79細胞などの継代培養方法
附属書3(参考) 摩擦摩耗溶液の調製方法の一例
附属書4(参考) 誘導結合プラズマ質量分析法 (ICP-MS) による培養液中の金属の濃度の測定方法
の一例
附属書5(参考) ニュートラルレッド法及びMTT法による測定方法の一例
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 0301 : 2000
金属系インプラント材料の
細胞適合性評価方法
Testing method for biocompatibility of implantable metals using cultured cells
1. 適用範囲 この規格は,金属系インプラント材料の細胞適合性を,培養細胞(以下,細胞という。)を
用いて評価する方法について規定する。特に,この規格においては,培地中で材料と細胞を直接接触(直
接接触法)又は材料の抽出液を細胞に作用(抽出法)させ,材料表面における細胞の初期付着性及び細胞
の増殖特性の観点から,参照材料に対する優劣を評価する方法に関して規定する。
2. 引用規格 付表1に示す引用規格は,この規格に引用されることによって,この規格の規定の一部を
構成する。これらの引用規格は,その最新版を適用する。
3. 定義 この規格で用いる主な用語の定義は,JIS K 3600,JIS K 3610,JIS K 3611及びJIS K 0211に
よるほかは,次による。
a) 金属系インプラント材料 皮下・筋肉,骨組織内などに埋入(埋植)され,生体組織と直接接触して
利用される金属系生体材料。窒化処理,酸化処理などで表面改質した金属系材料も含まれる。
b) 細胞適合性 培養細胞を用いて評価される金属系インプラント材料の生体適合性で,細胞が悪影響を
受けずに材料表面に付着し,増殖・機能を維持する材料の性質。
c) 参照材料 臨床的に利用され,生体適合性が明らかな金属系インプラント材料。
d) コントロール 培養シャーレ,参照材料などで実験群との対比に用いるもの。
e) 陰性対照材料 細胞の感度及び精度を検証するために使用し,細胞の初期付着及び細胞の増殖を阻害
しない対照材料。
f)
陽性対照材料 細胞の感度及び精度を検証するために使用し,細胞の初期付着と細胞の増殖に対して
阻害作用を示す対照材料。
g) コロニー 単一の細胞が,培地中で増殖してできる可視的な細胞集落。
h) 超純水 細胞培養に最適となるように,イオン交換,逆浸透又は限外ろ過などを行って高度に精製し
た純水。ただし,導電率が,25±2℃で5.5μS/m (0.055μS/cm) 以下,比抵抗は,約0.18MΩ・m (18MΩ・
cm) 以上となる。
i)
滅菌 対象物中のすべての微生物を殺菌又は除去する操作。主な滅菌操作は,次による。
1) 乾熱滅菌 乾熱滅菌器を用い,180℃で1時間以上行う滅菌。ピペットなどのガラス器具類の滅菌は,
この方法による。
2) 高圧蒸気(オートクレーブ)滅菌 高圧蒸気滅菌器を用い,121℃で15分間以上行う滅菌。高圧蒸
気滅菌器が使用可能なイーグルMEM溶液,PBS (−) 溶液,ろ過滅菌器,チップなどの滅菌は,こ
2
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
の方法による。
3) ろ過滅菌 ろ過滅菌器を用いたフィルタによる滅菌。
4) 火炎滅菌 火炎を用いる滅菌。
5) エタノール滅菌 エタノールを用いた滅菌。
6) 紫外線滅菌 紫外線を用いた滅菌。
7) その他の滅菌 過酸化水素の低温プラズマを用いた滅菌,エチレンオキシドを用いた滅菌,γ線滅菌
など。
j)
無菌 増殖能力のある微生物,特に,細菌,真菌類が存在しない状態。
4. 細胞系(細胞株) 細胞系(細胞株)は,使用環境を考慮し,次の中から一つ以上を使用する。
a) マウス線維芽組織由来L929細胞 ATCC(1) CCL 1 (NCTC Clone 929) 及びRCB(2)0081又はこれと同等
の品質のもの。
b) マウス頭頂骨由来MC3T3-E1細胞 RCB1126又はこれと同等の品質のもの。
c) チャイニーズハムスター肺線維芽組織由来V79細胞 RCB0008及びJCRB(3)0603又はこれと同等の品
質のもの。
d) その他の細胞系(細胞株)及び初代培養細胞 ヒト子宮けい(頸)部がん(癌)由来HeLa細胞,マ
ウス線維芽組織由来Balb/3T3などがあるが,一定の感度があり,認められた貯蔵機関によって提供さ
れ,試験に支障のない品質のもの。
注(1) American Type Culture Collectionの略
(2) Riken Cell Bank(理化学研究所細胞開発銀行)の略
(3) Japanese Collection of Research Bioresourcesの略
備考1. a)〜d)の細胞系は,凍結保護剤であるJIS K 9702に規定するジメチルスルホキシド (DMSO)
を10vol%加えた培地中で保存する。1年間程度の保存は,−80℃以下の低温槽で可能である
が,それ以上の長期保存は,液体窒素保存容器を使用する。
2. 細胞系は,JIS K 3810-1,JIS K 3810-2及びJIS K 3810-3に規定するいずれかの方法で定期的
にマイコプラズマ汚染の有無を検出する必要がある。
3. ATCC,RCB,JCRBなどの細胞系,培地などの情報は,附属書1に示した細胞バンクのWWW
ホームページによって検索できる。
5. 試薬 試薬は,細胞培養に適した試薬を使用し調製した後,a)〜b)及びf)〜l)に関しては冷蔵保存 (2
〜8℃) する。
a) 炭酸水素ナトリウム溶液 (75g/L) JIS K 8622に規定する炭酸水素ナトリウム75.0gを超純水に溶か
して1Lとする。121℃,30分間高圧蒸気滅菌して使用する。
b) カルシウム及びマグネシウムを含まないりん酸緩衝生理的塩類溶液[以下,PBS (−) 溶液という。]
PBS (−) 粉末9.6gを超純水に溶かして1Lとする。121℃,15分間以上高圧蒸気滅菌して使用する。
c) L-グルタミン溶液 (30g/L) L-グルタミン3gを超純水に溶かして100mLとする。滅菌した0.22μm
メンブレンフィルタでろ過滅菌し,1回の使用量に分取した後冷凍保存するとよい。
d) トリプシン溶液 (10g/L) トリプシン (1/250) 粉末をb)で規定したPBS (−) 溶液に室温以下の温度
で30分間以上かくはん(撹拌)して完全に溶かし,濃度を10g/Lとした溶液。0.22μmメンブレンフ
ィルタでろ過滅菌し,使用時まで冷凍保存する。
3
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
e) アクチナーゼ溶液 (10g/L) たん白質分解酵素アクチナーゼEをb)で規定したPBS (−) 溶液に室温
以下の温度で30分間以上かくはんして完全に溶かし,濃度を10g/Lとしたもの。0.22μmメンブレン
フィルタでろ過滅菌し,使用時まで冷凍保存する。
f)
エチレンジアミン四酢酸二水素二ナトリウム溶液 (20g/L) [以下,EDTA溶液 (20g/L) という。]
JIS K 8107に規定するエチレンジアミン四酢酸二水素二ナトリウム二水和物をb)で規定したPBS (−)
溶液に溶かし,濃度を20g/Lとした溶液。121℃,30分間高圧蒸気滅菌して使用する。
g) トリプシン溶液(0.5又は1g/L)+EDTA溶液 (0.2g/L) (L929細胞及びV79細胞に使用) d)で規
定したトリプシン溶液 (10g/L) をb)で規定したPBS (−) 溶液で10倍又は20倍に希釈し,f)で規定し
たEDTA溶液 (20g/L) をEDTAが0.2g/Lになるように加える。
h) アクチナーゼ (0.01g/L) +EDTA溶液 (0.2g/L) (MC3T3-E1細胞に使用) e)で規定したアクチナー
ゼ溶液 (10g/L) をb)で規定したPBS (−) 溶液で1 000倍に希釈し,f)で規定したEDTA溶液 (20g/L) を
EDTAが0.2g/Lになるように加える。
i)
ホルマリンりん酸緩衝塩類溶液(V79細胞に使用) JIS K 9009に規定するりん酸二水素ナトリウム
二水和物4.4g,JIS K 9020に規定するりん酸水素二ナトリウム6.5g及びJIS K 8872に規定するホルム
アルデヒド液100mLを超純水に溶かして全量を1Lとする。
j)
メチレンブルー溶液 (1g/L) (V79細胞に使用) JIS K 8897に規定するメチレンブルー1.0gを超純
水に溶かし,全量を1Lとする。
k) ニュートラルレッド溶液 ニュートラルレッド3.3gをb)で規定したPBS (−) 溶液1Lに溶かした溶液
を原液とする。540nmにおける吸光度を測定する場合には,この原液を超純水で66倍に希釈(最終
濃度:50μg/mL)して使用する。原液は,遮光して保存する。
l)
MTT溶液 MTT〔[3- (4, 5-Dimethy1-2-thiazolyl) -2, 5 diphenyl tetrazolium Bromide]〕25mgをb)で規定
したPBS (−) 溶液5mLに溶解した溶液。ろ過滅菌して使用する。
m) ニュートラルレッド用固定液 JIS K 8123に規定する塩化カルシウム1gとJIS K 8872に規定するホ
ルムアルデヒド液1mLを超純水100mLに溶かす。
n) ニュートラルレッド用抽出液 JIS K 8355に規定する酢酸1mLとJIS K 8101に規定するエタノール
(99.5)50mLを超純水49mLに加えた溶液。
o) 塩酸-2-プロパノール溶液(MTT用ホルマザン溶解液) JIS K 8180に規定する塩酸又は1mol/Lの塩
酸をJIS K 8839に規定する2-プロパノールに0.04mol/Lとなるように加える。
p) エタノール JIS K 8101に規定するエタノール(99.5)。
q) 血清 子牛血清 (CS) (4)又は牛胎児血清 (FBS) (5)。細胞に適した血清を使用し,一連の実験を通して
同一ロットのものを使用する。血清は,凍結保存したものを解凍して使用する。解凍はできるだけ1
回であることが望ましいが,凍結・解凍を繰り返して使用する場合には2〜3回以内とする。
注(4) Calf Serumの略
(5) Fetal Bovine Serumの略
6. 培地 培地は,無菌であることとし,使用する細胞に適した培地を選ぶ。また,培地は冷蔵保存 (2
〜8℃) し一週間以内に使用する。
a) L929細胞用培地 JIS K 3604に規定するイーグルMEM(6)粉末9.4gを超純水1Lに溶かし,121℃,15
分間以上の高圧蒸気滅菌を行い,5.a)に規定する炭酸水素ナトリウム溶液 (75g/L) を2.3vol%,5.c)に
規定するL-グルタミン溶液 (30g/L) を1vol%,更に,5.q)に規定する血清を10vol%になるように加え
4
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る。
注(6) Minimum Essential Mediumの略
b) MC3T3-E1細胞用培地 α-MEM(7)粉末10gを超純水1Lに入れ30分間以上かくはんし完全に溶かし
た後,滅菌した0.22μmメンブレンフィルタでろ過滅菌し,5.a)に規定する炭酸水素ナトリウム溶液
(75g/L) を2.4vol%,更に,5.q)に規定する血清を10vol%になるように加える。
注(7) α-modified Eagleʼs MEMの略
c) V79細胞用培地 JIS K 3604に規定するイーグルMEM粉末9.4gを超純水1Lに溶かし,121℃,15
分間以上高圧蒸気滅菌し,5.a)に規定する炭酸水素ナトリウム溶液 (75g/L) を1.5vol%又は2.0vol%及
び5.c)に規定するL-グルタミン溶液 (30g/L) を1vol%,更に,5.q)に規定する血清を10vol%になるよ
うに加える。
d) その他の培地 その他の培地を使用する場合には,陰性対照材料及び陽性対照材料を用いて細胞の感
度及び精度を確認し,細胞培養に支障のない品質のものとする。
7. 器具及び装置
a) 培養用容器 JIS K 0950で規定するプラスチック製滅菌シャーレ(細胞培養用)とし,主として直径
(内径)35mm及び直径60mmを使用する。12ウエル又は24ウエルプレートを用いる場合には,培
養面積が少なすぎると測定誤差が大きくなるため,直径1.0cm以上で底面が平らなウエルプレートを
使用することが望ましい。ただし,抽出液を用いた細胞増殖試験においては,96ウエルプレートを用
いることによって効率よく測定できる。
b) 継代用フラスコ 培養面積が,25cm2及び75cm2のプラスチック製滅菌フラスコ。
c) 滅菌遠心管(遠沈管) 容量15mL及び50mL
d) メスシリンダー 容量100〜1 000mL
e) 駒込ピペット及びパスツールピペット 滅菌箱に入れ乾熱滅菌して使用する。
f)
滅菌ディスポーザブルプラスチック製ピペット 容量5〜25mL
g) ディジタルピペット及びチップ JIS K 0970で規定するディジタルピペット。チップ類は,滅菌して
使用する。
h) ガラス製薬品瓶(メジューム瓶) 容量100〜500mL高圧蒸気滅菌できる材質のもの。
i)
二酸化炭素インキュベータ 温度37±1℃,二酸化炭素が5±1%,相対湿度をほぼ100%に保持できる
もの。
j)
ろ過滅菌器 孔径0.01〜0.22μmのメンブレンフィルタを取り付け,ろ過滅菌できるもの。材質に適し
た滅菌を行っておく。
k) 乾熱滅菌器 200℃まで加熱・保持できるもの。
l)
高圧蒸気滅菌器(オートクレーブ) JIS T 7322又はJIS T 7324に規定するもので,121℃に加熱でき,
196kPaの器内圧力で使用できるもの。
m) 恒温槽 水温を37±2℃に保持できるもの。
n) 倒立型位相差顕微鏡 100倍に拡大できるもの。
o) クリーンベンチ JIS B 9922に規定するもの又はJIS K 3801によって試験を行ったとき,捕集効率
99.99%以上のHEPAフィルタを備えたもの。
p) 血球計算盤 JIS T 4204に規定する計算盤。
q) 細胞数計数装置 JIS R 6002に規定する細孔電気抵抗試験法を用い細胞数が計測できる装置。
5
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
r) ウエルプレート用分光光度計(ウエルプレートリーダー) ニュートラルレッド溶液を使用する場合
には,540nmの吸光度が,MTT溶液を使用する場合には,570nm及び630nmの吸光度が測定できる
もの。
s)
遠心機 JIS T 1701で規定するもので,3 000min−1まで回転できるもの。
t)
超純水精製装置 3.g)に規定する細胞培養に適した超純水が精製できるもの。
u) 真空ポンプ 吸引除去及び吸引ろ過に適したもの。
v) 超音波洗浄器 試料,器具などが超音波洗浄できるもの。
備考 ガラス器具類は,JIS R 3503に規定するほうけい酸ガラス-1又はほうけい酸ガラス-2を用いる。
8. 容器及び器具の洗浄と滅菌
a) すべての容器及び器具は,洗剤,超音波洗浄などを用い細胞培養に適した方法で洗浄する。洗剤を使
用した場合には,洗剤が残らないように流水中で十分に洗浄する。ただし,血清などが乾固すると洗
いにくくなるので,使用したガラス器具は,直ちに水に入れ,血清などの乾固をさけることが望まし
い。
b) 洗浄した容器及び器具は,超純水で十分に洗浄し,乾燥後,乾熱滅菌(180℃,1時間以上),又は高
圧蒸気滅菌(121℃,30分間以上)する。ガラス器具類の滅菌は,乾熱滅菌器で滅菌する。ろ過滅菌
器,チップなどプラスチック類を高圧蒸気滅菌する場合には,滅菌状態を保って取り出せるようにア
ルミニウムはくなどを均一に巻き滅菌する。また,駒込ピペットなどのピペット類は,綿栓して滅菌
箱などに入れ滅菌する。
9. 一般的な操作
a) 試験操作の前後には,手指及びクリーンベンチを消毒する。消毒には,エタノール水溶液 (70vol%) を
用いる。
b) 培養液など細胞に接触する溶液は,細胞と接触させる前に,あらかじめ約37℃に温めておく。
c) クリーンベンチ内で開閉するすべての容器に対しては,開閉前後に口部及びふたを火炎滅菌(8)する。
ピペット類は,使用する直前に火炎滅菌して使用する。
d) メジューム瓶などから溶液を分取する場合には,火炎滅菌したディスポーザブルプラスチック製ピペ
ットを使用するとよい。
e) 二酸化炭素インキュベータ,恒温槽,洗浄槽などは定期的に洗浄する。また,超純水精製装置内のフ
ィルタ類は指定された期間内に交換する。
注(8) 試薬,培地などを入れたガラス製薬品瓶(メジューム瓶),細胞培養用フラスコ,遠心管(遠沈
管)などの口部及びふたの滅菌に用いる。メジューム瓶及び培養用フラスコのふたを外した直
後及びふたをする直前に,メジューム瓶,フラスコなどを斜めに持って回しながら口部及びふ
たを火炎の中に入れて滅菌する操作。
10. 細胞の継代培養 細胞の継代培養は,一週間程度の間隔で行い,次に示した操作を参考にし,これに
準じて行う。
a) L929細胞の継代 培養面積25cm2の培養用フラスコ1個を用いた場合を例に示すが,培養面積75cm2
のフラスコを用いる場合には,すべての液量をおよそ3倍にするとよい。
1) 細胞が単層で増殖し,飽和密度に近い状態のときにフラスコ内の培養液をパスツールピペットを用
6
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
いて吸引除去する。
2) 5.b)に規定するPBS (−) 溶液5mLをフラスコに加え細胞を洗浄した後,PBS (−) 溶液を吸引除去
する。
3) 5.g)に規定するトリプシン (1g/L) +EDTA溶液 (0.2g/L) を4mL加え,二酸化炭素インキュベータ
中に約1分間静置する。
4) フラスコ内のトリプシン (1g/L) +EDTA溶液 (0.2g/L) を駒込ピペットを用いてピペッティングし,
あらかじめ培養液5mLが入った15mLの遠沈管に移す。
5) 1 000min−1で5分間遠心分離し,上澄み液をパスツールピペットで吸引除去する。
6) 培養液10mLを遠沈管に加え,駒込ピペットで細胞に損傷を与えないように10回程度ピペッティン
グし細胞を洗浄した後,再度,1 000min−1で5分間遠心分離する。
7) 上澄み液をパスツールピペットで吸引後,培養液5mLを加え,ピペッティングし均一な細胞浮遊液
を調製する。パスツールピペットなどを用い血球計算盤に細胞浮遊液を載せ,倒立型位相差顕微鏡
を用いて細胞数を計数し,最適な初期細胞数が得られる濃度(1×105〜3×105個/mL程度)に希釈
する。
8) 培養液5mLを入れた新しいフラスコに1週間程度で細胞が飽和密度になる初期細胞数(例えば,3
×104〜5×104個)となるように,ディスポーザブルピペットなどを用いあらかじめ測定した1滴の
液量から必要な細胞浮遊液の量を算出し(例えば,2〜3滴)滴加する。滴加後,細胞が均一に拡散
するようにフラスコを静かに振とうした後,二酸化炭素インキュベータ中に静置する。
9) 二酸化炭素インキュベータ中に24時間静置した後,新しい培養液と交換する。
備考 ピペッティングとは,培養フラスコ,培養シャーレなどを傾斜させ,駒込ピペットなどを用い,
細胞付着面をトリプシン溶液又はアクチナーゼ溶液などで洗い流し,この流れを利用して細胞
をフラスコからはく離させる操作,又は駒込ピペットなどを用い,細胞を洗浄する操作及び均
一な細胞浮遊液を得る操作をいう。
b) MC3T3-E1細胞,V79細胞,その他の細胞系の継代に関しては,L929細胞に類似するため附属書2に
示す。
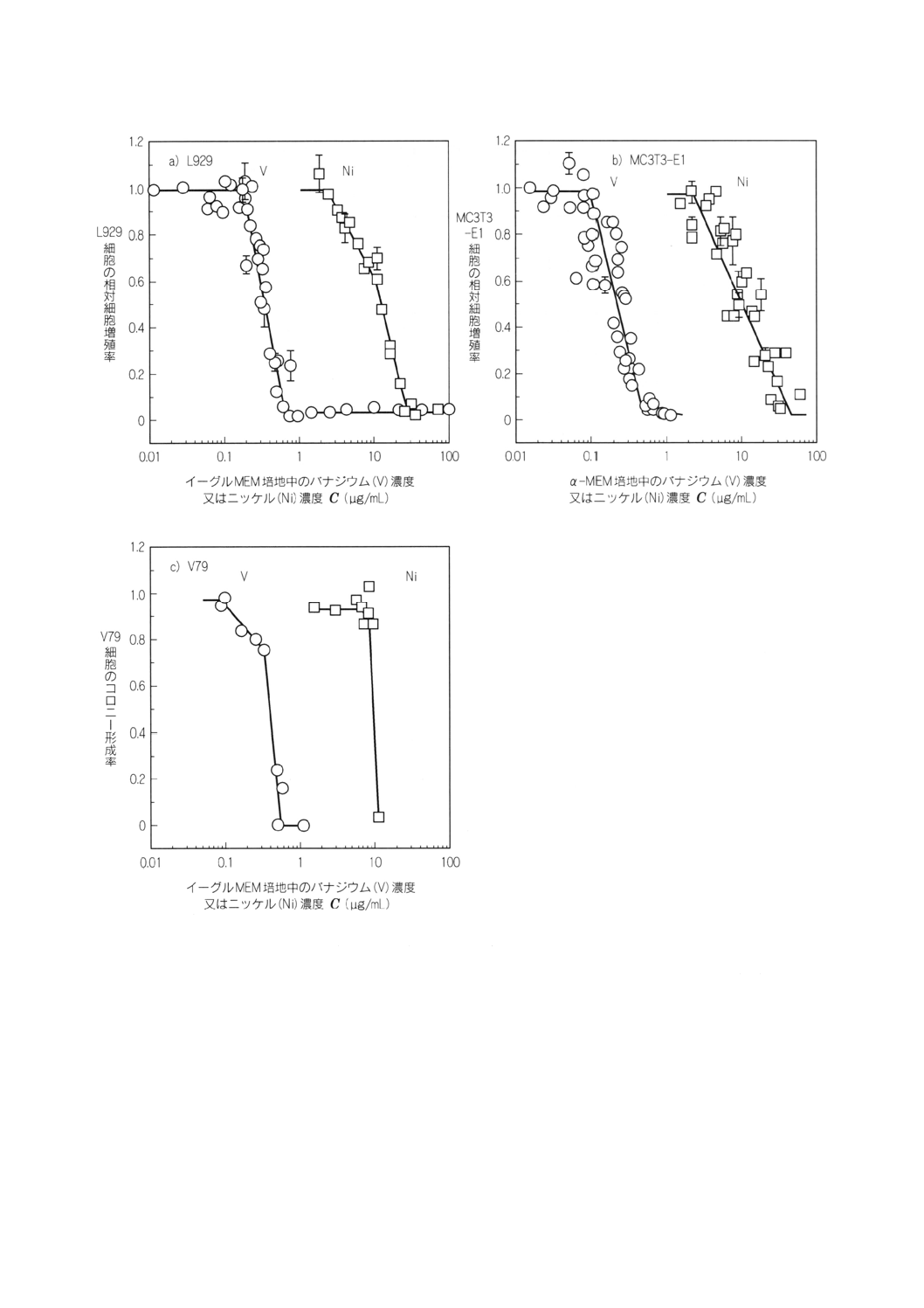
11. 実験系の検証に用いる対照材料 表1及び表2並びに図1に示した結果を参考にし,陰性対照材料及
び陽性対照材料をそれぞれ一つ以上選ぶ。
a) 陰性対照材料 標準的な陰性対照材料として,次の中から一つ以上を選ぶ。
1) JIS G 4303に規定するSUS316Lステンレス鋼製円板。
2) JIS H 4600に規定する2種相当工業用純チタン製円板
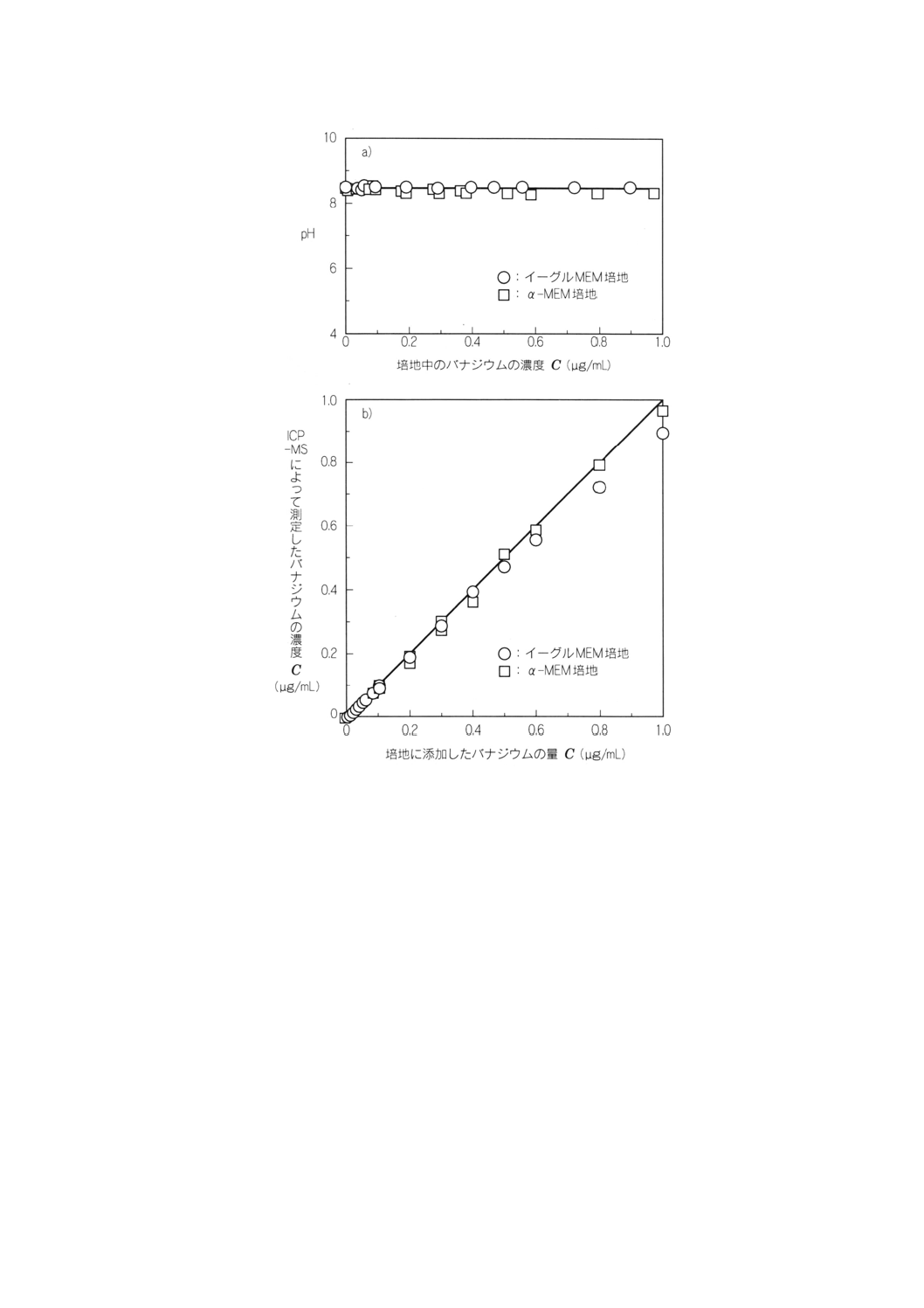
b) 陽性対照溶液 バナジウムを含む溶液(例えば,1g/L)。高圧蒸気滅菌などで滅菌後,図2に示した誘
導結合プラズマ質量分析法 (ICP-MS) による分析結果などを参考にし,培地に添加して使用する。
備考1. 11.a)の陰性対照材料において金属円板の表面性状は,実際の使用環境を考慮しJIS R 6253に
規定する1 000番以上の耐水研磨紙などで仕上げた表面粗さのものとし,超純水及びエタノー
ル溶液中で十分に洗浄し乾燥した後,高圧蒸気滅菌又は乾熱滅菌などの滅菌処理をしたもの。
2. 11.b)の陽性対照溶液において,酸などを含み希釈する必要がある場合には,5.b)に規定する
PBS (−) 溶液などで希釈(参考に示した1g/L溶液の場合には,2%硝酸を含むため10倍に希
釈する。)して使用する。2%硝酸の影響は,培地中では少なくとも1 000倍以上に希釈され,
図2からも明らかなようにpHの影響はほとんどみられないため,硝酸の影響は無視できる。
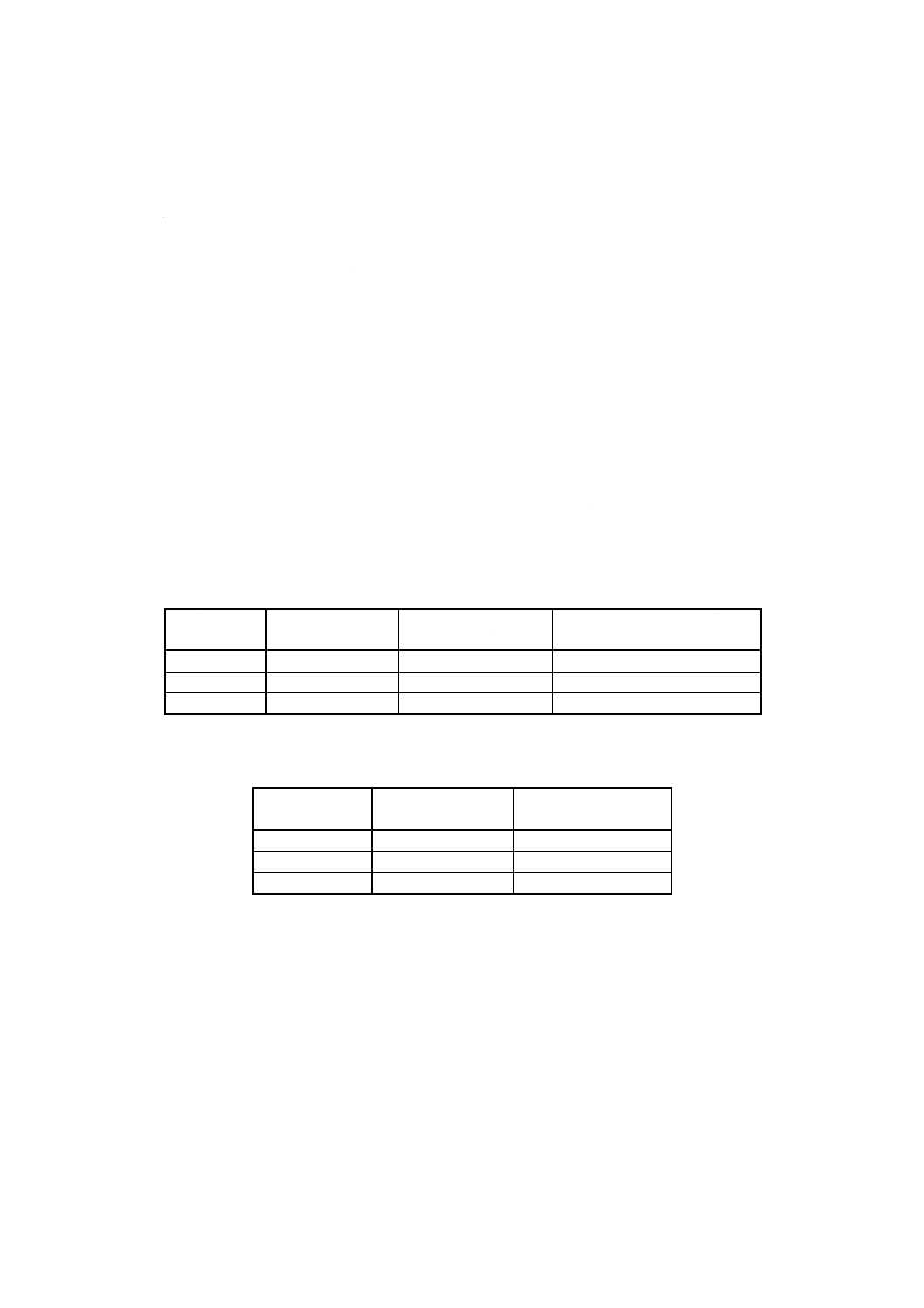
7
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
また,バナジウム(粉末)を超純水中で抽出して得られたバナジウムイオンを含む溶液を培
地に添加した結果とバナジウム標準液を培地に添加した結果とが一致することからバナジウ
ム以外の(アンモニウムイオンなど)の影響は無視できる[図1 a)及び図1 b)]。
3. 滅菌したバナジウム(金属板又はブロック)を培養液などで抽出し,バナジウムイオンを溶
出させた溶液又はバナジウム粉末を超純水中で抽出し,粉末を除去した後,滅菌した溶液を
培地に加えて陽性対照溶液としてもよい。
4. 図1に示す相対細胞増殖率に関するデータ及び図3に示した誘導結合プラズマ質量分析法
(ICP-MS) による分析結果を参考にし,ニッケルを含む溶液を5.b)に規定するPBS (−) 溶液
などで希釈(参考に示した10g/L溶液の場合には,2%硝酸を含むため10倍に希釈する。)し,
高圧蒸気滅菌などで滅菌した後,培地に添加して使用してもよい。ただし,この場合には,
pHの変化を最小限にする必要がある。又はJIS K 8152に規定する塩化ニッケル(II)六水和物
を超純水で溶かし,滅菌した後,培地に加えて陽性対照溶液とすることもできる。ただし,
塩化ニッケル(II)六水和物をPBS (−) 溶液に溶かすと沈殿物を生成するので注意を要する。
5. 強い細胞増殖阻害作用を示す陽性対照材料として,バナジウム製円板を用いてもよい。
参考 バナジウム及びニッケル溶液には,米国SPEX社製ICP (AES, MS) 用バナジウム標準溶液
[PLV2-2Y,1g/L,メタバナジン酸アンモニウム (NH4VO3),取扱代理店:西進商事株式会社な
ど]及びICP (AES, MS) 用ニッケル標準溶液(PLNI2-3Y,10g/L,ニッケル)などがある。
表1 陰性対照材料の相対細胞増殖率及びコロニー形成率
細胞系
コントロール
(培養シャーレ)
SUS316L
ステンレス鋼製円板
2種相当工業用純チタン製円板
L929
1.0
0.8〜0.9
0.8〜1.0
MC3T3-E1
1.0
0.7〜0.9
0.8〜1.0
V79
1.0
0.7〜0.9
0.8〜0.9
L929及びMC3T3-E1:高圧蒸気滅菌,初期細胞数:2万〜5万個
V79:乾熱滅菌,初期細胞数:100個
表2 陽性対照材料の相対細胞増殖率及びコロニー形成率
細胞系
コントロール
(培養シャーレ)
バナジウム製円板
L929
1.0
<0.02
MC3T3-E1
1.0
<0.03
V79
1.0
0
L929及びMC3T3-E1:高圧蒸気滅菌,初期細胞数:2万〜5万個
V79:乾熱滅菌,初期細胞数:100個
備考 バナジウム製円板の場合には,培地中へのバナジウムの溶
出量が約200μg/mLになるため,相対細胞増殖率及びコロニ
ー形成率が0近くなる。
8
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
備考 L929及びMC3T3-E1細胞の初期細胞数は2万〜5万個,
V79細胞の初期細胞数は100個である。
図1 培地中のバナジウム (V) の濃度又はニッケル (Ni) の濃度とL929,MC3T3-E1細胞の
相対細胞増殖率及びV79細胞のコロニー形成率の関係
9
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
備考 二酸化炭素5%の雰囲気下で最適なpHとなるように炭酸水素ナトリウム溶液
(75g/L) が添加されているため,a)に示したpHの値は高くなっている。
図2 培地にバナジウム陽性対照溶液を添加し大気雰囲気下で測定した場合のpHの変化a)及び
培地に添加したバナジウムの量とICP-MSを用いて測定したバナジウムの濃度の比較b)
10
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
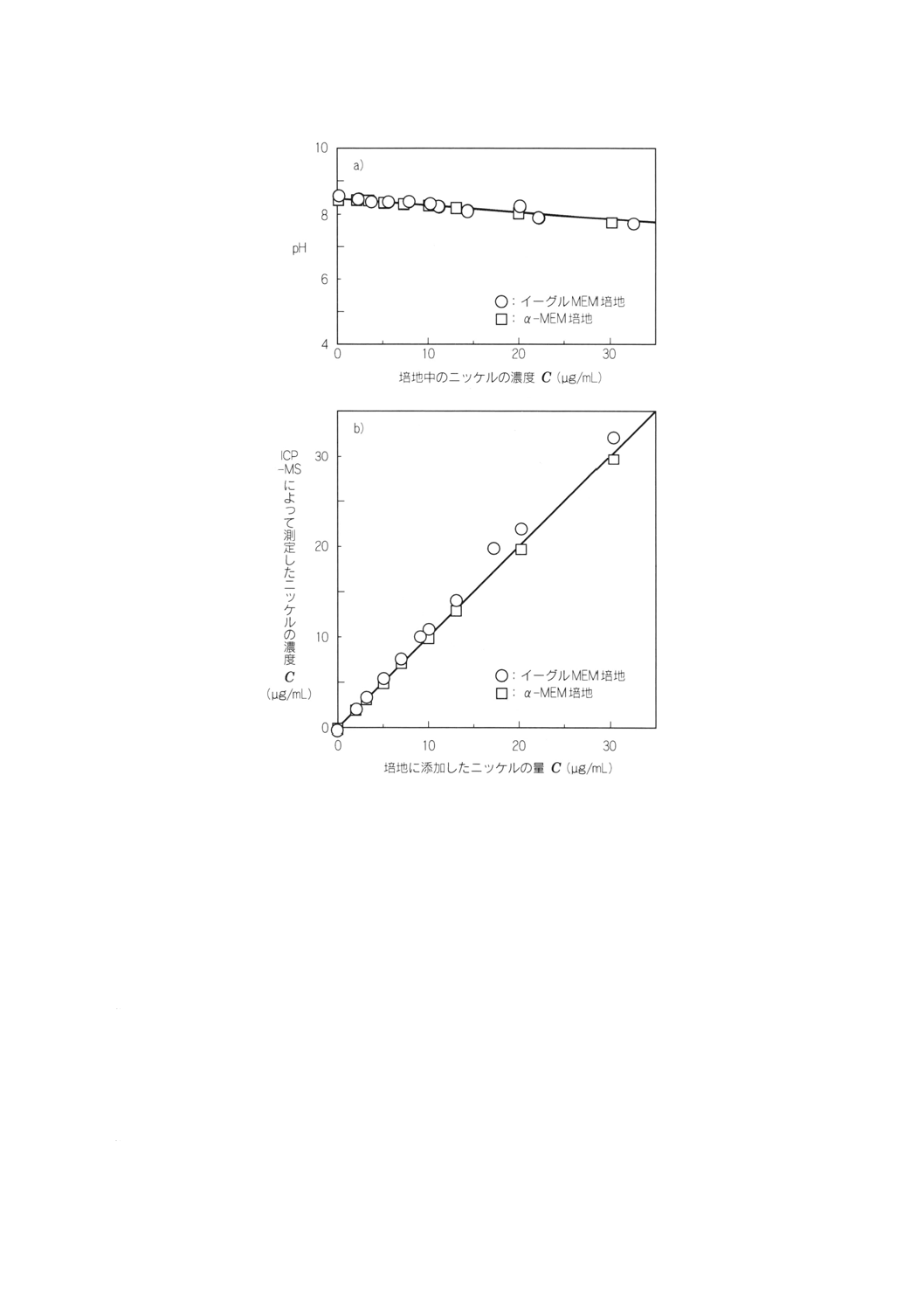
備考 濃度が10μg/mL以上では,pHが低下し培地がわずかに変色する。
図3 培地にニッケル陽性対照溶液を添加し大気雰囲気下で測定したpHの変化a)及び培地に
添加したニッケルの量とICP-MSを用いて測定したニッケルの濃度の比較b)
12. 試料の調製 試料と細胞を直接接触させた場合(直接接触法)及び抽出液を用いた場合(抽出法)に
ついて規定するが,金属系インプラント材料が使用される環境を考慮し,いずれかを選定し同一の条件で
細胞適合性を比較する。
a) 直接接触法
1) 直径35mm,60mm(主に35mm)の培養シャーレ又は,12ウエル及び24ウエルプレートのいずれ
かの大きさに合うように金属円板又は半円板を切断し,使用環境に合った表面粗さ(例えば,1 000
番以上の耐水研磨紙で仕上げる。)とする。円板又は半円板の試料は,最低5枚ずつ作製し,超純水
及びエタノール中で十分に超音波洗浄する。
2) 11.に規定する陽性及び陰性対照材料を試験試料と同様に切断する。
3) 180℃,1時間以上の乾熱滅菌又は121℃,30分間の高圧蒸気滅菌を行う。
4) 試料,陽性及び陰性対照材料は,シャーレ(又はウエルプレート)内によく密着させる。
11
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 抽出法 抽出試料,抽出液及び抽出条件は,金属系インプラント材料が使用される環境,材料の耐食
性などを考慮して選ぶ。
1) 抽出試料 最適な洗浄及び滅菌を行った金属板,金属粉末,JIS T 0303に規定する方法に従い作製
した金属摩耗粉などを用いる。金属粉末及び摩耗粉を使用する場合には,あらかじめ粉末の粒子径
及び粒子径分布を測定することが望ましい。板状試料の表面積は,できるだけ大きな条件とし,表
面積 (cm2) /抽出液量 (mL) の値が,0.5cm2/mL以上(9)となるようにする。
粉末を用い培地中で抽出後,粉末を取り除く場合には,粉末 (g) /抽出液量 (mL) の値が,
0.05g/mL以上で,0.2g/mLを超えない範囲で培地が劣化しない条件とする。摩耗粉など金属粉末を
培地に含んだままで細胞培養することも可能となるが,粉末 (g) /抽出液量 (mL) の値が,
0.01g/mL以下で培地が劣化しない条件で行う。この場合には,細胞系によっては,0.2μm付近の粒
子において,どん(貪)食作用を示し結果に影響を与えることがあるので注意する。
注(9) ISO 10993-12 Biological evaluation of medical devices−Part 12 : Sample preparation and reference
materialsでは,厚さ0.5mm以上で,3cm2/mLとなっているが,この抽出法では,ISO 10993-5 Test
for cytotoxicity : in vitro methodsに準じている。
2) 抽出液及び抽出条件 抽出液及び抽出条件は,次による。
2.1)
培地による抽出 試料及び血清を含んだ培地をメジューム瓶などに入れ,無菌状態を維持し,37℃
で培養液の活性度が低下しない時間内の条件で二酸化炭素インキュベータ中にふたを緩めた状態で
静置し抽出する。ただし,金属粉末及び金属摩耗粉を用いる場合には,できるだけ所定時間ごとに
かくはん(撹拌)し,抽出時間は72時間以下とし,特に,金属粉末の種類によって抽出時間が長く
なると培養液と反応し,沈殿物の生成などによる変性が生じる場合があるので注意する。
2.2)
高圧蒸気滅菌器が使用可能なイーグルMEM溶液などの無血清培地による抽出 試料及び高圧蒸気
滅菌器が使用可能な無血清培地をメジューム瓶などに入れ,121℃の高圧蒸気滅菌が可能な時間(例
えば,1〜6時間)まで高圧蒸気滅菌器中で抽出した後,血清などを加え培地とする。
2.3)
超純水抽出 超純水中で2.2)と同じ条件で抽出し,この超純水を用いて培地を調製する。
2.4)
その他の抽出液 長期間の使用環境を考慮し加速的な試験の一つとして行う場合,又はチタン系合
金のような耐食性に優れた材料間で合金を構成する元素の影響を比較する場合には,JIS T 0303に
規定する方法に準じ,金属ディスクと金属ピン,アルミナセラミックスピン,アパタイトセラミッ
クスピンなどを血清を含まないイーグルMEM溶液,PBS (−) 溶液などで摩擦させた摩擦摩耗溶液
を用いて培地を調製するか又はこの摩擦摩耗溶液を滅菌後,培地に加えて試験してもよい。摩擦摩
耗溶液の調製方法の一例を附属書3に示す。
更に,これら以外の抽出条件で行う場合には,適切な抽出条件で実施する。
2.5)
培養液中の金属濃度の測定を行う場合には,JIS K 0121及びJIS K 0116の規定に準じる方法又は類
似する方法でできるだけ早い時期に行う。分析の際には,培養液中で多くの金属は,水酸化物など
の沈殿物を生成する場合が多いので,孔径の小さなフィルタを用いて培養液をろ過し,金属イオン
と水酸化物などをできるだけ分離して測定し,分離した場合と分離しない場合で濃度差が大きい場
合には,そのことを結果に付記する。また,培養前と培養後で濃度差がある場合には,結果にその
ことを付記する。誘導結合プラズマ質量分析法 (ICP-MS) を用いた培養液中の金属濃度の測定法の
一例を附属書4に示す。分析するまでの保存期間中のゲルなどの生成を防止するためには,高純度
な酸(硝酸など)を少量加え,溶液のpHを2以下の状態で保存するとよい。
12
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
13. 細胞適合性評価方法 直接接触法及び抽出法による細胞適合性の評価は,次に示す方法に準じて行う。
a) 細胞は(播)種 直径35mmの培養シャーレを用いる場合を一例として次に示す。直径60mmのシャ
ーレを用いる場合には,培養液の量を8mLとし,ウエルプレートを用いる場合には,ウエルプレート
に適した培養液の量及び初期細胞数とし,その他はこれに準じて行う。
1) 10.の規定に従い,継代した細胞をトリプシン処理し,細胞浮遊液を調製し培養液に懸濁する。
2) 直径35mmのシャーレ(培養液3mL)を使用し,最適な細胞数(試験目的に応じ5×103〜105個)
の細胞をは(播)種する。
3) 11.に規定する陰性対照材料及び陽性対照材料に対しても同様に細胞をは(播)種する。
4) シャーレを37℃の二酸化炭素インキュベータ中に入れ,1〜7日間(主に4日間)培養する。可能で
あれば24時間後又は必要に応じて培地を交換するとよい。
5) MC3T3-E1細胞では,L929細胞に準じて行う。V79細胞では,主に直径60mmの培養シャーレ(培
養液8mL)を用いて行う。
b) 細胞数計数 培養後のL929細胞及びMC3T3-E1細胞の細胞数の計数は,次の方法に準じて行う。
1) 培養後,シャーレ内の培養液をパスツールピペットなどで吸引除去する。
2) 5.b)に規定するPBS (−) 溶液(例えば,直径35mmのシャーレの場合3mL)を加え細胞を洗浄し,
PBS (−) 溶液をパスツールピペットなどで吸引する。
3) 5.g)に規定するトリプシン (1g/L) +EDTA溶液 (0.2g/L) を(例えば,直径35mmのシャーレの場合
3mL)加え,37℃で約5分間二酸化炭素インキュベータ中に静置する。
4) トリプシン (1g/L) +EDTA溶液 (0.2g/L) をピペッティングし,培養液(例えば,3mL)を入れた
細胞数計数用カップに移す。更に,電解液 (3mL) でも同様にピペッティングして細胞数計数用カ
ップに移す。
5) 細胞数計数用カップ内の溶液をかくはんし細胞を均一に分散させた後,細胞数計数装置で細胞数を
計測する。この場合には,同一カップ内で3回以上繰り返し測定した平均値を細胞数とする。又は
血球計算盤を用いて同様に細胞数を計測してもよい。
6) 5.k)に規定するニュートラルレッド溶液又は5.1)に規定するMTT溶液を加え,ウエルプレートリー
ダーを用い吸光度を測定してもよい。ウエルプレートリーダー及び血球計算盤を使用した場合には,
感度及び精度の検証が必要となる。ニュートラルレッド溶液及びMTT溶液を用いた場合の方法を
附属書5に示す。
参考 細胞数計数装置用電解液には,コールターカウンターII試薬,アイソトン◯
RIIなどがある。
c) 細胞初期付着試験
1) 10.に規定する細胞の継代培養に準拠して細胞を継代する。
2) 12.に規定する試料の調製方法に準拠して試料を準備する。
3) a)に規定する細胞は(播)種方法に準拠して,試料,コントロール,11.に規定する対照材料に細胞
をは(播)種する。コントロールには,培養シャーレ又は参照材料を用いる。
4) b)に規定する細胞数計数に準拠して,は(播)種後,5時間〜1日間以内に細胞数を計測する。
5) 次の式から細胞初期付着率を算出する。
細胞初期付着率= (Nn/N0) / (Ncontroln/N0)
ただし,nは,5時間〜1日間以内の時間とする。
Nn: 試料でn時間培養後の細胞数
Ncontroln: コントロールでn時間培養後の細胞数の平均値
13
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
N0: 初期は(播)種細胞数
備考 ウエルプレートリーダーを用いた場合には,細胞数の代わりに吸光度を用いる。
6) 陰性対照材料及び陽性対照材料の細胞初期付着率を求める。
d) 細胞増殖試験
1) 10.に規定する細胞の継代培養に準拠して細胞を継代する。
2) 12.に規定する試料の調製に準拠して試料を準備する。
3) a)に規定する細胞は(播)種に準拠して,試料,コントロール,11.に規定する対照材料に細胞をは
(播)種する。コントロールには,培養シャーレ又は参照材料を用いる。
4) b)に規定する細胞数計数に準拠し,1〜7日間(主に4日間)培養後の細胞数を計数する。
5) 次の式によって相対細胞増殖率を算出する。この相対細胞増殖率が1より小さくなるにつれてコン
トロールに比べ細胞増殖阻害作用が強くなる。
相対細胞増殖率=Nn/Ncontroln
ただし,nは,1〜7日間。
Nn: 試料でn日間培養後の細胞数
Ncontroln: コントロールでn日間培養後の細胞数の平均値
又は,相対細胞増殖率= (logNn−logN1) / (logNcontroln−logNcontrol1)
Nn: 試料でn日間培養後の細胞数
N1: 試料で1日間培養後の細胞数
Ncontroln: コントロールでn日間培養後の細胞数の平均値
Ncontrol1: コントロールで1日間培養後の細胞数の平均値
備考 ウエルプレートリーダーを用いた場合には,細胞数の代わりに吸光度を用いる。
6) 陰性対照材料及び陽性対照材料の相対細胞増殖率を求める。
e) コロニー形成試験 V79細胞を用いたコロニー形成試験は,次の方法に準拠して行う。
1) 附属書2に規定した継代方法に準拠してV79細胞を継代する。継代した細胞を5.g)に規定する溶液
を用いてトリプシン処理し,細胞浮遊液を1 000min−1で5分間遠心分離した後,トリプシン溶液を
吸引除去し,培養液を入れ,十分にピペッティングを行い血球計算盤で細胞数を数え,50個/mLの
細胞濃度まで希釈する。
2) 12.に規定する試料の調製に準拠して試料を調製する。
3) 直径60mmの培養シャーレを用いる場合には,培養液6mLを入れ,初期細胞数が100個となるよう
に細胞浮遊液(50個/mL)を2mL加える。直径35mmのシャーレには,50〜100個(培養液3mL),
24ウエル又は12ウエルプレート(培養液0.5〜2mL)には,40〜50個のV79細胞をは(播)種す
る。は(播)種後,細胞が均一に拡散するように静かに振とうする。
4) シャーレ(又はウエルプレート)を二酸化炭素インキュベータ中に入れ,そのまま7日間培養する。
1日間二酸化炭素インキュベータ中に保持し,V79細胞を底面に付着させた後,培地に調製した抽
出液を加え,再び6日間二酸化炭素インキュベータ中で培養してもよい。
5) 11.に規定する陰性対照材料及び陽性対照材料についても同様にV79細胞をは(播)種する。
6) 培養後,培養液を捨て,PBS (−) 溶液で洗った後,5.i)に規定するホルマリンりん酸緩衝塩類溶液
(例えば,5mL)で30分間コロニーを固定する。
7) 固定後,5.j)に規定したメチレンブルー溶液 (1g/L) (例えば,5mL)を加え1時間保持し,コロニ
ーを染色する。
8) 染色液を捨て,流水で約30分間洗浄し,乾燥した後,シャーレ(又はウエルプレート)の細胞が
14
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
50個以上存在するコロニー数を数える。また,コロニーの大きさを比較することによって細胞への
影響を検討することもできる。
9) 試料を含まない培養シャーレ又は参照材料を含むシャーレ(又はウエルプレート)のコロニー数を
コントロールとしその平均値を算出する。
10) 試料のコロニー数を数え,次の式に示したようにコントロールのコロニー数の平均値に対する割合
(コロニー形成率)を求める。ただし,百分率 (%) で示してもよい。
コロニー形成率=N/Ncontrol
N: 試料で6〜7日間培養後のコロニー数
Ncontrol: コントロールで6〜7日間培養後のコロニー数の平均値
11) 陰性対照材料及び陽性対照材料のコロニー形成率を求める。
12) コロニーカウンターなどを用いてコロニー形成率を求める場合には,測定精度の検討が必要となる。
14. 結果の表示
a) シャーレ(又はウエルプレート)5個以上の平均値と標準偏差などの統計処理によって,培養シャー
レをコントロールとした場合の相対細胞増殖率及びコロニー形成率が,次の値を満たす場合には細胞
の感度及び精度が保証される。
1) 陰性対照材料 11.に規定する陰性対照材料が次の値を満たすこととする。
SUS316Lステンレス鋼製円板でのL929細胞及びMC3T3-E1細胞の相対細胞増殖率:0.7以上
V79細胞のコロニー形成率:0.7以上
又はJIS H 4600 2種相当工業用純チタン製円板のL929細胞及びMC3T3-E1細胞の相対細
胞増殖率
:0.8以上
V79細胞のコロニー形成率 :0.8以上
2) 陽性対照材料 図1に示した培地中のバナジウム又はニッケルの濃度と相対細胞増殖率及びコロニ
ー形成率の関係を参考にし,培養シャーレをコントロールとした場合に,11.に規定する陽性対照材
料の50%細胞の増殖を阻害する濃度 (50% Inhibitory Concentration : IC50) が,次に示す濃度付近に
ある場合には細胞の感度及び精度が検証できる。
バナジウム溶液でのIC50
L929細胞
MC3T3-E1細胞
V79細胞
0.3μg/mL
0.2μg/mL
0.4μg/mL
又はニッケル溶液でのIC50
L929細胞
MC3T3-E1細胞
V79細胞
10μg/mL
10μg/mL
10μg/mL
備考 細胞増殖阻害作用の強いバナジウム製円板を陽性対照材料とし培養シャーレをコントロールと
した場合の相対細胞増殖率及びコロニー形成率が,次に示す値である場合には細胞の感度及び
精度が検証できる。
バナジウム製円板
L929及びMC3T3-E1細胞の相対細胞増殖率
0.05以下
V79細胞のコロニー形成率
0
b) 直接接触法及び抽出法のいずれの場合でも,シャーレ(又はウエルプレート)5個以上の相対細胞増
殖率及びコロニー形成率の平均値を参照材料又はコントロールのそれらと統計解析に基づき比較する
ことによって,金属系インプラント材料間の細胞増殖阻害作用の強さを比較する。
15
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) 細胞増殖阻害作用に対する金属の濃度の影響を比較する場合には,縦軸に相対細胞増殖率又はコロニ
ー形成率,横軸に培地中の金属濃度(対数)を示す。このグラフから,コントロールに比べ20%又は
50%細胞の増殖を阻害する培地中の金属の濃度(IC20及びIC50)を求め,このIC20及びIC50の値を
用いて金属の濃度の影響を比較してもよい。
d) 試験報告書には,次の項目について報告する。
1) 試験を実施した機関の名称,住所,試験責任者の氏名,試験開始日及び試験終了日
2) 試験材料,陰性対照材料及び陽性対照材料について次の項目を明記する。
材料の名称,製造方法,ロット番号,製造業者の名称
3) 試料の調製方法
材料の寸法,形状,質量,表面積,表面仕上げ法と表面粗さなどの仕上げ状態,滅菌方法及び抽出
方法 ただし,金属粉末を用いる場合には,粒子の形状,粒子径と粒子径分布。
4) 使用した細胞系(細胞株),継代方法,培地の種類(抗生物質の種類及び含有量),細胞は(播)種
方法,細胞数計数方法
5) コントロールの種類,繰返し回数及びシャーレ数,相対細胞増殖率及びコロニー形成率の算出方法
及び統計解析方法
6) 細胞の増殖形態及びコロニー形態の光学顕微鏡写真
付表1 引用規格
JIS B 9922 クリーンベンチ
JIS G 4303 ステンレス鋼棒
JIS H 4600 チタン板及び条
JIS K 0116 発光分光分析通則
JIS K 0121 原子吸光分析通則
JIS K 0211 分析化学用語(基礎部門)
JIS K 0950 プラスチック製滅菌シャーレ
JIS K 0970 プッシュボタン式液体用微量体積計
JIS K 3600 バイオテクノロジー用語
JIS K 3604 組織培養用培地(最小必須培地)
JIS K 3610 生体工学用語(生体化学部門)
JIS K 3611 生体工学用語(生体システム部門)
JIS K 3801 除菌用HEPAフィルタのエアロゾル補集性能試験方法
JIS K 3810-1 マイコプラズマの検出法 第1部 人工培地による検出法
JIS K 3810-2 マイコプラズマの検出法 第2部 DNA蛍光染色による間接検出法
JIS K 3810-3 マイコプラズマの検出法 第3部 PCRによる検出法
JIS K 8101 エタノール(99.5)(試薬)
JIS K 8107 エチレンジアミン四酢酸二水素二ナトリウム二水和物(試薬)
JIS K 8123 塩化カルシウム(試薬)
JIS K 8152 塩化ニッケル(II)六水和物(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8355 酢酸(試薬)
16
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS K 8622 炭酸水素ナトリウム(試薬)
JIS K 8839 2-プロパノール(試薬)
JIS K 8872 ホルムアルデヒド液(試薬)
JIS K 8897 メチレンブルー(試薬)
JIS K 9009 りん酸二水素ナトリウム二水和物(試薬)
JIS K 9020 りん酸水素二ナトリウム(試薬)
JIS K 9702 ジメチルスルホキシド(試薬)
JIS R 3503 化学分析用ガラス器具
JIS R 6002 研削といし用研磨材の粒度の試験方法
JIS R 6253 耐水研磨紙
JIS T 0303 人工関節用材料のピンオンディスク法による摩耗試験方法
JIS T 1701 医療用遠心機
JIS T 4204 血球計
JIS T 7322 医療用高圧蒸気滅菌装置
JIS T 7324 医療用小形高圧蒸気滅菌器
関連規格 JIS K 8541 硝酸(試薬)
JIS K 9901 高純度試薬−硝酸
17
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書1(参考) 細胞バンクのWWWホームページアドレス一覧
この附属書1(参考)は,本体に関する事柄を補足するもので,規定の一部ではない。
細胞バンクのWWWホームページアドレスの一覧は,次のとおりである。
a) American Type Culture Collection http: //www. atcc. org/
b) 理化学研究所・細胞開発銀行 http: //www. rtc. riken. go. jp/
c) ヒューマンサイエンス研究資源バンク http: //www. jhfs. or. jp/index̲b. html
又は国立医薬品食品衛生研究所・JCRB細胞バンク http: //cellbank. nihs. go. jp
d) Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)
http: //www. dsmz. de/index. html
e) 東北大学加齢医学研究所・医用細胞資源センター
http: //www. idac. tohoku. ac. jp/idac/HomePages/ccr/
f)
その他の細胞情報
1) 株式会社林原生物化学研究所・細胞バンクインデックス
http: //cellbank. nihs. go. jp/jtca/book/
18
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書2(参考) MC3T3-E1及びV79細胞などの継代培養方法
この附属書2(参考)は,本体に関する事柄を補足するもので,規定の一部ではない。
MC3T3-E1及びV79細胞などの継代培養方法の一例を,次に示す。
a) MC3T3-E1細胞の継代 培養面積75cm2の培養用フラスコ1個を用いた場合を一例として示す。
1) 培養用フラスコ内で,細胞が単層で増殖し,飽和密度に近い状態のときにフラスコ内の培養液をパ
スツールピペットを用いて吸引除去する。
2) フラスコに5.b)に規定するPBS (−) 溶液15mLを加え細胞を洗浄し,フラスコ内のPBS (−) 溶液
を吸引除去する。
3) 本体の5.h)に規定するアクチナーゼ (0.01g/L) +EDTA溶液 (0.2g/L) 15mLを加え,約5分間二酸化
炭素インキュベータ中に静置する。
4) アクチナーゼ (0.01g/L) +EDTA溶液 (0.2g/L) を駒込ピペットを用いて細胞に損傷を与えないよう
にピペッティングし細胞をはく離させた後,PBS (−) 溶液15mLが入った遠沈管に移す。
5) 1 000min−1で,5分間遠心分離し,上澄み液をパスツールピペットで吸引除去する。
6) PBS (−) 溶液を10mL加え,駒込ピペットでピペッティングし細胞を洗浄した後,1 000min−1で5
分間遠心分離する。
7) 上澄み液をパスツールピペットで吸引除去した後,培養液10mLを遠沈管に加え,ピペッティング
し再度洗浄した後,1 000min−1で5分間遠心分離する。
8) 上澄み液をパスツールピペットで吸引後,培養液10mLを加え,ピペッティングし均一な細胞浮遊
液を調製する。パスツールピペットを用い血球計算盤に細胞浮遊液を載せ,位相差顕微鏡を用いて
細胞数を計数し,最適な初期細胞数が得られる濃度(2×105〜5×105個/mL)に希釈する。
9) 培養液15mLを入れた新しいフラスコに約1週間の培養で細胞が飽和密度になるような初期細胞数
(例えば,4×104〜105個)となるように,ディスポーザブルピペットなどを用い必要な量の細胞浮
遊液を(例えば,2〜4滴)滴加する。滴加後,細胞が均一に拡散するようにフラスコを静かに振と
うした後,二酸化炭素インキュベータ内に静置する。
b) V79細胞の継代 コロニーを形成しないような初期細胞数で3〜4日間ごとに継代する。培養面積
25cm2の培養用フラスコ1個を用いた場合を一例として示す。
1) 培養用フラスコ内で,細胞が単層で増殖し,飽和密度に近い状態のときにフラスコ内の培養液をパ
スツールピペットを用いて吸引除去する。
2) 本体の5.g)に規定するトリプシン(0.5又は0.1g/L)+EDTA溶液 (0.2g/L) を加え,1〜3分間二酸
化炭素インキュベータ中に静置する。
3) トリプシン(0.5又は0.1g/L)+EDTA溶液 (0.2g/L) を駒込ピペットを用いてピペッティングし,培
養液5mLが入った遠沈管に移す。
4) 1 000min−1で5分間遠心分離し,上澄み液をパスツールピペットで吸引除去する。
5) 上澄み液をパスツールピペットで吸引除去後,培養液10〜30mLを加えピペッティングし均一な細
胞浮遊液を調製する。
6) 培養液5mLを入れたフラスコに最適な初期細胞数(例えば,104個程度)になるように細胞浮遊液
1〜2mLを加える。
19
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) その他の細胞 L929細胞の継代方法に準じ,細胞株に最も適した方法で行う。
20
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書3(参考) 摩擦摩耗溶液の調製方法の一例
この附属書3(参考)は,本体に関する事柄を補足するもので,規定の一部ではない。
摩擦摩耗溶液の調製は,次に示した一例を参考にしこれに準じて行う。
a) 摩擦荷重及び摩擦回数は摩耗粉が生成し,JIS K 3604に規定するイーグルMEM又は本体の5.2b)に規
定するPBS (−) などの溶液が摩擦によって劣化しない範囲内とする。
b) 摩擦温度は,室温又は37℃とする。
c) 摩擦後,3 000min−1,約10分間の遠心分離を行い,上澄み液を0.22〜0.01μmのメンブレンフィルタ
を用いて段階的にろ過し,摩耗粉を除去する。
d) 121℃,30分間の高圧蒸気滅菌などを行い,この抽出液に炭酸水素ナトリウム溶液 (75g/L),血清など
を加え,培地とする。
e) 金属の濃度の影響を系統的に調べる場合には,抽出液を用いて調製した培養液を新しい培養液で段階
的に希釈して使用する。
21
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書4(参考) 誘導結合プラズマ質量分析法 (ICP-MS) による
培養液中の金属の濃度の測定方法の一例
この附属書4(参考)は,本体に関する事柄を補足するもので,規定の一部ではない。
誘導結合プラズマ質量分析法 (ICP-MS) による培養液中の金属の濃度の測定方法の一例を,次に示す。
a) すべての容器類を硝酸(1+19)(JIS K 8541に規定する硝酸1mLに水19mLの割合で混合し調製する。)
及び超純水で十分に洗浄する。
b) 測定する培養液を硝酸(1+99)(JIS K 9901に規定する高純度試薬−硝酸を用いて調製する。)で最適
な濃度範囲 (0.5〜1 000ng/mL) になるように希釈し,内標準物質,例えば,コバルト又はインジウム
を測定濃度範囲に応じて適切な感度(カウント数)が得られる濃度 (1〜10ng/mL) になるように加え,
さらに硝酸(1+99)を加えて一定液量とする。
c) 検量線用標準液は,測定濃度範囲で5点以上が望ましい。また,検量線用標準液中の内標準物質の濃
度は,測定溶液の濃度と一致させる。
d) 誘導結合プラズマ質量分析装置は,プラズマを点火し30分間以上保持しプラズマを安定させた後,最
適な感度に調整する。
e) 測定質量数は,培養液の影響ができるだけ小さくなるように選択する。
例 Ti : 49及び50,V : 51,Al : 27,Zr : 90及び91,Nb : 93,Ta : 181,Mo : 98及び96,Sn : 120及び
118,Pd : 106及び108,Fe : 54及び56,Cr : 53及び52,Ni : 60及び58,Co : 59,W : 184及び186
ただし,鉄の濃度の測定においては,シールドトーチを使用するとよい。
f)
オートサンプラを併用する場合には,次の条件を参考にする。
洗浄液:超純水及び硝酸(1+32)(JIS K 9901に規定する高純度試薬−硝酸を用いて調製する。)
ペリポンプ洗浄速度
:0.5s−1
洗浄時間
:180s
測定溶液の置換速度
:0.5s−1
置換時間
:60s
ペリポンプ安定待ち時間 :120s
測定中のペリポンプ速度 :0.10〜0.15s−1
質量数積分時間
:1〜3s
繰返し数
:6回
備考 アルミニウムを測定する場合には,アルミニウムの溶出が懸念されるため,アルミニウムが成
分として含まれている容器[例えば,パイレックス (Pyrex) 製メスフラスコなど]の使用を避
けること。また,測定溶液に硫酸及び塩酸が含まれる場合には,測定濃度の値に影響を及ぼす
ことがあるので注意する。
22
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書5(参考) ニュートラルレッド法及びMTT法による測定方法の一
例
この附属書5(参考)は,本体に関する事柄を補足するもので,規定の一部ではない。
ニュートラルレッド法及びMTT法による測定方法の一例を,次に示す。
a) ニュートラルレッド法 ニュートラルレッド溶液を用い,波長540nmの吸光度の比から相対細胞増殖
率を測定する場合には,次に示した方法に準じて行う。
1) ウエルプレートに培養液を適量(例えば,96ウエルプレート:0.2mL)入れ,最適な初期細胞数(試
験目的に応じ5×103〜105個)の細胞をは(播)種する。
2) 所定時間(1〜7日間)培養後,培養液を吸引除去する。24時間保持し,細胞を付着させた後,培養
液を交換し細胞への影響を評価してもよい。
3) 本体の5.k)で規定したニュートラルレッド溶液をウエルプレートの大きさに応じて適量(例えば,
96ウエルプレート:0.2mL,24ウエルプレート:1mL)を加え,二酸化炭素インキュベータ中に3
時間保持する。
4) ニュートラルレッド溶液を吸引除去し,本体の5.m)で規定した固定液を適量(例えば,96ウエルプ
レート:0.2mL,24ウエルプレート:1mL)加え,1分間保持する。
5) 固定液を吸引除去し,本体の5.n)で規定した抽出液を適量(96ウエルプレート:0.2mL,24ウエル
プレート:0.2mL)加える。
6) 10分間保持した後,ウエルプレート用分光光度計を用いて波長540nmの吸光度を測定する。
7) コントロールについても同様に操作し,実験群の吸光度をコントロールの吸光度の平均値で除して
相対細胞増殖率を算出する。
b) MTT法 MTTが細胞内に存在する酵素と反応し,ホルマザンを形成する。形成したホルマザンの量
は,細胞数と比例するのでホルマザンを本体の5.o)で規定した塩酸-2-プロパノール溶液で溶かした後,
次の方法によって吸光度を測定し相対細胞増殖率を算出する。
1) ウエルプレートに培養液を適量(96ウエルプレート:0.2mL)入れ,最適な初期細胞数(試験目的
に応じ5×103〜105個)の細胞をは(播)種する。
2) 二酸化炭素インキュベータ中で所定時間(1〜7日間)培養後,培養液を吸引除去する。
24時間保持し,細胞を付着させた後,培養液を交換し,細胞への影響を評価してもよい。
3) 本体の5.m)に規定するMTT溶液をウエルの大きさに応じて適量(例えば,培養液の10分の1の量
を目安とし,96ウエルでは10〜20μL)加え,二酸化炭素インキュベータ中に4時間保持する。
4) 本体の5.o)に規定する塩酸-2-プロパノール溶液を培養液と同量加え,超音波などでホルマザンを溶
かす。
5) プレートリーダーを用いて波長,570nmと630nm(空試験)の吸光度を測定し,570nmと630nmと
の吸光度の差を求める。
6) コントロールについても同様に操作し,実験群での570nmと630nmとの吸光度差をコントロール
での吸光度差の平均値で除して相対細胞増殖率を算出する。
23
T 0301 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
インプラント材料の試験方法関係JIS原案作成委員会 構成表
氏名
所属
(委員長)
堤 定 美
京都大学再生医科学研究所
(委員)
赤 松 功 也
山梨医科大学整形外科
桜 井 靖 久
東京女子医科大学医用工学研究施設
笹 田 直
千葉工業大学工学部
佐 藤 温 重
昭和大学歯学部
浜 中 人 士
東京医科歯科大学生体材料工学研究所
石 丸 裕
住友化学工業株式会社生産技術センター
大 森 健 一
小林製薬株式会社小林メディカル事業部
佐々木 佳 男
株式会社神戸製鋼所電子・情報事業本部
高 橋 孝
社団法人日本ファインセラミックス協会
服 部 昌 晃
日本特殊陶業株式会社総合研究所
平 野 昌 弘
三菱マテリアル株式会社総合研究所
柚 木 博 行
京セラ株式会社バイオセラム事業部
ロイ 堀 義和
ブリストル・マイヤーズスクイブ株式会社ジンマー事業部
中 村 晃 忠
国立医薬品食品衛生研究所
川 原 章
厚生省医薬安全局
立 石 哲 也
通商産業省工業技術院産業技術融合領域研究所
宮 崎 正 浩
通商産業省工業技術院標準部
茂 木 保 一
通商産業省工業技術院工業標準センター
山 本 洋二郎
通商産業省製品評価技術センター
○ 岡 崎 義 光
通商産業省工業技術院機械技術研究所
西 村 恵美子
通商産業省製品評価技術センター
(事務局)
橋 本 進
財団法人日本規格協会技術部
木 村 茂
財団法人日本規格協会技術部
増 森 かおる
財団法人日本規格協会技術部
○は,幹事を示す。
JIS原案作成WG1(金属系インプラント材料の細胞適合性評価方法)委員 構成表
氏名
所属
(委員長)
佐 藤 温 重
昭和大学歯学部
(委員)
武 田 昭 二
大阪歯科大学歯科理工学講座
坂 口 圭 介
テルモ株式会社研究開発センター
佐々木 佳 男
株式会社神戸製鋼所電子・情報事業本部
佐 藤 秀 隆
財団法人日本食品分析センター多摩研究所
吉 居 英 一
株式会社ジーシー研究所
土 屋 利 江
国立医薬品食品衛生研究所
塙 隆 夫
科学技術庁金属材料技術研究所
牛 田 多加志
通商産業省工業技術院産業技術融合領域研究所
立 石 哲 也
通商産業省工業技術院産業技術融合領域研究所
○ 岡 崎 義 光
通商産業省工業技術院機械技術研究所
西 村 恵美子
通商産業省製品評価技術センター
宗 像 保 男
通商産業省工業技術院標準部
(事務局)
木 村 茂
財団法人日本規格協会技術部
増 森 かおる
財団法人日本規格協会技術部
○は,幹事を示す。