R 1756:2020
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 2
3 用語及び定義 ··················································································································· 2
4 記号及び単位 ··················································································································· 3
5 測定原理 ························································································································· 4
6 材料······························································································································· 4
6.1 試験に用いるバクテリオファージ,細菌株及び試験の準備 ····················································· 4
6.2 試薬及び材料 ················································································································ 4
6.3 殺菌方法 ······················································································································ 5
7 装置及び機器 ··················································································································· 5
8 試験片···························································································································· 6
8.1 フィルム密着法 ············································································································· 6
8.2 ガラス密着法 ················································································································ 6
9 試験方法 ························································································································· 6
9.1 一般事項 ······················································································································ 6
9.2 宿主菌液の調製方法 ······································································································· 7
9.3 試験バクテリオファージ液の調製方法 ················································································ 7
9.4 フィルム密着法 ············································································································· 7
9.5 ガラス密着法 ················································································································ 9
9.6 可視光照射条件 ············································································································ 11
9.7 バクテリオファージ感染価の測定 ····················································································· 12
10 試験結果の計算 ············································································································· 12
10.1 一般事項 ···················································································································· 12
10.2 感染価の計算 ·············································································································· 12
10.3 試験成立条件 ·············································································································· 12
10.4 抗ウイルス活性値の計算 ······························································································· 12
10.5 光照射による抗ウイルス活性値の計算 ············································································· 13
10.6 暗所における抗ウイルス活性値の計算 ············································································· 13
11 試験結果の報告 ············································································································· 13
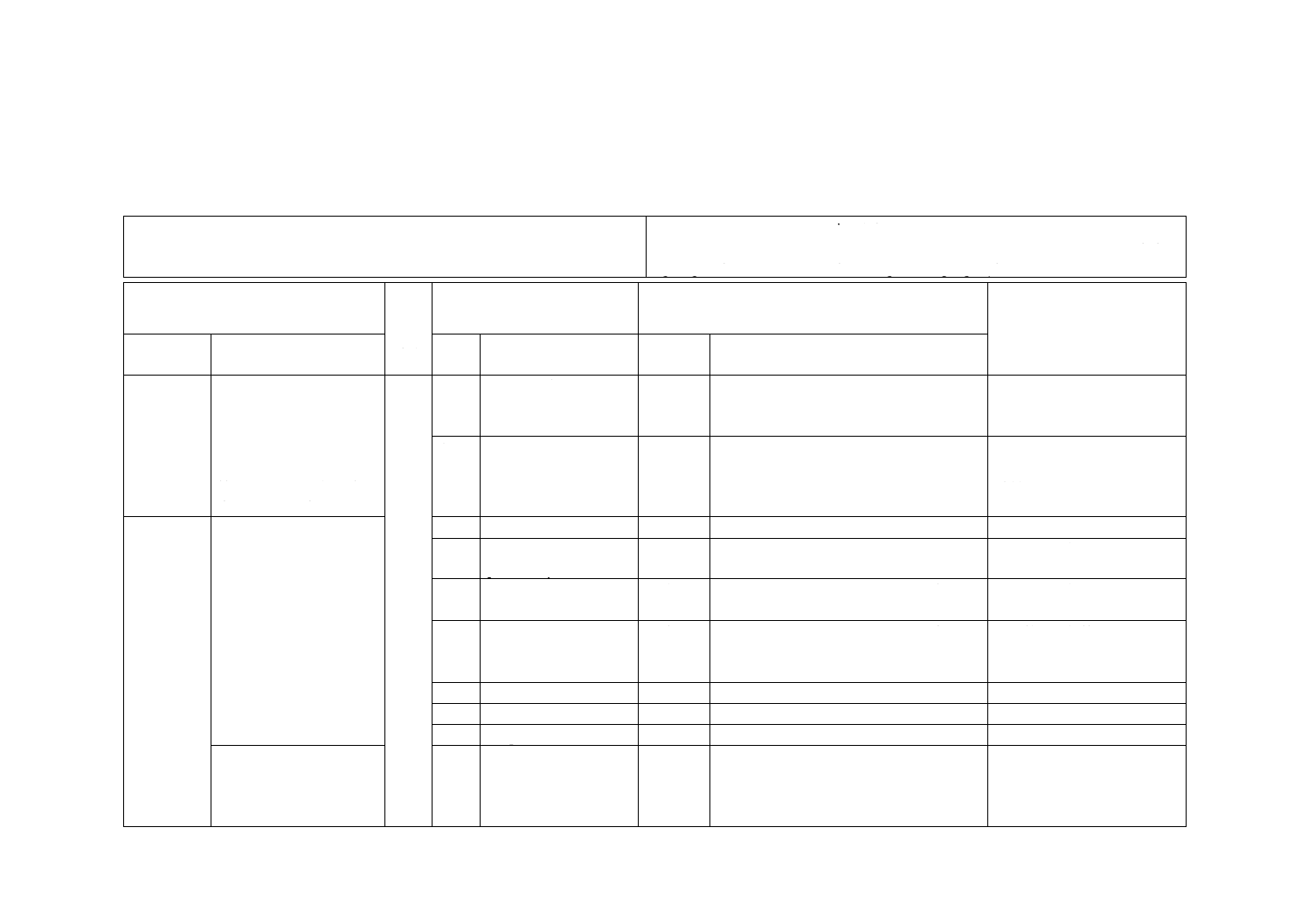
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 16
R 1756:2020
(2)
まえがき
この規格は,産業標準化法第16条において準用する同法第12条第1項の規定に基づき,一般社団法人
日本ファインセラミックス協会(JFCA)及び一般財団法人日本規格協会(JSA)から,産業標準原案を添
えて日本産業規格を改正すべきとの申出があり,日本産業標準調査会の審議を経て,経済産業大臣が改正
した日本産業規格である。これによって,JIS R 1756:2013は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
R 1756:2020
ファインセラミックス−
可視光応答形光触媒材料の抗ウイルス性試験方法−
バクテリオファージQβを用いる方法
Fine ceramics (advanced ceramics, advanced technical ceramics)-
Determination of antiviral activity of photocatalytic materials under indoor
lighting environment-Test method using bacteriophage Q-beta
序文
この規格は,2016年に第1版として発行されたISO 18071を基とし,技術的内容を変更して作成した日
本産業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,可視光照射後のバクテリオファージQβの不活化によって,可視光応答形光触媒を含有す
る加工材料及び表面に可視光応答形光触媒加工フィルムを含む材料(以下,可視光応答形光触媒抗ウイル
ス加工材料という。)の抗ウイルス性試験方法及び活性値の求め方について規定する。
この規格は,抗ウイルス用途をもつ可視光応答形光触媒材料に適用する。可視光応答形光触媒材料の他
の種類の機能,例えば,抗菌性,抗かび性,水浄化,セルフクリーニング,防曇及び空気浄化には適用で
きない。
この規格は,粉体,粒状及び多孔質な光触媒材料は含まないが,主に塗布作業などによって,平板状又
は繊維状に加工した可視光応答形光触媒に対しては適用できる。
紫外光領域での抗ウイルス性を試験する場合は,この規格ではなく,JIS R 1706を適用する。
警告 この規格に基づいて試験を行う者は,微生物学的技術を習得していることを前提とする。
注記1 この規格では,インフルエンザウイルスの代替モデルとして,バクテリオファージQβを用
いている。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 18071:2016,Fine ceramics (advanced ceramics, advanced technical ceramics)−Determination
of antiviral activity of semiconducting photocatalytic materials under indoor lighting
environment−Test method using bacteriophage Q-beta(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。

2
R 1756:2020
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS C 1609-1 照度計 第1部:一般計量器
JIS K 0950 プラスチック製滅菌シャーレ
JIS K 0970 ピストン式ピペット
JIS K 3800 バイオハザード対策用クラスIIキャビネット
JIS K 8101 エタノール(99.5)(試薬)
JIS L 0803 染色堅ろう度試験用添付白布
JIS P 3801 ろ紙(化学分析用)
JIS R 1600 ファインセラミックス関連用語
JIS R 1702 ファインセラミックス−光触媒抗菌加工材料の抗菌性試験方法及び抗菌効果
注記 対応国際規格:ISO 27447,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test
method for antibacterial activity of semiconducting photocatalytic materials
JIS R 1706 ファインセラミックス−光触媒材料の抗ウイルス性試験方法−バクテリオファージQβ
を用いる方法
JIS R 1709 ファインセラミックス−紫外線励起形光触媒試験用光源
JIS R 1750 ファインセラミックス−屋内照明環境で用いる光触媒試験用光源
注記 対応国際規格:ISO 14605,Fine ceramics (advanced ceramics, advanced technical ceramics)−Light
source for testing semiconducting photocatalytic materials used under indoor lighting environment
JIS R 1752 ファインセラミックス−可視光応答形光触媒抗菌加工材料の抗菌性試験方法及び抗菌効
果
注記 対応国際規格:ISO 17094,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test
method for antibacterial activity of semiconducting photocatalytic materials under indoor lighting
environment
JIS R 3505 ガラス製体積計
JIS R 3644 ガラス管類
JIS R 3645 ガラス棒
JIS Z 2801 抗菌加工製品−抗菌性試験方法・抗菌効果
3
用語及び定義
この規格で用いる主な用語及び定義は,次によるほか,JIS R 1600,JIS R 1702,JIS R 1706及びJIS R 1752
による。
3.1
可視光応答形光触媒抗ウイルス加工(indoor-light-active photocatalytic antiviral treatment)
可視光応答形光触媒の抗ウイルス機能を利用するために,可視光応答形光触媒で抗ウイルス加工するこ
と。可視光応答形単味光触媒抗ウイルス加工及び可視光応答形ハイブリッド光触媒抗ウイルス加工に分類
される。
3.2
可視光応答形単味光触媒抗ウイルス加工(indoor-light-active simplex photocatalytic antiviral treatment)
3
R 1756:2020
可視光応答形光触媒抗ウイルス加工のうち,塗布,含浸,練り込みなど種々の方法によって可視光応答
形光触媒を担持すること。また,可視光照射下での可視光応答形光触媒の抗ウイルス性を増強するために,
可視光応答形光触媒と抗ウイルス性のない他の機能性物質とを組み合わせた材料を担持することも含む。
3.3
可視光応答形ハイブリッド光触媒抗ウイルス加工(indoor-light-active hybrid photocatalytic antiviral treatment)
可視光応答形光触媒抗ウイルス加工のうち,可視光が当たらない環境においても抗ウイルス機能を発現
させるために,可視光応答形光触媒と抗ウイルス性のある他の機能性物質とを組み合わせた材料を塗布,
含浸,練り込みなど種々の方法によって担持すること。
3.4
可視光応答形光触媒抗ウイルス加工材料(indoor-light-active photocatalytic antiviral treated material)
可視光応答形光触媒抗ウイルス加工した膜状,平板状,繊維状などの材料。可視光応答形単味光触媒抗
ウイルス加工,可視光応答形ハイブリッド光触媒抗ウイルス加工及び可視光応答形抗ウイルス加工した製
品を含む。
3.5
フィルム密着法(film cover method)
可視光応答形光触媒抗ウイルス加工した平板状材料の可視光照射条件下又は暗所条件下での抗ウイルス
性を評価する試験方法。
3.6
ガラス密着法(glass cover method)
可視光応答形光触媒抗ウイルス加工した繊維状材料の可視光照射条件下又は暗所条件下での抗ウイルス
性を評価する試験方法。
3.7
可視光応答形光触媒抗ウイルス加工材料の抗ウイルス活性値(indoor-light-active photocatalyst antiviral
activity value)
可視光照射後の可視光応答形光触媒抗ウイルス加工した材料と無加工材料との感染価の対数値の差。
注記 この値には,可視光照射しない条件で得られるプラーク数の減少分も含まれる。
3.8
可視光応答形光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値(indoor-light-active photocatalyst
antiviral activity value with UV irradiation)
可視光照射後と暗所に置いた後との可視光応答形光触媒抗ウイルス加工した材料の感染価の対数値の差。
3.9
可視光応答形光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値(indoor-light-active photocatalyst
antiviral activity value without UV irradiation)
可視光応答形光触媒抗ウイルス加工した材料と無加工材料を暗所に置いた後との感染価の対数値の差。
4
記号及び単位
この規格で用いる主な記号及び単位は,次による。
A:
無加工試験片の接種直後の3個の試験片の感染価の平均値(pfu)
BD:
無加工試験片を暗所に保存した後の3個の試験片の感染価の平均値(pfu)
BF-L:
無加工試験片を照射条件F-Lで光照射した後の3個の試験片の感染価の平均値(pfu)
4
R 1756:2020
CD:
可視光応答形光触媒抗ウイルス加工した試験片を暗所に保存した後の3個の試験片の感染価の
平均値(pfu)
CF-L:
可視光応答形光触媒抗ウイルス加工した試験片を照射条件F-Lで光照射した後の3個の試験片
の感染価の平均値(pfu)
DF:
希釈倍率
F:
試験で用いたシャープカットフィルタの種類(A又はB)
L:
試験で用いた照度(lx)
Logmax: 3個の試験片の感染価の常用対数値の最大値
Logmean: 無加工試験片の3個の試験片の感染価の常用対数値の平均値
Logmin: 3個の試験片の感染価の常用対数値の最小値
N:
感染価(pfu)
VD:
可視光応答形光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値
VF-L:
照射条件F-Lで光照射した可視光応答形光触媒抗ウイルス加工材料による抗ウイルス活性値
ΔV:
可視光応答形光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値
W:
洗い出しに用いたSCDLP培地の液量(ml)
Z:
2枚のシャーレのプラーク数の平均値(pfu)
5
測定原理
この試験方法は,可視光応答形光触媒材料の開発,性能比較,品質管理,特徴付け,信頼性及び設計デ
ータの取得の使用に適している。この試験方法は,可視光照射下において,バクテリオファージと試験片
とが接触することによる可視光応答形光触媒材料の抗ウイルス性を得るために適用する。フィルム密着法
は,平板状の材料に適用できる。ガラス密着法は,繊維状の材料に適用できる。
試験片をシャーレに置き,バクテリオファージ液を試験片に滴下する。次に,密着フィルム又は密着ガ
ラスでバクテリオファージ液を覆い,保湿ガラスをシャーレの上にかぶせる。試験片を入れたシャーレに
可視光を照射する。照射後,試験片及び密着フィルム又は密着ガラスからバクテリオファージ液を洗い出
す。この洗い出されたバクテリオファージの感染価をバクテリオファージに感受性をもつ大腸菌を用いた
プラーク形成法によって測定する。得られた結果は,可視光応答形光触媒抗ウイルス加工した試験片と同
様の条件で可視光照射をした無加工試験片,暗所に置いた可視光応答形光触媒抗ウイルス加工した試験片
及び無加工試験片の測定結果と比較する。
6
材料
6.1
試験に用いるバクテリオファージ,細菌株及び試験の準備
6.1.1
試験に用いるバクテリオファージ及び細菌の種類
JIS R 1706の6.1.1(試験に用いるバクテリオファージ及び細菌の種類)に規定する種類の細菌とする。
6.1.2
細菌株の保存
JIS R 1706の6.1.2(細菌株の保存)に規定する方法による。
6.1.3
バクテリオファージストック液の準備
JIS R 1706の6.1.3(バクテリオファージストック液の準備)に規定する方法による。
6.2
試薬及び材料
試験に用いる試薬及び材料は,6.2.1〜6.2.4による。

5
R 1756:2020
なお,培地は,同一成分であれば,市販のものを用いてもよく,また作成する培地量は,試験片の数に
合わせて変更してもよい。
6.2.1
SCDLP培地 JIS Z 2801の5.4 e)(SCDLP培地)に規定する方法による。
6.2.2
エタノール(C2H5OH) JIS K 8101に規定する特級を用いる。
6.2.3
非イオン界面活性剤 JIS R 1702の6.2.16(非イオン界面活性剤)に規定するものを用いる。
6.2.4
綿標準布 JIS L 0803に規定する綿100 %の添付白布(綿3-1号)を用いて,洗剤及び漂白剤を使
用せず,60 ℃の水温で10分間水洗い後,すすぎ5分を2回繰り返し,この一連の処理を10回繰り返し,
風乾したものを用いる。
6.3
殺菌方法
殺菌方法は,高圧蒸気殺菌とし,JIS Z 2801の5.3 b)(高圧蒸気殺菌)による。
7
装置及び機器
装置及び機器は,次による。
7.1
試験装置 JIS R 1752の7.1(試験装置)に規定する試験装置。
7.2
密着フィルム JIS R 1702の7.2(密着フィルム)に規定するもの。
7.3
密着ガラス JIS R 1702の7.3(密着ガラス)に規定するもの。
7.4
保湿用ガラス JIS R 1702の7.4(保湿用ガラス)に規定するもの。
7.5
保存シャーレ 内径約90 mmのガラス製,又はJIS K 0950に規定する90A号若しくは90B号に適
合するもの。
7.6
調湿用ろ紙 JIS P 3801に規定する微生物の発育に影響を及ぼさないろ紙で,試験片を置く容器に入
るよう切断したもの。
7.7
ガラス管・ガラス棒 JIS R 3644に規定するガラス管又はJIS R 3645に規定するガラス棒を試験片
を置く容器に入るよう切断したもの。
7.8
光源 JIS R 1750の4.2(蛍光ランプ)に規定する光源のうち,広帯域発光形蛍光ランプの普及形白
色(W形)のもの。
7.9
UVシャープカットフィルタ JIS R 1750の4.4(シャープカットフィルタ)に規定するType A又は
Type BのUVシャープカットフィルタ。製品が使用される状況によって,使用するフィルタ(試験条件)
を選択する。
なお,シャープカットフィルタを用いずに試験する場合は,7.9.1又は7.9.2に規定する条件と組み合わ
せて試験しなければならない。
7.9.1
条件A(400 nm以下をカットする条件) JIS R 1750の4.4に規定するType Aシャープカットフィ
ルタを用いた条件。
7.9.2
条件B(380 nm以下をカットする条件) JIS R 1750の4.4に規定するType Bシャープカットフィ
ルタを用いた条件。
7.10 照度計 JIS C 1609-1に規定する一般形A級照度計以上のもの。
7.11 紫外線蛍光ランプ JIS R 1709に規定するブラックライトブルー形紫外線蛍光ランプ(BLBランプ)
又はブラックライト形紫外線蛍光ランプ(BLランプ)。
7.12 紫外放射照度計 JIS R 1709に規定するもので,0.001 mW/cm2まで計測できるもの。
7.13 暗箱 JIS R 1702の7.12(暗箱)に規定するもの。
7.14 安全キャビネット JIS K 3800に適合するもの又は同等の性能をもつもの。

6
R 1756:2020
7.15 ピペット JIS K 0970若しくはJIS R 3505のクラスAに適合するもの,又は同等の精度をもつもの。
8
試験片
8.1
フィルム密着法
フィルム密着法で用いる試験片は,次による。
a) 平板状の材料の平らな部分を50 mm±2 mm角(厚さ10 mm以内)の正方形に切り取り,これを標準
の大きさの試験片とする。
平板状の材料を50 mm±2 mm角(厚さ10 mm以内)にカットすることが難しい,又は不可能な場
合には,1/2のサイズ(厚さ10 mm以内)にした試験片を使用してもよい。試験片の大きさを小さく
した場合,密着フィルムの大きさも小さくする。表面積800 mm2〜1 600 mm2の密着フィルムをかぶせ
ることが可能な試験片の大きさであれば,ここに規定する形状及び大きさ以外の試験片を使用しても
よい。
b) これらの試験片を,無加工試験片は9個,可視光応答形光触媒抗ウイルス加工した試験片は6個準備
する。無加工試験片が準備できない場合は,ガラス板を使用する。微生物汚染と試験片との間の相互
汚染に十分注意する。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源で24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は試験前に無菌化処理を行うこ
とができる(例参照)。
例 エタノール,又は水で70 %に調整したエタノールを用いて拭き取る。
8.2
ガラス密着法
ガラス密着法で用いる試験片は,次による。
a) 繊維状の材料を50 mm±2 mm角の正方形に切り取り,これを標準の大きさの試験片とする。
b) これらの試験片を,無加工試験片は9個,可視光応答形光触媒抗ウイルス加工した試験片は6個準備
する。
c) 無加工試験片が準備できない場合は,6.2.4に規定する綿標準布を使用してもよい。
綿標準布を無加工試験片として用いる場合,可視光照度によっては,試験成立条件を満足しない場
合があるので注意する。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源で24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は試験前に高圧蒸気殺菌などの
無菌化処理を行うことができる。
9
試験方法
9.1
一般事項
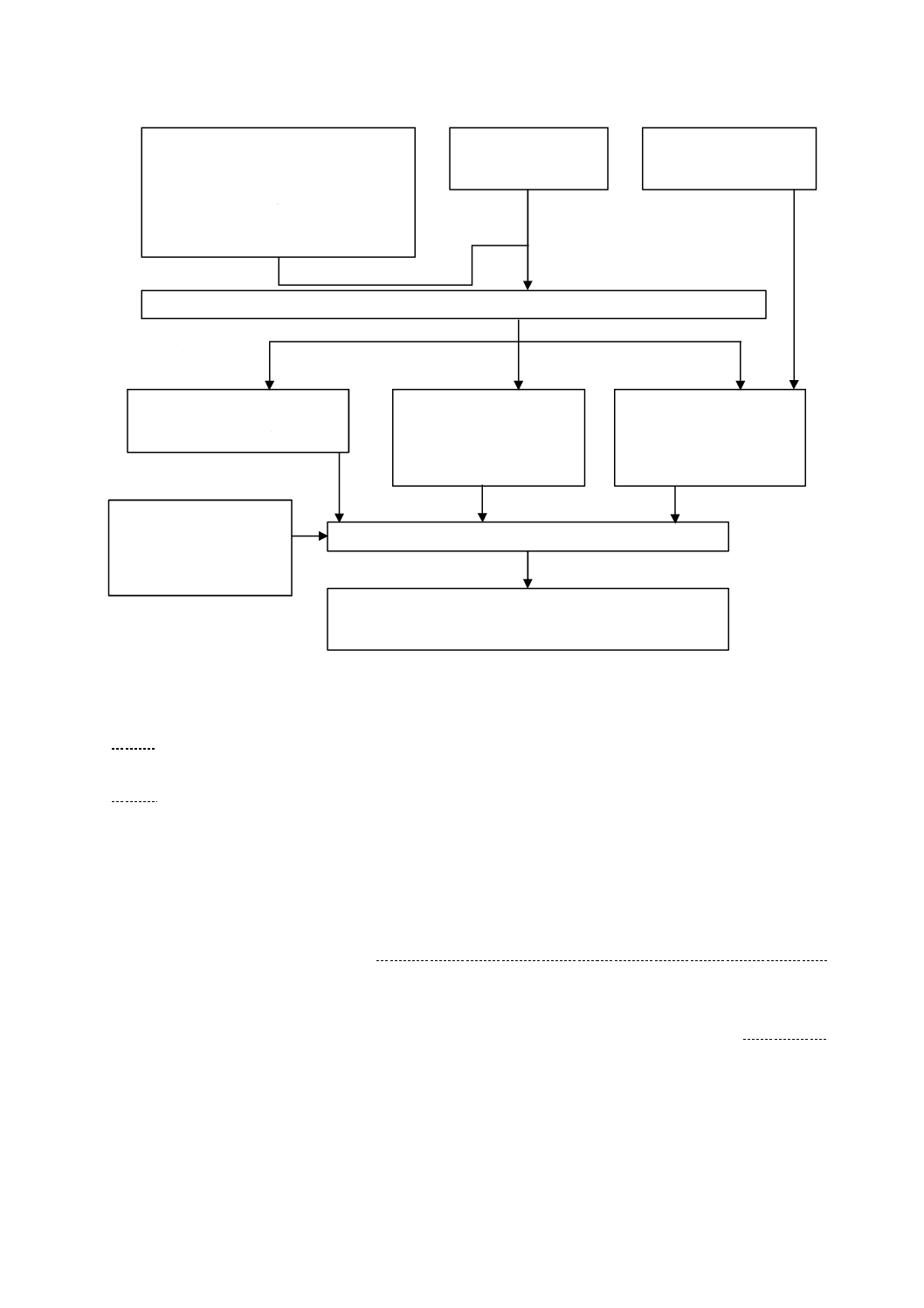
試験方法のフローチャートを,図1に示す。
試験片を取り扱う作業でSCDLP培地を加えるまでの作業を行うときに,安全キャビネット内に漏れる
光によって光触媒作用が働かないことを確実にするため,照度計及び紫外放射照度計を用いて,安全キャ
ビネットの作業台上の照度及び紫外放射照度を測定する。照度が200 lx以上で紫外放射照度が0.001
mW/cm2以上の場合は,照度が200 lx未満で紫外放射照度が0.001 mW/cm2未満になるよう,要因を取り除
いてから試験する。
7
R 1756:2020
バクテリオファージ
6.1.3
バクテリオファージストック液
の準備
↓
9.3
試験バクテリオファージ液の調製
方法
試験片
8
試験片
光照射条件
9.6
可視光照射条件
9.4 a),b),c)又は9.5 a),b),c)
試験片への試験液の接種
接種直後の試験片
9.4 e)又は9.5 e)
洗い出し
接種後の試験片
9.6 d)
暗所保存
↓
9.4 e)又は9.5 e)
洗い出し
接種後の試験片
9.6 c)
光照射
↓
9.4 e)又は9.5 e)
洗い出し
細菌
6.1.2
細菌株の保存
↓
9.2
宿主菌液の調製方法
3個の無加工試験片
3個の加工試験片
3個の無加工試験片
3個の加工試験片
3個の無加工試験片
9.7
バクテリオファージ感染価の測定
10
試験結果の計算
↓
11
試験結果の報告
図1−試験方法のフローチャート
9.2
宿主菌液の調製方法
JIS R 1706の9.2(宿主菌液の調製方法)に規定する方法による。
9.3
試験バクテリオファージ液の調製方法
JIS R 1706の9.3(試験バクテリオファージ液の調製方法)に規定する方法によって,調製したものを試
験液とする。
9.4
フィルム密着法
フィルム密着法による試験準備は,次による。
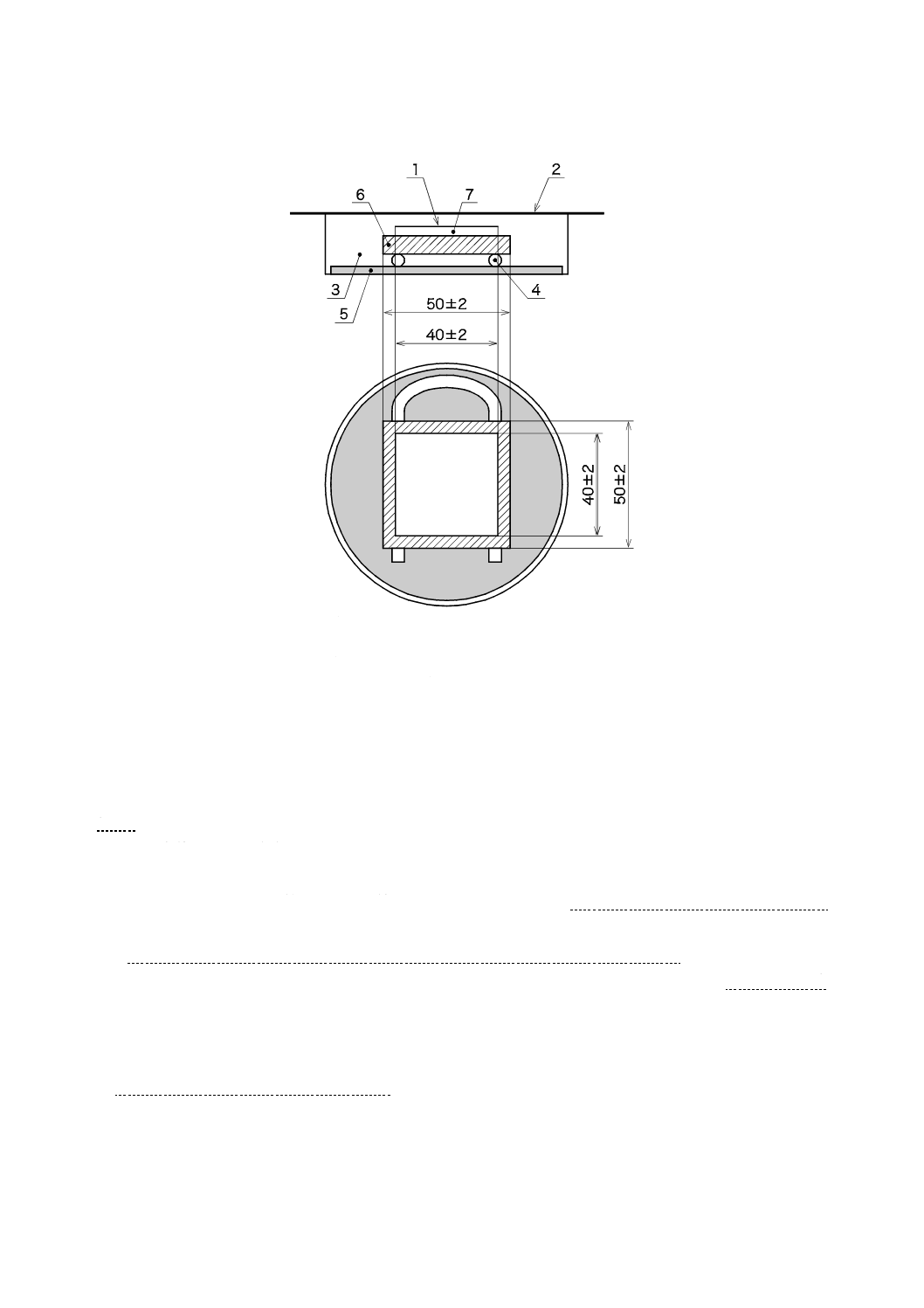
a) 滅菌済保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙と
が触れないようガラス管又はガラス棒を置き,その上に可視光応答形光触媒抗ウイルス加工した面を
上にして試験片を置く(図2参照)。試験面は可視光応答形光触媒抗ウイルス加工した材料の表面とす
る。内部まで可視光応答形光触媒抗ウイルス加工した試験片であっても,切断面は試験面としない。
また,高圧蒸気殺菌によってろ紙が湿った場合は,乾燥させてから使用する。
滅菌水を入れすぎると,保湿用ガラスが曇り,試験に影響するため,滅菌水の量は,4 ml〜6 mlが
適切である。
b) 9.3に規定する試験液をピペットで0.15 ml採取し,a)で準備した各試験片に滴下する。滴下した試験
液の上に密着フィルムをかぶせ,試験液が密着フィルムの端からこぼれないように注意しながら試験
液が密着フィルム全体に行き渡るように軽く押さえ付ける。標準の大きさ以外の試験片の場合,試験
液の接種量は,被覆する密着フィルムに合わせて調整する[8.1 a)参照]。
8
R 1756:2020
密着フィルムは,あらかじめ裁断したものをエタノールを吸収させた局方ガーゼ又は脱脂綿を用い
て両面を拭くか,エタノールで両面を拭いた密着フィルムを無菌的に裁断したものを使用することが
望ましい。
規定に基づく試験液量を接種したとき,フィルム全体に行き渡らなかったり,密着フィルムの端か
ら試験液が漏れ出したりする場合がある。このような場合は,接種試験液量を規定量の2倍から1/2
を限度に調整してもよい。ただし,試験片に接種する試験液量を変更した場合においても,1試験片
当たり1.0×106 pfu〜4.0×106 pfuとする。この場合,試験液のバクテリオファージ濃度は,9.3の規定
によらず,接種液量から換算して調整する。
c) 保存シャーレの上部に保湿用ガラスを置く。
保湿用ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いた後,十分に乾燥し
てから使用することが望ましい。
d) 試験液接種直後の感染価測定用の3個の無加工試験片を除いて,試験液を接種した後,速やかに,9.6
に規定する光照射試験を行う。
e) 試験液接種直後の3個の無加工試験片については,密着フィルム及び無加工試験片を滅菌ピンセット
を用い,試験液が漏れないように注意しながら,ストマッカー袋に入れる。10 mlのSCDLP培地を加
え,ストマッカー袋の外側から試験片及びフィルムを手で十分もみ,バクテリオファージを洗い出す。
この洗い出し液は速やかに9.7に規定する感染価の測定を行う。
この方法と同等の結果が得られる場合は,ストマッカー袋に代わるものを用いてもよい。
試験片の大きさによって,SCDLP培地10 mlで洗い出しが困難な場合は,液量を増やしてもよい。
9
R 1756:2020
単位 mm
1
密着フィルム
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験液
図2−フィルム密着法試験片及び保湿用ガラスの組立て
9.5
ガラス密着法
ガラス密着法による試験準備は,次による。
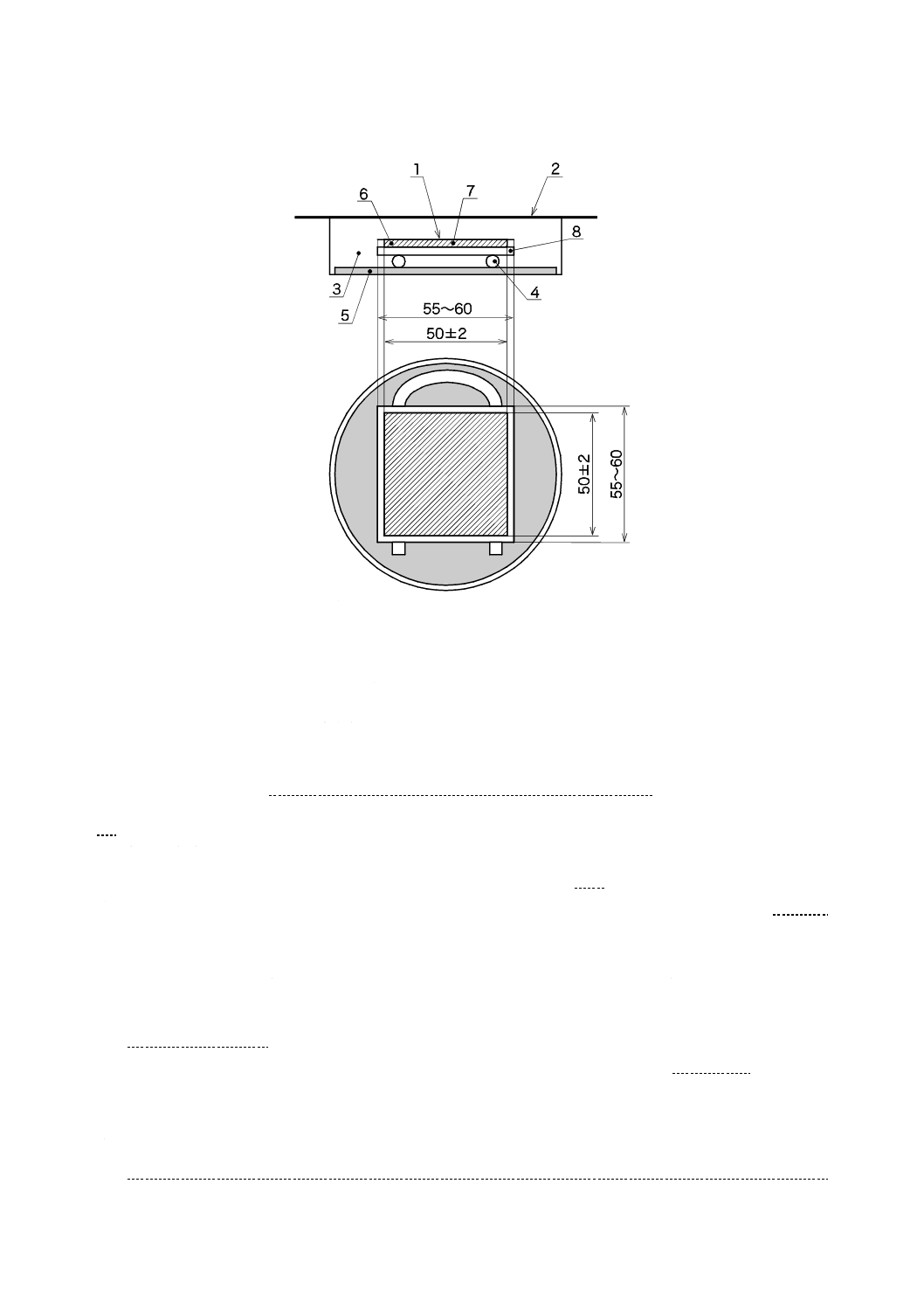
a) 滅菌済保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙と
が触れないようガラス管又はガラス棒を置き,その上に一辺が55 mm〜60 mmの正方形の殺菌したガ
ラス板を置く。その上に,可視光応答形光触媒抗ウイルス加工した面を上にして試験片を置く(図3
参照)。高圧蒸気殺菌によってろ紙が湿った場合は,乾燥させてから使用する。
滅菌水を入れすぎると保湿用ガラスが曇り,試験に影響するため,滅菌水の量は,4 ml〜6 mlが適
切である。
ガラス板は,全面をエタノールを吸収させた局方ガーゼ又は脱脂綿で軽く2回〜3回拭いた後,十
分に乾燥してから使用することが望ましい。
b) 9.3に規定する試験液をピペットで0.15 ml採取し,これをa) によって準備した各試験片に滴下する。
滴下した試験液の上に密着ガラスをかぶせ,試験液が密着ガラスの端からこぼれないように注意しな
がら試験液が密着ガラス全体に行き渡るように軽く押さえ付ける(図3参照)。
密着ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いて,十分に乾燥してか
10
R 1756:2020
ら使用することが望ましい。
規定に基づく試験液量を接種したとき,試験片全体に行き渡らなかったり,試験片の端から試験液
が漏れ出したりする場合がある。このような場合は,接種試験液量を規定量の2倍から1/2を限度に
調整してもよい。ただし,試験片に接種する試験液は接種液量を変更した場合においても,1試験片
当たり1.0×106 pfu〜4.0×106 pfuとする。この場合,試験液のバクテリオファージ濃度は,9.3の規定
によらず,接種液量から換算して調整する。
試験片に試験液を十分に浸透させるために,非イオン界面活性剤0.05 %を含む試験液を用いてもよ
い。試験液に非イオン界面活性剤を使用した場合は,その記録を試験報告書に記載する。
c) 保存シャーレの上部に保湿用ガラスを置く。
保湿用ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いて十分に乾燥してか
ら使用することが望ましい。
d) 試験液接種直後の感染価測定用の3個の無加工試験片を除いて,試験液を接種した後,速やかに,9.6
に規定する光照射試験を行う。
e) 試験液接種直後の3個の無加工試験片については,密着ガラス,無加工試験片及びガラス板を滅菌ピ
ンセットで試験液が漏れないように注意しながら,ストマッカー袋に入れる。20 mlのSCDLP培地を
加え,ストマッカー袋の外側から密着ガラス,試験片及びガラス板を手で十分もみ,試験液を洗い出
す。この洗い出し液は,速やかに9.7に規定する感染価の測定を行う。この方法と同等の結果が得ら
れる場合は,ストマッカー袋に代わるものを用いてもよい。
11
R 1756:2020
単位 mm
1
密着ガラス
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験液
8
ガラス板
図3−ガラス密着法試験片及び保存用シャーレの組立て
9.6
可視光照射条件
可視光照射条件は,次による。
a) 試験装置内における可視光照射時は,試験片周囲の温度を25 ℃±3 ℃に保つ。
b) 評価する可視光応答形光触媒の使用する場所に応じて,シャープカットフィルタを選択し,JIS R 1752
の9.4(可視光照射条件)に規定する方法によって,照度の測定及び試験片設置の位置決めを行う。
c) 試験液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び可視光応答形光触媒抗ウイル
ス加工した試験片3個)を,b)で準備した試験片設置位置へ置き,4時間光照射する。
可視光応答形光触媒材料の用いられる場所の実情を考慮して,光照射時間を2時間〜8時間の範囲
で変更してもよい。
d) 試験液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び光触媒抗ウイルス加工した試
験片3個)を,c)に規定する試験と同じ時間,7.13の暗箱の中に保存する。
保存シャーレを覆う保湿用ガラスの代わりに,保存シャーレの蓋を用いてもよい。
e) c)及びd)に規定する試験片は,9.4 e)又は9.5 e)に規定する操作によって,試験液を洗い出す。この洗
い出し液は,速やかに9.7に規定する感染価の測定を行う。この方法と同等の結果が得られる場合は,
12
R 1756:2020
ストマッカー袋に代わるものを用いてもよい。
9.7
バクテリオファージ感染価の測定
バクテリオファージ感染価の測定は,JIS R 1706の9.7(バクテリオファージ感染価の測定)による。
10 試験結果の計算
10.1 一般事項
試験結果は,次のように計算する。
a) 3個の試験片の感染価の平均値は,10.2に規定する方法で求めた数値を用いて計算し,抗ウイルス活
性値の計算時には四捨五入しない数値を用いる。
b) 得られた抗ウイルス活性値は,小数点2桁目を四捨五入する。
c) 報告書に記載する平均値は,有効数字3桁目を四捨五入して,有効数字2桁とした数値とする。
10.2 感染価の計算
感染価は,式(1)によって求める。洗い出し液1.0 ml中のプラーク数が30 pfu未満の場合は,測定したプ
ラーク数の平均値を用いて,感染価を算出する。また,洗い出し液1.0 mlを用いたシャーレからプラーク
が認められない場合は,プラーク数の平均値に“1”を用いて感染価を算出する。
N=Z×DF×W ··········································································· (1)
ここに,
N: 感染価(pfu)
Z: 2枚のシャーレのプラーク数の平均値(pfu)
DF: 希釈倍率
W: 洗い出しに用いたSCDLP培地の液量(ml)
10.3 試験成立条件
次の4項目の試験成立条件を全て満たすとき,その試験は有効と判定する。1項目でも条件を満足しな
い場合は,試験不成立と判定し,再度試験を実施する。
a) 無加工試験片の接種直後の感染価の対数値について,次の式(2)が成立する。
(Logmax−Logmin)/Logmean≦0.2 ························································· (2)
ここに, Logmax: 3個の試験片の感染価の常用対数値の最大値
Logmin: 3個の試験片の感染価の常用対数値の最小値
Logmean: 3個の試験片の感染価の常用対数値の平均値
b) 無加工試験片の接種直後の感染価の平均値は,1.0×106 pfu〜4.0×106 pfuである。
c) 無加工試験片の光照射後の感染価は,3個の値が全て1.0×104 pfu以上である。ただし,無加工試験片
にガラス板を用いた場合は,光照射後の感染価の値が全て1.0×105 pfu以上とする。
d) 無加工試験片の暗所に保存した後の感染価は,3個の値が全て1.0×104 pfu以上である。ただし,無加
工試験片にガラス板を用いた場合は,暗所に保存した後の感染価の値が全て1.0×105 pfu以上とする。
10.4 抗ウイルス活性値の計算
試験成立時の可視光応答形光触媒抗ウイルス加工材料の抗ウイルス活性値の計算は,式(3)による。
VF-L=log(BF-L/A)−log(CF-L/A)=log(BF-L/CF-L) ····································· (3)
ここに, VF-L: 照射条件F-Lで光照射した可視光応答形光触媒抗ウイルス加
工材料による抗ウイルス活性値
F: 試験で用いたシャープカットフィルタの種類(A又はB)
L: 試験で用いた照度(lx)
A: 無加工試験片の接種直後の3個の試験片の感染価の平均値
(pfu)
BF-L: 無加工試験片を照射条件F-Lで光照射した後の3個の試験片の
13
R 1756:2020
感染価の平均値(pfu)
CF-L: 可視光応答形光触媒抗ウイルス加工した試験片を照射条件
F-Lで光照射した後の3個の試験片の感染価の平均値(pfu)
10.5 光照射による抗ウイルス活性値の計算
可視光応答形光触媒抗ウイルス加工材料の光照射による抗ウイルス活性値の計算は,式(4)による。
ΔV=log(BF-L/CF-L)−[log(BD/A)−log(CD/A)]=log(BF-L/CF-L)−log(BD/CD) ···· (4)
ここに,
ΔV: 可視光応答形光触媒抗ウイルス加工材料の光照射による抗ウ
イルス活性値
BD: 無加工試験片を暗所に保存した後の3個の試験片の感染価の
平均値(pfu)
CD: 可視光応答形光触媒抗ウイルス加工した試験片を暗所に保存
した後の3個の試験片の感染価の平均値(pfu)
10.6 暗所における抗ウイルス活性値の計算
可視光応答形光触媒抗ウイルス加工材料の暗所における抗ウイルス活性値の計算は,式(5)による。
VD=log(BD/CD) ·········································································· (5)
ここに,
VD: 可視光応答形光触媒抗ウイルス加工材料の暗所における抗ウ
イルス活性値
11 試験結果の報告
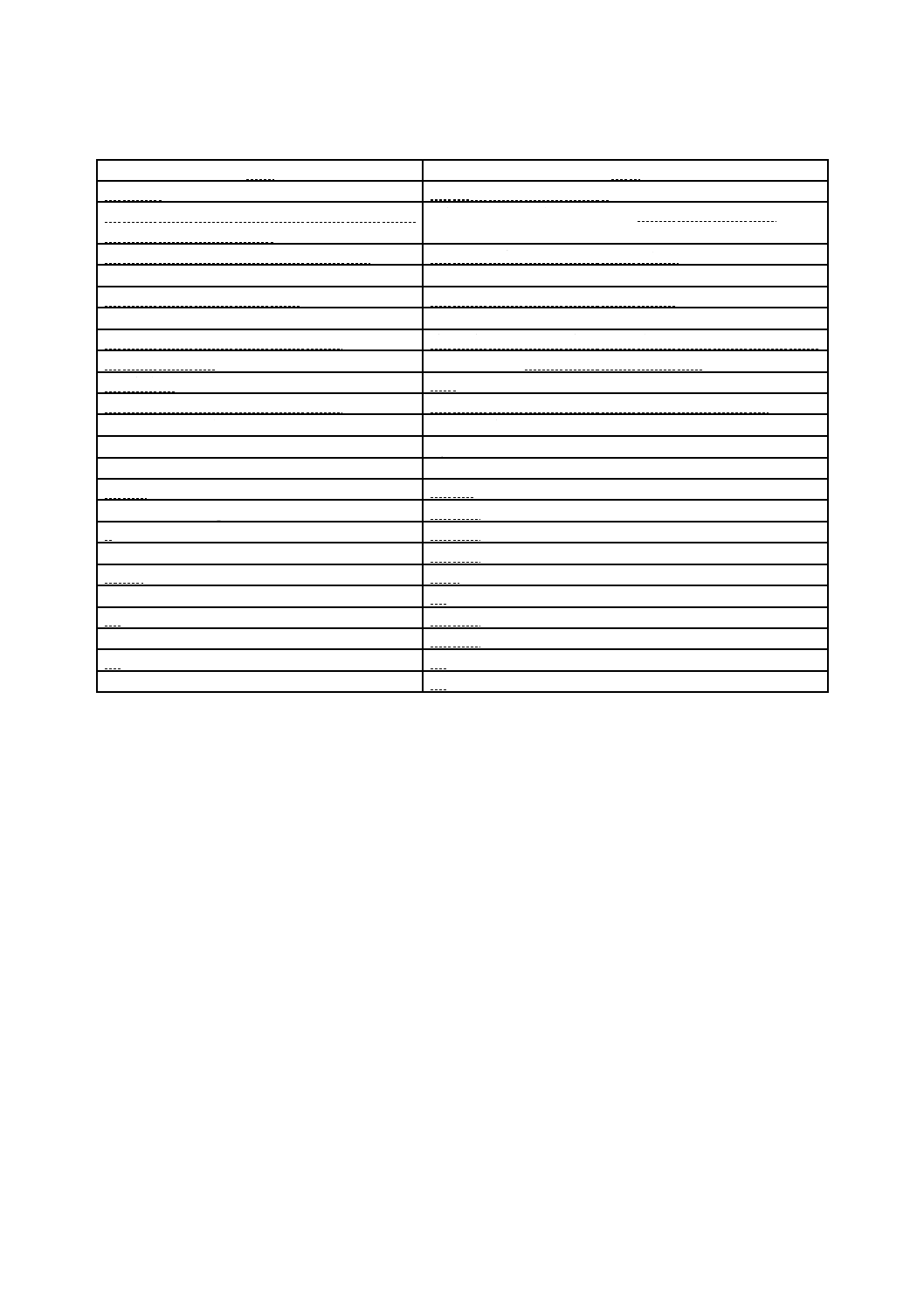
試験結果の報告には,次の事項を記載する(表1参照)。
a) 規格番号
b) 可視光応答形光触媒抗ウイルス加工した試験片及び無加工試験片の種類・大きさ・形状・厚さ
c) 光源の種類,製造業者名及び品番
d) シャープカットフィルタの種類(製造業者,品番など)
e) 照度計及び紫外放射照度計の製造業者名及び品番
f)
有機物を除去した場合の情報(光源の種類,製造業者名,品番,照射時間など)
g) 光照射条件(照度及び光照射時間)
h) 密着フィルム又は密着ガラス及び保湿用ガラスの種類及び大きさ
i)
試験に用いたバクテリオファージ及び細菌の保存番号
j)
試験液の接種量及び感染価
k) 試験値(A,BF-L,CF-L,VF-L,BD,CD,ΔV及び可視光応答形ハイブリッド光触媒抗ウイルス加工した
試験片の場合は,これらに加えてVD)
l)
その他の必要事項
14
R 1756:2020
表1−試験結果の報告例(フィルム密着法の場合)
項目
内容
規格番号
JIS R 1756,フィルム密着法
可視光応答形光触媒抗ウイルス加工した試験片の
種類・大きさ・形状・厚さ
可視光応答形光触媒フィルム,50 mm×50 mm×0.2 mm
無加工試験片の種類・大きさ・形状・厚さ
PETフィルム,50 mm×50 mm×0.2 mm
光源の種類,製造業者名及び品番
白色蛍光灯(○○電機,FL20S・W)
シャープカットフィルタの種類
タイプA(波長400 nm以下をカット)
照度計の製造業者名及び品番
照度計(△△製作所,本体:FL-X,受光部:FL-Y)
紫外放射照度計の製造業者名及び品番
紫外放射測定器(△△製作所,本体:UV-X,受光部:UV-Y)
有機物の除去方法
FL20̲BLB,1.0 mW/cm2で24時間予備照射
光照射条件
500 lx,4時間
密着フィルム,又は密着ガラスの種類
ポリプロピレンフィルム(□□商会),40 mm×40 mm
保湿用ガラスの種類
ほうけい酸ガラス
試験に用いたバクテリオファージの保存番号
Qβ(NBRC20012)
試験に用いた細菌の保存番号
大腸菌(NBRC106373)
接種量
0.15 ml
試験液の感染価(pfu/ml)
1.8×107
A
1.7×106
BA-1000
1.2×106
CA-1000
<10
VA-1000
5.0
BD
1.7×106
CD
5.5×103
ΔV
2.5
VD
2.4
15
R 1756:2020
参考文献
[1] JIS L 1916 繊維製品の白色度測定方法
注記 対応国際規格:ISO 105-F,Textiles−Tests for colour fastness−Part F: Standard adjacent fabrics
[2] JIS Z 8703 試験場所の標準状態
注記 対応国際規格:ISO 554,Standard atmospheres for conditioning and/or testing−Specifications
[3] JIS K 7350-3 プラスチック−実験室光源による暴露試験方法−第3部:紫外線蛍光ランプ
注記 対応国際規格:ISO 4892-3,Plastics−Methods of exposure to laboratory light sources−Part 3:
Fluorescent UV lamps
[4] JIS K 8951 硫酸(試薬)
注記 対応国際規格:ISO 6353-2,Reagents for chemical analysis−Part 2: Specifications−First series
[5] JIS K 8342 酸化りん(V)(試薬)
注記 対応国際規格:ISO 6353-3,Reagents for chemical analysis−Part 3: Specifications−Second
series
[6] JIS Z 9110 照明基準総則
[7] JIS Z 9125 屋内作業場の照明基準
[8] 住宅照明設計技術指針(JIEG-009),社団法人照明学会
[9] オフィス照明設計技術指針(JIEG-008),社団法人照明学会
[10] ISO 10705-1,Water quality−Detection and enumeration of bacteriophages−Part 1:Enumeration of
F-specific RNA bacteriophages
[11] Ishiguro H, Yao Y, Nakano R, Hara M, Sunada K, Hashimoto K, Kajioka J, Fujishima A, Kubota Y.
Photocatalytic activity of Cu2+/TiO2-coated cordierite foam inactivates bacteriophages and Legionella
pneumophila. Applied Catalysis B: Environmental. 129: 56-61, 2013.
[12] Ishiguro H, Nakano R, Yao Y, Kajioka J, Fujishima A, Kubota Y. Inactivation of Qβ bacteriophage by
photocatalysis using TiO2 thin film under weak with long wavelength UV irradiation. Photochemical and
Photobiological Science. 10: 1825-1829, 2011.
[13] Watanabe I, Miyake T, Sakurai T, Shiba T, Ohno T. Isolation and grouping of RNA phages. Proceedings of
the Japan Academy. 43: 204-209, 1967.
[14] 西原徹,渡辺格.大腸菌ファージQβの生成とその性質.ウイルス,16:1-6,1966.
[15] 病原体等安全管理規程
[16] 公益社団法人日本薬学会編 衛生試験法・注解(2015)
[17] 厚生労働省監修 食品衛生検査指針微生物編(2015)
16
R 1756:2020
附属書JA
(参考)
JISと対応国際規格との対比表
JIS R 1756:2020 ファインセラミックス−可視光応答形光触媒材料の抗ウイル
ス性試験方法−バクテリオファージQβを用いる方法
ISO 18071:2016,Fine ceramics (advanced ceramics, advanced technical ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials under indoor
lighting environment−Test method using bacteriophage Q-beta
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲 可視光応答形光触媒を含
有する加工材料及び表面
に可視光応答形光触媒加
工フィルムを含む材料の
抗ウイルス性試験方法・
抗ウイルス活性値の求め
方について規定
1
JISとほぼ同じ
追加
平板状及びISO規格には規定されていな
い繊維状の材料について試験方法を用い
ることを追加した。
ISO規格の改正時に追加する
ことを提案する。
1
JISとほぼ同じ
追加
紫外光応答形光触媒の抗ウイルス性能を
試験する場合には,JIS R 1706を用いる
ことを追加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
3 用語及び
定義
3.1
Photocatalystを定義。
削除
JIS R 1702を引用しているため削除した。 実質的な技術的差異はない。
3.2
indoor-light-active
photocatalystを定義。
削除
JIS R 1752を引用しているため削除した。 実質的な技術的差異はない。
3.3
indoor
lighting
environmentを定義。
削除
JIS R 1752を引用しているため削除した。 実質的な技術的差異はない。
3.4
indoor-light-active
photocatalytic materials
を定義。
削除
JIS R 1752を引用しているため削除した。 実質的な技術的差異はない。
3.5
antiviralを定義
削除
JIS R 1706を引用しているため削除した。 実質的な技術的差異はない。
3.6
Bacteriophageを定義。 削除
JIS R 1706を引用しているため削除した。 実質的な技術的差異はない。
3.7
Plaqueを定義。
削除
JIS R 1706を引用しているため削除した。 実質的な技術的差異はない。
3.1 可視光応答形光触媒
抗ウイルス加工
−
−
追加
可視光応答形光触媒の抗ウイルス機能を
利用するために,可視光応答形光触媒で
抗ウイルス加工することとその分類を追
加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
2
R
1
7
5
6
:
2
0
2
0
17
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
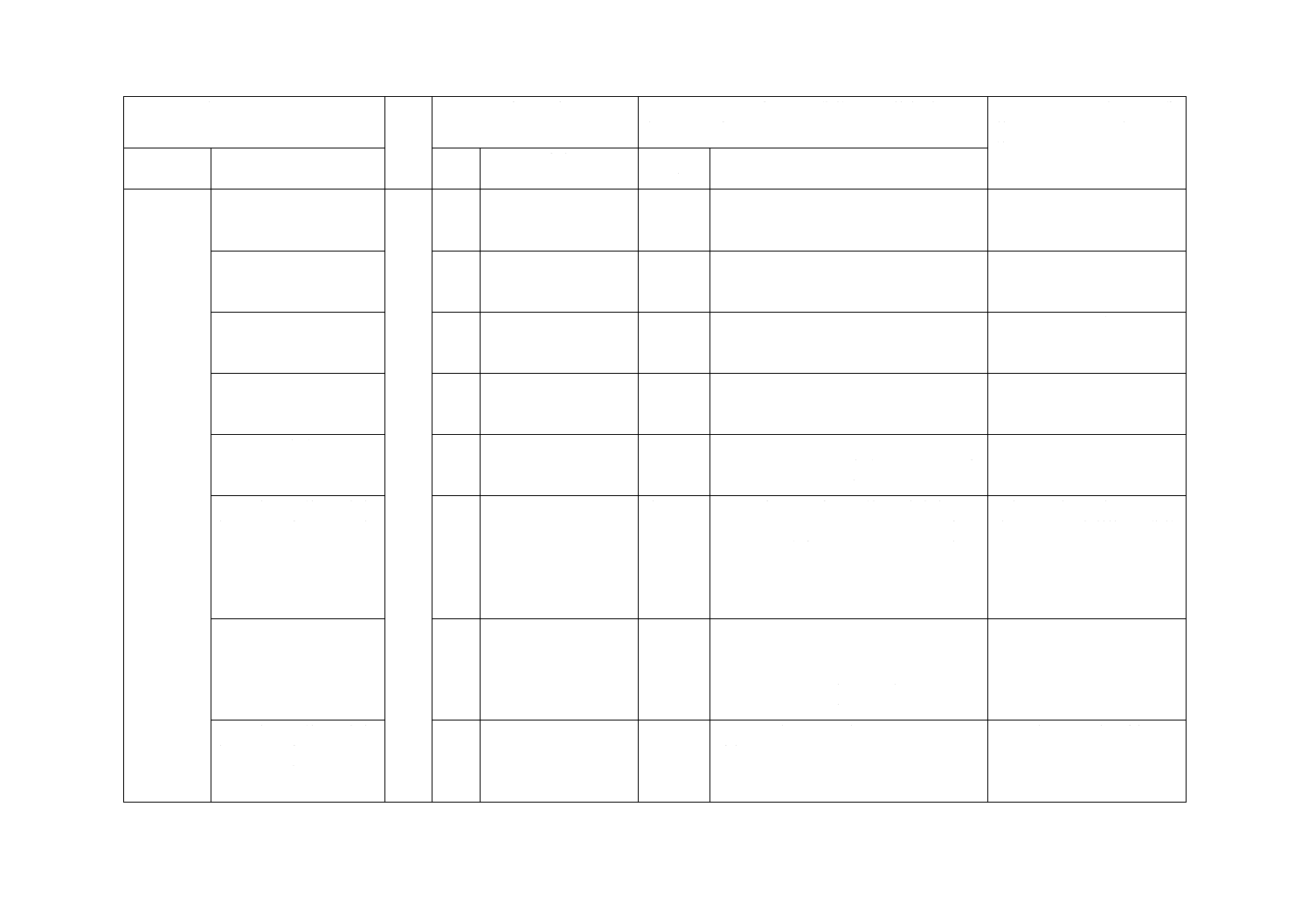
3 用語及び
定義(続き)
3.2 可視光応答形単味光
触媒抗ウイルス加工
−
−
追加
可視光応答形光触媒抗ウイルス加工の方
法と内容を追加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
3.3 可視光応答形ハイブ
リッド光触媒抗ウイルス
加工
−
−
追加
暗所においても抗ウイルス効果をもつ可
視光応答形光触媒抗ウイルス加工の方法
と内容を追加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
3.4 可視光応答形光触媒
抗ウイルス加工材料
−
−
追加
可視光応答形光触媒抗ウイルス加工した
膜状,平板状,繊維状などの材料を追加
した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
3.5 フィルム密着法
−
−
追加
ISO規格の試験方法をフィルム密着法と
して,名称を追加した。
ISO規格の改正時にフィルム
密着法を追加することを提
案する。
3.6 ガラス密着法
−
−
追加
ガラス密着法を規定するため,従来のISO
規格試験をフィルム密着法とし,試験方
法を区別するために追加した。
ISO規格の改正時にガラス密
着法を追加することを提案
する。
3.7 可視光応答形光触媒
抗ウイルス加工材料の抗
ウイルス活性値
3.8
JISとほぼ同じ
変更
ISO規格では可視光応答形光触媒抗ウイ
ルス活性値としているが,JISでは可視光
応答形光触媒抗ウイルス加工材料の抗ウ
イルス活性値とし,可視光応答形光触媒
抗ウイルス加工した材料と無加工材料と
の対数値の差と記載を変更した。
規格使用者の理解のための
変更であり,実質的な技術的
差異はない。
3.8 可視光応答形光触媒
抗ウイルス加工材料の光
照射による抗ウイルス活
性値
3.9
JISとほぼ同じ
変更
ISO規格では可視光照射による可視光応
答形光触媒抗ウイルス活性値としている
が,JISでは可視光応答形光触媒抗ウイル
ス加工材料の光照射による抗ウイルス活
性値とし,記載を変更した。
規格使用者の理解のための
変更であり,実質的な技術的
差異はない。
3.9 可視光応答形光触媒
抗ウイルス加工材料の暗
所における抗ウイルス活
性値
−
−
追加
暗所に保存した後の抗ウイルス活性値を
追加した。
ISO規格の改正時に追加する
ことを提案する。
2
R
1
7
5
6
:
2
0
2
0
18
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
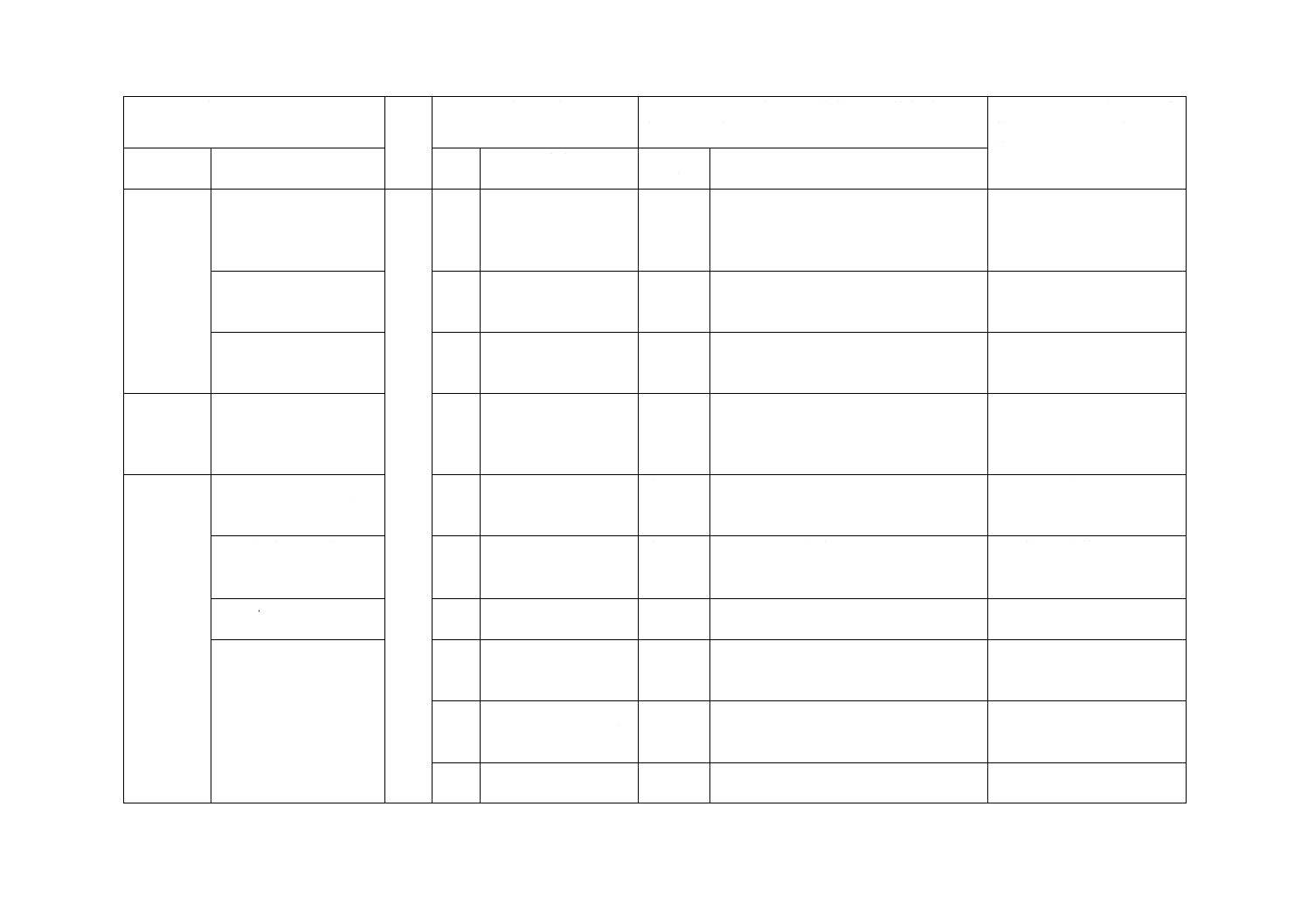
4 記号及び
単位
4
JISとほぼ同じ
変更
ISO規格では可視光応答形光触媒加工試
験片としているが,JISでは可視光応答形
光触媒抗ウイルス加工した試験片と記載
を変更した。
規格使用者の理解のための
変更であり,実質的な技術的
差異はない。
4
JISとほぼ同じ
変更
ISO規格には記載がないが,JISでは各値
で3個の試験片の感染価を用いること記
載を変更した。
規格使用者の理解のための
変更であり,実質的な技術的
差異はない。
W:洗い出しに用いた
SCDLP培地の液量(ml)
−
−
追加
ISO規格には記載がないが,JISではガラ
ス密着法を規定することで,洗い出し液
量が変わるため,追加した。
ISO規格の改正時に,ガラス
密着法を追加することを提
案する。
5 測定原理
5
JISとほぼ同じ
追加
従来のISO規格をJISではフィルム密着
法とし,繊維状材料についてはガラス密
着法として,繊維状材料に適用できるこ
とを追加した。
ISO規格の改正時に追加する
ことを提案する。
6 材料
6.1.1 試験に用いるバク
テリオファージ及び細菌
の種類
6.1.1
JISとほぼ同じ
変更
JIS R 1706を引用するように変更した。
実質的な技術的差異はない。
6.1.2 細菌株の保存
6.1.2
JISとほぼ同じ
変更
ISO規格では細菌の準備となっているが,
JISでは細菌株の保存とし,JIS R 1706を
引用するように変更した。
実質的な技術的差異はない。
6.1.3 バクテリオファー
ジストック液の準備
6.1.3
JISとほぼ同じ
変更
JIS R 1706を引用するように変更した。
実質的な技術的差異はない。
6.2 試薬及び材料
6.2.1
JISとほぼ同じ
変更
ISO規格では6.2.1としているが,JISで
は6.2に含めることとし,箇条番号を変更
した。
実質的な技術的差異はない。
6.2.2
1/500 Nutrient broth
(1/500 NB)について規
定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.3
Calcium solutionについ
て規定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
2
R
1
7
5
6
:
2
0
2
0
19
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
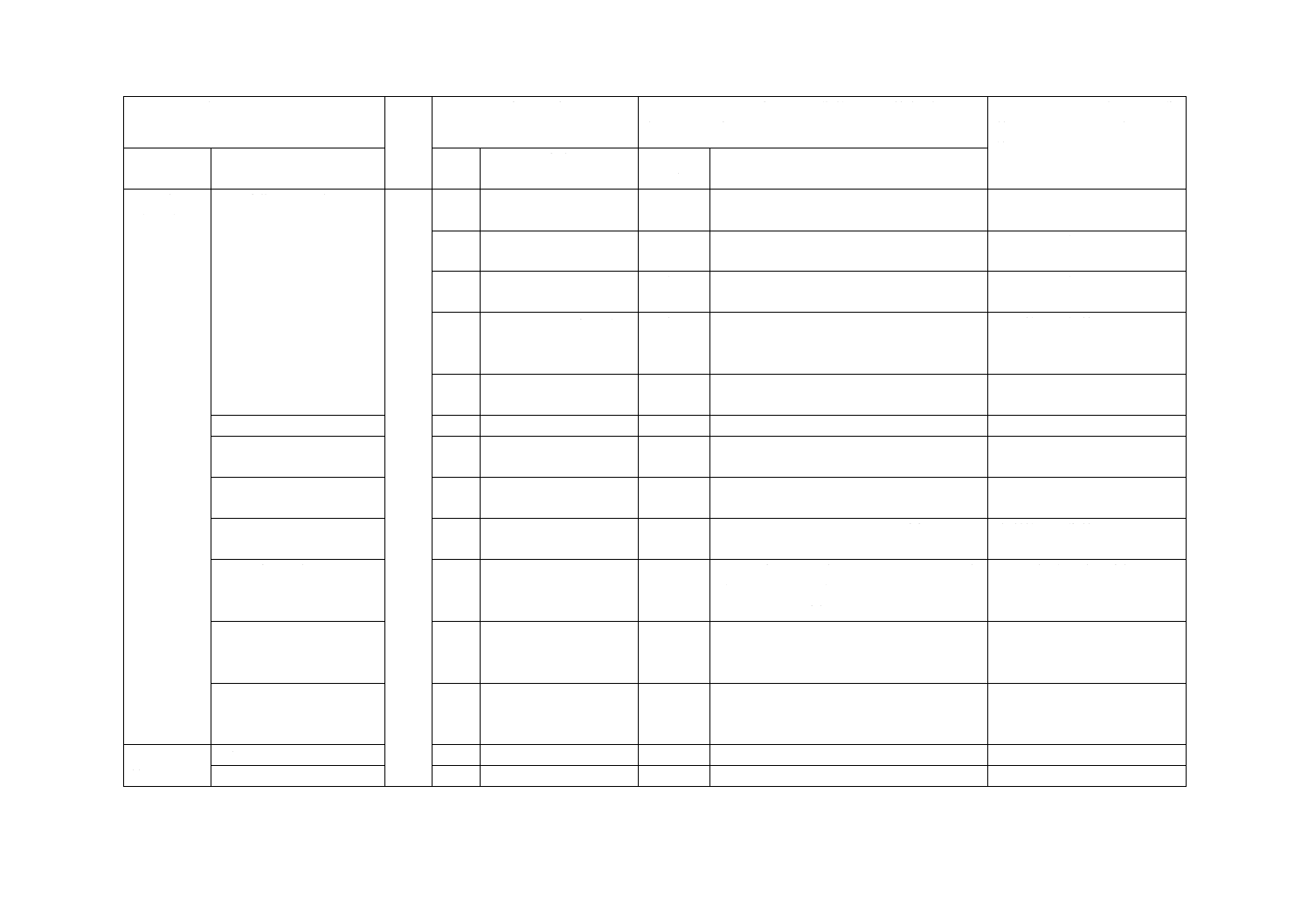
6 材料
(続き)
6.2 試薬及び材料
6.2.4
LB broth with calcium
について規定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.5
Agar powderについて
規定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.6
LB agarについて規定。 削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.7
Bottom agar plate (LB
agar plate with calcium)
について規定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.8
Top agarについて規
定。
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.1 SCDLP培地
6.2.9
JISとほぼ同じ
変更
JIS Z 2801を引用するように変更した。
実質的な技術的差異はない。
6.2.1
0
Peptone saline solution
削除
JIS R 1706を引用することによって,こ
のJIS中には記載がないため削除した。
実質的な技術的差異はない。
6.2.2 エタノール
(C2H5OH)
−
−
追加
JIS K 8101を引用するように追加した。
実質的な技術的差異はない。
6.2.3 非イオン界面活性
剤
−
−
追加
JIS R 1702を引用するように追加した。
実質的な技術的差異はない。
6.2.4 綿標準布
−
−
追加
ISO規格には規定されていないガラス密
着法で使用する綿標準布をJIS L 0803を
引用するよう追加した。
ISO規格改正時に追加するこ
とを提案する。
6.3 殺菌方法
−
−
追加
JISでは殺菌方法の箇条を追加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
6.3 高圧蒸気殺菌
−
−
追加
高圧蒸気殺菌方法について,JIS Z 2801
を引用するように追加した。
規格使用者の理解のための
追加であり,実質的な技術的
差異はない。
7 装置及び
機器
7.1 試験装置
7.1
JISとほぼ同じ
変更
JIS R 1752を引用するように変更した。
実質的な技術的差異はない。
7.2 密着フィルム
7.2
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
2
R
1
7
5
6
:
2
0
2
0
20
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7 装置及び
機器(続き)
7.3 密着ガラス
−
−
追加
ISO規格には規定されていないガラス密
着法で使用するガラスをJIS R 1702を引
用するよう追加した。
ISO規格改正時に追加するこ
とを提案する。
7.4 保湿用ガラス
7.3
JISとほぼ同じ
変更
JIS R 1702を引用するように変更した。
実質的な技術的差異はない。
7.5 保存シャーレ
−
−
追加
JIS K 0950を引用するよう追加した。
実質的な技術的差異はない。
7.6 調湿用ろ紙
7.5
JISとほぼ同じ
変更
JIS P 3801を引用するように変更した。
実質的な技術的差異はない。
7.7 ガラス管・ガラス棒
7.4
JISとほぼ同じ
変更
JIS R 3644及びJIS R 3645を引用するよ
うに変更した。
実質的な技術的差異はない。
7.8 光源
7.6
JISとほぼ同じ
変更
JIS R 1750を引用するように変更した。
実質的な技術的差異はない。
7.9 UVシャープカットフ
ィルタ
7.7
JISとほぼ同じ
変更
JIS R 1750を引用するように変更した。
実質的な技術的差異はない。
7.9 UVシャープカットフ
ィルタ
7.7
JISとほぼ同じ
追加
使用するフィルタの選択方法について追
加した。
実質的な技術的差異はない。
7.9.1 条件A(400 nm以
下をカットする条件)
7.7.1
JISとほぼ同じ
変更
JIS R 1750を引用するように変更した。
実質的な技術的差異はない。
7.9.2 条件B(380 nm以
下をカットする条件)
7.7.2
JISとほぼ同じ
変更
JIS R 1750を引用するように変更した。
実質的な技術的差異はない。
7.10 照度計
7.8
追加
JIS C 1609-1を引用するように追加した。 実質的な技術的差異はない。
7.11 紫外線蛍光ランプ
−
−
追加
JIS R 1709を引用するよう追加した。
ISO規格改正時に改正提案を
行う。
7.12 紫外放射照度計
−
−
追加
JIS R 1709を引用するよう追加した。
ISO規格改正時に改正提案を
行う。
7.13 暗箱
−
−
追加
暗所保管に使用する暗箱について,JIS R
1702を引用して追加した。
ISO規格改正時に改正提案を
行う。
7.9
Centrifuge
削除
各種JISを引用することによって,この
JIS中には記載がないため削除した。
実質的な技術的差異はない。
7.10
Sterilized syringe filter
unit
削除
各種JISを引用することによって,この
JIS中には記載がないため削除した。
実質的な技術的差異はない。
7.14 安全キャビネット
−
−
追加
JIS K 3800を引用するよう追加した。
実質的な技術的差異はない。
2
R
1
7
5
6
:
2
0
2
0
21
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7 装置及び
機器(続き)
7.15 ピペット
−
−
追加
JIS K 0970又はJIS R 3505を引用するよ
う追加した。
実質的な技術的差異はない。
8 試験片
8.1 フィルム密着法
8
JISとほぼ同じ
追加
ISO規格の試験方法をフィルム密着法と
して,名称を追加した。
試験片についての注記はJISでは本文に
記載した。
ISO規格改正時に追加するこ
とを提案する。
8.2 ガラス密着法
−
−
追加
JISではガラス密着法を規定するため,ガ
ラス密着法で用いる試験片について追加
した。
ISO規格改正時に追加するこ
とを提案する。
9 試験方法 9.1 一般事項
9.1
JISとほぼ同じ
追加
ISO規格のフローチャートに加えて,作
業中の照度が200 lx未満,紫外放射照度
が0.001 mW/cm2未満となるようにするこ
とを追加した。
ISO規格改正時に追加するこ
とを提案する。
9.2 宿主菌液の調製方法
9.2
JISとほぼ同じ
変更
JIS R 1706を引用するよう変更した。
実質的な技術的差異はない。
9.3 試験バクテリオファ
ージ液の調製方法
9.3
JISとほぼ同じ
変更
JIS R 1706を引用するよう変更した。
ISO規格改正時に濃度変更に
ついて改正提案を行う。
9.4 フィルム密着法
9.4
JISとほぼ同じ
変更
ISO規格の試験方法をJISではフィルム
密着法と変更した。
ISO規格改正時に追加するこ
とを提案する。
9.4 フィルム密着法
9.4
JISとほぼ同じ
追加
図を追加し,試験片の設置について説明
を追加した。
滅菌水量及び試験液量についての注記を
JISでは本文に記載した。
実質的な技術的差異はない。
9.5 ガラス密着法
−
−
追加
ISO規格ではガラス密着法が規定されて
いないが,JISではガラス密着法を規定す
るためにその方法について,追加した。
ISO規格改正時に追加するこ
とを提案する。
9.6 可視光照射条件
9.5.1
JISとほぼ同じ
変更
ISO規格では25 ℃±5 ℃と規定されて
いるが,JISでは試験装置内の温度を
25 ℃±3 ℃とするように変更した。
ISO規格改正時に変更するこ
とを提案する。
9.6 可視光照射条件
9.5.2
9.5.3
JISとほぼ同じ
変更
JISでは可視光照射照度測定と設置位置
について,JIS R 1752を引用することに
変更した。
実質的な技術的差異はない。
2
R
1
7
5
6
:
2
0
2
0
22
R 1756:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評
価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
9 試験方法
(続き)
9.7 バクテリオファージ
感染価の測定
9.6
JISとほぼ同じ
変更
JIS R 1706を引用するよう変更した。
実質的な技術的差異はない。
10 試験結
果の計算
10.1 一般事項
10.1
JISとほぼ同じ
追加
抗ウイルス活性値の計算時及び報告書に
記載する平均値の取扱いについて追加し
た。
実質的な技術的差異はない。
10.2 感染価の計算
10.2
JISとほぼ同じ
変更
ISO規格の10.2記載の試験成立条件をJIS
では10.3に変更し,JISの10.2を感染価
の計算だけに変更した。
実質的な技術的差異はない。
10.3 試験成立条件
10.2
JISとほぼ同じ
変更
ISO規格の10.2記載の試験成立条件をJIS
では10.3に変更し,JISの10.2を感染価
の計算だけに変更した。
実質的な技術的差異はない。
10.4 抗ウイルス活性値
の計算
10.3
JISとほぼ同じ
変更
ISO規格の10.3記載のΔVの項目をJIS
では10.5として別の項目に変更した。
実質的な技術的差異はない。
10.5 光照射による抗ウ
イルス活性値の計算
10.3
JISとほぼ同じ
追加
ISO規格の10.3記載のΔVの項目をJIS
では10.5として別の項目に変更した。
実質的な技術的差異はない。
10.6 暗所における抗ウ
イルス活性値の計算
10.4
JISとほぼ同じ
変更
ISO規格では光触媒以外の抗ウイルス材
料による抗ウイルス活性値としている
が,JISでは暗所における光触媒抗ウイル
ス活性値と分かりやすい記載に変更し
た。
実質的な技術的差異はない。
11 試験結
果の報告
11
JISとほぼ同じ
追加
ISO規格の報告内容に加えて,その他必
要な事項の項目を追加した。
実質的な技術的差異はない。
11
JISとほぼ同じ
追加
JISでは表1として,試験結果の報告例を
追加した。
実質的な技術的差異はない。
JISと国際規格との対応の程度の全体評価:ISO 18071:2016,MOD
2
R
1
7
5
6
:
2
0
2
0

23
R 1756:2020
注記1
箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2
JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
R
1
7
5
6
:
2
0
2
0














