R 1705:2016
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 試験に用いるかび ············································································································· 3
5 試験の準備 ······················································································································ 3
5.1 薬品,材料及び器具 ······································································································· 3
5.2 殺菌方法 ······················································································································ 4
5.3 培地 ···························································································································· 5
5.4 かびの保存及び使用 ······································································································· 5
5.5 胞子懸濁液 ··················································································································· 6
6 生残胞子数の測定 ············································································································· 6
7 光照射方法 ······················································································································ 6
7.1 紫外放射照度の測定及び試験片設置位置の準備 ···································································· 6
7.2 光照射条件 ··················································································································· 7
7.3 胞子懸濁液を接種した試験片の光照射················································································ 7
7.4 胞子懸濁液を接種した試験片の暗条件での保存 ···································································· 7
8 試験方法························································································································· 7
8.1 試験片の採取 ················································································································ 7
8.2 試験片の用途 ················································································································ 7
8.3 試験片の清浄化及び設置 ································································································· 8
8.4 胞子懸濁液の接種 ·········································································································· 8
8.5 接種した胞子の回収 ······································································································· 9
8.6 生残胞子数の計算 ·········································································································· 9
8.7 試験結果 ······················································································································ 9
9 試験結果の報告 ··············································································································· 10
9.1 報告項目 ····················································································································· 10
9.2 試験結果の報告例 ········································································································· 10
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 12
R 1705:2016
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
ファインセラミックス協会(JFCA)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して
日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した
日本工業規格である。
これによって,JIS R 1705:2010は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
R 1705:2016
ファインセラミックス−光照射下での
光触媒抗かび加工製品の抗かび性試験方法
Fine ceramics (advanced ceramics, advanced technical ceramics)-
Test method for antifungal activity of photocatalytic products under
photoirradiation
序文
この規格は,2013年に第1版として発行されたISO 13125を基とし,日本の技術動向,実態などに合わ
せるために,技術的内容を変更して作成した日本工業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JAに示す。また,附属書JAは対応国際規格にはない事項であ
る。
1
適用範囲
この規格は,光触媒を含有する抗かび加工平板状製品の,十分な紫外放射照度のある環境を模擬した光
照射下における,抗かび性の試験方法について規定する。ただし,光触媒粉末には適用しない。
なお,この規格では,主として太陽光の照射下において波長300〜380 nmの紫外線領域で効果を示す光
触媒を対象としている。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 13125:2013,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test method for
antifungal activity of semiconducting photocatalytic materials(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0557 用水・排水の試験に用いる水
JIS K 0950 プラスチック製滅菌シャーレ
JIS K 0970 ピストン式ピペット
JIS K 8102 エタノール(95)(試薬)
JIS K 8150 塩化ナトリウム(試薬)
JIS K 8263 寒天(試薬)
2
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS P 3801 ろ紙(化学分析用)
JIS R 1600 ファインセラミックス関連用語
JIS R 1702 ファインセラミックス−光触媒抗菌加工製品の抗菌性試験方法・抗菌効果
JIS R 1709 ファインセラミックス−紫外線励起形光触媒試験用光源
JIS R 3505 ガラス製体積計
JIS R 3644 ガラス管類
JIS R 3645 ガラス棒
3
用語及び定義
この規格で用いる主な用語及び定義は,JIS R 1600によるほか,次による。
3.1
光触媒
光照射下で,酸化・還元作用によって,空気浄化・脱臭,水質浄化,抗菌,抗かび,抗ウイルス,セル
フクリーニングなどの諸機能を発現する物質。機能性ファインセラミックスの一種。
3.2
光照射
300〜380 nmの範囲にある波長の紫外光を照射すること。
3.3
抗かび
製品の表面におけるかび胞子の発芽・発育活性を抑制する状態。
3.4
胞子懸濁液
界面活性剤を含む生理食塩水に,かびの胞子を均一に分散させた懸濁液。
3.5
生残胞子数
光照射又は暗所保存後の試験片上に存在する発芽・発育が可能なかび胞子の数。
3.6
光触媒抗かび加工
光触媒の抗かび機能を利用するため,塗布,含浸,練り込み及び種々の方法によって光触媒加工するこ
と。
3.7
抗かび活性値
光触媒抗かび加工した平板状製品及び無加工の平板状製品にかび胞子を接種し,光照射後の生残胞子数
を測定したときの,無加工の平板状製品及び光触媒抗かび加工した平板状製品の生残胞子数の対数値の差。
この値には,光を照射しない条件で得られる生残胞子数の減少分も含まれる。
3.8
光触媒抗かび加工製品の光照射による効果
光触媒抗かび加工した平板状製品にかび胞子を接種し,光照射後の生残胞子数及び暗所に保存した後の
生残胞子数を測定し,暗所に保存した後の生残胞子数及び光照射後の生残胞子数の対数値の差。
3
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
試験に用いるかび
試験に用いるかび(以下,試験用のかびという。)の種類は,次による。
これら試験用のかびの菌株は,独立行政法人製品評価技術基盤機構が分譲している菌株である。ただし,
国際微生物株保存連盟又は日本微生物資源学会に加盟している機関において保存されている同一系統の菌
株を使用することができる(表1参照)。
a) アスペルギルス ニゲル(Aspergillus niger)
b) ペニシリウム ピノヒルム(Penicillium pinophilum)
表1−試験用のかびの菌株
かびの種類
株番号
保存機関
アスペルギルス ニゲル
(Aspergillus niger)
NBRC 105649 a)
独立行政法人製品評価技術基盤機構バイオテクノロジー本部
生物遺伝資源部門,千葉県木更津市
ATCC 6275
American Type Culture Collection, Rockville, Maryland, U.S.A.
CBS 769.97
Centraalbureau voor Schimmelcultures, Fungal Biodiversity
Centre, Utrecht, the Netherlands
NRRL 334
Agricultural Research Service, U.S. Department of Agriculture,
Peoria, Illinois, U.S.A.
ペニシリウム ピノヒルム
(Penicillium pinophilum)
NBRC 6345
独立行政法人製品評価技術基盤機構バイオテクノロジー本部
生物遺伝資源部門,千葉県木更津市
ATCC 9644
American Type Culture Collection, Rockville, Maryland, U.S.A.
DSM 1960
Deutsche Sammlung von Mikro-orgamismen und Zellkulturen
GmbH, Braunschweig, Germany
CBS 170.60
Centraalbureau voor Schimmelcultures, Fungal Biodiversity
Centre, Utrecht, the Netherlands
NRRL A-5245
Agricultural Research Service, U.S. Department of Agriculture,
Peoria, Illinois, U.S.A.
注 a) 独立行政法人製品評価技術基盤機構から分譲を受けた菌株NBRC 6341を用いてもよい。
5
試験の準備
5.1
薬品,材料及び器具
5.1.1
薬品
5.1.1.1
エタノール(95) JIS K 8102に規定する1級以上のもの。
5.1.1.2
塩化ナトリウム JIS K 8150に規定するもの。
5.1.1.3
消毒用エタノール 最新の日本薬局方の基準に適合するもの。
5.1.1.4
塩化ベンザルコニウム液(0.2 g/L) 最新の日本薬局方の基準に適合するもの。
5.1.1.5
寒天 JIS K 8263に規定するもの。
5.1.1.6
グルコース 微生物試験用のもの。
5.1.1.7
精製水 JIS K 0557に規定するA2以上のもの。
5.1.1.8
アニオン界面活性剤 ジオクチルスルホこはく酸ナトリウム。
5.1.2
材料及び器具
5.1.2.1
綿栓 青梅綿を使用した栓又はシリコーンゴム栓など。
5.1.2.2
シャーレ 内径約90 mmのガラス製,JIS K 0950に規定する90A号又は90B号に適合するもの。
5.1.2.3
乾熱殺菌器 温度を160〜180 ℃に保持できるもの。
5.1.2.4
オートクレーブ(高圧蒸気殺菌器) 温度を121 ℃(圧力103 kPa相当)に保持できるもの。
4
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.1.2.5
クリーンベンチ 微生物試験用のもので,送風を停止できるもの。
5.1.2.6
白金耳 先端のループが約2〜4 mmのもの。
5.1.2.7
培養器 目的とする温度±2 ℃を保持できるもの。
5.1.2.8
ガラス板 微生物の発育に影響を及ぼさない材質のもの。
5.1.2.9
ピペット JIS K 0970又はJIS R 3505のクラスAに適合又は同等の精度のもの。
5.1.2.10 試験管ミキサー 理化学実験用のもの。
5.1.2.11 超音波洗浄器 実験器具洗浄用の小形のもので,周波数が30〜50 kHz前後のもの。
5.1.2.12 ストマッカー袋 微生物試験用のもの。
5.1.2.13 密着フィルム JIS R 1702に規定する,微生物の発育に影響を及ぼさない材質で,吸水性がなく,
密着性がよく,340〜380 nmの透過率が85 %以上のフィルム。
5.1.2.14 保湿用ガラス JIS R 1702に規定する,厚みが1.1 mm以内で,340〜380 nmの透過率が85 %以
上のガラス板をシャーレ全面が覆えるサイズに切断したもの。
5.1.2.15 保存シャーレ 内径約90 mmのJIS K 0950に規定する90A号又は90B号に適合するもの。
5.1.2.16 調湿用ろ紙 JIS P 3801に規定する微生物の発育に影響を及ぼさないろ紙で,試験片を置くシャ
ーレに入るよう裁断されたもの。
5.1.2.17 ガラス管・ガラス棒 JIS R 3644に規定するガラス管又はJIS R 3645に規定するガラス棒を保存
シャーレに入るよう切断したものか,U字状に折り曲げたもの。
5.1.2.18 紫外線蛍光ランプ JIS R 1709に規定するもの。
5.1.2.19 光照射装置 JIS R 1702に規定するもの。
5.1.2.20 紫外放射照度計 JIS R 1709に規定するもの。
注記 試験管,ピペット,ピンセットなどは,アルカリ性洗剤又は中性洗剤で丁寧に洗浄し,水で十
分にすすぎ,乾燥してから乾熱殺菌又は高圧蒸気殺菌する。
5.2
殺菌方法
5.2.1
乾熱殺菌
殺菌しようとするものを,160〜180 ℃の乾熱殺菌器に入れ,30〜60分間加熱する。乾熱殺菌終了後,
殺菌対象物の綿栓,包装紙などが水でぬれたときは,その器具は使用してはならない。
5.2.2
高圧蒸気殺菌
オートクレーブに水を入れ,殺菌しようとする器具などを金網かごに入れてオートクレーブ内の棚に載
せる。オートクレーブの蓋を固く締めて加熱を開始し,温度121 ℃(圧力103 kPa相当)で15〜20分間加
熱する。加熱を止めて100 ℃以下まで自然冷却した後,排気弁を開いて残存する蒸気を抜き取り,蓋を開
けて殺菌した器具などを取り出す。殺菌済みの器具などは,必要に応じてクリーンベンチ内で更に冷却す
る。
なお,オートクレーブ内部は,培地,加工薬剤などからの汚染を防ぐため,必要に応じて洗浄して常に
清浄にする。
5.2.3
火炎殺菌
殺菌しようとするものを,ガス又はアルコールの火炎に当てる。白金耳の場合は,十分に赤熱し,試験
管口の場合は,回しながら全体的に2〜3秒間火炎に当てる。
5.2.4
薬剤殺菌
手指などの場合は,エタノール(77〜81 %),日本薬局方消毒用エタノール,塩化ベンザルコニウム溶
液(0.1〜1 %)又はこれらを組み合わせた薬剤を用いて殺菌する。
5
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.3
培地
5.3.1
ポテト・デキストロース寒天培地(PDA培地)
大粒できずの少ないジャガイモを水でよく洗って皮をむき,芽の部分は,深くえぐって周囲約10 mmま
で除去した上で,約10 mmのさい(賽)の目切りにする。その200 gをとり,精製水1 000 mLを加えて直
火で1時間煮沸する。内容物を直ちに数枚のガーゼでろ別し,精製水を加えて1 000 mLとしたものにグル
コース20 gと寒天20 gとを加えて,更に内容物を十分に溶解させた後,オートクレーブによって殺菌を行
う。また,同組成の市販粉末培地又は市販平板培地を,それぞれの調製方法に従い用いてもよい。
5.3.2
斜面培地(スラント)
乾熱殺菌した試験管の中に,あらかじめ加温して完全に溶解した5.3.1のポテト・デキストロース寒天培
地を適量注ぎ込み,綿栓をしてオートクレーブで殺菌する。殺菌後,熱いうちに試験管を水平から15°程
度傾けて固定し,培地を固化させる。この角度によって試験管内の培地の角度及び表面積が変化するが,
傾けすぎて培地が綿栓に接触しないようにする。
完全に冷却した斜面培地は,5〜10 ℃で保存する。斜面培地は,調製してから30日間以上経過したもの
は用いてはならない。
5.4
かびの保存及び使用
5.4.1
かびの保存
試験用のかびの移植及び胞子の取扱いは,クリーンベンチ又はクリーンベンチと同等の清浄さを保った
環境で行う。元株の試験管及び移植用試験管の綿栓及び首部は,火炎殺菌又は5.2.4の薬剤による拭き取
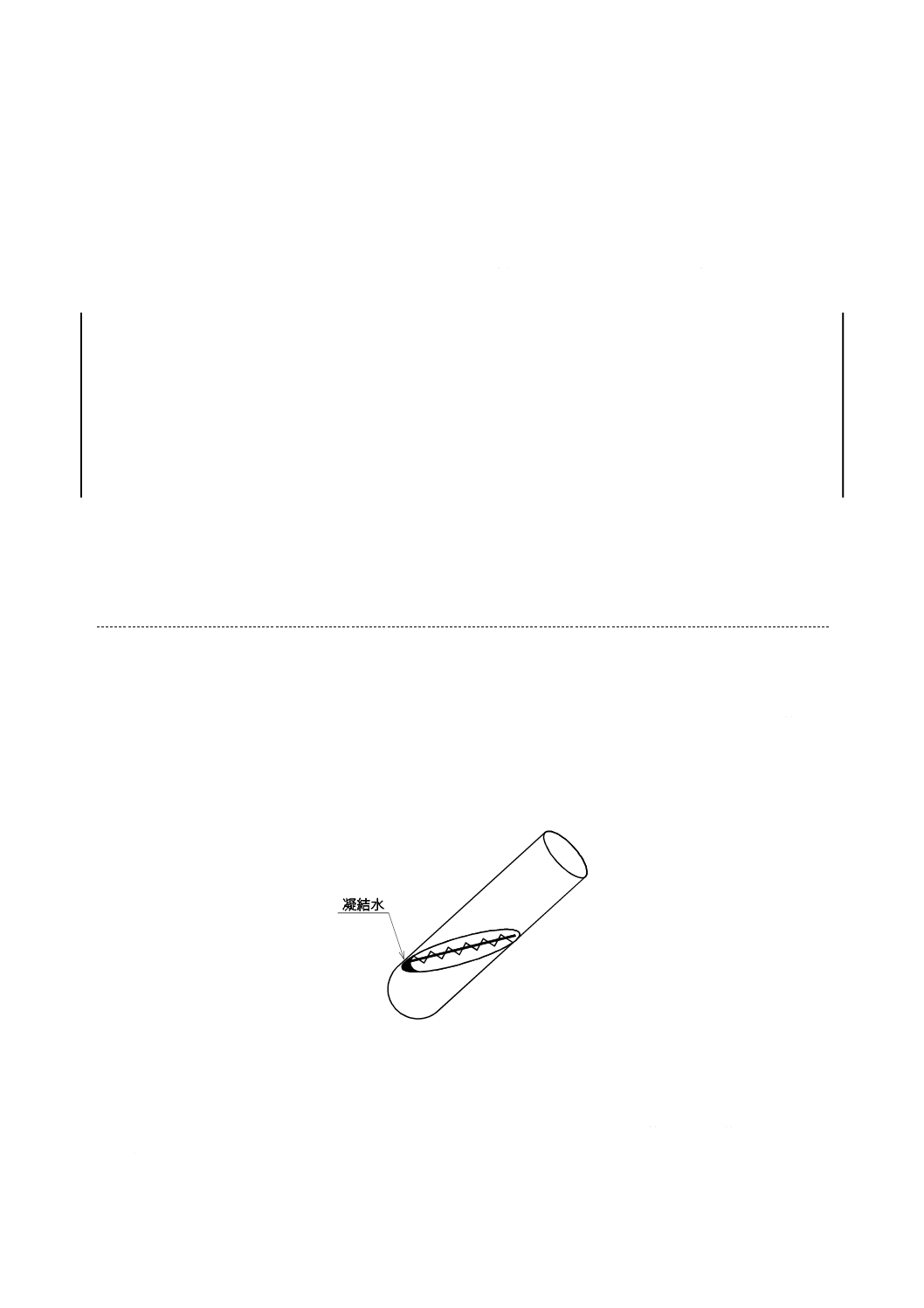
りを行い,試験管立てに立ててクリーンベンチの中に入れる。次に,元株から1白金耳程度をか(掻)き
取り,培地斜面下端の凝結水に,白金耳にかき取ったかび胞子を分散し,ここから培地斜面上端まで直線
又は波状にかび胞子をなす(擦)り付ける(図1参照)。白金耳は,異なったかびを移植するたびに火炎
殺菌する。プラスチック製殺菌白金耳の場合は,移植のたびに白金耳を替える。移植した斜面培地は,培
養器に入れ26±2 ℃で,アスペルギルス ニゲルは7日間,ペニシリウム ピノヒルムは14日間培養し,
十分に胞子を産生していることを確認した後,5〜10 ℃で保存する。
移植してから90日以内に培養株から新しい斜面培地に移植して培養保存し,以後,90日以内ごとに移
植を繰り返す。移植してから90日を超えて経過したものは,次の移植に用いてはならない。
図1−斜面培地への移植
5.4.2
かびの使用
5.5の胞子懸濁液に用いるかびは,5.4.1によって保存されたかびを新しい斜面培地に移植し,26±2 ℃
で,アスペルギルス ニゲルは7日間,ペニシリウム ピノヒルムは14日間培養する。培養後,5〜10 ℃
で保存し,10日以内に使用する。
6
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.5
胞子懸濁液
5.5.1
湿潤液・回収液・希釈液の調製
ジオクチルスルホこはく酸ナトリウム(Dioctyl sodium sulfosuccinate)50 mg及び塩化ナトリウム9 gを
精製水1 000 mLに溶解し,三角フラスコなどに小分けしてオートクレーブで殺菌する。
5.5.2
胞子数の計測
胞子数は,ヘモサイトメーター(血球計算盤)を用いて,顕微鏡下で計測する。
5.5.3
胞子懸濁液の調製
5.4.2の保存培養試験管内に5.5.1の湿潤液を適量注ぎ入れ,ピペッティング又は白金耳のループを利用
して培養面を軽くこす(擦)って胞子を離脱させ,数枚の殺菌したガーゼ又は脱脂綿でろ過する。ろ過後,
ペニシリウム ピノヒルムについては,更にピペッティング又は試験管ミキサーによって十分に胞子を分
散させる。アスペルギルス ニゲルについては胞子が凝集しやすいため,超音波洗浄器を用いて周波数30
〜50 kHzで5分間超音波による処理を行い,胞子を十分に分散させる。
調製した胞子懸濁液の胞子数を5.5.2の方法で計測する。この計測のときに,胞子が凝集して胞子塊又は
連鎖をしていないかを確認する。胞子の凝集又は連鎖が多数認められた場合は,分散の作業をやり直す。
計測値から希釈率を算出して胞子濃度5.0×105個/mLに,5.5.1の希釈液を用いて希釈する。実際の胞
子数は,8.5.1の胞子懸濁液接種直後の試験片の測定で確認する。
調製した胞子懸濁液は,使用するまで5〜10 ℃で保存する。調製後,24時間以上経過した胞子懸濁液は,
試験に用いてはならない。
6
生残胞子数の測定
生残胞子数の測定は,次の10倍希釈法による混釈平板培養によって行う。
8.5.1の回収原液(洗い出し液)を殺菌したピペットで1 mL採取し,5.5.1の希釈液9.0±0.1 mLの入っ
た試験管に加えて十分にかくはんする。この操作を,順次,繰り返して10倍希釈系列液を作製し,回収原
液及び各希釈系列液を,それぞれ別のシャーレ2枚に新しい殺菌ピペットで1 mL入れる。ここに,45〜
48 ℃に保温した5.3.1のポテト・デキストロース寒天培地15〜20 mLを注ぎ入れ,シャーレを軽く水平に
回して蓋をした後,15分間室温で静置する。培地が固化したら26±2 ℃で,通常7日間培養する。培養後,
10〜99個のコロニーが現れた希釈系列のシャーレのコロニー数を計測する。また,回収原液でコロニー数
が1〜9個の場合は,それを計測する。回収液の生残胞子濃度を,式(1)によって有効数字2桁まで求める。
S=K×D ·················································································· (1)
ここに,
S: 胞子濃度(個/mL)
K: 2枚のシャーレのコロニー数の平均値(個)
D: 希釈倍率
回収原液のコロニー数が“<1”の場合の胞子数は,平均値を“1”として計算する。
なお,コロニーの発育が良好で7日間の培養では計測不能と予想された場合は,7日以内の培養で計測
してもよい。ただし,コロニーが全く現れない場合は,必ず7日間培養して確認する。
7
光照射方法
7.1
紫外放射照度の測定及び試験片設置位置の準備
光照射装置の床面に紫外放射照度計の受光部を据え付け,受光部の上に試験に使用するフィルム及びガ
ラス板を置く。指示値を読み取りながら,7.2に規定する紫外放射照度が得られる位置を決め,試験片の設
7
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
置位置とする。
なお,紫外放射照度を測定するときは,紫外放射照度を安定化させるため,照射装置の光源を15分間以
上予備点灯しておく。
7.2
光照射条件
紫外放射照度は,実際に製品が使用される状況に応じて0.8 mW/cm2を上限として試験を行う。
注記 この試験に用いる光照射装置の紫外放射照度の上限は,約1.0 mW/cm2である。しかし,0.8
mW/cm2以上の場合,紫外線ランプからの放熱及びそれに伴う胞子懸濁液の乾燥によって,胞
子が死滅するおそれがある。このため,0.8 mW/cm2を上限として,紫外放射照度を設定する。
7.3
胞子懸濁液を接種した試験片の光照射
胞子懸濁液を接種した試験片(光触媒抗かび加工した試験片3個及び光触媒抗かび加工していない試験
片3個)の入った保存シャーレを温度25±5 ℃で,24時間光照射する。
注記 光触媒抗かび加工製品が実際に使用される状況を考慮して,光照射時間を短くしてもよい。
7.4
胞子懸濁液を接種した試験片の暗条件での保存
胞子懸濁液を接種した試験片(光触媒抗かび加工した試験片3個及び光触媒抗かび加工していない試験
片3個)の入った保存シャーレを温度25±5 ℃で,7.3と同じ時間,暗所で保存する。
注記1 保存シャーレを覆う保湿用ガラスの代わりに,保存シャーレの蓋を代用してもよい。
注記2 暗所で保存する場合,試験片に光が当たらないように,保存シャーレをアルミニウムはくで
被覆したり,暗箱などに保存してもよい。
8
試験方法
8.1
試験片の採取
平板状製品の平たんな部分を50±2 mm角(厚さ10 mm以内)の正方形に切り取り,これを標準の大き
さの試験片とする。この試験片の大きさで,光触媒抗かび加工していない試験片を9個,光触媒抗かび加
工された試験片を6個準備する。ただし,平板状製品を50±2 mm角(厚さ10 mm以内)の正方形に切り
取ることが困難な場合又は不可能な場合,表面積400〜1 600 mm2のフィルムが被覆できる試験片の大きさ
であれば,ここに規定する形状及び大きさ以外の試験片を使用してもよい。また,光触媒抗かび加工して
いない試験片が準備できない場合は,同じ大きさのガラス板を代用してもよい。試験片の調製に当たって
は微生物汚染,製品間の相互汚染及び汚れの付着に十分注意する。試験片は製品自体から採取することが
望ましいが,製品の形状などから試験片の調製が困難な場合は,同じ原材料及び加工方法で,別途,平板
状に加工したものから試験片を調製してもよい。また,試験片の表面が有機物で汚染されている場合は,
汚染有機物を除去するための予備作業として,0.8 mW/cm2程度の光源で24時間を上限として照射しても
よい。
8.2
試験片の用途
光触媒抗かび加工をしていない製品又はガラス板から切り取った試験片9個のうち,3個は胞子懸濁液
接種直後の生残胞子数測定用に,3個は所定時間光照射後の生残胞子数測定に,残りの3個は所定時間暗
所に保存した後の生残胞子数測定用に用いる。
光触媒抗かび加工された試験片6個のうち,3個は所定時間光照射後の生残胞子数測定用に,残りの3
個は所定時間暗所に保存した後の生残胞子数測定用に用いる。
8
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
8.3
試験片の清浄化及び設置
8.3.1
試験片の清浄化
8.1の試験片全面をエタノール又は日本薬局方消毒用エタノールを吸収させたガーゼ又は脱脂綿で軽く2,
3回拭いた後,十分に乾燥させる。
これらの処理によって,試験片の軟化,塗装の溶解,成分の溶出などの変化が起こり,これが原因で試
験の結果に影響を及ぼすと判断される場合においては,8.1によって紫外放射によって清浄化するか,又は
清浄化せずにそのまま試験に用いる。
8.3.2
試験片の設置
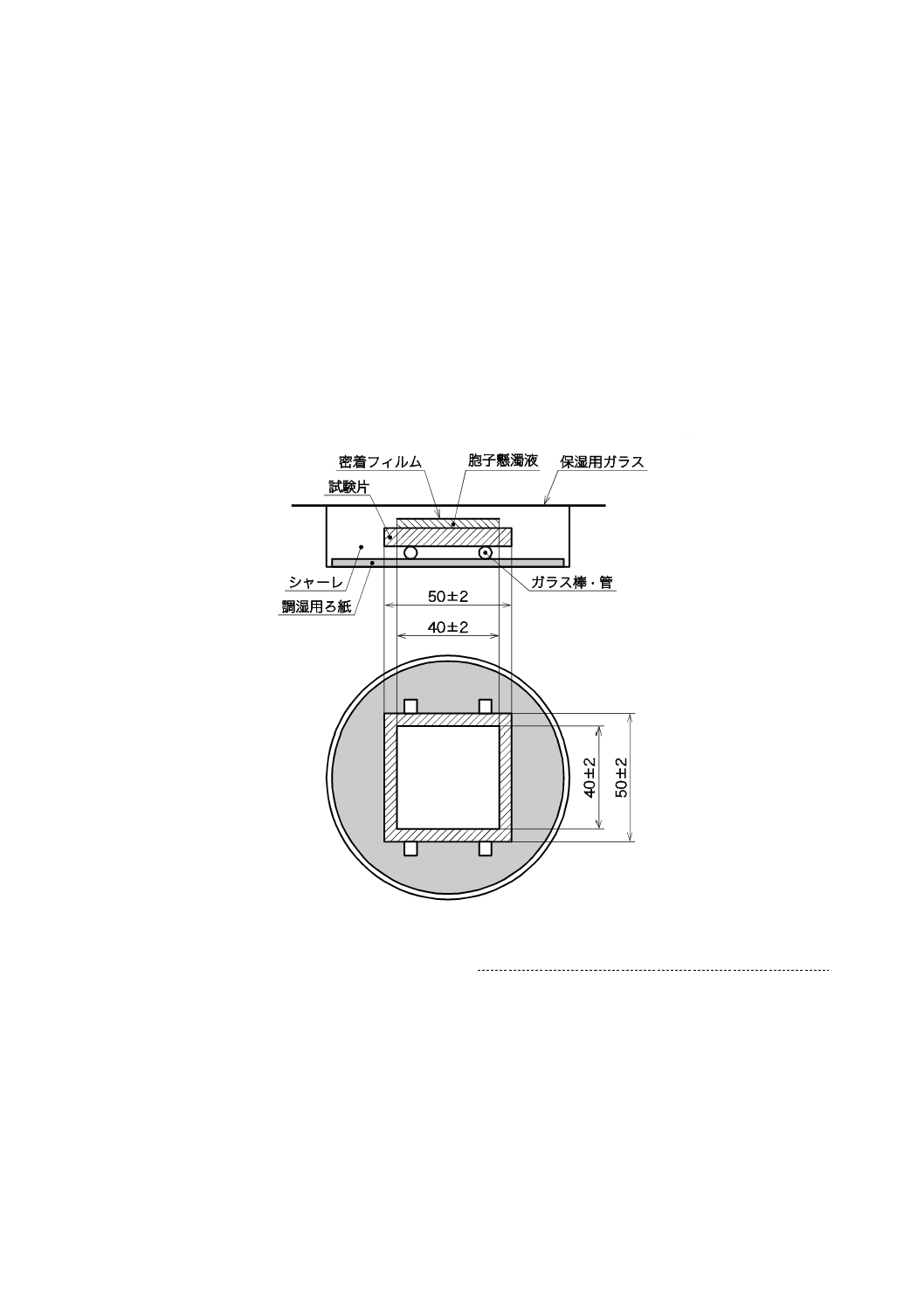
殺菌済み保存シャーレの底に,殺菌済み調湿用ろ紙を置き,殺菌水を適量入れ,試験片とろ紙とが直接
触れないようにガラス管又はガラス棒を置き,その上に光触媒抗かび加工が施されている面を上にして試
験片を置く(図2参照)。
単位 mm
図2−試験片及び保湿ガラスなどの組立
試験面は光触媒抗かび加工された製品の表面とする。内部まで光触媒抗かび加工された製品であっても,
切断面は試験面としない。
注記 殺菌水の量は,ろ紙の種類によって吸水量が異なるため,5〜7 mLの範囲で調整するとよい。
8.4
胞子懸濁液の接種
胞子懸濁液をピペットで正確に0.1 mL採取し,これを8.3.2の各試験片に滴下する。滴下した胞子懸濁
液の上に殺菌した密着フィルムをかぶせ,胞子懸濁液がフィルムの端からこぼれないように注意しながら
液が密着フィルム全体にいきわたるように軽く押さえた後,保湿用ガラスを載せ(図2参照),7.3及び7.4
の試験を行う。
なお,標準の大きさ以外の試験片の胞子接種量は,被覆した密着フィルムの面積比で案分する。標準の
9
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
大きさの試験片であっても,親水性に乏しい試料では密着フィルム全体に胞子懸濁液が広がらない場合が
ある。このような場合は,規定量の2倍を限度に接種量を増加してもよい。ただし,このような場合であ
っても試験片に接種する胞子数は標準の場合と同様に,1試験片当たり5.0×104個とする。
また,密着フィルムの大きさは40±2 mm角の正方形を標準とする。試験片が標準の大きさ以外の場合
は,密着フィルムが試験片より2.5 mm以上内側となるように大きさを調整する。ただし,密着フィルム
の大きさは400 mm2より小さくしてはならない。
8.5
接種した胞子の回収
8.5.1
胞子懸濁液接種直後の試験片
胞子懸濁液を接種した直後の光触媒抗かび加工していない試験片3個について,密着フィルムと試験片
とを,それぞれ懸濁液がこぼれないように注意しながら,殺菌ピンセットを用いて殺菌済みストマッカー
袋内に入れ,これにピペットで5.5.1の回収液を10 mL加えて,袋の外から手で試験片及び密着フィルム
を十分にも(揉)んで胞子を洗い出す。この洗い出し液は,速やかに箇条6の測定に供する。また,胞子
の洗い出しについては,この方法と同等又はそれ以上の回収率が得られる方法であれば,他の方法を用い
てもよい。また,試験片の大きさ及び特性上,回収液10 mLでは洗い出しが困難な場合は,液量を増やし
てもよい。
8.5.2
試験後の試験片
7.3及び7.4の試験片について,8.5.1と同様に胞子を洗い出す。この洗い出し液は,速やかに箇条6の測
定に供する。
8.6
生残胞子数の計算
箇条6で求めた胞子濃度から,式(2)によって生残胞子数を求める。
F=S×V ·················································································· (2)
ここに,
F: 生残胞子数(個)
S: 箇条6で求めた胞子濃度(個/mL)
V: 洗い出しに用いた回収液の液量(mL)
コロニー数が“<1”の場合の胞子数は,“<10”(Vが10 mLの場合)と表示し,生残胞子数の平均を算
出する場合は“10”を用いる。
8.7
試験結果
試験結果は,次による。
a) 試験成立条件の判定 次の3項目の試験成立条件を全て満たすとき,その試験は有効と判定する。全
ての条件を満足しない場合は,試験不成立と判定して,再度,試験を実施する。
1) 5.5.3において,胞子懸濁液の単一胞子が十分に分散された状態にある。
2) 胞子懸濁液を接種した直後の光触媒抗かび加工していない試験片の生残胞子数が,1.0×104個以上
で1.0×105個未満である。
3) 光触媒加工していない試験片の光照射後の生残胞子数が,5.0×103個以上である。
b) 光触媒加工製品の抗かび活性値の計算 試験が成立した場合について,試験を行った紫外放射照度に
おける光触媒抗かび加工製品の抗かび活性値は,式(3)によって求める。式(3)においては,小数点以下
2桁目を切り捨て,小数点1桁で算出する。
(
)
(
)
[
]
(
)
L
L
L
L
L
/
log
/
log
/
log
C
B
A
C
A
B
R
=
−
=
······································· (3)
ここに,
RL: 紫外放射照度条件L(mW/cm2)における光触媒抗かび加工製
品の抗かび活性値(3.7参照)
A: 光触媒抗かび加工していない試験片の接種直後の生残胞子数
10
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
の平均値(個)
BL: 光触媒抗かび加工していない試験片に紫外放射照度L
(mW/cm2)で所定時間光照射した後の生残胞子数の平均値
(個)
CL: 光触媒抗かび加工した試験片に紫外放射照度L(mW/cm2)で
所定時間光照射した後の生残胞子数の平均値(個)
c) 光触媒抗かび加工製品の光照射による効果の計算 式(4)によって,光触媒抗かび加工製品の光照射に
よる効果ΔRを,小数点以下2桁目を切り捨て,小数点以下1桁で算出する。
(
)
(
)
(
)
[
]
(
)
(
)
(
)
D
D
L
D
D
L
L
D
D
L
L
/
log
/
log
/
log
/
log
/
log
/
log
Δ
C
B
R
C
B
C
B
A
C
A
B
C
B
R
−
=
−
=
−
−
=
······································ (4)
ここに,
ΔR: 光触媒抗かび加工製品の光照射による効果(3.8参照)
BD: 光触媒加工していない試験片を所定時間暗所に保存した後の
3試験片の生残胞子数の平均値(個)
CD: 光触媒加工した試験片を所定時間暗所に保存した後の3試験
片の生残胞子数の平均値(個)
9
試験結果の報告
9.1
報告項目
試験結果の報告項目は,次による。
a) この規格の規格番号
b) 光触媒抗かび加工した試験片及び光触媒抗かび加工をしていない試験片の種類,大きさ及び厚み
c) 使用した光源の種類(製造業者名及び品番)
d) 予備照射をした場合は,その条件
e) 使用した紫外放射照度計の種類(製造業者名及び品番)
f)
密着フィルムの種類及び大きさ
g) 保湿ガラスの種類
h) 光照射条件
i)
胞子懸濁液の接種量
j)
試験菌種及び株番号
k) 胞子懸濁液の推定胞子数
l)
8.7 b)のA,BL,CLのそれぞれの値及びRL
m) 8.7 c)のBD,CDのそれぞれの値及びΔR
9.2
試験結果の報告例
試験結果の報告例を,表2に示す。

11
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表2−試験結果の報告(例)
規格番号
JIS R 1705
光触媒抗かび加工した試験片の種類
光触媒塗料塗布PET板 50×50×5 mm
光触媒抗かび加工していない試験片の種類
PET板 50×50×5 mm
光源の種類
ブラックライト蛍光灯(○○電気,FL20・BLB)
予備照射条件
FL20・BLB,0.8 mW/cm2で24時間予備照射
紫外放射照度計
紫外放射測定器(△△製作所,本体:UV-X,受光部:UV-Y)
密着フィルムの種類
ポリプロピレンフィルム(□□商会),40×40 mm
保湿ガラスの種類
ほうけい(硼珪)酸ガラス
光照射条件
0.8 mW/cm2で24時間
胞子懸濁液の接種量
0.1 mL
試験菌・株番号
A. niger NBRC 105649
P. pinophilum NBRC 6345
胞子懸濁液の推定胞子数
5.0×105
5.0×105
A
4.8×104
4.2×104
B0.8
4.2×104
2.8×104
C0.8
1.1×102
<10
R0.8
2.6
3.4
BD
4.7×104
4.2×104
CD
3.5×104
3.2×104
ΔR
2.5
3.3
12
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
JIS R 1705:2016 ファインセラミックス−光照射下での光触媒抗かび加工製品
の抗かび性試験方法
ISO 13125:2013,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test
method for antifungal activity of semiconducting photocatalytic materials
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
2 引用規格
3.2 光照射
300〜380 nmの紫外
線
3.2
300〜400 nmの紫外線
変更
今回の改正において,可視光応答形
光触媒との重複を避けるため300〜
380 nmの紫外線と規定を修正。
可視光応答形光触媒との重複を
避けるため,300〜380 nmに修正
するようISO改正時に提案する。
3.4 胞子懸
濁液
胞子懸濁液について
規定
記載なし
追加
JISでは,胞子懸濁液について追加。 JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
3.5 生残胞
子数
保存後の試験片上の
残存する発芽・発育可
能なかび胞子数と定
義した。
記載なし
追加
JISでは,生残胞子数について追加。 JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
3.7 抗かび
活性値
抗かび活性値につい
て規定
3.5
光を照射しない条件で得
られる残存胞子数の減少
分も含まれることについ
て記載されていない。
追加
本質的な技術的差異はなく,JISで
は,光を照射しない条件で得られる
残存胞子数の減少分も含まれること
を記載。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
5.1 薬品,
材料及び器
具
一般的な薬品,材料及
び器具について規定
7
一部の薬品,材料及び器具
についてだけ規定されて
いる。
追加
本質的な技術的差異はなく,JISで
はISO規格よりも詳細な仕様を規定
した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
5.1.2.15 保
存シャーレ
保存シャーレについ
て
7.7
滅菌したシャーレ又は類
似品とだけ記載。
追加
本質的な技術的差異はなく,JISで
はJIS K 0950を引用してISO規格よ
りも詳細な仕様を規定した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
2
R
1
7
0
5
:
2
0
1
6
13
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
5.1.2.18 紫
外線蛍光ラ
ンプ
紫外線蛍光ランプに
ついて
7.3
ISO規格ではISO 4892-3
を,JISではJIS R 1709を
引用した。ISO規格ではピ
ーク波長が351 nmで前後
40 nmの帯域幅のBLBラ
ンプと記載されているの
でJIS R 1709と同等。
一致
本質的な技術的な差異はない。
JISではランプの指定がないのでJIS
R 1709に準拠し351 nm±2 nmの
BLBランプ(351BLB)を用いる。ISO
13125の記述は351BLBのことを示
しているので,技術的な内容は一致
している。
対応するISO規格の記載内容に
ついて,JIS R 1709に対応する
ISO 10677を引用するように修
正するようISO改正時に提案す
る。
5.3 培地
PDAの調製方法につ
いて規定
6.2.1
ポテト・デキストロース培
地の一般的な組成及び調
製方法を記載。
追加
JISでは,調製方法の詳細を記載。
JISではオートクレーブの温度及び
時間は5.2.2で記載している。
JISでは斜面培地の調製を追加。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
5.4.1 かび
の保存
かびの保存について
9.3.1
ISO規格では斜面培地又
は平板での継代と規定。
追加
JISでは具体的な継代の手順を追記
した。ISO規格では斜面培地又は平
板での継代と規定したが,JISでは
前者だけとした。技術的な差異はな
い。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
5.5.3 胞子
懸濁液の調
製
胞子懸濁液の調製に
ついて
9.3.3
胞子の凝集状態の確認に
関する規定がISO規格に
は記載されていない。
追加
JISでは胞子の凝集状態の確認に関
する規定を追記した。技術的な差異
はない。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
6 生残胞子
数の測定
生残胞子数の測定と
計算方法について
9.4
10倍希釈法による混釈平
板培養によって生残胞子
数の測定を行うことを記
載。
追加
JISでは回収原液での計数方法,測
定限界値の取扱いについて記載。ま
た,発育良好で規定の7日培養では
計測不能となると予想される場合,
培養期間を短縮してもよい旨につい
ても記載した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
数値の丸め方:有効数
字2桁まで求める
10 計
算
計算結果を
IEC
60068-2-10に従って小数
点以下2桁に丸める。
一致
技術的な差異はない。
ISO
規格での引用
IEC
60068-2-10が違っているため
ISO規格の訂正が必要。
生残胞子数の測定(希
釈方法,培養条件)及
び胞子濃度の計算
10.1
胞子濃度の計算について,
計算式を記載。
追加
ISO規格では,この項は計算式だけ
記載。JISには,<1の場合は,平均
値1として計算する旨を記載した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
2
R
1
7
0
5
:
2
0
1
6
14
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7.2 光照射
条件
光照射条件について
9.2.2
ISO規格では紫外放射照
度を0.4 mW/cm2〜0.8
mW/cm2,照射時間を3時
間以上24時間以内と規定
している。
変更
JISでは紫外放射照度及び照射時間
の具体的な下限値を規定していな
い。
JISでは,光触媒抗かび製品が実
際に使用される状況を考慮して
上限値までの範囲で変更してよ
いとしており,試験の目的に応じ
て実施者の判断に委ねている。本
質的な技術的差異はない。
8.1 試験片
の採取
試験片の採取につい
て
8.1
製品自体から試験片が採
取できない場合について
の規定がない。
追加
JISでは製品自体から試験片が採取
できない場合についての規定を追記
した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
8.3.1 試験
片の清浄化
試験片の清浄化につ
いて
8.3
80 %エタノールによる清
浄化と,試験片に対する事
前の光照射を規定。エタノ
ール処理できない場合に
ついての記載はない。
変更
JISではISO規格に記載される80 %
エタノールの代わりにJIS K 8102に
規定のエタノール(95)又は最新の
日本薬局方の基準に適合する消毒用
エタノールとした。エタノール処理
できない場合について記載。また,
試験片に対する事前の光照射につい
てはJISの8.1に記載した。
JISでは,JISに規定の試薬とし,
エタノール処理できない場合の
対応について,より詳細な記述を
行った。本質的な技術的差異はな
い。
8.3.2 試験
片の設置
試験片のシャーレ内
での設置方法
9.5.2
切断面に対する記載は特
にない。
追加
JISには,切断面を試験面としては
ならない旨の記載がある。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
8.4 胞子懸
濁液の接種
9.5.1
ISO規格には,この項に表
面がフラットで吸水性の
ないサンプルだけ試験可
能との記載あり。
カバーフィルムの大きさ
は,本文中は40 mm角と
記載されているが,図1に
40±2 mmと記載されてい
てJISと一致している。
追加
JISでも同様に,明記していないが
吸水性のあるサンプルでは胞子懸濁
液が吸収されるため試験不可能であ
る。
親水性の乏しい試料で胞子懸濁液が
密着フィルム全体に広がらない場合
の対処について,JISには2倍を限
度に接種量を増加してもよい旨の記
載があるが,ISO規格にはない。
接種量の増加については,JISで
はデータに基づいて容認してい
る。本質的な技術的差異はない。
2
R
1
7
0
5
:
2
0
1
6
15
R 1705:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
8.5.1 胞子
懸濁液接種
直後の試験
片
胞子懸濁液接種直後
の試験片からの洗い
出し
9.5.3.1 ISO規格では,もみ洗いの
回数を最低10回と記載し
ている。
追加
JISでは,十分にもんで洗い出すと
記載。また,JISでは,他の回収方
法に変更できる旨,回収液10 mLで
は洗い出しが困難な場合,変更して
よい旨を記載した。
本質的な技術的差異はない。
8.6 生残胞
子数の計算
生残胞子数の計算
10.2
ISO規格では,この項は計
算式だけ記載。
追加
JISには,コロニー数が“<1”の場
合の胞子数は,“<10”(Vが10 mL
の場合)と表示し,生残胞子数の平
均を算出する場合は“10”を用いる
旨を記載した。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
9.2 試験結
果の報告例
試験結果の報告項目
11
報告項目の列挙順がJISと
は異なる。本質的に差異は
ない。
追加
JISでは,報告例の表についても記
載されている。JISではBD,CDの値
についても記載を求めている。
JISではより詳細な記述を行っ
た。本質的な技術的差異はない。
JISと国際規格との対応の程度の全体評価:ISO 13125:2013,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致 ················ 技術的差異がない。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
R
1
7
0
5
:
2
0
1
6








