R 1702:2020
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 記号及び単位 ··················································································································· 3
5 測定原理························································································································· 4
6 材料······························································································································· 4
6.1 試験に用いる細菌株及び試験の準備··················································································· 4
6.2 試薬及び材料 ················································································································ 6
6.3 殺菌方法 ······················································································································ 7
7 装置及び機器 ··················································································································· 7
8 試験片··························································································································· 10
8.1 フィルム密着法 ············································································································ 10
8.2 ガラス密着法 ··············································································································· 10
9 試験方法························································································································ 11
9.1 一般事項 ····················································································································· 11
9.2 フィルム密着法 ············································································································ 12
9.3 ガラス密着法 ··············································································································· 14
9.4 紫外光照射条件 ············································································································ 16
9.5 生菌数の測定 ··············································································································· 17
10 試験結果の計算 ············································································································· 17
10.1 一般事項 ···················································································································· 17
10.2 フィルム密着法 ··········································································································· 18
10.3 ガラス密着法 ·············································································································· 19
11 抗菌効果の判定 ············································································································· 19
12 試験結果の報告 ············································································································· 20
附属書A(参考)試験結果例 ································································································· 22
附属書B(参考)密着フィルム及び密着ガラスの測定例 ······························································ 24
附属書C(参考)紫外光照射による細菌の損傷の評価 ································································ 26
附属書JA(規定)平板状のハイブリッド光触媒抗菌加工材料の光が当たらない環境での
抗菌性試験方法及び抗菌効果 ··························································································· 27
附属書JB(参考)住環境における紫外放射照度及び照度分布(戸建住宅) ···································· 32
附属書JC(参考)住環境における紫外放射照度分布(場所別一覧) ············································· 43
附属書JD(参考)光触媒による抗菌性評価結果 ········································································ 44
附属書JE(参考)JISと対応国際規格との対比表 ······································································ 48
R 1702:2020
(2)
まえがき
この規格は,産業標準化法第16条において準用する同法第12条第1項の規定に基づき,一般社団法人
日本ファインセラミックス協会(JFCA)及び一般財団法人日本規格協会(JSA)から,産業標準原案を添
えて日本産業規格を改正すべきとの申出があり,日本産業標準調査会の審議を経て,経済産業大臣が改正
した日本産業規格である。これによって,JIS R 1702:2012は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
R 1702:2020
ファインセラミックス−
光触媒抗菌加工材料の抗菌性試験方法及び抗菌効果
Fine ceramics (advanced ceramics, advanced technical ceramics)-
Test method for antibacterial activity of photocatalytic materials and efficacy
序文
この規格は,2009年に第1版として発行されたISO 27447を基とし,技術的内容を変更して作成した日
本産業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JEに示す。
1
適用範囲
この規格は,紫外光照射後の細菌の生存数を計測することによる,光触媒を含有する加工材料及び表面
に光触媒加工フィルムを含む材料(以下,光触媒抗菌加工材料という。)の抗菌性試験方法及びその結果に
よる抗菌効果の判定について規定する。
この規格は,抗菌用途をもつ光触媒材料に適用する。光触媒材料の他の種類の機能,例えば,抗かび性,
抗ウイルス性,水浄化,セルフクリーニング,防曇及び空気浄化には適用できない。
この規格は,粉体,粒状及び多孔質な光触媒材料は含まないが,主に塗布するなどの作業によって,平
板状及び繊維状に加工した光触媒材料に対しては適用できる。
可視光領域での抗菌性を試験する場合は,この規格ではなく,JIS R 1752を適用する。
警告 この規格に基づいて試験を行う者は,微生物学技術を習得していることを前提とする。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 27447:2009,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test method for
antibacterial activity of semiconducting photocatalytic materials(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 0050 化学分析方法通則
JIS K 0557 用水・排水の試験に用いる水
JIS K 0950 プラスチック製滅菌シャーレ
JIS K 0970 ピストン式ピペット

2
R 1702:2020
JIS K 3800 バイオハザード対策用クラスIIキャビネット
JIS K 8101 エタノール(99.5)(試薬)
JIS K 8150 塩化ナトリウム(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8263 寒天(試薬)
JIS K 8576 水酸化ナトリウム(試薬)
JIS L 0803 染色堅ろう度試験用添付白布
JIS L 1902 繊維製品の抗菌性試験方法及び抗菌効果
JIS P 3801 ろ紙(化学分析用)
JIS R 1600 ファインセラミックス関連用語
JIS R 1709 ファインセラミックス−紫外線励起形光触媒試験用光源
JIS R 3505 ガラス製体積計
JIS R 3644 ガラス管類
JIS R 3645 ガラス棒
JIS Z 2801 抗菌加工製品−抗菌性試験方法・抗菌効果
JIS Z 8802 pH測定方法
3
用語及び定義
この規格で用いる主な用語及び定義は,次によるほか,JIS R 1600,JIS Z 2801及びJIS L 1902による。
3.1
光触媒(photocatalyst)
光照射下で,酸化・還元作用によって,汚染物質の分解・除去,空気浄化,抗菌,抗かび,抗ウイルス
セルフクリーニング,防曇などの機能を発現する物質。
3.2
光触媒抗菌加工(photocatalytic antibacterial treatment)
光触媒の抗菌機能を利用するために,光触媒で抗菌加工すること。単味光触媒抗菌加工及びハイブリッ
ド光触媒抗菌加工に分類される。
3.3
単味光触媒抗菌加工(simplex photocatalytic antibacterial treatment)
光触媒抗菌加工のうち,塗布,含浸,練り込みなど種々の方法によって光触媒を担持すること。また,
光照射下での光触媒の抗菌性を増強するために,光触媒と抗菌性のない他の機能性物質とを組み合わせた
材料を担持することも含む。
3.4
ハイブリッド光触媒抗菌加工(hybrid photocatalytic antibacterial treatment)
光触媒抗菌加工のうち,光が当たらない環境においても抗菌機能を発現させるために,光触媒と抗菌性
のある他の機能性物質とを組み合わせた材料を塗布,含浸,練り込みなど種々の方法によって担持するこ
と。
3.5
光触媒抗菌加工材料(photocatalytic antibacterial treated material)
光触媒抗菌加工した膜状,平板状,繊維状などの材料。単味光触媒抗菌加工,ハイブリッド光触媒抗菌
3
R 1702:2020
加工及び光触媒抗菌加工した製品を含む。
3.6
フィルム密着法(film cover method)
光触媒抗菌加工した平板状材料の光照射条件下での抗菌性を評価する試験方法。
注記 平板状のハイブリッド光触媒抗菌加工材料の光が当たらない環境での抗菌性を評価する試験方
法を,附属書JAに示す。
3.7
ガラス密着法(glass cover method)
光触媒抗菌加工した繊維状材料の光照射条件下での抗菌性を評価する試験方法。
注記 繊維状のハイブリッド光触媒抗菌加工材料の光が当たらない環境での抗菌性を評価する試験方
法は,JIS L 1902の8.1(菌液吸収法)参照。
3.8
平板状の光触媒抗菌加工材料の抗菌活性値(antibacterial activity value of photocatalytic treated flat surface
material)
紫外光照射後の光触媒抗菌加工した平板状材料と無加工材料との生菌数の対数値の差。
注記 この値には,紫外光照射しない条件で得られる生菌数の減少分も含まれる。
3.9
繊維状の光触媒抗菌加工材料の抗菌活性値(antibacterial activity value of photocatalytic treated cloth)
紫外光照射後の光触媒抗菌加工した繊維状材料と未加工布との生菌数の対数値の差。
注記 この値には,紫外光照射しない条件で得られる生菌数の減少分も含まれる。
3.10
平板状の光触媒抗菌加工材料の光照射による抗菌活性値(antibacterial activity value with UV irradiation of
photocatalytic treated flat surface material)
紫外光照射後と暗所に保存した後との光触媒抗菌加工した平板状材料の生菌数の対数値の差。
3.11
繊維状の光触媒抗菌加工材料の光照射による抗菌活性値(antibacterial activity value with UV irradiation of
photocatalytic treated cloth)
紫外光照射後と暗所に保存した後との光触媒抗菌加工した繊維状材料の生菌数の対数値の差。
3.12
抗菌効果(antibacterial efficacy)
抗菌活性値によって判定される光触媒抗菌加工による効果。
4
記号及び単位
この規格で用いる主な記号及び単位は,次による。
A:
無加工試験片の接種直後の3個の試験片の生菌数の平均値(個)
BD: 無加工試験片を暗所に保存した後の3個の試験片の生菌数の平均値(個)
BL: 無加工試験片を紫外放射照度Lで光照射した後の3個の試験片の生菌数の平均値(個)
CD: 光触媒抗菌加工した試験片を暗所に保存した後の3個の試験片の生菌数の平均値(個)
CL: 光触媒抗菌加工した試験片を紫外放射照度Lで光照射した後の3個の試験片の生菌数の平均値
(個)
4
R 1702:2020
DF: 希釈倍率
FBD: 暗所で試験した増殖値
FBL: 紫外放射照度Lで試験した増殖値
L:
紫外放射照度(mW/cm2)
Logmax:3個の試験片の生菌数の常用対数値の最大値
Logmean:3個の試験片の生菌数の常用対数値の平均値
Logmin:3個の試験片の生菌数の常用対数値の最小値
M: ガラス密着法による生菌数(個)
MBA: 無加工試験片の接種直後の3個の試験片の生菌数の算術平均値の常用対数値
MBD: 無加工試験片を暗所に保存した後の3個の試験片の生菌数の算術平均値の常用対数値
MBL: 無加工試験片を紫外放射照度Lで光照射した後の3個の試験片の生菌数の算術平均値の常用対数
値
MD: 光触媒抗菌加工した試験片を暗所に保存した後の3個の試験片の生菌数の算術平均値の常用対数
値
ML: 光触媒抗菌加工した試験片を紫外放射照度Lで光照射した後の3個の試験片の生菌数の算術平均
値の常用対数値
N:
フィルム密着法による生菌数(個)
P:
菌濃度(個/ml)
RL: 紫外放射照度Lで光照射した平板状の光触媒抗菌加工材料の抗菌活性値
ΔR: 平板状の光触媒抗菌加工材料の光照射による抗菌活性値
SL: 紫外放射照度Lでの繊維状の光触媒抗菌加工材料の抗菌活性値
ΔS: 繊維状の光触媒抗菌加工材料の光照射による抗菌活性値
V:
洗い出しに用いたSCDLP培地の液量(ml)
Z:
2枚のシャーレのコロニー数の平均値(個)
5
測定原理
この試験方法は,光触媒材料の開発,性能比較,品質管理,特徴付け,信頼性及び設計データの取得に
適している。この試験方法は,紫外光照射下において,細菌と試験片とが接触することによる光触媒材料
の抗菌性を得るために適用する。フィルム密着法は,平板状の材料に適用できる。ガラス密着法は,繊維
状材料に適用できる。
試験片をシャーレに置き,試験菌液を試験片に滴下する。次に,密着フィルム又は密着ガラスで試験菌
液を覆い,保湿ガラスをシャーレの上にかぶせる。試験片を入れたシャーレに紫外光を照射する。照射後,
試験片,及び密着フィルム又は密着ガラスから試験菌を洗い出す。この洗い出された試験菌液の生菌数を
生菌数測定法によって測定する。得られた結果は,光触媒抗菌加工した試験片と同様の条件で紫外光照射
をした無加工試験片,暗所に置いた光触媒抗菌加工した試験片及び無加工試験片の測定結果とを比較する。
6
材料
6.1
試験に用いる細菌株及び試験の準備
6.1.1
フィルム密着法に用いる細菌の種類
フィルム密着法に用いる細菌の種類は,次による。
5
R 1702:2020
a) スタフィロコッカス・アウレウス(Staphylococcus aureus):黄色ぶどう球菌
b) エシェリヒア・コリー(Escherichia coli):大腸菌
6.1.2
ガラス密着法に用いる細菌の種類
ガラス密着法に用いる細菌は,次による。
a) スタフィロコッカス・アウレウス(Staphylococcus aureus):黄色ぶどう球菌
b) クレブシェラ・ニュウモニアエ(Klebsiella pneumoniae):肺炎かん(桿)菌
6.1.3
細菌株の準備
光触媒抗菌加工した材料の種類別に,試験に用いる細菌の種類は,6.1.1及び6.1.2による。
なお,試験に用いる細菌株は,世界微生物株保存連盟(World Federation for Culture Collections)又は日本
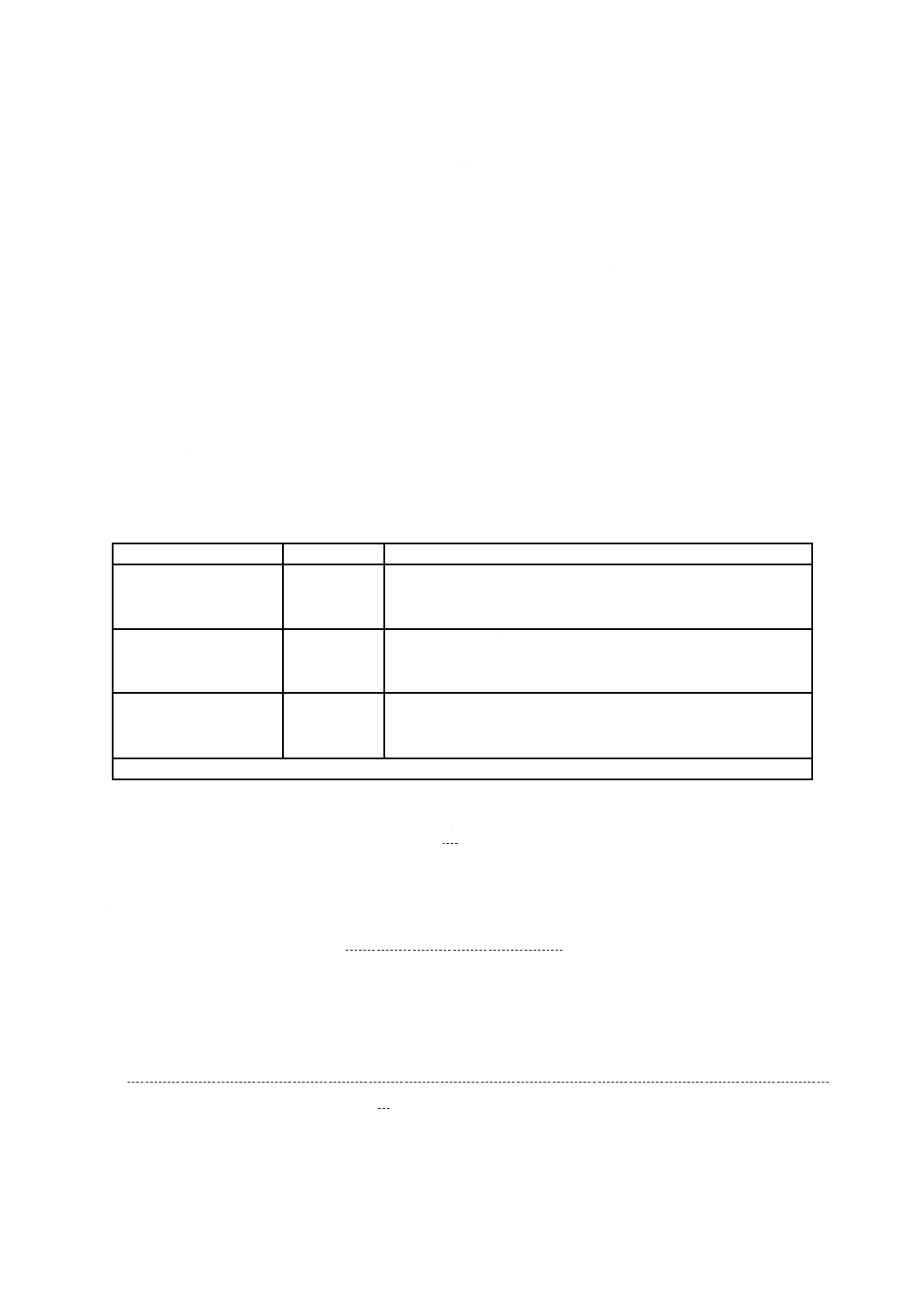
微生物資源学会に加入している機関において保存されている同一系統の菌株を使用する(表1参照)。細
菌を用いる作業は適切な安全キャビネット内で行い,取り扱う微生物のバイオセーフティレベルに必要な
設備が用意された実験室で試験する。
なお,ハザードレベル及び必要な設備については,国立感染症研究所病原体等安全管理規程などを参考
とするのがよい。
表1−試験に用いる細菌株
細菌の種類
保存番号
保存機関名
スタフィロコッカス・ア
ウレウス
(Staphylococcus aureus)
ATCC 6538P
American Type Culture Collection
DSM 346
German Collection of Microorganisms and Cell Cultures (DSMZ)
NBRC 12732
独立行政法人製品評価技術基盤機構バイオテクノロジーセンター
エシェリヒア・コリー
(Escherichia coli)
ATCC 8739
American Type Culture Collection
DSM 1576
German Collection of Microorganisms and Cell Cultures (DSMZ)
NBRC 3972
独立行政法人製品評価技術基盤機構バイオテクノロジーセンター
クレブシェラ・ニュウモ
ニアエ
(Klebsiella pneumoniae)
ATCC 4352
American Type Culture Collection
DSM 789
German Collection of Microorganisms and Cell Cultures (DSMZ)
NBRC 13277
独立行政法人製品評価技術基盤機構バイオテクノロジーセンター
必要に応じて,他の細菌を用いた追加試験をしてもよい。
6.1.4
細菌株の保存
細菌株の保管及び継代は,次によるほか,JIS L 1902の7.2(菌株の保存)による。
a) 各細菌株を6.2.4に規定するニュートリエント寒天斜面培地又は6.2.3に規定するニュートリエント寒
天培地で16時間〜24時間,37 ℃±1 ℃で培養し,その後5 ℃〜10 ℃で保存する。
b) a)の過程を再度行うことによって,1か月以内に継代培養を繰り返す。
c) ニュートリエント寒天斜面培地又はニュートリエント寒天培地で培養したものは,1か月以上の使用
はできない。
d) 保存機関から入手した菌株は,初代から数えて10回までの継代培養とする。凍結乾燥,凍結などの長
期間保存可能な方法で保存した菌株にあっては,菌株保存機関から分譲された菌株を,保存菌株を作
製するために元株から培養した継代回数を保存菌株の継代回数とする。この保存菌株を試験に用いる
場合は,10回から保存菌株の継代回数を引いた回数を使用限度とする。最大継代回数は,保存機関か
ら入手してから10回までとする。JIS L 1902の7.2に規定する保存方法を用いる場合でも,最大継代
回数は,保存機関から入手して10回までとする。

6
R 1702:2020
6.2
試薬及び材料
試験に用いる試薬及び材料は,6.2.1〜6.2.19による。
なお,培地は,同一成分であれば,市販のものを用いることができ,また,作成する培地量は,試験片
の数に合わせて変更することができる。
6.2.1
1/500濃度普通ブイヨン培地(以下,1/500 NBという。) JIS Z 2801の5.4 a)(普通ブイヨン培地)
に規定する方法による。
6.2.2
ニュートリエント培地 精製水1 000 mlに対して化学はかりで肉エキス3.0 g及びペプトン5.0 g
を計量し,フラスコに入れて混合し,内容物を十分に溶解した後,pH6.8±0.2(25 ℃)になるように0.1 mol/l
水酸化ナトリウム溶液で調整し,必要に応じて試験管又は三角フラスコに分注し,綿栓をして高圧蒸気殺
菌する。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。調製後,1か月以上過ぎたニ
ュートリエント培地は,用いてはならない。
6.2.3
ニュートリエント寒天培地 精製水1 000 mlに対して化学はかりで肉エキス3.0 g及びペプトン5.0
gを計量し,フラスコに入れて混合し,内容物を十分に溶解した後,pH6.8±0.2(25 ℃)になるように0.1
mol/l水酸化ナトリウム溶液で調整する。これに化学はかりで計量した寒天粉末15.0 gを加え,沸騰する水
浴中で加熱するか又は他の方法を用いて内容物を十分に溶解した後,綿栓をして高圧蒸気殺菌する。調製
後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。調製後,1か月以上過ぎたニュートリエン
ト寒天培地は,用いてはならない。菌液を混釈する場合は,培地の温度を45 ℃〜48 ℃にしておく。
6.2.4
ニュートリエント寒天斜面培地 試験管をあらかじめ温めて溶解した6.2.3に規定するニュートリ
エント寒天培地を約10 ml注ぎ,綿栓をして高圧蒸気殺菌し,殺菌終了後,清浄な室内に試験管を水平面
に対して約15°傾けて置き,内容物を凝固させる。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温
度で保存する。凝結水がなくなったものは溶解し,再び凝固させて使用する。調製後,1か月以上過ぎた
ニュートリエント寒天斜面培地は,用いてはならない。
6.2.5
SCDLP培地 JIS Z 2801の5.4 e)(SCDLP培地)に規定する方法による。
6.2.6
生理食塩水 生理食塩水の調製は,JIS L 1902の6.7(生理食塩水)に規定する方法による。調製
後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。調製後,1か月以上過ぎた生理食塩水は,
用いてはならない。
6.2.7
洗い出し用生理食塩水 洗い出し用生理食塩水の調製は,JIS L 1902の6.20(洗い出し用生理食塩
水)に規定する方法による。調製後,直ちに使用しないものは,5 ℃〜10 ℃の温度で保存する。調製後,
1か月以上過ぎた洗い出し用生理食塩水は,用いてはならない。
6.2.8
普通寒天培地 JIS Z 2801の5.4 b)(普通寒天培地)に規定する方法による。
6.2.9
普通寒天斜面培地 JIS Z 2801の5.4 d)(斜面培地)に規定する方法による。
6.2.10 りん酸緩衝生理食塩水 JIS Z 2801の5.4 g)(りん酸緩衝生理食塩水)に規定する方法による。
6.2.11 標準寒天培地 JIS Z 2801の5.4 c)(標準寒天培地)に規定する方法による。
6.2.12 エタノール(C2H5OH) JIS K 8101に規定する特級を用いる。
6.2.13 寒天 JIS K 8263に規定する特級を用いる。
6.2.14 塩化ナトリウム(NaCl) JIS K 8150に規定する特級を用いる。
6.2.15 精製水 JIS K 0557に規定するA2又はA3に適合するものを用いる。
6.2.16 非イオン界面活性剤 ポリオキシエチレンソルビタンモノオレエート[ポリソルベート80
(Tween80)]
注記 ポリソルベート80(Tween80)は,市販製品の一例である。この情報は,この規格の利用者の
7
R 1702:2020
便宜を図って記載するもので,この製品を推奨するものではない。
6.2.17 水酸化ナトリウム(NaOH) JIS K 8576に規定する特級のものを用いる。
6.2.18 塩酸(HCl) JIS K 8180に規定する特級のものを用いる。
6.2.19 綿標準布 JIS L 0803に規定する綿100 %の添付白布(綿3-1号)を用いて,洗剤及び漂白剤を使
用せず,60 ℃の水温で10分間水洗い後,すすぎ5分を2回繰り返し,この一連の処理を10回繰り返し,
風乾したものを用いる。
6.3
殺菌方法
殺菌方法は,高圧蒸気殺菌とし,JIS Z 2801の5.3 b)(高圧蒸気殺菌)による。
7
装置及び機器
装置及び機器は,次による。
7.1
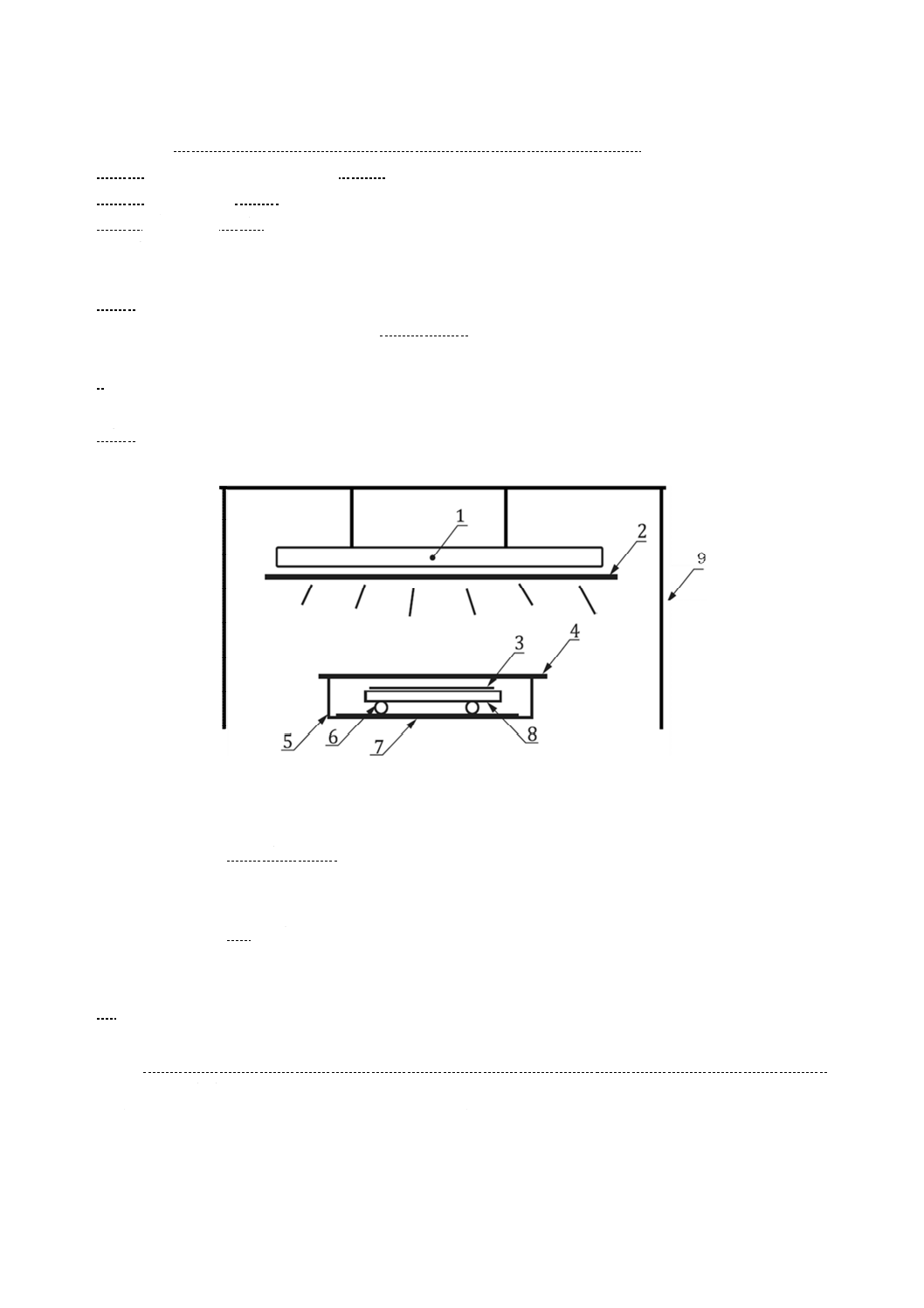
試験装置 試験装置は,7.9に示す光照射装置,7.8に示す光源及び試験片を備えたチャンバから成
る。試験装置の概略を図1に示す。
1
光源
2
金属製遮光板
3
密着フィルム又は密着ガラス
4
保湿用ガラス
5
保存シャーレ
6
ガラス管又はガラス棒
7
調湿用ろ紙
8
試験片
9
光照射装置
図1−試験装置の概略
7.2
密着フィルム 微生物の発育に影響を及ぼさない材質で,吸水性がなく,密着性がよく,波長340 nm
〜380 nmの透過率が85 %以上のフィルム。密着フィルムの大きさは,40 mm±2 mm角の正方形を標準と
する。試験片が標準の大きさ以外の場合は,密着フィルムが試験片より内側となるように大きさを調整す
る。ただし,密着フィルムの大きさは,800 mm2より大きくする。
透過率の測定は,分光光度計の試料ホルダの光が透過する面に,測定するフィルムを貼り付け,測定す
る波長範囲について1 nm刻みで透過度を計測し,試料ホルダに何も貼らない状態で計測した透過度を対
照として,透過率(%T)を求める。
8
R 1702:2020
注記 密着フィルムの透過率の測定例を附属書Bに示す。
7.3
密着ガラス 厚さが1.1 mm以内で,波長340 nm〜380 nmの透過率が85 %以上のガラス板。密着ガ
ラスの大きさは,50 mm±2 mm角の正方形とする。
透過率の測定は,分光光度計の試料ホルダの光が透過する面に,測定するフィルムを貼り付け,測定す
る波長範囲について1 nm刻みで透過度を計測し,試料ホルダに何も貼らない状態で計測した透過度を対
照として,透過率(%T)を求める。
注記 密着ガラスの透過率の測定例を附属書Bに示す。
7.4
保湿用ガラス 厚さが1.1 mm以内で,波長340 nm〜380 nmの透過率が85 %以上のガラス板をシャ
ーレ全面が覆えるサイズに切断したもの。
透過率の測定は,分光光度計の試料ホルダの光が透過する面に,測定するフィルムを貼り付け,測定す
る波長範囲について1 nm刻みで透過度を計測し,試料ホルダに何も貼らない状態で計測した透過度を対
照として,透過率(%T)を求める。
7.5
保存シャーレ 内径約90 mmのガラス製,又はJIS K 0950に規定する90A号若しくは90B号。
7.6
調湿用ろ紙 JIS P 3801に規定する微生物の発育に影響を及ぼさないろ紙で,試験片を置く容器に入
るよう切断したもの。
調湿用ろ紙は,吸水性によって1枚から4枚程度が必要である。
7.7
ガラス管・ガラス棒 JIS R 3644に規定するガラス管又はJIS R 3645に規定するガラス棒を試験片
を置く容器に入るように切断したもの。
7.8
光源 JIS R 1709に規定するブラックライトブルー形紫外線蛍光ランプ(BLBランプ)又はブラッ
クライト形紫外線蛍光ランプ(BLランプ)。
7.9
光照射装置 光源が設置でき,周囲からの光を遮断することができる装置。
7.10 紫外放射照度計 JIS R 1709に規定するもので,0.001 mW/cm2まで計測できるもの。
7.11 金属製遮光板 点線の高さを調整して所定の強度を得ることができない場合には,ランプからの光
の一部が透過するように金属板に穴を開けたものを,光源の直下に設置する(図2及び図3参照)。
9
R 1702:2020
単位 mm
1
光源の位置
2
穴(φ5〜φ15)
図2−金属製遮光板の形状例(紫外放射照度0.01 mW/cm2の場合)
単位 mm
1
光源の位置
2
穴(φ5〜φ15)
図3−金属製遮光板の形状例(紫外放射照度0.001 mW/cm2の場合)
7.12 暗箱 容器内の紫外放射照度が0.001 mW/cm2未満の蓋の付いたもの。
7.13 綿栓 青梅綿を使用した栓。シリコン栓,金属栓,モルトン栓などでもよい。
7.14 シャーレ 内径約90 mmのガラス製,又はJIS K 0950に規定する90A号若しくは90B号に適合す
10
R 1702:2020
るもの。
7.15 安全キャビネット JIS K 3800に適合又は同等の性能をもつもの。
7.16 ピペット JIS K 0970若しくはJIS R 3505のクラスAに適合するもの又は同等の精度をもつもの。
7.17 化学はかり JIS K 0050に規定する化学はかり又は同等の性能をもつもの。
7.18 pH計 JIS Z 8802に適合するもの。
8
試験片
8.1
フィルム密着法
フィルム密着法で用いる試験片は,次による。
a) 平板状の材料の平らな部分を50 mm±2 mm角(厚さ10 mm以内)の正方形に切り取り,これを標準
の大きさの試験片とする。
平板状の材料を50 mm±2 mm角(厚さ10 mm以内)にカットすることが難しい,又は不可能な場
合には,1/2のサイズ(厚さ10 mm以内)にした試験片を使用してもよい。試験片の大きさを小さく
した場合,密着フィルムの大きさも小さくする。表面積800 mm2〜1 600 mm2の密着フィルムをかぶせ
ることが可能な試験片の大きさであれば,ここに規定する形状及び大きさ以外の試験片を使用しても
よい。
b) これらの試験片を,無加工試験片は9個,光触媒抗菌加工した試験片は6個準備する。無加工試験片
が準備できない場合は,ガラス板を使用する。微生物汚染及び試験片間の相互汚染に十分注意する。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源を24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は,試験前に無菌化処理を行う
ことができる(例参照)。
例 エタノール,又は水で70 %に調整したエタノールを用いて拭き取る。
8.2
ガラス密着法
ガラス密着法で用いる試験片は,次による。
a) 繊維状の材料を50 mm±2 mm角の正方形に切り取り,これを標準の大きさの試験片とする。
b) これらの試験片を,無加工試験片は9個,光触媒抗菌加工した試験片は6個準備する。微生物汚染,
試験片間の相互汚染及び汚れに十分注意する。
c) 無加工試験片が準備できない場合は,6.2.19に規定の綿標準布を使用してもよい。
綿標準布を無加工試験片として使用する場合,紫外放射照度条件によっては,試験成立条件を満足
しない場合があるので注意する。
d) 試験片ごとにガラス製シャーレに入れる。これらを金網かごに入れ,金網かごの上部全体をアルミニ
ウムはくで覆い,オートクレーブに入れ高圧蒸気殺菌する。オートクレーブから取り出した後,安全
キャビネット内でアルミニウムはくを外し,試験片を乾燥させるためにガラス製シャーレの蓋をずら
して60分程度乾燥後,ガラス製シャーレの蓋をする。
試験片表面が有機物で汚染されている場合は,1.0 mW/cm2程度の光源を24時間を上限として照射
し,有機物を除去する予備作業をしてもよい。必要に応じて,試験片は試験前に高圧蒸気殺菌などの
無菌化処理を行うことができる。
11
R 1702:2020
9
試験方法
9.1
一般事項
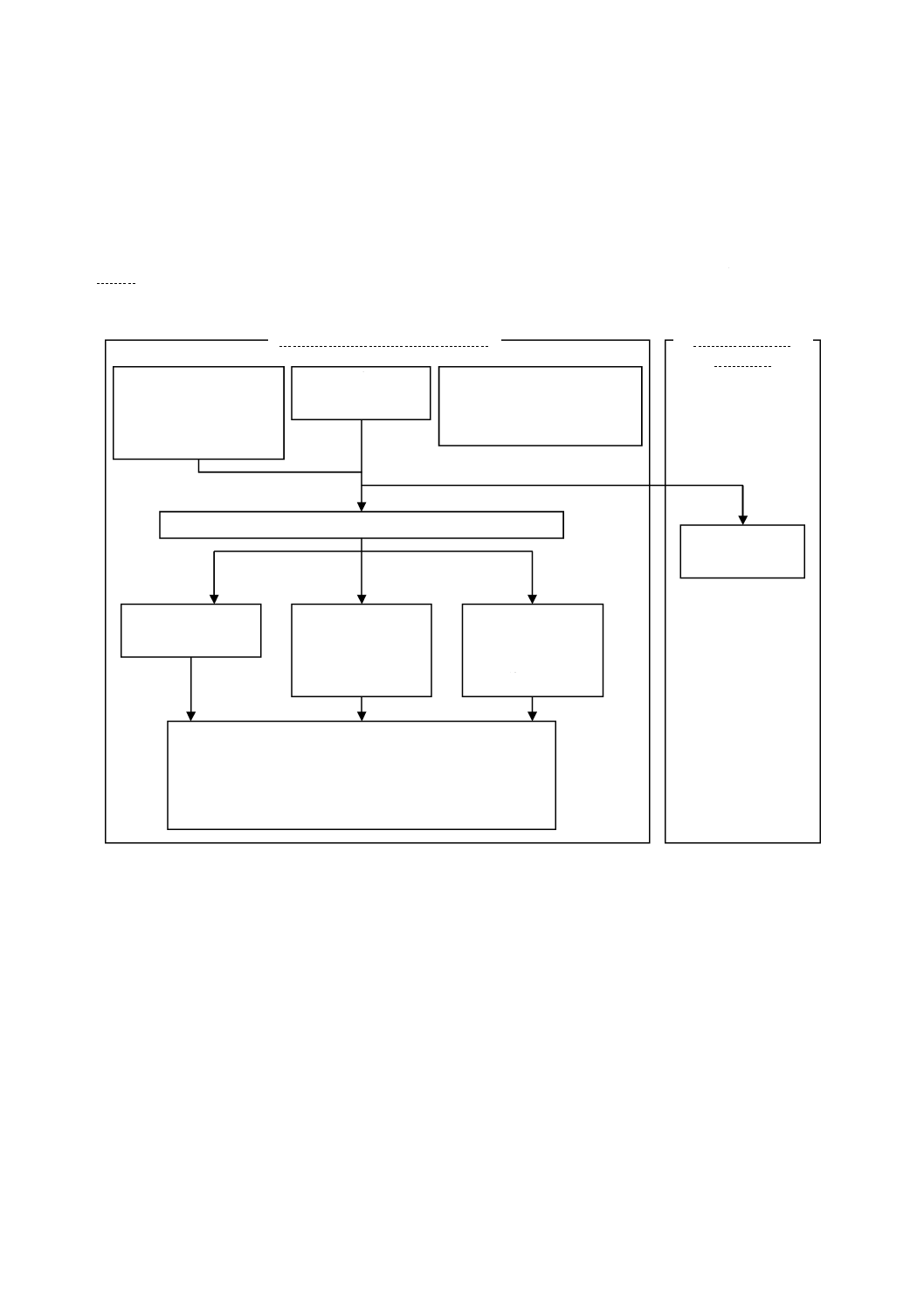
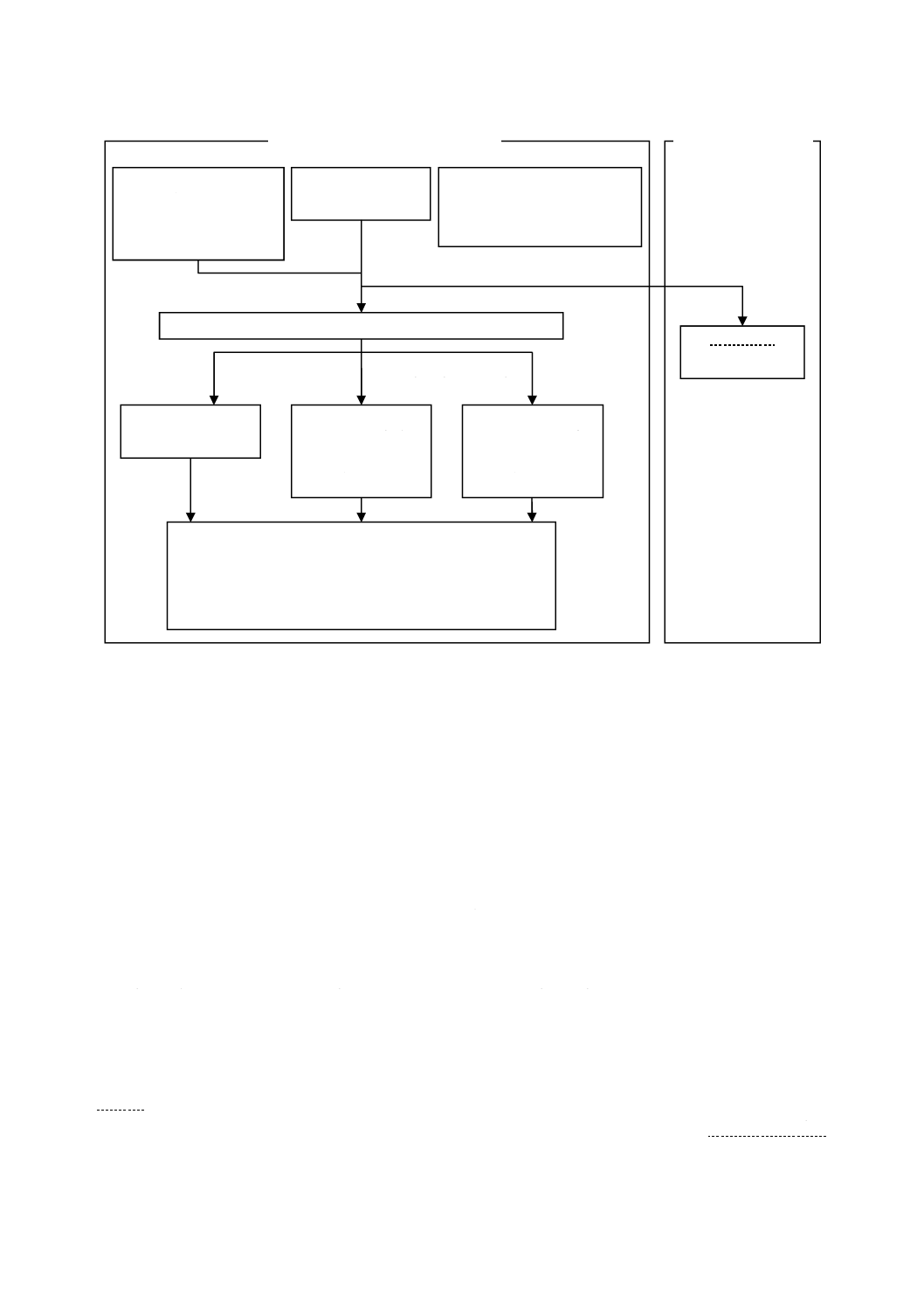
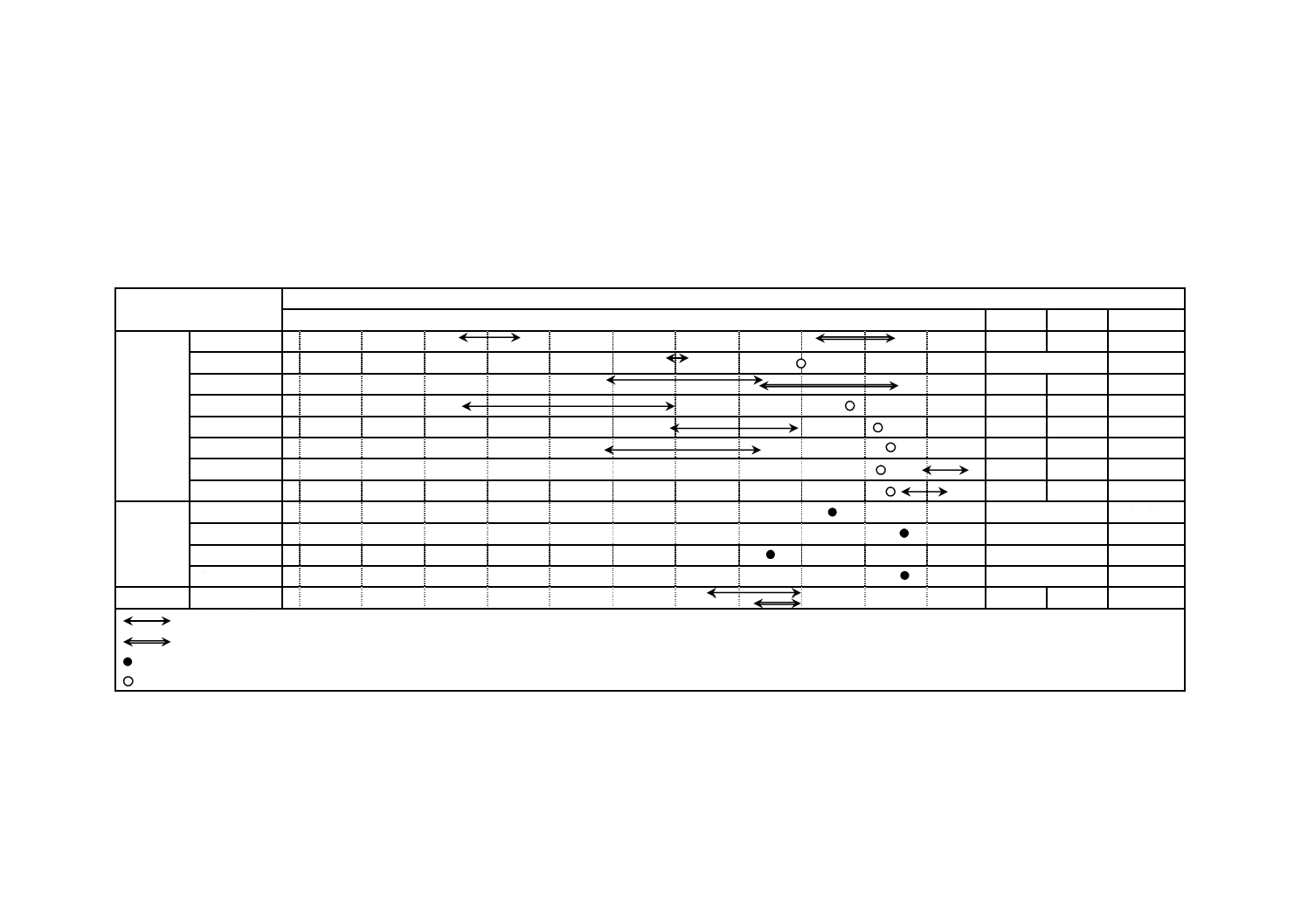
試験方法のフローチャートを図4及び図5に示す。試験片を取り扱う作業でSCDLP培地を加えるまで
の作業を行うときに,安全キャビネット内に漏れる光によって光触媒作用が働かないことを確実にするた
め,紫外放射照度計を用いて,安全キャビネットの作業台上の紫外放射照度を測定する。紫外放射照度が
0.001 mW/cm2以上の場合は,紫外放射照度が0.001 mW/cm2未満になるよう,要因を取り除いてから試験
する。
図4−フィルム密着法のフローチャート
光照射条件下でのフィルム密着法
試験片
8.1 フィルム密着法
紫外光照射条件
9.4.1 試験片設置位置の準備
(9.4.2 光照射条件)
9.2.3 試験片への試験菌液の接種(7 装置及び機器を参照)
9.5 生菌数の測定
↓
10 試験結果の計算
↓
12 試験結果の報告
光が当たらない
環境での
フィルム密着法
附属書JA
3個の加工試験片
3個の無加工試験片
3個の
無加工試験片
3個の加工試験片
3個の無加工試験片
接種後の試験片
9.4.4 暗所保存
↓
9.2.4 b) 洗い出し
接種後の試験片
9.4.3 紫外光照射
↓
9.2.4 b) 洗い出し
接種直後の試験片
9.2.4 a) 洗い出し
細菌
6.1 細菌株の準備
↓
9.3.1 試験菌液の調製
12
R 1702:2020
図5−ガラス密着法のフローチャート
9.2
フィルム密着法
9.2.1
試験菌液の調製
試験菌液の調製は,次による。
a) 6.1.4に規定する保存菌株から6.2.3に規定するニュートリエント寒天培地に1白金耳移植し,温度
37 ℃±1 ℃に設定した培養器で16時間〜24時間培養する。さらに,この培養菌から新たなニュート
リエント寒天培地に1白金耳移植し,温度37 ℃±1 ℃に設定した培養器で16時間〜20時間培養する。
b) a)で前培養した試験菌の菌体1白金耳量を少量の1/500 NBに均一に分散させ,顕微鏡による直接観察
又は他の適切な方法によって菌数を測定する。この菌液を1/500 NBを用いて適宜希釈し,菌数が約
6.7×105個/ml〜約2.6×106個/mlとなるように調製し,これを試験菌液とする。試験菌液をすぐに使
用しない場合は,氷冷(0 ℃)保存し,保存2時間以内に使用する。
9.2.2
試験片の設置
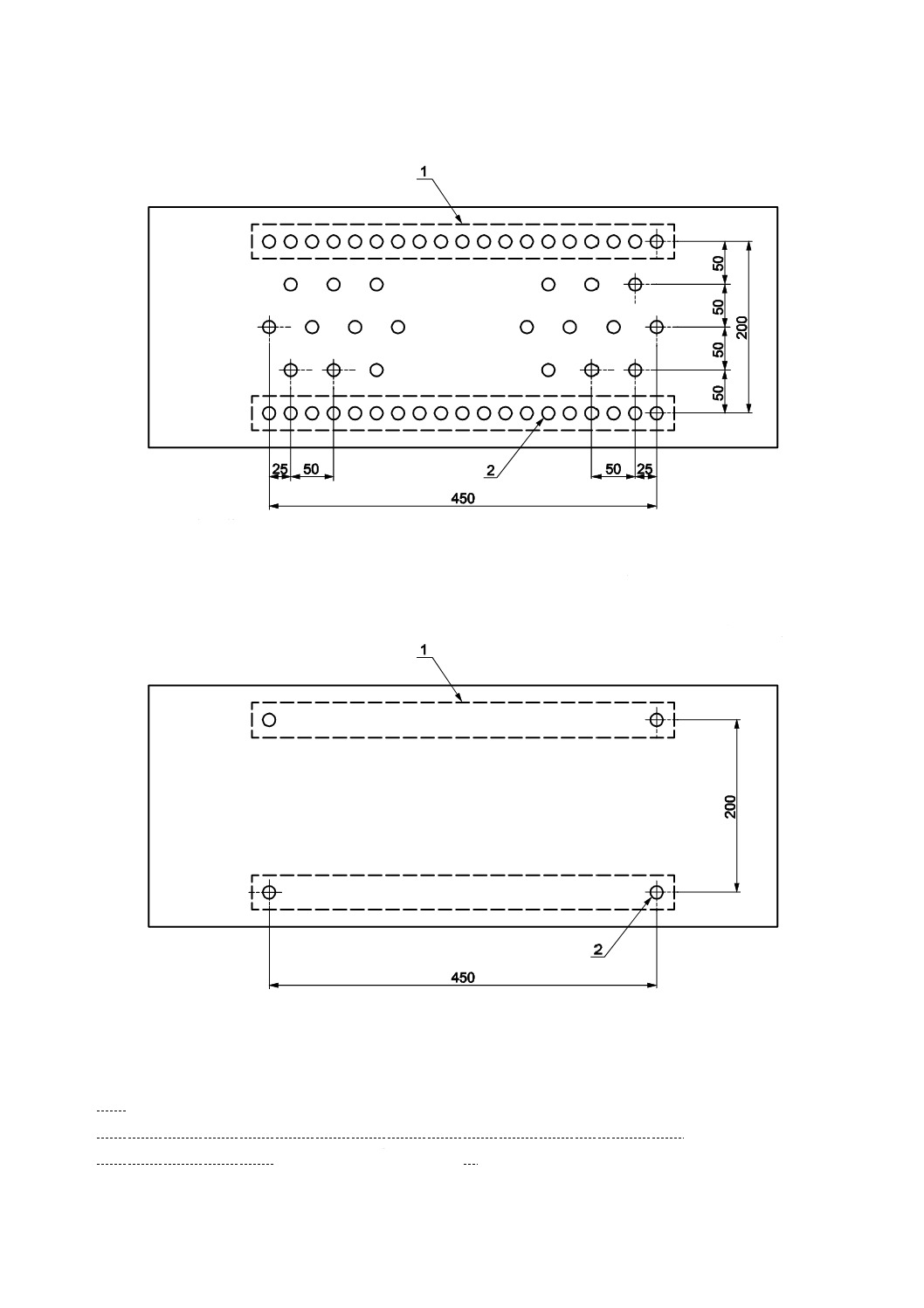
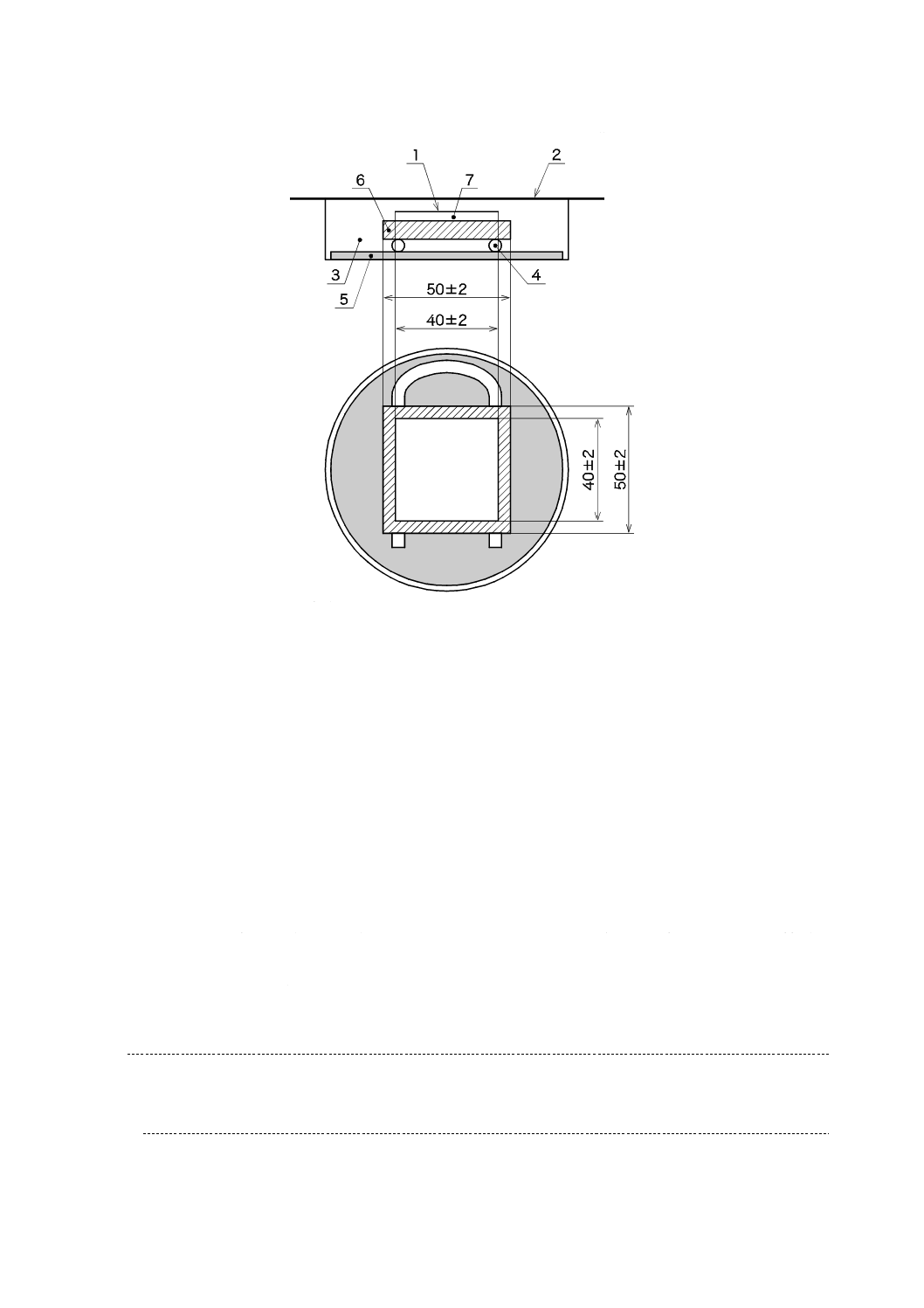
滅菌済保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙とが
触れないようガラス管又はガラス棒を置き,その上に光触媒抗菌加工した面を上にして試験片を置く(図
6参照)。試験面は,光触媒抗菌加工した試験片の表面とする。内部まで光触媒抗菌加工した試験片であっ
ても,切断面は試験面としない。また,高圧蒸気殺菌によってろ紙が湿った場合は,乾燥させてから使用
する。
滅菌水を入れすぎると,保湿用ガラスが曇り,試験に影響するので,滅菌水の量は,4 ml〜6 mlが適切
である。
光照射条件下でのガラス密着法
試験片
8.2 ガラス密着法
紫外光照射条件
9.4.1 試験片設置位置の準備
(9.4.2 光照射条件)
9.3.4 試験片への試験菌液の接種(7 装置及び機器を参照)
9.5 生菌数の測定
↓
10 試験結果の計算
↓
12 試験結果の報告
光が当たらない
環境での
ガラス密着法
JIS L 1902
8.1菌液吸収法
3個の加工試験片
3個の無加工試験片
3個の
無加工試験片
3個の加工試験片
3個の無加工試験片
接種後の試験片
9.4.4 暗所保存
↓
9.3.5 b) 洗い出し
接種後の試験片
9.4.3 紫外光照射
↓
9.3.5 b) 洗い出し
接種直後の試験片
9.3.5 a) 洗い出し
細菌
6.1 細菌株の準備
↓
9.3.1 試験菌液の調製
13
R 1702:2020
単位 mm
1
密着フィルム
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験菌液
図6−フィルム密着法試験片及び保湿用ガラスの組立て
9.2.3
試験菌液の接種
試験菌液の接種は,次による。
a) 9.2.1に規定する試験菌液をピペットで0.15 ml採取し,これを試験菌液として,9.2.2に規定する各試
験片に滴下する。滴下した試験菌液の上に密着フィルムをかぶせ,試験菌液が密着フィルムの端から
こぼれないように注意しながら試験菌液が密着フィルム全体に行き渡るように軽く押さえ付けた後,
保湿用ガラスを載せる(図6参照)。標準の大きさ以外の試験片の場合,試験菌液の接種量は,被覆す
る密着フィルムに合わせて調整する。この手順を試験に使用する試験片(可視光応答形光触媒抗菌加
工した試験片は6個,無加工試験片は9個)全てに行う。
密着フィルムは,あらかじめ裁断したものをエタノールを吸収させた局方ガーゼ又は,脱脂綿を用
いて両面を拭くか,エタノールで両面を拭いた密着フィルムを無菌的に裁断したものを使用すること
が望ましい。また,保湿用ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いた
後,十分に乾燥してから使用することが望ましい。
規定に基づく試験菌液量を接種したとき,密着フィルム全体に行き渡らなかったり,密着フィルム
の端から試験菌液が漏れ出す場合がある。このような場合は,接種試験菌液量を規定量の2倍から1/2
14
R 1702:2020
を限度に調整してもよい。ただし,試験片に接種する試験菌液量を変更した場合においても,1試験
片当たり1.0×105個〜4.0×105個とする。この場合,試験菌液の菌数は,9.2.1 b)の規定によらず,接
種試験菌液量から換算して調整する。
b) 試験菌液接種直後の生菌数測定用の3個の無加工試験片を除いて,試験菌液を接種した後,速やかに,
9.4に規定する光照射試験に進む。
9.2.4
試験菌の洗い出し
試験菌液の洗い出しは,次による。
a) 試験菌液接種直後の試験片 試験菌液接種直後の生菌数測定用の3個の無加工試験片については,密
着フィルム及び無加工試験片を滅菌ピンセットを用い,試験菌液が漏れないように注意しながら,ス
トマッカー袋に入れる。10 mlのSCDLP培地を加え,ストマッカー袋の外側から試験片及びフィルム
を手で十分にもみ,試験菌を洗い出す。この洗い出し液は速やかに9.5に規定する測定を行う。同等
の結果が得られる場合は,ストマッカー袋に代わるものを用いてもよい。
試験片の大きさによって,SCDLP培地10 mlで洗い出しが困難な場合は,液量を増やしてもよい。
b) 試験後の試験片 9.4.3及び9.4.4に規定する試験片について,a)と同様に試験菌を洗い出す。この洗
い出し液は,速やかに9.5に規定する測定を行う。
9.3
ガラス密着法
9.3.1
試験菌の培養
試験菌液の培養は,次による。
a) 培養A 6.1.3に規定する保存菌を6.2.3に規定するニュートリエント寒天培地に1白金耳移植し,温
度37 ℃±1 ℃で24時間〜48時間培養する。この平板は,5 ℃〜10 ℃で保存し,1週間以上保存し
たものは用いてはならない。また,一度コロニーを採取した平板は,再度用いてはならない。
b) 培養B 100 ml三角フラスコに6.2.2に規定するニュートリエント培地20 mlを入れ,培養Aの平板か
ら1白金耳移植し,培養する。培養条件は,次による。
なお,培養Bの菌濃度は,吸光光度法又は光学顕微鏡観察法を用いて推定する。
− 温度 37 ℃±1 ℃
− 振とう数 110 rpm。振幅は3 cmを目安とする。
− 時間 18時間〜24時間
c) 培養C 100 mlの三角フラスコに6.2.2に規定するニュートリエント培地20 mlを入れる。培養Bの菌
濃度1×108個/ml〜2×108個/mlの菌液0.4 mlを加え,培養する。培養条件は,次による。
− 温度 37 ℃±1 ℃
− 振とう数 110 rpm。振幅は3 cmを目安とする。
− 時間 3時間±1時間
− 培養後の目標菌数 107個/ml
9.3.2
試験菌液の調製
培養Cの菌濃度を,吸光光度法又は光学顕微鏡観察法を用いて推定する。6.2.2に規定するニュートリエ
ント培地を精製水を用いて室温で20倍に希釈し,氷冷する。これを用いて,培養Cの菌濃度を7.0×104
個/ml〜1.3×105個/mlに調製し,これを試験菌液とする。試験菌液をすぐに使用しない場合は,氷冷(0 ℃)
保存し,保存4時間以内に使用する。
9.3.3
試験片の設置
滅菌済保存シャーレの底に,滅菌した調湿用ろ紙を置き,滅菌水を適量入れ,試験片と調湿用ろ紙とが
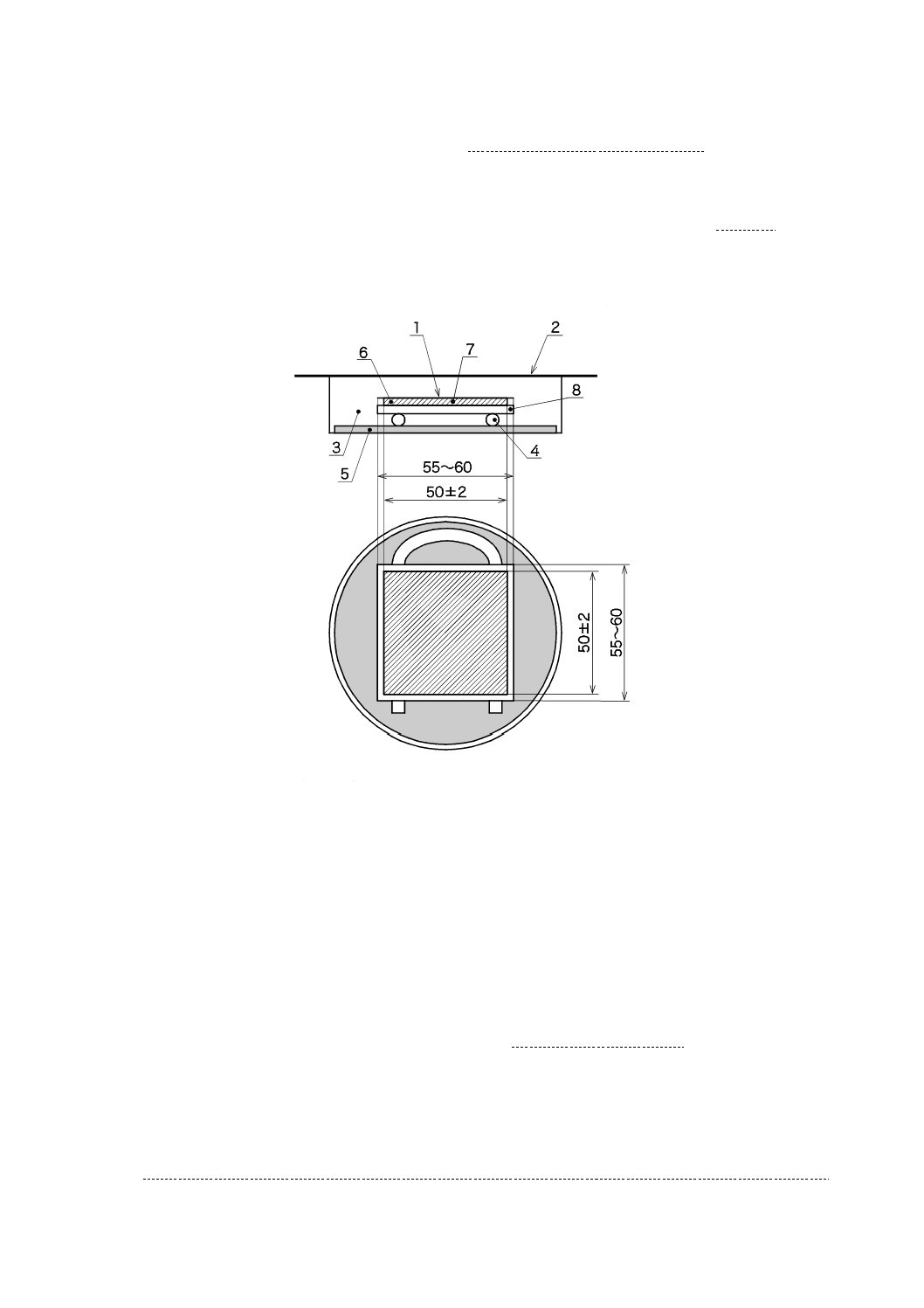
15
R 1702:2020
触れないようガラス管又はガラス棒を置き,その上に一辺が55 mm〜60 mmの正方形の殺菌したガラス板
を置く。その上に光触媒抗菌加工した面を上にして試験片を置く(図7参照)。高圧蒸気殺菌によってろ
紙が湿った場合は,乾燥させてから使用する。
滅菌水を入れすぎると,保湿用ガラスが曇り,試験に影響するので,滅菌水の量は,4.0 ml〜6.0 mlが適
切である。また,ガラス板は,ガラスの全面をエタノールを吸収させた局方ガーゼ又は脱脂綿で軽く2回
〜3回拭いた後,十分に乾燥してから使用する。
単位 mm
1
密着ガラス
2
保湿用ガラス
3
保存シャーレ
4
ガラス棒・ガラス管
5
調湿用ろ紙
6
試験片
7
試験菌液
8
ガラス板
図7−ガラス密着法試験片及び保湿用ガラスの組立て
9.3.4
試験菌液の接種
試験菌液の接種は,次による。
a) 9.3.2に規定する試験菌液をピペットで0.2 ml採取し,これを試験菌液として,9.3.3に規定する各試
験片の数箇所に滴下接種する。滴下した試験菌液の上に滅菌した密着ガラスをかぶせ,試験菌液が密
着ガラスの端からこぼれないように注意しながら試験菌液が密着ガラス全体に行き渡るように軽く押
さえ付けた後,保湿用ガラスを載せる(図7参照)。この手順を試験に使用する試験片(光触媒抗菌加
工した試験片は6個,無加工試験片は9個)全てに行う。
密着ガラス及び保湿用ガラスは,エタノールを吸収させた局方ガーゼ又は脱脂綿で両面を拭いて,

16
R 1702:2020
十分に乾燥してから使用することが望ましい。
規定に基づく試験菌液量を接種したとき,試験片全体に行き渡らなかったり,試験片の端から試験
菌液が漏れ出したりする場合がある。このような場合は,接種試験菌液量を規定量の2倍から1/2を
限度に調整してもよい。ただし,試験片に接種する試験菌液は,試験片に接種する試験菌液量を変更
した場合においても,1試験片当たり1.4×104個〜2.6×104個とする。この場合,試験菌液の菌数は,
9.3.2の規定によらず,接種試験菌液量から換算して調整する。
試験片に試験菌液を十分に浸透させるため,非イオン界面活性剤0.05 %を含む試験菌液を用いても
よい。試験菌液に非イオン界面活性剤を使用した場合は,その記録を試験報告書に記載する。
b) 試験菌液接種直後の生菌数測定用の3個の無加工試験片を除いて,試験菌液を接種した後,速やかに,
9.4に規定する光照射試験に進む。
9.3.5
試験菌の洗い出し
試験菌液の洗い出しは,次による。
a) 試験菌液接種直後の試験片 試験菌液接種直後の3個の無加工試験片については,密着ガラス,無加
工試験片及びガラス板を滅菌ピンセットで試験菌液が漏れないように注意しながら,ストマッカー袋
に入れる。20 mlの洗い出し用生理食塩水又はSCDLP培地のいずれか1種類だけを加え,ストマッカ
ー袋の外側から試験片,ガラス板及び密着ガラスを手で十分にもみ,試験菌を洗い出す。この洗い出
し液は,速やかに9.5に規定する測定を行う。また,試験菌の洗い出しについては,この方法と同等
の結果が得られる場合は,ストマッカー袋に代わるものを用いてもよい。
b) 試験後の試験片 9.4.3及び9.4.4に規定する試験片について,a)と同様に試験菌を洗い出す。この洗
い出し液は,速やかに9.5に規定する測定を行う。
9.4
紫外光照射条件
9.4.1
紫外放射照度の測定及び試験片設置位置の準備
試験装置の試験片表面と同じ高さに紫外放射照度計の受光部基準面を据え付ける。受光部の上に,試験
に使用する密着フィルム又は密着ガラス,及び保湿用ガラス板を置く。指示値を読み取りながら,9.4.2に
規定する紫外放射照度が得られる位置を決め,試験片設置位置とする。紫外放射照度を測定する場合は,
紫外放射照度を安定化させるため,照射装置の光源を30分以上予備点灯しておく。
9.4.2
光照射条件
紫外放射照度は,使用する状況に応じた紫外放射照度を設定して試験する(附属書JB及び附属書JC参
照)。紫外放射照度の選定の目安として,代表的な場所における紫外放射照度を表2に示す。光源の高さ
を調整することによって所定の紫外放射照度が得られない場合は,金属製遮光板を使って紫外放射照度を
減衰させて設定する。
なお,紫外光による細菌の損傷を避けるために,0.25 mW/cm2を上限とする。
注記 細菌への紫外光照射による損傷については,附属書Cを参照。
表2−代表的な場所における紫外放射照度
紫外放射照度
代表的な場所
0.25 mW/cm2
昼間の窓際,光触媒機能を作用させるために使用される光源などを使う場合
0.10 mW/cm2
昼間の室内(太陽光が入る窓から1.5 m程度内側まで),朝又は夕方の窓際
0.01 mW/cm2
昼間の室内(太陽光が入る窓から3 m程度内側まで)
0.001 mW/cm2
太陽光が入らない昼間の室内,夜間の室内(蛍光灯の紫外線)
17
R 1702:2020
9.4.3
試験菌液を接種した試験片の光照射
試験菌液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び光触媒抗菌加工した試験片3
個)を,9.4.1で準備した試験片設置位置へ置き,8時間光照射する。この操作の間は,試験片周囲の温度
を25 ℃±3 ℃に保つ。
光触媒抗菌加工材料の用いられる場所の実情を考慮して,光照射時間を4時間を下限として短くしても
よい。
9.4.4
試験菌液を接種した試験片の暗所での保存
試験菌液を接種した試験片を入れた保存シャーレ(無加工試験片3個及び光触媒抗菌加工した試験片3
個)を,9.4.3に規定する試験と同じ時間,7.12に規定する暗箱の中に保存する。この操作の間は,試験片
周囲の温度を25 ℃±3 ℃に保つ。
保存シャーレを覆う保湿用ガラスの代わりに,保存シャーレの蓋を用いてもよい。
9.5
生菌数の測定
9.2.4 a),9.2.4 b),9.3.5 a)及び9.3.5 b)に規定する洗い出し液を滅菌したピペットで1.0 ml採り,6.2.6に
規定する生理食塩水9.0 ml±0.1 mlが入った試験管に加え,十分にかくはんする。さらに,この試験管か
ら1.0 mlを新しいピペットで採り,6.2.6に規定する生理食塩水9.0 ml±0.1 mlが入った別の試験管に加え,
十分にかくはんする。この操作を順次繰り返して,10倍希釈法による希釈系列を作製し,各希釈系列の試
験管からそれぞれ別のシャーレ2枚に新しいピペットで1.0 ml採り,45 ℃〜48 ℃に保温した6.2.3に規
定するニュートリエント寒天培地15 ml〜20 mlを入れ,蓋をして15分間室温で放置する。培地が凝固し
たら,シャーレを倒置し,37 ℃±1 ℃に設定した培養器で40時間〜48時間培養する。培養後,30個〜300
個のコロニーが現れた希釈系列のシャーレのコロニー数を測定し,洗い出し液の菌濃度を式(1)によって有
効数字2桁まで求める。
P=Z×DF ················································································· (1)
ここに,
P: 菌濃度(個/ml)
Z: 2枚のシャーレのコロニー数の平均値(個)
DF: 希釈倍率
洗い出し液1.0 mlを用いたシャーレのコロニー数が30個未満の場合は,測定した集落数をコロニー数
として菌濃度を算出する。また,洗い出し液1.0 mlを用いたシャーレから生残菌が認められない場合は,
コロニー数に“1”を用いて菌濃度を算出する。
なお,同一の希釈系列以外で30個〜300個のコロニーが現れるなど,ここで規定する以外のコロニー数
の採用方法については,公益社団法人日本薬学会編 衛生試験法・注解(2015)の1.2(微生物試験法)1.2.1.1
(細菌一般試験法)3)(菌数測定)(1)(混釈平板培養法),又は厚生労働省監修 食品衛生検査指針微生物
編(2015) の第2章(細菌) 2(衛生指標菌) 1(細菌数)を参考とするのがよい。
10 試験結果の計算
10.1 一般事項
試験結果は,次のように計算する。
a) 3個の試験片の生菌数の平均値は,10.2.1及び10.3.1に規定する方法で求めた数値を用いて計算し,抗
菌活性値の計算時には,四捨五入しない数値を用いる。
b) 得られた抗菌活性値は,小数点2桁目を四捨五入する。
c) 報告書に記載する平均値は,有効数字3桁目を四捨五入して有効数字2桁とした数値を用いる。
18
R 1702:2020
注記 試験結果例を附属書Aに示す。
10.2 フィルム密着法
10.2.1 生菌数の計算
9.5によって求めた菌濃度を用い,式(2)によって生菌数を求める。
N=P×V ·················································································· (2)
ここに,
N: フィルム密着法による生菌数(個)
P: 9.5によって求めた菌濃度(個/ml)
V: 洗い出しに用いたSCDLP培地の液量(ml)
洗い出し液1.0 mlを用いたシャーレから生残菌が認められない場合は,生菌数は“<10”と表示し(V
が10 mlの場合),10.2.2では,“10”を用いて計算する。
10.2.2 試験結果の計算
試験結果は,次による。
a) 試験成立条件 次の4項目の試験成立条件を全て満たすとき,その試験は有効と判定する。1項目で
も条件を満足しない場合は,試験不成立と判定し,再度試験を実施する。
1) 無加工試験片の接種直後の生菌数の対数値について,次の式(3)が成立する。
(Logmax−Logmin)/(Logmean)≦0.2 ······················································· (3)
ここに,
Logmax: 3個の試験片の生菌数の常用対数値の最大値
Logmin: 3個の試験片の生菌数の常用対数値の最小値
Logmean: 3個の試験片の生菌数の常用対数値の平均値
2) 無加工試験片の接種直後の生菌数の平均値は,1.0×105個〜4.0×105個である。
3) 無加工試験片の光照射後の生菌数は,3個の値が全て1.0×103個以上である。ただし,無加工試験
片にガラス板を用いた場合は,光照射後の生菌数の値が全て1.0×104個以上とする。
4) 無加工試験片の暗所に保存した後の生菌数は,3個の値が全て1.0×103個以上である。ただし,無
加工試験片にガラス板を用いた場合は,暗所に保存した後の生菌数の値が全て1.0×104個以上とす
る。
b) 平板状の光触媒抗菌加工材料の抗菌活性値の計算 試験成立時の平板状の光触媒抗菌加工材料の抗
菌活性値の計算は,式(4)による。
RL=log(BL/A)−log(CL/A)=log(BL/CL) ·············································· (4)
ここに,
RL: 紫外放射照度Lで光照射した平板状の光触媒抗菌加工材料の
抗菌活性値
L: 紫外放射照度(mW/cm2)
A: 無加工試験片の接種直後の3個の試験片の生菌数の平均値
(個)
BL: 無加工試験片を紫外放射照度Lで光照射した後の3個の試験
片の生菌数の平均値(個)
CL: 光触媒抗菌加工した試験片を紫外放射照度Lで光照射した後
の3個の試験片の生菌数の平均値(個)
c) 平板状の光触媒抗菌加工材料の光照射による抗菌活性値の計算 平板状の光触媒抗菌加工材料の光
照射による抗菌活性値の計算は,式(5)による。
ΔR=log(BL/CL)−[log(BD/A)−log(CD/A)]=log(BL/CL)−log(BD/CD) ··········· (5)
ここに,
ΔR: 平板状の光触媒抗菌加工材料の光照射による抗菌活性値
BD: 無加工試験片を暗所に保存した後の3個の試験片の生菌数の
平均値(個)
CD: 光触媒抗菌加工した試験片を暗所に保存した後の3個の試験
19
R 1702:2020
片の生菌数の平均値(個)
10.3 ガラス密着法
10.3.1 生菌数の計算
9.5によって求めた菌濃度を用い,式(6)によって生菌数を求める。
M=P×20 ················································································ (6)
ここに,
M: ガラス密着法による生菌数(個)
P: 9.5によって求めた菌濃度(個/ml)
20: 洗い出しに用いた生理食塩水又はSCDLP培地の量(ml)
洗い出し液1.0 mlを用いたシャーレから生残菌が認められない場合は,洗い出し液に20 mlを用いてい
ることから生菌数は“<20”と表示し,10.3.2では,“20”を用いて計算する。
10.3.2 試験結果の計算
試験結果は,次による。
a) 試験成立条件 試験成立の判定は,増殖値によって行う。増殖値を式(7)及び式(8)によって求め,小数
点2桁目を四捨五入する。増殖値が0を超える場合は,試験成立と判定し,増殖値が0以下の場合は,
試験不成立と判定し,再度試験を実施する。
FBL=MBL−MBA ········································································· (7)
ここに, FBL: 紫外放射照度Lで試験した増殖値
L: 紫外放射照度(mW/cm2)
MBL: 無加工試験片を紫外放射照度Lで光照射した後の3個の試験
片の生菌数の算術平均値の常用対数値
MBA: 無加工試験片の接種直後の3個の試験片の生菌数の算術平均
値の常用対数値
FBD=MBD−MBA ········································································· (8)
ここに, FBD: 暗所で試験した増殖値
MBD: 無加工試験片を暗所に保存した後の3個の試験片の生菌数の
算術平均値の常用対数値
b) 繊維状の光触媒抗菌加工材料の抗菌活性値の計算 試験成立時の繊維状の光触媒抗菌加工材料の抗
菌活性値の計算は,式(9)による。
SL=MBL−ML ············································································ (9)
ここに,
SL: 紫外放射照度Lでの繊維状の光触媒抗菌加工材料の抗菌活性
値
ML: 光触媒抗菌加工した試験片を紫外放射照度Lで光照射した後
の3個の試験片の生菌数の算術平均値の常用対数値
c) 繊維状の光触媒抗菌加工材料の光照射による抗菌活性値の計算 繊維状の光触媒抗菌加工材料の光
照射による抗菌活性値の計算は,式(10)による。
ΔS=(MBL−ML)−(MBD−MD)······················································· (10)
ここに,
ΔS: 繊維状の光触媒抗菌加工材料の光照射による抗菌活性値
MD: 光触媒抗菌加工した試験片を暗所に保存した後の3個の試験
片の生菌数の算術平均値の常用対数値
11 抗菌効果の判定
抗菌効果の有無の判定は,試験方法によって区分し,次による。
a) 光照射条件下でのフィルム密着法による判定 10.2.2 b) の式(4)によって算出した平板状の光触媒抗
菌加工材料の抗菌活性値が2.0以上のとき,平板状の光触媒抗菌加工材料は抗菌効果があるものと判

20
R 1702:2020
定する。受渡当事者間の協定によって,2.0を上回る数値をもって抗菌効果の有無を判定してもよい。
なお,平板状の光触媒抗菌加工材料の光照射による抗菌活性値は,10.2.2 c) の式(5)によって算出す
る。
b) 光が当たらない環境でのフィルム密着法による判定 附属書JAによって算出した平板状のハイブリ
ッド光触媒抗菌加工材料の抗菌活性値が2.0以上のとき,平板状のハイブリッド光触媒抗菌加工材料
は,光が当たらない環境においても抗菌効果があるものと判定する。受渡当事者間の協定によって,
2.0を上回る数値をもって抗菌効果の有無を判定してもよい。
c) 光照射条件下でのガラス密着法による判定 10.3.2 b) の式(9)によって算出した繊維状の光触媒抗菌
加工材料の抗菌活性値が2.0以上のとき,繊維状の光触媒抗菌加工材料は抗菌効果があるものと判定
する。受渡当事者間の協定によって,2.0を上回る数値をもって抗菌効果の有無を判定してもよい。
なお,繊維状の光触媒抗菌加工材料の光照射による抗菌活性値は,10.3.2 c) の式(10)によって算出
する。
d) 光が当たらない環境でのガラス密着法による判定 JIS L 1902の8.1.5.2(試験試料での試験成立の判
定及び抗菌活性値の計算)によって算出した繊維状のハイブリッド光触媒抗菌加工材料の抗菌活性値
が2.0以上のとき,繊維状のハイブリッド光触媒抗菌加工材料は,光が当たらない環境においても抗
菌効果があるものと判定する。受渡当事者間の協定によって,2.0を上回る数値をもって抗菌効果の有
無を判定してもよい。
12 試験結果の報告
試験結果の報告には,次の事項を記載する(表3参照)。
a) 規格番号及び試験方法の種類
b) 光触媒抗菌加工した試験片及び無加工試験片の種類・大きさ・形状・厚さ
c) 光源の種類,製造業者名及び品番
d) 紫外放射照度計の製造業者名及び品番
e) 有機物を除去した場合の光源の情報(種類,製造業者名及び品番,照射時間など)
f)
光照射条件(紫外放射照度,光照射時間)
g) フィルム密着法の場合
密着フィルム・保湿用ガラスの種類及び大きさ,試験に用いた細菌の種類及び細菌の保存番号,試
験菌液の接種量,試験菌液の生菌数,並びに試験値(A,BL,CL,RL,BD,CD,ΔR,並びにハイブリ
ッド型光触媒抗菌加工した試験片の場合は,附属書JAによって算出した抗菌活性値)
h) ガラス密着法の場合
密着ガラス・保湿用ガラスの種類及び大きさ,試験に用いた細菌の種類及び細菌の保存番号,試験
菌液の接種量,試験菌液の濃度,並びに試験値(SL及びΔS)
i)
ガラス密着法の場合
試験菌液に非イオン界面活性剤を添加した場合の情報(名称及び濃度)
j)
その他の必要事項
注記 光触媒による抗菌性について,異なるタイプの光触媒及び紫外放射照度について評価した結果
を,附属書JDに示す。

21
R 1702:2020
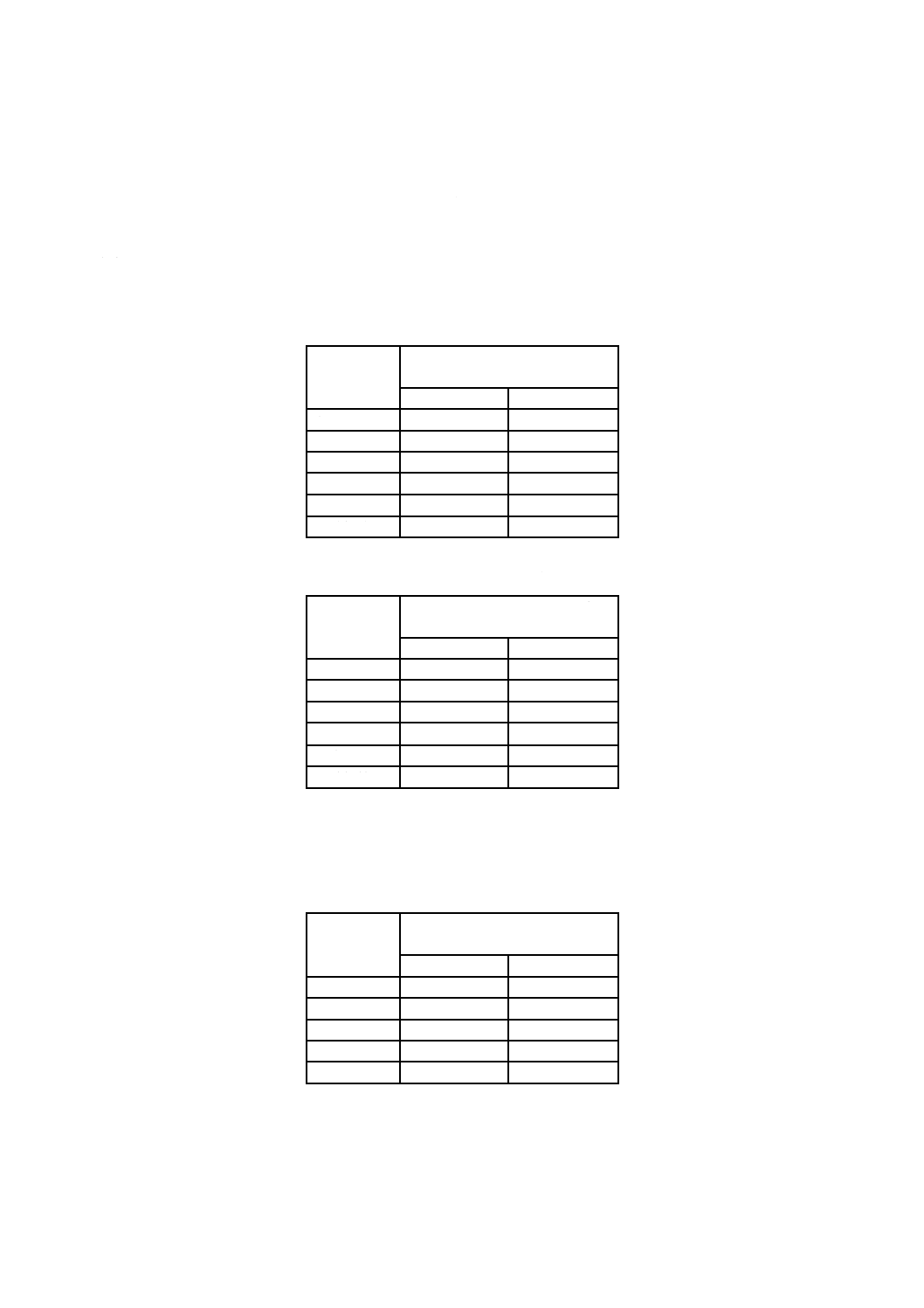
表3−試験結果の報告例
項目
記載内容
規格番号及び試験方法
JIS R 1702 フィルム密着法
光触媒抗菌加工した試験片の種類・大きさ・
形状・厚さ
単味光触媒フィルム,50 mm×50 mm×0.2 mm
無加工試験片の種類・大きさ・形状・厚さ
PETフィルム,50 mm×50 mm×0.2 mm
光源の種類,製造業者名及び品番
ブラックライト形紫外線蛍光ランプ(○○電気,FL20̲BLB)
紫外放射照度計の製造業者名及び品番
紫外放射測定器(△△製作所,本体:UV-X,受光部:UV-Y)
有機物の除去方法
FL20̲BLB,1.0 mW/cm2で24時間予備照射
光照射条件
0.1 mW/cm2で,8時間
密着フィルム又は密着ガラスの種類
ポリプロピレンフィルム(□□商会),40 mm×40 mm
保湿用ガラスの種類
ほうけい酸ガラス
試験に用いた菌種(細菌の保存株番号)
黄色ぶどう球菌(NBRC12732)
大腸菌(NBRC3972)
接種量
0.1 ml
0.1 ml
試験菌液の生菌数
2.0×106
3.2×106
A
2.0×105
3.2×105
B0.01
3.2×105
2.0×106
C0.01
5.0×102
3.1×103
R0.01
2.8
2.8
BD
3.5×105
2.2×106
CD
2.8×105
1.8×106
ΔR
2.7
2.7
22
R 1702:2020
附属書A
(参考)
試験結果例
A.1 フィルム密着法
フィルム密着法を用いた試験結果の例を,表A.1及び表A.2に示す。
表A.1−黄色ぶどう球菌に対する試験結果例
試験機関
紫外放射照度 0.01 mW/cm2
照射時間 8 h
R0.01
ΔR
A
3.4
2.9
B
2.5
2.0
C
2.3
2.3
D
3.4
3.0
平均
2.90
2.55
標準偏差
0.58
0.48
表A.2−大腸菌に対する試験結果例
試験機関
紫外放射照度0.01 mW/cm2
照射時間8 h
R0.01
ΔR
E
5.1
4.1
F
4.5
3.8
G
2.6
2.2
H
4.9
4.4
平均
4.28
3.63
標準偏差
1.14
0.98
A.2 ガラス密着法
ガラス密着法を用いた試験結果の例を,表A.3及び表A.4に示す。
表A.3−黄色ぶどう球菌に対する試験結果例
試験機関
紫外放射照度 0.01 mW/cm2
照射時間 8 h
S0.01
ΔS
I
0.9
0.2
J
0.7
−1.0
K
0.3
−0.4
平均
0.63
−0.40
標準偏差
0.31
0.60

23
R 1702:2020
表A.4−肺炎かん菌に対する試験結果例
試験機関
紫外放射照度0.01 mW/cm2
照射時間8 h
S0.01
ΔS
L
2.2
1.0
M
3.1
1.3
N
2.2
1.3
平均
2.50
1.20
標準偏差
0.52
0.17
24
R 1702:2020
附属書B
(参考)
密着フィルム及び密着ガラスの測定例
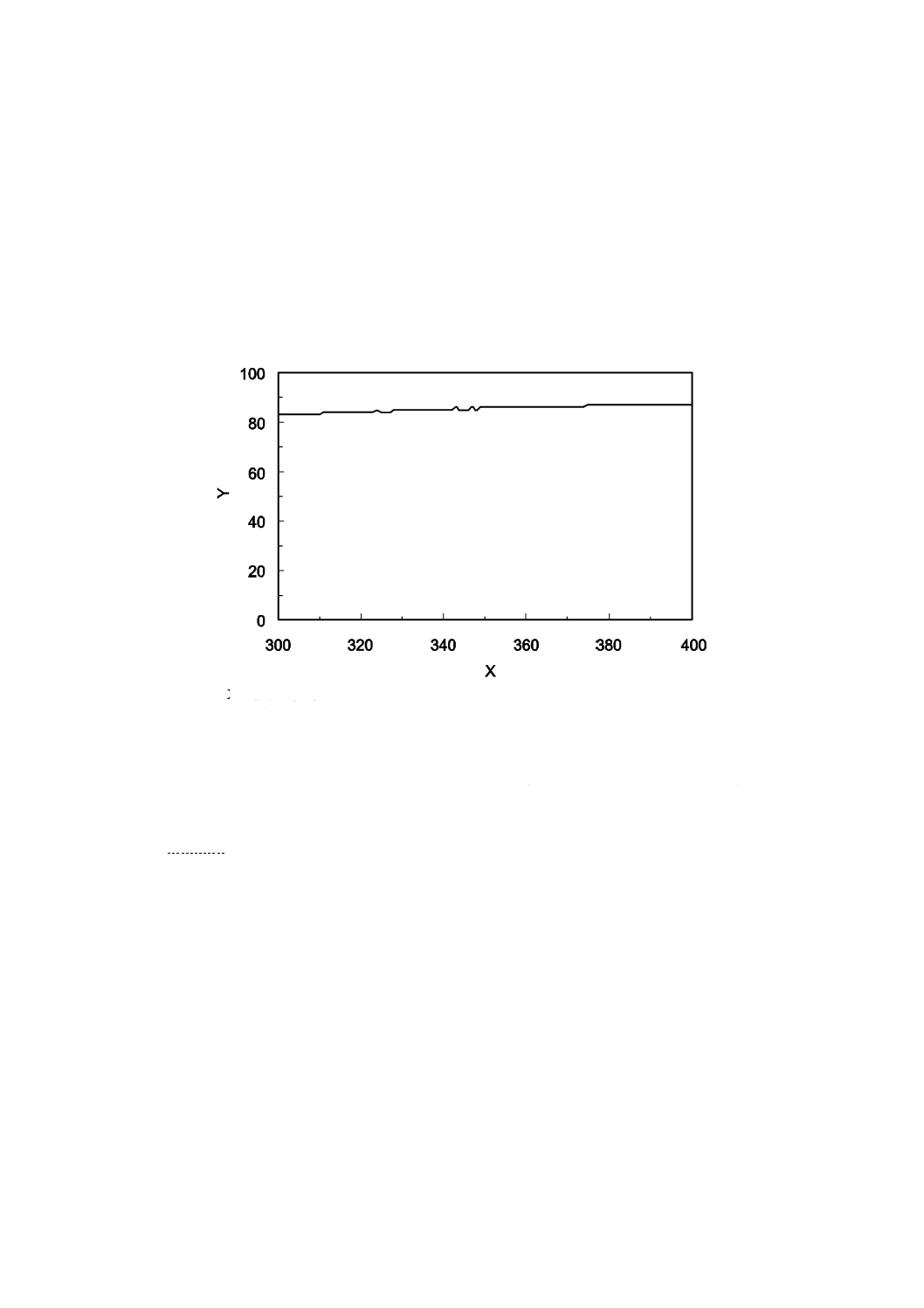
透過率が規定された値を満足するフィルム(コクヨ社製手書き用OHPフィルム,VF-15)の測定例を図
B.1に示す。
注記 コクヨ社製手書き用OHPフィルム,VF-15は,市販製品の一例である。この情報は,この規格
の利用者の便宜を図って記載するもので,この製品を推奨するものではない。
X 波長(nm)
Y 透過率(%)
図B.1−密着フィルムの透過率の測定例
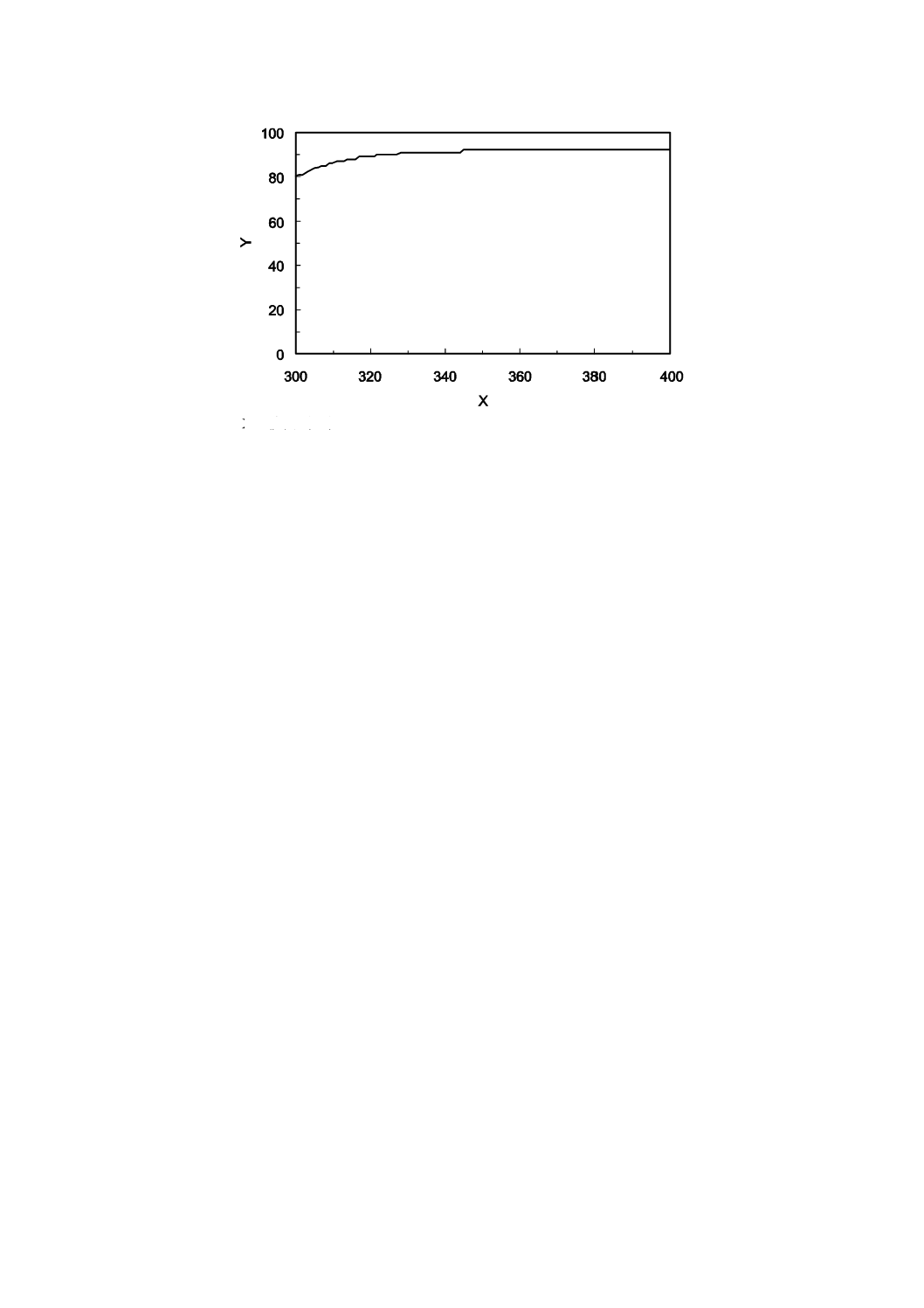
透過率が規定された値を満足する密着ガラス(SCOTT AG社製TEMPAX又はCORNING社製Pyrex7740)
の測定例を,図B.2に示す。
注記 SCOTT AG社製TEMPAX及びCORNING社製Pyrex7740は,市販製品の一例である。この情報
は,この規格の利用者の便宜を図って記載するもので,この製品を推奨するものではない。
25
R 1702:2020
X 波長(nm)
Y 透過率(%)
図B.2−密着ガラスの透過率の測定例
26
R 1702:2020
附属書C
(参考)
紫外光照射による細菌の損傷の評価
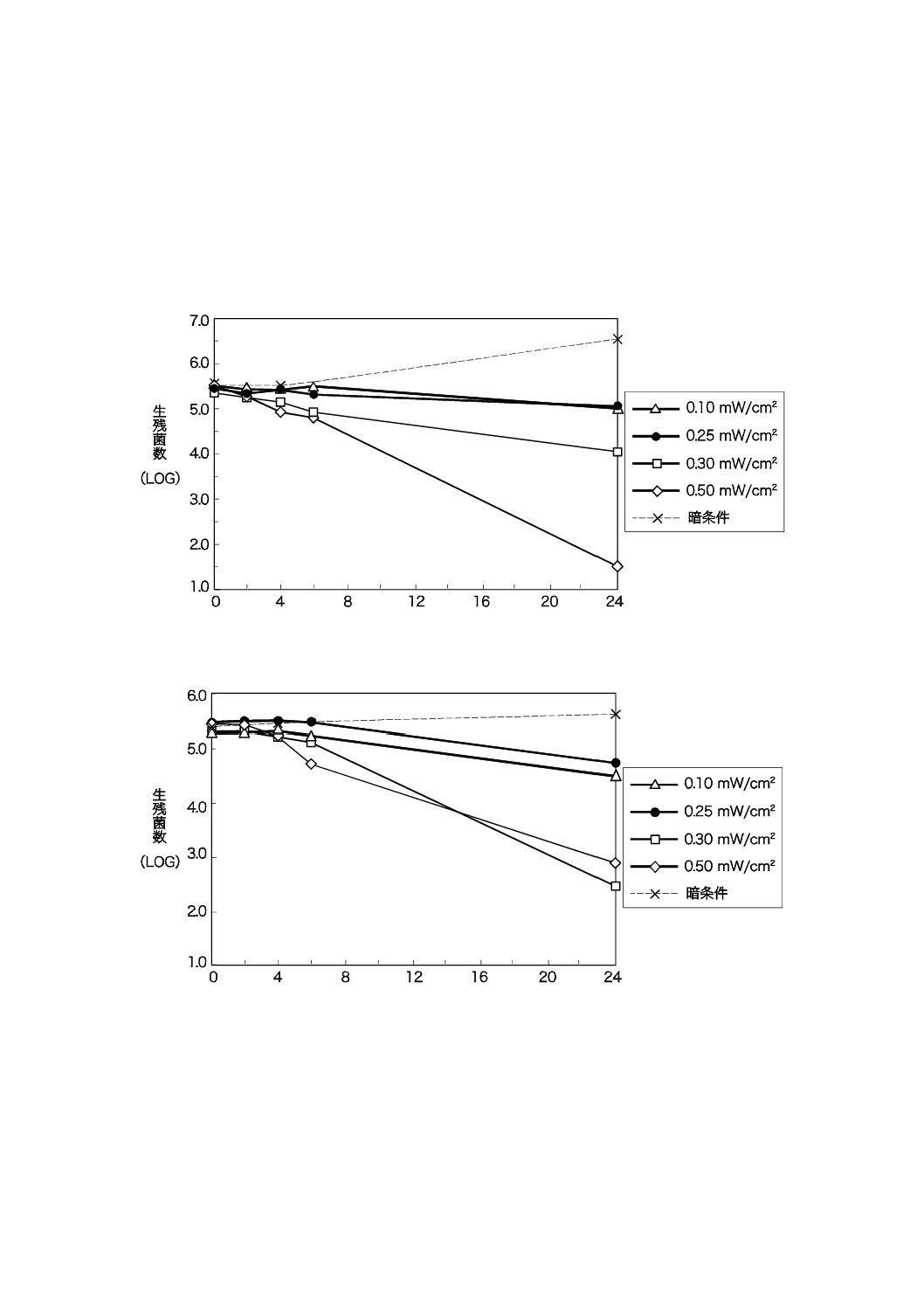
光触媒抗菌加工していないガラス板を用いて,紫外光照射(BLBランプを使用)による細菌の損傷を評
価した結果を,図C.1(大腸菌)及び図C.2(黄色ぶどう球菌)に示す。
紫外光照射時間(h)
図C.1−大腸菌に対する紫外光照射時間の影響
紫外光照射時間(h)
図C.2−黄色ぶどう球菌に対する紫外光照射時間の影響
27
R 1702:2020
附属書JA
(規定)
平板状のハイブリッド光触媒抗菌加工材料の光が当たらない環境での
抗菌性試験方法及び抗菌効果
JA.1 一般
この附属書は,平板状のハイブリッド光触媒抗菌加工材料及び製品の光(波長300 nm〜380 nmの紫外
線)が当たらない環境での抗菌性を測定する手順について,JIS Z 2801の5.6(試験操作)に規定する操作
に代わる試験操作を規定する。
なお,ここに規定していない項目である箇条3(用語及び定義),5.7(生菌数の計算),5.8(試験結果)
及び箇条6(試験結果の記録)については,JIS Z 2801による。また,抗菌効果については,JIS Z 2801
の箇条4(抗菌効果)に従う。
JA.2 概要
JIS Z 2801では,抗菌加工製品の抗菌性試験法及び抗菌効果について規定しているが,光(波長300 nm
〜380 nmの紫外線)の影響を考慮していない。平板状のハイブリッド光触媒抗菌加工材料及び製品の光が
当たらない環境での抗菌性を測定するためには,この光の影響を排除しないと,光触媒による抗菌性も含
めて評価することになる。そこで,JIS Z 2801に記載されている試験方法に,光の影響を排除した試験条
件で抗菌性を評価するために必要な手順を追加する。
JA.3 試験操作
JA.3.1 一般事項
取り扱う微生物のバイオセーフティレベルに必要な設備が用意された実験室で試験する。
なお,ハザードレベル及び必要な設備については,国立感染症研究所病原体等安全管理規程などを参考
とするのがよい。
JA.3.2 細菌株の保存
細菌株の保管及び継代は,次による。
a) 各細菌株を6.2.9に規定する普通寒天斜面培地又は6.2.8に規定する普通寒天培地で,24時間〜48時間,
35 ℃±1 ℃で培養し,その後5 ℃〜10 ℃で保存する。
b) a)の過程を再度行うことによって,1か月以内に継代培養を繰り返す。
c) 普通寒天斜面培地又は普通寒天培地で培養したものは,1か月以上の使用はできない。
d) 保存機関から入手した菌株は,初代から数えて5回までの継代培養とする。
JA.3.3 試験菌の前培養
JA.3.2に規定する保存菌株から6.2.9に規定する普通寒天斜面培地又は6.2.8に規定する普通寒天培地に
1白金耳量を移植し,培養器中で温度35 ℃±1 ℃で16時間〜24時間培養する。さらに,この培養菌から
新たな普通寒天斜面培地又は普通寒天培地に1白金耳量を移植し,培養器中で温度35 ℃±1 ℃で16時間
〜20時間培養する。
JA.3.4 試験に用いる安全キャビネット,容器及び培養器の評価(紫外放射照度の測定)
試験に用いる安全キャビネット,容器及び培養器の評価は,次による。
28
R 1702:2020
a) 試験片を取り扱うJA.3.6,JA.3.8及びJA.3.10に規定する作業を行うときに,安全キャビネット内に
漏れる紫外線によって光触媒作用が働かないことを確実にするため,0.001 mW/cm2まで測定できる紫
外放射照度計を用いて,安全キャビネットの作業台上の紫外放射照度を測定する。紫外放射照度が
0.001 mW/cm2以上の場合は,紫外放射照度が0.001 mW/cm2未満になるよう,要因を取り除いてから
試験する。
b) 試験片を取り扱うJA.3.6に規定する作業を行うときに,試験片を保管する容器内に漏れる紫外線によ
って光触媒作用が働かないことを確実にするため,0.001 mW/cm2まで測定できる紫外放射照度計を用
いて,容器内の紫外放射照度を測定する。紫外放射照度が0.001 mW/cm2以上の場合は,紫外放射照度
が0.001 mW/cm2未満になるよう,要因を取り除いてから試験する。
c) 試験片を培養する培養器内に漏れる紫外線によって光触媒作用が働かないことを確実にするため,
0.001 mW/cm2まで測定できる紫外放射照度計を用いて,培養器内の紫外放射照度を測定する。紫外放
射照度が0.001 mW/cm2以上の場合は,紫外放射照度が0.001 mW/cm2未満になるよう,窓を覆い隠す
など,要因を取り除いてから試験する。
JA.3.5 試験片の調製
試験片の調製は,次による。
a) 平板状のハイブリッド光触媒抗菌加工材料及び無加工材料の平らな部分を50 mm±2 mm角(厚さ10
mm以内)の正方形に切り取り,これを標準の大きさの試験片とする。
材料を50 mm±2 mm角(厚さ10 mm以内)の正方形に切り取ることが困難又は不可能なとき,表
面積800 mm2〜1 600 mm2の密着フィルムをかぶせることが可能な試験片の形状及び大きさの場合は,
ここに規定する形状及び大きさ以外の試験片を使用してもよい。
b) これらの試験片を,無加工試験片は6個,ハイブリッド光触媒抗菌加工した試験片は3個準備する。
c) 無加工材料から無加工試験片を準備できない場合は,8.1 b)のガラス板を使用してもよい。試験片の調
製に当たっては,微生物汚染,試験片間の相互汚染及び汚れに十分注意する。
JA.3.6 試験片の清浄化及び保管
試験片に紫外線が作用しないようにするため,次によってJA.3.4 a) に規定する状態に保った安全キャ
ビネット内で作業する。
a) JA.3.5の試験片の全面を,エタノールを吸収させた局方ガーゼ又は脱脂綿で軽く2回〜3回拭いた後,
十分に乾燥する。
b) JA.3.5に規定する各試験片を,試験面を上にして滅菌済みシャーレ内に置く。ただし,直ちにJA.3.7
に規定する手順に移らない場合には,JA.3.7に規定する作業を始めるまでの間,JA.3.4 b) に規定する
容器内で保管する。試験面は,ハイブリッド光触媒抗菌加工が施されている試験片の表面とし,内部
までハイブリッド光触媒抗菌加工されている試験片であっても,切断面は試験面としない。
JA.3.7 試験菌液の調製
JA.3.3で前培養した試験菌の菌体1白金耳量を,少量の6.2.1に規定する1/500 NBに均一に分散させ,
顕微鏡による直接観察又は他の適切な方法によって,菌数を測定する。この菌液を1/500 NBを用いて適宜
希釈し,菌数が2.5×105個/ml〜10×105個/mlとなるように調製し,これを試験菌液とする。試験菌液をす
ぐに使用しない場合は,氷冷(0 ℃)保存し,保存2時間以内に使用する。
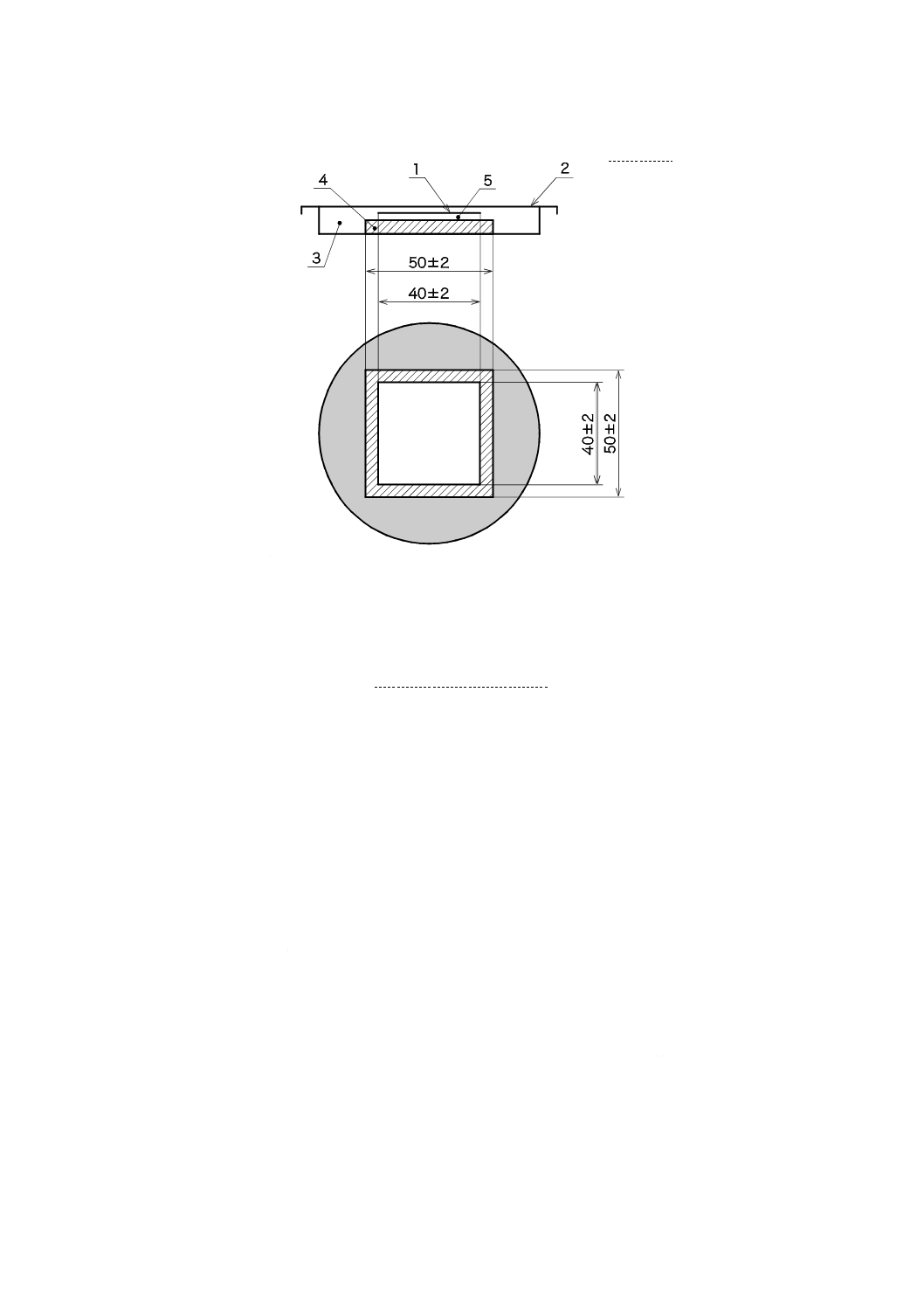
JA.3.8 試験菌液の接種
試験片に紫外線が作用しないようにするため,次によってJA.3.4 a) に規定する状態に保った安全キャ
ビネット内で作業する。
29
R 1702:2020
a) JA.3.7に規定する試験菌液をピペットで0.4 ml採取し,これを試験菌液として,シャーレ内の各試験
片に滴下し,直ちに相対湿度90 %以上になるように調整した蓋の付いた容器に入れる。標準の大きさ
以外の試験片の接種菌液量は,被覆した密着フィルムに合わせて調整する。また,標準の大きさの試
験片であっても,規定に基づく菌液量を接種したとき,陶磁器,タイル,ほうろう,ガラスなどのぬ
れ性が極めてよい試験片では,僅かな傾斜で密着フィルムが移動したり,密着フィルムの端から菌液
が漏れ出す場合がある。このような場合は,接種菌液の液量を規定量の1/4を限度に減じてもよい。
ただし,試験片に接種する菌数は接種菌液量を少なくした場合においても,標準の大きさの試験片の
場合と同様に1試験片当たり1.0×105個〜4.0×105個(6.2×103個/cm2〜2.5×104個/cm2)とする。
b) 滴下した試験菌液の上に密着フィルムをかぶせ,菌液が密着フィルムの端からこぼれないように注意
しながら,試験菌液が密着フィルム全体に行き渡るように軽く押さえ付けた後,シャーレの蓋をする
(図JA.1参照)。密着フィルムの大きさは,40 mm±2 mm角の正方形を標準とする。試験片が標準の
大きさ以外の場合は,密着フィルムが試験片より内側となるように大きさを調整する。ただし,密着
フィルムの面積は,800 mm2より大きくする(例参照)。
紫外線が影響しないことを確実にするため,速やかに操作することが望ましい。
例 試験片の大きさが標準の3/4の大きさの場合には,1試験片当たり7.5×104個〜3.0×105個の試
験菌液を接種する。このとき,ぬれ性がよく,標準の大きさの試験片で1試験片当たり0.15 ml
接種する場合で想定すると,試験片の大きさが標準の3/4の大きさの場合には,6.7×105個/ml
〜2.6×106個/mlとなるように試験菌液を調製し,試験片には0.11 ml接種する。
c) 直ちにb)のシャーレを相対湿度90 %以上になるように,調整した蓋の付いた容器に入れる。
30
R 1702:2020
単位 mm
1
密着フィルム
2
シャーレ蓋
3
シャーレ
4
試験片
5
試験菌液
図JA.1−試験片の組立て
JA.3.9 試験菌液を接種した試験片の培養
試験菌液を接種した試験片(無加工試験片3個及びハイブリッド光触媒抗菌加工した試験片3個)を入
れたシャーレが入った容器を,直ちにJA.3.4 c)に規定する培養器に入れ,温度35 ℃±1 ℃で24時間±1
時間培養する。
JA.3.10 接種した試験菌の洗い出し
JA.3.10.1 試験菌液接種直後の試験片
JA.3.8に規定する試験菌液を接種した直後の無加工試験片3個について,密着フィルム及び試験片をそ
れぞれ菌液がこぼれないように注意しながら,それぞれ別のシャーレに置く。シャーレ内に6.2.5に規定
するSCDLP培地10 mlを加え,ピペットで無加工試験片上の試験菌を最低4回洗い出し菌液を完全に回収
する。この洗い出し液は,速やかにJA.3.11に規定する測定を行う。また,試験菌の洗い出しについては,
この方法と同等又はそれ以上の回収率が認められる方法であれば,他の方法を用いてもよい。
なお,試験片に紫外線が作用しないようにするため,SCDLP培地を加えるまでは,JA.3.4 a) に規定す
る状態に保った安全キャビネット内で作業する。このとき,SCDLP培地を加えるまでに試験片に光紫外線
が当たる時間は,10分以内とし,直ちに作業に移れない場合は,試験片に紫外線が当たらないよう7.12
に規定する暗箱などを使って光を遮る。
試験片の大きさ又は特性上,SCDLP培地10 mlで洗い出しが困難な場合は,液量を増やしてもよい。
JA.3.10.2 培養後の試験片
JA.3.9に規定する培養後の試験片について,JA.3.10.1に規定と同様に試験菌を洗い出す。この洗い出し
31
R 1702:2020
液は,速やかにJA.3.11に規定する測定を行う。また,試験菌の洗い出しについては,この方法と同等又
はそれ以上の回収率が認められる他の方法を用いてもよい。
なお,試験片に紫外線が作用しないようにするため,SCDLP培地を加えるまでは,JA.3.4 a) に規定す
る状態に保った安全キャビネット内で作業する。このとき,SCDLP培地を加えるまでに試験片に光紫外線
が当たる時間は10分以内とし,直ちに作業に移れない場合は,試験片に紫外線が当たらないよう7.12に
規定する暗箱などを使って光を遮る。
なお,試験片の大きさ又は特性によって,SCDLP培地10 mlで洗い出しが困難な場合は,液量を増やし
てもよい。また,紫外線が影響しないことを確実にするため,速やかに操作することが望ましい。
JA.3.11 寒天平板培養法による生菌数の測定
JA.3.10.1又はJA.3.10.2に規定する洗い出し液を滅菌したピペットで1.0 ml採り,6.2.10に規定するりん
酸緩衝生理食塩水9.0 mlの入った試験管に加え,十分にかくはんする。さらに,この試験管から1.0 mlを
新しいピペットで採り,りん酸緩衝生理食塩水9.0 mlが入った別の試験管に加え,十分にかくはんする。
この操作を順次繰り返して,10倍希釈系列希釈液を作製し,各希釈系列の試験管からそれぞれ別のシャー
レ2枚に新しいピペットで1.0 ml採り,45 ℃〜48 ℃に保温した6.2.11に規定する標準寒天培地15 ml〜
20 mlを加え,蓋をして室温で放置し,培地が固まった後,シャーレを倒置し,培養器中で35 ℃±1 ℃で
40時間〜48時間培養する。培養後,30個〜300個の集落が現れた希釈系列のシャーレのコロニー数を測定
する。洗い出し液1.0 mlを用いたシャーレの集落数が30個未満の場合は,測定した集落数をコロニー数
とする。また,洗い出し液1.0 mlを用いたシャーレから生残菌が認められない場合は,“<1”と表示する。
同一の希釈系列以外で30個〜300個のコロニーが現れるなど,ここで規定する以外の集落数の採用方法
については,日本薬学会編 衛生試験法・注解(2015)の1.2(微生物試験法)1.2.1.1(細菌一般試験法)
3)(菌数測定)(1)(混釈平板培養法)又は厚生労働省監修 食品衛生検査指針微生物編(2015)の第2章
(細菌)2(衛生指標菌)1.(細菌数)を参考とするのがよい。
32
R 1702:2020
附属書JB
(参考)
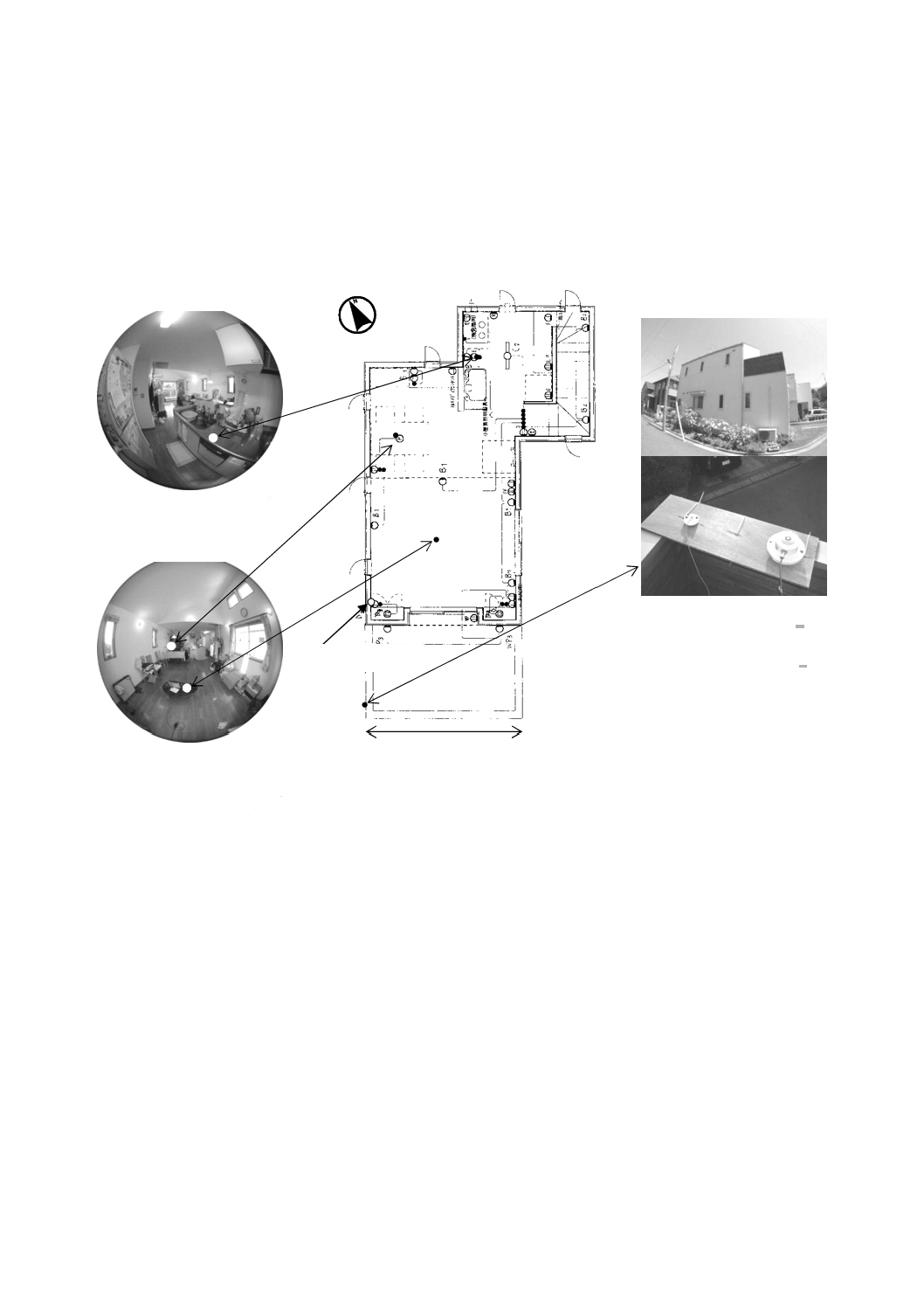
住環境における紫外放射照度及び照度分布(戸建住宅)
紫外放射照度を測定した戸建住宅の平面図を,図JB.1及び図JB.2に示す。
注a) これらの計器は,市販製品の一例である。この情報は,この規格の利用者の便宜を図って記載するもので,こ
の製品を推奨するものではない。
図JB.1−紫外放射照度を測定した戸建住宅の平面図(2階)
住宅の概観(西側)
台所
クリアガラス(109×27 cm)
リビング・ダイニング
屋外用UV-A放射計
[MS-210A,英弘精機a)]
屋外用照度計
[ML-020-O,英弘精機a)]
クリアガラス(引き違い南側182×75 cm×2)
クリアガラス(引き違い東側95×75 cm×2)
クリアガラス(79×27 cm×4)
クリアガラス(リビング上採光窓68×54 cm×2)
3.64 m
分布図作成時の原点
33
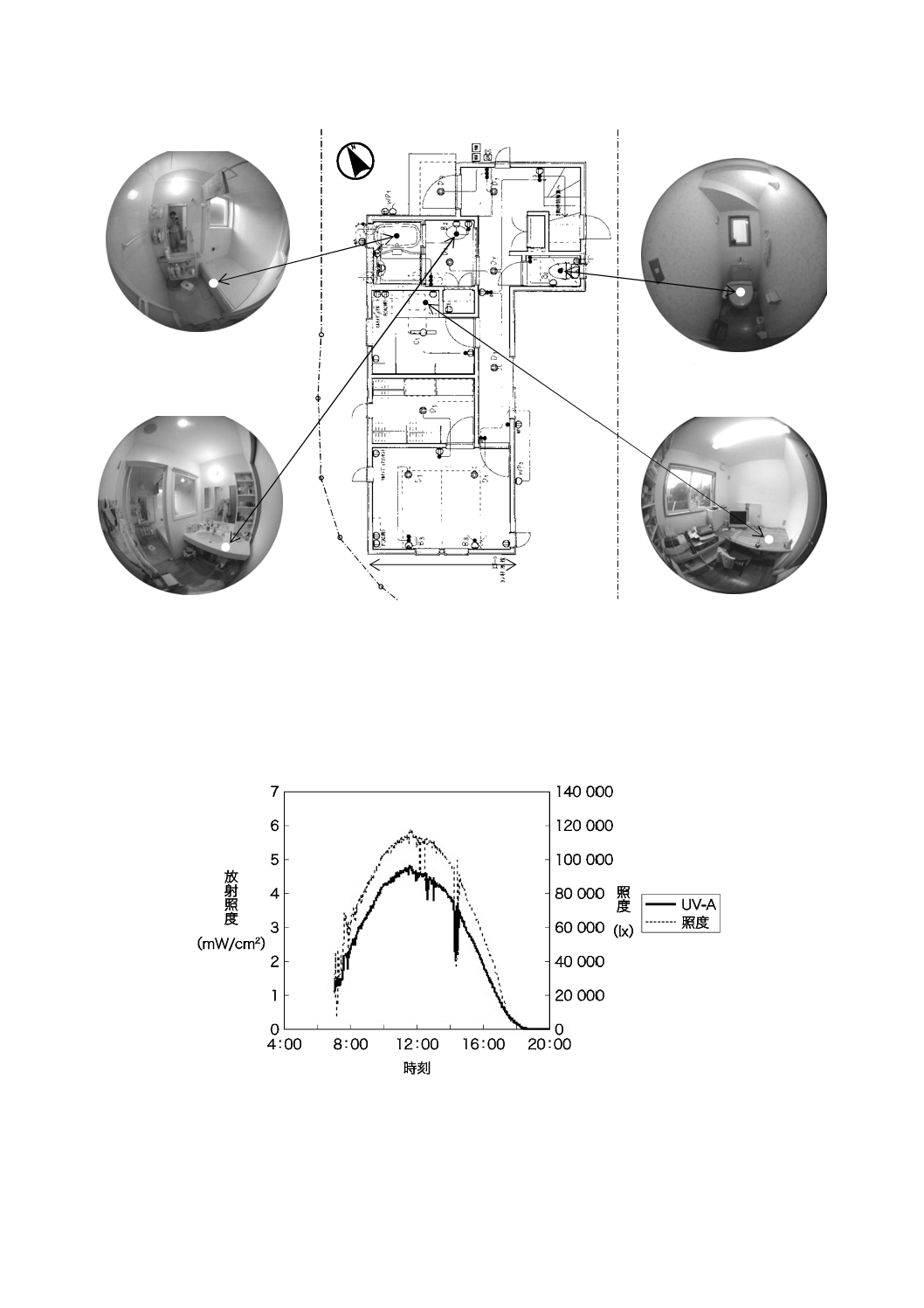
R 1702:2020
図JB.2−紫外放射照度を測定した戸建住宅の平面図(1階)
測定当日(2005年8月,天候:晴)の屋外での紫外放射照度及び照度を測定した結果を,図JB.3に示
す。
図JB.3−戸建住宅の紫外放射照度測定日の時刻別屋外紫外放射照度及び照度
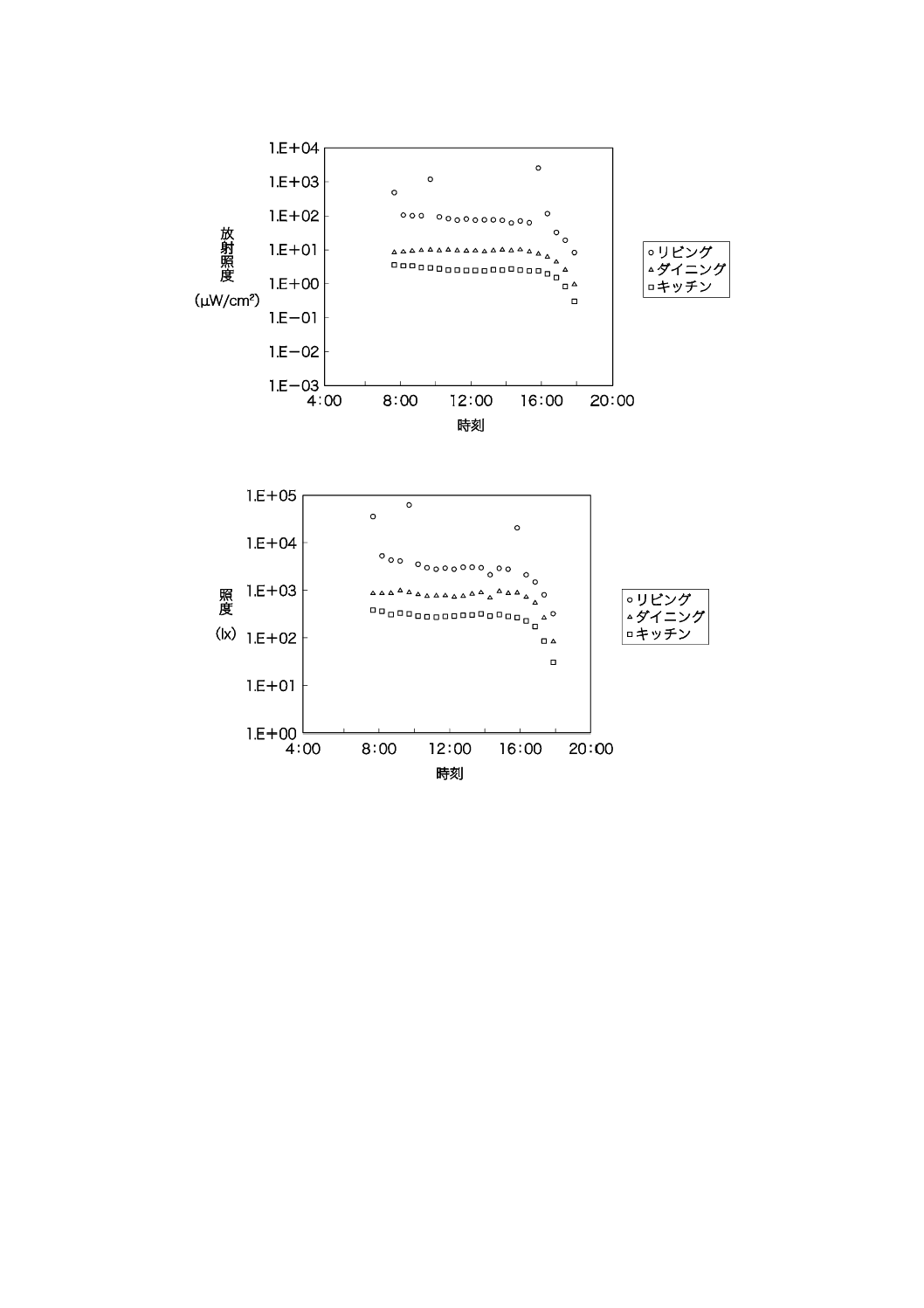
午前8時から午後6時まで,30分間隔で2階室内の紫外放射照度及び照度を測定した結果を,図JB.4
及び図JB.5に示す。
浴室
曇りガラス(60×50 cm)
トイレ
曇りガラス(53×27 cm)
書斎
クリアガラス(80×53 cm×2)
洗面所
3.64 m
クリアガラス(ビットウィーン窓,70×53 cm)
クリアガラス(浴室用ドア,90×30 cm×2+64×30 cm×2)
34
R 1702:2020
図JB.4−戸建住宅の紫外放射照度測定日の時刻別屋内紫外放射照度(2階)
図JB.5−戸建住宅の紫外放射照度測定日の時刻別屋内照度(2階)
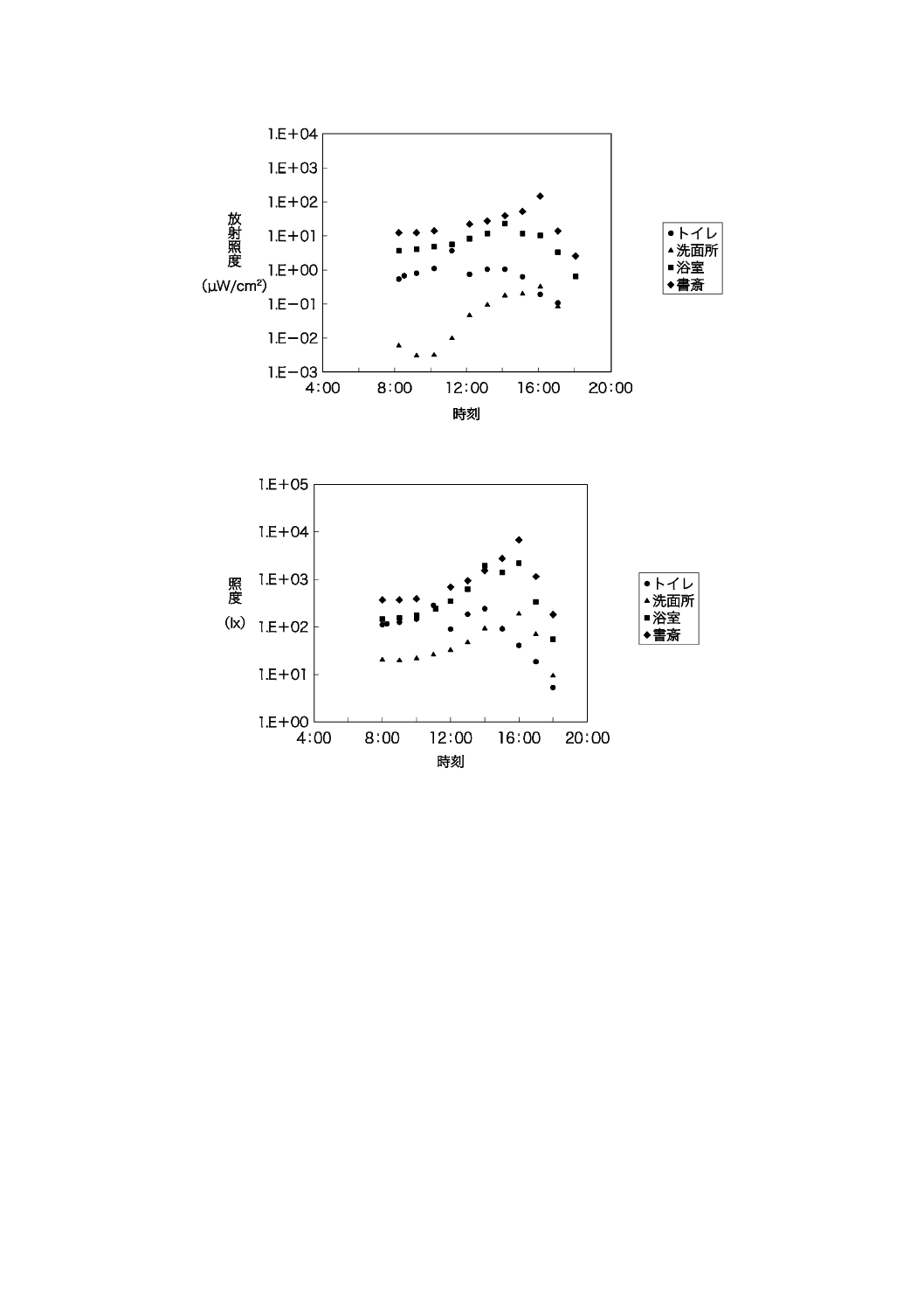
午前8時から午後6時まで,60分間隔で1階室内の紫外放射照度及び照度を測定した結果を,図JB.6
及び図JB.7に示す。
35
R 1702:2020
図JB.6−戸建住宅の紫外放射照度測定日の時刻別屋内紫外放射照度(1階)
図JB.7−戸建住宅の紫外放射照度測定日の時刻別屋内照度(1階)
午前8時頃の2階室内の紫外放射照度及び照度を50 cm間隔で測定し,分布図としてまとめた結果を,
図JB.8及び図JB.9に示す。
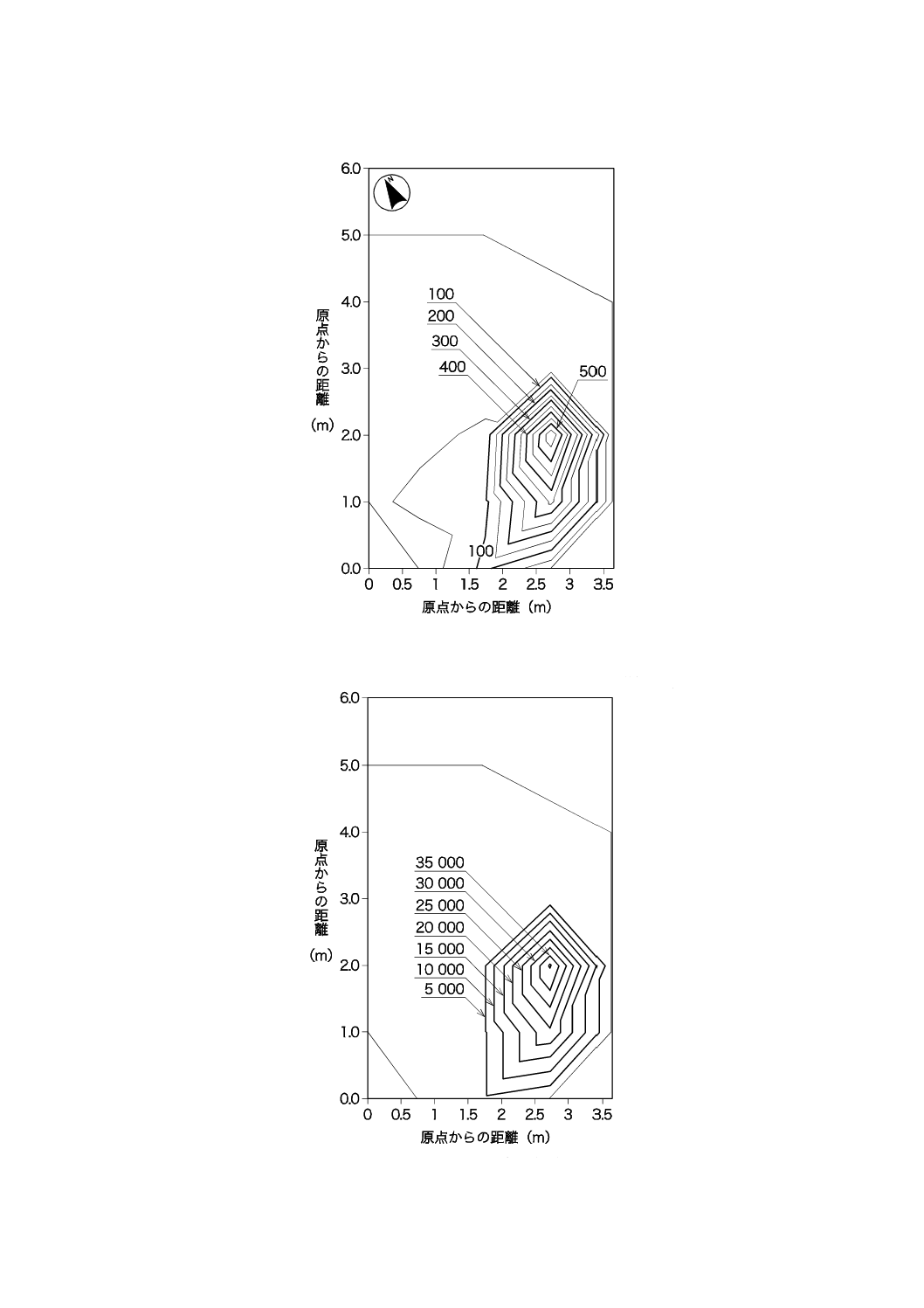
36
R 1702:2020
単位 μW/cm2
図JB.8−2階部分の紫外放射照度の分布(午前8時頃)
単位 lx
図JB.9−2階部分の照度の分布(午前8時頃)
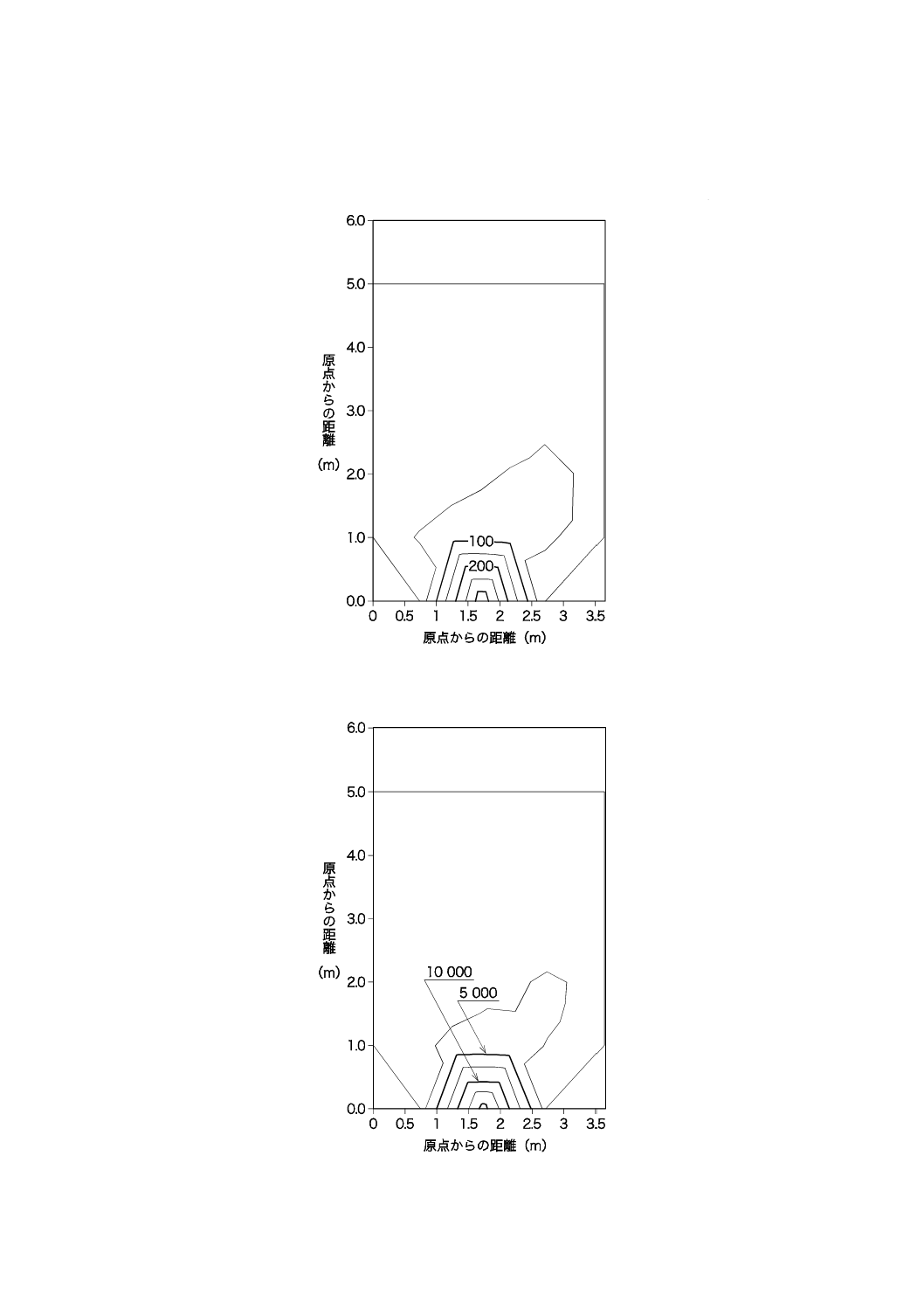
37
R 1702:2020
正午頃の2階室内の紫外放射照度及び照度を50 cm間隔で測定し,分布図としてまとめた結果を,図
JB.10及び図JB.11に示す。
単位 μW/cm2
図JB.10−2階部分の紫外放射照度の分布(正午頃)
単位 lx
図JB.11−2階部分の照度の分布(正午頃)
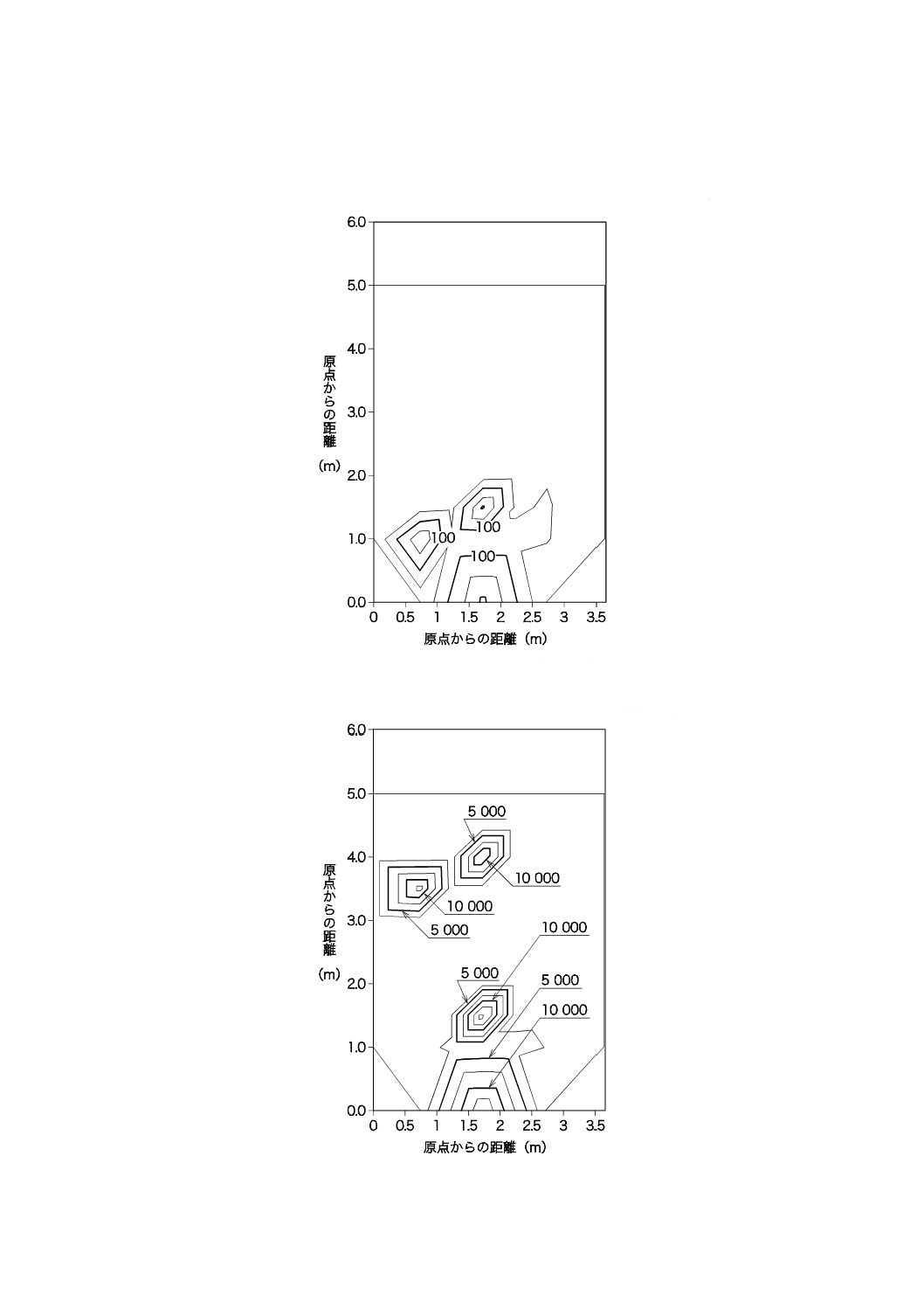
38
R 1702:2020
午後4時頃の2階室内の紫外放射照度及び照度を50 cm間隔で測定し,分布図としてまとめた結果を,
図JB.12及び図JB.13に示す。
単位 μW/cm2
図JB.12−2階部分の紫外放射照度の分布(午後4時頃)
単位 lx
図JB.13−2階部分の照度の分布(午後4時頃)
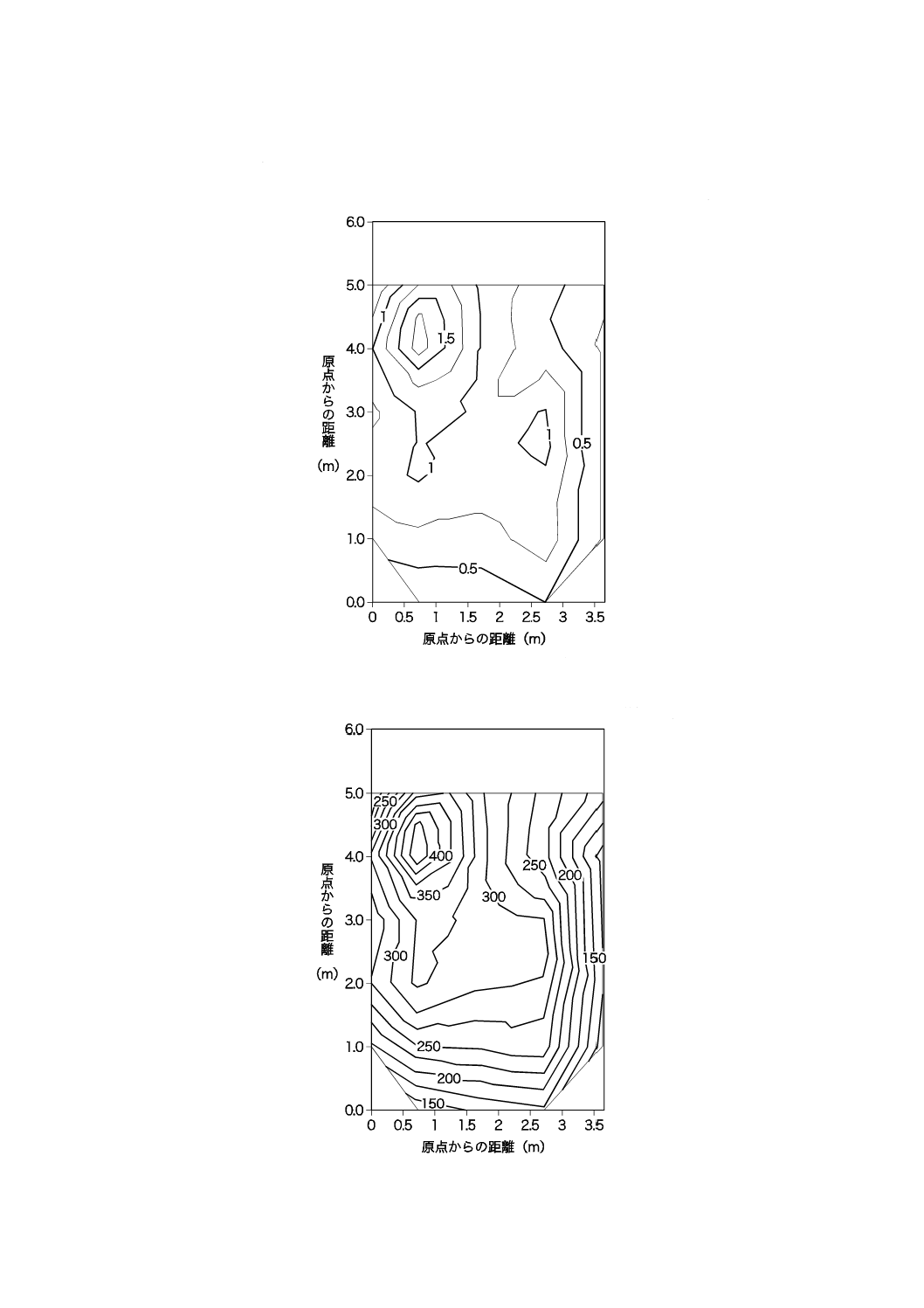
39
R 1702:2020
太陽光が当たらない(=室内照明だけ)夜間の2階室内の紫外放射照度及び照度を50 cm間隔で測定し,
分布図としてまとめた結果を,図JB.14及び図JB.15に示す。
単位 μW/cm2
図JB.14−2階部分の紫外放射照度の分布(夜間)
単位 lx
図JB.15−2階部分の照度の分布(夜間)
40
R 1702:2020
和室内の紫外放射照度を測定した住宅の和室の平面図を,図JB.16に示す。
図JB.16−紫外放射照度を測定した和室の平面図
測定当日(天候:晴)の和室の時刻別紫外放射照度及び照度を測定した結果を,図JB.17に示す。
図JB.17−和室の紫外放射照度測定日の時刻別屋外紫外放射照度及び照度
41
R 1702:2020
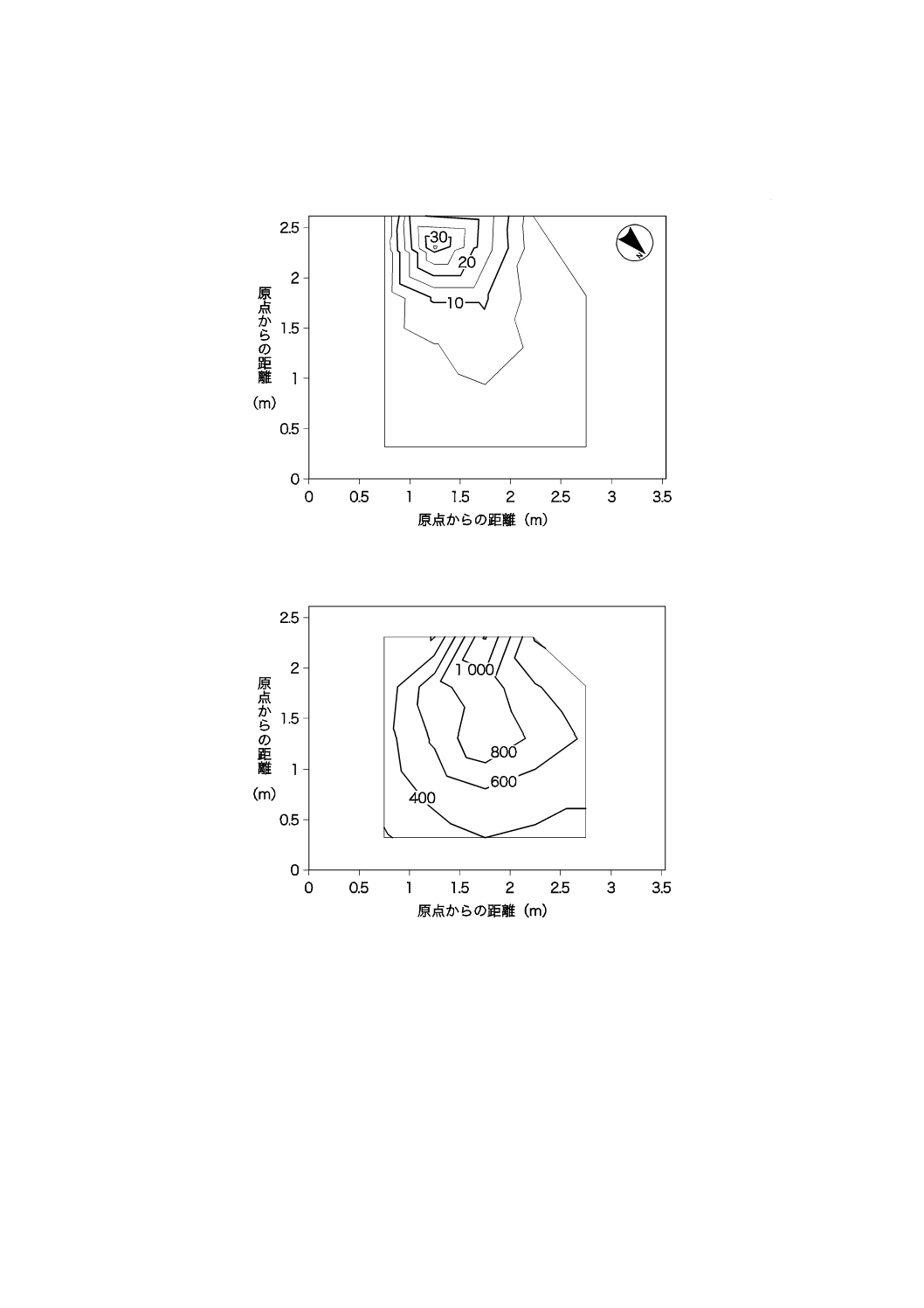
正午頃の和室室内の紫外放射照度及び照度を50 cm間隔で測定し,分布図としてまとめた結果を,図
JB.18及び図JB.19に示す。
単位 μW/cm2
図JB.18−和室の紫外放射照度の分布(正午頃)
単位 lx
図JB.19−和室の照度の分布(正午頃)
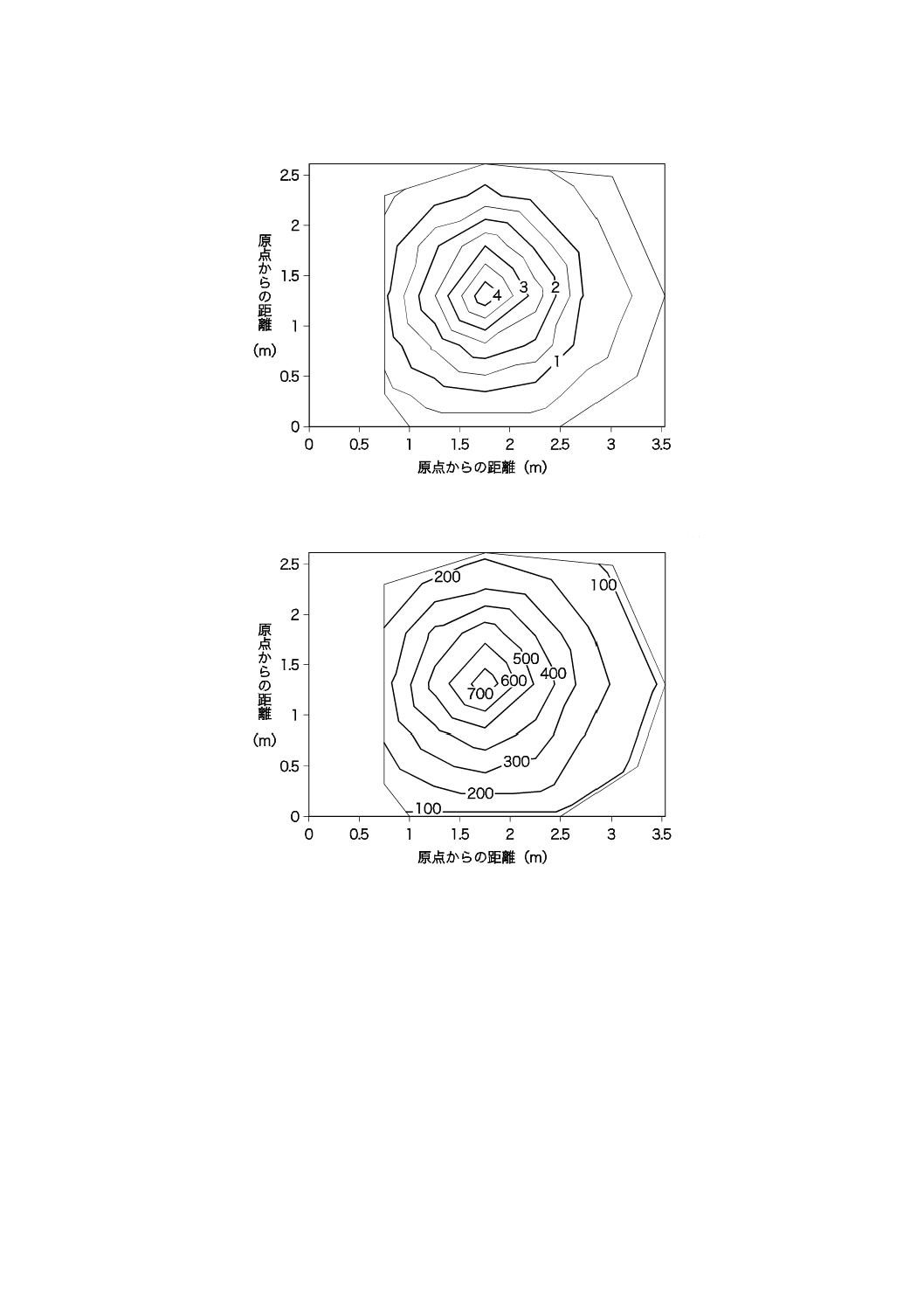
太陽光が当たらない(=室内照明だけ)夜間の和室室内の紫外放射照度及び照度を50 cm間隔で測定し,
分布図としてまとめた結果を,図JB.20及び図JB.21に示す。
42
R 1702:2020
単位 μW/cm2
図JB.20−和室の紫外放射照度の分布(夜間)
単位 lx
図JB.21−和室の照度の分布(夜間)
43
R 1702:2020
附属書JC
(参考)
住環境における紫外放射照度分布(場所別一覧)
附属書JBに記載したデータ以外に,これまでに得られている室内住環境での紫外放射照度測定値の範囲を一覧にしたものを,表JC.1に示す。
表JC.1−室内住環境での紫外放射照度測定値の範囲
場所
実測値(mW/cm2)
1.0
0.5
0.25
0.10
0.05
0.02
0.01
0.005
0.002
0.001
0.001>
上限
下限
照明だけ
戸建住宅 リビング
0.13
0.06
0.001
ダイニング
0.01
0.002
和室
0.03
0.003
0.001
書斎
0.13
0.01
0.001
台所
0.011
0.002
0.001>
浴室
0.03
0.004
0.001>
洗面所
0.001>
0.001>
トイレ
0.004
0.001>
0.001>
集合住宅 台所
0.001
0.001
浴室
0.001>
0.001>
洗面所
0.003
0.003
トイレ
0.001>
0.001>
公共建物 会議室
0.008
0.002
0.003
:日中の放射照度範囲
:夜間(照射だけ)の放射照度範囲
:日中の放射照度
:夜間(照明だけ)の放射照度
3
R
1
7
0
2
:
2
0
1
9
44
R 1702:2020
附属書JD
(参考)
光触媒による抗菌性評価結果
光触媒による抗菌性の特徴について,異なるタイプの光触媒及び紫外放射照度について評価した結果を
参考データとしてまとめたものを,表JD.1に示す。この表は,使用したサンプルの略号及び性状を示した
ものである。
表JD.1−使用したサンプル一覧
サンプル名
略号
膜厚
固形分比Ag量
(質量分率)
光触媒単独
T3
200 nm
−
T5
250 nm
−
光触媒−Agハイブリッド
H3
200 nm
300 ppm
Ag単独
A3
−
300 ppm
無加工ガラス板(比較)
ガラス板
−
−
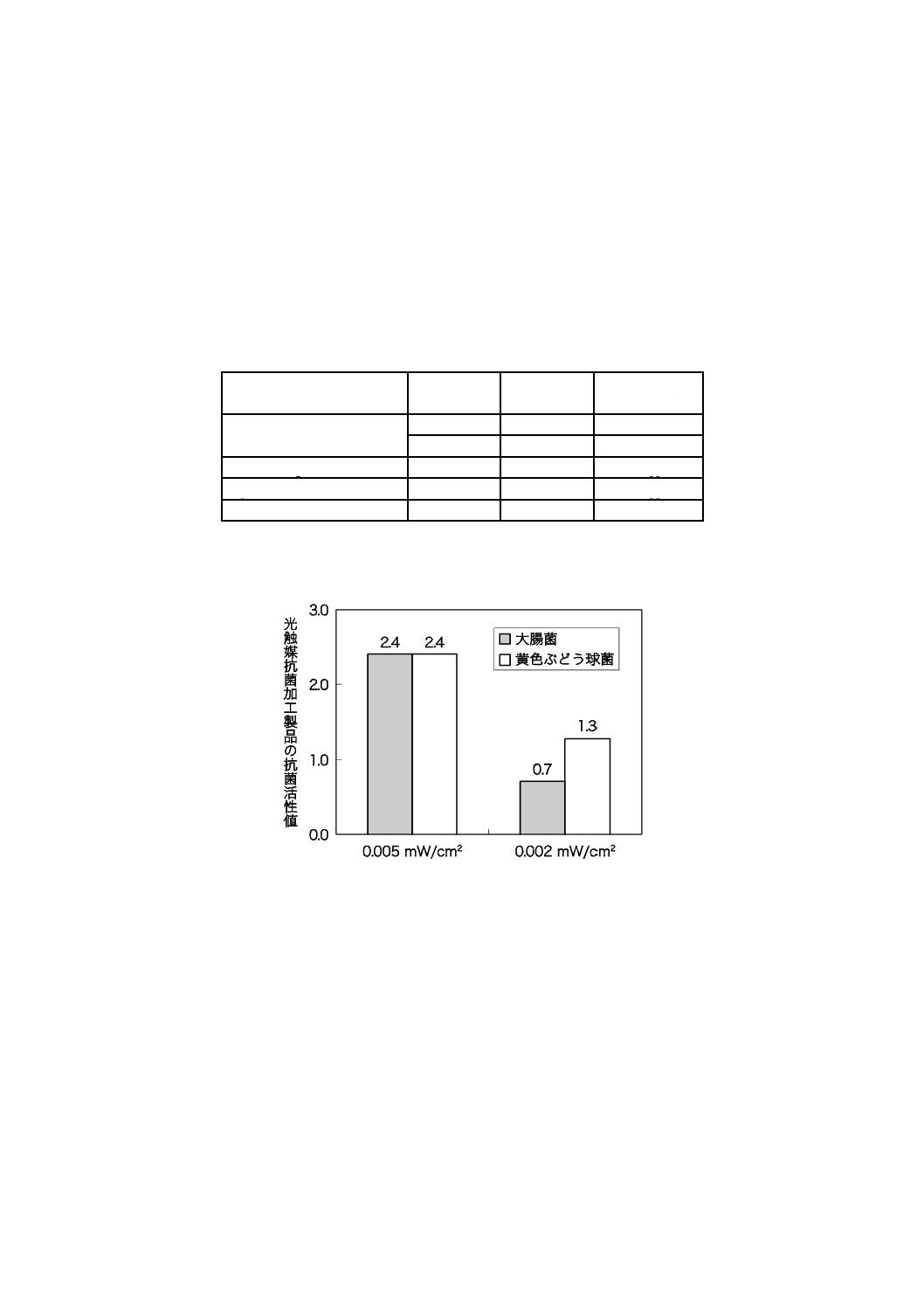
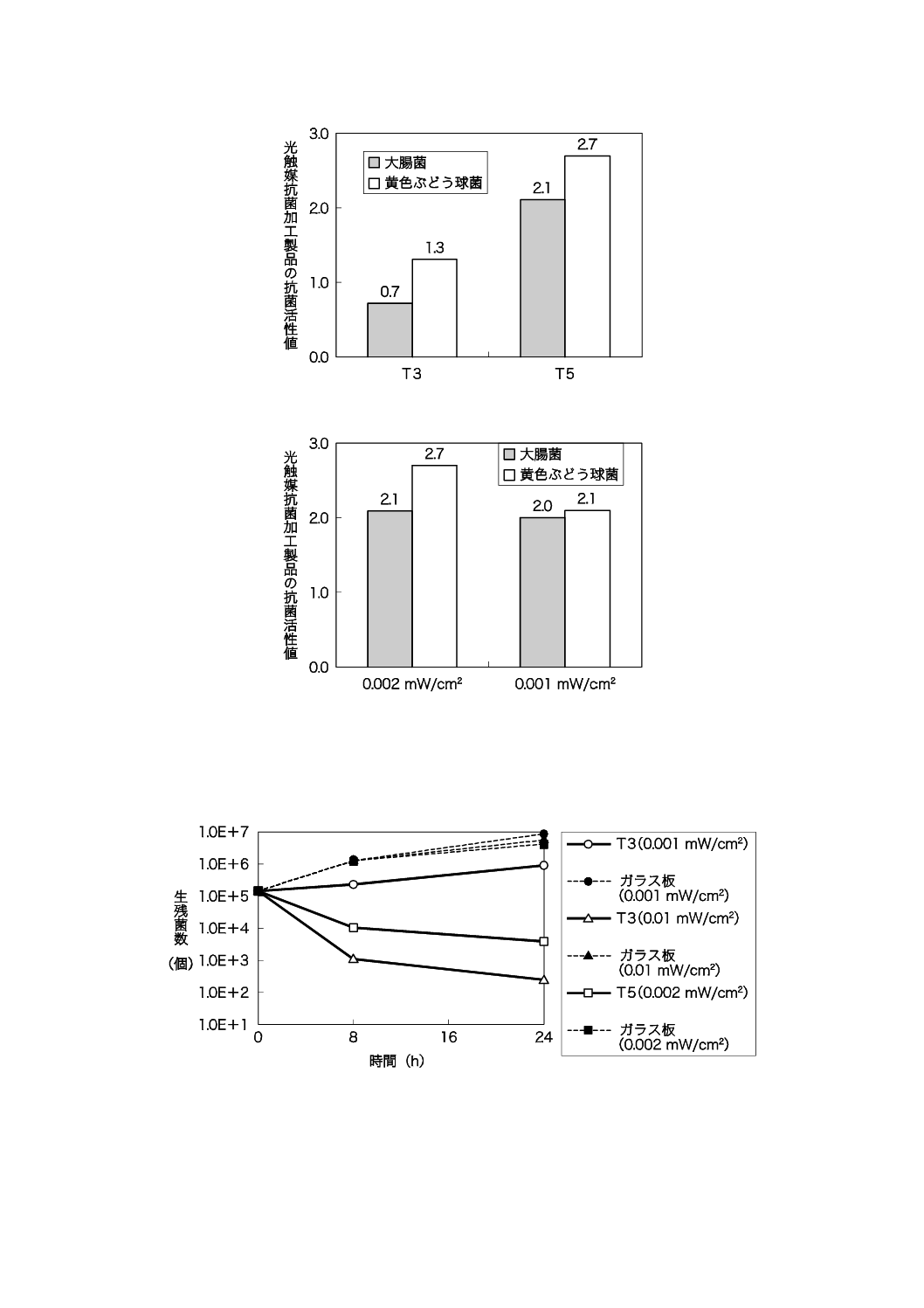
光触媒による抗菌性が,照射される紫外放射照度に依存することを示す評価結果を,図JD.1〜図JD.3
に示す。
紫外放射照度
図JD.1−サンプルT3を用いて紫外放射照度条件を変え試験した評価結果(光照射時間:8時間)
45
R 1702:2020
図JD.2−2種類のサンプルを用いて紫外放射照度0.002 mW/cm2で試験した評価結果(光照射時間:8時間)
紫外放射照度
図JD.3−サンプルT5を用いて紫外放射照度条件を変え試験した評価結果(光照射時間:8時間)
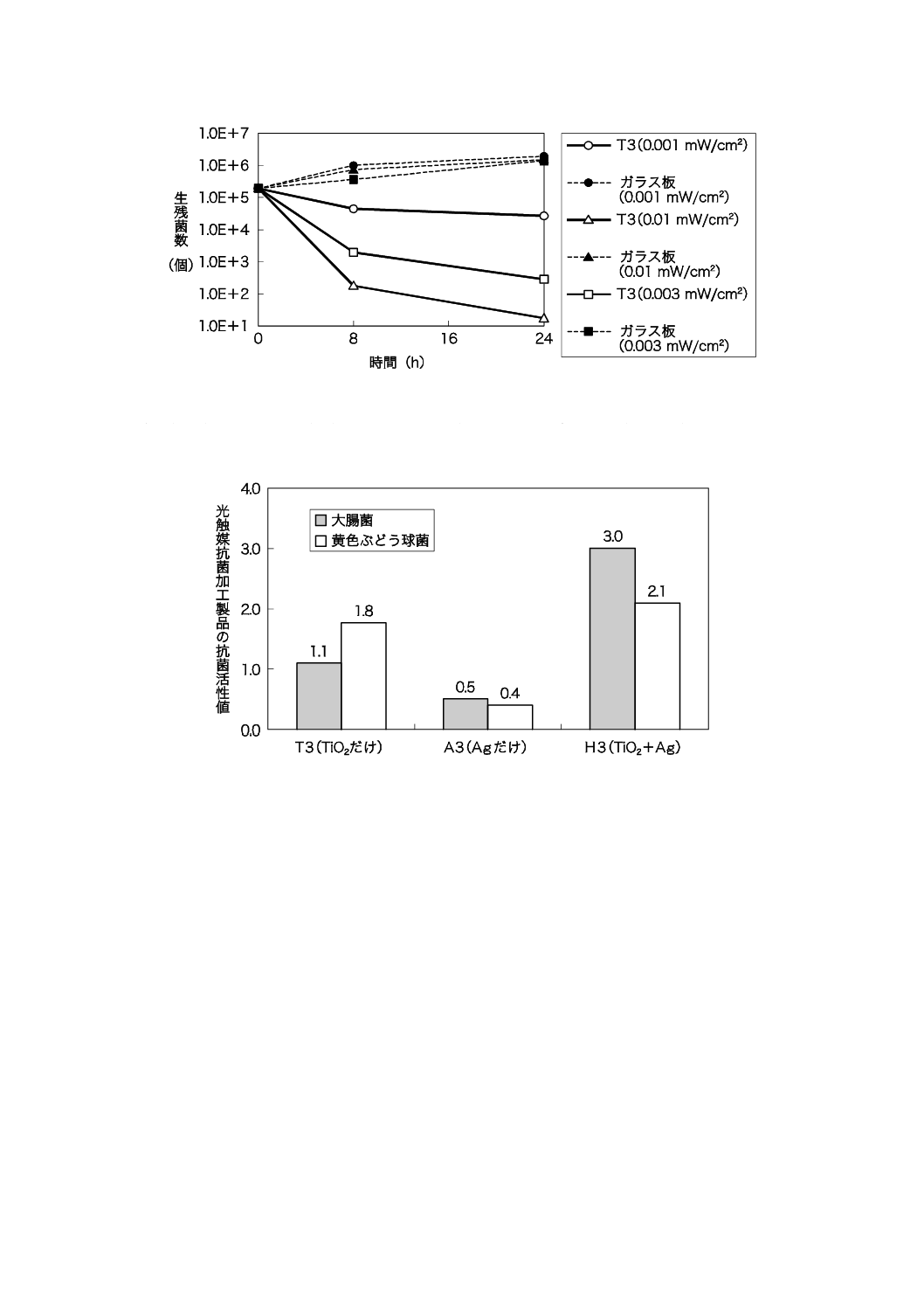
8時間光照射した後の試験片を16時間暗所に放置する条件で,3種類の光触媒サンプルを評価した結果
を,図JD.4及び図JD.5に示す。
図JD.4−大腸菌を用いて試験した評価結果
46
R 1702:2020
図JD.5−黄色ぶどう球菌を用いて試験した評価結果
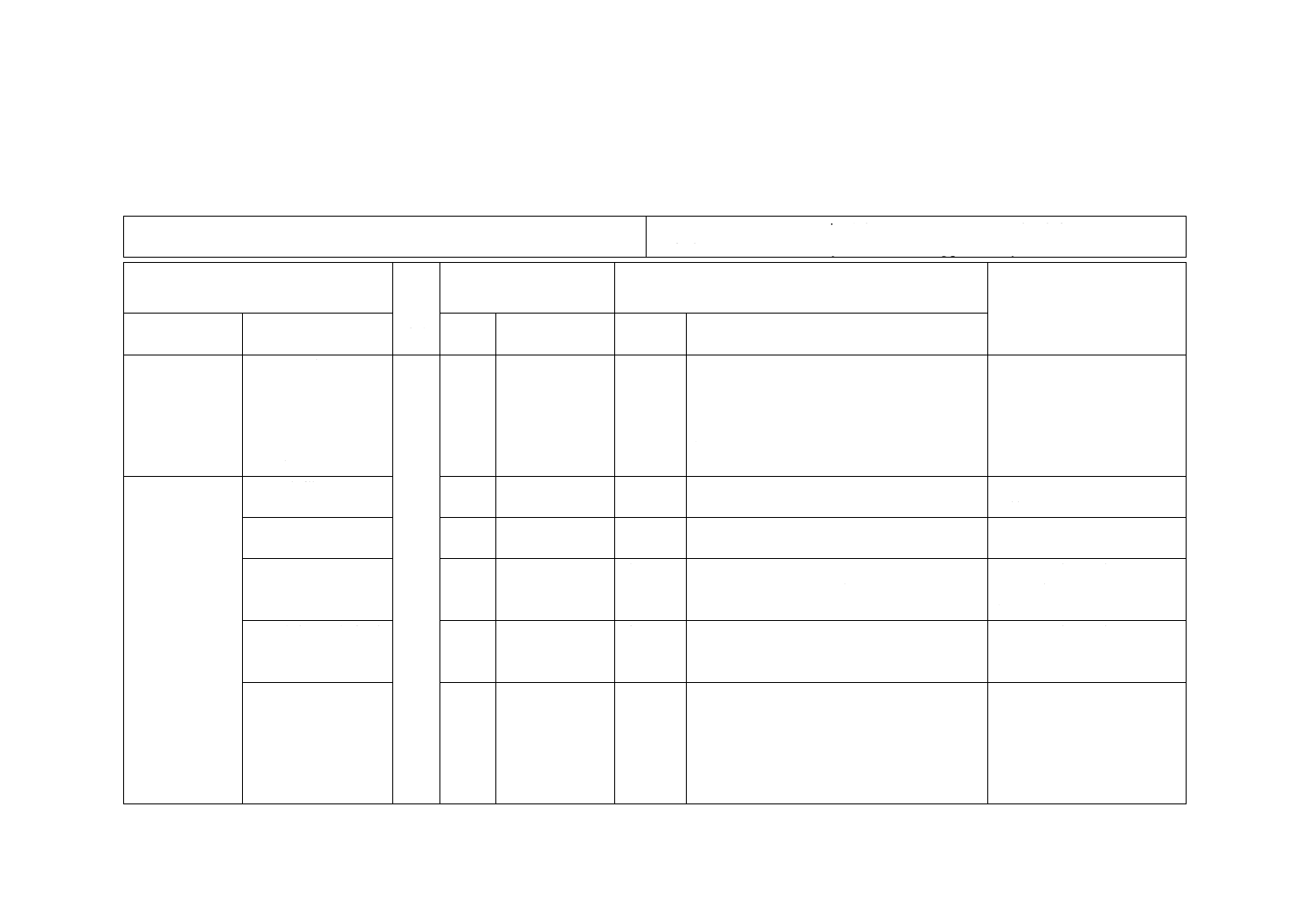
光触媒(TiO2)だけ,金属(Ag)だけ,及び光触媒−金属ハイブリッド(TiO2-Ag)の3種類のサンプ
ルを用いて,複合化の効果を評価した結果を,図JD.6に示す。
図JD.6−3種類のサンプルを用いて紫外放射照度0.01 mW/cm2で試験した評価結果(光照射時間:4時間)
47
R 1702:2020
参考文献
JIS L 1916 繊維製品の白色度測定方法
注記 対応国際規格:ISO 105-F,Textiles−Tests for colour fastness−Part F: Standard adjacent fabrics
JIS Z 8703 試験場所の標準状態
注記 対応国際規格:ISO 554,Standard atmospheres for conditioning and/or testing−Specifications
JIS K 7350-3 プラスチック−実験室光源による暴露試験方法−第3部:紫外線蛍光ランプ
注記 対応国際規格:ISO 4892-3,Plastics−Methods of exposure to laboratory light sources−Part 3:
Fluorescent UV lamps
JIS K 8951 硫酸(試薬)
注記 対応国際規格:ISO 6353-2,Reagents for chemical analysis−Part 2: Specifications−First series
JIS K 8342 酸化りん(V)(試薬)
注記 対応国際規格:ISO 6353-3,Reagents for chemical analysis−Part 3: Specifications−Second series
JIS R 1752 ファインセラミックス−可視光応答形光触媒抗菌加工材料の抗菌性試験方法及び抗菌効果
注記 対応国際規格:ISO 17094,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test
method for antibacterial activity of semiconducting photocatalytic materials under indoor lighting
environment
JIS R 1706 ファインセラミックス−光触媒材料の抗ウイルス性試験方法−バクテリオファージQβを
用いる方法
注記 対応国際規格:ISO 18061,Fine Ceramics (Advanced Ceramics, Advanced Technical Ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials−Test method using
bacteriophage Q-beta
JIS R 1756 ファインセラミックス−可視光応答形光触媒材料の抗ウイルス性試験方法−バクテリオフ
ァージQβを用いる方法
注記 対応国際規格:ISO 18071,Fine Ceramics (Advanced Ceramics, Advanced Technical Ceramics)−
Determination of antiviral activity of semiconducting photocatalytic materials under indoor lighting
environment−Test method using bacteriophage Q-beta
K. Sunada, T. Watanabe and K. Hashimoto,“Studies on phototokilling of bacteria on TiO2 thin film”, J.
Photochem. Photobiol. A:Chem., 156, 227 (2003)
K. Sunada, T. Watanabe and K. Hashimoto, “Bactericidal activity of copper-deposited TiO2 thin film under weak
UV light illumination”, Environ. Sci. Technol., 37, 4785 (2003)
抗菌加工製品ガイドライン,通商産業省生活産業局編,(1998)
公益社団法人日本薬学会編 衛生試験法・注解(2015)
厚生労働省監修 食品衛生検査指針微生物編(2015)
48
R 1702:2020
附属書JE
(参考)
JISと対応国際規格との対比表
JIS R 1702:2020 ファインセラミックス−光触媒抗菌加工材料の抗菌性試験方
法及び抗菌効果
ISO 27447:2009,Fine ceramics (advanced ceramics, advanced technical ceramics)−Test
method for antibacterial activity of semiconducting photocatalytic materials
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲
光触媒を含有する加
工材料及び表面に光
触媒加工フィルムを
含む材料の抗菌性試
験方法及び抗菌効果
を規定。
1
JISとほぼ同じ
追加
JISでは,試験方法だけでなく抗菌効果も規
定した。
適用外に抗ウイルス性,抗かび性を追加した。
可視光応答形光触媒の抗菌性を試験する場合
には,JIS R 1752を用いることを追加した。
ISO規格改正時に,適用外機
能の追加について提案を検
討する。
3 用語及び定義
3.1 光触媒
3.1
JISとほぼ同じ
追加
機能に抗ウイルス,抗かびを追加した。
ISO規格改正時に,改正提案
を検討する。
3.2
3.3
光触媒材料
抗菌
削除
JISでは,引用規格JIS R 1600,JIS Z 2801
で定義されているため削除した。
実質的な技術的な問題はな
い。
3.2 光触媒抗菌加工
−
−
追加
光触媒の抗菌機能を利用するために,光触媒
で抗菌加工することを追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
3.3 単味光触媒抗菌
加工
−
−
追加
光触媒抗菌加工のうち,塗布,含浸,練り込
みなど種々の方法によって光触媒を担持する
ことを追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
3.4 ハイブリッド光
触媒抗菌加工
−
−
追加
光触媒抗菌加工のうち,光が当たらない環境
においても抗菌機能を発現させるために,光
触媒と抗菌性のある他の機能性物質とを組み
合わせた材料を用いて,塗布,含浸,練り込
みなど種々の方法によって担持することを追
加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
3
R
1
7
0
2
:
2
0
2
0
49
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及び定義
(続き)
3.5 光触媒抗菌加工
材料
−
−
追加
光触媒抗菌加工した膜状,平板状,繊維状な
どの材料であることを追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
3.6 フィルム密着法
3.8
JISとほぼ同じ
変更
ISO規格では,平板状の光触媒材料の抗菌性
を評価する試験方法としているが,JISでは,
光触媒抗菌加工した平板状の材料の光照射条
件下での抗菌性を評価する試験方法とした。
実質的な技術的な問題はな
い。
3.7 ガラス密着法
3.9
JISとほぼ同じ
変更
ISO規格では,繊維状の光触媒材料の抗菌性
を評価する試験方法としているが,JISでは,
光触媒抗菌加工した繊維状の材料の光照射条
件下での抗菌性を評価する試験方法とした。
実質的な技術的な問題はな
い。
3.8 平板状の光触媒
抗菌加工材料の抗菌
活性値
3.4
JISとほぼ同じ
変更
ISO規格では,光触媒抗菌活性値としている
が,JISでは光触媒抗菌加工材料による抗菌
活性値に変更した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
3.9 繊維状の光触媒
抗菌加工材料の抗菌
活性値
3.5
JISとほぼ同じ
変更
ISO規格では,光触媒抗菌活性値としている
が,JISでは光触媒抗菌加工材料による抗菌
活性値に変更した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
3.10 平板状の光触媒
抗菌加工材料の光照
射による抗菌活性値
3.6
JISとほぼ同じ
変更
ISO規格では,光触媒抗菌活性値としている
が,JISでは光触媒抗菌加工材料の光照射に
よる抗菌活性値に変更した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
3.11 繊維状の光触媒
抗菌加工材料の光照
射による抗菌活性値
3.7
JISとほぼ同じ
変更
ISO規格では,光触媒抗菌活性値としている
が,JISでは光触媒抗菌加工材料の光照射に
よる抗菌活性値に変更した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
3.12 抗菌効果
−
−
追加
JISでは,抗菌活性値から判定される光触媒
抗菌加工による効果であることを追加した。
各国又は製品によって判定
基準は変わる可能性があり,
そのためJISには追加した。
−
3.10
紫外線蛍光ラン
プ
削除
JISでは,7.8 光源で定義されているため削除
した。
ISO規格改正時に,改正提案
を検討する。
3
R
1
7
0
2
:
2
0
2
0
50
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
4 記号及び単位
4
MBA,MBD,MBL,
MD,ML以外は
JISとほぼ同じ。
MBA,MBD,MBL,
MD,MLは3個の
試験片の生菌数
の常用対数の算
術平均値として
いる。
追加
変更
ISO規格ではBD,BL,CD,CLには3個の試
験片の平均値との記載がないため,JISでは3
個の試験片の平均値であることを追加した。
記号Lmax,Lmean,LminをLogmax,Logmean,Logmin
に変更した。
ISO規格では,MBA,MBD,MBL,MD,MLは
3個の試験片の生菌数の常用対数値の算術平
均値としているが,JISでは,生菌数の算術
平均値の常用対数値に変更した。
MBA,MBD,MBL,MD,Mは,
フィルム密着法の計算方法
に合わせ変更した。ISO規格
の改正時に変更することの
提案を検討する。
5 測定原理
5
JISとほぼ同じ
追加
JISでは,得られた結果についての説明を追
加した。
ISO規格の改正時に,追加に
ついての提案を検討する。
6 材料
6.1 試験に用いる細
菌株及び試験の準備
6.1.3 細菌株の準備
6.1.3
JISとほぼ同じ
追加
JISでは,取り扱う微生物のバイオセーフテ
ィレベルに必要な設備を用いることを追記し
た。
表1に記載の細菌を用いた追加試験について
の注記を表の中の段落に記載した。
実質的な技術的な問題はな
い。
6.1.4 細菌株の保存
6.1.3
JISとほぼ同じ
追加
JISでは,長期保存可能な方法で保存した場
合の継代回数について追記した。さらに平板
状培地の使用及び保管方法としてJIS L 1902
の7.2を追記した。
ISO規格の改正時に,追加に
ついての提案を検討する。
6.2 試薬及び材料
−
−
追加
培地は同一の組成であれば,市販品のもので
よいこと,及び培地量は試験片の数で変更で
きることを追加した。
ISO規格改正時に,追加する
ことの提案を検討する。
6.2.1 1/500濃度普通
ブイヨン培地
6.2.1
JISとほぼ同じ
変更
ISO規格の記載に変えて,JIS Z 2801を引用
するよう変更した。
実質的な技術的な問題はな
い。
6.2.3 ニュートリエ
ント寒天培地
6.2.3
JISとほぼ同じ
変更
JISでは,ニュートリエント寒天培地を調製
する際,化学はかりを使い,寒天を培地成分
を溶解し,pHの調整後に,加えることとした。
実質的な技術的な問題はな
い。
6.2.4 ニュートリエ
ント寒天斜面培地
−
−
追加
JISでは,ニュートリエント寒天斜面培地の
調製方法を追加した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
3
R
1
7
0
2
:
2
0
2
0
51
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 材料(続き)
6.2.5 SCDLP培地
6.2.4
JISとほぼ同じ
変更
ISO規格の記載に変えて,JIS Z 2801を引用
するよう変更した。
実質的な技術的な差異はな
い。
6.2.6 生理食塩水
6.2.5
JISとほぼ同じ
変更
ISO規格の記載に変えて,調製方法は,JIS L
1902を引用するよう変更した。
実質的な技術的な差異はな
い。
6.2.7 洗い出し用生
理食塩水
6.2.6
JISとほぼ同じ
変更
ISO規格の記載に変えて,調製方法は,JIS L
1902を引用するよう変更した。
実質的な技術的な差異はな
い。
6.2.8 普通寒天培地
−
−
追加
附属書JAで使用するため,普通寒天培地を
規定し,JIS Z 2801を引用するよう追加した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
6.2.9 普通寒天斜面
培地
−
−
追加
附属書JAで使用するため,普通寒天斜面培
地を規定し,JIS Z 2801を引用するよう追加
した。。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
6.2.10 りん酸緩衝生
理食塩水
−
−
追加
附属書JAで使用するため,りん酸緩衝生理
食塩水を規定し,JIS Z 2801を引用するよう
追加した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
6.2.11 標準寒天培地
−
−
追加
附属書JAで使用するため,標準寒天培地を
規定し,JIS Z 2801を引用するよう追加した。
規格使用者が分かりやすく
するために変更した。実質的
な技術的差異はない。
6.2.12 エタノール
(C2H5OH)
−
−
追加
引用しているJIS及び試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.13 寒天
−
−
追加
引用しているJIS及び試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.14 塩化ナトリウ
ム(NaCl)
−
−
追加
引用しているJIS及び試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.15 精製水
−
−
追加
引用しているJISの説明を追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
3
R
1
7
0
2
:
2
0
2
0
52
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
6 材料(続き)
6.2.16 非イオン界面
活性剤
−
−
追加
ガラス密着法で使用する試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.17 水酸化ナトリ
ウム(NaOH)
−
−
追加
引用しているJIS及び試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.18 塩酸(HCl)
−
−
追加
引用しているJIS及び試薬の説明を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.2.19 綿標準布
−
−
追加
ガラス密着法で使用する標準布についてJIS
L 0803を引用するよう追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
6.3 殺菌方法
6.3.1 高圧蒸気殺菌
−
−
追加
高圧蒸気殺菌器を用いた殺菌手順を追加し
た。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7 装置及び機器
7.1 試験装置
7
JISとほぼ同じ
追加
JISでは光照射装置を追加した。図の記号に
光照射装置及び保存シャーレを追加した。
ISO規格改正時に,光照射装
置の追加について提案を検
討する。
7.2 密着フィルム
7.3 密着ガラス
7.4 保湿用ガラス
7.1
7.2
7.3
JISとほぼ同じ
追加
JISでは,試験片が標準の大きさ以外の場合
のフィルムの大きさについて追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
7.5 保存シャーレ
−
−
追加
試験片を設置するシャーレについて規格を引
用して追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.6 調湿用ろ紙
−
−
追加
調湿用ろ紙について規格を引用して追加し
た。
ISO規格改正時に,規定の追
加について提案を検討する。
7.7 ガラス管・ガラス
棒
7.4
JISとほぼ同じ
変更
JISでは,JIS R 3644又はJIS R 3645を引用
するよう変更し,加えて長さと形状に関する
規定を変更した。
実質的な技術的な差異はな
い。
7.9 光照射装置
−
−
追加
JISでは,光源が設置でき,周囲からの光を
遮断することができる装置と規定した。
ISO規格改正時に,規定の追
加について提案を検討する。
3
R
1
7
0
2
:
2
0
2
0
53
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7 装置及び機器
(続き)
7.10 紫外放射照度計
7.6
JISとほぼ同じ
追加
JISでは,ISO規格の記載に変えて,JIS R
1709を引用するよう変更した。また,計測下
限値を規定した。
実質的な技術的な差異はな
い。
7.12 暗箱
−
−
追加
暗所保管用の箱を規定した。
ISO規格改正時に,改正提案
を検討する。
7.13 綿栓
−
−
追加
用語の定義を追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.14 シャーレ
−
−
追加
JIS K 0950を引用するよう追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.15 安全キャビネッ
ト
−
−
追加
JIS K 3800を引用するよう追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.16 ピペット
−
−
追加
JIS K 0970又はJIS R 3505を引用するよう追
加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.17 化学はかり
−
−
追加
JIS K 0050を引用するよう追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
7.18 pH計
−
−
追加
JIS Z 8802を引用するよう追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
8 試験片
8.1 フィルム密着法
8.1
JISとほぼ同じ
変更
平板状材料及び無菌化処置についての記載を
JISでは本文に記載した。
実質的な技術的な差異はな
い。
8.2 ガラス密着法
8.2
JISとほぼ同じ
追加
JISでは,高圧蒸気殺菌後の乾燥後に,ガラ
ス製シャーレの蓋をすることを追記した。加
えて,無加工試験片が準備できない場合に使
用する綿標準布について追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
3
R
1
7
0
2
:
2
0
2
0
54
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
9 試験方法
9.1 一般事項
9
JISとほぼ同じ
追加
JISでは,光の当たらない場所での試験方法
をフローチャートに追記した。また,試験片
の取り扱う作業で紫外放射の影響を取り除い
てから試験するよう追加した。
ISO規格改正時に,追加につ
いて提案を検討する。
9.2 フィルム密着法
9.2.2 試験片の設置
9.1.2
JISとほぼ同じ
追加
JISでは,試験面の規定,高圧蒸気殺菌によ
ってろ紙が湿った場合の対応を追加した。図
6を追加し,試験片の設置について説明を追
加した。
滅菌水量についての注記をJISでは本文に記
載した。
ISO規格改正時に,追加につ
いて提案を検討する。
9.2.3 試験菌液の接
種
9.1.2
JISとほぼ同じ
追加
JISでは,手順を全ての試験片で行うことを
追加した。
試験菌液量についての注記をJISでは本文に
記載した。
ISO規格改正時に,追加につ
いて提案を検討する。
9.2.4 試験菌の洗い
出し
9.1.3
9.1.4
JISとほぼ同じ
追加
JISでは,洗い出し液を速やかに測定に用い
ることを追記した。
実質的な技術的な問題はな
い。
9.3 ガラス密着法
9.3.1 試験菌の培養
9.2.1
a)〜c)
JISとほぼ同じ
追加
JISでは,一度コロニーを採取した平板は再
度用いてはならないことを追加した。
実質的な技術的な問題はな
い。
9.3.3 試験片の設置
9.2.2
JISとほぼ同じ
追加
JISではガラス板の大きさ,ろ紙が湿った場
合の対応を追加した。図7を追加し,試験片
の設置について説明を追加した。
滅菌水量についての注記をJISでは本文に記
載した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
9.3.4 試験菌液の接
種
9.2.2
JISとほぼ同じ
追加
JISでは,手順を全ての試験片で行うことを
追加した。
試験菌液についての注記をJISでは本文に記
載した。
実質的な技術的な差異はな
い。
9.3.5 試験菌の洗い
出し
9.2.3
9.2.4
JISとほぼ同じ
追加
JISでは,洗い出し液にSCDLP培地を追加し
た。
実質的な技術的な差異はな
い。
3
R
1
7
0
2
:
2
0
2
0
55
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
9 試験方法
(続き)
9.4 紫外光照射条件
9.4.1 紫外放射照度
の測定及び試験片設
置位置の準備
9.3.2
JISとほぼ同じ
追加
JISでは,紫外放射照度を測定する場合は,
紫外放射照度を安定化させるため,照射装置
の光源を30分以上予備点灯しておくことを
追加した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
9.4.2 光照射条件
9.3.29.
3.3
JISとほぼ同じ
追加
JISでは,参考情報として附属書JB及び附属
書JCを引用した。紫外光による細菌の損傷を
避けるために紫外放射照度の上限を本文中で
規定した。
ISO規格の試験で使用されて
おり,実質的な技術的な差異
はない。
9.4.3 試験菌液を接
種した試験片の光照
射
9.3.1
9.3.4
JISとほぼ同じ
追加
JISでは,試験片周囲の温度を25 ℃±3 ℃に
維持しておくことを追加した。
光照射時間についての注記をJISでは本文に
記載した。
ISO規格改正時に,追加につ
いて提案を検討する。
9.4.4 試験菌液を接
種した試験片の暗所
での保存
9.3.1
9.3.5
JISとほぼ同じ
追加
JISでは,試験片周囲の温度を25 ℃±3 ℃に
維持しておくことを追加した。
ISO規格改正時に,追加につ
いて提案を検討する。
10 試験結果の
計算
10.1 一般事項
10
JISとほぼ同じ
追加
JISでは,抗菌活性値の計算時及び報告書に
記載する平均値の取扱いについて追加した。
実質的な技術的な差異はな
い。
10.2 フィルム密着法
10.2.1 生菌数の計算
10.1.1
JISとほぼ同じ
追加
JISでは,洗い出し液1.0 mlを用いたシャー
レから生残菌が認められない場合の表示を追
加した。
実質的な技術的な差異はな
い。
10.2.2 試験結果の計
算
10.1.1
10.1.2
JISとほぼ同じ
変更
JISでは,記号及び記号の添え字を変更した
(Logmax,Logmean,Logmin)。規格使用者が分
かりやすくするために変更した。
実質的な技術的な差異はな
い。
10.3 ガラス密着法
10.3.1 生菌数の計算
10.2.1
JISとほぼ同じ
追加
JISでは,洗い出し液1.0 mlを用いたシャー
レから生残菌が認められない場合の表示を追
加した。
実質的な技術的な差異はな
い。
10.3.2 試験結果の計
算
10.2.1
10.2.2
JISとほぼ同じ
変更
ISO規格では,MBA,MBD,MBL,MD,MLは
3個の試験片の生菌数の常用対数値の算術平
均値としているが,JISでは,生菌数の算術
平均値の常用対数値に変更した。
JIS L 1902に合わせた。ISO
規格改正時に,算出方法の変
更についての提案を検討す
る。
3
R
1
7
0
2
:
2
0
2
0
56
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
11 抗菌効果の
判定
a) 光照射条件下での
フィルム密着法によ
る判定
−
−
追加
平板状の光触媒抗菌加工平材料の抗菌活性値
が2.0以上で抗菌効果があると判定すること
を追加とした。
JISとして規定した。
各国又は製品によって判定
基準は変わる可能性があり,
そのためJISには追加した。
b) 光が当たらない環
境でのフィルム密着
法による判定
−
−
追加
附属書JAによって算出した抗菌活性値が2.0
以上で抗菌効果があると判定することを追加
とした。
JISとして規定した。
各国又は製品によって判定
基準は変わる可能性があり,
そのためJISには追加した。
c) 光照射条件下での
ガラス密着法による
判定
−
−
追加
繊維状の光触媒抗菌加工材料の抗菌活性値が
2.0以上で抗菌効果があると判定することを
追加とした。
JISとして規定した。
各国又は製品によって判定
基準は変わる可能性があり,
そのためJISには追加した。
d) 光が当たらない環
境でのガラス密着法
による判定
−
−
追加
JIS L 1902の8.1.5.2によって算出した抗菌活
性値が2.0以上で抗菌効果があると判定する
ことを追加とした。
JISとして規定した。
各国又は製品によって判定
基準は変わる可能性があり,
そのためJISには追加した。
12 試験結果の
報告
11
JISとほぼ同じ
変更
追加
JISでは,ISO規格及び項目の構成を変更し
た。ハイブリッド光触媒抗菌加工した試験片
で附属書JAの試験を実施した場合の記載に
ついて追加した。さらに,必要な事項及び結
果の表示例を追加した。
実質的な技術的な差異はな
い。
附属書JA(規定)
平板状のハイブ
リッド光触媒抗
菌加工材料の光
が当たらない環
境での抗菌性試
験方法及び抗菌
効果
−
−
追加
JISでは,平板状のハイブリッド光触媒抗菌
加工材料の光が当たらない環境での抗菌性試
験方法及び抗菌効果の詳細を追加した。
国内での製品認証に必要な
項目のため追加した。
3
R
1
7
0
2
:
2
0
2
0
57
R 1702:2020
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごとの評価及
びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書JB(参考)
住環境における
紫外放射照度及
び照度分布(戸
建住宅)
−
−
追加
JISでは,試験条件を設定する場合に,参考
とするために追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
附属書JC(参考)
住環境における
紫外放射照度分
布(場所別一覧)
−
−
追加
JISでは,試験条件を設定する場合に,参考
とするために追加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
附属書JD(参考)
光触媒による抗
菌性評価結果
−
−
追加
JISでは,光触媒による抗菌性評価結果を追
加した。
規格使用者の理解のため,
JISに追加した。実質的な技
術的な差異はない。
JISと国際規格との対応の程度の全体評価:ISO 27447:2009,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
R
1
7
0
2
:
2
0
2
0










































