3
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 患者にエネルギーを与え及び/又は患者からエネルギーを取り出すか?
考慮することが望ましい要因には,伝達されるエネルギーの種類,その制御,質,量,時間係数な
どがある。
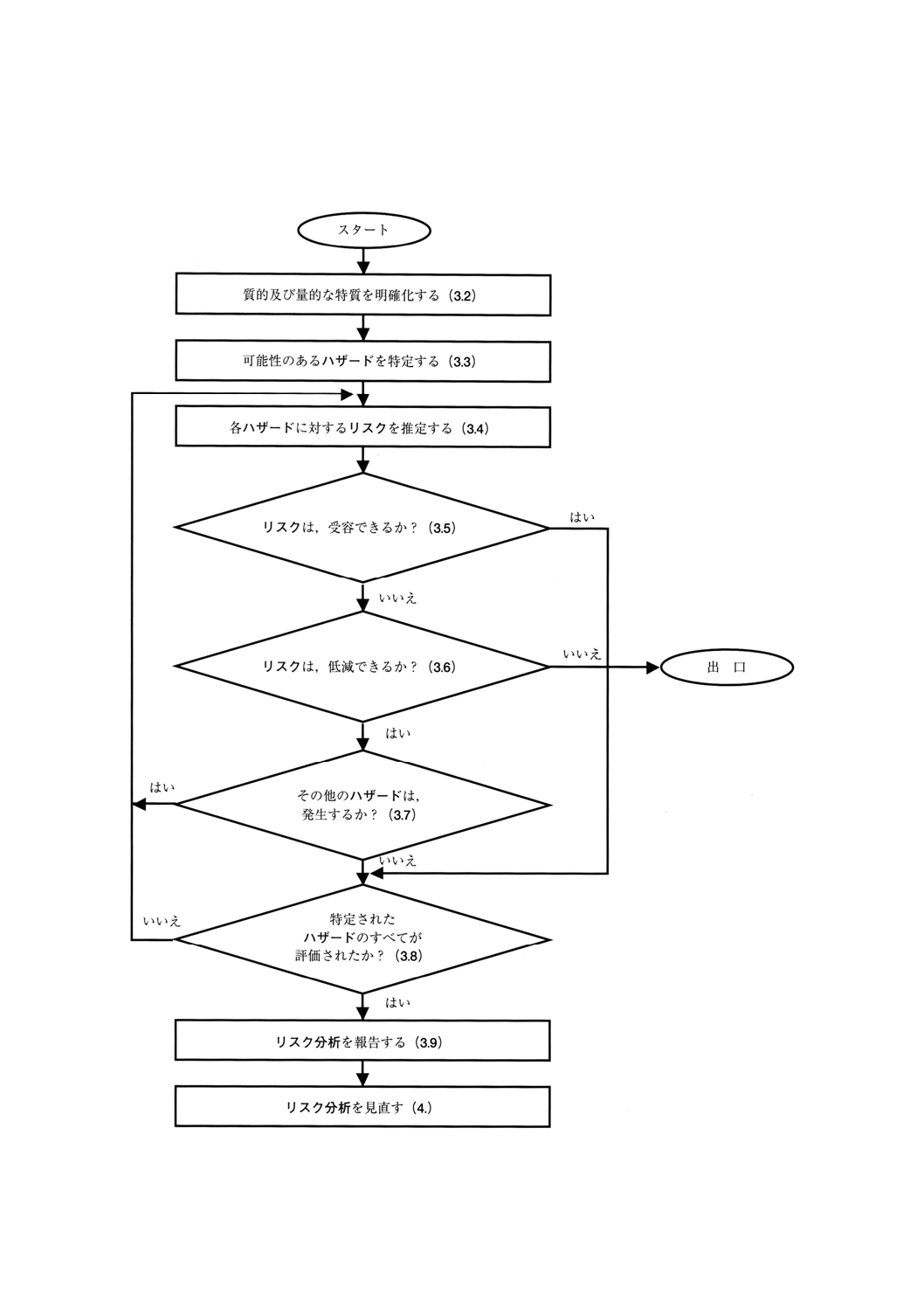
図1 リスク分析手順の流れ図
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,日本医療機器関係団体協議会から工業標準原
案を具して日本工業規格を制定すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣
及び経済産業大臣が制定した日本工業規格である。
JIS Q 14971-1には,次に示す附属書がある。
附属書A(参考) インビトロ診断用具に関するリスク分析手順の指針
附属書B(参考) 毒性学的なハザードに関するリスク分析手順の指針
附属書C(参考) 医療用具に関連して起こる可能性があるハザード及び関連する要因の例
附属書D(参考) リスク分析手法に関する情報
附属書E(参考) リスク分析と他のリスクマネジメント活動との簡素化された関係
附属書F(参考) 参考文献
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目次
ページ
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 1
2. 定義 ······························································································································ 2
3. 手順 ······························································································································ 2
3.1 一般 ···························································································································· 2
3.2 医療用具に関する質的及び量的な特質の明確化 ···································································· 2
3.3 可能性のあるハザードの特定 ···························································································· 5
3.4 各ハザードに対するリスクの推定 ······················································································ 5
3.5 リスクの審査 ················································································································ 5
3.6 リスクの低減 ················································································································ 6
3.7 その他のハザードの発生·································································································· 6
3.8 すべての特定されたハザードの評価 ··················································································· 6
3.9 リスク分析の報告 ·········································································································· 6
4. リスク分析の見直し ········································································································· 6
附属書A(参考) インビトロ診断用具に関するリスク分析手順の指針 ··········································· 7
附属書B(参考) 毒性学的なハザードに関するリスク分析手順の指針 ··········································· 8
附属書C(参考) 医療用具に関連して起こる可能性があるハザード及び関連する要因の例 ················ 10
附属書D(参考) リスク分析手法に関する情報 ········································································ 12
附属書E(参考) リスク分析と他のリスクマネジメント活動との簡素化された関係 ························· 14
附属書F(参考) 参考文献 ··································································································· 15
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
Q 14971-1 : 2001
(ISO 14971-1 : 1998)
医療用具−
リスクマネジメント−
第1部:リスク分析の適用
Medical devices−Risk management−Part 1 : Application of risk analysis
序文 この規格は,1998年に発行されたISO 14971-1, Medical devices−Risk management−Part 1 :
Application of risk analysisを翻訳し,技術的内容及び規格票の様式を変更することなく作成した日本工業規
格である。
リスクの受容度を含めた安全性について判断を下すことは,医療用具の意図した用途への適格性を決め
るために必す(須)なことである。安全性の認知に影響を与える要因として,その社会の社会経済的及び
教育的背景,患者の現状及び予想される状況と状態とが含まれる。そのような判断には,医療用具の意図
した用途,性能,リスクと効用,及び臨床上の処置にかかわるリスクと効用とが考慮されなければならな
い。
リスクをコントロールするためのすべてのプロセスは,リスクマネジメントに属する。この規格は,医
療用具の適用に関して,仮定事象によって起こる可能性がある結果の量的又は質的ながい(蓋)然性の推
定に基づくリスク分析の手法について規定している。このリスク分析の手法は,リスクマネジメントに関
する総合的なプロセスの最初の一歩である。リスクマネジメント全体のプロセスを完成するために,流れ
図(図1参照)にはリスク評価及びリスクコントロールの要素が含まれている。リスク分析,リスク評価,
及びリスクコントロールの間の関係を附属書Eに示す。リスクマネジメント全般については,検討中であ
る。
なお,この規格で点線の下線を施してある参考は,原国際規格にない事項である。
1. 適用範囲 この規格は,医療用具に関連するハザードの特定及びリスクの推定によって,インビトロ
診断用具又は附属品を含む医療用具の安全性を,利用可能な情報を用いて,調査する手順を規定する。
この規格は,適切な規格がないか,あっても使用されていない分野において特に助力となる。この規格
は,受容度の水準を規定するものではない。受容度の水準は,このような規格に規定できない種々の要因
によって決定されるからである。
この規格は,リスクマネジメントの全容に関する指針を示すことを目的としたものではない。さらに,
特定の医療用具を使用するための適応及び禁忌事項の内容を評価することを意図するものでもない。
備考 この規格の対応国際規格を,次に示す。
なお,対応の程度を表す記号は,ISO/IEC Guide21に基づき,IDT(一致している),MOD(修
正している),NEQ(同等でない)とする。
2
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ISO 14971-1 : 1998 Medical devices−Risk management−Part 1 : Application of risk analysis (IDT)
2. 定義 この規格で用いる主な用語の定義は,次による。
2.1
損傷 (harm) 健康に対する身体的傷害及び/又は財産(所有物)に対する損害。 (ISO/IEC Guide
51)
参考 損傷は,死亡などの傷害も含める。
2.2
ハザード (hazard) 損傷を発生する潜在的な源。 (ISO/IEC Guide 51)
2.3
リスク (risk) 損傷をもたらすハザードの予想される発生確率及び損傷の程度。 (ISO/IEC Guide
51)
2.4
リスク分析 (risk analysis) ハザードを特定し,リスクを推定するための,利用可能な情報の調査。
備考1. 附属書Eを参照する。
2. 情報源の事例は,3.4の備考3.に示す。
2.5
安全性 (safety) 損傷に対する受容できないリスクがないこと。 (ISO/IEC Guide 51)
3. 手順
3.1
一般 製造業者は,図1の流れ図及び3.2〜3.9に規定するリスク分析の手順によらなければならな
い。また,そのリスク分析の手順の実施及び結果を文書化し,維持しなければならない。
備考1. リスク分析は,品質システムの一部として実行することができる。
2. リスク分析の手順の実施と結果の文書化は,最小限として次を包含することが望ましい。
a) 対象とする医療用具又は附属品に関する完全な記述と識別
b) 3.3で特定した可能性のあるハザードの一覧表
c) 受容できる水準までリスクを低減させた方法
d) リスク分析を実施した当事者の明確化
3.2
医療用具に関する質的及び量的な特質の明確化 対象とする特定の医療用具又は附属品に対して,
安全性に影響を与えるすべての特質を列挙することが望ましい。該当する場合には,その特質の限度を列
挙することが望ましい。
備考1. インビトロ診断用具のリスク分析手法に関する追加指針を,附属書Aに示す。
2. 毒物学的ハザードのリスク分析手法に関する追加指針を,附属書Bに示す。
次の質問事項は,特質の列挙を行ううえで有効な指針となる。
a) 医療用具の意図する用途は何か,それはどのように使われるか?
考慮することが望ましい要因には,意図した使用者は誰か,使用者として必要な技術及び訓練,人
間工学的観点,使用される環境,据付けは誰がするか,患者がその医療用具の使用に関して制御でき
るか又は影響を与えるかなどがある。身体障害者,老人及び子供の特別な要求がある使用者に対して
は,特別な配慮をすることが望ましい。これらの要求として,医療用具の使用を可能にするために他
の人による助力が必要かもしれない。
b) 医療用具は,患者又はその他の人に接触することを意図しているか?
考慮することが望ましい要因には,意図した接触,体表面接触,侵襲的接触及び埋込み並びにそれ
ぞれについて接触の期間と頻度などがある。
c) どのような材料及び/又は部品を使用しているか?
考慮することが望ましい要因は,安全性に関連する特質が分かっているかどうかである。

3
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 患者にエネルギーを与え及び/又は患者からエネルギーを取り出すか?
考慮することが望ましい要因には,伝達されるエネルギーの種類,その制御,質,量,時間係数な
どがある。
図1 リスク分析手順の流れ図
4
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
e) 患者に投与したり,及び/又は患者から採取する物質はあるか?
考慮することが望ましい要因には,その物質は投与されるか又は採取されるか,その物質は単一の
物質又は一連の物質群か,最大・最小投与・採取速度とその制御方法などがある。
f)
その医療用具は,生体物質を処理して再利用するためのものか?
考慮することが望ましい要因には,処理のプロセス,処理される物質の種類などがある(例えば,
自動輸液装置及び透析装置)。
g) 医療用具は,滅菌されて供給されるのか,若しくは未滅菌で供給され使用者が滅菌することを意図す
るか,又は他の微生物制御法が適用できるか?
考慮することが望ましい要因には,医療用具は,使い捨てを意図するか,再利用を意図するか,滅
菌包装形態,使用期限,再利用回数の制限,用いるべき滅菌方式などがある。
h) 医療用具は,患者の環境を変更することを意図しているか?
考慮することが望ましい要因には,温度,湿度,雰囲気ガスの組成と圧力などがある。
i)
測定をするか?
考慮することが望ましい要因には,測定するパラメータ,測定確度,測定精度などがある。
j)
医療用具は,解釈機能をもっているか?
考慮することが望ましい要因には,入力したデータ又は収集したデータから医療用具が結果を表示
するかどうか,そして使われるアルゴリズム,信頼の限界などがある。
k) 医療用具は,その他の医療用具若しくは薬剤を制御することを意図するか,又はそれらと相互に作用
することを意図するか?
考慮することが望ましい要因には,関与する他の医療用具又は薬剤の特定,その相互作用に関連し
て引き起こされる潜在的な問題などがある。
l)
好ましくないエネルギー又は物質を排出するか?
エネルギーに関連して考慮することが望ましい要因には,騒音と振動,熱,放射線(電離,非電離
及び紫外線,可視光線,赤外線の放射),接触温度,漏れ電流,電磁場などがある。
物質に関連して考慮することが望ましい要因には,化学的排出物,廃棄物,体液などがある。
m) 医療用具は,環境的影響を受けやすいか?
考慮することが望ましい要因には,こぼれ並びに電力及び冷却の供給を含めて使用・輸送・保管の
環境などがある。
n) 医療用具に関連する必すの消耗品及び附属品が存在するか?
考慮することが望ましい要因には,消耗品及び附属品についての仕様書,使用者がそれらを選ぶ際
の制限条件などがある。
o) 保守及び/又は校正を必要とするか?
考慮することが望ましい要因には,保守及び/又は校正は,操作者若しくは使用者又は専門家によ
って実施されるべきかどうかなどがある。
p) 医療用具は,ソフトウェアを含んでいるか?
考慮することが望ましい要因には,ソフトウェアが使用者及び/又は操作者によってインストール,
修正又は交換されることを意図するかどうかなどがある。
q) 医療用具には,使用期限に関する制約があるか?
考慮することが望ましい要因には,ラベリング又は標識,該当医療用具の処分などがある。
参考 ラベリングの定義は,JIS Q 13485を参照する。
5
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
r) 使用が遅れた場合及び/又は長期間使用した場合の影響はどうか?
考慮することが望ましい要因には,人間工学的影響及び蓄積効果などがある。
s)
医療用具は,どのような機械的力を受けるか?
考慮することが望ましい要因には,医療用具が受ける力は使用者によって制御されるか,又は使用
者以外の人とのやりとりによって制御されるものであるかなどがある。
t)
何が医療用具の寿命を決めるか?
考慮することが望ましい要因には,老朽化,電池の消耗などがある。
u) 医療用具は,使い捨てを意図するか又は再利用を意図するか?
3.3
可能性のあるハザードの特定 附属書C及びインビトロ診断用具についての附属書A.2に記載され
ている可能性のあるハザードの例を用いて,正常状態及び故障状態の両方における医療用具に関連する潜
在的なハザードの一覧表を作成する。
3.4
各ハザードに対するリスクの推定 3.3に基づき特定された可能性のあるハザードのそれぞれにつ
いて,入手できる情報/データを用いて正常状態及び故障状態の両方におけるリスクを推定する。分析中
のリスクレベルについての尺度を設定するために,リスク推定では特定されたハザードのきっかけとなる
事象又は環境,関連する事象のつながり,緩和特性,及び起こる可能性がある有害な結果の性質と頻度と
を調査することが望ましい。
備考1. リスクを分析するために,リスクの要素(すなわち,重大性及び確率)は,個別に分析され
ることが望ましい。定量的又は定性的な手法が適宜用いられてよい。これは,次の質問に対
する回答を含む。
− 医療用具の故障がなくても,ハザードは存在するか?
− 医療用具の故障状態において,ハザードは存在するか?
− 多重故障状態の場合に限って,ハザードは存在するか?
附属書D及びインビトロ診断用具についての附属書A.3には,幾つかの使用可能なリス
ク分析の手法についての情報を記載している。
2. リスク分析のために使用できる手法には,FMEA(故障モード影響解析),FTA(故障の木解
析)及びHAZOPがある。その手法の必要性,選択及び使用は,医療用具の性質に基づいて
行われるが,この規格の範囲外である。
附属書Dは,使用できる手法の幾つかについて簡単な要約を示している。この概念におけ
るそれ以上の詳細については,IEC 60300-3-9を参照する。参考文献については,附属書F
を参照する。
3. 情報/データは,例えば,次によって得ることができる。
− 関連する規格
− 科学的データ
− 公表された事故報告を含む既に使用中の類似の医療用具による市場データ
− 臨床的な証拠
− 適切な調査結果
3.5
リスクの審査 与えられたハザードに対するリスクが,関連規格に適合することによって適切性が
示され,又は受容性がその他の手段によって実証されている場合には,3.8に進む。3.4によって推定され
たハザードに対するリスクが関連規格の適用又は他の方法によって定義された受容性の限界の水準を超
えている場合には,3.6に進む。
6
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
医療用具が故障した状態でだけリスクが受容性の限界を超えていると判断される場合には,故障の発生
の可能性を分析することが望ましい。この分析を行う場合には,次の問題を配慮することが望ましい。
− 故障は,ハザードの発生以前に使用者によって検知することが可能か?
− 故障は,製造上の更に効果的な管理又は予防的保守によって除去することができるか?
− 誤った使い方によって故障発生の可能性は増すか?
− 警報装置を付けることはできるか?
3.6
リスクの低減 リスクが適切に低減される場合は,3.7に進む。リスクが適切に低減されない場合に
は,リスク分析手順の流れから出る。
リスクは,次のような適切な手法によって,受容レベルにまで軽減することができる。
a) 直接的な安全手段(設計)。
b) 間接的な安全対策(保護手段)。保護手段の例としては,
− 近づきやすさを制限する。例えば,放射線傷害に対して
− ハザードから遮へいする。例えば,保護カバーの手段によって
c) 記述的安全手段。例えば,医療用具の使用期間又は頻度の制限,並びに用途,寿命又は環境の制限。
d) 用途の再明確化。
3.7
その他のハザードの発生 リスク低減の方法が,新しいハザードをもたらしたかどうかを判定する。
3.8
すべての特定されたハザードの評価 すべての特定されたハザードに対しリスクの評価が終わった
場合には,3.9に進む。評価が終わっていない場合には,3.4に戻る。
備考 第三者の検証がされていない場合には,IEC 60300-3-9の5.5に示した分析検証をしてもよい。
3.9
リスク分析の報告 特定されたハザードに付随する残ったリスクが受容できるかどうかを判断する
ために,3.1によったリスク分析の結果を文書で残す。その際,医療用具の意図した用途及び使用に関し
て考慮する。
4. リスク分析の見直し 新しい情報及びデータに照らしてリスク分析の見直しが考慮されることが望ま
しい。
備考 時間の経過とともにリスクが変わるならば,リスク分析の見直しが必要になるかもしれない。
急速に変化する技術は,すでに特定されたハザードに対するリスクを除去したり,増加又は減
少する可能性がある。
新たなリスクが,この見直しによって生じたり又は特定される可能性がある。
7
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A(参考)
インビトロ診断用具に関するリスク分析手順の指針
序文 この附属書(参考)は,インビトロ診断用具に関するリスク分析手順の指針について記述するもの
であり,規定の一部ではない。
A.1 一般 この附属書は,インビトロ診断用具のリスク分析について,追加的指針を与える。規定の際に
当該医療用具の特殊性と固有の状況とを考慮した。インビトロ診断用具の使用は,患者又は検査対象者に
対して,いかなる直接的リスクも引き起こさない。これらの医療用具は人体の内部に入れたり,人体の表
面に接触させたりしないからである。ただし,ある種の状況の下で,医療用具に関連するハザードから間
接的リスクが生じた結果,誤った決定を導いたり,又はそれをもたらすかもしれない。それに加えて,使
用者に関連するハザード及びそのハザードに付随するリスクが考慮されることが望ましい。
A.2 ハザードの特定 次の状況は,附属書Cに記述した観点に追加して,患者又は検査対象者に対する潜
在的なハザードを,それぞれ特定することが望ましい。
− バッチの不均等性,バッチ間の不一致性
− 一般的干渉要因
− キャリオーバ効果(持越されたものからの影響)
− 試料の識別間違い
− 安定性の問題(保管中,輸送中,使用時及び容器の最初の開こん後)
− 試料の採取,準備及び安定性に関する問題
− 必要条件の不十分な仕様
使用者に対する潜在的なハザードは,試薬が放射性,感染性,有毒性,又はその他の危険な成分をもっ
ていること及び包装の設計からもたらされる。器械に対しては,どの器械にも不特定の医療用具に関連す
るハザード(例えば,エネルギーによるハザード)に加えて,特に運搬操作及び保守の期間中における潜
在的な汚染の問題を考慮することが望ましい。
A.3 リスクの推定 各ハザードに対するリスクの推定において,次の状況を判断の中に取り入れることが
望ましい。
− 分析結果における信頼の限度(医学的判断に対する寄与度)
− もっともらしさの確認
− 対照の適用性と使用
− 検査室において適用される品質保証手段,技術
− 欠陥,誤りの発見のしやすさ
− 使用の状態(例えば,救急用)
− 専門家による使用,非専門家による使用
8
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(参考)
毒性学的なハザードに関するリスク分析手順の指針
序文 この附属書(参考)は,毒性学的なハザードに関するリスク分析手順の指針について記述するもの
であり,規定の一部ではない。
B.1 一般 この附属書は,毒性学的なハザードの観点からリスク分析手順の指針を与える。毒性学的なハ
ザードは,生物学的損傷をもたらす化学的な成分によるものである。ISO 10993-1は,材料及び医療用具
の生物学的な評価に対する一般的原理を述べている。
不必要な動物実験を避ける努力をすることが望ましい。動物愛護の要求事項についてのISO 10993-2及
び関連する国の法律,例えば,動物保護についてのEC指令 (86/609/EEC) に留意する。
もし,その試験の省略が科学的に正当化できるならば,省略してもよい。
B.2 毒性学的リスクの推定
B.2.1 一般 毒性学的リスク分析は,次の点を考慮することが望ましい。
− 材料の化学的性質
− 材料の使用前歴
− 生物学的安全性試験データ
データの量と評価の深さは,意図する用途によって変化し,患者との接触の状態と期間とに左右される。
包装材料及び損なわれていない皮膚に接する医療用具並びに身体組織,注入液,粘膜又は負傷した皮膚と
直接接触しない医療用具の構成品に対するデータの要求は,通常それほど厳しくない。
追加的データが必要か否かを決定するために,科学的文献から得られる材料及び医療用具の現在の知識,
過去の臨床経験,その他関連するデータを検討することが望ましい。ある場合には,成分データ,残留物
のデータ(例えば,滅菌プロセス,モノマー),生物学的試験データなどを得ることが必要になることがあ
る。
B.2.2 材料の化学的性質 材料の化学的特性及び生物学的反応の特質を明確にした情報は,その意図した
用途のために医療用具の評価に有用である。材料の生物学的適合性に影響を与える因子には,次の事項が
ある。
− すべての成分(例えば,添加物,処理助材,モノマー,触媒及び反応生成物)の識別,濃度,生体移
行性及び毒性
− 材料に対する生体内分解性及び腐食の影響
反応性又は有害性のある成分の使用又は生成が,材料の製造,処理,保管又は分解において起こる場合
には,それらの残留物に対する生体暴露の可能性を考慮することが望ましい。残留物の濃度及び/又は溶
出に関する情報を得ることが必要である。これは,実験的データ又は当該材料の化学に関する情報によっ
て形成される。完全な成分組成が秘密性のために製造業者が利用できない場合には,提案された用途に使
用するための材料の適切性が評価されていることを検証することが望ましい。
9
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.2.3 使用前歴 各材料又は意図的に添加されたものの使用前歴及び経験した有害な作用に関して利用で
きる情報は調べることが望ましい。しかし,ある成分又は材料が以前に使われたからといって類似の用途
に使われる場合に,適切性を保証できるとは限らない。意図される用途・成分の濃度・最新の毒性学的情
報を考慮することが望ましい。
B.2.4 生物学的安全性試験データ ISO 10993-1は,どの試験をどの用途に適用するかの指針である。試験
の必要性は,存在するデータに照らしてケースバイケースで検討することが望ましい。その結果として,
不必要な試験は,省略することができる。
10
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C(参考)
医療用具に関連して起こる可能性があるハザード及び関連する要因の例
序文 この附属書(参考)は,医療用具に関連して起こる可能性があるハザードと関連する要因の例につ
いて記述するものであり,規定の一部ではない。
C.1 一般 C.2〜C.6に,種々の医療用具に関連して起こる可能性があるハザードと関連する要因に関して
のリストを示す。ただし,すべてを網羅しているわけではない。リストは,リスク分析手順の3.3におい
て起こる可能性があるハザードの明確化への手助けを目的とする(図1の3.3参照)。
C.2 エネルギーのハザード
− 電気
− 熱
− 機械的な力
− 電離放射線
− 非電離放射線
− 電磁場
− 可動部分
− 懸垂物体
− 患者を支える装置の故障
− 圧力(容器の破裂)
− 音圧
− 振動
− 磁場(例えば,MRI)
C.3 生物学的なハザード
− 生物的汚染
− 生物不適合性
− 不正確な産出物(物質/エネルギー)
− 間違った成分組成(化学組成)
− 毒性
− アレルギー性
− 変異原性
− 催奇形性
− 発がん性
− (交差)感染
− 発熱性
− 衛生上の安全を維持できない
11
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− 退化
C.4 環境的なハザード
− 電磁干渉
− 電力又は冷却材の不適切な供給
− 冷却の制限
− 規定された環境条件を外れて操作する可能性
− その他の機器との不適合性
− 偶発的な機械的損害
− 廃棄物及び/又は医療用具の廃棄による汚染
C.5 医療用具の使用に関連するハザード
− 不適切なラベリング
− 不適切な取扱説明書
− 不適切な附属品の仕様書
− 不適切な使用事前点検の仕様書
− 複雑すぎる取扱説明書
− 使いにくい,まとまりのない取扱説明書
− 未熟練な要員による使用と未訓練者による使用
− 合理的に予見できる誤使用
− 副作用に関する不十分な警告
− 使い捨て医療用具の再使用しがちなハザードに関する不適切な警告
− 不正確な計測及びその他の計量状態
− 不正確な診断
− 間違ったデータ転送
− 結果の誤表示
− 消耗品,附属品,その他の機器との不適合性
C.6 機能的故障,保守及び老朽化によってもたらされるハザード
− 意図した用途に対して性能特性が不適切
− 保守後の機能点検を含めた保守仕様の欠如又は不適切さ
− 不適切な保守
− 医療用具の寿命が適切に決められていない
− 機械的完全性(気密性,剛性など)の喪失
− 不適切なこん(梱)包(医療用具の汚染及び/又は劣化)
− 不適切な再使用
12
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D(参考)
リスク分析手法に関する情報
序文 この附属書(参考)は,リスク分析手法に関する情報について記述するものであり,規定の一部で
はない。
D.1 一般 この附属書は,3.4のリスク分析に利用できる手法についての指針を与える。これらの手法は補
足的なもので,一つ以上を使用する必要があるかもしれない。想定された事象の結果を一つ一つ分析する
ということが基本原理である。
D.2 FMEA(故障モード影響解析) FMEAは,本来定性的な手法であり,これによって個々の構成要素
の故障モードの結果を体系的に特定し評価する。これは“もし……ならば,出力はどうなるだろうか?”
という問いを用いた帰納的手法である。構成要素は,一度に一つずつ分析され,一般的に単一故障状態ま
で検討される。これは,“ボトムアップ”方式で行われる。つまり,プロセスを進めることで一段ずつ高い
機能システムレベルに上がっていく。
結果の重大性の程度の調査,それぞれの影響の発生確率及びその検出可能性を統合することでFMEAは
拡大され,これによって,いわゆる故障モード影響重大度解析 (FMCEA) となる。このような分析を行う
には,医療用具の構造をある程度詳細に知らなければならない。
FMEAは,ヒューマンエラーを取り扱うのにも有用な手法である。また,ハザードを特定するためにも
使用できるので,FTAへの入力を与える。
この手法の弱点は,冗長性の取扱いが困難なこと,修理又は予防的保守活動の取込みが困難なこと及び
単一故障状態に限定されることである。
D.3 FTA(故障の木解析) FTAは,主として,他の諸手法で特定されたハザードを分析する手段であり,
想定された好ましくない結果(トップイベントとも呼ばれる。)から出発する。トップイベントから始まる
演えき的手法によって,可能性のある原因,又は好ましくない結果を引き起こす一段ずつ低い機能システ
ムレベルでの故障モードが特定される。好ましくないシステム動作を段階的に順次低いシステムレベルま
で特定することによって,コンポーネント故障モードと通常呼ばれる目的とするシステムレベルに導かれ
る。これによって想定された結果に導くことができる適切なシーケンスが明らかとなる。
FTAは,法廷弁論の目的には有益であることが立証されている。結果は,図式的に事象の木の形で表現
される。木の中で特定された故障は,ハードウェアの故障及びソフトウェアの間違い,ヒューマンエラー
又は好ましくない事象に導かれるその他の関連事象である。FTAの有利な点は,単一故障状態には限定さ
れないことである。
FTAは,体系的アプローチを可能とし,同時に十分に柔軟性があるので人的相互作用を含む様々な要因
の分析ができる。FTAは,主としてリスク分析において,故障の確率を推定するためのツールとして用い
られる。図式的表現は,システムの動作と関連する要因を容易に理解できるが,木が大きくなるとともに
その処理は高度な数学的方法の使用が必要になるかもしれない。このような特徴が,故障の木の検証を困
難にしている。
13
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
D.4 HAZOP (Hazard and operability study) HAZOPは,FMEAの一つの形式であると考えることができ
る。
HAZOPは,ハザードと動作性の諸問題を特定するための体系的手法であり,当初,化学プロセス産業
で使うために開発された。HAZOPの原理は,プロセス・プラントの運用状態又は設計の各種段階に適用
できる。設計の初期段階で実施されるHAZOPは,更に安全な詳細設計の指針を提供できる場合が多い。
当該手法の目的は,次による。
a) プラント及びその意図する設計状態を含むプロセスの全体的な記述の作成
b) 正常な動作状態とその意図する設計からの逸脱がどのようにして生じるかを突き止めるためにプロセ
スのあらゆる部分の体系的な審査
c) そのような逸脱がプロセス及びその出力に対してどのような結果をもたらすかを特定し,これらの逸
脱がハザード又は運用性の諸問題に導けるかどうかの決定
医療用具の特質が製造プロセス,又はその他の化学的プロセスに依存する場合には,HAZOPは,医療
用具のリスク分析に特に有益であるという特徴がある。
14
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
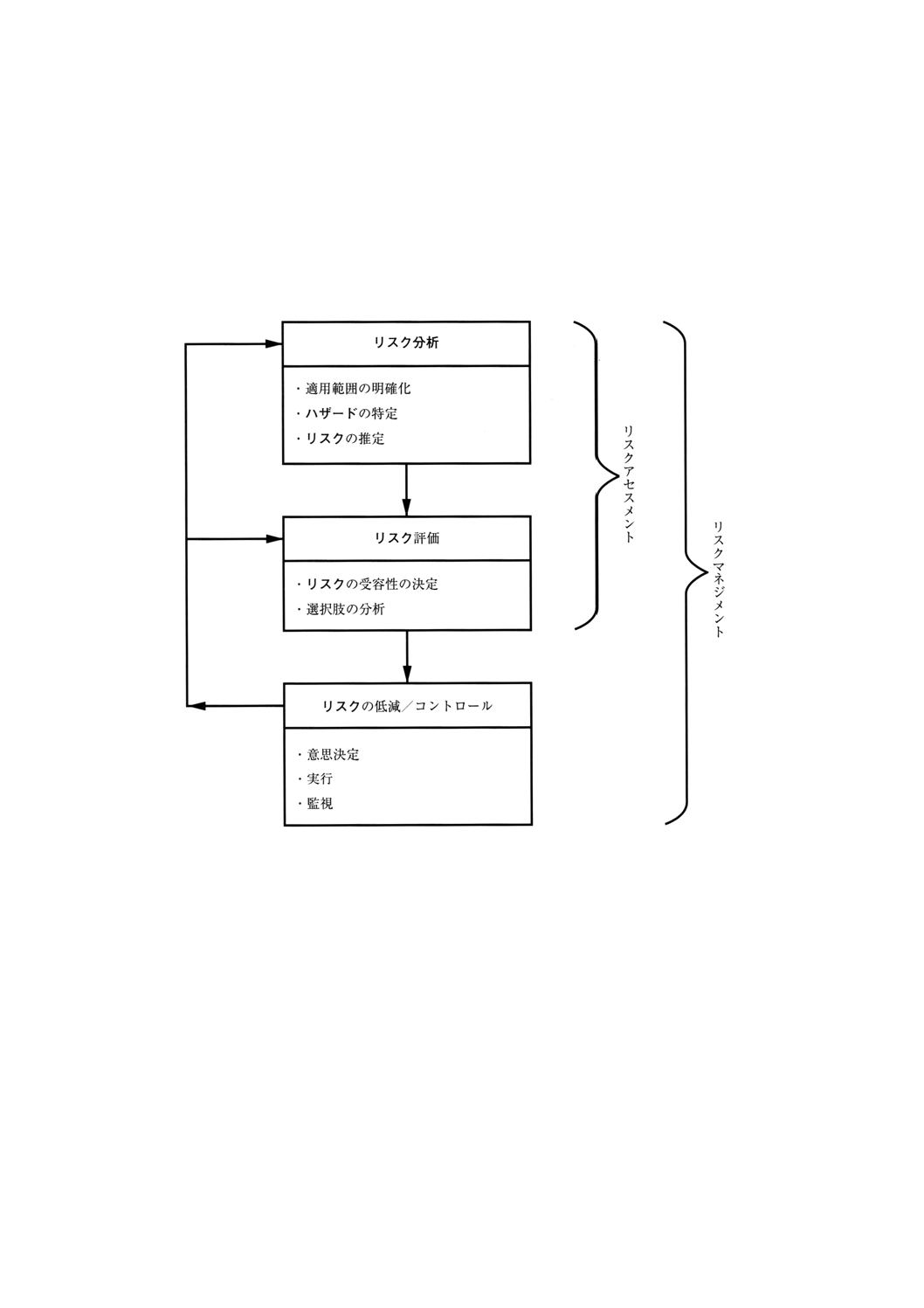
附属書E(参考)
リスク分析と他のリスクマネジメント活動との簡素化された関係
序文 この附属書(参考)は,リスク分析と他のリスクマネジメント活動との簡素化された関係について
記述するものであり,規定の一部ではない。
備考 この図は,IEC 60300-3-9の図1から引用した。
15
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書F(参考)
参考文献
序文 この附属書(参考)は,参考文献について記述するものであり,規定の一部ではない。
[1] ISO 10993-1 : 1992 Biological evaluation of medical devices−Part 1 : Guidance on selection of tests.
[2] ISO 10993-2 : 1993 Biological evaluation of medical devices−Part 2 : Animal welfare requirements.
[3] ISO 10993-3 : 1993 Biological evaluation of medical devices−Part 3 : Tests for genotoxicity, carcinogenicity
and reproductive toxicity.
[4] ISO/TEC Guide 51 : 1990 Guidelines for the inclusion of safety aspects in standards.
[5] IEC 60300-3-9 : 1995 Dependability management−Part 3 : Application guide−Section 9 : Risk analysis of
technological systems.
[6] IEC/TR 60513 : 1994 Fundamental aspects of safety standards for medical electrical equipment.
[7] IEC 60601-1-4 : 1994 Medical electrical equipment−Part 1 : General requirements for safety, 4 : Collateral
standard : Safety requirements for programmable electronic medical sysytems.
[8] IEC 60812 : 1985 Analysis techniques for system reliability−Procedures for failure mode and effects
analysis (FMEA).
[9] IEC 61025 : 1990 Analysis techniques for system reliability−Procedures for fault tree analysis (FTA).
[10] 86/609/EEC European Community on Animal Protection.
16
Q 14971-1 : 2001 (ISO 14971-1 : 1998)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
原案審議委員会 構成表
氏名
所属
(委員長)
桜 井 靖 久
東京女子医科大学
(副委員長)
古 川 孝
NECメディカルシテムズ株式会社
(幹事)
馬 場 功 夫
東芝医用システムエンジニアリング株式会社
(委員)
浅 川 敏 郎
通商産業省工業技術院標準部
飯 沼 武
埼玉工業大学工学部
菊 地 眞
防衛医科大学校医用電子工学
白 石 順 一
厚生省医薬安全局
瀬 戸 四 郎
社団法人日本臨床検査薬協会
高 島 史 路
日本光電工業株式会社
辻 隆 之
東京大学大学院
土 屋 明
株式会社東芝医用システム社那須工場品質保証部
都 甲 和 久
アロカ株式会社設計部
内 藤 正 章
日本光電工業株式会社R&Dセンター
中 村 晃 忠
国立医薬品食品衛生研究所医薬品医療機器審査センター
西 川 泰 蔵
通商産業省工業技術院標準部
萩 原 敏 彦
オリンパス光学工業株式会社内視鏡開発部
平 井 俊 樹
厚生省医薬安全局
平 山 一 男
厚生省医薬安全局
福 原 利 行
財団法人日本品質保証機構
三 浦 重 孝
ジーイー横河メディカルシステム株式会社
村 山 靖
オリンパス光学工業株式会社内視鏡品質保証部
箭 内 博 行
財団法人医療機器センター
山 村 修 蔵
財団法人日本規格協会技術部
吉 田 正 人
旭メディカル株式会社
渡 辺 敏
北里大学医療衛生学部臨床工学
(事務局)
塚 本 英 雄
日本医療機器関係団体協議会
原案作成グループ 構成表
氏名
所属
(主査)
馬 場 功 夫
東芝医用システムエンジニアリング株式会社
(副主査)
萩 原 敏 彦
オリンパス光学工業株式会社内視鏡開発部
(幹事)
二 又 紳一郎
株式会社東芝医用システム社那須工場品質保証部
(委員)
磯 部 総一郎
厚生省医薬安全局
宗 像 保 男
通商産業省工業技術院標準部
井 上 勇 二
ジーイー横河メディカルシステム株式会社技術本部
稲 葉 隆 一
和光純薬工業株式会社
上 田 雅 久
フクダ電子株式会社
内 藤 正 章
日本光電工業株式会社R&Dセンタ
中 込 宏
テルモ株式会社品質保証部
浜 原 公 幸
株式会社日立メディコ品質保証部
廣 瀬 佳 治
株式会社島津製作所CS統括部
本 間 潤
泉工医科工業株式会社
三 橋 弘 文
NECメディカルシステムズ株式会社医療機器事業部品質保証部
(事務局)
小 嶋 正 男
社団法人日本電子機械工業会標準化センター
佐 藤 実
社団法人日本電子機械工業会標準化センター
塚 本 英 雄
日本医療機器関係団体協議会