L 1902:2015
(1)
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 安全対策························································································································· 3
5 試験機器························································································································· 3
6 試薬及び培地 ··················································································································· 4
7 試験菌株························································································································· 7
7.1 菌株 ···························································································································· 7
7.2 菌株の保存 ··················································································································· 7
8 試験手順························································································································· 9
8.1 菌液吸収法 ··················································································································· 9
8.2 トランスファー法 ········································································································· 12
8.3 菌転写法 ····················································································································· 14
8.4 ハロー法 ····················································································································· 17
9 抗菌効果························································································································ 17
10 試験報告書 ··················································································································· 17
附属書A(規定)試験菌株 ···································································································· 19
附属書B(規定)洗い出し法 ································································································· 21
附属書C(規定)混釈平板培養法による定量法 ········································································· 22
附属書D(規定)発光測定法による定量法 ··············································································· 23
附属書E(参考)試験例 ······································································································· 25
附属書F(参考)抗菌効果 ····································································································· 28
附属書JA(規定)定性試験(ハロー法) ················································································· 29
附属書JB(参考)JISと対応国際規格との対比表 ······································································ 34
L 1902:2015
(2)
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人繊維
評価技術協議会(JTETC)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業
規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した日本工業
規格である。これによって,JIS L 1902:2008は改正され,この規格に置き換えられた。
また,令和2年10月20日,産業標準化法第17条又は第18条の規定に基づく確認公示に際し,産業標
準化法の用語に合わせ,規格中“日本工業規格”を“日本産業規格”に改めた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本産業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
日本産業規格 JIS
L 1902:2015
繊維製品の抗菌性試験方法及び抗菌効果
Textiles-
Determination of antibacterial activity and efficacy of textile products
序文
この規格は,2013年に第2版として発行されたISO 20743を基とし,我が国の技術動向を踏まえて,技
術的内容を一部変更して作成した日本産業規格である。
なお,この規格で側線又は点線の下線を施してある箇所は,対応国際規格を変更している事項である。
変更の一覧表にその説明を付けて,附属書JBに示す。また,試験例を附属書Eに参考として記載した。
なお,附属書JAは対応国際規格にはない事項である。
1
適用範囲
この規格は,不織布を含む全ての抗菌性繊維製品の抗菌活性を評価する定量試験方法及び定性試験方法
並びに抗菌効果について規定する。
この規格は,布はく(帛),詰めもの,糸,衣服素材,寝具,家具用繊維及び雑品を含む全ての繊維製品
に適用する。抗菌剤の種類は,有機,無機,天然又は合成を問わず,また,加工方法も,練り込み,後加
工又はグラフト処理の種類を問わず適用する。
抗菌性試験方法は,抗菌加工方法,繊維製品の使用環境及び繊維製品の表面特性を考慮し,次の四つの
試験方法の中から最も適切な方法を選択する。
a) 菌液吸収法 試験接種菌液を直接試験片上に接種する定量試験方法。
b) トランスファー法 試験菌を寒天平板上に塗布し,試験片に転写する定量試験方法。
c) 菌転写法 試験菌をメンブランフィルタ上に配置し,試験片に菌転写する定量試験方法。
d) ハロー法 ハローの有無によって評価する定性試験方法。
また,生菌数の測定方法として,混釈平板培養法及び発光測定法を規定する。
なお,光触媒加工を施した繊維製品の抗菌性試験方法は,JIS R 1702に規定されたガラス密着法によっ
て行う。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 20743:2013,Textiles−Determination of antibacterial activity of textile products(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
2
L 1902:2015
JIS K 0970 ピストン式ピペット
JIS K 3800 バイオハザード対策用クラスIIキャビネット
JIS K 8150 塩化ナトリウム(試薬)
JIS L 0803 染色堅ろう度試験用添付白布
JIS R 1702 ファインセラミックス−光触媒抗菌加工製品の抗菌性試験方法・抗菌効果
JIS R 3505 ガラス製体積計
JIS Z 8401 数値の丸め方
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
対照試料(control specimen)
試験する繊維製品と同じもの,かつ,抗菌加工が行われていないもので,試験の成立条件の検証用に使
用する試料。ただし,対照試料が入手できない場合は,JIS L 0803に規定する綿100 %の添付白布(綿3-1
号)を用いて,洗剤及び漂白剤を使用せず,60 ℃の水温で10分間水洗い後すすぎ5分を2回繰り返す。
この一連の処理を10回繰り返し,風乾したものを用いる。
3.2
抗菌剤(antibacterial agent)
細菌数の減少又は細菌を死滅させることによって,細菌の増殖を阻止及び抑制する薬剤。
3.3
抗菌加工(antibacterial finish)
細菌数の減少又は細菌を死滅させることによって,細菌の増殖を阻止及び抑制する加工。
3.4
抗菌活性(antibacterial activity)
細菌数の減少又は細菌を死滅させることによって,細菌の増殖を阻止及び抑制する加工の活性。
3.5
抗菌効果(antibacterial efficacy)
抗菌加工によって認められる抗菌性の効果。ハローの有無及び抗菌活性値によって評価する。
3.6
混釈平板培養法(plate count method)
10倍希釈法によって,培養後のコロニー数を数え,菌濃度を算出する方法。結果は,“CFU(Colony Forming
Unit:コロニー形成単位)”で表記する。
3.7
発光測定法(luminescence method)
細菌の細胞内に含まれるアデノシン三りん酸(以下,ATPという。)量を算出する方法。結果は,“ATP
モル数”で表記する。
3.8
不活性化液(neutralizer)
抗菌剤の抗菌特性を不活化又は消失させるもの。
3.9
3
L 1902:2015
ハロー
試験菌を含む培地の上に抗菌加工試料を置いて培養したとき,試料の周りにできる試験菌の生育が阻止
された部分。
4
安全対策
この試験方法では,細菌を使用する。このため,この規格の試験実施者は,微生物学的技術に関して訓
練を受け,経験をもつ者が望まれる。また,安全対策については,法規制に照らし合わせて適切であるこ
とを確認しておかなければならない。
5
試験機器
5.1
分光光度計 620 nm〜660 nmの波長を測定できるもの,又はマクファーランドのネフェロメータ。
5.2
培養器 37 ℃±2 ℃の温度を維持できるもの。
5.3
ウォーターバス 46 ℃±2 ℃を保持できるもの及び70 ℃〜90 ℃を保持できるもの。
5.4
ミキサ ボルテックスかくはん(撹拌)動作ができるもの。
5.5
ストマッカー 使い捨て容器付で,6回/秒〜8回/秒の振り出し速度のもの。
5.6
クリーンベンチ又は安全キャビネット 微生物試験対応のもので,安全キャビネットはJIS K 3800
に規定するもの。
5.7
白金耳 先端のループ径が約4 mmのもの。
5.8
恒湿槽 トロピカルチャンバー又はこれと同等の容器で70 %RH以上の高湿度条件を維持できるも
の。
5.9
発光光度計 発光試薬を用い,300 nm〜650 nmでATP濃度を,10−13 mol/L〜10−7 mol/Lの範囲で測
定できるもの。
5.10 菌転写装置 試験片に4 Nの力を加えることができ,試料を一方向に3秒間で180度回転できるも
の。
5.11 冷蔵庫 2 ℃〜8 ℃の温度を維持できるもの。
5.12 冷凍庫 −70 ℃以下を保持できるもの及び−20 ℃以下を維持できるもの。
5.13 天びん(秤) 0.01 g単位を測定できるもの。
5.14 ろ過装置 容器上部にメンブランフィルタ,容器下部には吸引口を装備するもの。
5.15 ピペット この規格で測定する容量に適切なもので,先端がガラス製又はプラスチック製であり,
かつ,JIS K 0970又はJIS R 3505のクラスAに適合したもの若しくは同程度の精度をもつもの。
5.16 バイアル瓶 容量30 mLのねじ蓋式のガラス瓶で,ポリテトラフルオロエチレン又はシリコンのパ
ッキンを使用し,ポリプロピレン,ポリカーボネート又は他の適切な材料で作られたキャップを使用した
もの。
5.17 シャーレ 滅菌されたガラス製又はプラスチック製で,直径が90 mm〜100 mmのもの。トランスフ
ァー法の試験片を入れるものは,直径が55 mm〜60 mmのもの。
5.18 ガラス棒 直径が約18 mmのもの。
5.19 突沸防止粒子(ガラスビーズ) 直径が3 mm〜4 mmのもの。
5.20 蓋付三角フラスコ 容量100 mLのもの。
5.21 裁断型枠 滅菌処理可能な素材(ステンレススチール又はガラス)製で直径38 mm±1 mmのもの。
5.22 使い捨てプラスチックバッグ 食品用の無菌のものでストマッカーでの洗い出しに使用するもの。
4
L 1902:2015
5.23 ピンセット 滅菌できる材料で作られたもの。
5.24 ステンレス分銅 質量が200 g±10 gで,直径が35 mm±1 mmのもの。
5.25 金網かご 高圧蒸気滅菌機(オートクレーブ)で,試験片などを滅菌するのに使用できるもの。
5.26 アルミニウムホイル 金網かごなどを包めるもの。
5.27 振とう培養機 温度37 ℃±2 ℃,110回/分,振り幅30 mm程度に設定できるもの。
5.28 オートクレーブ 温度120 ℃±2 ℃,圧力103 kPa±5 kPaで滅菌できるもの。
6
試薬及び培地
6.1
水 微生物学用培地の作製に使用できる分析用品質のもので,新規に蒸留され,イオン交換したも
ので,限外ろ過したもの及び/又は逆浸透膜でろ過した,あらゆる毒性物質及び細菌成長阻害物質を含ん
でいないもの。
6.2
トリプトンソーヤ培地(TSB) 次の成分をよくかくはんし,pHを7.2±0.2に調整した後,オート
クレーブ(5.28)によって滅菌したもの。
− カゼイン製トリプトン
17 g
− 大豆製ペプトン
3 g
− 塩化ナトリウム(NaCl) JIS K 8150による。
5 g
− グルコース
2.5 g
− りん酸水素二カリウム
2.5 g
− 水(6.1)
1000 mL
6.3
トリプトンソーヤ寒天培地(TSA) 次の成分をよくかくはんし,pHを7.2±0.2に調整した後,オ
ートクレーブによって滅菌したもの。
− カゼイン製トリプトン
15 g
− 大豆製ペプトン
5 g
− 塩化ナトリウム(NaCl)
5 g
− 寒天
15 g
− 水
1000 mL
6.4
トランスファー法用寒天培地 次の成分をよくかくはんし,pHを7.2±0.2に調整した後,オートク
レーブによって滅菌したもの。
− カゼイン製トリプトン
0.75 g
− 大豆製ペプトン
0.25 g
− 塩化ナトリウム(NaCl)
5 g
− 寒天
15 g
− 水
1000 mL
6.5
ニュートリエント培地(NB) 次の成分をよくかくはんし,pHを6.9±0.2に調整した後,オートク
レーブによって滅菌したもの。
− 肉エキス
3 g
− ペプトン
5 g
− 水
1000 mL
6.6
ペプトン食塩水 次の成分をよくかくはんし,pHを6.9±0.2に調整した後,オートクレーブによっ
て滅菌したもの。
5
L 1902:2015
− カゼイン製ペプトン
1 g
− 塩化ナトリウム(NaCl)
8.5 g
− 水
1000 mL
6.7
生理食塩水 次の成分をよくかくはんし,その後,オートクレーブによって滅菌したもの。
− 塩化ナトリウム(NaCl)
8.5 g
− 水
1000 mL
6.8
SCDLP培地 次の成分をよくかくはんし,pHを7.2±0.2に調整した後,オートクレーブによって
滅菌したもの。
− カゼイン製ペプトン
17 g
− 大豆製ペプトン
3 g
− 塩化ナトリウム(NaCl)
5 g
− りん酸水素二カリウム
2.5 g
− グルコース
2.5 g
− レシチン
1 g
− ポリソルベート80
7 g
− 水
1000 mL
6.9
菌液調製用緩衝液 0.037 %のスクロースを含む,0.005 mol/Lのりん酸二水素ナトリウムからなり,
pHを7.2±0.2に調整したもの。
6.10 不活性化液 標準的な不活性化液の組成は,次による。
− ポリソルベート80
30 g
− 卵黄レシチン
3 g
− ヒスチジン塩酸塩
1 g
− 肉又はカゼイン製ペプトン
1 g
− 塩化ナトリウム(NaCl)
4.3 g
− りん酸二水素カリウム
3.6 g
− りん酸二ナトリウム二水和物
7.2 g
− 水
1000 mL
6.11 混釈平板培養法用寒天培地(EA) 次の成分をよくかくはんし,pHを7.2±0.2に調整した後,オー
トクレーブによって滅菌したもの。
− 脱水酵母エキス
2.5 g
− カゼイン製トリプトン
5.0 g
− グルコース
1.0 g
− 寒天
12 g〜15 g 1)
− 水
1000 mL
注1) 必要質量は,製品のゲル強度による。
6.12 菌転写法用寒天培地 次の成分をよくかくはんし,オートクレーブによって滅菌したもの。
− 寒天
20 g
− 水
1000 mL
6.13 細菌の凍結防止溶液 150 g/Lのグリセリン又は100 g/Lのジメチルスルホキシドを含む凍結防止溶
液で,次の手順で作製したもの。
6
L 1902:2015
a) トリプトンソーヤ培地(TSB)(6.2)又はニュートリエント培地(NB)(6.5):1 000 mLを加える。グ
リセリン150 g又はジメチルスルホキシド100 gをよくかくはんし,オートクレーブで滅菌する。
b) グリセリンを含む溶液については,オートクレーブでその混合液を滅菌する。ジメチルスルホキシド
を含む溶液については,0.22 µmのメンブランフィルタを使用し,混合液を滅菌する。
注記 凍結防止溶液は,グリセリン又はジメチルスルホキシドを含有している保存用のものであり,
規定された溶液と同様に菌株の保存ができるものであれば,市場で購入できる製品の使用を推
奨する。
6.14 ATP標準試薬原液 アデノシン-5'三りん酸二ナトリウム三水和物60.5 mgを水に溶かし,1 000 mL
に調製したもの。その濃度は1×10−4 mol/Lである。
調製後,調製溶液はしっかり密封された容器に入れ,−20 ℃又はそれ以下の温度で冷凍保存する。調製
溶液は,調製後6か月以内に使用しなければならない。
なお,一度解凍したものを再凍結してはならない。
注記 アデノシン-5'三りん酸二ナトリウム三水和物の混合量は,購入した製品のATP含有量から計算
される。
6.15 ATP発光試薬用緩衝液 次の成分からなり,pHを7.2±0.2に調整したもの。
− N-(トリスヒドロキシメチル)メチルグリシン
1117 mg
− エチレンジアミン四酢酸二ナトリウム二水和物
183 mg
− 酢酸マグネシウム四水和物
808 mg
− DL-ジチオスレイトール
6.7 mg
− デキストリン
25000 mg
− スクロース
925 mg
− 水
250 mL
6.16 ATP発光試薬 次の成分からなり,完全に溶解させた後,使用前に15分間室温で静置させたもの。
なお,調製後3時間以内に使用する。また,通常と異なるATP発光試薬を使用するときは,その組成を
記録しなければならない。
− ルシフェラーゼ(EC:1.13.12.7)
16.0 mg
− D-ルシフェリン
12.6 mg
− うし血清アルブミン
56 mg
− ATP発光試薬用緩衝液(6.15)
30 mL
6.17 ATP抽出試薬 次の成分からなり,pHを7.2±0.2に調整したもの。
なお,通常と異なるATP抽出試薬を使用するときは,その組成を記録しなければならない。
− N-(トリスヒドロキシメチル)メチルグリシン
45 mg
− 10 %塩化ベンザルコニウム水溶液
0.2 mL
− 水
9.8 mL
6.18 ATP消去試薬 次の成分からなり,pHを6.0±0.5に調整したもので,トリプトンソーヤ培地(TSB)
(6.2),又はニュートリエント培地(NB)(6.5)中のATP量を15分以内に10−13 mol/L未満に減少させた
もの。
− アピラーゼ(EC:3.6.1.5)
46国際単位/mL
− アデノシンりん酸デアミナーゼ(EC:3.5.4.6又はEC:3.5.4.17)
46国際単位/mL
− スクロース
37 mg
7
L 1902:2015
− うし血清アルブミン
20 mg
− 0.05 mol/L 2-モルホリノエタンスルホン酸一水和物緩衝液
10 mL
この試薬は,調製後8時間以内に使用しなければならない。
なお,通常と異なる消去試薬を使用するときは,その組成を記録しなければならない。
6.19 ATP標準試薬調製のためのSCDLP培地又は他の培地 次の成分からなり,洗い出し液のATP濃度
が不活性化剤の添加によって10−11 mol/Lを超過した場合に作製する。
− SCDLP培地(6.8)又は他の培地
10 mL
− ATP消去試薬(6.18)
1 mL
調製後,微生物汚染がないように注意して,30 ℃〜37 ℃で1時間保持する。次に,70 ℃〜90 ℃のウ
ォーターバス(5.3)に1時間保持し,その後室温まで冷却する。続いて,調製溶液を冷蔵庫に保存し,24
時間以内に使用する。
6.20 洗い出し用生理食塩水 次の成分からなり,よくかくはんして,オートクレーブ(5.28)で滅菌した
もの。
− 塩化ナトリウム(NaCl)
8.5 g
− ポリソルベート80
2.0 g
− 水
1000 mL
注記1 試験に使用する試薬は,分析用品質及び/又は微生物試験用のものがよい。
注記2 培地作製には,市場で利用可能な乾燥製品を使用することが推奨される。これらの培地作製
に当たっては,製造業者の作製指示書に従う。
7
試験菌株
7.1
菌株
附属書Aに規定する細菌から,いずれかを選択して試験に用いる。
7.2
菌株の保存
7.2.1
一般事項
菌株の保存は,供給者の推奨方法に従わなければならない。
7.2.2
セラミックビーズ法
セラミックビーズ法は,次による。
a) 推奨された培地とともに凍結保存された細菌株のサンプルを用意し,トリプトンソーヤ培地(TSB)
(6.2)5 mLに再懸濁する。その懸濁液のサンプルを用意し,それをトリプトンソーヤ寒天培地(TSA)
(6.3)の入ったシャーレ(5.17)に分離し載せる。
b) その細菌株を18時間〜24時間,37 ℃±2 ℃の条件で培養する。培養後,株の純度の検証にはシャー
レに分離した培養株を使用する。検証後,保存原液を用意する。
c) 0.7 mLの培養原液のサンプルを取り,シャーレのトリプトンソーヤ寒天培地(TSA)の表面に塗り広
げる。b) に規定した条件下で,寒天表面上の培養原液を18時間〜24時間培養する。
d) TSA寒天の平板培養表面上に10 mLの細菌の凍結防止溶液(6.13)を加える。次に,滅菌したガラス
棒スプレッダーを使い,寒天上に細菌を再懸濁する。寒天上から懸濁された細菌をサンプル採取し,
それを100 mLの凍結防止溶液で希釈し,それを20 ℃で30分間培養する。
e) ピペット(5.15)を使用し,1 mLの懸濁液をサンプル採取し,そのサンプルを突沸防止粒子(ガラス
ビーズ)(5.19)を入れたバイアル瓶(5.16)に移す。ビーズの周りに細菌懸濁液を付着させるために,
8
L 1902:2015
バイアル瓶を振とうする。このとき,ジメチルスルホキシドを含む凍結防止溶液を使用している場合
は,それを室温環境に1分以上放置してはならない。また,グリセリンを含む凍結防止溶液を使用し
ている場合は,それを20 ℃で30分間保持する。
f)
滅菌したピペットで余分な凍結防止溶液を除去する。バイアル瓶を−70 ℃,又はそれ以下の冷凍庫
(5.12)に保存する。
g) 次に,生菌数の確認のため,附属書Cに規定する混釈平板培養法を実施する。初めに,連続希釈法に
よって,10−6〜10−7の希釈懸濁液を用意する。それぞれの希釈液から1.0 mLのサンプルを採取し,そ
れをシャーレに分けて移す。45 ℃±1 ℃まで冷却した12 mL〜15 mLのEA寒天培地溶液を加える。
それを37 ℃±2 ℃の条件で18時間〜24時間培養する。
h) 平板培養した菌のコロニー数を数え,その懸濁液が5×108 CFU/mL以下であることを確認する。
7.2.3
グリセリン懸濁法
グリセリン懸濁法は,次による。
a) 5 mLの適切な培地を含む15 mLの試験管に新規に増殖され,分離したコロニーを含む培養液を接種
する。37 ℃で,通常5時間から一晩,細菌培養の増殖曲線が対数後期又は定常期に到達するまで培養
する。
b) 保存場所において−70 ℃以下で保存されているそれぞれの細菌株について,滅菌し,ラベルが貼られ
た極冷温用バイアル瓶を用意し,その極低温用バイアル瓶に225 μLの滅菌した80 %グリセリンを入
れる。
c) 1.0 mLの細菌培養液(15 %グリセリンを含む冷凍保存品)を加える。ミキサ(5.4)でよくかくはんし,
試験管に入れ,−70 ℃以下で保存する。
d) 液体グリセリン作業原液として−20 ℃で保存されているそれぞれの細菌株について,80 %グリセリ
ン及び細菌培養液をラベルが貼られたポリプロピレン試験管中に等量をピペットに入れ,細菌の生存
力を低下させる氷結を避けるため,内容物をよくかくはんする。その後,試験管を−20 ℃設定の冷凍
庫で保存する。可能な場合には,1週間後に細菌の生存力を確認する。
e) −70 ℃以下で保存されたグリセリン保存の細菌株の回収のため,滅菌した爪よう(楊)枝を使用し,
固形物片を取り出す。その後,細菌を適切な培地に筋状に塗り付ける。冷凍保存物を解凍してはなら
ない。それは,冷凍・解凍の繰り返しを行うと1回のサイクルで細菌の生存力を50 %消失する結果と
なる。
f)
5 mLの一晩培養液に対し,−20 ℃の作業原液を50 μL〜100 μL接種する。
7.2.4
斜面培地法
斜面培地法は,次による。
a) 斜面培地の作製は,試験管にあらかじめ温めて溶解した混釈平板培養法用寒天培地(EA)(6.11)を
約10 mL注ぎ,綿栓をして高圧蒸気滅菌し,滅菌終了後,清浄な室内に試験管を水平面に対して約15
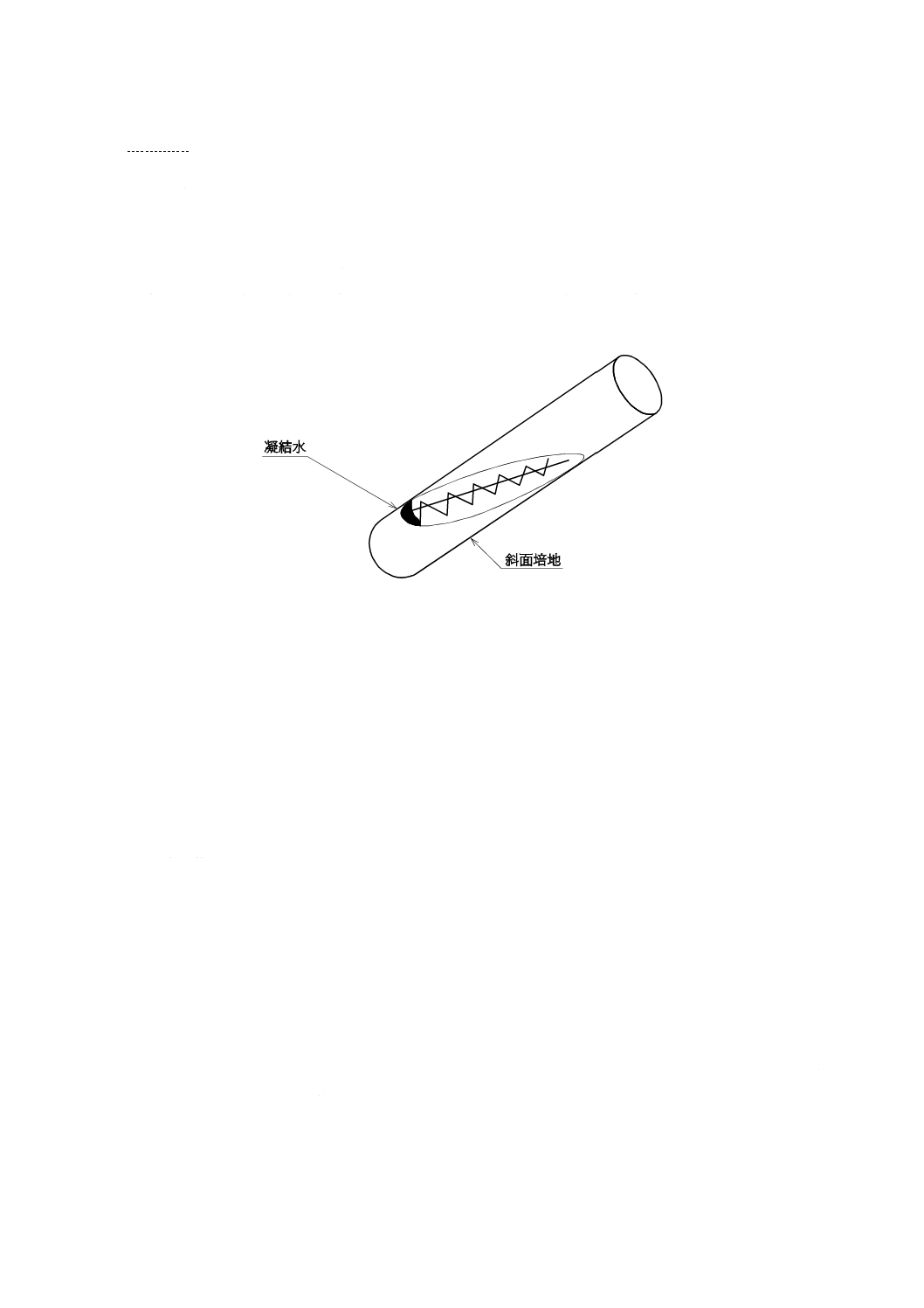
度傾けて置き,内容物を凝固させる。凝結水がなくなったものは溶解し,再び凝固させて使用する。
b) 細菌の移植は,次の手順によって無菌的に行う。片手に元株及び移植しようとする斜面培地を持ち,
他方の手に白金耳の柄を持ち,その手で綿栓を抜き取り,試験管の口を火炎滅菌する。
c) 次に,白金耳を火炎滅菌し,斜面培地の凝結水のある部分に白金耳のループを差し込んでよく冷却し
てから,元株の試験管に入れる(図1参照)。細菌の繁殖面から白金耳でかき取り,斜面培地に塗抹し,
再び試験管の口を火炎滅菌し,元のように綿栓をする。使用後の白金耳は火炎滅菌する。
d) 細菌を移植した斜面培地は,37 ℃±2 ℃で24時間〜48時間培養し,その後は温度5 ℃〜10 ℃で保
9
L 1902:2015
存する。
なお,白金耳を斜面培地に塗抹するときは,図1に示す凝結水に細菌を分散し,ここから斜面上方
まで直線を引く。一旦,培地から白金耳の先端を離し,再び凝結水につけ,今度は蛇行させながら斜
面上方まで線を引く。
e) 細菌移植後,1か月以内に次の細菌移植を同様に行い,継代培養する。継代培養は10回を限度とする。
また,移植して1か月以上過ぎたものは,次の移植に用いてはならない。
注記 長期保存の場合は凍結乾燥するか,又は高層培地に移植し,殺菌流動パラフィンで重層して
保存してもよい。
図1−斜面培地への細菌移植
8
試験手順
8.1
菌液吸収法
8.1.1
培養
8.1.1.1
前培養A
白金耳(5.7)を使用し,保存容器から試験菌を取り出す。取り出した試験菌を混釈平板培養法用寒天培
地(EA)(6.11)上に培養後のコロニーが単離されるよう筋状に塗り付ける。その後,37 ℃±2 ℃で24
時間〜48時間培養する。培養後の平板は,5 ℃〜10 ℃で保存でき,1週間以内に使用する。
なお,一度コロニーを採取した平板は,再度用いてはならない。
8.1.1.2
前培養B
20 mLのニュートリエント培地(NB)(6.5)又はトリプトンソーヤ培地(TSB)(6.2)を100 mLの蓋付
三角フラスコ(5.20)に入れる。8.1.1.1の平板から白金耳を使用し,一つのコロニーをかき取り,そのコ
ロニーをフラスコの培養液に接種する。次の条件で培養する。
− 温度
:37 ℃±2 ℃
− 振とう速度:振とう培養機(5.27)によって,振り幅30 mmで110回/分の速度で振とう。
− 培養時間 :18時間〜24時間
8.1.1.3
前培養C
20 mLのニュートリエント培地(NB)(6.5)又はトリプトンソーヤ培地(TSB)(6.2)を100 mLの三角
フラスコに入れる。8.1.1.2の培養液から0.4 mLをこの三角フラスコに加える。この接種液は菌濃度で,1
×108 CFU/mL〜3×108 CFU/mL,又はATP濃度で,1×10−6 mol/L〜3×10−6 mol/Lを目標とし,次の条件
で培養する。
10
L 1902:2015
− 温度
:37 ℃±2 ℃
− 振とう速度:振とう培養機によって,振り幅30 mmで110回/分の速度で振とう。
− 培養時間 :3時間±1時間
培養後の菌濃度及びATP濃度の目標値は,107 CFU/mL又は10−7 mol/Lである。
注記 調製された接種液は氷冷で保持し,8時間以内に使用するのがよい。
8.1.2
試験接種菌液の調製
8.1.1.3の培養後の菌濃度を分光光度計又はマクファーランドのネフェロメータ(5.1)によって,室温で
水によって20倍希釈したニュートリエント培地(NB)(6.5)若しくはトリプトンソーヤ培地(TSB)(6.2)
を用いて,1×105 CFU/mL〜3×105 CFU/mLに調製するか,又は発光測定法によって8.1.1.3の培養後のATP
濃度を測定し,室温で水によって20倍希釈したニュートリエント培地(NB)若しくはトリプトンソーヤ
培地(TSB)を用いてATP濃度を1×10−9 mol/L〜3×10−9 mol/Lに調製する。
調製した試験接種菌液に対し,附属書C及び附属書Dに規定した定量法で菌濃度及びATP濃度を測定
し,試験接種菌液濃度とする。
注記 調製した接種液は氷冷で保持し,4時間以内に使用するのがよい。
8.1.3
試験片の採取及び準備
8.1.3.1
試験片の採取
0.40 g±0.05 gの質量で,適切な大きさに裁断した試験片を6検体,及び対照試料を6検体を採取する。
注記 試験試料の3検体及び対照試料の3検体は,接種直後の測定に使用し,残りの3検体ずつは,
培養時間18時間〜24時間後の測定に使用する。
8.1.3.2
試験片の準備
試験試料の形状に合わせ,次に示す適切な処置を行ってから,それぞれの試験片を別々のバイアル瓶
(5.16)に入れる。
a) 試験片がカールしやすいものか,中わた又は羽毛を含んでいる場合は,バイアル瓶の中の試験片の上
にガラス棒(5.18)を載せるか,又は試料片の両端を糸で俵状に固定する方法を用いる。
b) 試験片が糸の場合は,適切な本数を束にし,ガラス棒を載せる。
c) 試験片がカーペットなどの場合には,カーペットそのもの又はパイル部分を切り取り,バイアル瓶の
中に入れ,ガラス棒を載せる。
必要な場合は,試験当事者間の合意に基づき前処理を行う。実施した前処理に関しては,その詳細を試
験報告書に記載する。
8.1.3.3
滅菌
汚染がないことが確認されている場合以外には,次の手順に従って,オートクレーブ(5.28)によって
試験片を滅菌する。
a) 試験片が入ったバイアル瓶(5.16)の開口部をアルミニウムホイル(5.26)で包む。
b) アルミニウムホイルで包んだバイアル瓶を金網かご(5.25)に入れる。
c) バイアル瓶のキャップを別のアルミニウムホイルで包み,金網かごに入れる。
d) バイアル瓶及びキャップを15分間〜20分間オートクレーブで処理する。
e) 滅菌後クリーンベンチ又は安全キャビネット(5.6)内,若しくは空中からの汚染の心配のない場所で,
アルミニウムホイルを取り除き,60分間又はそれ以上静置し,試験片を乾燥させる。
f)
しっかりバイアル瓶にキャップをする。
注記 オートクレーブ滅菌ができない場合は,エチレンオキサイドガス,γ線,又は別の適切な方法
11
L 1902:2015
を採用してもよい。それらの滅菌法を採用した場合は,その旨を試験報告書に記載するのがよ
い。
8.1.4
試験操作
8.1.4.1
試験片への接種
8.1.2で調製された試験接種菌液を試験片(8.1.3.2)上にピペット(5.15)で正確に,0.2 mLずつ数箇所
に分けて接種する。その場合,接種液がバイアル瓶(5.16)の壁面及びキャップに触れてはならない。
8.1.4.2
接種直後の洗い出し
8.1.4.1の接種直後に,試験試料3検体及び対照試料3検体のバイアル瓶(5.16)のそれぞれの中に,20 mL
のSCDLP培地(6.8),不活性化液(6.10),又は洗い出し用生理食塩水(6.20)のいずれか1種だけを添加
する。次に,バイアル瓶のキャップを締め,附属書Bによって,洗い出しを行う。
8.1.4.3
培養
8.1.4.2で洗い出さなかった対照試料3検体,及び試験試料3検体のバイアル瓶(5.16)を37 ℃±2 ℃で
18時間〜24時間培養する。
8.1.4.4
培養後の洗い出し
8.1.4.3の培養後,6検体のバイアル瓶(5.16)のそれぞれの中に20 mLのSCDLP培地,不活性化液,又
は洗い出し用生理食塩水のいずれか1種だけを添加する。次に,バイアル瓶のキャップを締め,附属書B
によって,洗い出しを行う。
8.1.4.5
生菌数及びATP量の計算
8.1.4.5.1
一般事項
次式に従い,8.1.4.2及び8.1.4.4による処理後の生菌数を,附属書Cで得た菌濃度から,また,ATP量を
附属書Dで得たATP濃度から計算する。
8.1.4.5.2
生菌数
生菌数の計算は,式(1)による。
20
B×
=c
M
·············································································· (1)
ここに,
M: 1試験片当たりの生菌数
cB: 附属書Cで得た菌濃度
20: 洗い出し液量(mL)
8.1.4.5.3
ATP量
ATP量の計算は,式(2)による。
20
ATP×
=
'
c
M'
··········································································· (2)
ここに,
M': 1試験片当たりのATP量
cATP': 附属書Dで得たATP濃度
20: 洗い出し液量(mL)
8.1.5
試験結果
8.1.5.1
対照試料での試験成立の判定
対照試料での試験は,次のa),b) 及びc),又はa),b) 及びd) が満たされた場合,成立したものと判
断する。ただし,この試験が不成立と判断した場合は,再試験を実施しなければならない。
a) 8.1.2の試験接種菌液の菌濃度は,1×105 CFU/mL〜3×105 CFU/mL,又はATP濃度で1×10−9 mol/L〜
3×10−9 mol/Lとする。
b) 対照試料の接種直後及び培養後のそれぞれの3検体における,常用対数での生菌数又はATP量の最大
最小の差は1以下とする。
12
L 1902:2015
c) 混釈平板培養法の増殖値(F)は,1.0以上とし,JIS Z 8401の規則B(四捨五入法)によって小数点
以下1桁に丸める。
d) 発光測定法の増殖値(F)は,0.5以上とし,JIS Z 8401の規則Bによって小数点以下1桁に丸める。
増殖値(F)の計算は,式(3)による。
0
tlog
log
C
C
F
−
=
······································································ (3)
ここに,
F: 対照試料の増殖値
log Ct: 18時間〜24時間培養後の対照試料3検体の生菌数,又はATP
量の算術平均の常用対数
log C0: 接種直後の対照試料3検体の生菌数,又はATP量の算術平均
の常用対数
8.1.5.2
試験試料での試験成立の判定及び抗菌活性値の計算
試験試料での試験で,試験試料の3検体間について,常用対数での生菌数又はATP量の接種直後と培養
後とのそれぞれの最大値と最小値との差が2以下の場合,成立したものと判断する。ただし,この試験が
不成立と判断された場合は,再試験を実施しなければならない。
試験が成立した場合には,式(4)に従って,抗菌活性値を計算し,JIS Z 8401の規則Bによって小数点以
下1桁に丸める。
log C0>log T0の場合は,log T0をlog C0に置き換えて計算する。
(
)(
)
G
F
T
T
C
C
A
−
−
−
−
=
=
0
t
0
t
log
log
log
log
······································ (4)
ここに,
A: 抗菌活性値
F: 対照試料の増殖値(F=log Ct−log C0)
G: 試験試料の増殖値(G=log Tt−log T0)
log Tt: 18時間〜24時間培養後の試験試料3検体の生菌数,又はATP
量の算術平均の常用対数
log T0: 接種直後の試験試料3検体の生菌数,又はATP量の算術平均
の常用対数
8.2
トランスファー法
8.2.1
試験菌及び接種液の調製
8.2.1.1
試験菌の培養
白金耳を使用し,保存容器から保存菌を取り出す。取り出した保存菌をトリプトンソーヤ寒天培地(TSA)
(6.3)を寒天上に筋状に塗り付ける。次に,37 ℃±2 ℃の条件で18時間〜24時間培養する。培養後寒天
平板からコロニーを白金耳でかき取り,別のトリプトンソーヤ寒天培地(TSA)を寒天平板に筋状に塗り
付ける。次に,37 ℃±2 ℃の条件で18時間〜24時間培養する。
注記 2回目の平板が試験に使用されるものとなる。
接種が1日以内に終了できない場合は,追加の48時間用の培地に接種を行い,その培地を,培養器(5.2)
に37 ℃±2 ℃の条件で48時間保持し培養する。この場合には,新規の24時間継代培養を試験に先立ち
準備する。4回目の培養細菌は使用してはならない。
8.2.1.2
試験接種菌液の調製
白金耳を使用し,2回目の平板からコロニーを取り,ペプトン食塩水(6.6)に入れる。ボルテックスミ
キサ(5.4)でよくかくはんする。
菌濃度を分光光度計又はマクファーランドのネフェロメータ(5.1)を用いて,菌濃度を推定し,1×108
CFU/mL〜3×108 CFU/mLにペプトン食塩水で調製する。ATP濃度については,発光測定法によって,2×
10−7 mol/L〜6×10−7 mol/Lに,ペプトン食塩水で調製する。
13
L 1902:2015
その調製液を,更に,ペプトン食塩水を用いて,菌濃度は,1×106 CFU/mL〜3×106 CFU/mLとし,ATP
濃度は,発光測定法によって,2×10−9 mol/L〜6×10−9 mol/Lに調製する。
最終調製液は,附属書C及び附属書Dに規定する定量法によって,確認しなければならない。
8.2.2
試験片の準備
裁断型枠(5.21)を用いて,38 mmの直径に試験片を裁断する。必要な場合は,試験当事者間の合意に
基づき前処理を行う。実施した前処理に関しては,その詳細を試験報告書に記載する。
汚染がないことが確認されている場合以外には,オートクレーブ(5.28)によって試験片を滅菌する。
オートクレーブ滅菌ができない場合には,エチレンオキサイドガス,γ線,又は別の適切な方法を採用し
てもよい。それらの滅菌法を採用した場合は,その旨を試験報告書に記載する。
8.2.3
試験操作
8.2.3.1
寒天平板への接種
トランスファー法用寒天培地(6.4)を対照試料用に6枚,試験試料用に6枚準備する。8.2.1.2の試験接
種菌液1 mLを寒天上に接種し,寒天平板を多方向に傾けながら寒天平板表面全体に行き渡るようにする。
余分な接種液を可能な限り吸い取る。次に,300秒±30秒間静置する。
8.2.3.2
試験片への転写
対照試料を6検体及び試験試料を6検体準備する。
必要な場合は,試験当事者間の合意に基づき前処理を行う。実施した前処理については,その詳細を試
験報告書に記載する。
注記 対照試料3検体及び試験試料3検体は,転写直後の測定に使用し,残りの3検体ずつは,培養
後の測定に使用する。
それぞれの検体を,試験試料の場合は抗菌加工面を寒天培地側にして,8.2.3.1の寒天表面上に載せ,ス
テンレス分銅(5.24)で60秒±5秒間押さえる。次に,それぞれの試料片を55 mm〜60 mmの直径のシャ
ーレに転写した面を上にして置く。恒湿槽(5.8)に入れ,温度37 ℃±2 ℃及び湿度70 %RH以上の条件
で18時間〜24時間培養する。
8.2.3.3
菌転写後の洗い出し
転写直後,それぞれの試験片を使い捨てプラスチックバッグ(5.22)又はバイアル瓶に入れ,20 mLの
不活性化液(6.10)を追加し,附属書Bの規定によって,洗い出す。
8.2.3.4
培養後の洗い出し
培養後,それぞれの試験片を使い捨てプラスチックバッグ又はバイアル瓶に入れ,20 mLの不活性化液
(6.10)を追加し,附属書Bの規定によって,洗い出す。
8.2.3.5
生菌数又はATP量の計算
8.2.3.5.1
一般事項
8.2.3.5.2及び8.2.3.5.3に示した式に従い,8.2.3.3及び8.2.3.4による処理後の生菌数を,附属書Cで得た
菌濃度から,また,ATP量を附属書Dで得たATP濃度から計算する。
8.2.3.5.2
生菌数
生菌数の計算は,8.1.4.5.2の式(1)による。
8.2.3.5.3
ATP量
ATP量の計算は,8.1.4.5.3の式(2)による。
14
L 1902:2015
8.2.4
試験結果
8.2.4.1
対照試料での試験成立の判定
対照試料での試験が,次のa),b) 及びc),又はa),b) 及びd) を満たされた場合,成立したものと判
断する。ただし,この試験が不成立と判定された場合は,再試験を実施しなければならない。
a) 8.2.1.2の試験接種菌液の菌濃度は,生菌数で1×106 CFU/mL〜3×106 CFU/mL,又はATP濃度で2×
10−9 mol/L〜6×10−9 mol/Lでなければならない。
b) 対照試料について,接種直後3検体間と培養後3検体間で常用対数での生菌数又はATP量のそれぞれ
の最大値と最小値との差は,1以下でなければならない。
c) 混釈平板培養法の増殖値(F)は,1.0以上でなければならない。
d) 発光測定法の増殖値(F)は,0.5以上でなければならない。
なお,増殖値(F)は,8.1.5.1の式(3)による。計算結果は,JIS Z 8401の規則Bによって小数点以下1
桁に丸める。
8.2.4.2
試験成立の判定及び抗菌活性値の計算
試験試料での試験は,試験試料の3検体間について,常用対数での生菌数又はATP量の接種直後と培養
後とのそれぞれの最大値と最小値との差が2以下の場合,成立したものと判断する。ただし,この試験が
不成立と判断した場合は,再試験を実施しなければならない。
試験が成立した場合には,8.1.5.2の式(4)に従って,抗菌活性値を計算し,JIS Z 8401の規則Bによって
小数点以下1桁に丸める。
なお,log C0>log T0の場合は,log T0をlog C0に置き換えて計算する。
8.3
菌転写法
8.3.1
培養
8.3.1.1
保存菌株を白金耳(5.7)で取り出し,混釈平板培養法用寒天培地(EA)(6.11)を平板上に筋状
に塗り付け,37 ℃±2 ℃で24時間〜48時間培養する。
培養後の寒天平板は,5 ℃〜10 ℃で保存し,1週間以内に使用しなければならない。
8.3.1.2
100 mLの蓋付三角フラスコ(5.20)に20 mLのニュートリエント培地(NB)(6.5)又はトリプ
トンソーヤ培地(TSB)(6.2)を注ぎ入れる。白金耳(5.7)で8.3.1.1の平板から1コロニーを採取し,培
地に入れ培養する。
次の条件で培養する。
− 温度 :37 ℃±2 ℃
− 振とう速度:振とう培養機(5.27)によって,振り幅30 mmで110回/分の速度で振とう。
− 培養時間 :18時間〜24時間
8.3.1.3
20 mLのニュートリエント培地(NB)又はトリプトンソーヤ培地(TSB)を100 mLの蓋付三角
フラスコに注ぎ入れる。8.3.1.2の培養液から0.4 mLをとり,このフラスコに加える。
この接種液を1×108 CFU/mL〜3×108 CFU/mLの菌濃度,又はATP濃度で1×10−6 mol/L〜3×10−6 mol/L
を含んでいるようにニュートリエント培地(NB)又はトリプトンソーヤ培地(TSB)で調製する。
次の条件で培養する。
− 温度 :37 ℃±2 ℃
− 振とう速度:振とう培養機によって,振り幅30 mmで110回/分の速度で振とう。
− 培養時間 :3時間±1時間
培養後の菌濃度又はATP濃度の目標値は,107 CFU/mL又は10−7 mol/Lとする。
15
L 1902:2015
注記 調製した接種液は氷冷して保持し,8時間以内に使用するのがよい。
8.3.2
試験接種菌液の調製
8.3.1.3の菌濃度を分光光度計又はマクファーランドのネフェロメータ(5.1)で推定し,室温で水によっ
て20倍希釈したニュートリエント培地(NB)若しくはトリプトンソーヤ培地(TSB)を用いて,1×107
CFU/mL〜3×107 CFU/mLに調製するか,又は発光測定法によって8.3.1.3の培養後のATP濃度を測定し,
室温で水によって20倍希釈したニュートリエント培地(NB)若しくはトリプトンソーヤ培地(TSB)を
用いてATP濃度を1×10−7 mol/L〜3×10−7 mol/Lに調製する。
注記 調製した接種液は氷冷して保持し,4時間以内に使用するのがよい。
8.3.3
試験片の前準備
8.3.3.1
試験片の採取
直径60 mmに裁断した対照試料を6検体及び試験試料を6検体準備する。
必要な場合は,試験当事者間の合意に基づき前処理を行う。実施した前処理に関しては,その詳細を試
験報告書に記載する。
注記 対照試料3検体及び試験試料3検体は,転写直後の測定に使用し,残りの3検体ずつは,培養
後の測定に使用する。
8.3.3.2
試験片の滅菌
試験片をガラスシャーレ(5.17)に入れ,アルミニウムホイルで包み,オートクレーブ(5.28)で15分
間〜20分間処理する。
滅菌後,アルミニウムホイルを取り除き,クリーンベンチ(5.6)又は空中汚染の危険がない場所に静置
し,60分間以上乾燥させる。
オートクレーブ滅菌ができない場合には,エチレンオキサイドガス,γ線,又は別の適切な方法を採用
してもよい。それらの滅菌法を採用した場合は,その旨を試験報告書に記載する。
8.3.3.3
試験片の調湿
10 mLの菌転写法用寒天培地(6.12)をシャーレに注ぎ入れる。次に,シャーレをクリーンベンチに静
置し,冷却固化する。このとき結露を防ぐため,蓋をずらしてシャーレを室温まで冷却する。
寒天が固化したことを確認して,蓋をしてシャーレを倒置する。培地入りのものをずらし,試験片をシ
ャーレの蓋に載せる。試験片は,シャーレの蓋底に,寒天培地は天面にくるようにする。
その後,恒湿槽(5.8)で,温度20 ℃±2 ℃,湿度70 %RH以上の条件で18時間〜24時間湿度調整を
行う。
8.3.4
試験操作
8.3.4.1
試験菌のフィルタリング
クリーンベンチ内において,オートクレーブで滅菌したろ過装置(5.14)にメンブランフィルタをセッ
トする。
メンブランフィルタに,20倍に希釈されたニュートリエント培地(NB)(6.5)を5 mL注ぎ入れる。8.3.2
で調製した試験接種菌液を2 mL加える。次に,これを吸引しながらフィルタろ過する。フィルタ上の液
体が消失した後も約1分間吸引を続ける。
注記1 メンブランフィルタ自身の滅菌は,滅菌時に孔径が変化する可能性があるので実施しない。
注記2 ろ過装置を使用する場合は,焼結ガラス又はポリテトラフルオロエチレンでコーティングさ
れたネットをメンブランフィルタの保持に使用するのがよい。また,吸引にはアスピレータ,
小形のエアポンプ又は他の単純な装置を使用するのがよい。
16
L 1902:2015
8.3.4.2
試験菌の菌転写
試験菌の菌転写は,次による。
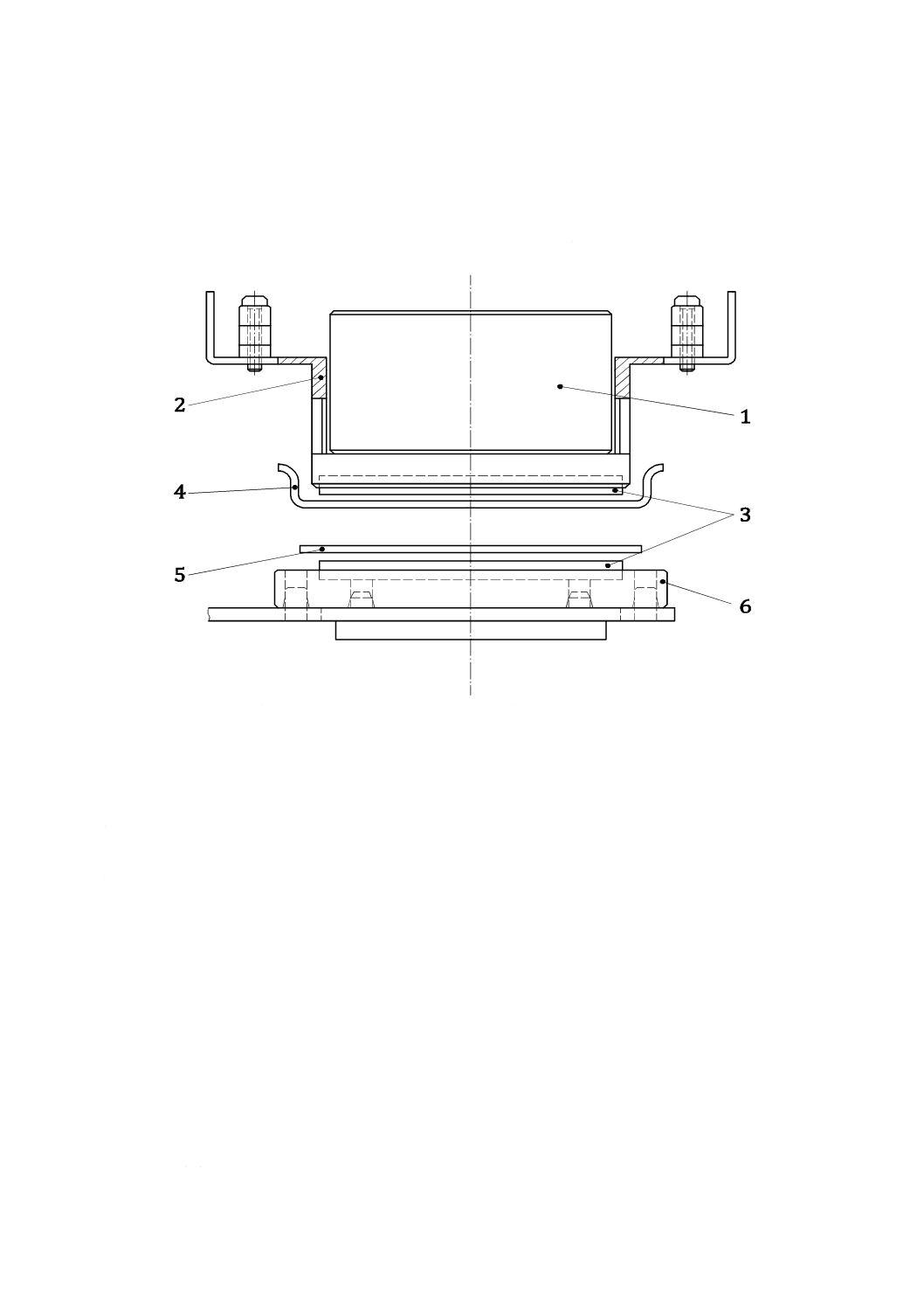
a) 滅菌されたピンセット(5.23)を使用し,ろ過装置から試験菌を収集したメンブランフィルタを取り
外す。次に,図2に示すように菌収集面を上にして,菌転写装置(5.10)の回転テーブル上に置く。
なお,菌転写装置の外部寸法は,高さ170 mm,幅160 mm,奥行き150 mmである。
1
おもり(質量300 g)
2
重し板
3
シリコーンゴム(42 mm)
4
試料片(60 mm)
5
メンブランフィルタ(47 mm)
6
回転プレート(54 mm)(左回りの回転)
図2−菌転写装置の例
b) 滅菌されたピンセット(5.23)を使用し,8.3.3.3によって調湿したシャーレから試験片を取り出し,
メンブランフィルタ上に抗菌加工面を下にして置く。
c) 重し板におもりを載せて,回転テーブルを3秒間に180度まで一方向に回転させ,メンブランフィル
タの細菌を試験片に転写する。
d) 転写直後,試験片を8.3.3.3の寒天の入っているシャーレの蓋に菌転写面を上向きにして移し,20 ℃
±2 ℃,70 %RH以上の培養器(5.2)にシャーレごと入れ,8.3.4.3によって培養する。
8.3.4.3
培養試験
8.3.4.2 d) の培養時間を1時間±0.1時間,2時間±0.1時間,3時間±0.1時間及び4時間±0.1時間の中
から決められた条件に合わせて選択する。選択した培養時間は,試験報告書に記載する。
8.3.4.4
菌転写直後の洗い出し
8.3.4.2 c) の菌転写後,菌転写直後測定用の対照試料3検体,及び試験試料3検体それぞれを別々のバイ
アル瓶に入れる。それぞれバイアル瓶に20 mLのSCDLP培地(6.8)を添加し,附属書Bによって,洗い
出しを行う。
8.3.4.5
培養後の洗い出し
17
L 1902:2015
8.3.4.3の培養後,培養後測定用の対照試料3検体,及び試験試料3検体それぞれを別々のバイアル瓶に
入れる。それぞれバイアル瓶に20 mLのSCDLP培地を添加し,附属書Bによって,洗い出しを行う。
8.3.4.6
生菌数又はATP量の計算
8.3.4.6.1
一般事項
8.3.4.6.2及び8.3.4.6.3に示した式に従い,8.3.4.4及び8.3.4.5のそれぞれにおける生菌数を附属書Cで得
た菌濃度から,また,ATP量を附属書Dで得たATP濃度から計算する。
8.3.4.6.2
生菌数
生菌数の計算は,8.1.4.5.2の式(1)による。
8.3.4.6.3
ATP量
ATP量の計算は,8.1.4.5.3の式(2)による。
8.3.5
試験結果
8.3.5.1
対照試料での試験成立の判定
対照試料での試験は,次のa)及びb) を満たした場合,試験成立と判定する。ただし,この試験が不成
立と判定された場合は,再試験を実施しなければならない。
a) 対照試料に転写された生菌数及びATP量は,1.0×106 CFU又は1.0×10−11 molを超える。
b) 8.1.5.1の式(3)によって計算する対照試料の増減値(F)が,+0.5〜−0.5の範囲にある。
8.3.5.2
抗菌活性値の計算
試験が成立したと判定した場合,次の式(5)で抗菌活性値を計算し,JIS Z 8401の規則Bによって小数点
以下1桁に丸める。
t
tlog
log
T
C
A
−
=
······································································· (5)
ここに,
A: 抗菌活性値
log Ct: 1時間〜4時間培養後の対照試料3検体の生菌数,又はATP
量の算術平均の常用対数
log Tt: 1時間〜4時間培養後の試験試料3検体の生菌数,又はATP
量の算術平均の常用対数
8.4
ハロー法
ハロー法による定性試験方法は,附属書JAによる。
9
抗菌効果
抗菌効果は,次による。
a) 定量試験 試験法によって,次による。
1) 菌液吸収法 8.1によって試験したとき,抗菌活性値が2.0以上。
2) トランスファー法 8.2によって試験したとき,抗菌活性値が2.0以上。
3) 菌転写法 8.3によって試験したとき,抗菌活性値が0以上。
b) 定性試験(ハロー法) 8.4によって試験したとき,ハロー(JA.7.2)があるもの。
10 試験報告書
試験報告書は,次の事項を含めなければならない。
a) この規格の規格番号
b) 試験試料の詳細
c) 試験菌の名称
18
L 1902:2015
d) 菌株保存番号及び供給者
e) 実施した試験方法
f)
試験接種菌液の濃度
g) 抗菌活性値
h) 使用した定量法及び試験結果
i)
試験片の滅菌方法
j)
接種後からの培養時間
k) log C0>log T0の場合は,log T0をlog C0に置き換える。
l)
この規格からの逸脱事項
19
L 1902:2015
附属書A
(規定)
試験菌株
A.1 一般事項
試験で使用する細菌は,表A.1に規定したものと同一系で,国際微生物保存連盟(WFCC)の会員によ
って保存されているものでなければならない。試験で使用された菌株については,供給者及び保存番号を
試験報告書に記載する。
A.2 細菌のリスト
試験用細菌のリストは,表A.1による。国別保存番号及び保存機関名の例を,表A.2に示す。
表A.1−試験用細菌a)
細菌名称
WDCMコードb)
黄色ぶどう球菌
00193
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00193
肺炎かん(桿)菌
00192
http://refs.wdcm.org/getinfo.htm?sid=WDCM̲00192
注a) 試験が成立する場合,他の細菌も使用できる。
b) WDCMのウェブサイトへ:http://refs.wdcm.org/search.htm.(WDCM: World
Data Centre for Microorganismsの略称である。)

20
L 1902:2015
表A.2−試験に使用する細菌の菌株の国別保存番号及び保存機関名の例
細菌の種類
保存番号
国別保存機関名
スタフィロコッカス・
アウレウス
Staphylococcus aureus
(黄色ぶどう球菌)
ATCC 6538
ATCC 6538P
American Type Culture Collection (USA)
(米国基準微生物株保存機関)
FDA 209P
Food and Drug Administration(食品・医薬品局)
AHU 1142
北海道大学農学部
CIP 4.83
Institut Pasteur, Collection de IʼInstitut Pasteur (France)
(仏国パスツール研究所)
DSM 799
German Collection of Microorganism and Cell Culture (Germany)
(独国微生物・培養細胞保存機関)
GIFU 10391
岐阜大学医学部
IAM 12082
東京大学分子細胞生物学研究所
NBRC 12732
NBRC 13276
NITE Biological Resource Center (Japan)
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンター)
NRIC 1136
東京農業大学
OUT 8232
大阪大学工学部
NCIMB 9518
National Collection of Industrial, Food and Marine Bacterial Ltd. (UK)
クレブシェラ・ニュウ
モニアエ
Klebsiella pneumoniae
(肺炎かん菌)
ATCC 4352
American Type Culture Collection (USA)
CIP 104216
Institut Pasteur, Collection de IʼInstitut Pasteur (France)
(仏国パスツール研究所)
DSM 789
German Collection of Microorganism and Cell Culture (Germany)
(独国微生物・培養細胞保存機関)
IAM 12015
東京大学分子細胞生物学研究所
NBRC 13277
NITE Biological Resource Center (Japan)
(独立行政法人製品評価技術基盤機構バイオテクノロジーセンター)
NCIMB 10341
National Collection of Industrial, Food and Marine Bacterial Ltd. (UK)
注記 実際に入手するときは,それぞれの保存機関に問い合わせるのがよい。
21
L 1902:2015
附属書B
(規定)
洗い出し法
B.1
一般事項
試験片から細菌を洗い出す方法は,ボルテックスミキサによる洗い出し法,手振りによる洗い出し法及
びストマッカー(5.5)による洗い出し法とする。
B.2
ボルテックスミキサによる洗い出し法
ボルテックスミキサ(5.4)の平板,ゴム製保持部に試験管及びバイアル瓶の下部を押し付け,5秒×5
サイクルの振とうを行う。
B.3
手振りによる洗い出し法
バイアル瓶(5.16)を手に取り,約300 mmの円弧状に1秒1往復の割合で30秒振とうする。
B.4
ストマッカーによる洗い出し法
使い捨てプラスチックバッグ(5.22)をストマッカーに設置する。スイッチを入れ,各面について1分
間処理する。
22
L 1902:2015
附属書C
(規定)
混釈平板培養法による定量法
C.1 一般事項
この附属書は,混釈平板培養法による定量法の試験方法について規定する。
C.2 試験手順
C.2.1 ピペット(5.15)を使用し,洗い出し液1 mLを採る。ニュートリエント培地(NB)(6.5),生理食
塩水(6.7)又はペプトン食塩水(6.6)が9.0 mL±0.1 mL入った試験管に採取した液を加え,よくかくは
んする。
C.2.2 新しいピペットを使用し,この液を1 mL採り,液をニュートリエント培地(NB)(6.5),生理食
塩水(6.7)又はペプトン食塩水を9.0 mL±0.1 mLを含む別の試験管に加え,よくかくはんする。
この手順を繰り返し,それぞれの希釈が10倍希釈になるように希釈系列を作る。それぞれの希釈液から
二つのシャーレに各1 mLをピペットで入れる。
C.2.3 水温を45 ℃〜46 ℃に温めたウォーターバス(5.3)で保持しておいた混釈平板培養法用寒天培地
(EA)(6.11)又はトリプトンソーヤ寒天培地(TSA)(6.3)をシャーレに約15 mL加え,よくかくはんす
る。次に,室温で静置し,培地が固化したら,シャーレを逆さにし,37 ℃±2 ℃でコロニーの形成が確認
できる24時間〜48時間培養する。
C.2.4 培養後に,希釈系列のシャーレのコロニー数が30〜300のシャーレを見つけ,コロニー数を数える。
洗い出し液1 mLを入れたシャーレの測定可能なコロニー数が30以下の場合は,計算に使用するコロニー
数として,その2枚の平均値をそのまま使用する。もし,洗い出し液の1 mLを入れたシャーレの測定可
能なコロニー数が1以下の場合は,平均値を1として計算する。
C.2.5 次の式によって,その希釈液の菌濃度を計算する。
R
Z
c
×
=
B
ここに,
cB: 菌濃度の1 mL当たりのコロニー形成単位(CFU/mL)
Z: 二つのシャーレのコロニー数の平均値,洗い出し液1 mL当た
りのコロニー形成単位(CFU/mL)
R: 希釈倍率
23
L 1902:2015
附属書D
(規定)
発光測定法による定量法
D.1 一般事項
この附属書は,発光測定法による定量法の試験方法について規定する。
D.2 試験手順
D.2.1 検量線の作成
D.2.1.1 ATP標準試薬原液(6.14)及び希釈液として,洗い出し用生理食塩水(6.7),SCDLP培地(6.8)
又は別の適切な培地を用意する。次に,ATP標準試薬原液を測定する操作に対応した種類の希釈液(表D.1
参照)で希釈し,ATP濃度2×10−8 mol/L,2×10−9 mol/L,及び2×10−10 mol/LのATP標準試料を用意す
る。
表D.1−ATP標準試薬希釈液及びブランク
試験方法
操作
ATP標準試薬希釈液及びブランク
菌液吸収法
試験接種菌液調製
水
接種直後の洗い出し
培養後の洗い出し
使用する洗い出し液
トランスファー法
試験接種菌液調製
水
転写直後の洗い出し
培養後の洗い出し
不活性化液(6.10)
菌転写法
試験接種菌液調製
水
転写直後の洗い出し
培養後の洗い出し
ATP標準試薬調製のためのSCDLP培地
又は他の培地(6.19)
D.2.1.2 各濃度水準の液0.1 mLを別の空プラスチック試験管に注ぎ入れる。次に,それぞれの試験管に
0.9 mLの菌液調製用緩衝液(6.9)を入れ,十分にかくはんする。さらに,菌液調製用緩衝液が入った液を
二つのプラスチック試験管にそれぞれ0.1 mLずつ注ぎ入れる。これらを各濃度水準の測定用希釈標準液と
する。
D.2.1.3 空プラスチック試験管に0.1 mLのD.2.1.1で使用した希釈液(表D.1参照)を注ぎ入れ,次に,
0.8 mLの菌液調製用緩衝液と0.1 mLのATP消去試薬(6.18)を入れる。十分にかくはんし,0.1 mLずつ
別の2本の空プラスチック試験管に分ける。5〜30分間静置し,これらをブランク測定用試料とする。
D.2.1.4 ブランク測定試料の試験管に0.1 mLのATP抽出試薬を加え,かくはんする。次に,0.1 mLのATP
発光試薬(6.16)を加え,再びかくはんし,直ちに,発光光度計で発光量を計測する。
D.2.1.5 低濃度のものから順に各濃度水準の測定用希釈標準液の試験管に0.1 mLのATP抽出試薬(6.17)
を加え,かくはんする。次に,0.1 mLのATP発光試薬を加え,再びかくはんし,直ちに,発光光度計で発
光量を計測する。
D.2.1.6 ATP濃度を,2×10−8 mol/L,2×10−9 mol/L,及び2×10−10 mol/Lの各濃度の測定用希釈標準液の
発光量計測値の平均値で除し,それらの平均値を係数aとする。
D.2.1.7 次の式に係数aを代入し,cATP=0で係数bを計算する。
b
X
a
c
+
×
=
ATP
24
L 1902:2015
ここに, cATP: ATP濃度(mol/L)
X: 発光量(RLU=相対発光量)
a: 直線近似曲線の勾配
b: 直線近似曲線の切片
注記 cATP及びXの間のR2値は0.9以上,及び信頼水準は0.95を超える水準である。
D.2.2 試験接種菌液及び洗い出し液のATP濃度測定
D.2.2.1 ATP消去用の空プラスチック試験管を1本及び測定用空プラスチック試験管を2本用意する。
D.2.2.2 ATP消去用の試験管に,菌液を0.1 mL,菌液調製用緩衝液を0.8 mL,更にATP消去試薬(6.18)
を0.1 mLを注ぎ入れ,よくかくはんする。この混合液を測定用の2本の試験管に0.1 mLずつ分け入れ,5
〜30分間静置する。
D.2.2.3 それぞれの測定用試験管にATP抽出試薬を0.1 mLを加え,よくかくはんする。次に,0.1 mLの
ATP発光試薬を加え,再びかくはんし,直ちに,発光光度計で発光量を計測する。
D.2.2.4 ATP濃度をD.2.1.7の式によって計算し,次の式によって試験接種菌液及び洗い出し液のATP濃
度を計算する。その際のATP濃度の下限値は,1×10−13 mol/Lとする。
000
1
ATP
P
AT
c
c
=
′
ここに, cATP': 試験接種菌液及び洗い出し液のATP濃度(mol/mL)
cATP: ATP濃度(mol/L)

25
L 1902:2015
附属書E
(参考)
試験例
E.1
菌液吸収法
菌液吸収法の試験例として,混釈平板培養法による定量測定(表E.1参照)及び発光測定法による定量
測定(表E.2参照)を示す。
表E.1−混釈平板培養法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
接種菌液濃度(CFU/mL)
1.2×105
1.1×105
対照試料3検体の最大最小差(log)
(成立条件1未満)
接種直後
培養後
接種直後
培養後
0.4
0.3
0.5
0.4
試験試料3検体の最大最小差(log)
(成立条件2未満)
接種直後
培養後
接種直後
培養後
0.6
0.5
0.7
0.6
増殖値F(F=log Ct−log C0)
+2.7:(log Ct:+7.0,log C0:+4.3) +3.2:(log Ct:+7.5,log C0:+4.3)
増殖値G(G=log Tt−log T0)
−1.0:(log Tt:+3.2,log T0:+4.2) +0.7:(log Tt:+4.9,log T0:+4.2)
抗菌活性値(A=F−G)
3.8
2.6
定量測定方法
混釈平板培養法
試験試料明細
靴下:綿 100 %
試験片の滅菌法
オートクレーブ
培養時間
20時間
表E.2−発光測定法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
接種ATP濃度(mol/L)
1.2×10−9
1.9×10−9
対照試料3検体の最大最小差(log)
(成立条件1未満)
接種直後
培養後
接種直後
培養後
0.5
0.6
0.5
0.4
試験試料3検体の最大最小差(log)
(成立条件2未満)
接種直後
培養後
接種直後
培養後
0.5
0.7
0.6
0.8
増殖値F(F=log Ct−log C0)
+1.7:(log Ct:−11.0,log C0:−12.7) +2.1:(log Ct:−10.4,log C0:−12.5)
増殖値G(G=log Tt−log T0)
−0.8:(log Tt:−13.6,log T0:−12.8) −0.1:(log Tt:−12.6,log T0:−12.5)
抗菌活性値(A=F−G)
2.6
2.2
定量測定方法
発光測定法
試験試料明細
カーテン:ポリエステル 100 %
試験片の滅菌法
エチレンオキサイドガス
培養時間
20時間

26
L 1902:2015
E.2
トランスファー法
トランスファー法の試験例として,混釈平板培養法による定量測定(表E.3参照)及び発光測定法によ
る定量測定(表E.4参照)を示す。
表E.3−混釈平板培養法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
接種菌液濃度(CFU/mL)
2.2×106
1.1×106
対照試料3検体の最大最小差(log)
(成立条件1未満)
接種直後
培養後
接種直後
培養後
0.3
0.4
0.2
0.3
試験試料3検体の最大最小差(log)
(成立条件2未満)
接種直後
培養後
接種直後
培養後
0.6
0.5
0.7
0.6
増殖値F(F=log Ct−log C0)
+2.9:(log Ct:+8.5,log C0:+5.6) +2.7:(log Ct:+8.1,log C0:+5.4)
増殖値G(G=log Tt−log T0)
−1.7:(log Tt:+3.8,log T0:+5.5) −2.5:(log Tt:+2.8,log T0:+5.3)
抗菌活性値(A=F−G)
4.6
5.2
定量測定方法
混釈平板培養法
試験試料明細
靴下:綿 100 %
試験片の滅菌法
オートクレーブ
培養時間
22時間
表E.4−発光測定法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
接種ATP濃度(mol/L)
3.2×10−9
4.9×10−9
対照試料3検体の最大最小差(log)
(成立条件1未満)
接種直後
培養後
接種直後
培養後
0.5
0.6
0.4
0.3
試験試料3検体の最大最小差(log)
(成立条件2未満)
接種直後
培養後
接種直後
培養後
0.4
0.7
0.5
0.6
増殖値F(F=log Ct−log C0)
+3.1:(log Ct:−9.1,log C0:−12.2) +2.6:(log Ct:−9.4,log C0:−12.0)
増殖値G(G=log Tt−log T0)
−2.2:(log Tt:−14.5,log T0:−12.3) −2.2:(log Tt:−14.1,log T0:−11.9)
抗菌活性値(A=F−G)
5.3
4.8
定量測定方法
発光法
試験試料明細
カーテン:ポリエステル 100 %
不活性化液の組成及び濃度
卵黄レシチン,全容量対比 0.5 %
試験片の滅菌法
γ線
培養時間
22時間
27
L 1902:2015
E.3
菌転写法
菌転写法による試験例として,混釈平板培養法による定量測定(表E.5参照)及び発光測定法による定
量測定(表E.6参照)を示す。
表E.5−混釈平板培養法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
フィルタの上の生菌数(CFU)
3.0×107
3.6×107
菌転写直後の対照試料上の生菌数
(CFU)
4.2×106
6.4×106
抗菌活性値(A=log Ct−log Tt)
1.7:(log Ct:+6.7,log Tt:+5.0)
1.1:(log Ct:+6.7,log Tt:+5.6)
定量測定方法
混釈平板培養法
試験試料の詳細
カーテン:ポリエステル 100 %
滅菌法
オートクレーブ
培養時間
4時間
表E.6−発光測定法による定量測定
試験菌
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
フィルタの上のATP量(mol)
2.9×10−10
1.7×10−10
菌転写直後の対照試料片上のATP
量(mol)
4.0×10−11
3.0×10−11
抗菌活性値(A=log Ct−log Tt)
1.7:(log Ct:−10.4,log Tt:−12.1) 1.1:(log Ct:−10.6,log Tt:−11.7)
定量測定方法
発光測定法
試験試料の詳細
カーテン:ポリエステル 100 %
滅菌法
エチレンオキサイドガス
培養時間
2時間
E.4
ハロー法
ハロー法による試験例(表E.7参照)を示す。
表E.7−ハロー法による試験結果例
試験に用いた菌種
黄色ぶどう球菌
肺炎かん(桿)菌
菌株保存番号
ATCC 6538
ATCC 4352
菌濃度(CFU/mL)
2.3×106
3.5×106
ハローの幅の平均値(mm)
3.5
2.0
ハローの有無
あり
あり
試験片の種類及び形状
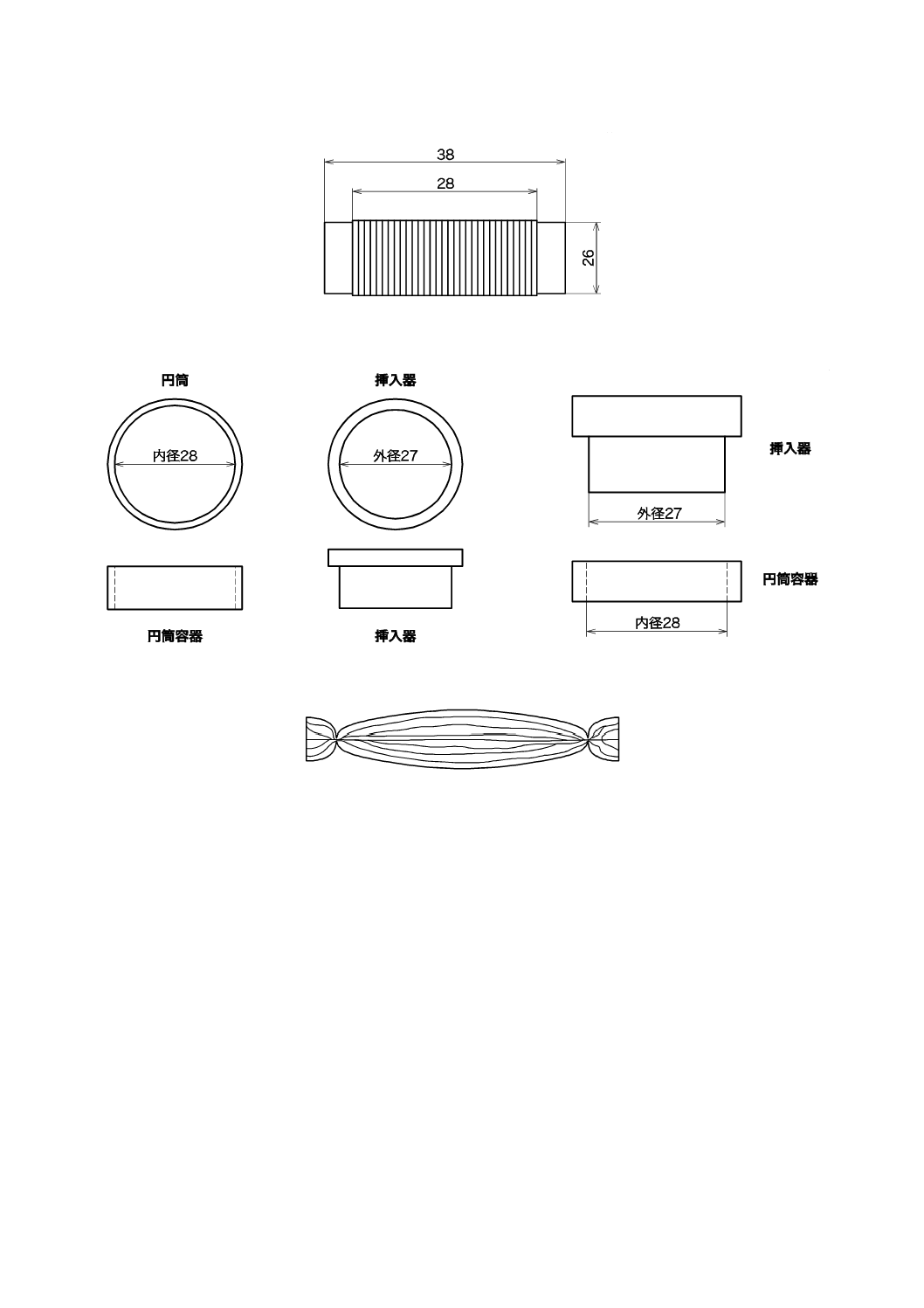
編物,28 mm円形(ステンレス鋼製円板を載置)
28
L 1902:2015
附属書F
(参考)
抗菌効果
試験結果からの試験試料の抗菌効果は,表F.1による。
表F.1−抗菌活性値及び効果基準
抗菌活性値 A
抗菌効果
2.0≦A<3.0
効果が認められる。
3.0≦A
強い効果が認められる。

29
L 1902:2015
附属書JA
(規定)
定性試験(ハロー法)
JA.1 一般事項
この附属書は,ハロー法による定性の試験方法について規定する。
JA.2 追加する培地
JA.2.1 ブイヨン培地 次の成分からなり,よくかくはんし,pHを7.0±0.2に調整したもの。
− 肉エキス
5.0 g
− ぺプトン
10.0 g
− 塩化ナトリウム
5.0 g
− 水
1000 mL
JA.2.2 普通寒天培地 次の成分からなり,よくかくはんし,pHを7.0±0.2調整する。その後,オートク
レーブ(5.28)で滅菌する。
− 肉エキス
5.0 g
− ぺプトン
10.0 g
− 塩化ナトリウム
5.0 g
− 寒天
15.0 g
− 水
1000 mL
JA.3 試験片の調製
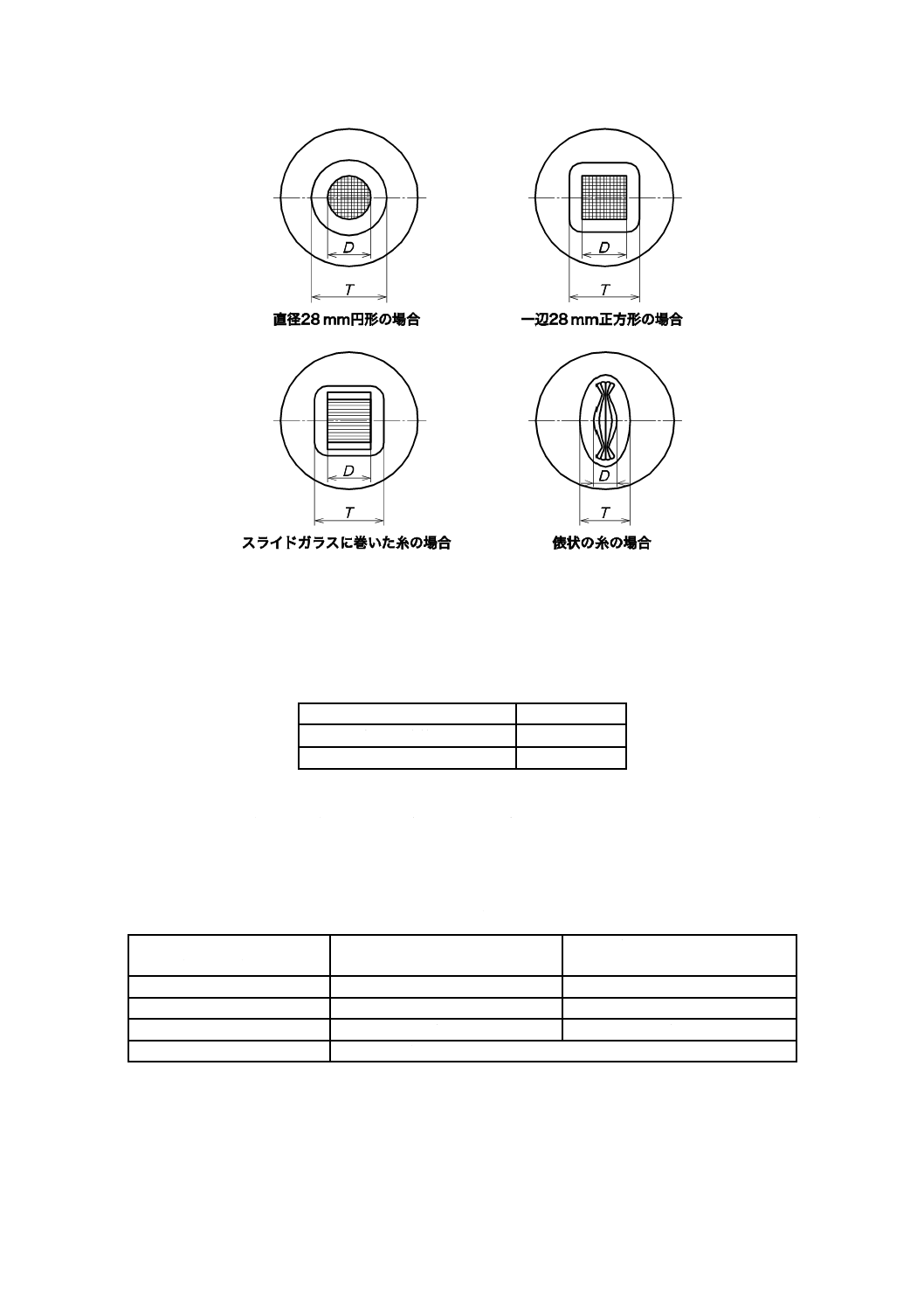
JA.3.1 試験片の大きさ,形状及び数量
試験に用いる試験片の大きさ及び形状は,表JA.1による。試験試料と対照試料とをそれぞれ用意し,試
験片は,各試験菌について試験試料から3検体,及び対照試料から3検体を採取する。
表JA.1−試験片の大きさ及び形状
試験片の種類
試験片の大きさ及び形状
織物,編物及び不織布
直径28 mmの円形a)
糸
図JA.1のように38 mm×26 mm(約3.3 g)のスライドガラスの
中央部に28 mmの幅で糸を1重に巻き付けるb)。
わた及びパイルの長いもの
約0.2 gを3 mm〜5 mmに切断してよく混ぜ,図JA.2のような内
径28 mmの円筒容器に入れて,一様に広げ,外径27 mmの挿入
器を用いて加圧して28 mmの円形にするc)。
注a) 試験片の大きさ及び形状は,28 mm×28 mmの正方形も適用できる。
b) 図JA.3のように長さ50 mmの糸を平行にそろえてこれを約0.2 g採り,両端から5 mm
のところを同一の糸で縛ったもの(俵状)も適用できる。
c) 細断し,圧力約63.7 MPaで約10分間,圧縮したものも適用できる。
30
L 1902:2015
単位 mm
図JA.1−糸巻き状試験片
単位 mm
図JA.2−試験片調製容器
図JA.3−俵状試験片
JA.3.2 試験片の前処理
JA.3.1で採取した試験片をアルミニウムホイルで包み,又はガラス製シャーレに入れてオートクレーブ
滅菌を行う。ただし,試験試料は,スライドガラスに巻いた糸の場合を除き,この操作を省略してもよい。
JA.4 試験操作
JA.4.1 菌液の調製
保存菌から7.2.4の斜面培地に1白金耳接種し,温度37 ℃±2 ℃で24時間〜48時間培養する。培養後,
更にブイヨン培地(JA.2.1)に白金耳移植し,温度37 ℃±2 ℃で24時間±2時間培養する。菌液の菌濃
度を吸光度法若しくは顕微鏡による直接観察法又はATP濃度を発光測定法によって推定し,室温のブイヨ
ン培地で,菌濃度を106 CFU/mL〜107 CFU/mL又はATP濃度を10−8 mol/L〜10−7 mol/Lに調製する。
JA.4.2 混釈平板培養培地の調製
クリーンベンチ内でJA.4.1の菌液1 mLを滅菌済みシャーレに入れ,45 ℃〜46 ℃に保温した普通寒天
培地(JA.2.2)15 mLをシャーレに加えて十分に混ぜて室温で放置し,寒天を凝固させる。これを倒置し,
蓋をずらして室温で更に30分〜3時間放置し,余分な水分を乾燥させる(図JA.4及び図JA.5を参照)。

31
L 1902:2015
図JA.4−倒置したシャーレ
図JA.5−蓋をずらしたシャーレ
JA.4.3 試験片の設置
滅菌したピンセットを用いて,JA.3.2の試験片をJA.4.2の混釈平板培養培地の中央に,培地の表面にき
ずを付けないように軽く置いて密着させる。このとき,試験片がカールするもの,わた及びパイルの長い
ものは,試験片上に,滅菌したステンレス鋼製円板(直径約28 mm,質量約20 gのステンレス鋼製のもの)
を置く。ただし,ステンレス鋼製円板が試験片より大きいときは,ステンレス鋼製円板が培地表面に接触
しないように試験片を数枚重ねた上に置く。
JA.5 培養試験
JA.3.2の試験片を設置したシャーレを倒置して,37 ℃±2 ℃で24時間〜48時間培養する。ただし,試
験片上にステンレス鋼製円板を置いた場合,及びスライドガラスに巻いた糸の試験片は倒置しない。
JA.6 細菌の活性状態の確認
JA.5の培養試験後,対照試料の平板培地上全面に細菌の繁殖がない場合は,この試験を無効とし,再試
験を行う。
JA.7 試験結果
JA.7.1 ハローの測定
JA.5の培養の結果,試験片の周囲にできたハローについて,シャーレの底から図JA.6に示すT及びD
の距離をmm単位で整数位まで測定し,式(JA.1)によって,ハローの幅を計算する。試験試料について3
検体のハローの幅の平均値を求め,小数点以下1桁に丸める。
2
D
T
W
−
=
··········································································· (JA.1)
ここに,
W: ハローの幅(mm)
T: 試験片の長さとハローの幅との合計(mm)
D: 試験片の長さ(mm)
32
L 1902:2015
図JA.6−ハローの測定
JA.7.2 ハローの有無の判定
JA.7.1の結果から,ハローの有無を表JA.2によって判定する。
表JA.2−ハローの判定
試験結果
ハローの有無
ハローの幅の平均値>0のとき
あり
ハローの幅の平均値=0のとき
なし
JA.7.3 試験結果の記録
試験に用いた菌種,細菌の保存番号,菌濃度又はATP濃度,試験片のハローの幅の平均値,ハローの有
無,試験片の種類及び形状を記録する。また,試験片上にステンレス鋼製円板を載せた場合は,その旨を
記載する(表JA.3参照)。
表JA.3−試験結果の例
試験に用いた菌種
(細菌の保存番号)
スタフィロコッカス・アウレウス
(ATCC 6538P)
クレブシェラ・ニュウモニアエ
(ATCC 4352)
菌濃度(CFU/mL)
2.3×106
3.5×106
ハローの幅の平均値(mm)
3.5
2.0
ハローの有無
あり
あり
試験片の種類及び形状
編物,28 mm円形(ステンレス鋼製円板を載置)
33
L 1902:2015
参考文献
[1] ISO/IEC Guide 98-3:2008,Uncertainty of measurement−Part 3: Guide to the expression of uncertainty in
measurement (GUM:1995) (GUM)
[2] JIS Z 8402-1 測定方法及び測定結果の精確さ(真度及び精度)−第1部:一般的な原理及び定義
注記 対応国際規格:ISO 5725-1,Accuracy (trueness and precision) of measurement methods and results
−Part 1: General principles and definitions(IDT)
[3] JIS Z 8402-2 測定方法及び測定結果の精確さ(真度及び精度)−第2部:標準測定方法の併行精度及
び再現精度を求めるための基本的方法
注記 対応国際規格:ISO 5725-2,Accuracy (trueness and precision) of measurement methods and results
−Part 2: Basic method for the determination of repeatability and reproducibility of a standard
measurement method(IDT)
[4] JIS Z 8402-3 測定方法及び測定結果の精確さ(真度及び精度)−第3部:標準測定方法の中間精度
注記 対応国際規格:ISO 5725-3,Accuracy (trueness and precision) of measurement methods and results
−Part 3: Intermediate measures of the precision of a standard measurement method(IDT)
[5] JIS Z 8402-4 測定方法及び測定結果の精確さ(真度及び精度)−第4部:標準測定方法の真度を求め
るための基本的方法
注記 対応国際規格:ISO 5725-4,Accuracy (trueness and precision) of measurement methods and results
−Part 4: Basic methods for the determination of the trueness of a standard measurement method
(IDT)
[6] JIS Z 8402-6 測定方法及び測定結果の精確さ(真度及び精度)−第6部:精確さに関する値の実用的
な使い方
注記 対応国際規格:ISO 5725-6,Accuracy (trueness and precision) of measurement methods and results
−Part 6: Use in practice of accuracy values(IDT)
[7] ISO 20645,Textile fabrics−Determination of antibacterial activity−Agar diffusion plate test
[8] EN 12353,Chemical disinfectants and antiseptics−Preservation of test organisms used for the determination of
bactericidal, mycobactericidal sporicidal and fungicidal activity
34
L 1902:2015
附属書JB
(参考)
JISと対応国際規格との対比表
JIS L 1902:2015 繊維製品の抗菌性試験方法及び抗菌効果
ISO 20743:2013,Textiles−Determination of antibacterial activity of textile products
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規
定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差異の
理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
1 適用範囲
試験方法の一覧
JISに同じ
(以下同文)
追加
抗菌効果として判定基準を追加し
た。
従来JISの運用上の都合による。
選択
ハロー法を追加した。
国内ではまだハロー法の需要がある
ため。
2 引用規格
3 用語及び定義
3.1 対照試料
変更
綿布の洗濯処理の詳細を追加した。
国際規格では対照試料としての綿布
の作製法が不十分なため。
3.4 抗菌活性
追加
抗菌活性の用語の定義を追加した。
試験運用の使用実態に合わせるため。
3.5 抗菌効果
追加
抗菌効果の用語の定義を追加した。
抗菌効果として判定基準を追加した。
3.9 ハロー
追加
ハローの定義を追加した。
国内の利用実態に合わせた。
5 試験機器
5.6 クリーンベンチ又は
安全キャビネット
追加
安全キャビネットを追加した。
安全キャビネットも使用できるよう
に追加。
5.7 白金耳
変更
白金耳を追加規定した。
洗濯機削除による入れ替えのため。
5.9 発光光度計
変更
仕様を変更した。
試験運用の実態に合わないため。
5.15 ピペット
変更
仕様を変更した。
国際規格の設定では試験運用の実態
に合わないため。
5.26 アルミニウムホイル
追加
仕様規定を追加した。
不十分のため追加した。
5.27 振とう培養機
追加
仕様規定を追加した。
不十分のため追加した。
6 試薬及び培地
6.8 SCDLP培地
削除
効果が不十分な場合の対応を削除し
た。
効果を評価する規定がないため記載
事項を運用することができない。
6.10 不活性化液
削除
効果が不十分な場合の対応を削除し
た。
効果を評価する規定がないため記載
事項を運用することができない。
6.14 ATP標準試薬原液
追加
再凍結を禁止にした。
品質劣化による影響を避けるため。
2
L
1
9
0
2
:
2
0
1
5
35
L 1902:2015
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規
定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差異の
理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
7 試験菌株
7.1 菌株
変更
1菌種でも試験可と変更した。
試験運用の実態に合わせるため。
7.2.4 斜面培地法
追加
斜面培地で継代培養する方法を追加
した。
従来JISを引き継ぐため。
8 試験手順
8.1.1.1 前培養Aなど
変更
培養の工程に名称を付けた。
試験運用の実態に合わせるため。
追加
平板からとるコロニーは一つに限定
した。
従来JISの規定による。
追加
平板の再使用について追加した。
国内の実態に合わせた。
8.1.1.3 前培養C
変更
培養液の濃度は参考とする。
試験運用の実態に合わせるため。
8.1.2 試験接種菌液の調製
追加
希釈液の濃度調製操作を追加した。
分光光度計では濃度の調製はできな
いため。
追加
試験接種菌液濃度の測定法を追加し
た。
試験報告書記載要件だが,国際規格に
規定がないため追加した。
8.1.3.2 c) カーペット類の
場合
追加
カーペット自体も試験片として試験
できるよう追加した。
試験運用の実態に合わせるため。
8.1.3.2 前処理
選択
洗濯処理に限定しないよう変更し
た。
洗濯処理に対応するJISが検討段階の
ため変更した。
8.1.5.1 対照試料での試験
成立の判定
追加
数値の丸め方を追加した。
結果の表記を明確にするため。
8.1.5.2 試験試料での試験
成立の判定
追加
試験の成立要件を追記した。
国内の試験実態に合わせた。
削除
解説へ移行した。
試験成立条件設定の補足説明のため。
追加
数値の丸め方を追加した。
結果の表記を明確にするため。
変更
C0,T0ともlog C0,log T0に変更した。 比較は対数値によるため。
8.2.2 試験片の準備
削除
試料の採取部位の限定を削除した。
試料の採取においては,JISの試験通
則にあるため。
選択
洗濯処理に限定しないよう変更し
た。
洗濯処理に対応するJISが検討段階の
ため変更した。
8.2.3.1 寒天平板への接種
追加
試料別の必要枚数を追記した。
国内の試験実態に合わせた。
8.2.4.1 対照試料での試験
成立の判定
追加
数値の丸め方を追加した。
結果の表記を明確にするため。
2
L
1
9
0
2
:
2
0
1
5
36
L 1902:2015
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規
定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差異の
理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
8 試験手順
(続き)
8.2.4.2 試験試料での試験
成立の判定
削除
解説へ移行
試験成立条件設定の補足説明のため。
追加
数値の丸め方を追加した。
結果の表記を明確にするため。
変更
C0,T0ともlog C0,log T0に変更した。 比較は対数値によるため。
8.3.1 培養など
追加
TSBを追加した。
菌液吸収法に合わせた。
8.3.2 試験接種菌液の調製
追加
希釈液の濃度調製操作を追加した。
分光光度計では濃度の調製はできな
いため。
8.3.3.1 試験片の採取
選択
洗濯処理に限定しないよう変更し
た。
洗濯処理に対応するJISが検討段階の
ため変更した。
8.3.3.3 試験片の調湿
追加
試験片の状態を追記した。
国内の試験実態に合わせた。
8.3.4.2 図2
変更
おもりの重さを変更した。
国際規格の記載は不適切のための変
更。
8.3.5.1 対照試料での試験
成立の判定
変更
10×10−9 molを1.0×10−11 molに修
正した。
国内の試験実態に合わせた。
8.3.5.2 抗菌活性値の計算
追加
数値の丸め方を追加した。
結果の表記を明確にするため。
8.4 ハロー法
−
−
追加
ハロー法の試験手順を追加した。
従来JISを引き継ぐため。
9 抗菌効果
−
−
追加
抗菌効果を追加した。
従来JISの運用上の都合による。
10 試験報告書
i),j),k)
追加
滅菌法,培養時間,log T0をlog C0
に置き換えを記載した。
附属書Fに整合するため。
附属書A(規定)
試験菌株
A.2 細菌のリスト
追加
例を表A.2として追加した。
Web参照の手間を省くため。
附属書B(規定)
洗い出し法
B.3 手振りによる洗い出
し法
追加
速度を追加した。
作業者による差異をなくすため。
削除
試験管を削除した。
洗い出しに試験管は使用しないため。
附属書C(規定)
混釈平板培養法
による定量法
C.2.3
変更
温度管理は培地ではなく水浴を対象
とした。
操作上の都合による。
附属書D(規定)
発光測定法によ
る定量法
D.2.1.1
追加
表D.1を追加した。
文言だけでは分かりにくいため追加。
D.2.1.2他
変更
測定回数を2回に変更した。
従来JISどおり2回で十分のため。
D.2.2.4
追加
検出限界を設定した。
必要だが国際規格に抜けているため。
2
L
1
9
0
2
:
2
0
1
5
37
L 1902:2015
(I)JISの規定
(II)
国際
規格
番号
(III)国際規格の規
定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差異の
理由及び今後の対策
箇条番号
及び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
附属書JA(規定)
定性試験(ハロ
ー法)
追加
ハロー法の詳細を追加した。
国内ではまだハロー法の需要がある
ため。
JISと国際規格との対応の程度の全体評価:ISO 20743:2013,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除 ················ 国際規格の規定項目又は規定内容を削除している。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
− 選択 ················ 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
2
L
1
9
0
2
:
2
0
1
5