K 8008-1992
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目次
ページ
1. 適用範囲 ························································································································ 1
2. 一般事項 ························································································································ 1
2.1 用語の定義 ··················································································································· 1
2.2 名称の付け方 ················································································································ 2
2.3 単位及び記号 ················································································································ 2
3. 共通事項 ························································································································ 3
3.1 試験環境 ······················································································································ 3
3.2 水 ······························································································································· 4
3.2.1 種別及び品質 ·············································································································· 4
3.2.2 試験方法 ···················································································································· 4
3.3 試薬 ···························································································································· 9
3.4 標準物質及び標準液 ······································································································· 9
3.5 器具 ···························································································································· 9
3.6 試験用溶液保存容器 ······································································································· 9
3.7 容器及び器具の洗浄及び保存方法 ····················································································· 10
3.8 水,試薬,容器,器具及び作業衣の滅菌並びにエンドトキシンの不活化又は除去方法 ················ 11
3.9 試料の採取方法 ············································································································ 13
3.10 採取した試料の取扱い及び試験操作時の注意 ···································································· 14
3.11 試料,試薬,容器及び器具の廃棄方法 ············································································· 14
4. 試験方法 ······················································································································· 15
4.1 一般機器分析による試験································································································· 15
4.1.1 水 ···························································································································· 15
4.1.2 標準液 ······················································································································ 15
4.1.3 判定 ························································································································· 16
4.1.4 吸光光度法による試験法 ······························································································ 16
4.1.5 電気加熱方式原子吸光法による試験法 ············································································ 16
4.1.6 冷蒸気方式原子吸光法による試験法 ··············································································· 17
4.1.7 フレーム原子吸光法による試験法 ·················································································· 17
4.1.8 誘導結合プラズマ発光分光分析法(ICP分析法)による試験法 ············································ 17
4.1.9 誘導結合プラズマ質量分析法(ICP-MS分析法)による試験法 ············································· 17
4.1.10 イオンクロマトグラフ法による試験法 ··········································································· 18
4.1.11 高速液体クロマトグラフ法による試験法 ········································································ 18
4.1.12 ガスクロマトグラフ法による試験法 ·············································································· 18
4.1.13 蛍光光度法による試験法 ····························································································· 18
4.1.14 ゾーン電気泳動法による試験法 ···················································································· 18
K 8008-1992 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
4.1.15 等電点電気泳動法による試験法 ···················································································· 19
4.1.16 液体シンチレーション計数器法による試験法 ·································································· 20
4.1.17 赤外分光光度法による試験法 ······················································································· 20
4.2 酵素活性試験 ··············································································································· 20
4.2.1 水 ···························································································································· 20
4.2.2 試薬 ························································································································· 20
4.2.3 装置及び器具 ············································································································· 21
4.2.4 試料溶液(酵素液) ···································································································· 22
4.2.5 試験方法 ··················································································································· 22
4.2.6 操作条件 ··················································································································· 22
4.2.7 操作 ························································································································· 23
4.2.8 計算 ························································································································· 23
4.2.9 判定 ························································································································· 24
4.3 エンドトキシン試験 ······································································································ 24
4.3.1 ゲル化法 ··················································································································· 24
4.3.2 比濁時間分析法 ·········································································································· 31
4.3.3 発色合成基質法 ·········································································································· 37
4.4 パイロジェン試験 ········································································································· 43
5. 容器及び荷姿 ················································································································· 44
5.1 密閉容器 ····················································································································· 44
5.2 気密容器 ····················································································································· 44
5.3 密封容器 ····················································································································· 44
6. 保存方法 ······················································································································· 44
7. 取扱い上の注意事項 ········································································································ 45
8. 表示 ····························································································································· 45
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 8008-1992
生化学試薬通則
General rules for biochemical reagents
1. 適用範囲 この規格は,生化学の試薬(1)に関する共通事項について規定する。
注(1) この規格で適用する生化学試薬は,アミノ酸,補酵素,酵素,核酸,酵素基質,生化学用緩衝
剤,糖質及びたん白質とする。
備考 この規格の引用規格を,付表1に示す。
2. 一般事項
2.1
用語の定義 この規格で用いる主な用語の定義は,JIS K 3600によるほかは,次による。
(1) 生化学試薬 一般的には,遺伝子操作,細胞融合,組織・細胞培養などのバイオテクノロジーとその
応用において生化学的又は化学的方法による物質の検出若しくは定量,物質の合成の実験又は物質の
物理的特性の測定のために使用される化学物質。
(2) エンドトキシン グラム陰性かん(桿)菌の細胞壁成分で,発熱性及びカブトガニ血球成分の凝固性
などの活性をもつもの。
(3) 滅菌 対象物に存在するすべての微生物を殺滅又は除去すること。
備考 滅菌法には,加熱法,ろ過法,照射法,ガス法及び薬液法がある。
(4) 殺菌 対象物に生存している微生物を殺滅すること。
備考 殺菌法には,加熱法,照射法,ガス法及び薬液法がある。
(5) 除菌 対象物からろ過又は洗浄によって微生物を除去すること。
(6) 酵素単位 定められた条件下で,単位時間に単位量の基質を変換する酵素量。
(7) 酵素活性 酵素の触媒作用の大きさ,すなわち,酵素の反応速度。
備考 酵素活性の大きさは,酵素単位で表される。
(8) 比活性 酵素の単位量当たりの酵素活性
(9) 酵素の失活 酵素活性を減少若しくは消失させること,又は酵素活性が減少若しくは消失すること。
備考 酵素の失活には,熱失活,酸失活などのほか,酵素阻害剤の添加・混入による失活,補助因子
の除去・消失による失活などがある。
(10) 無菌状態 増殖できる微生物が対象物に存在しない状態。
備考 無菌状態は滅菌操作によって創り出され,無菌試験法などによって試験される。
(11) 指標菌 滅菌条件の選定,滅菌効果の確認などの指標として用いられる菌。
(12)LAL 試料中に存在するエンドトキシンを,エンドトキシン試験法によって検出又は定量するために,
微量のエンドトキシンによって活性化してゲル化,又は発色合成基質を加水分解したりするカブトガ
ニの血球抽出成分を調製した凍結乾燥品。
(13) 発色合成基質(エンドトキシン試験用) 発色基を含む合成基質で,エンドトキシンを比色定量する
2
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ときに,活性化されたLAL中の凝固酵素によって加水分解され,発色基を遊離するように調製した凍
結乾燥品。
(14) パイロジェン試験 試料中に,それを投与したとき恒温動物の体温に異常上昇をもたらす物質,すな
わち,発熱性物質の有無を家と(兎)を用いて確認する試験方法。
(15) エンドトキシン試験 グラム陰性かん(桿)菌由来のエンドトキシンがLALを活性化し,ゲル化を引
き起こす反応又はそのゲル化反応カスケード中の凝固酵素のペプチド加水分解能に基づき,エンドト
キシンを検出又は定量する方法。
(16) 超ろ過法 ウイルス,マイコプラズマ,細菌・真菌などの微生物及びエンドトキシンを除去する能力
をもつ逆浸透膜若しくは限外ろ過膜又はこれらの膜を組み合わせた膜ろ過装置を用い,十字流ろ過方
式などでろ過する方法。
(17) エンドトキシンの不活化 存在するエンドトキシン活性を消失させること。
備考 不活化には,加熱法,超ろ過法,放射線照射法などがある。
(18) エンドトキシンの力価 エンドトキシン試験法によって測定したエンドトキシンの活性。
なお,各ロットのLALには1容器(1バイアル)ごとにエンドトキシン試験用水又は緩衝液の添加
量を定め,それを添加した場合の力価を1容器(1バイアル)ごとに表示する。以下,LAL表示力価
という。
2.2
名称の付け方 名称の付け方は,JIS K 8001によるほか,次のとおりとする。
(1) 酵素については,国際生化学連合(International Union of Biochemistry,略称IUB)勧告の推奨名を用
い,推奨名がない場合は最も広く使用されている慣用名を用いる。必要に応じ,系統名及び酵素番号
を付記する。
(2) たん白質などについては,原則として国際純正及び応用化学連合(International Union of Pure and
Applied Chemistry,略称IUPAC)又はIUBの命名の規定に従うものとするが,それらを適用できない
場合には関連学会などで認められ,現在最も広く使用されている慣用名を使用する。
(3) 酵素及びたん白質については,起源を明記する。
2.3
単位及び記号 単位及び記号は,SI単位を用いるほかは,次のとおりとする。
なお,必要がある場合には,個別規格で規定する。
(1) カタール (kat) 1カタール (kat) は,最適条件下で,1秒間に1molの基質を変換する酵素量。
備考 μkat,nkat又はpkatを用いることもできる。比活性は,kat/kgたん白質で示され,従来の酵素
単位のユニット (U) との関係は,1kat=6×107Uである。
参考 カタール (kat) は,国際生化学連合・酵素委員会の第3回(1972年)勧告で定義された新しい
酵素単位。
(2) ユニット (U) 1ユニット (U) は,最適条件下で,1分間に1μmolの基質を変換する酵素量。
備考 比活性は,U/mgたん白質で示され,新しい酵素単位のカタール (kat) との関係は,1U=16.67nkat
である。
参考 ユニット (U) は,国際生化学連合・酵素委員会の第1回(1961年)報告で定義された従来の
酵素単位。
(3) エンドトキシン単位 (EU) エンドトキシン単位 (EU) は,US Standard Endotoxin(E. coli 0113株)lot
EC-2の0.2ngに含まれるエンドトキシン力価を示す単位。エンドトキシン0.2ng=1EUである(2)。
注(2) 日本のエンドトキシン標準品はlot EC-5を基準とし,第十二改正日本薬局方エンドトキシン試験
法によってそのエンドトキシン単位 (EU) を定めている。
3
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3. 共通事項 共通事項は,JIS K 0050及びJIS K 8001によるほか,次のとおりとする。
3.1
試験環境 試験環境は,個別規格で規定のないときは,JIS Z 8703に規定する標準状態とするほか,
必要に応じて次の設備を用いて試験を行う。
(1) クリーンルーム クリーンルームは,JIS B 9920によって浮遊微粒子数を測定したとき,粒径0.5μm
以上の粒子数が3 500 000個/m3以下(3)のものとする。
注(3) JIS B 9920に規定する清浄度クラス8又はそれより清浄度の高いクラスに相当する。
(2) クリーンベンチ クリーンベンチは,JIS B 9922に規定するクリーンベンチとする。
備考 クリーンベンチは,必要に応じてエアカーテンを備えたものを用いる。
(3) バイオクリーンルーム バイオクリーンルームは,JIS B 9920によって浮遊微粒子数を測定したとき,
粒径0.5μm以上の粒子数が3 500個/m3以下(4)のもの。
注(4) JIS B 9920に規定する清浄度クラス5又はそれより清浄度の高いクラスに相当する。室内に送ら
れる空気流は,周囲の気圧に対して陽圧であること。
(4) 安全キャビネット 安全キャビネットは,実験操作中に発生するエーロゾルが外部に漏出しないもの
とする。
備考 安全キャビネットは,P2レベル(5)又はLS-1レベル(6)以上の物理的封じ込めを必要とする組換
えDNA実験又は危険度3a(7)以上の病原体を取り扱う実験に用いる。ただし,エーロゾルの発
生のおそれのある実験の場合は,危険度2b(8)の病原体を取り扱う実験においても用いる。
注(5) P2レベルとは,“組換えDNA実験指針”(昭和54年8月27日内閣総理大臣決定。昭和62年9月16
日最終改訂。以下,組換えDNA実験指針という。)において,20l以下の規模で行う組換えDNA
実験に対して,組換え体の処理において発生するエーロゾルを外部に漏れないように収容する
安全キャビネットを設置するか,又はそれに相当する封じ込め機能のある機器を使用する必要
があり,汚染物及び廃棄物の消毒のための高圧蒸気滅菌器を備えた建物内に実験室を置くこと
が要求されているほか,実験の進行中はP2レベル実験中の表示を実験室の入口に掲げることな
どの実験実施要項が定められている物理的封じ込めのレベルをいう。
(6) LS-1レベルとは,“組換えDNA実験指針”において,20lを超える組換え体の大量培養実験に
対して,組換え体の外部への漏出が防止できるように設計され,かつ,閉じた状態のままで内
部の滅菌操作を行うことができる培養装置を設置し,組換え体の処理において発生するエーロ
ゾルを外部に漏れないように収容する安全キャビネットを設置するか,又はそれに相当する封
じ込め機能のある機器を使用する必要があり,培養装置の排気ガスは除菌フィルター又はそれ
に相当する効果のある除菌用機器を通してだけ排出される設計とすることなどが要求されてい
るほか,大量培養実験区域を明確に設定し,実験の進行中はLS-1レベル大量培養実験中の表示
を大量培養実験区域に掲げることなどの実験実施要項が定められている物理的封じ込めのレベ
ルをいう。
(7) 危険度3aの病原体とは,“国立予防衛生研究所病原体等安全管理規程”(昭和50年11月5日国
立予防衛生研究所決定。昭和58年3月24日改正。以下,病原体等安全管理規程という。)にお
ける“病原体等の危険度分類基準”において規定されており,次の条件のいずれかに該当する
病原体などと定められている。
(1) 実験室感染の機会は比較的多いが,感染した場合も軽症にとどまるもの。
(2) 日本国内に常在して,成人の多くには免疫があるため,実験室感染の可能性は少ないが,感
染した場合,重症になる可能性のあるもの。

4
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(8) 危険度2bの病原体とは,“病原体等安全管理規程”における“病原体等の危険度分類基準”に
おいて規定されており,通常の微生物学的操作手順で実験室感染を防ぐことがおおむね可能で
あり,仮に感染しても,発病の可能性が非常に少ない病原体などをいう。
(5) 放射線施設 放射線施設は,放射性同位元素及び放射性同位元素によって汚染されたもの(以下,放
射性同位元素等という。)又は放射線発生装置を取り扱う場合に,放射線障害の発生を防止するように
設計されたものとする。
参考 “放射性同位元素等による放射線障害の防止に関する法律”(以下,放射線障害防止法という。)
において,放射線施設とは使用施設,詰替施設,廃棄物詰替施設,貯蔵施設,機器設置施設,
廃棄物貯蔵施設又は廃棄施設をいう。
3.2
水 水は,個別規格又は4.3に規定するもののほかは,次のとおりとする。
3.2.1
種別及び品質 水の種別をA1〜A4に分類し,その品質を表1のように規定する。
表1 化学分析用の水の品質
項目
種別
A1
A2
A3
A4
電気伝導率 (mS/m) (25℃)
0.5以下
0.1(9)(10)以下
0.1(9)以下
0.1(9)以下
有機体炭素 (TOC) (mgC/l)
1 以下
0.5以下
0.2以下
0.05以下
亜鉛 (μgZn/l)
0.5以下
0.5以下
0.1以下
0.1 以下
シリカ (μgSiO2/l)
50 以下
5.0以下
2.5 以下
塩化物イオン (μgCl−/l)
10 以下
2 以下
1 以下
1
以下
硫酸イオン (μgSO42−/l)
10 以下
2 以下
1 以下
1
以下
過マンガン酸カリウムによる試験 (ml) (11)
0.5以下
0.3以下
0.2 以下
注(9) 水精製装置の出口水を,電気伝導率計の検出部に直接導入して測定したときの値。
(10) イオン交換装置の出口に精密ろ過器などのろ過器を直接接続した場合には,0.01mS/m (25℃) 以下
になる。
(11) 水100mlをとり硫酸酸性とし5mmol/l過マンガン酸カリウム溶液の一定量を加えて30分間加熱し
たときに消費された5mmol/l過マンガン酸カリウム溶液の量 (ml) 。
備考 表1に示した各種別の水の品質の項目は,水の品質を表す代表的な項目として選択したものであ
る。化学分析の種類及び目的に応じて,これ以外の項目を追加又は項目を省略してもよい。表1
に規定された項目の省略及び規定されていない項目の追加は,個別規格の試験方法による。
A1は,器具類の洗浄などに用いる。水の精製の最終工程でイオン交換法によって精製したもの,
又はこれと同等の品質が得られる方法で精製したもの。
A2は,一般の化学分析などに用いる。通常,水A1を用いて水の精製の最終工程でイオン交換
法(出口に精密ろ過器などを接続する。)によって精製したもの,又はこれと同等の品質が得られ
る方法で精製したもの。
A3は,試薬溶液類の調製,微量成分の化学分析などに用いる。通常,水A1又はA2を用いて
水の精製の最終工程で蒸留法によって精製したもの,又はこれと同等の品質が得られる方法で精
製したもの。
A4は,有機物の試験,微量成分の化学分析などに用いる。通常,水A1又はA2を用いて水の
精製の最終工程で酸化剤を共存させた蒸留法で精製したもの,又はこれと同等の品質が得られる
方法で精製したもの。
3.2.2
試験方法
(1) 共通事項
(1.1) 試薬 試薬は,3.3のとおりとする。
(1.2) 水 試薬の調製及び試験に用いる水は特に規定のない場合は,水A3又はA4を用いる。
(1.3) 試液及び標準液 試液及び標準液は,JIS K 8001によるほかは,次のとおりとする。
なお,調製において溶液の名称の後に括弧内で濃度を示す場合は,概略の濃度である。
5
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(1.4) 結果の表示 同一の試験項目に対して試験方法が二種類以上ある場合は,用いた試験方法を表示す
る。
(2) 電気伝導率 (μS/cm) (25℃) 電気伝導率の試験は,JIS K 0552による。
(2.1) 連続測定法による試験 連続測定法による試験は,JIS K 0552の5.2(連続測定法)によるほかは,
次のとおりとする。
導管,継ぎ手,バルブなどは,あらかじめ試料を十分に流して洗った後接続し,流量と温度を調
節して,流液形の検出器に直接導入する。
なお,必要に応じて熱交換器又は恒温槽を検出器の前に置く。
また,流量を変えても温度及び電気伝導度が変化しないことを確認する。
(2.2) 間欠測定法による場合 採取した試料又は容器に入れられた水A4の試験の試料(水A2〜A4の試
験には用いない。)は,次の事項によるほかは,JIS K 0552の5.1(間欠測定法)によって試料を採
取した後直ちに行う。
(2.2.1) 試料容器 試料容器は,硬質ガラス製,ポリエチレン製及びポリプロピレン製を用いる。
(2.2.2) 試料容器の洗浄 試料容器の洗浄は,3.7による。この場合,すすぎ洗いに替えて次の洗浄を行う。
試料容器の容量の41量の水A1を入れ,30秒間激しく振り混ぜる。この操作を5回繰り返した後,
水A3又は試験しようとする水の品質規格と同等の品質の水を満杯にして,16時間放置した後水を
捨て,更に試料採取時までA3又は試験しようとする水の品質規格と同等の品質の水を満杯にして,
クリーンベンチ又はクリーンルーム若しくはそれと同等以上の清浄な場所で保管する。
(2.2.3) 試料採取 試料採取は,皮膚からの汚染を避けるため試験しようとする水の品質規格と同等又はそ
れ以上の水で十分に洗浄した手術用の手袋を着用した手でクリーンベンチ又はクリーンルーム若し
くはそれと同等以上の清浄な場所で作業を次のとおり行う。
(a) 水精製装置の出口配管に,あらかじめ十分に水A1で洗浄した軟質合成樹脂製の試料導入管を取り
付ける。
(b) 試料容器に充てんした水を捨て,試験しようとする水を満杯にして16時間放置する。
(c) 試料容器の底部に試料導入管の先端が接するようにした後,試料容器の5倍量の試料を流出させ,
その後連続して流出する試料を試料容器に満杯となるまで入れ測定用の試料とする。
(d) 試料導入管を取り除く。
なお,取り除いた試料導入管はよく洗浄した栓で密栓して清浄な場所に保管する。
(3) 有機体炭素 (TOC) 有機体炭素 (TOC) の試験は,JIS K 0551によるほかは,次のとおりとする。
(3.1) TOC自動計測器による試験 水精製装置の出口水を4.1.1によってTOC自動計測器に導入し,JIS K
0551の5.1(燃焼酸化−赤外線式TOC自動計測法)又は5.3(紫外線酸化−赤外線式TOC自動計測
法)によって試験する。
なお,この試験の検量線の作成に用いる水は,JIS K 0551の5.1(2)(a)に規定するもの,又はこれ
と同等の品質のものを用いる。
(3.2) TOC分析装置による試験
(3.2.1) 試料容器 試料容器は,硬質ガラス製又は四ふっ化エチレン樹脂製などの気密容器を用いる。
(3.2.2) 試料容器の洗浄方法 試料容器の洗浄は,次のとおり行う。
(a) 硝酸 (0.2mol/l) [JIS K 8541に規定する硝酸(更に高品質の硝酸を用いてもよい。)と水A1を用い
て調製する。]で洗い,水A1で十分に洗う。
(b) 試料容器の容量の約41量の水A1を入れ,約30秒間激しく振り混ぜて洗浄する。この操作を5回繰
6
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
り返す。
(c) 水A3(又は試験しようとする水と同等の水)を満杯にして16時間以上放置した後,水を捨てる。
(d) (c)と同じ水を満杯にして試料採取時まで放置する。
(3.2.3) 試料採取 試料採取は,次のとおり行う。
(a) 試料容器の水を捨て,試験しようとする水で(3.2.2)(b)の操作を行う。
(b) 試料容器に(2.2.3)によって試料を採取する。この場合,精製後直ちに試験を行う試料は,水精製装
置の出口水をとる。
備考 水精製装置の処理容量が大きい場合には,以下の方法で試料を採取してもよい。
水精製装置の出口配管に試料採取弁を取り付け,試料採取弁の先端に試料導入管(例え
ば,軟質のプラスチック製のもの。)を取り付け,試料を約5l/minの割合で約5分間放流
する。主管路から採取弁までの距離が長い場合には,主管路から採取弁までの滞留水が完
全に置換されるまで放流してから,引き続き約5分間放流する。
また,採取弁を全開しても約5l/minの流量が得られない場合には,約25l流出させる(常時
約1l/minの割合で採取弁から流出しておくことが望ましい。)。引き続き約1l/minの割合で約30
分間放流した後(3.2.2)(a)〜(d)の操作を行った試料容器に試験しようとする水を容器の約41量を
入れて激しく振り混ぜて洗浄(5回繰り返す。)する。次に,試料容器の底面に導入管の先端が
接するようにして容器の容量の約5倍量の試料を流出させた後,導入管を抜き出す。栓を試料
で十分に洗浄した後,密栓する。
(3.2.4) 試験 試験は,次のとおり行う。
(a) JIS K 0551の5.2(燃焼酸化−赤外線式TOC分析法)又は5.4(紫外線酸化−赤外線式TOC分析法)
によって試験する。
なお,この試験の検量線の作成に用いる水は,JIS K 0551の5.1(2)(a)に規定するもの,又はこれ
と同等の品質のものを用いる。
(4) 亜鉛 亜鉛の試験は,JIS K 0553による。
(4.1) 試料容器 試料容器は,石英ガラス製,ポリエチレン製及びポリプロピレン製の気密容器を用いる。
(4.2) 試料容器の洗浄方法 試料容器の洗浄は,3.7による。
(4.3) 試料採取 試料採取は,(2.2.3)による。この場合,精製後直ちに試験を行う試料は,水精製装置の
出口水をとる。
(4.4) 試験 試験は,次のとおり行う。
(a) JIS K 0553の5.7(亜鉛)に従って試験する。
備考 金属元素を試験する場合には,試料採取操作で試料が汚染されないように,最大限の注意
を払わなければならない。そのためには,使用する器具の材質,形状,寸法及び洗浄方法,
試薬中の不純物,試験環境中の粉じんなどに留意し,操作時には大気との接触をできるだ
け少なくする必要がある。
(5) シリカ シリカの試験は,JIS K 0555による。
(5.1) 試料容器 試料容器は,ポリエチレン製,ポリプロピレン製などの合成樹脂製の気密容器を用いる。
(5.2) 試料容器の洗浄方法 3.7による。
(5.3) 試料採取 試料採取は,(2.2.3)による。この場合,精製後直ちに試験を行う試料は,水精製装置の
出口水をとる。
備考 (3.2.3)の備考による。
7
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(5.4) 試験 試験は,次のとおり行う。
(a) JIS K 0555によって試験する。
(6) 塩化物イオン 塩化物イオンの試験は,JIS K 0556による。
(6.1) 試料容器 試料容器は,硬質ガラス製,ポリエチレン製,ポリプロピレン製などの気密容器を用い
る。
(6.2) 試料容器の洗浄方法 3.7による。
(6.3) 試料採取 試料採取は,(2.2.3)による。この場合,精製後直ちに試験を行う試料は,水精製装置の
出口水をとる。
備考 (3.2.3)の備考による。
(6.4) 試験 試験は,次のとおり行う。
(a) JIS K 0556に規定する5.1(塩化物イオン)によって試験(12)する。
注(12) JIS K 0556に規定したイオンクロマトグラフのほかに1μgCl−/lの定量が可能なイオンクロ
マトグラフを用いてもよい。
(7) 硫酸イオン 硫酸イオンの試験は,JIS K 0556による。
(7.1) 試料容器 試料容器は,(6.1)による。
(7.2) 試料容器の洗浄方法 試料容器の洗浄方法は,3.7による。
(7.3) 試料採取 試料採取は,(2.2.3)による。この場合,精製後直ちに試験を行う試料は,水精製装置の
出口水をとる。
備考 (3.2.3)の備考による。
(7.4) 試験 試験は,次のとおり行う。
(a) JIS K 0556に規定する5.6(硫酸イオン)によって試験(13)する。
注(13) JIS K 0556に規定したイオンクロマトグラフのほかに2μgSO42−/lの定量が可能なイオンク
ロマトグラフを用いてもよい。
(8) 過マンガン酸カリウムによる試験 水を硫酸酸性とし,酸化剤として5mmol/l過マンガン酸カリウム
溶液の一定量を加え,沸騰水浴中で一定時間反応させ,そのとき消費した過マンガン酸カリウムの量
を求め,5mmol/l過マンガン酸カリウム溶液の量 (ml) で表す。この試験は,試料採取後直ちに行う。
(8.1) 試料容器 試料容器は,(6.1)による。
(8.2) 試料容器の洗浄方法 試料容器の洗浄方法は,3.7による。
(8.3) 試料採取 試料採取は,(2.2.3)による。
備考 (3.2.3)の備考による。
(8.4) 試験 試験は,次のとおり行う。
(8.4.1) 水及び試薬溶液 水及び試薬溶液は,次のとおりとする。
(a) 水 水A2又はA3を蒸留(14)する。
(b) 硫酸 (1+2) 水100mlにJIS K 8951に規定する硫酸50mlをかき混ぜながら徐々に加えた後,薄い
紅色になるまで過マンガン酸カリウム溶液 (3g/l %) を加える。
(c) 硝酸銀溶液 (200g/l) JIS K 8550に規定する硝酸銀20gを全量フラスコ100mlにはかりとり,水
20mlを加えて溶かし,水を標線まで加えて振り混ぜ,褐色ガラス瓶に入れて保存する。
(d) 5mmol/l過マンガン酸カリウム溶液 JIS K 8001の4.5(7)に規定する20mmol/l過マンガン酸カリウ
ム溶液250mlを全量ピペット250mlを用いてはかりとり,全量フラスコ1 000mlに入れ,水を標線
まで加えて振り混ぜる。
8
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
なお,標定は,JIS K 8005に規定するしゅう酸ナトリウムをあらかじめ200℃で約1時間加熱し,
デシケーター中で放冷する。その約0.42gを1mgのけたまではかりとり,水20mlに溶かして全量
フラスコ250mlに移し入れ,水を標線まで加えて振り混ぜる。この溶液25mlを全量ピペット25ml
を用いて三角フラスコ300mlにはかりとり,水で約100mlとし,硫酸 (1+2) 10mlを加える。液温
25〜30℃で,ビュレット25mlを用いて調製した5mmol/l過マンガン酸カリウム溶液22mlを一度に
加え,紅色が消えるまで放置する。
脱色後55〜60℃に加熱し,調製した5mmol/l過マンガン酸カリウム溶液で滴定する。終点は微紅
色を約30秒間保つときとする。
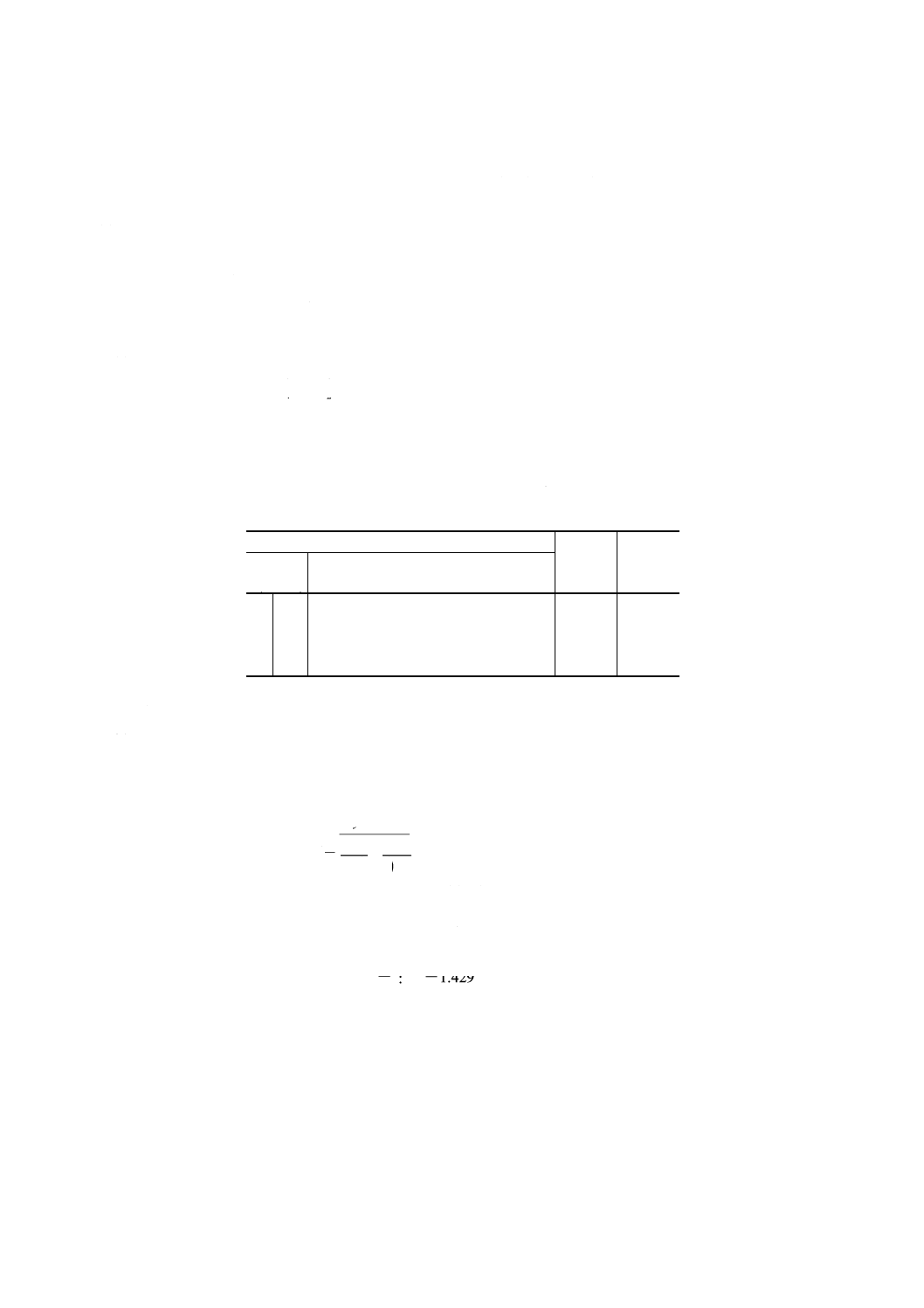
次の式によって5mmol/l過マンガン酸カリウム溶液のファクター (f ) を算出する。
675
0.001
1
100
250
25
×
×
×
×
x
b
a
f=
ここに,
a: しゅう酸ナトリウムの量 (g)
b: しゅう酸ナトリウムの純度 (%)
x: 滴定に要した5mmol/l過マンガン酸カリウム溶液 (ml)
0.001 675: 5mmol/l過マンガン酸カリウム溶液1mlのしゅう酸ナト
リウム相当量 (g)
(e) しゅう酸ナトリウム溶液 (12.5mmol/l) JIS K 8528に規定するしゅう酸ナトリウム1.8gを0.1mg
のけたまではかりとり,水200mlを加えて溶かし,全量フラスコ1 000mlに移し入れ,水を標線ま
で加えて振り混ぜる。
注(14) 過マンガン酸カリウム溶液 (3g/l) を加えて着色させ(蒸留後まで着色していること。),(b)
の硫酸 (1+2) を加えて微酸性とした後蒸留する。
(8.4.2) 器具 器具は,次のとおりとする。
(a) 水浴 試料を入れたとき,引き続いて沸騰状態を保てるような,熱容量及び加熱能力をもつもの。
(8.4.3) 操作 操作は,次のとおり行う。
(a) 全量ピペット100mlを用いて試料100mlをはかりとり,三角フラスコ300mlに入れ,硝酸銀溶液
(200g/l) 5mlと硫酸 (1+2) 10mlとを加える。
(b) 全量ピペット10mlを用いて5mmol/l過マンガン酸カリウム溶液10mlを加えて振り混ぜ,直ちに沸
騰水浴中に入れ,30分間加熱する。このとき,フラスコ中の試料の液面は沸騰水浴中の水面下で,
三角フラスコが水浴の底に直接接触しないように保つ。
(c) 全量ピペット10mlを用いてしゅう酸ナトリウム溶液 (12.5mmol/l) 10mlをはかりとり,(b)で30分
間加熱した5mmol/l過マンガン酸カリウム溶液に加えて振り混ぜ,よく反応させる。
(d) 液温を55〜60℃に保ち,5mmol/l過マンガン酸カリウム溶液で滴定する。終点は微紅色を約30秒間
保つときとする。
(e) 別に,対照試験として,全量ピペット100mlを用いて水[(a)の水]100mlをはかりとり,三角フラ
スコ300mlに入れ,全量ピペット5ml及び10mlを用いて硝酸銀溶液 (200g/l) 5ml,硫酸 (1+2) 10ml
及び5mmol/l過マンガン酸カリウム溶液10mlそれぞれはかりとり,それらを加えて振り混ぜる。
(f) 更に全量ピペット10mlを用いてしゅう酸ナトりウム溶液 (12.5mmol/l) 10mlをはかりとり,それを
加えて振り混ぜ,液温を55〜60℃に保ち,5mmol/l過マンガン酸カリウム溶液で滴定する。終点は
微紅色を約30秒間保つときとする。
(g) 次の式によって試料100ml当たりの過マンガン酸カリウム消費量を5mmol/l過マンガン酸カリウム
溶液のml数から算出する。
9
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
M= (a−b) ×f
ここに, M: 5mmol/l過マンガン酸カリウム溶液の消費量 (ml)
a: (d)の滴定に要した5mmol/l過マンガン酸カリウム溶液 (ml)
b: (f)の滴定に要した5mmol/l過マンガン酸カリウム溶液 (ml)
f: 5mmol/l過マンガン酸カリウム溶液のファクター
3.3
試薬 試薬は,JISマーク表示品の最上級品又はこれと同等以上の品位のものを用いる。
なお,JISマーク表示品がない場合には,4.又は個別規格に規定するものを用いる。
3.4
標準物質及び標準液 標準物質及び標準液は,4.又は個別規格に規定する。
3.5
器具 器具は,個別規格に規定するもののほかは,次のとおりとする。
(1) ガラス器具 ガラス器具は,硬質1級のものを用いる。
なお,ガラスの成分であるナトリウム,カリウム,ほう素,けい酸,アルミニウムなどが溶出する
こともあるので注意をする。
また,すり合せ部分をもつガラス器具は,すり合せ部分に汚れが付着しやすいので,透明ずりのも
のとする。
(2) 石英器具 石英器具は,透明石英製のもので,すり合せ部分をもつ石英器具はすり合せ部分に汚れが
付着しやすいので透明ずりのものとする。
(3) 合成樹脂器具 合成樹脂器具は,着色剤及び充てん剤などを添加していない四ふっ化エチレン樹脂(15),
ポリエチレン樹脂(16),ポリプロピレン樹脂(17)及び難燃剤を添加していないアクリル樹脂(18)を用いる。
注(15) 鉄,ニッケル,銅,亜鉛などの重金属がわずかに溶出することがある。
また,成型時混入した異物を含むことがあるので,使用目的によって注意する。
(16) 高密度ポリエチレン製のもので,鉄,クロム,チタンなどの重金属がわずかに溶出することが
あるので,高濃度の硝酸を使用する試験には用いない。
(17) 鉄,チタンなどの重金属がわずかに溶出することがあるので,高濃度の硝酸を使用する試験に
は用いない。
(18) 塩酸を使用する試験には用いない。
(4) 白金器具 白金器具は,JIS H 6201,JIS H 6202及びJIS H 6203に規定されているもので,合金成分
又は不純物としてパラジウム,ロジウム,ルテニウム,イリジウム,金,銀,銅,鉄などを含むため.
試験に支障のないことを確認して用いる。
3.6
試験用溶液保存容器 試験用溶液保存容器は,試料を異物,湿気,大気,光線などの外因から遮断
又は吸収し保護できるもので,その材質及び形態は,次のとおりとする。
(1) 材質 試験用容器の材質は,個別規格に規定するもののほかは,次のとおりとする。
(a) ガラス ガラスは,硬質1級のものを用いる。遮光する場合は,マンガン,鉄などを混合した着色
ガラスを用いる。特殊用途としては,ほうけい酸低アルカリガラス(耐熱ガラス)又は石英ガラス
を用いることもできる。
備考 ガラス容器は,耐薬品性透視性に優れている反面,破損しやすく,強アルカリ及びふっ化
物には耐性が低い欠点がある。
(b) 合成樹脂 四ふっ化エチレン(19),ポリエチレン(20),ポリプロピレン(21),アクリル(22)などの樹脂を
用いる。
注(19) 酸・アルカリ・有機溶媒のいずれにも耐性で合成樹脂中最も耐薬品性に優れている。
(20) 強酸又は有機溶媒を含む試料には適さない。
10
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
また,通気性があるために,酸化されやすいもの及び吸湿性のあるものには適さない。
(21) 一部の有機溶媒を除き,耐薬品性に優れているとともに耐熱性にも優れている。しかし,
ポリエチレンと同じように通気性がある。
(22) 耐薬品性は他の樹脂に比べて劣る。
備考 ガラス容器に比べて軽量で破損しにくい利点があるが,透視性や硬度に欠け,器壁損傷に
よる異物侵入のおそれがあり,更に,可塑性や帯電防止剤の溶出の可能性もある。
また,耐薬品性や通気性に差があり,目的によって使い分ける必要がある。
(2) 容器の種類 容器の種類は,次のとおりとする。
(a) バイアル瓶 バイアル瓶は,通常の状態で保管する間に,気体又は微生物の侵入するおそれのない
硬質1級ガラス容器で,耐薬品性のゴム栓とキャップシールによって,密封して用いる。
備考 ワクチン,抗血清,抗体などの無菌保存などの用途がある。
(b) ガラス瓶 ガラス瓶は,通常の状態で保存する間に,液体又は固体の異物の侵入を防ぎ,内容物を
保護することができる有栓形容器で,ガラスを用いる。遮光する場合は,マンガン,鉄などを混合
した褐色瓶を用いる。パッキングの材質は,四ふっ化エチレン樹脂シート又は内容物と反応しない
ものとし,ふたは,ねじ形とし材質は硬質ポリプロピレン又はメラミンとする。
(c) 合成樹脂瓶 合成樹脂瓶は,ガラス瓶とほぼ同じように内容物を保護することができる有栓形容器
とする。
備考 材質によって耐薬品性,通気性に差があり,また,溶液成分を吸着するものがあることか
ら,必要に応じて前処理をすることがあり,目的によって使い分けをする。
(d) アンプル アンプルは,通常の保存状態で,気体又は微生物の侵入するおそれのない容器とする。
備考 発煙性の強いもの,空気酸化しやすいもの,及び加熱殺菌の必要があるものなど,瓶類で
は適用できない試験に用いる。
3.7
容器及び器具の洗浄及び保存方法 容器及び器具の洗浄と保存は,4.又は個別規格で規定するものの
ほかは,次のとおりとし,必要があれば使用直前に3.2に規定する水のうち,試験目的によって選定した
ものを用いて洗浄する。
なお,必要な場合は,乾燥,滅菌,エンドトキシンの不活化などの処理をする。
備考 乾燥器で乾燥する場合は,気流の循環によって汚染されることがあるので,試験に支障がない
ことを確認して用いる。
(1) ガラス器具及び石英ガラス器具の洗浄 ガラス器具及び石英ガラス器具は,水道水で十分洗浄した後,
50〜60℃に加熱した硝酸 (1+1) で更に洗浄し,3.2に規定する水A2〜A4のうち,試験目的によって
選定した水で十分にすすぎ洗いをする。
なお,新しい器具は,非イオン性界面活性剤と水道水,3.2に規定する水のうち,試験目的によって
選定した水,アセトンの順で洗浄を行う。
(2) 合成樹脂器具の洗浄 合成樹脂器具は,ポリエチレン製の容器に入れた硝酸 (1+3) に合成樹脂器具
を2時間以上浸した後,更に1時間以上超音波洗浄した後,3.2に規定する水のうち,試験目的によっ
て選定した水を用いて十分にすすぎ洗いをする。
(3) 白金器具の洗浄 白金器具は,80℃以上の硝酸 (1+3) に約1時間浸し,3.2に規定する水のうち,試
験目的によって選定した水ですすぎ洗いをする。
なお,前に使用した試料による汚染が認められた場合には,JIS K 8783に規定する二硫酸カリウム
又はJIS K 8972に規定する硫酸水素カリウムを溶融して汚染物質を取り除いた後,洗浄する。
11
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(4) 試験用容器及びふたの洗浄 試験用容器及びそのふたは,水道水と洗浄剤で洗い,更に硝酸 (1+3) に
約12時間以上浸した後,3.2に規定する水A1又はA2で洗浄し,次に塩酸 (1+1) で洗った後,3.2
に規定する水のうち,試験目的によって選定した水で更に洗浄する。
なお,エンドトキシン試験に用いる場合は,3.2に規定する水の代わりに4.3.1(1)(a)を用いる。
また,アルミニウム製のふたの洗浄には酸類を用いない。
(5) 保存 保存する場合は,乾燥し,ふたのあるものは密栓して汚染のおそれがない場所に保存する。
3.8
水,試薬,容器,器具及び作業衣の滅菌並びにエンドトキシンの不活化又は除去方法 水,試薬,
容器,器具及び作業衣の滅菌並びにエンドトキシンの不活化又は除去方法は,個別規格で規定するほかは,
次のとおりとする。
(1) 水,試薬,容器,器具及び作業衣の滅菌方法 水,試薬,容器,器具及び作業衣の滅菌は,それぞれ
の性質及び状態に応じて操作法及び操作条件の適性化を検討し(23),表2のうち適切な滅菌方法を選択
して単独又は併用して行う。高圧蒸気法で行う場合は,JIS K 3605に従う。
注(23) 操作法及び操作条件の検討には,それぞれの滅菌方法に適した指標菌を用いることができる。
指標菌としては,対象とする滅菌法に適合する菌種を用いる。すなわち,その滅菌法に対して
最も抵抗性の強い菌であって,その性質が保存期間中に変異しない安定な菌株を指標菌とする。
各種滅菌法に対して一般に用いられている指標菌は,表3のとおりである。
12
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表2 各種滅菌法
方法
対象
操作条件
加熱法 火炎法
主としてガラス製,磁製,金属製の物品などで,
火炎によって破損しないもの
通常,火災中で数秒間以上加熱する。
乾熱法
主としてガラス製,磁製,金属製,繊維製の物
品,鉱油,脂肪,脂肪油,固形の試薬などで,
乾熱に耐えるもの
通常,
135〜145℃,3
〜5時間
160〜170℃,2
〜4時間
180〜200℃,0.5 〜1時間
高圧蒸気法 主としてガラス製,磁製,金属製,ゴム製,紙
製,繊維製の物品,水,培地,固形,液状の試
薬などで,高圧蒸気に耐えるもの
通常,
115℃,30分間
121℃,20分間
126℃,15分間
流通蒸気法 主としてガラス製,磁製,金属製,ゴム製,繊
維製の物品,水,培地,固形,液状の試薬など
で,乾熱法又は高圧蒸気法によって変質するお
それがあるもの
通常,100℃の流通水蒸気中で30〜60分間
行う。
煮沸法
主としてガラス製,磁製,金属製,ゴム製,繊
維製の物品,培地,固形,液状の試薬などで,
乾熱法又は高圧蒸気法によって変質するおそ
れがあるもの
通常,沸騰水中に沈め,15分間以上煮沸す
る。
間欠法
主としてゴム製の物品,培地,固形,液状の試
薬などで,乾熱法又は高圧蒸気法によって変質
するおそれがあるもの
通常,80〜100℃の水中又は流通水蒸気中
で、1日1回,30〜60分間ずつ,3〜5回加
熱を繰り返す。加熱の休止中は,20℃以上
の微生物の発育に適当な温度に保つ。
ろ過法
主として気体,水,熱に不安定な培地,固形,
液状の試薬などで,加熱法によって変質するお
それがあるもの
通常,メンブランフィルター,磁製フィル
ターなどを用いる。
照射法 放射線法
主としてガラス製,磁製,金属製,ゴム製,プ
ラスチック製,繊維製の物品などで,放射線照
射に耐えるもの
通常,60Co又は137Csなどを含む放射線源
を用いる。
紫外線法
主としてガラス製,金属製,ゴム製,プラスチ
ック製,繊維製の比較的平滑な物品の表面,施
設,設備,水,固形,液状の試薬などで,紫外
線照射に耐えるもの
通常,254nm付近の波長の紫外線を用いる。
高周波法
主として水,培地,固形,液状の試薬などで,
高周波照射に耐えるもの
通常,915MHz又は2450MHzの高周波を用
いる。
ガス法
主としてガラス製,磁製,金属製,ゴム製,プ
ラスチック製,繊維製の物品,施設,設備,粉
末状の試薬などで,用いるガスによって変質し
ないもの
通常,酸化エチレン,ホルムアルデヒドな
どのガスを用いる。主としてガス滅菌器を
用いる。
薬液法
主としてガラス製,磁製,金属製,ゴム製,プ
ラスチック製,繊維製の物品,手指,無菌箱,
無菌施設などで,用いる薬液によって変質しな
いもの
通常,0.2〜1g/l塩化ベンザルコニウム液,
消毒用エタノール,フェノール水,クレゾ
ール水,ホルムアルデヒド水溶液などを用
いる。

13
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表3 各種指標菌
滅菌法
指標菌
高圧蒸気法 Bacillus stearothermophilus ATCC 7953
Clostridium tetani (non-toxigenic strain) NCTC 5411
乾熱法
Bacillus stearothermophilus
Bacillus subtilis var. niger ATCC 9372
ろ過法
Serratia marcescens
Pseudomonas diminuta ATCC 19146
放射線法
Bacillus sphaericus C1−A
Bacillus pumilus E-601
Streptococcus jaecium A2-1
ガス法
Bacillus subtilis var. globigii NCTC 10073
(Bacillus subtilis var. niger)
備考 ATCC:American Type Culture Collection
NCTC:National Collection of Type Cultures
参考1. 第十二改正日本薬局方において,各種滅菌方法とそれぞれの操作条件及び操作方法が規定さ
れている。表2の各種滅菌法は,第十二改正日本薬局方による。
2. 滅菌の適否は,通常,無菌試験法によって判定する。
なお,第十二改正日本薬局方において,無菌試験法が規定されている。
3. 表3の各種指標菌は,第十二改正日本薬局方による。
(2) エンドトキシンの不活化又は除去方法 エンドトキシン試験に用いるガラス製,金属製などの乾熱に
耐える器具,容器などは250℃以上で90分間加熱し,ゴム製,プラスチック製など放射線照射に耐え
るものは放射線法を用いてエンドトキシンを不活化する。エンドトキシンの含有量が微量の場合で,
水,溶液などで250℃に加熱できないものは121℃で1時間,JIS T 7322又はJIS T 7324に規定する高
圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて処理する。
また,気体,水,ろ過できる培地,水又は溶剤に溶解できる固体,液体の試薬などで,加熱によっ
て変質するおそれがあるものは超ろ過法などを用い,蒸留温度で変質しないものは超ろ過法と蒸留法
とを併用してエンドトキシンを除去する。
備考 エンドトキシンの不活化及び除去方法の適否は,4.3の各試験方法のいずれかによって判定する。
3.9
試料の採取方法 試料の採取方法は,個別規格に規定するもののほかは,次のとおりとする。
(1) 一般的採取方法 試料の採取には,洗浄,乾燥した清浄な容器及び器具を用い,清浄な試験環境下で
行う。採取する試料量は,なるべく全体を代表する最小の量とする。
(2) 不安定な試料の採取方法 不安定な試料の取扱いには,その分解又は変質に十分注意し,操作をなる
べく速やかに行う。
参考 10℃以下の低温で操作することが多い。
(3) 無菌的採取方法 無菌的取扱いを必要とする場合は,3.8(1)によって滅菌した容器及び器具を用い,バ
イオクリーンルーム又はこれと同等以上の清浄な試験環境下で,なるべく速やかに操作する。
(4) エンドトキシン試験用試料の採取方法 3.8(2)によってエンドトキシンの不活化を行った容器及び器
具を用いる。
(5) 組換えDNA実験試料又は病原体試料の採取方法 P2レベル(5)又はLS-1レベル(6)以上の物理的封じ込
めを必要とする組換えDNA実験試料又は危険度3a(7)以上の病原体試料を採取する場合は,エーロゾ
ルが外部に漏出しない設計が施された機器を用いるか,又は安全キャビネットの中で採取し,発生す
14
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る汚染エーロゾルが外部に漏出しないように操作する。ただし,エーロゾルの発生のおそれがある場
合は,危険度2b(8)の病原体試料も危険度3a(7)以上の病原体試料と同様に操作する。
(6) 放射性同位元素を含む試料の採取方法 放射性同位元素を含む試料を採取する場合は,放射線業務従
事者が放射線施設で行う。
参考 放射性同位元素,放射線業務従事者及び放射線施設が放射線障害防止法で定義されている。
3.10 採取した試料の取扱い及び試験操作時の注意 採取した試料の取扱い及び試験操作時の注意は,個
別規格に規定するもののほかは,次のとおりとする。
(1) 一般的取扱い方法 採取後の試料,試料溶液,検量線用溶液などの調製,保存及び取扱いは,試験に
用いる水,試薬,容器,器具,環境及び作業従事者からの汚染,蒸発などによる濃度変化が最小限に
なるように注意して,なるべく速やかに行う。
備考 例えば,作業従事者からの汚染防止には,清浄な,繊維質の飛散の少ない作業衣を着用する。
また,溶液は,使用前によく振り,容器に直接ピペットを入れないで,共洗いした容器にと
り出した後はかりとる。
なお,とり出した溶液は元の容器に戻さない。
(2) 無菌的取扱い方法 無菌的取扱い方法は,一般的取扱い方法のほかは,次のとおりとする。
(a) 試料 すべての操作は,バイオクリーンルーム又はこれと同等以上の清浄な環境下で外部からの汚
染を防止し,なるべく速やかに取り扱う。
(b) 容器及び器具 容器及び器具は,滅菌したものを用いる。
なお,エンドトキシン試験を行う場合は,エンドトキシンの不活化を行った容器及び器具を用い
る。
(c) 作業衣及び作業従事者 作業衣は滅菌したものを用い,作業従事者は滅菌手袋を用いるか,手指を
消毒液で十分に洗浄し,腕が露出する場合は腕も消毒液で十分に洗浄する。
(3) 組換えDNA実験試料又は病原体試料の取扱い方法 P2レベル(5)又はLS-1(6)レベル以上の物理的封じ
込めを必要とする組換えDNA実験試料又は危険度3a(7)以上の病原体試料を取り扱う場合は,エーロ
ゾルが外部に漏出しない設計が施された機器を用いるか,又は安全キャビネットの中で取り扱い,発
生する汚染エーロゾルが外部に漏出しないように操作する。ただし,エーロゾルの発生のおそれがあ
る場合は,危険度2b(8)の病原体試料も危険度3a(7)以上の病原体試料と同様に操作する。
(4) 放射性同位元素を含む試料の取扱い方法 放射性同位元素を含む試料を取り扱う場合は,放射線業務
従事者が放射線施設で行う。
3.11 試料,試薬,容器及び器具の廃棄方法 試料,試薬,容器及び器具の廃棄方法は,作業従事者と環
境に対する安全対策を講じて行う。特に人体及び環境に有害なものは,それぞれ適切な無害化処理(24)を行
った後,廃棄する。
なお,その他のものは,洗浄した後廃棄する。
注(24) 有害物質の無害化は,対象とする物質の性質及び状態に応じて,中和,分解,抽出,沈殿,吸
着,焼却,滅菌,有害物質が漏出しない固形化など適切な処理方法を選択して単独で又は併用
して行う。
なお,エンドトキシン試験に使用した試料,試薬,容器及び器具は,JIS T 7322又はJIS T 7324
に規定する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて121℃で1時間以上処理した後廃棄
する。
また,組換えDNA実験及び病原体取扱い実験に係る廃棄物の廃棄方法は,それぞれ“組換え
15
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
DNA実験指針”及び“病原体等安全管理規程”に規定された方法によるものとする。放射性同
位元素を含む廃棄物は,“放射線障害防止法”に規定された処理を行った後に廃棄するか,又は
専門の廃棄業者に委託する。その他の注射針などの危険な廃棄物の廃棄には十分注意し,専門
の廃棄業者に委託することが望ましい。
4. 試験方法 試験方法は,JIS K 0050及びJIS K 8001によるほか,一般機器分析による試験,酵素活性
試験,エンドトキシン試験及びパイロジェン試験は,次のとおりとする。
4.1
一般機器分析による試験
4.1.1
水 一般機器分析による試験に用いる水は,各個別規格に規定するもののほか,3.2に規定する水
A3又はA4を用いる。
4.1.2
標準液 標準液は,各試験法に規定するもののほか,次のとおりとする。
なお,取扱いは,3.1(1)クリーンルーム又は3.1(2)クリーンベンチ内で行う。
(1) 検量線用標準液の調製 検量線用標準液としては,希釈標準液又は混合標準液を用いる。検量線用標
準液の調製は,使用する水,試薬及び作業者からの汚染が最小限になるように注意して行う。検量線
用標準液の保存には,四ふっ化エチレン樹脂又はポリエチレン樹脂製の気密容器を用いる。
(1.1) 希釈標準液の調製 希釈標準液の調製は,標準液(25)を分取して,希釈することによって行う。操作
は,次のとおり行う。
(a) 標準液の容器をよく振った後開封し,直ちに標準液でビーカーを共洗いする。
(b) 共洗いしたビーカーに,標準液を必要量より多めにとる。
(c) 全量ピペット10ml以上を用い,標準液を適当な体積の全量フラスコ(26)にとる。
(d) 低濃度の硝酸又は塩酸(27)(pH2以下)を全量フラスコの標線まで加え,栓をして振りよく混合する。
(e) 調製した溶液を気密容器に移し換える。
注(25) JIS K 8001の4.3(標準液)に従って調製する。日本工業規格に規定された標準液又は市販
の標準液を用いてもよい。
(26) 100ml又は1 000mlとする。
(27) 通常は水1 000mlに対し,いずれもJIS K 8001の4.1(希釈溶液)によって調製した硝酸 (1
+1) 3ml又は塩酸 (1+1) 3mlでよい。
備考1. 希釈標準液は,使用の都度調製する。
2. 標準液をそのまま検量線用標準液の一つとして用いる場合は,これと同時に用いる希釈
標準液の酸濃度を標準液の酸濃度と等しくなるように調製する。
3. 更に希釈する必要がある場合は,(1.1)の操作に準じて希釈標準液を再度希釈する。
4. 金属イオンはポリエチレン樹脂やガラスの表面に吸着されやすい。特に低濃度の場合に
は測定値に影響を与えることがあるので,容器の材質や酸濃度に注意する。
(1.2) 混合標準液の調製 標準液又は希釈標準液を他の標準液又は希釈標準液と混合して調製する。混合
によって沈殿の生成や濁りを生じない組合せとする(28)。
操作は,(1.1)の操作に準じて行う。
注(28) 誘導結合プラズマ発光分光分析法においては,元素同士でスペクトル線の重なりを生じや
すい。誘導結合プラズマ質量分析法においても,共存元素の同位体ピークや酸化物ピーク
が目的元素のスペクトルに重なる場合がある。
誘導結合プラズマ発光分光分析法に適する混合標準液の例を,表4に示す。
16
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表4 誘導結合プラズマ発光分光分析用混合標準液の一例
混合標準液
元素
A
Al, Ca, Mg
B
Cd, Co, Cr, Cu, Fe, Mn, Mo, Ni, Pb, Zn, V
C
As, Ge, P, Se, Si
備考 混合標準液は,使用の都度調製し,直ちに使用する。
(1.3) 試料溶液及び検量線用標準液の取扱い 試料溶液及び検量線用標準液は,汚染,蒸発などによる濃
度変化が最小限になるように注意して取り扱う。
備考1. 使用の直前によく振って用いる。
2. 気密容器から分取して使用する場合は,共洗いした容器に分取する。分取した溶液は気
密容器に戻してはならない。
3. 直接ピペットなどを気密容器に入れてはならない。
4.1.3
判定 試料溶液中の試験対象不純物の濃度が定量下限より高いことを確認し,試料中の濃度に換算
し,規格値と照合する。
なお,試験対象不純物の濃度が定量下限より低い場合は,定量下限の試料中の不純物濃度に換算し,そ
の濃度以下とする。空試験溶液が調製できない場合は,蒸留水又は溶液を入れないで得られる指示値で補
正して含まれる濃度を算出し,その濃度以下とすることができる。
4.1.4
吸光光度法による試験法 吸光光度法は,JIS K 0115による。
4.1.5
電気加熱方式原子吸光法による試験法 電気加熱方式原子吸光法は,JIS K 0121によるほかは,次
のとおりとする。
(1) 装置及び器具 装置及び器具は,次のとおりとする。
(a) プッシュボタン式液体用微量体積計又は自動試料注入装置 JIS K 0970に規定されたものを必要に
応じて用いる。
(2) 操作条件 操作条件は,JIS K 0121の6.3(装置操作条件の設定)によるほかは,次の事項について設
定する。
(a) 分析線波長
(b) ランプ電流値
(c) 分光器のスリット幅
(d) バックグラウンド補正法
(e) 加熱炉の材質と形状
(f) 試料注入量
(g) 乾燥過程における温度又は電流値及び時間
(h) 灰化過程における温度又は電流値及び時間
(i) 原子化過程における温度又は電流値及び時間
(3) 操作 操作は,次のとおり行う。
(a) 電気加熱方式原子吸光分析装置を作動できる状態にする。
(b) 試料溶液を(1)(a)の器具又は装置を用いて電気加熱炉に注入し,原子化を行い,分析線波長における
指示値を読む。
(c) 空試験液について(b)と同様の操作を行い,試料溶液について得た指示値を補正する。
(d) JIS K 0121の7.1(1)(検量線法)又は7.1(2)(標準添加法)に従って,検量線から試料溶液中の分析
17
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
対象元素の濃度を算出する。
(4) 判定 判定は,4.1.3による。
4.1.6
冷蒸気方式原子吸光法による試験法 冷蒸気方式による原子吸光法は,JIS K 0121によって行い,
判定は,4.1.3による。
4.1.7
フレーム原子吸光法による試験法 フレーム原子吸光法は,JIS K 0121によって行い,判定は,4.1.3
による。
4.1.8
誘導結合プラズマ発光分光分析法(ICP分析法)による試験法 誘導結合プラズマ発光分光分析法
は,JIS K 0116の7.3(ICP発光分析)によるほか,次のとおりとする。
(1) 装置及び器具 装置及び器具は,次のとおりとする。
(a) 誘導結合プラズマ発光分光分析装置
(b) 自動試料注入装置 必要に応じて用いる。
(2) 操作条件 操作条件は,次の事項について設定する。
(a) 高周波出力
(b) プラズマガス流量
(c) 補助ガス流量
(d) キャリヤーガス流量
(e) 真空形の装置においてはパージガス流量
(f) 観測高さ
(g) 分光器のスリット幅
(h) 分析線波長
(i) 内標準法においては内標準線波長
(j) 波長固定形の装置においては積分時間
(k) 波長走査形の装置においては波長走査範囲及び走査速度
(3) 操作 操作は,次のとおり行う。
(a) 誘導結合プラズマ発光分光分析装置の高周波プラズマを点灯し,分光器を作動できる状態にする(29)。
(b) 水を噴霧し,バックグラウンドが正常レベルにあることを確認する(30)。
(c) 空試験液を噴霧し,検量線法及び標準添加法においては分析線の発光強度を,内標準法においては
分析線及び内標準の発光強度を測定する。
(d) 試料溶液について(c)と同じ操作を行い,得られた発光強度を空試験液の発光強度で補正する。
(e) JIS K 0116の9.2.1(光電測光法)に従って,検量線から試料溶液中の分析対象元素の濃度を算出す
る。
注(29) 装置が安定するまで十分に時間をとる(安定に要する時間は装置によって異なる。)。
(30) 前に測定した試料によるメモリー効果が見られる場合は,硝酸 (1+10) を噴霧して汚染を
除去する。汚染が残る場合には,ネブライザー,噴霧室,トーチ管を取り外し,硝酸 (1+
3) に半日以上浸すか,又は硝酸 (1+3) に浸して80℃以上で2時間以上加熱した後,水で
洗浄する。
(4) 判定 判定は,4.1.3による。
4.1.9 誘導結合プラズマ質量分析法(ICP-MS分析法)による試験法 誘導結合プラズマ質量分析法は,
JIS K 0116によるほか,次のとおりとする。
(1) 装置 装置は,次のとおりとする。
18
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(a) 誘導結合プラズマ質量分析計
(b) 自動試料注入装置 必要に応じて用いる。
(2) 操作条件 操作条件は,次の事項について設定する。
(a) 高周波出力
(b) プラズマガス流量
(c) 補助ガス流量
(d) キャリヤーガス流量
(e) サンプリング深さ
(f) シグナル測定用質量数
(g) 質量数設定範囲
(h) 積分時間(31)
注(31) 1元素当たりのシグナル測定時間,ドエル時間及び積算回数で表示してもよい。
(3) 操作 操作は,次のとおり行う。
(a) 誘導結合プラズマ質量分析計の高周波プラズマを点灯し,質量分析計を作動できる状態にする(29)。
(b) 水を噴霧し,バックグラウンドが正常レベルにあることを確認する(32)(33)。
(c) 空試験液を噴霧し,検量線法及び標準添加法においては分析対象元素のシグナル(34)を,内標準法に
おいては分析対象元素のシグナル及び内標準元素(35)のシグナルを測定する。
(d) 試料溶液について(c)と同じ操作を行い,得られたシグナルを空試験液のシグナルで補正する。
(e) JIS K 0116の9.2.1(光電測光法)に準じて,検量線から試料溶液中の分析対象元素の濃度を算出す
る。
注(32) 装置が安定化するまで十分に時間をとる。安定化に要する時間は装置によって異なる。必
要があれば,質量軸校正を行う。
(33) 注(30)の操作で汚染が除去できない場合は,サンプリングコーンとスキマーコーンを取り外
し,研磨粉で研磨した後,硝酸 (1+20) 及び水で洗浄する。
(34) 1価イオンの質量におけるイオン強度を測定する。同位体がある場合には妨害イオンがな
い限り最もアバンダンスの大きい質量数を用いて測定する。
(35) 試料中に無視し得る濃度しか含まれず,かつ,酸化物イオン,水酸化物イオンなどの妨害
イオンを生じない元素を選択する。通常はカドミウム,インジウム,ロジウムなどを用い
る。
(4) 判定 判定は,4.1.3による。
4.1.10 イオンクロマトグラフ法による試験法 イオンクロマトグラフ法は,JIS K 0127によって行い,判
定は,4.1.3による。
4.1.11 高速液体クロマトグラフ法による試験法 高速液体クロマトグラフ法は,JIS K 0124によって行い,
判定は,4.1.3による。
4.1.12 ガスクロマトグラフ法による試験法 ガスクロマトグラフ法は,JIS K 0114によって行い,判定は,
4.1.3による。
4.1.13 蛍光光度法による試験法 蛍光光度法は,JIS K 0120による。
4.1.14 ゾーン電気泳動法による試験法 ゾーン電気泳動法による試験法は,次のとおりとする。
参考 電気泳動において,試料に電場をかけると電気泳動移動度を異にする成分は,徐々に相互
の位置にずれを生じる。これを利用し,多孔性支持体を採用し対流を防ぎ,多くの成分を
19
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
層状に相互に重なることなく分離する方法で,これには,Native-PAGE,SDS-PAGEなどポ
リアクリルアミドゲルを支持体とした泳動法がある。
(1) 装置 装置は,次のとおりとする。
(a) 電気泳動用安定電源装置
(b) 電気泳動用試料分離用装置
(c) 検出器
(2) 操作条件 操作条件は,次の事項について設定する。
(a) 泳動に用いる支持体又は支持体の作製方法
(b) 泳動条件(最大電圧,最大電流,使用電力,泳動温度,泳動時間)
(c) 泳動に用いる電極液の組成,濃度及びpH値
(d) 試料添加量及び組成
(e) 検出方法
(f) 検出器
(3) 操作 操作は,次のとおり行う。
(a) 泳動用支持体及び電極液を準備する。
(b) 泳動用支持体を作動できるように装着し,電極槽に電極液を満たす。
(c) 通電条件を設定した後,試料を添加し,電気泳動を開始する。
(d) 泳動終了後,直ちに染色して(検出方法によっては不要)検出又は測定を行う。
(e) 電気泳動の結果は直ちに写真を撮るか,又はデンシトグラムを記録する。
(4) 判定 判定は,試料液中の対象物質の濃度が,定量範囲にあることを確認し,濃度に換算して示す。
4.1.15 等電点電気泳動法による試験法 等電点電気泳動法による試験法は,次のとおりとする。
参考 種々の等電点をもつ両性電解質の混合液,又はそれらを固定した担体を用いて電気泳動を
行うと,含まれる両性電解質によってpHグラディエントが形成される。その形成された
pHグラディエント上に試料を置くと,自らの等電点に相当するpH値の位置に濃縮されて
静止することを利用した電気泳動法である。
(1) 装置 装置は,次のとおりとする。
(a) 定電流定電圧自動移行電源装置
(b) 恒温試料分離用装置(10℃で±1℃の温度調節可能な装置)
(c) 検出器
(2) 操作条件 操作条件は,次の事項について設定する。
(a) 泳動に用いた支持体又は支持体の作製方法
(b) pHグラディエント作成のために用いたキャリア・アンホライトの種類
(c) 泳動条件(最大電圧,最大電流,使用電力,泳動温度,泳動時間)
(d) 泳動に用いた電極液の組成,濃度及びpH値
(e) 試料添加量及び組成
(f) 検出方法
(g) 検出器
(3) 操作 操作は,次のとおり行う。
(a) キャリア・アンホライトを加えた支持体及び電極液を準備する。
(b) 泳動条件に従って分離用装置の温度を設定し,作製した泳動用支持体を装着する。
20
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(c) 通電条件を設定し,前泳動を行いpHグラディエントを形成させる。
(d) 試料を添加し,本泳動用通電条件を設定して泳動を行う。
(e) 泳動終了後,直ちに固定,染色し(検出方法によっては不要)検出又は測定を行う。
(f) 電気泳動の結果は直ちに写真を撮るか,又はデンシトグラムを記録する。
(4) 判定 判定は,試料液中の特性が定量範囲にあることを確認し,対象物質の等電点及び濃度を示す。
4.1.16 液体シンチレーション計数器法による試験法 液体シンチレーション計数器法による試験法は,次
のとおりとする。
備考 試料を液体シンチレーター溶媒に溶かし,放射線によるシンチレーターからの発光を光電
子倍増管に受けて電気パルスに変換し,計数することによって試験する方法である。
(1) 装置 装置は,次のとおりとする。
(a) 液体シンチレーション計数器
(2) 操作条件 操作条件は,次の事項について設定する。
(a) シンチレーター溶媒又は溶媒組成
(b) シンチレーターの種類
(c) クエンチャーの種類
(d) ベータ線放出核種
(e) 試料容器の材質,形態,容量,寸法
(f) 光電子増倍管の種類
(g) 測定温度と恒温性能
(h) バックグラウンド補正方法
(i) 試料の調製方法
(3) 操作 操作は,次のとおり行う。
(a) 装置を測定条件に設定する。
(b) 試料を調製して容器に入れ装置にセットする。
(c) 光子の計数を行って測定データの処理をする。
(4) 測定データの処理 バックグラウンドの補正をする。
(5) 判定 判定は,試料液中の計数値が定量範囲にあることを確認し,記録する。
4.1.17 赤外分光光度法による試験法 赤外分光光度法は,JIS K 0117による。
4.2
酵素活性試験 酵素活性試験は,酵素反応における生成物の増加量又は基質の減少量を測定し,そ
の反応速度を算出することによって,酵素活性で表される相対量としての酵素量を求める方法である。
酵素活性試験は,個別規格で規定するほかは,次のとおりとする。
4.2.1
水 水は,3.2に規定する水A3又はA4を用いる。
4.2.2
試薬 試薬は,3.3によるほかは,次のとおりとする。
(1) 緩衝液 通常,活性測定は目的とする酵素の最適pH付近で緩衝力の強い緩衝液を用いる(36)。
注(36) 緩衝液が目的とする酵素活性を阻害する場合があるので,このような場合には,酵素活性の測
定に支障がない適切な緩衝液の種類及び濃度を選択する。
また,酵素が補助因子(補酵素,活性化剤)を必要とする場合は,活性発現に必要な十分量
の補助因子をあらかじめ緩衝液に添加しておく。
さらに,基質が有機溶媒に易溶性で水に難溶性又は不溶性である場合は,緩衝液と混和でき,
かつ,酵素活性の測定に支障がない適切な有機溶媒を緩衝液に添加して基質を溶解することが
21
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
できる。一般に,有機溶媒の添加によって,緩衝液のpHが変化するので,実際に用いる有機
溶媒含有緩衝液についてそのpHをJIS Z 8802に規定するpH計形式IIを用いて測定する。
(2) 基質液 基質液は,目的の酵素に最も適した安定な高純度基質を用い,水,緩衝液又は緩衝液と混和
でき酵素活性の測定に支障がない適切な有機溶媒を用いて活性測定に適した濃度に溶解して調製した
もの(37)。
注(37) 天然物,特に天然高分子を基質とする場合には,ロットによって活性測定値が変動することが
あるので,同じロットのものを用いることが望ましい。ロットを変更する場合は,あらかじめ,
新旧のロット間における活性値の変化を検討しておく。
また,基質液は調製後なるべく短時間の内に用いることが望ましい。
備考 気体の基質を用いる場合,固形又は液状の基質をそのまま緩衝液に添加して懸濁状態で用いる
場合,水と混和しない適切な有機溶媒に溶解した基質を緩衝液に添加して水相−有機相の二相
系で用いる場合など特殊な場合には,基質を均一溶液としない。
4.2.3
装置及び器具 装置及び器具は,JIS K 0050,JIS K 8001及び4.1によるもののほかは,必要に応
じて次のとおりとする。
(1) 恒温槽 酵素反応に用いる場合は,常温〜80℃の任意の温度で温度変化を±0.1〜±0.5℃に保てるもの。
ただし,粘度測定に用いる場合は,JIS Z 8803に規定するもの。
また,ワールブルグ検圧装置に用いる場合は,温度変化を±0.02〜±0.05℃に保つことができるもの。
備考 反応液を振とう又はかき混ぜる機能のあるものが望ましい。
また,保持すべき温度変化の範囲は設定温度によって異なる。
(2) ボルテックスミキサー 試験管内の溶液を渦巻状に激しくかき混ぜることができるもの。
(3) プッシュボタン式液体用微量体積計 JIS K 0970に規定するもの。
(4) 酸素電極,酸素電極用反応容器及び酸素電極用電気回路 酸素電極は,反応液中の溶存酸素濃度を測
定することができるもの。酸素電極用反応容器は,酸素電極取付け口及び試料添加口がある容器。酸
素電極用電気回路は,反応液に接触した酸素電極からの入力を反応液中の溶存酸素濃度に比例した電
流値として出力し,自動記録することができるもの。
備考 酸素電極にはクラーク型電極などを用いる。
(5) ワールブルグ検圧装置 反応容器内の気体の量の変化を,U字管の液面の高さの変化によって圧力変
化として測定することができるもの。
備考 ワールブルグ検圧装置は,主室・副室・側室からなる反応容器,この反応容器と連結されたU
字管式圧力計からなるワールブルグ検圧計及び反応容器を恒温に保ちながらワールブルグ検圧
計を振とうすることができるワールブルグ検圧計用の振とう恒温槽によって構成する。
(6) pHスタット 反応液のpHをJIS Z 8802に規定するpH計形式IIで測定し,制御装置によって自動ビ
ューレットから酸又はアルカリ溶液を反応液に自動的に滴加することによって反応液のpHをあらか
じめ設定しておいたpHに戻すとともに,滴加された酸又はアルカリの量を連続的に自動記録するこ
とができるもの。
(7) 旋光計 JIS K 0063に規定するもの。
(8) 粘度計 JIS K 7117又はJIS Z 8803に規定するもの。
(9) イオン電極 JIS K 0122に規定するもの。
(10) マグネチックスターラー 回転による発熱が液温に変化を与えないもの。
(11) pH計 JIS Z 8802に規定するpH計形式II。
22
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4.2.4
試料溶液(酵素液) 試料溶液は,個別規格によるほかは,試料(酵素)を水又は適切な緩衝液を
用いて溶解又は希釈し,活性測定に適した濃度のものとする(38)。
注(38) 試料中に酵素活性を阻害する物質が含まれている場合には,阻害しない濃度以下にまで除去し
ておく。補助因子(補酵素,活性化剤)が必要な場合には,活性測定前に十分量を加えておく。
なお,試料が不安定な場合には,酵素活性の測定に支障のない適切な安定化剤を加えておく。
また,一般に,試料は熱,希釈に対して不安定であり,希薄溶液は室温で放置すると徐々に
失活することが多いので,試料溶液は活性測定の都度,直前になるべく高濃度のものを調製し,
活性測定を開始するまで氷冷しておくことが望ましい。
また,試料が熱に安定な場合は,試料溶液をあらかじめ設定した反応温度に保持しておくこ
とが望ましい。
4.2.5
試験方法 酵素活性(酵素反応速度)の試験方法は,酵素反応液中からその一部を採取せずに,酵
素反応の経過を直接連続的に追跡するか,酵素反応液中からその一定量を一定時間ごとに経時的に採取す
ることによって酵素反応の経過を不連続的に追跡し,酵素反応による基質又は生成物の変化量をそれぞれ
の酵素反応に適切な方法によって分析する。基質又は生成物の変化量の分析方法は,JIS K 0050,JIS K 8001
及び4.1によるほかは,次のとおりとする。
(1) 酸素電極法 酵素反応による反応液中の溶存酸素濃度の変化を酸素電極を用いて電流値として測定す
ることによって,基質又は生成物となる酸素の変化量を測定する。
(2) 検圧法 酵素反応による反応容器内の気体の量の変化を圧力変化として検圧計を用いて測定すること
によって,基質又は生成物となる気体の変化量を測定する。
(3) pHスタット法 酵素反応による反応液のpH変化をJIS Z 8802に規定するpH計形式IIを用いて測定
し,自動的に酸又はアルカリ溶液を反応液中に滴加することによってあらかじめ設定しておいたpH
に戻すとともに,この滴加量を連続的に自動記録することによって,基質又は生成物となる酸又はア
ルカリの変化量を測定する。
(4) イオン電極法 酵素反応による反応液中のイオン濃度の変化をイオン電極を用いて測定することによ
って,基質又は生成物となるイオンの変化量を測定する。
(5) 旋光度法 酵素反応による反応液,若しくは反応液から分離した基質又は生成物の旋光度の変化を旋
光計を用いて測定することによって,光学活性な基質又は生成物の変化量を測定する。
(6) 粘度法 酵素反応による反応液の粘度の変化を粘度計を用いて測定することによって,高分子量の基
質又は生成物の変化量を測定する。
(7) 酵素法 活性試験をする試料(主酵素)の作用による基質又は生成物の変化量を,その基質又は生成
物に特異的な酵素(系)[共役酵素(系)]を用いることによって測定する。
備考 酵素反応の経過を直接連続的に追跡する場合の試験方法には,吸光光度法,蛍光光度法,pHス
タット法,酸素電極法などがある。
また,酵素反応の経過を不連続的に追跡する場合の試験方法には,直接連続的に追跡する場
合の試験方法のほか,高速液体クロマトグラフ法,ガスクロマトグラフ法,液体シンチレーシ
ョン計数器法,中和滴定や錯滴定などの容量分析法などがある。
4.2.6
操作条件 操作条件は,JIS K 0050,JIS K 8001及び4.1によるほか,次の事項について設定する。
(1) 緩衝液の種類,濃度及びpH
(2) 反応温度
(3) 反応時間
23
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(4) 基質の種類(必要な場合,ロット番号)及び濃度
(5) 必要な場合,添加する補助因子,安定化剤及び有機溶媒の種類と濃度
4.2.7
操作 操作は,JIS K 0050,JIS K 8001及び4.1によるほか,次のとおりとする。
(1) 緩衝液,基質液及び試料溶液(酵素液)を調製する(39)。
注(39) 一般に,試料溶液は反応液に添加するまで氷冷しておくことが望ましい。しかし,試料が熱に
安定な場合は,試料溶液をあらかじめ設定した反応温度に保持しておくことが望ましい。
(2) 恒温槽の電源を入れ,あらかじめ設定した反応温度に保持しておく。
備考 通常,酵素活性の測定は,25℃又は30℃で行われることが多い。
(3) 反応容器に緩衝液と基質液を添加し,十分にかき混ぜて均一溶液とした後,恒温槽中で予備温置して
おく。
備考 気体の基質を用いる場合,固形又は液状の基質をそのまま添加して懸濁状態で用いる場合,水
と混和しない適切な有機溶媒に溶解した基質を添加して水相‐有機相の二相系で用いる場合な
ど特殊な場合には,基質を均一溶液としない。
(4) 試料溶液を添加し,速やかにかき混ぜた後,反応を開始する(40)。
注(40) 添加する酵素液量は,できるだけ少量であることが望ましい。
(5) 酵素反応液中からその一部を採取せずに,酵素反応の経過を直接連続的に追跡する場合は,自記記録
する。酵素反応液中からその一部を経時的に採取して酵素反応の経過を不連続的に追跡する場合は,
一定時間ごとに一定量の反応液を採取し(41),直ちに反応を停止させる。
注(41) 一定時間ごとに反応液を採取する場合は,反応液の採取は,反応開始直後のほか,一定反応時
間後の一点だけでなく,初速度の算出が可能な数点で行うことが望ましい。
備考 反応の停止方法は,通常,酵素の失活によることが多いが,基質又は生成物の沈殿・抽出など
によることもある。
また,特殊な場合として,反応容器中の気相,不溶性の基質若しくは生成物,又は水相‐有
機相の二相系のいずれかの相を採取することがある。
(6) 反応を停止した採取液について,直接又は発色,遠心分離,ろ過,抽出,pH調整などの処理を行った
後,4.2.5の適切な試験方法によって,基質又は生成物の変化量を測定する。
(7) 同一試料溶液について,2回以上測定する。
(8) 空試験を行う。
なお,空試験は,個別規格に規定するほかは,次のいずれかによる。
(a) 緩衝液に基質液を添加し,次に反応停止液を添加した後,試料溶液を添加して(5)〜(7)の操作を行う。
(b) 緩衝液にまず試料溶液を添加し,適切な方法によって酵素を失活させた後,基質液を添加して(5)〜
(7)の操作を行う。
(c) 緩衝液に基質液を添加した後,試料溶液の代わりに試料溶液と同じ容量の試験に用いた緩衝液又は
水を添加して(5)〜(7)の操作を行う。
4.2.8
計算 試料又は試料溶液の酵素活性は,次の式によって酵素反応の反応初速度として算出する。
t
d
s
S
A
)
(−
=
c
A
B=
ここに, A: 試料溶液の原液の酵素活性 [kat/ml (U/ml)]
24
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
S: 基質の減少量又は生成物の増加量 [mol/ml (μmol/ml)]
s: 基質の減少量又は生成物の増加量の空試験値 [mol/ml
(μmol/ml)]
d: 試料溶液の希釈倍数
t: 反応時間 [s (min)]
B: 試料の比活性 [kat/kg (U/mg)]
c: 試料溶液の濃度 [kg/ml (mg/ml)]
4.2.9
判定 判定は,測定値の平均値が,個別規格に規定する規格値以上である。
備考 個別規格において,測定値の最大値と最小値の差の限度を規定し,測定値がそれ以上であ
る場合は,再試験をすることが望ましい。
4.3
エンドトキシン試験 エンドトキシン試験は,ゲル化法,比濁時間分析法及び発色合成基質法の3
種類とする。
4.3.1
ゲル化法 ゲル化法は,次のとおりとする。
参考 LAL中に含まれるエンドトキシン感受性の各種の凝固因子がエンドトキシンによって順
次活性化し,最終的にコアグローゲンがコアグリンに変換しゲルを形成する。ゲル化法は,
このゲル形成能が,存在するエンドトキシン量に比例することからゲル形成の有無でエン
ドトキシンを検出する方法である。
(1) 水
(a) エンドトキシン試験用水 エンドトキシン試験用水は,蒸留又は超ろ過法によって精製した水で(42),
4.3.2又は4.3.3の試験法によって試験し,エンドトキシン含有量が0.006EU/ml以下のもの又は個別
規格に規定するエンドトキシン濃度以下のもの。
注(42) 通常,第十二改正日本薬局方第二部に規定する注射用水を用いる。
(2) 試薬,溶液及び緩衝液 試薬,溶液及び緩衝液の調製は,次のとおりとする。
(a) LAL 微量のエンドトキシンによって活性化してゲル化又は発色合成基質を水解するカブトガニ
の血球抽出成分から調製し,それを凍結乾燥したもの。冷蔵庫に入れて貯蔵する。
参考 エンドトキシンに特異的に反応するよう調製したものがあり,市販品にはリムルスHS-J
テストワコー,パイロテル,パイロジェントなどがある。
(b) LAL溶液 LAL表示力価となるように1バイアルのLALに,定められた量のエンドトキシン試験
用水を加えて,穏やかに振り混ぜて溶かす。LALによってはエンドトキシン試験用水の代わりに(e)
エンドトキシン試験用トリス(ヒドロキシメチル)アミノメタン−塩酸塩緩衝液 (0.1mol/l) を用い
るなど,それぞれ目的に応じて個別規格で規定する。保存する場合は,−20℃以下に凍結し,7日
間以内に使用する。
(c) エンドトキシン試験用水酸化ナトリウム溶液 (0.1mol/l) JIS K 8576に規定する水酸化ナトリウム
4.3gを三角フラスコ1lにはかりとり,エンドトキシン試験用水に溶かして1lとし,JIS T 7322又は
JIS T 7324に規定する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて121℃で1時間以上処理した
もの。
(d) エンドトキシン試験用塩酸 (0.1mol/l) JIS K 8180に規定する塩酸9mlを三角フラスコ1lにはかり
とり,エンドトキシン試験用水を加えて1lとし,JIS T 7322又はJIS T 7324に規定する高圧蒸気滅
菌装置又は高圧蒸気滅菌器を用いて121℃で1時間以上処理したもの。
(e) エンドトキシン試験用トリス(ヒドロキシメチル)アミノメタン−塩酸塩緩衝液 (0.1mol/l, pH7.4)
JIS K 9704に規定する2−アミノ−2−ヒドロキシメチル−1,3−プロパンジオール[トリス(ヒド
25
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ロキシメチル)アミノメタン]12.1gを三角フラスコ1lにはかりとり,エンドトキシン試験用水800ml
に溶かし,高圧蒸気滅菌器を用いて121℃で1時間以上処理した後,25℃まで冷却し,JIS Z 8802
に規定するpH計形式IIを用いてエンドトキシン試験用塩酸 (1+10) でpH7.4に調整する。この液
にエンドトキシン試験用水を加えて1lとし,JIS T 7322又はJIS T 7324に規定する高圧蒸気滅菌装
置又は高圧蒸気滅菌器を用いて121℃で1時間以上処理したもの。
参考 0.1mol/lトリス塩酸緩衝液などがある。
(f) エンドトキシン試験用塩酸 (1+10) JIS K 8180に規定する塩酸100mlを三角フラスコ1lにはかり
とり,エンドトキシン試験用水をかき混ぜながら加えて1lとし,JIS T 7322又はJIS T 7324に規定
する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて121℃で1時間以上処理したもの。
(g) エンドトキシン特異的LAL溶解用緩衝液 (e)において調製した緩衝液に, (1→3) ‐β‐D‐グル
カンなどのG因子反応物質の反応を抑制できる量の脱エンドトキシンした水溶性 (1→3) ‐β‐D‐
グルカン又はその誘導体を加え,JIS T 7322又はJIS T 7324に規定する高圧蒸気滅菌装置又は高圧
蒸気滅菌器を用いて121℃で1時間以上処理したもの。
なお,この液は冷蔵庫に貯蔵する。容器は,通常,バイアルを用いる。
(h) エンドトキシン特異的LAL溶液 LAL表示力価となるように1バイアルLALに定められた量のエ
ンドトキシン特異的LAL溶解用緩衝液を加え,穏やかに振り混ぜて溶かす。
なお,エンドトキシン特異的LAL溶液を貯蔵する場合は,−20℃以下で保存し,7日間以内に使
用する。
参考 リムルスES-Jテストワコーなどがある。
(3) 標準物質及び標準液
(a) 標準エンドトキシン 標準エンドトキシンは,力価(EUで表す。)を国立衛生試験所で標定した日
本薬局方エンドトキシン標準品を用いる。
(b) 対照標準エンドトキシン 標準エンドトキシンの代わりに,標準エンドトキシンに対して相対力価
を厳密に標定した市販のエンドトキシンを,対照標準エンドトキシンとする。
(c) エンドトキシン標準原液 標準エンドトキシン1バイアルをとり,その1.0mlにエンドトキシン10
000EUを含む液となるように,エンドトキシン試験用水(43)を加え,数回転倒かくはんし,更にボル
テックスミキサーで3分間以上激しくかき混ぜてエンドトキシンを完全に溶かし,エンドトキシン
標準原液 [10 000EU/ml] を調製する。
なお,この標準原液は,2〜8℃で保存し,14日間以内に使用する。
注(43) エンドトキシン試験用水は,通常,1.60mlを加える。
(d) エンドトキシン標準液 エンドトキシン標準原液をボルテックスミキサーで1分間以上激しくかき
混ぜ,氷水で冷却し,その一定量を正確にはかりとり,エンドトキシン試験用水を正確に加えて,
各個別規格に規定されたエンドトキシン規格値(限度値)の濃度を含む各標準液を調製する。表5
に希釈系列の一例を示す。
なお,各標準液は,氷水中に保存し,調製後90分間以内に使用する。

26
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5 エンドトキシン標準液の調製(希釈系列の一例)
標準液の名称
A
B
C
D
E
F
G
H
I
J
K
エンドトキシン
単位 (EU/ml)
1 000
100
10
1
0.5
0.25
0.125 0.062 5 0.031 3 0.015 6 0.007 8
エンドトキシン
標準原液又はエ
ンドトキシン標
準液 (ml)
標準
原液
A液
B液
C液
D液
E液
F液
G液
H液
I液
J液
0.5
0.5
0.5
0.5
2.0
2.0
2.0
2.0
2.0
2.0
2.0
エンドトキシン
試験用水
4.5
4.5
4.5
4.5
2.0
2.0
2.0
2.0
2.0
2.0
2.0
参考 通常,LALの表示力価の4倍のところから倍数希釈し,各希釈溶液は,次の希釈操作を行う前
に30秒間以上ボルテックスミキサーでかき混ぜ,1段階の希釈で10倍より大きい希釈は行わ
ない。
(4) 装置及び器具 装置及び器具は,JIS K 0050によるもののほか,次のとおりとする。
(a) 恒温水槽又はブロックヒーター 水槽の水又はブロックの温度を37±1℃に保つことができるもの。
(b) 冷蔵庫 庫内の温度を2〜8℃に保つことができるもの。
(c) 冷凍庫 庫内の温度を−20℃以下に保つことができるもの。
(d) 乾熱滅菌器 器内の温度を250℃以上で90分間保つことができるもの。
(e) 高圧蒸気滅菌器 JIS T 7322若しくはJIS T 7324に規定するもの又はこれらと同等以上の性能をも
つもの。
(f) ボルテックスミキサー 試験管内の溶液を渦巻状に激しくかき混ぜることができるもの。
(g) 全量ピペット及びメスピペット 0.1ml,0.5ml,1.0ml,2.0ml,5.0ml及び10.0mlの全量目盛又はそ
れ以下の体積が計量できる分量目盛付きのガラス製のもので,いずれも3.7(4)によって洗浄し,更
に乾熱滅菌器を用いて250℃以上の温度で,90分間滅菌したもの。
なお,250℃以上で乾熱滅菌するため,エンドトキシン試験専用として,JIS K 0050の9.3(全量
ピペット,全量フラスコ及びビュレットの校正方法)によって使用後校正を行う。校正値は,必要
な場合に,測定値の補正に用いる。
(h) 試験管(反応容器) 内径約10mm,長さ約75mmのガラス試験管で3.7(4)によって洗浄し,アル
ミニウム製のふたは,非イオン界面活性剤,水道水,エンドトキシン試験用水で順次洗い,更に3.8(2)
によってエンドトキシンの不活化を行ったもの。
(i) その他のガラス器具 その他のガラス器具は,3.5(1)による。この場合,洗浄は3.7(4)によって行い,
更に3.8(2)のエンドトキシンの不活化を行う。
(5) 試料溶液の調製
(a) 固体試料 個別規格に規定する試料量を正確にはかりとり,エンドトキシン試験用水に溶かし,必
要な場合はエンドトキシン試験用水酸化ナトリウム溶液 (0.1mol/l) 又はエンドトキシン試験用塩
酸 (0.1mol/l) で,JIS Z 8802に規定するpH計形式IIを用いて,pH6.0〜7.5に調整した後,個別規
格で規定する全量フラスコにエンドトキシン試験用水で洗い入れ,更にエンドトキシン試験用水を
標線まで加えて振り混ぜて,試料溶液とする。
(b) 液体試料 個別規格に規定する試料量を正確にはかりとり,必要な場合はエンドトキシン試験用水
酸化ナトリウム溶液 (0.1mol/l) 又はエンドトキシン試験用塩酸 (0.1mol/l) で,JIS Z 8802に規定す
るpH計形式IIを用いてpH6.0〜7.5に調整した後,個別規格で規定する全量フラスコにエンドトキ
シン試験用水で洗い入れ,更にエンドトキシン試験用水を標線まで加えて振り混ぜて,試料溶液と
27
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
する。
(6) 本試験 (7)のそれぞれの予備試験をあらかじめ行い,ゲル化法が十分な精度をもち,有効に実施でき
ることを確認した後,本試験を行う。
(6.1) 操作 操作は,次のとおり行う。
(a) 試験管4本 (A) , (B) , (C) 及び (D) に,それぞれ全量ピペット0.1mlを用いて迅速にLAL溶液(又
はエンドトキシン特異的LAL溶液)0.10mlずつをはかりとり,直ちにふたをする。
(b) 試験管 (A) に,全量ピペット0.1mlを用いて試料溶液0.10mlを加え,直ちにふたをして穏やかに振
り混ぜた後,恒温水槽又はブロックヒーターを用いて37±1℃で60±2分間振動を与えない状態で
放置する。
(c) 試験管 (B) に,全量ピペット0.1mlを用いて個別規格に規定されたエンドトキシン規格値(限度値)
に相当する濃度のエンドトキシン標準液0.10mlを加え,直ちにふたをして穏やかに振り混ぜた後,
恒温水槽又はブロックヒーターを用いて37±1℃で60±2分間振動を与えない状態で放置する。
(d) 試験管 (C) に,全量ピペット0.1mlを用いてエンドトキシン試験用水0.10mlを加え,直ちにふたを
して穏やかに振り混ぜた後,恒温水槽又はブロックヒーターを用いて37±1℃で60±2分間振動を
与えない状態で放置する。
(e) 試験管 (D) に,全量ピペット0.1mlを用いて最終濃度がLAL表示力価の2倍濃度になるようエン
ドトキシン標準液を添加した試料溶液0.10mlを加え,直ちにふたをして,穏やかに振り混ぜた後,
恒温水槽又はブロックヒーターを用いて37±1℃で60±2分間振動を与えない状態で放置する。
備考 ゲル化法で試料溶液のエンドトキシン濃度を知るためには,試料溶液をそのままか又は10
倍段階希釈系列を調製し,(6.1)によって試験を行いエンドポイント(44)を求め,更にこのエ
ンドポイントを挟んで適当な2倍段階希釈列を調製し,正確なエンドポイントを求める。
この場合,各濃度について2本の試験管を用いエンドトキシン標準液の希釈系列を同時に
併行して試験する。
注(44) ゲル化反応終末点で陽性反応を示す最大希釈濃度。
(6.2) 判定 判定は,次のとおり行う。
(a) 試験管 (A) , (B) , (C) 及び (D) を,振動を与えないよう注意して取り出し,穏やかに180°転倒し,
内容物を観察する。
(b) 内容物が凝固して変形しない場合を陽性,それ以外を陰性とする。
(c) 試料溶液及びエンドトキシン試験用水を加えた試験管 (A) 及び (C) の反応が陰性で,限度値に相
当するエンドトキシン標準液を加えた試験管 (B) 及び試料溶液に最終濃度がLAL表示力価の2倍
濃度になるようエンドトキシン標準液を添加した試験管 (D) の反応が陽性を示すとき,試験は適合
とする。
(d) エンドトキシン試験用水を加えた試験管 (C) が陽性の場合,又はエンドトキシン標準液及び最終濃
度がLAL表示力価の2倍濃度になるようエンドトキシン標準液を添加した試料溶液を加えた試験管
(B) 及び (D) の反応が陰性の場合は,試験は無効とし,新しい試薬を用いるか,器具を取り替えて
再試験を行う。
(e) 試料溶液を加えた試験管 (A) の反応が陽性で,(c)のその他の条件が満たされている場合は[(C) の
反応が陰性, (B) 及び (D) の反応が陽性],試料中のエンドトキシン濃度は次の式によって算出し,
試験の適否を決める。このエンドトキシン濃度が個別規格に規定された規格値(限度値)を超えな
い場合を合格とし,超える場合を不合格とする。
28
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ET=λ×D
ここに,
ET: エンドトキシン濃度 (EU/ml)
λ: LALの表示力価(検出限界)
D: 最大希釈倍数(陽性を示す最大の希釈)
(7) 予備試験 本試験が十分な精度をもち,有効に実施できるか否かを確認するため,次のそれぞれの予
備試験を行う。
(7.1) 試験精度及びLAL力価の確認試験 試験室及び試験者の適正を評価するとともに,新しく使用す
るロットのLAL表示力価を確認する。
(7.1.1) 操作 操作は,次のとおりとする。
(a) エンドトキシン標準原液にエンドトキシン試験用水を加えて,LALに表示された力価に相当するエ
ンドトキシン濃度の41倍,21倍,1倍及び2倍濃度の標準液を調製し,それぞれ4回ずつ(6.1)によっ
て試験する。
(b) 各希釈系列における測定回数ごとのエンドポイントをエンドポイント判定例(表6)に示すように
して求める。
表6 LALの力価確認におけるエンドポイントの判定例
(LALの表示力価が0.062 5EU/mlの場合)
実測結果
E
log10E
ET
(EU/ml)
0.125
0.062 5
0.031 3
0.015 6
測
定
回
数
1
+
+
+
−
0.031 3
−1.504
2
+
+
+
−
0.031 3
−1.504
3
+
+
+
−
0.031 3
−1.504
4
+
+
−
−
0.062 5
−1.204
ET:エンドトキシン濃度
E:エンドポイント
(7.1.2) 判定 判定は,次のとおりとする。
(a) 各エンドポイントを対数変換し,次の式によって標準偏差を求める。標準偏差が0.365未満ならば,
その試験精度の信頼性があることが確認されたものとする。
例 表6の標準偏差の計算
()
(
)1
2
2
2
−
−
=
f
f
e
e
SD
Σ
Σ
ここに,
SD2: 標準偏差の二乗
e: log10E
Σe: eの和
f: 測定回数
f
Σe: −1.429
逆対数: 0.037 2
SD: 0.150
(b) 標準偏差が0.365以上の場合は,更に各希釈系列ごとに8回試験し,標準偏差を求める。8回の繰返
し試験後,標準偏差が0.306未満ならその試験精度の信頼性があることが確認されたものとする。8
回の繰返し試験の標準偏差が0.306以上なら試験精度を高めるように努力し,再試験する。
なお,表7に標準偏差の基準を示す。

29
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表7 標準偏差の99%上限値の基準
回数
log10
4
0.365
8
0.306
(c) 試験精度の信頼性があることを確認した後,それぞれのエンドポイントを求めその常用対数eの平
均値を計算し,その逆対数をLALの実測力価とする。この値は,LAL表示力価の21以上,2倍以下
でなければならない。
(7.2) (1→3) −β−D−グルカン含有の有無に関する確認試験 試料中に (1→3) −β−D−グルカンを含
有しているか否かを確認し,エンドトキシンに特異的に反応するLALを用いる必要があるかどうか
を明らかにする。
(7.2.1) 操作 操作は,次のとおりとする。
(a) 最低6本の各試験管に,全量ピペット0.1mlを用いてLAL溶液0.10mlずつを入れ,直ちにふたを
する。
(b) 各試験管に,全量ピペット0.1mlを用いて,A液,B液及びC液をそれぞれ0.10mlずつ加え,(6.1)
によって測定する。
A液 : 試料溶液
B液 : エンドトキシン試験用水
C液 : エンドトキシン標準原液のエンドトキシン試験用水による2倍段階希釈の最低4濃度
[LAL表示力価 (λ) の41,
2
1,1及び2倍]
(c) それぞれについてエンドポイントを求め,(6.2)及び(7.1)によって,エンドトキシン濃度の計算及び
試験精度の確認を行う。
(d) (a)〜(c)の操作を,LAL溶液に替えてエンドトキシン特異的LAL溶液を用いて行う。
(e) LAL溶液及びエンドトキシン特異的LAL溶液を使用するいずれの場合も,エンドトキシン試験用
水に対して陰性であることを確認する。
(f) C液の各エンドトキシン標準液によって求めたエンドポイントが21λ〜2λの範囲内にあることを確
認する。
(7.2.2) 判定 判定は,次のとおりとする。
(a) LAL溶液を用いて求めた試料溶液中のエンドトキシン濃度が,エンドトキシン特異的LAL溶液を
用いて求めたエンドトキシン濃度の21倍から2倍の範囲内にある場合は,試料中に (1→3) −β−D
−グルカンを含有しないとする。
(b)
2
1倍から2倍の範囲外にある場合は,試料中に (1→3) −β−D−グルカンを含有するとする。
(c) (a)の場合は,LAL溶液を用いて,次の予備試験及び本試験を行ってよい。
(b)の場合は,エンドトキシン特異的LAL溶液を用いて,次の予備試験及び本試験を行う。
備考1. (7.2.1)(e)又は(f)が満たされなかった場合は,試験を無効とし,新しい試薬を用いるか,
器具を取り替えて再試験する。
2. LAL溶液を用いず,エンドトキシン特異的LAL溶液を常用する場合は,(7.2)の試験を省
略することができる。
(7.3) 阻害又は促進作用の確認試験 阻害又は促進作用の程度を確認する。
(7.3.1) 操作 操作は,次のとおりとする。
(a) 最低10本の各試験管に,全量ピペット0.1mlを用いてLAL溶液又はエンドトキシン特異的LAL溶
30
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
液0.10mlずつを入れ,直ちにふをする。
(b) 各試験管に,全量ピペット0.1mlを用いて,A液,B液,C液及びD液をそれぞれ0.10mlずつ加え,
(6.1)によって測定する。
A液 : 試料溶液
B液 : エンドトキシン試験用水
C液 : エンドトキシン標準原液のエンドトキシン試験用水による2倍段階希釈の最低4濃度
[LAL表示力価 (λ) の41,21,1及び2倍]
D液 : 試料溶液に,エンドトキシン標準原液を試料溶液で希釈し,最終濃度がC液と同濃度に
なるよう添加したもの(4濃度)
(c) C液のそれぞれの希釈系列における測定回数ごとのエンドポイントを求め,それらの常用対数の平
均値を計算し,その逆対数値を求める。
(d) 同様にD液のそれぞれの測定回数ごとのエンドポイントを求め,それらの常用対数の平均値を計算
し,その逆対数値を求める。
(7.3.2) 判定 判定は,次のとおりとする。
(a) (7.3.1)(d)の値が(7.3.1)(c)の値の21以上,2倍以下なら,試料溶液は阻害又は促進作用を示さない。そ
の範囲を超えるなら本試験に適さない。その場合は,試料溶液をエンドトキシン試験用水で最大有
効希釈(45)を超えない範囲で希釈し,再試験する。
注(45) 最大有効希釈 (Maximum Valid Dilution, MVD) とは,個別規格に規定したエンドトキシンの規格
値(限度値)を検出できる試料の最大希釈率である。これは使用する測定試薬の検出限界値と
エンドトキシンの規格値によって決まる値で,次の式によって算出する。
λ
C
L
MVD
・
=
ここに, MVD: 最大有効希釈
L: 個別規格に規定されたエンドトキシンの規格値(限度値)
(EU/g)
C: 試料原液の濃度 (g/ml)
[試料溶液(A液)を試料原液とする場合と試料溶液(A液)
を更に希釈したものを試料原液とする場合がある。]
λ: LAL表示力価(検出限界)
(b) A液が陽性と判定された場合は試験は無効とし,その場合は,別の試料溶液を準備し再試験を行う。
(c) B液が陽性と判定された場合は試験は無効とし,新しい試薬を用いるか,器具を取り替えて再試験
を行う。
(7.4) 対照標準エンドトキシン (CSE) の標準エンドトキシン (RSE) に対する力価標定 RSEの代わり
に,RSE以外の市販エンドトキシンを試験に用いるときは,RSEに対して相対力価を標定すること
が必要である。
また,新しいロットのCSEを用いるとき及び新しいLALを用いるときも,同様にCSEの力価の
標定を行うこととする。
標定は,次のとおりとする。
(a) (3)(b)の対照標準エンドトキシン4バイアルと(3)(a)の標準エンドトキシン1バイアルを,(3)(c)と同
様にして溶かす。
(b) (3)(d)エンドトキシン標準液によって,それぞれのバイアルごとの段階希釈列をつくる。

31
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(c) 各濃度ごとに4本の試験管を用い,(6.1)によって同時に試験する。
(d) 表8に示すように,対照標準エンドトキシンの各希釈列ごとのゲル化のエンドポイントを求め,そ
の常用対数eに対する標準エンドトキシンのEの常用対数をとり,それぞれの平均の逆対数を求め,
その比を対照標準エンドトキシンの力価とする。
表8 対照標準エンドトキシン (CSE) の標準エンドトキシン (RSE) に対する力価の標定(一例)
(LALの表示力価が0.25EU/mlの場合)
RSE
EU/ml
f
e
∑の逆対数
0.5
0.25
0.125
0.062 5 End point
1
+
+
−
−
0.25
0.312 5
+
−
−
−
0.5
+
+
−
−
0.25
+
+
−
−
0.25
CSE
ng/ml
f
e
∑の逆対数
0.05
0.025
0.012 5
0.006 3 End point
1
+
+
+
−
0.012 5
0.014 8
+
+
+
−
0.012 5
+
+
+
−
0.012 5
+
+
−
−
0.025
2
+
+
−
−
0.025
0.025
+
+
−
−
0.025
+
+
−
−
0.025
+
+
−
−
0.025
3
+
+
+
−
0.012 5
0.017 6
+
+
+
−
0.012 5
+
+
−
−
0.025
+
+
−
−
0.025
4
+
+
+
−
0.012 5
0.017 6
+
+
+
−
0.012 5
+
+
−
−
0.025
+
+
−
−
0.025
f
e
∑の平均値
0.018 75
計算
16.7EU/ng
75ng/ml
0.018
EU/ml
5
312
.0
CSE
RSE
=
=
4.3.2
比濁時間分析法 比濁時間分析法は,次のとおりとする。
参考 LAL中に含まれるエンドトキシン感受性の各種の凝固因子が,エンドトキシンによって順
次活性化され,最終的にコアグローゲンがコアグリンに変換してゲルを形成する。比濁時
間分析法は,ゲル形成に要する時間がエンドトキシン量に反比例することから,反応に伴
う透過光量の変化を測定することによって,エンドトキシンを定量する方法である。
(1) 水,試薬,溶液,緩衝液,標準物質及び標準液 水,試薬,溶液,緩衝液,標準物質及び標準液は,
4.3.1(1)〜(3)による。
(2) 装置及び器具 装置及び器具は,4.3.1(4)によるもののほか,次のとおりとする。
(a) 並列比濁時間分析装置 エンドトキシンとLALとの一定温度における振動を与えない状態でのゲ
ル化反応を透過光量の変化に変換し,透過光量がある一定の割合だけ変化するまでの時間(以下,
Tgという。)を測定することによって,エンドトキシン濃度を測定する装置。
装置の構成を図1に示す。
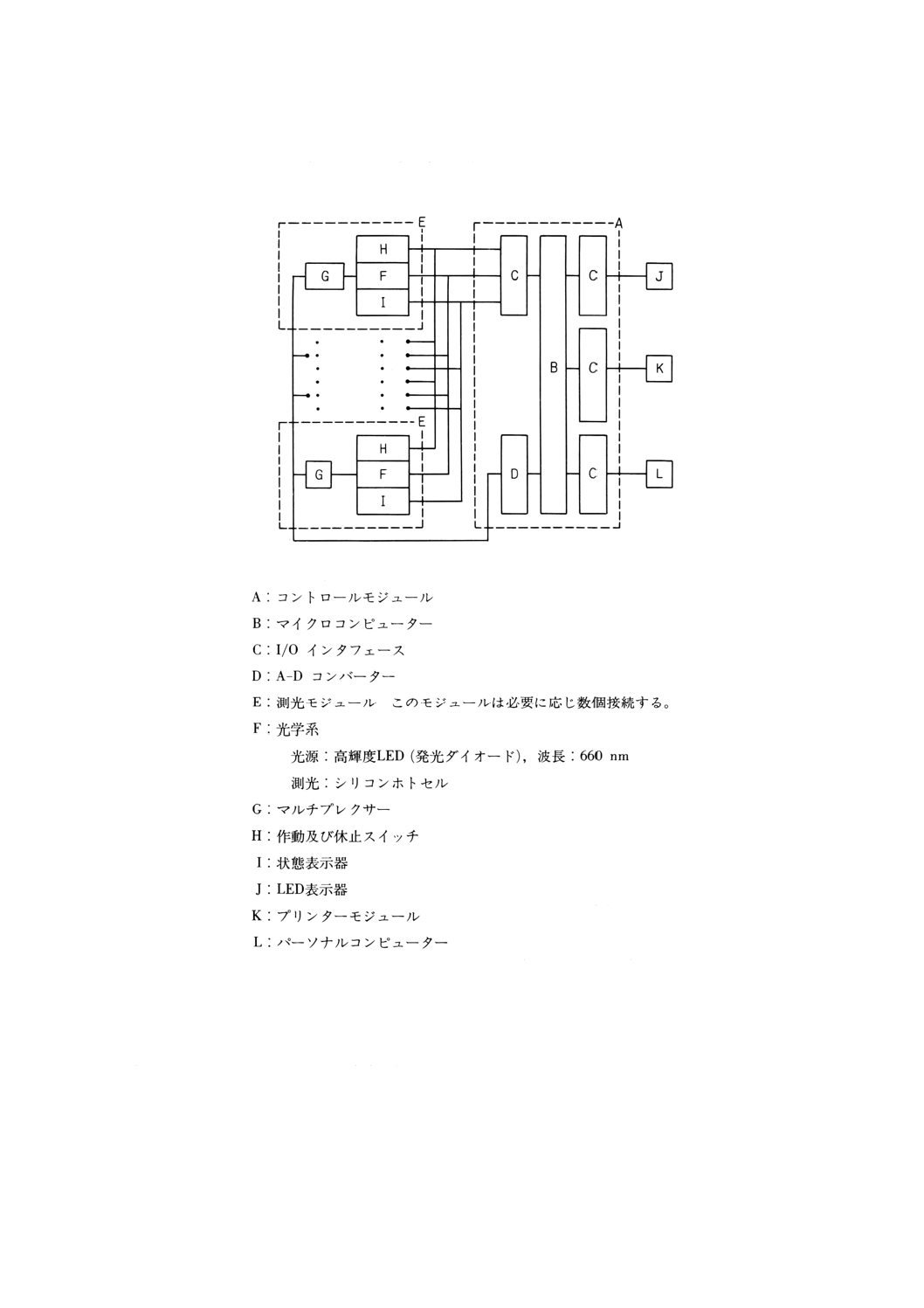
32
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考 トキシノメーターET-201などがある。
この装置は,ゲル化法と同時測定も可能である。
図1 並列比濁時間分析装置構成図
(3) 試料溶液及び高濃度試料溶液の調製 試料溶液及び高濃度試料溶液の調製は,4.3.1(5)による。この場
合,高濃度試料溶液の調製には試料溶液の2倍量の試料を用いる。ただし,試料が溶けない場合は調
製しない。
(4) 本試験 (5)のそれぞれの予備試験をあらかじめ行い,比濁時間分析法が十分な精度をもち,有効に実
施できることを確認した後,本試験を行う。
なお,本試験は2回以上の繰返し試験を行い,測定結果はそれらの平均値とする。
(4.1) 操作 操作は,次のとおりとする。
(a) 表5に示す標準液D〜Kのうちから,エンドトキシン検量線作成用標準液として,連続する4種類
33
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
のエンドトキシン標準液を選ぶ。このとき,規格値に相当するエンドトキシン濃度が,選んだエン
ドトキシン標準液の最小濃度より大きく,最大濃度より小さくなければならない。
なお,選んだエンドトキシン標準液の濃度を低いものから順に,λ2,2λ2,4λ2,8λ2とする。
(b) 並列比濁時間分析装置の電源を入れ,測光部の光源及び温度を安定化する。
(c) (5.1.1)で作成した検量線によって,λ2の濃度のエンドトキシン標準液のTgを求め,求めたTgより
長い時間になるように測定時間を設定する。
(d) 試験管7本 (A) , (B) , (C) , (D) , (E) , (F) 及び (G) にそれぞれ全量ピペット0.1mlを用いて速やかに
LAL溶液又はエンドトキシン特異的LAL溶液0.10mlずつをはかりとり,直ちにふたをする。
(e) 試験管 (A) に,全量ピペット0.1mlを用いて試料溶液0.10mlを加え,直ちにふたをして振り混ぜた
後,並列比濁時間分析装置に取り付け,装置を作動させる。
(f) 全量ピペット0.1mlを用いて,(a)で選んだ4種類の検量線作成用各標準液0.10mlずつを各試験管 (B)
〜 (E) に加え,並列比濁時間分析装置に取り付け,装置を作動させる。
(g) 試験管 (F) に全量ピペット0.1mlを用いてエンドトキシン試験用水0.10mlを加え,直ちにふたをし
て振り混ぜた後,並列比濁時間分析装置に取り付け,装置を作動させる。
(h) 全量ピペット2mlを用いて8λ2の濃度のエンドトキシン標準液及び高濃度試料溶液それぞれ2.0ml
を適当な容器にとり,振り混ぜ,検討液Aとする.
なお,高濃度試料溶液が調製できない場合などの検討液Aの調製方法は,これとエンドトキシン
及び試料の濃度が同一となる他の調製方法によってもよい。
(i) 試験管 (G) に全量ピペット0.1mlを用いて検討液A0.10mlを加え,直ちにふたをして振り混ぜた後,
並列比濁時間分析装置に取り付け,装置を作動させる。
(j) 各試験管内の溶液が一定の濁度になった場合,それぞれのTgが表示されるので,それを記録する。
(k) 試験管 (B) 〜 (E) の4種類のエンドトキシン標準液のそれぞれのエンドトキシン濃度と測定した
Tgから,横軸をエンドトキシン濃度の対数値,縦軸をTgの対数値とする検量線を作成する。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度におけるTgと最小濃度
におけるTgとの間である。
(l) 試料溶液を加えた試験管 (A) における反応によって表示されるTgから検量線を用いてエンドトキ
シン濃度 (EU/ml) を求める。
(m) 試験管 (G) の検討液AのTgから検量線を用いてエンドトキシン濃度を求める。
備考 あらかじめ毎回の試験で一定の検量線が得られることが確認されている場合には,試験の
都度検量線を作成する必要はない。その場合には標準液4λ2を調製し,そのTgを測定する。
測定したTgから,あらかじめ得られている検量線を用いて,エンドトキシン濃度 (λm) を
求める。この場合,λmが4λ2の75〜125%でなければならない。
(n) 試料のエンドトキシン含有量を,次の式によって算出する。
C
Em
Ec=
ここに,
Ec: 試料のエンドトキシン含有量 (EU/g)
Em: 試料溶液のエンドトキシン濃度 (EU/ml)
C: 試料溶液の濃度 (g/ml)
(4.2) 判定 判定は,次の条件をすべて満足した場合を合格とし,それ以外を不合格とする。
(a) エンドトキシン試験用水のTgが,設定した測定時間を超える。
34
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(b) λ2の濃度の検量線作成用エンドトキシン標準液のTgが,測定時間以内である。
(c) 得られた検量線について,(5.1)による試験精度の信頼性がある。
(d) 検討液AのTgから求めたエンドトキシン濃度から,試料溶液のTgから求めたエンドトキシン濃度
を差し引いた値が,4λ2のエンドトキシン量の75〜125%である。
(e) 試料のエンドトキシン含有量が個別規格に規定する規格値以下である。
備考 (a),(c)又は(d)が満たされなかった場合には,試験は無効とし,新しい試薬を用いるか,器具を
取り替えて再試験を行う。
なお,(c)又は(d)が満たされなかった場合には,更にエンドトキシン標準液を調製し直す。
(b)が満たされなかった場合には,新しい試薬を用いるか,エンドトキシン標準液を調製し直
すか,器具を取り替えるか,又は測定時間を長くして再試験を行う。
(5) 予備試験 試験が十分に有効に実施できるか否かを確認するため,次のとおり行う。
なお,予備試験は2回以上の繰返し試験を行い,測定結果はそれらの平均値とする。
備考 本試験を予備試験の後,速やかに行うことが必要な場合は,予備試験は本試験と同時に行うこ
とができる。例えば,本試験の一部(検量線の作成操作)を予備試験とみなすことができる。
(5.1) 試験精度の確認試験 試験精度の確認は,試験環境,試験者などの適正を評価する場合,又は新し
いロットのLALを使用する場合,次のとおり行う。
(5.1.1) 操作 操作は,次のとおりとする。
(a) 並列比濁時間分析装置の電源を入れ,測光部の光源及び温度を安定化する。
(b) 最低5本の試験管にそれぞれ全量ピペット0.1mlを用いて速やかにLAL溶液又はエンドトキシン特
異的LAL溶液0.10mlをはかりとり,直ちにふたをする。
(c) エンドトキシン試験用水,(4.1)(a)で選択したエンドトキシン濃度λ2を含む4種類以上の濃度の検量
線作成用のエンドトキシン標準液を全量ピペット0.1mlを用いてそれぞれ0.10mlずつ,(4.1)の本試
験操作に従って,各試験管に速やかに加え,直ちにふたをして振り混ぜた後,並列比濁時間分析装
置に取り付けて装置を作動させ,一定の濁度になったときに表示されるTgを記録する。
(d) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定したTgから,横軸をエンドトキシ
ン濃度の対数値,縦軸をTgの対数値とする検量線を作成し,次の式によって検量線の相関係数 (r)
を求める。
SxSy
n
n
y
x
xy
n
r=
)1
(−
−
∑
∑
∑
ここに,
r: 相関係数
n: プロット数
x: エンドトキシン濃度 (EU/ml) の対数値
y: Tg(分)の対数値
Sx: xの標準偏差
Sy: yの標準偏差
(5.1.2) 判定 判定は,次のとおりとする。
検量線の相関係数 (r) が−0.98以下であるとき,試験精度の信頼性が確認されたこととする。
なお,相関係数が−0.98を超える場合は,試験精度を向上する努力をした上で,再度試験を行う。
(5.2) (1→3) −β−D−グルカン含有の有無に関する確認試験 試料中に (1→3) −β−D−グルカンを含
有しているか否かを確認し,エンドトキシンに特異的に反応するLALを用いるかどうかを明らかに
する。
35
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(5.2.1) 操作 操作は,次のとおりとする。
(a) エンドトキシン検量線作成用として,(4.1)(a)で選択したλ2を最低濃度とする4種類以上のエンドト
キシン標準液を調製する。
(b) 並列比濁時間分析装置の電源を入れ,測光部の光源及び温度を安定化する。
(c) (5.1.1)で作成した検量線によって,λ2の濃度のエンドトキシン標準液のTgを求め,求めたTgより
長い時間になるように測定時間を設定する。
(d) 最低6本の試験管にそれぞれ全量ピペット0.1mlを用いて速やかにLAL溶液0.10mlをはかりとり,
直ちにふたをする。
(e) エンドトキシン試験用水,試料溶液,4種類以上の濃度のエンドトキシン標準液0.10mlずつを,全
量ピペット0.1mlを用いて,(4.1)の本試験操作に従って,各試験管に速やかに加え,直ちにふたを
して振り混ぜた後,並列比濁時間分析装置に取り付けて装置を作動させ,一定の濁度になったとき
に表示されるTgを記録する。
(f) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定したTgから,横軸をエンドトキシ
ン濃度の対数値,縦軸をTgの対数値とする検量線を作成する。
検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度におけるTgと最小濃度におけ
るTgとの間である。
(g) 試料溶液のTgから検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(h) (a)〜(g)の操作を,LAL溶液に替えてエンドトキシン特異的LAL溶液を用いて行う。
(5.2.2) 判定 次の条件を満足しなかった場合には,試料中に (1→3) −β−D−グルカンが含有される可能
性があると判断されるため,(4)の操作は,LAL溶液に替えてエンドトキシン特異的LAL溶液を使
用する。
(a) エンドトキシン試験用水のTgが,設定した測定時間を超える。
(b) λ2の濃度のエンドトキシン標準液のTgが,測定時間以内である。
(c) 得られた検量線について,(5.1)による試験精度の信頼性がある。
(d) LAL溶液を使用した場合の試料溶液のエンドトキシン濃度が,エンドトキシン特異的LAL溶液を
使用した場合の試料溶液のエンドトキシン濃度の75〜125%であるか,又は検量線の最低濃度 (λ2)
以下である。
備考1. (a),(c)又は(d)が満たされなかった場合には,試験は無効とし,新しい試薬を用いるか,
器具を取り替えて再試験を行う。
なお,(c)又は(d)が満たされなかった場合には,更にエンドトキシン標準液を調製し直
す。
(b)が満たされなかった場合には,新しい試薬を用いるか,エンドトキシン標準液を調
製し直すか,器具を取り替えるか,又は測定時間を長くして再試験を行う。
2. LAL溶液を用いないで,エンドトキシン特異的LAL溶液を常用する場合は,(5.2)の試験
を省略することができる。
(5.3) 阻害又は促進作用の確認試験 阻害又は促進作用の程度を確認する。
(5.3.1) 操作 操作は,次のとおりとする。
(a) エンドトキシン検量線作成用として,(4.1)(a)で選んだλ2を最低濃度とする4種類以上のエンドトキ
シン標準液を調製する。
(b) 並列比濁時間分析装置の電源を入れ,測光部の光源及び温度を安定化する。
36
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(c) (5.1.1)で作成した検量線によって,λ2の濃度のエンドトキシン標準液のTgを求め,求めたTgより
長い時間になるように測定時間を設定する。
(d) 全量ピペット2mlを用いて4λ2の濃度のエンドトキシン標準液及び高濃度試料溶液それぞれ2.0ml
を適当な容器にとり,振り混ぜ,検討液Bとする。
なお,高濃度試料溶液が調製できない場合などの検討液Bの調製方法は,これとエンドトキシン
及び試料の濃度が同一となる他の調製方法によってもよい。
(e) 最低8本の試験管にそれぞれ全量ピペット0.1mlを用いて速やかにLAL溶液又はエンドトキシン特
異的LAL溶液を0.10mlずつ入れ,直ちにふたをする。
(f) 各試験管にそれぞれエンドトキシン試験用水,試料溶液,4種類以上の濃度のエンドトキシン標準
液及び(4.1)(h)によって調製した検討液A及び検討液Bをそれぞれ0.10mlずつ,全量ピペット0.1ml
を用いて,(4.1)の本試験操作に従って,各試験管に速やかに加え,直ちにふたをして振り混ぜた後,
並列比濁時間分析装置に取り付けて装置を作動させ,一定の濁度になったときに表示されるTgを
記録する。
(g) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定したTgから,横軸をエンドトキシ
ン濃度の対数値,縦軸をTgの対数値とする検量線を作成する。
検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度におけるTgと最小濃度におけ
るTgとの間である。
(h) 検討液BのTgから検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(i) 検討液AのTgから検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(5.3.2) 判定 次の条件を満足した場合に,試料溶液はエンドトキシン試験に阻害又は促進作用を示さない
ことが確認されたこととする。
(a) エンドトキシン試験用水のTgが,測定時間を超える。
(b) λ2のエンドトキシン標準液のTgが,測定時間以内である。
(c) 得られた検量線について,(5.1)による試験精度の信頼性がある。
(d) 試料溶液のTgがλ2のエンドトキシン標準液のTgより大きい。
(e) 検討液AのTgから求めたエンドトキシン濃度から検討液BのTgから求めたエンドトキシン濃度
を差し引いた値が,2λ2の75〜125%である。
備考 (a)又は(c)が満たされなかった場合には,試験は無効とし,新しい試薬を用いるか,器具を
取り替えて再試験を行う。
なお,(c)が満たされなかった場合には,更にエンドトキシン標準液を調製し直す。
(b)が満たされなかった場合には,新しい試薬を用いるか,エンドトキシン標準液を調製
し直すか,器具を取り替えるか,又は測定時間を長くして再試験を行う。
(e)が満たされなかった場合には,試料溶液を最大有効希釈 (MVD) (46)を超えない範囲で
エンドトキシン試験用水で希釈し,再試験することができる。
注(46) 最大有効希釈は,個別規格に規定されたエンドトキシンの規格値によって決定される値で
ある。
2
C
L
MVD
λ
・
=
ここに, MVD: 最大有効希釈
L: 規格値 (EU/g)
37
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
C: 試料原液の濃度 (g/ml)
λ2: 検量線作成に使用したエンドトキシン標準液の最小濃度
(EU/ml)
(5.4) 対照標準エンドトキシン (CSE) の標準エンドトキシン (RSE) に対する力価標定 対照標準エン
ドトキシンの標準エンドトキシンに対する力価標定は,次のとおりとする。
なお,この力価の評定は,対照標準エンドトキシンのロット及びLALのロットが変わるごとに行
うこととする。
(a) 4.3.1(3)(b)の対照標準エンドトキシン4バイアルと4.3.1(3)(a)標準エンドトキシン1バイアルを,
4.3.1(3)(c)によって溶かす。
(b) 標準エンドトキシンを使用した6種類の濃度のエンドトキシン標準液を4.3.1(3)(d)によって調製し,
それらのTgを(4.1)によって測定する。得られたTgから標準エンドトキシンの検量線を作成する。
この検量線に(5.1)を行って,試験精度の信頼性があることを確認する。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度におけるTgと最小濃度
におけるTgとの間である。
備考 標準エンドトキシン検量線の範囲は,(4.1)の試験で使用する検量線の範囲を含むことが望
ましい。
(c) 対照標準エンドトキシンをエンドトキシン試験用水で2倍段階希釈し,これらのTgを(4.1)によって
測定する。対照標準エンドトキシンの希釈系列から得られたTgのうち,少なくとも3濃度のTgは,
標準エンドトキシンの検量線の範囲に含まれていなければならない。
(d) 対照標準エンドトキシンの希釈系列から得られたTgのうち,標準エンドトキシンの検量線の範囲
に入ったTgから,標準エンドトキシンの検量線を用いてエンドトキシン濃度 (EU/ml) を求め,そ
のエンドトキシン濃度から更に次の式によってEU換算値を計算し,平均値を算出する。
EU換算値の平均値を対照標準物質を相対力価とする。
Eg
Es
Ek=
ここに, Ek: EU換算係数 (EU/ng)
Es: 標準エンドトキシンの検量線を用いて求めたエンドトキシン
濃度 (EU/ml)
Eg: 対照標準エンドトキシンの質量濃度 (ng/ml)
4.3.3
発色合成基質法 発色合成基質法は,次のとおりとする。
参考 LAL中に含まれるエンドトキシン感受性の各種の凝固因子が,エンドトキシンによって順
次活性化する。その結果生成した凝固酵素が,凝固酵素に特異的に反応する発色合成基質
を加水分解し,発色基が遊離する。発色合成基質法は,遊離した発色基量がエンドトキシ
ン量に比例することから,発色基量を吸光度の変化を測定することによってエンドトキシ
ンを定量する方法である。
また,遊離した発色基に化学反応を行ってアゾ色素化合物に誘導し,その色素の吸光度
を測定して定量することもできる。
(1) 水,試薬,溶液,緩衝液,標準物質及び標準液 水,試薬,溶液,緩衝液,標準物質及び標準液は,
4.3.1(1)〜(3)によるもののほか,次のとおりとする。
(a) 発色合成基質溶液 発色基としてp−ニトロアニリンを含む1バイアルの発色合成基質にバイアル
瓶に表示された量のエンドトキシン試験用水を加えて泡立てないように穏やかにかき混ぜて溶かす。
38
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
貯蔵する場合は2〜8℃に保ち,30日間以内に使用する。
(b) エンドトキシン試験用トリス−塩酸緩衝液 (0.2mol/l, pH8.0) JIS K 9704に規定する2−アミノ−
2−ヒドロキシメチル−1,3−プロパンジオール[トリス(ヒドロキシメチル)アミノメタン]24.2g
を三角フラスコ1lにはかりとり,エンドトキシン試験用水約800mlに溶かし,JIS T 7322又はJIS T
7324に規定する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて,121℃で1時間以上処理した後,
25℃まで冷却し,JIS Z 8802に規定するpH計形式IIを用いてエンドトキシン試験用塩酸 (1+10) で
pH8.0に調整する。この液にエンドトキシン試験用水を加えて1lとし,JIS T 7322又はJIS T 7324
に規定する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用いて,121℃で1時間以上処理したもの。
(c) LAL−発色合成基質溶液 発色基としてp−ニトロアニリンを含む1バイアルのLAL−発色合成基
質にバイアル瓶に表示された量のエンドトキシン試験用トリス−塩酸緩衝液 (0.2mol/l, pH8.0) を加
えて泡立てないように穏やかにかき混ぜて溶かす。貯蔵する場合は直ちにドライアイス・エタノー
ルなどの寒剤で急速に凍結後,−20℃以下で保存し,7日間以内に使用する。
参考 トキシカラー,Kinetic-QCLなどがある。
(d) エンドトキシン特異的LAL−発色合成基質 (1→3) −β−D−グルカンとの反応を遮断し,エンド
トキシンと特異的に反応するように調製したLAL−発色合成基質。
参考 エンドスペシーなどがある。
(e) エンドトキシン特異的LAL−発色合成基質溶液 発色基としてp−ニトロアニリンを含む1バイア
ルのエンドトキシン特異的LAL−発色合成基質にバイアル瓶に表示された量のエンドトキシン試
験用トリス−塩酸緩衝液 (0.2mol/l, pH8.0) を加えて泡立てないように穏やかにかき混ぜて溶かす。
貯蔵する場合は直ちにドライアイス・エタノールなどの寒剤で急速に凍結後,−20℃以下で保存し,
7日間以内に使用する。
(f) 反応停止液 JIS K 8355に規定する酢酸に3.2のA3の水を加えて,個別規格で規定する濃度に調製
する。
(2) 装置及び器具 装置及び器具は,4.3.1(4)によるもののほか,次のとおりとする。
(a) 反応容器(試験管など) エンドトキシン定量用の容器[例えば,内径約10mm,長さ約75mmの
ガラス試験管(アルミニウム製のふた付き)]。反応容器は3.7(4)によって洗浄し,アルミニウム製
のふたは非イオン性界面活性剤,水道水,エンドトキシン試験用水で順次洗い,更にそれらの反応
容器及びふたを3.8(2)のエンドトキシンの不活化を行ったもの。
(3) 試料溶液及び高濃度試料溶液の調製 試料溶液及び高濃度試料溶液の調製は,4.3.1(5)による。この場
合,高濃度試料溶液の調製には試料溶液の2倍量の試料を用いる。ただし,試料が溶けない場合は調
製しない。
(4) 本試験 (5)のそれぞれの予備試験をあらかじめ行い,発色合成基質法が十分な精度をもち,有効に実
施できることを確認した後,本試験を行う。
なお,本試験は2回以上の繰返し試験を行い,測定結果はそれらの平均値とする。
(4.1) 操作 操作は,JIS K 0115によるほかは,次のとおりとする。
(a) 表5に示す標準液D〜Kのうちから,エンドトキシン検量線作成用標準液として,連続する4種類
のエンドトキシン標準液を選ぶ。このとき,規格値に相当するエンドトキシン濃度が,選んだエン
ドトキシン標準液の最小濃度より大きく,最大濃度より小さくなければならない。
なお,選択したエンドトキシン標準液の濃度を低いものから順に,λ2,2λ2,4λ2,8λ2とする。
(b) 氷水中で冷却した反応容器7個 (A) , (B) , (C) , (D) , (E) , (F) 及び (G) にそれぞれ全量ピペット
39
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
0.1mlを用いて速やかにLAL溶液及び発色合成基質溶液又はLAL−発色合成基質溶液0.10mlずつを
はかりとり,直ちにふたをする。
(c) 反応容器 (A) に,全量ピペット0.1mlを用いて試料溶液0.10mlを加え,直ちにふたをする。
(d) (a)で選択した4種類の検量線作成用各標準液0.10mlずつを各反応容器 (B) 〜 (E) に全量ピペット
0.1mlを用いて速やかに加え,直ちにふたをする。
(e) 反応容器 (F) に全量ピペット0.1mlを用いて速やかにエンドトキシン試験用水0.10mlを加え,直ち
にふたをする。
(f) 全量ピペット2mlを用いて8λ2の濃度のエンドトキシン標準液及び高濃度試料溶液それぞれ2.0ml
を適当な容器にとり,振り混ぜ,検討液Aとする。
なお,高濃度試料溶液が調製できない場合などの検討液Aの調製方法は,これとエンドトキシン
及び試料の濃度が同一となる他の調製法によってもよい。
(g) 反応容器 (G) に全量ピペット0.1mlを用いて速やかに検討液A0.10mlを加え,直ちにふたをする。
(h) 各反応容器を振り混ぜた後,温度37±0.5℃の恒温水槽に個別規格で規定する時間放置する。
(i) 各反応容器を直ちに氷水中に移し,個別規格で規定する量の反応停止液を加えて反応を停止する。
(j) エンドトキシン試験用水を対照とし,405nmの吸光度を測定する。
なお,試料溶液中に黄褐色系色素などを含む場合は,(h)の操作後,直ちにJIS K 8197の4.(試験
方法)(c)(鋭敏度)に準じてジアゾカップリング反応を行い,生成したアゾ色素を,エンドトキシ
ン試験用水を対照として545nmの吸光度を測定する。
(k) 反応容器 (B) 〜 (E) の4種類のエンドトキシン標準液のそれぞれのエンドトキシン濃度と測定し
た吸光度から,検量線を作成する。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度における吸光度と最小濃
度における吸光度との間である。
(l) 試料溶液を加えた反応容器 (A) から得られた吸光度から検量線を用いてエンドトキンン濃度
(EU/ml) を求める。
(m) 反応容器 (G) の検討液Aから得られた吸光度から検量線を用いてエンドトキシン濃度 (EU/ml) を
求める。
備考 あらかじめ毎回の試験で一定の検量線が得られることが確認されている場合には,試験の
都度検量線を作成する必要はない。その場合には標準液4λ2を調製し,その吸光度を測定
する。測定した吸光度から,あらかじめ得られている検量線を用いて,エンドトキシン濃
度 (λm) を求める。この場合,λmが4λ2の75〜125%でなければならない。
(n) 試料のエンドトキシン含有量を,次の式によって算出する。
C
Em
Ec=
ここに,
Ec: 試料のエンドトキシン含有量 (EU/g)
Em: 試料溶液のエンドトキシン濃度 (EU/ml)
C: 試料溶液の濃度 (g/ml)
(4.2) 判定 判定は,次の条件をすべて満足した場合を合格とし,それ以外を不合格とする。
(a) エンドトキシン試験用水の吸光度がλ2の濃度の検量線作成用エンドトキシン標準液の吸光度より小
さい。
(b) 得られた検量線について,(5.1)による試験精度の信頼性がある。
40
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(c) 検討液Aの吸光度から求めたエンドトキシン濃度から,試料溶液の吸光度から求めたエンドトキシ
ン濃度を差し引いた値が,4λ2の75〜125%である。
(d) 試料のエンドトキシン含有量が個別規格に規定する規格値以下である。
備考 (a)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン標準液を
選び直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
(b)又は(c)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン
標準液を調製し直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
(5) 予備試験 試験が十分に有効に実施できるか否かを確認するため,JIS K 0115によるほかは,次のと
おり行う。
なお,予備試験は2回以上の繰返し試験を行い,測定結果はそれらの平均値とする。
備考 本試験を予備試験の後,速やかに行うことが必要な場合は,予備試験は本試験と同時に行うこ
とができる。例えば,本試験の一部(検量線の作成操作)を予備試験とみなすことができる。
(5.1) 試験精度の確認試験 試験精度の確認は,試験環境,試験者などの適正を評価する場合,又は新し
いロットのLAL及び発色合成基質若しくはLAL−発色合成基質を使用する場合に,次のとおり行
う。
(5.1.1) 操作 操作は,次のとおりとする。
(a) 氷水中で冷却した最低5個の反応容器にそれぞれ全量ピペット0.1mlを用いて速やかにLAL溶液及
び発色合成基質溶液又はLAL−発色合成基質溶液0.10mlをはかりとり,直ちにふたをする。
(b) エンドトキシン試験用水,(4.1)(a)で選択したエンドトキシン濃度λ2を含む4種類以上の濃度の検量
線作成用のエンドトキシン標準液をそれぞれ0.10mlずつ,全量ピペット0.1mlを用いて,(4.1)の本
試験操作に従って,各反応容器に速やかに加え,(4.1)(h)〜(j)によって,吸光度を測定する。
(c) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定した吸光度からJIS K 0115の8.1
(検量線法)によって検量線を作成し,次の式によって検量線の相関係数 (r) を求める。
SxSy
n
n
y
x
xy
n
r
)1
(−
=∑
∑∑
−
ここに,
r: 相関係数
n: プロット数
x: エンドトキシン濃度 (EU/ml)
y: 吸光度
Sx: xの標準偏差
Sy: yの標準偏差
(5.1.2) 判定 判定は,次のとおりとする。
相関係数 (r) が0.98以下であるとき,試験精度の信頼性が確認されたこととする。
なお,相関係数が0.98未満の場合は,試験精度を向上する努力をした上で,再試験を行う。
(5.2) (1→3) −β−D−グルカン含有の有無に関する確認試験 試料中に (1→3) −β−D−グルカンを含
有しているか否かを確認し,エンドトキシンに特異的に反応するエンドトキシン特異的LAL−発色
合成基質を用いるかどうかを明らかにする。
(5.2.1) 操作 操作は,JIS K 0115によるほかは,次のとおりとする。
(a) エンドトキシン検量線作成用として,(4.1)(a)で選択したλ2を最低濃度とする4種類以上のエンドト
キシン標準液を調製する。
(b) 氷水中で冷却した最低6個の反応容器に全量ピペット0.1mlを用いて速やかにLAL溶液及び発色合
41
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
成基質溶液又はLAL−発色合成基質溶液0.10mlをはかりとり,直ちにふたをする。
(c) エンドトキシン試験用水,試料溶液,4種類以上の濃度のエンドトキシン標準液0.10mlずつを,全
量ピペット0.1mlを用いて,(4.1)の本試験操作に従って,各反応容器に速やかに加え,(4.1)(h)〜(j)
によって,吸光度を測定する。
(d) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定した吸光度から,検量線を作成す
る。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度における吸光度と最小濃
度における吸光度との間である。
(e) 試料溶液の吸光度から検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(f) (a)〜(e)の操作を,LAL溶液及び発色合成基質溶液又はLAL−発色合成基質溶液に替えてエンドト
キシン特異的LAL−発色合成基質溶液を用いて行う。
(5.2.2) 判定 次の条件を満足しなかった場合には,試料中に (1→3) −β−D−グルカンが含有される可能
性があると判断されるため,(4.1)の操作は,LAL溶液及び発色合成基質溶液又はLAL−発色合成基
質溶液に替えてエンドトキシン特異的LAL−発色合成基質溶液を使用する。
(a) エンドトキシン試験用水の吸光度がλ2の濃度の検量線作成用エンドトキシン標準液の吸光度より小
さい。
(b) 得られた検量線について,(5.1)による試験精度の信頼性がある。
(c) LAL溶液及び発色合成基質溶液又はLAL−発色合成基質溶液を使用した場合の試料溶液のエンド
トキシン濃度が,エンドトキシン特異的LAL−発色合成基質溶液を使用した場合の試料溶液のエン
ドトキシン濃度の75〜125%であるか,又は検量線の最低濃度 (λ2) 以下である。
備考1. (a)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン標準液
を選び直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
(b)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン標準
液を調製し直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
2. LAL溶液及び発色合成基質溶液又はLAL−発色合成基質溶液を用いないで,エンドトキ
シン特異的LAL−発色合成基質溶液を常用する場合は,(5.2)の試験を省略することがで
きる。
(5.3) 阻害又は促進作用の確認試験 阻害又は促進作用の程度を確認する。
(5.3.1) 操作 操作は,JIS K 0115によるほかは,次のとおりとする。
(a) エンドトキシン検量線作成用として,(4.1)(a)で選択したエンドトキシン濃度λ2を最低濃度とする4
種類以上のエンドトキシン標準液を調製する。
(b) 全量ピペット2mlを用いて4λ2の濃度のエンドトキシン標準液及び高濃度試料溶液それぞれ2.0ml
を適当な容器にとり,振り混ぜ,検討液Bとする。
なお,高濃度試料溶液が調製できない場合などの検討液Bの調製法は,これとエンドトキシン及
び試料の濃度が同一となる他の調製法によってもよい。
(c) 氷水中で冷却した最低8個の反応容器にそれぞれ全量ピペット0.1mlを用いて速やかにLAL溶液及
び発色合成基質溶液又はLAL−発色合成基質溶液0.10mlずつをはかりとり,直ちにふたをする。
(d) 各容器にそれぞれエンドトキシン試験用水,試料溶液,4種類以上の濃度のエンドトキシン標準液,
及び(4.1)(f)によって調製した検討液A及び検討液Bを0.10mlずつ,全量ピペット0.1mlを用いて,
(4.1)の本試験の操作に従って,各反応容器に速やかに加え,(4.1)(h)〜(j)によって,吸光度を測定す
42
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る。
(e) 4種類以上のエンドトキシン標準液のエンドトキシン濃度と測定した吸光度から,検量線を作成す
る。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度における吸光度と最小濃
度における吸光度との間である。
(f) 検討液Bの吸光度から検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(g) 検討液Aの吸光度から検量線を用いてエンドトキシン濃度 (EU/ml) を求める。
(5.3.2) 判定 次の条件を満足した場合に,試料溶液はエンドトキシン試験に阻害又は促進作用を示さない
ことが確認されたこととする。
(a) エンドトキシン試験用水の吸光度がλ2の濃度の検量線作成用エンドトキシン標準液の吸光度より小
さい。
(b) 得られた検量線について,(5.1)による試験精度の信頼性がある。
(c) 試料溶液の吸光度がλ2のエンドトキシン標準液の吸光度より小さい。
(d) 検討液Aの吸光度から求めたエンドトキシン濃度から,検討液Bの吸光度から求めたエンドトキシ
ン濃度を差し引いた値が,2λ2の75〜125%である。
備考 (a)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン標準液を
選び直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
(b)が満たされなかった場合には,試験は無効とし,検量線作成用エンドトキシン標準液
を調製し直すか,新しい試薬を用いるか,又は器具を取り替えて再試験を行う。
(d)が満たされなかった場合には,試料溶液を最大有効希釈 (MVD) (45)を超えない範囲で
エンドトキシン試験用水で希釈し,再試験することができる。
(5.4) 対照標準エンドトキシン (CSE) の標準エンドトキシン (RSE) に対する力価標定 対照標準エン
ドトキシンの標準エンドトキシンに対する力価標定は,次のとおりとする。
なお,この力価の標定は,対照標準エンドトキシンのロット,LALのロット,発色合成基質のロ
ット又はLAL−発色合成基質のロットが変わるごとに行うこととする。
(a) 4.3.1(3)(b)の対照標準エンドトキシン4バイアルと4.3.1(3)(a)の標準エンドトキシン1バイアルを,
4.3.1(3)(c)によって溶かす。
(b) 標準エンドトキシンを使用した6種類の濃度のエンドトキシン標準液を4.3.1(3)(d)によって調製し,
それらの吸光度を(4.1)によって測定する。得られた吸光度から標準エンドトキシンの検量線を作成
する。この検量線について(5.1)を行って,試験精度の信頼性があることを確認する。
なお,検量線の有効範囲は,使用したエンドトキシン標準液の最大濃度における吸光度と最小濃
度における吸光度との間である。
備考 標準エンドトキシン検量線の範囲は,(4.1)の試験で使用する検量線の範囲を含むことが望
ましい。
(c) 対照標準エンドトキシンをエンドトキシン試験用水で2倍段階希釈し,(4.1)によって吸光度を求め
る。対照標準エンドトキシンの希釈系列から得られた吸光度のうち,少なくとも3濃度の吸光度は,
標準エンドトキシンの検量線の範囲に含まれていなければならない。
(d) 対照標準エンドトキシンの希釈系列から得られた吸光度のうち,標準エンドトキシンの検量線の範
囲に入った吸光度から,標準エンドトキシンの検量線を用いてエンドトキシン濃度 (EU/ml) を求め,
そのエンドトキシン濃度から更に次の式によってEU換算係数 (EU/ng) を計算し,平均値を算出す
43
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る。
EU換算係数の平均値を対照標準物質の相対力価とする。
Eg
Es
Ek=
ここに, Ek: EU換算係数 (EU/ng)
Es: 標準エンドトキシンの検量線を用いて求めたエンドトキシン
濃度 (EU/ml)
Eg: 対照標準エンドトキシンの質量濃度 (ng/ml)
4.4
パイロジェン試験 パイロジェン試験は,試料中の発熱性物質の有無を家と(兎)を用いて検定す
る方法である。
参考 第十二改正日本薬局方発熱性物質試験法がある。
(1) 試験動物 体重1.5kg以上の栄養状態のよい健康な家と(兎)で,使用前1週間以上は一定飼料で飼
育し,体重の減少をみなかったものを試験動物として使用する。
備考 試験に用いた家と(兎)を再び使用するには,休養期間をできるだけ長くし,また,発熱性物
質陽性と判定された試験に用いた家と(兎)は,再び使用しない。
試験動物は,試験前1〜3日間,2時間ごとに体温を4回測定する。この期間,試験動物1匹
ずつをおりに入れ,できるだけ興奮しないようにし,試験日には特に注意する。
室温は,試験前48時間以上及び試験中の温度を20〜27℃で,なるべく恒湿に保つ。
(2) 水
(a) エンドトキシン試験用水4.3.1(1)(a)による。
(3) 試薬 調製した後,JIS T 7322又はJIS T 7324に規定する高圧蒸気滅菌装置又は高圧蒸気滅菌器を用
いて121℃で,20分間処理したものを用いる。
(a) パイロジェン試験用水酸化ナトリウム溶液 (0.1mol/l) JIS K 8576に規定する水酸化ナトリウム
4.3gを三角フラスコ1lにはかりとり,エンドトキシン試験用水を加えて溶かして1lとし,振り混
ぜる。
(b) パイロジェン試験用塩酸 (0.1 mol/l) JIS K 8180に規定する塩酸9.0mlを三角フラスコ1lに入れ,
エンドトキシン試験用水をかき混ぜながら加えて1lとし,振り混ぜる。
(c) 生理食塩水 JIS K 8150に規定する塩化ナトリウム9gを三角フラスコ1lにはかりとり,エンドト
キシン試験用水を加えて溶かして1lとし,振り混ぜる。
参考 第十二改正日本薬局方の生理食塩液を用いてもよい。
(4) 装置及び器具 装置及び器具は,次のとおりとする。
(a) 温度計 直腸体温計又はこれと同等以上の感度の自動体温測定装置を用いる。ただし,あらかじめ,
試験動物の直腸体温測定に必要な時間を設定する。
(b) 恒温槽 槽内の温度を37±0.5℃に保つことができるもの。
(c) 器具類の滅菌 試験に用いるガラス器具,容器,注射筒,注射針などは,あらかじめ,250℃で30
分間以上加熱して発熱性物質を除く。
(5) 試験用量
(a) 試料の投与量は,個別規格に規定する。
(b) 試料の溶解に用いる溶媒は,個別規格に規定するもののほか,生理食塩水を用いる。必要な場合に
は,パイロジェン試験用水酸化ナトリウム溶液 (0.1mol/l) 又はパイロジェン試験用塩酸 (0.1mol/l)
44
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
を用いてpHを5〜8に調整する。
(6) 操作 操作は,次のとおり行う。
(a) 試験は,試験動物が入れられていた部屋と同一温度及び湿度の部屋で行う。
(b) 試験動物は,通常,適当な固定器に固定する。
(c) 直腸体温測定は,温度計を直腸内に60〜90mmの範囲内で一定の深さに十分な時間挿入した後,読
み取る。
(d) 1回体温測定の数時間前から,その日の最終体温測定まで飼料を与えない。
(e) 試料の注射前,体温を1時間間隔で3回測定し,第2回及び第3回の測定体温が,ほとんど一致し
たとき,第3回の値を対照体温とする。第2回及び第3回の測定体温が,一致しない場合,又は一
致してもその値が39.8℃を超えるときは,その試験動物を試験から除外する。
(f) 試料は37℃の恒温槽に30分間入れた後,第3回の体温を測定し,15分間以内に,耳静脈に注射す
る。
(g) エンドトキシン試験用水を除く他の低張な薬液には,必要な場合には試験する前に,発熱性物質を
含まない塩化ナトリウムを加えて等張としてもよい。
(h) 注射後の体温測定は,注射後1時間間隔で3回行う。対照体温と最高体温との差を体温上昇とする。
(7) 判定 判定は,次のとおりとする。
(a) 第1回の試験には,試験動物3匹を用いる。注射後の体温上昇0.6℃以上の試験動物が2匹又は3
匹のときは,発熱性物質陽性と判定する。
また,体温上昇0.6℃以上の試験動物が1匹であるとき,又は3匹の体温上昇の合計が1.4℃を超
えるときは,更に試験を行う。
(b) 第2回の試験には試験動物5匹を用い,体温上昇0.6℃以上の試験動物が2匹以上のときは,発熱性
物質陽性と判定する。
5. 容器及び荷姿 製品の容器及び荷姿は,次のとおりとする。
品質保持のため必要な場合には,材質,形状,遮光包装及び搬送中の温度管理のために保冷包装を施す
ことなどを記載する(47)。
注(47) 遮光が必要な物質には,光の影響を防止できる容器(例えば,褐色瓶など)を用いるか又は光
の影響を防止できる材料(例えば,黒色紙など)で容器を包装する。
また,保冷など温度管理が必要な物質には,搬送中,保冷ができる容器などでこん(梱)包
(例えば,発泡スチロール製容器など)して保護する。
5.1
密閉容器 日常の取扱い又は保存の間に,ごみなどの固形異物の混入が起こらないように閉じるこ
とができる容器(例えば,紙箱,紙袋,ポリエチレン袋など)。
5.2
気密容器 日常の取扱い又は保存の間に,固体及び液体の侵入などが起こらないように閉じること
のできる容器(例えば,ガラス瓶,ポリエチレン瓶,缶,熱封して用いる場合のポリエチレン袋など)。
5.3
密封容器 日常の取扱い又は保存の間に,固体,液体及び気体が侵入することのない容器(例えば,
アンプルなど)。
6. 保存方法 品質保存のための保存条件として,保存温度,換気,遮光措置など必要事項を規定する。
45
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
7. 取扱い上の注意事項 取扱い上の注意事項として,物質に応じて使用目的,使用方法,保存期間,安
定性など必要事項を規定する。
8. 表示 容器には,次の事項を表示する。ただし,物質に応じて表示項目の採択を個別規格で規定する。
なお,表示するとき,容器への表示が困難な場合は,個装外面への表示又は内封(添付)することがで
きる。
(1) 名称 規格の名称及び“試薬”の文字を付記する。
(2) 化学式及び式量
(3) 品質 物質によっては,実測値で示すことが必要な項目(例 酵素の活性値及び単位の定義など)
(4) 添加剤の名称及び量
(5) 内容量 正味容量又は正味質量
(6) 製造番号
(7) 製造年月
(8) 有効期間 有効期限を表示したときは,製造年月は省略してもよい。
(9) 製造業者名又は販売業者名
(10) 保存方法
(11) 取扱い上の注意事項
(12) 取扱説明書
例
・ 物理化学的性状(例えば,酵素の熱安定性,pH安定性など)
・ 反応特性(反応阻害物質など)
・ 溶解調製方法
・ 毒性作用
・ 参考文献
・ 問合せ先
46
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
付表1 引用規格
JIS B 9920 クリーンルーム中における浮遊微粒子の濃度測定方法及びクリーンルームの空気清浄度
の評価方法
JIS B 9922 クリーンベンチ
JIS H 6201 化学分析用白金るつぼ
JIS H 6202 化学分析用白金皿
JIS H 6203 化学分析用白金ボート
JIS K 0050 化学分析方法通則
JIS K 0063 化学製品の旋光度測定方法
JIS K 0114 ガスクロマトグラフ分析のための通則
JIS K 0115 吸光光度分析通則
JIS K 0116 発光分光分析方法通則
JIS K 0117 赤外分光分析方法通則
JIS K 0120 蛍光光度分析方法通則
JIS K 0121 原子吸光分析のための通則
JIS K 0122 イオン電極方法通則
JIS K 0124 高速液体クロマトグラフ分析のための通則
JIS K 0127 イオンクロマトグラフ分析通則
JIS K 0551 超純水中の有機体炭素 (TOC) 試験方法
JIS K 0552 超純水の電気伝導率試験方法
JIS K 0553 超純水中の金属元素試験方法
JIS K 0555 超純水中のシリカ試験方法
JIS K 0556 超純水中の陰イオン試験方法
JIS K 0970 プッシュボタン式液体用微量体積計
JIS K 3600 バイオテクノロジー用語
JIS K 3605 高圧蒸気滅菌操作通則
JIS K 7117 液状の樹脂の回転粘度計による粘度試験方法
JIS K 8001 試薬試験方法通則
JIS K 8005 容量分析用標準物質
JIS K 8150 塩化ナトリウム(試薬)
JIS K 8180 塩酸(試薬)
JIS K 8197 N-1−ナフチルエチレンジアミン二塩酸塩(試薬)
JIS K 8355 酢酸(試薬)
JIS K 8528 しゅう酸ナトリウム(試薬)
JIS K 8541 硝酸(試薬)
JIS K 8550 硝酸銀(試薬)
JIS K 8576 水酸化ナトリウム(試薬)
JIS K 8783 二硫酸カリウム(試薬)
JIS K 8951 硫酸(試薬)
47
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS K 8972 硫酸水素カリウム(試薬)
JIS K 9704 2−アミノ−2−ヒドロキシメチル−1,3−プロパンジオール[トリス(ヒドロキシメチ
ル)アミノメタン](試薬)
JIS T 7322 医療用高圧蒸気滅菌装置
JIS T 7324 医療用小形高圧蒸気滅菌器
JIS Z 8703 試験場所の標準状態
JIS Z 8802 pH測定方法
JIS Z 8803 液体の粘度−測定方法
関連規格 第十二改正日本薬局方
国際生化学連合 酵素委員会報告又は勧告[第1回,1961年報告:第2回,1964年勧告:第3
回,1972年勧告:第4回(1978年)]
国際純正及び応用化学連合 (International Union Pure and Applied Chemistry) (略称:IUPAC)
国際生化学連合 (International Union of Biochemistry) (略称:IUB)
生化学命名委員会勧告 (1980) [IUPAC-IUB/JCBN The (or joint) Commission on Biochemical
Nomenclature]
国立予防衛生研究所 病原体等安全管理規程(昭和56年11月5日国立予防衛生研究所決定,
昭和58年3月24日改正)
“組換えDNA実験指針”(昭和54年8月27日内閣総理大臣決定,昭和62年9月16日改訂)
放射性同位元素等による放射線障害の防止に関する法律(昭和32年6月10日法律第167号)
48
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS K 8008 原案作成委員会 構成表
氏名
所属
(委員長)
奥 山 典 生
東京都立大学
(委員)
桑 克 彦
筑波大学医療技術短期大学
梅 田 誠
横浜市立大学木原生物研究所
増 田 優
通商産業省基礎産業局
細 川 幹 夫
工業技術院標準部
田 中 秀 興
工業技術院微生物工業技術研究所
川 瀬 晃
工業技術院化学技術研究所
喜多川 忍
通商産業省通商産業検査所
武 田 寧
国立衛生試験所
佐々木 堯
農林水産省食品総合研究所
大 野 忠 夫
理化学研究所
野 原 和 夫
財団法人化学品検査協会
三 木 敬三郎
東燃株式会社
角 田 勝
三菱化成株式会社
塚 本 徹
味の素株式会社
河 崎 忠 好
ファルマシア・バイオシステムズ株式会社
堀 尾 武 一
オリエンタル酵母工業株式会社
藤 島 鉄 郎
ヤマサ醤油株式会社
竹 内 幸 夫
和光純薬工業株式会社
木 幡 守
協和醗酵工業株式会社
(事務局)
古 寺 武 利
財団法人バイオインダストリー協会
瀬 下 美和子
財団法人バイオインダストリー協会
第1分科会 構成表
氏名
所属
(分科会長)
河 崎 忠 好
ファルマシア・バイオシステムズ株式会社
喜多川 忍
通商産業省通商産業検査所
宗 像 豊 克
協和醗酵工業株式会社
友 末 保 幸
関東化学株式会社
倉 橋 嘉 治
コスモバイオ株式会社
高 野 虞美子
東京化成工業株式会社
(事務局)
古 寺 武 利
財団法人バイオインダストリー協会
瀬 下 美和子
財団法人バイオインダストリー協会
第2分科会 構成表
氏名
所属
(分科会長)
竹 内 幸 夫
和光純薬工業株式会社
(A-WG主査)
田 中 秀 興
工業技術院微生物工業技術研究所
塚 本 徹
味の素株式会社
君 塚 房 夫
宝酒造株式会社
川 上 文 清
東洋紡績株式会社
(B-WG主査)
末 広 健
日本バイオ・ラット・ラボラトリーズ株式会社
田 村 嘉 治
日本理化学薬品株式会社
藤 島 鉄 郎
ヤマサ醤油株式会社
(事務局)
古 寺 武 利
財団法人バイオインダストリー協会
瀬 下 美和子
財団法人バイオインダストリー協会
49
K 8008-1992
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
第3分科会 構成表
氏名
所属
(分科会長)
竹 内 幸 夫
和光純薬工業株式会社
(A-WG主査)
井 上 肇
ナカライテスク株式会社
斉 藤 幹 彦
株式会社同仁化学研究所
河 崎 忠 好
ファルマシア・バイオシステムズ株式会社
(B-WG主査)
川 崎 浩之進
国立衛生試験所
桑 原 樹 義
生化学工業株式会社
鈴 木 喜久次
第一化学薬品株式会社
西 村 紀 之
田辺製薬株式会社
(事務局)
古 寺 武 利
財団法人バイオインダストリー協会
瀬 下 美和子
財団法人バイオインダストリー協会








