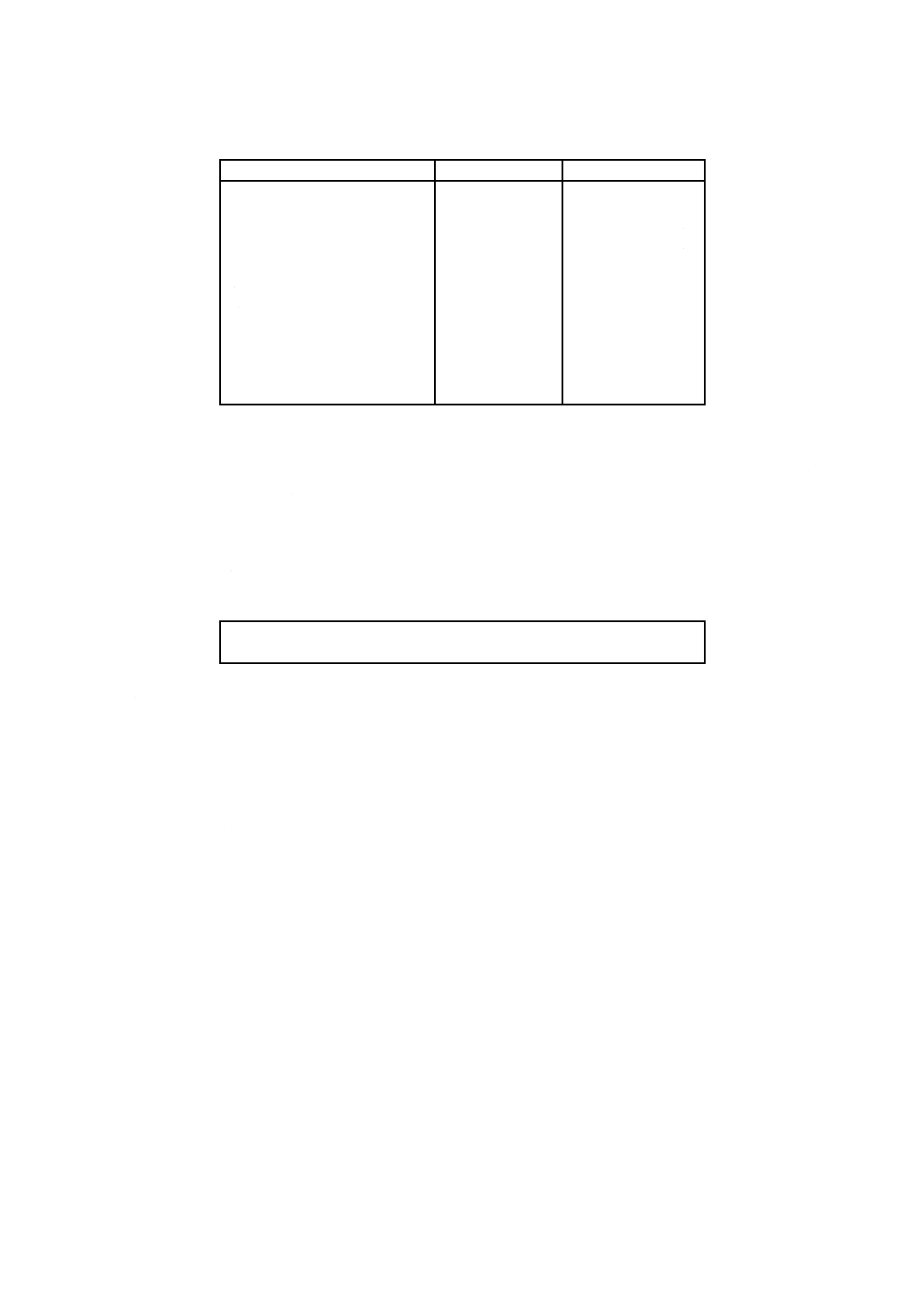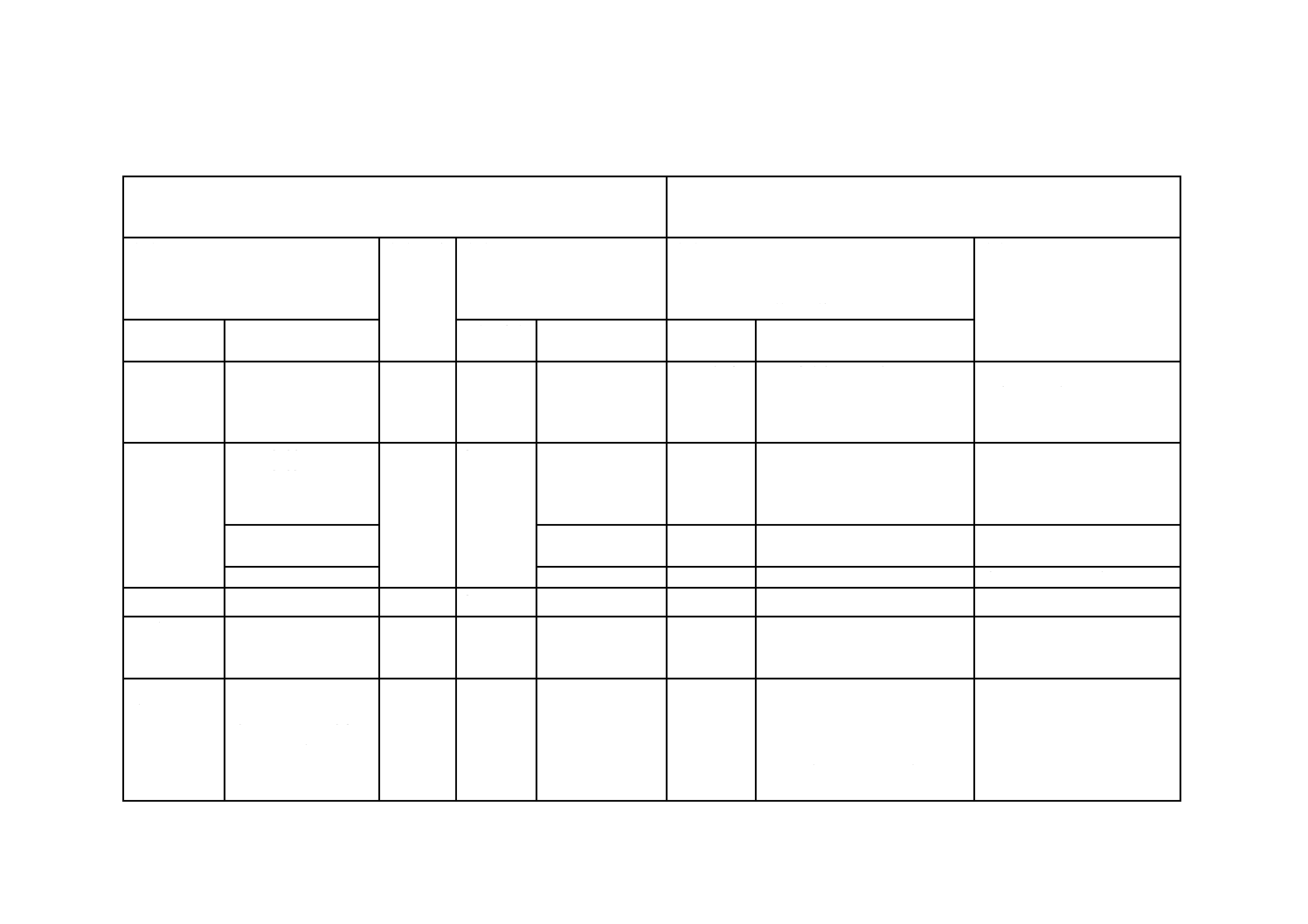K 3703-3:2008
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,財団法人バイオインダストリー協会(JBA)及
び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日
本工業標準調査会の審議を経て,経済産業大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に
抵触する可能性があることに注意を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許
権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に係る確認について,責任は
もたない。
JIS K 3703の規格群には,次に示す部編成がある。
JIS K 3703-1 第1部:ベアード・パーカー寒天培地
JIS K 3703-2 第2部:ウサギ血しょう(漿)フィブリノーゲン寒天培地
JIS K 3703-3 第3部:低菌数の検出法及び最確数(MPN)法による生菌数測定法
K 3703-3:2008
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 1
3. 定義 ······························································································································ 2
4. 一般原則 ························································································································ 2
4.1 検出法 ························································································································· 2
4.2 生菌数測定法 ················································································································ 3
5. 希釈液及び培地 ··············································································································· 3
5.1 希釈液 ························································································································· 3
5.2 改変Giolitti-Cantoniブロス(ブイヨン又は液体培地) ·························································· 3
5.3 寒天溶液 ······················································································································ 5
5.4 ベアード・パーカー選択寒天培地······················································································ 5
5.5 ウサギ血しょうフィブリノーゲン寒天培地 ·········································································· 6
5.6 ブレインハートインフュージョン(BHI)ブロス(ブイヨン又は液体培地) ····························· 6
5.7 ウサギ血しょう ············································································································· 7
6. 装置及び器具 ·················································································································· 7
6.1 細菌培養器 ··················································································································· 7
6.2 乾燥キャビネット又は乾燥器···························································································· 7
6.3 シャーレ ······················································································································ 7
6.4 白金線 ························································································································· 7
6.5 白金耳 ························································································································· 7
6.6 試験管 ························································································································· 7
6.7 目盛付きピペット(メスピペット) ··················································································· 7
6.8 ウォーターバス ············································································································· 7
6.9 薬さじ ························································································································· 7
6.10 嫌気ジャー ·················································································································· 7
7. サンプリング方法 ············································································································ 7
8. 試料の調製 ····················································································································· 7
9. 手順 ······························································································································ 7
9.1 検出法 ························································································································· 8
9.2 生菌数測定法 ················································································································ 8
9.3 平板の選択及び判定 ······································································································· 8
10. 試験結果の表現 ············································································································ 10
10.1 検出法 ······················································································································· 10
10.2 生菌数測定法 ·············································································································· 10
K 3703-3:2008 目次
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
11. 精度 ··························································································································· 10
12. 試験報告書 ·················································································································· 10
参考文献 ···························································································································· 11
附属書(参考)JISと対応する国際規格との対比表 ···································································· 12
K 3703-3:2008
(4)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
白 紙
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 3703-3:2008
コアグラーゼ陽性ブドウ球菌(黄色ブドウ球菌など)
の菌数測定方法−第3部:低菌数の検出法及び
最確数(MPN)法による生菌数測定法
Horizontal method for the enumeration of coagulase-positive staphylococci
(Staphylococcus aureus and other species)-Part 3: Detection and MPN
technique for low numbers
序文 この規格は,2003年に第1版として発行されたISO 6888-3,Microbiology of food and animal feeding
stuffs−Horizontal method for the enumeration of coagulase-positive staphylococci (Staphylococcus aureus and
other species)−Part 3: Detection and MPN technique for low numbersを翻訳し,技術的内容を変更して作成し
た日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,原国際規格を変更している事項である。変更の一覧
表をその説明を付けて,附属書(参考)に示す。
1. 適用範囲 この規格は,コアグラーゼ陽性ブドウ球菌用培地を用いて低菌数のコアグラーゼ陽性ブド
ウ球菌(黄色ブドウ球菌及びその他の種)を検出する方法について規定する。この規格で用いる試料は,
食品,動物用飼料及び食品を製造若しくは取り扱う現場の環境試料とする。
備考1. この規格は,当該ブドウ球菌がストレスを受けて,その数が少ないと予想される乾燥試料な
どに利用できる。コアグラーゼ陽性ブドウ球菌は,主に黄色ブドウ球菌(Staphylococcus
aureus)であるが,Staphylococcus intermedius,Staphylococcus hyicus,Staphylococcus delphini,
Staphylococcus schleiferiなどの一部の菌株もコアグラーゼを産生する。
2. この規格の対応国際規格を,次に示す。
なお,対応の程度を表す記号は,ISO/IEC Guide 21に基づき,IDT(一致している),MOD
(修正している),NEQ(同等でない)とする。
ISO 6888-3:2003,Microbiology of food and animal feeding stuffs−Horizontal method for the
enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species)−
Part 3: Detection and MPN technique for low numbers (MOD)
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3701 培地の試験方法−通則
備考 ISO 7218:1996,Microbiology of food and animal feeding stuffs−General rules for microbiological
examinations及びAMENDMENT 1:2001からの引用事項は,この規格の該当事項と同等であ
2
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
る。
JIS K 3702 培地の試験方法−試料懸濁液及び希釈系列の調製方法
備考 ISO 6887-1:1999,Microbiology of food and animal feeding stuffs−Preparation of test samples,
initial suspension and decimal dilutions for microbiological examination−Part 1: General rules for
the preparation of the initial suspension and decimal dilutionsからの引用事項は,この規格の該当
事項と同等である。
JIS K 3703-1 コアグラーゼ陽性ブドウ球菌(黄色ブドウ球菌など)の菌数測定方法−第1部:ベア
ード・パーカー寒天培地
備考 ISO 6888-1:1999,Microbiology of food and animal feeding stuffs−Horizontal method for the
enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species) −Part 1:
Technique using Baird-Parker agar mediumからの引用事項は,この規格の該当事項と同等であ
る。
JIS K 3703-2 コアグラーゼ陽性ブドウ球菌(黄色ブドウ球菌など)の菌数測定方法−第2部:ウサ
ギ血しょう(漿)フィブリノーゲン寒天培地
備考 ISO 6888-2:1999, Microbiology of food and animal feeding stuffs−Horizontal method for the
enumeration of coagulase-positive staphylococci (Staphylococcus aureus and other species)−Part 2:
Technique using rabbit plasma fibrinogen agar mediumからの引用事項は,この規格の該当事項と
同等である。
JIS K 8008 生化学試薬通則
ISO/TS 11133-2:2003 Microbiology of food and animal feeding stuffs−Guidelines on preparation and
production of culture media−Part 2: Practical guidelines on performance testing of culture media
3. 定義 この規格で用いる主な用語の定義は,JIS K 3701,JIS K 3702,JIS K 3703-1,JIS K 3703-2,
JIS K 8008によるほか,次による。
3.1
コアグラーゼ陽性ブドウ球菌(coagulase-positive staphylococci) 選択培地上に定形及び/又は非定
形コロニーを形成し,コアグラーゼ反応陽性反応又はウサギ血しょうフィブリノーゲン寒天培地上でウサ
ギ血しょうに特異的凝集反応を示す細菌。
備考 この規格では,強いコアグラーゼ陽性反応によって,コアグラーゼ陽性ブドウ球菌の確認を行
っているが,コアグラーゼ陽性ブドウ球菌にはコアグラーゼ陽性反応が弱い菌株があることが
確認されている。これらの弱陽性の菌株は他の細菌と混同される可能性があるが,耐熱性ヌク
レアーゼ産生性などの追加試験を行うことによって鑑別できる。
3.2
コアグラーゼ陽性ブドウ球菌の計数(enumeration of coagulase-positive staphylococci) 試料1 ml又
は1 g中のコアグラーゼ陽性ブドウ球菌数は,JIS K 3703-2に規定する方法に従って求める。
3.3
精製水 JIS K 8008の3.2に規定するA2の水。
備考 これを超える精製度のものを使用することに関しては制限しない。滅菌水は,イオン交換水の
品質以上のものを乾熱滅菌若しくは蒸気滅菌又はフィルターでろ過し除菌したものとする。ま
た,市販の精製水を用いる場合は,この規格で規定する精製水と同等以上の品質のものとする。
4. 一般原則
4.1
検出法
3
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4.1.1
液体試料であれば規定量の試料を,他の試料であれば規定量の試料懸濁液(JIS K 3702参照)を,
選択培地に接種する。
4.1.2
各試験管を37 ℃で嫌気的に24時間及び48時間培養する。培養後に亜テルル酸カリウムの減少(黒
変又は黒色の沈殿物の生成)が認められる場合,コアグラーゼ陽性ブドウ球菌の存在が推定される。
備考 この規格では,各試験管に寒天又は流動パラフィンを重層して嫌気環境を得る。嫌気状態のジ
ャー又は細菌培養器(6.1)内で試験管を培養する方法もある。
4.1.3
24時間後,ベアード・パーカー選択寒天培地上に陽性と推定される試験管(4.1.2)の培養液を接
種する。残りの試験管については,いずれも48時間後に接種を行う。
4.1.4
試験管(4.2.2)の培養液を接種した各ベアード・パーカー選択寒天培地を37 ℃で24時間及び48
時間培養する。培養後に亜テルル酸カリウムの減少及び卵黄反応が認められる場合,コアグラーゼ陽性ブ
ドウ球菌の存在を推定できる。
4.1.5
定形及び/又は非定形コロニーについて,コアグラーゼ反応陽性を示すコロニーを確認する。
4.1.6
ウサギ血しょうフィブリノーゲン寒天培地上に試料を接種してもよい。コアグラーゼ陽性のブドウ
球菌の存在は,適切な培養[JIS K 3703-2の9.(実施手順)による。]後に,ウサギ血しょうフィブリノー
ゲンに特異反応を示すコロニーとして確認できる。
4.1.7
結果は,試料x g又はx mL中にコアグラーゼ陽性ブドウ球菌が“陽性”又は“陰性”と記録する。
4.2
生菌数測定法
4.2.1
当該試料の希釈系列(段階希釈試料液)を,液体選択培地に接種する。
4.2.2
各試験管を37 ℃で嫌気的に24時間及び48時間培養する。亜テルル酸カリウムの減少が認められ
る場合,コアグラーゼ陽性ブドウ球菌の存在を推定できる。
備考 この規格では,各試験管に寒天又は流動パラフィンを重層して嫌気環境を得る。嫌気状態のジ
ャー又は細菌培養器(6.1)内で試験管を培養する方法もある。
4.2.3
24時間後,ベアード・パーカー選択寒天培地上に陽性と推定される試験管(4.2.2)の培養液を接
種する。残りの試験管については,いずれも48時間後に接種を行う。
4.2.4
試験管(4.2.2)の培養液を接種した各ベアード・パーカー選択寒天培地を37 ℃で24時間及び48
時間培養する。培養後に亜テルル酸カリウムの減少及び卵黄反応が認められる場合,コアグラーゼ陽性ブ
ドウ球菌の存在を推定できる。
4.2.5
定形及び/又は非定形コロニーについて,コアグラーゼ反応陽性を示すコロニーを確認する。
4.2.6
菌が確認された希釈試料液(4.2.5又は4.1.6)について,試料1 g又は1 mL当たりのコアグラーゼ
陽性ブドウ球菌の最確数(MPN)を,最確数表(JIS K 3701参照)を参照して算出する。
5. 希釈液及び培地 JIS K 3701による。培地及び試薬の調製に用いる素材は,分析用として品質が保証
されているものを使用する。
5.1
希釈液 JIS K 3702による。
5.2
改変Giolitti-Cantoniブロス(ブイヨン又は液体培地)
5.2.1
基礎培地
5.2.1.1
組成 組成は,表1による。
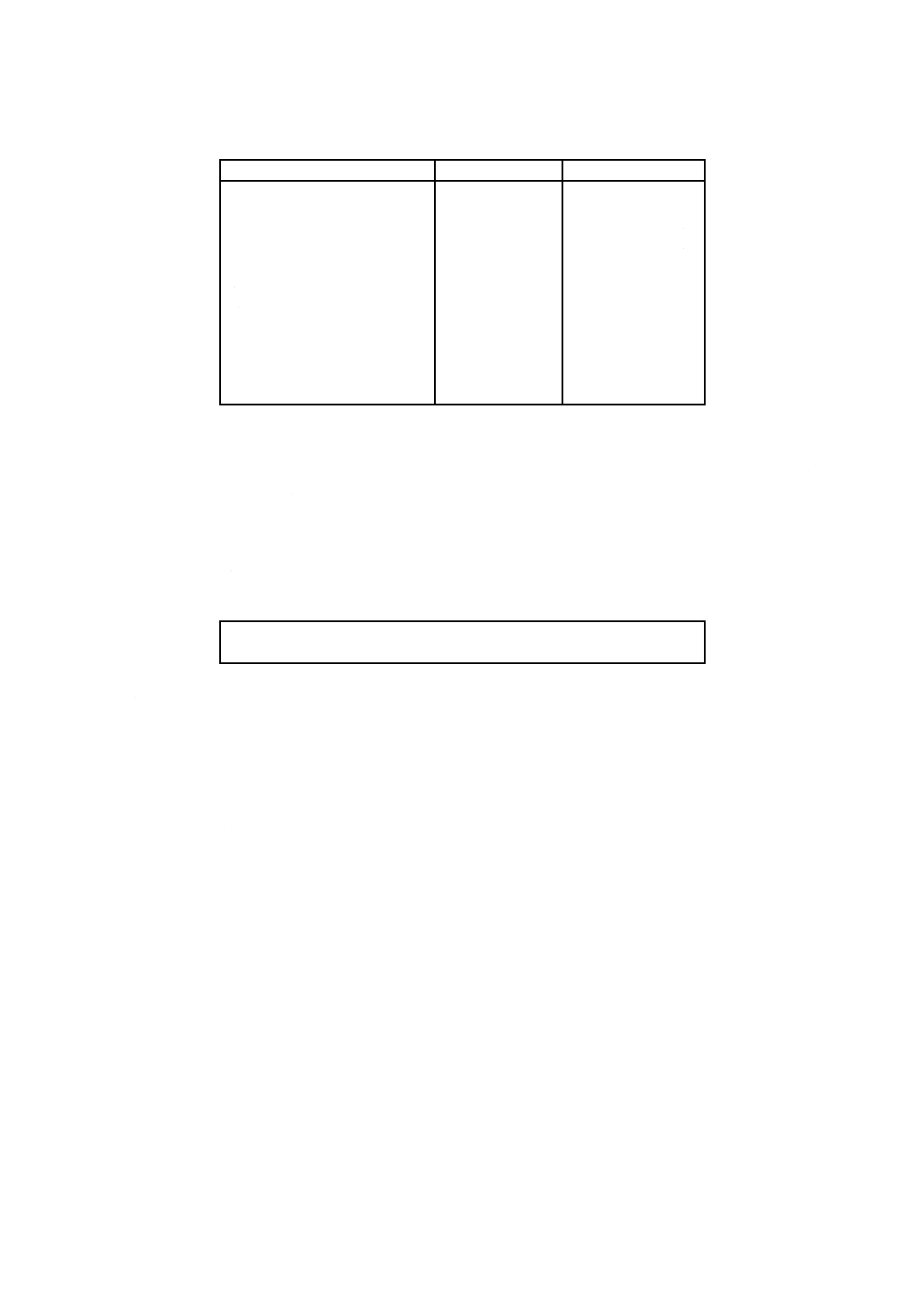
4
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1 基礎培地の組成
2倍濃度培地
1倍濃度培地
カゼインの酵素分解物
20.0 g
10.0 g
肉エキス
10.0 g
5.0 g
酵母エキス
10.0 g
5.0 g
塩化リチウム
10.0 g
5.0 g
マンニトール
40.0 g
20.0 g
塩化ナトリウム
10.0 g
5.0 g
グリシン
2.4 g
1.2 g
ピルビン酸ナトリウム
6.0 g
3.0 g
ポリオキシエチレンソルビタン
モノオレエート(Tween 80)
2.0 g
1.0 g
精製水
1 000 mL
1 000 mL
5.2.1.2
調製 各成分を精製水に溶解する。必要に応じて加温・かくはんし,完全に溶解する。室温まで
冷却し,必要であれば滅菌後の最終pHが6.9±0.2となるようにpHを調整する。適切な大きさの試験管
(例:1倍濃度培地の場合 16 mm×160 mm,2倍濃度培地の場合 20 mm×200 mm)に,培地を適当量分
注する。オートクレーブで121 ℃,15分間滅菌する。
5.2.2
亜テルル酸カリウム溶液
5.2.2.1
組成 組成は,表2による。
表2 亜テルル酸カリウム溶液の組成
亜テルル酸カリウム(K2TeO3)
1.0 g
精製水
100 mL
5.2.2.2
調製 最小限の加熱で亜テルル酸カリウムを精製水に溶解する。白色の不溶物が精製水中に生じ
た場合は,これを用いない。孔径0.22 μmのメンブランフィルターを用いてろ過し,除菌する。溶液は3
±2 ℃で最長1か月間保存できる。白色の沈殿物が生じた場合は,溶液を用いない。
5.2.3
完全培地 使用直前に,基礎培地(5.2.1)を100 ℃で15分間加熱し,空気を追い出す。44〜47 ℃
まで冷却し,1倍濃度培地の場合は試験管1本につき0.1 mL,2倍濃度培地の場合は試験管1本につき0.2
mLの亜テルル酸カリウム溶液(5.2.2)を無菌操作で加える。
5.2.4
培地の品質保証のための性能 改変Giolitti-Cantoniブロス(ブイヨン又は液体培地)の性能基準を,
表3に示す。
5
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表3 改変Giolitti-Cantoniブロス(ブイヨン又は液体培地)の性能基準
機能
培養
品質管理用菌株
対照培地
品質管
理方法
基準
培養能
37 ℃,
48時間
黄色ブドウ球菌ATCC
6538 P若しくは25923
+競合菌株(大腸菌
(E. coli)ATCC 8739
若しくは25922),又は
他の菌株保存機関に
登録されている同じ
菌株
半定量
法
選択培地
上のコロ
ニー数が
10個を超
える。
選択性
37 ℃,
48時間
大腸菌ATCC 25922若
しくは8739,又は菌株
保存機関に登録され
ている同じ菌株
TSA
(トリプト
ソイ寒天
培地)
半定量
法
選択培地
上では,
発育しな
い。
備考 選択性(selectivity)及び培養能(productivity)の定義については,ISO/TS
11133-2による。これらの菌株は理化学研究所生物基盤研究部微生物系
統保存施設,独立行政法人製品評価技術基盤機構生物遺伝資源部門など
から購入可能である。
5.3
寒天溶液
5.3.1
組成 組成は,表4による。
表4 寒天溶液の組成
寒天
15〜20 g
精製水
1 000 mL
備考 寒天の量は,寒天のゲル強度による。
5.3.2
調製 寒天を精製水に懸濁した後,121 ℃で15分間オートクレーブにかける。使用前に44〜47 ℃
まで冷却し,適切な容量の試験管に分注する。保存は,JIS K 3701に準拠する。
5.4
ベアード・パーカー選択寒天培地
5.4.1
組成及び調製 JIS K 3703-1による。
5.4.2
培地の性能 ベアード・パーカー選択寒天培地の性能基準を,表5に示す。
表5 ベアード・パーカー選択寒天培地の性能基準
機能
培養
品質管理用菌株
対照
培地
品質管
理方法
基準及びコロ
ニーの特徴
培養能
37 ℃,
24〜48
時間
黄色ブドウ球菌
ATCC 6538若しくは
25923,又は他の菌株
保存機関に登録され
ている同じ菌株
TSA
定量法
PR≧0.5。
黒色又は灰色
のコロニーで
透明なハロー
(卵黄反応)
をもつ。
選択性
37 ℃,
48時間
大腸菌ATCC 25922若
しくは8739,又は菌
株保存機関に登録さ
れている同じ菌株
−
定量法
生育が完全に
阻害されるこ
と。
6
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表5 ベアード・パーカー選択寒天培地の性能基準(続き)
特異性
37 ℃,
24〜48
時間
表皮ブドウ球菌
(S. epidermidis)
ATCC 12228,又は他
の菌株保存機関に登
録されている同じ菌
株
−
定量法
黒色又は灰色
のコロニーで
透明なハロー
(卵黄反応)
をもたないも
の。
備考 これらの菌株は理化学研究所生物基盤研究部微生物系統保存施設,独立
行政法人製品評価技術基盤機構生物遺伝資源部門などから購入可能で
ある。
PR(培養能指標)は,次の式によって算出する。
o
S
R
N
N
P=
ここに, Ns: 1枚又はそれ以上の試験培地のシャーレに出現したコロニ
ーの総数
No: 1枚又はそれ以上の対照培地のシャーレに出現したコロニ
ーの総数
5.5
ウサギ血しょうフィブリノーゲン寒天培地 [参考文献(6)及び(7)参照]
5.5.1
組成及び調製 JIS K 3703-1による。
5.5.2
培地の性能 ウサギ血しょうフィブリノーゲン寒天培地の性能基準を,表6に示す。
表6 ウサギ血しょうフィブリノーゲン寒天培地の性能基準
機能
培養
品質管理用菌株
対照
培地
品質管
理方法
基準及びコロ
ニーの特徴
培養能
37 ℃,
24〜48
時間
黄色ブドウ球菌(S.
aureus)ATCC 6538若
しくは6538P,25923,
又は他の菌株保存機
関に登録されている
同じ菌株
TSA
定量法
PR≧0.5。
黒色又は灰色
のコロニーで
混濁したハロ
ーをもつ。
選択性 37 ℃,
48時間
大腸菌(E. coli)ATCC
25922若しくは8739,
又は菌株保存機関に
登録されている同じ
菌株
−
定量法
生育が完全に
阻害される。
特異性
37 ℃,
24〜48
時間
表皮ブドウ球菌
(S. epidermidis)
ATCC 12228,又は他
の菌株保存機関に登
録されている同じ菌
株
−
定量法
黒色又は灰色
のコロニーで
混濁したハロ
ーをもつ。
備考 これらの菌株は理化学研究所生物基盤研究部微生物系統保存施設,独
立行政法人製品評価技術基盤機構生物遺伝資源部門などから購入可能
である。
5.6
ブレインハートインフュージョン(BHI)ブロス(ブイヨン又は液体培地)
5.6.1
組成及び調製 JIS K 3703-1による。
7
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.6.2
培地の性能 ブレインハートインフュージョン(BHI)ブロス(ブイヨン又は液体培地)の性能基
準を,表7に示す。
表7 ブレインハートインフュージョン(BHI)ブロスの性能基準
機能
培養
品質管理用菌株
対照
培地
品質管
理方法
基準となる混
濁度
培養能
37 ℃,
24時間
黄色ブドウ球菌(S.
aureus)ATCC 25923,
又は他の菌株保存機
関に登録されている
同じ菌株
−
定性法
うっすらと濁
る,又ははっ
きりと濁る。
備考 これらの菌株は理化学研究所生物基盤研究部微生物系統保存施設,独立
行政法人製品評価技術基盤機構生物遺伝資源部門などから購入可能で
ある。
5.7
ウサギ血しょう JIS K 3703-1による。
6. 装置及び器具 通常の微生物検査用装置及び器具(JIS K 3701参照),及び次に挙げるものを用いる。
備考 同様の仕様であれば,再利用可能なガラス器具の代わりに使い捨ての器具を使用してもよい。
6.1
細菌培養器 37±1 ℃で操作できるもの。
6.2
乾燥キャビネット又は乾燥器 対流によって換気され,37〜55 ℃を保持できるもの。
備考 層流式キャビネットを使用してもよい。
6.3
シャーレ 滅菌済みのもの。
6.4
白金線 白金・イリジウム合金,ニッケル・クロム合金又はプラスチック製の滅菌済み使い捨てせ
ん(穿)刺接種用ワイヤー。
6.5
白金耳 白金・イリジウム合金,ニッケル・クロム合金又はプラスチック製で,ループの直径が約3
mmのもの,又は,容量が10 μLの滅菌済み使い捨てループ。
6.6
試験管 適切な大きさのもの(16 mm×160 mm,20 mm×200 mm,10 mm×75 mmなど)。
6.7
目盛付きピペット(メスピペット) 容量が1 mLで,0.1 mL単位で目盛られており,流出口径(先
端口径)が適当な大きさもの。
6.8
ウォーターバス 44〜47 ℃及び37 ℃で操作できるもの。
6.9
薬さじ 寒天を切断するためのもの。
6.10 嫌気ジャー
7. サンプリング方法 個別の規格による。
備考 検査対象を真に代表する試料が,輸送中又は保存中に,損傷又は変質を来すことなく,検査室
に届けられることが重要である。個別の規格がない場合には,受渡当事者間の協定による。
8. 試料の調製 個別の規格による。
備考 個別の規格がない場合には,受渡当事者間の協定による。
9. 手順
8
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.1
検出法
9.1.1
試料及び試料懸濁液 JIS K 3702による。試料懸濁液は,試料1 g若しくは1 mLを1倍濃度の改
変Giolitti-Cantoniブロス(ブイヨン又は液体培地)(5.2)9 g若しくは9 mLに,又は試料10 g若しくは10
mLを2倍濃度の改変Giolitti-Cantoniブロス(ブイヨン又は液体培地)(5.2)10 g若しくは10 mLに加えて
調製する(前者では試料0.1 g又は0.1 ml,後者では試料1 g又は1 mlに相当する。)。試料がより大量であ
る場合は,試料x g又はx mLを1倍濃度の改変Giolitti-Cantoniブロス(ブイヨン又は液体培地)(5.2)9 x
g又は9 x mLに加える。培地は前もって脱気し,亜テルル酸カリウムを加えておき,フラスコ又は容器内
の空気容量は最小限とする。44〜47 ℃まで冷却した寒天(5.3)又は流動パラフィンを重層して培地上に
慎重に注ぎ,密閉する。
9.1.2
増菌 試料懸濁液(9.1.1)を,37 ℃で24±2時間培養する(6.1参照)。黒変又は黒色の沈殿物が
認められた場合は,9.1.3に示すように継代培養を行う。黒変を生じなかった場合は,さらに24±2時間培
養した後,(黒変又は黒色沈殿物の発生の有無にかかわらず)9.1.3に示すように継代培養を行う。
9.1.3
各管の継代培養 滅菌済みの薬さじ(6.9)を用いて重層した寒天又は流動パラフィン(4.1.2の備
考を参照)を縦に四つに切り,寒天又は流動パラフィンの栓を無菌的に取り除く。必要に応じて,薬さじ
(6.9)を栓の周囲に差し込み,試験管のガラス壁からはがす。試験管の内容物をよくかくはんし,培養液
が均質な懸濁液となるようにする。分離コロニーを得るため,滅菌済みの白金耳(6.5)を用いて,選択し
たそれぞれの管の培養液から1白金耳量をベアード・パーカー選択寒天培地(5.4)又はウサギ血しょうフ
ィブリノーゲン寒天培地(5.5)の表面上に塗抹する。作製した平板を倒置し,37 ℃に設定した細菌培養
器(6.1)内で24±2時間及び48±2時間培養する。
9.2
生菌数測定法
9.2.1
試料及び試料懸濁液 JIS K 3702による。
9.2.2
接種 脱気し,亜テルル酸カリウムを加えた(5.2.3)2倍濃度培地の試験管3本を用意し,液体試
料の場合は試料10 mLを,他の試料の場合は,試料懸濁液10 mL(試料1 g相当)を各試験管内に入れる。
脱気し,亜テルル酸カリウムを加えた(5.2.3)1倍濃度培地の試験管3本を用意し,液体試料の場合は試
料1 mLを,他の試料の場合は,試料懸濁液1 mL(試料0.1 g相当)を各試験管内に入れる。以降の各希
釈段階(液体試料の場合は10−1,10−2及び10−3,他の試料の場合は10−2,10−3又は10−4)についても,
希釈段階ごとに新しい滅菌済みのピペットを用いて上記のように接種を行う。十分な数の希釈段階を設け,
最終希釈段階では3本とも陰性結果となるようにする。接種物と培地とを慎重に混合し,いずれにも空気
が混入しないようにする。接種した各試験管内の培地上に,44〜47 ℃まで冷却した寒天(5.3)を栓とな
るように慎重に注ぎ,凝固させて密閉する。
9.2.3
培養 接種した2倍濃度又は1倍濃度培地の試験管(9.2.2)を,37 ℃で24±2時間培養する(6.1
参照)。黒変又は黒色の沈殿物を呈した試験管は,いずれも継代培養を行う。残りの接種試験管について
は,さらに24±2時間培養した後,48±2時間後に黒色の沈殿物を生じたものと生じなかったものとに
かかわらず,すべての試験管を継代培養する。
9.2.4
継代培養 9.1.3による。
9.3
平板の選択及び判定
9.3.1
ベアード・パーカー選択寒天培地
9.3.1.1
コロニーの選択 各平板を24時間培養後(9.1.3又は9.2.4),存在するすべての定形コロニーの
位置について,平板の底面に印を付ける。
備考1. 定形コロニーは,黒色又は灰色で光沢があり,凸状の形態をもち(24時間培養後の直径は1
9
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
〜1.5 mm,48時間培養後の直径は1.5〜2.5 mmとなる。),部分的に不透明なこともある透明
帯で囲まれている。24時間以上培養すると,この透明帯の中に,コロニーに直接接触した乳
白色の環が現れることもある。
2. 非定形コロニーは定形コロニーと同じ大きさをもっており,次に挙げる形態のいずれかを呈
することがある。
a) 光沢のある黒色のコロニーで,細幅の白色縁を形成することもある。透明帯は 存在し
ないか,わずかに見える程度であり,乳白色の環は存在しないか,ほとんど見えない。
b) 透明帯の存在しない,灰色のコロニー
非定形コロニーは,乳製品,エビ及び臓物などを汚染しているコアグラーゼ陽性ブドウ球菌株によって
主に形成される。他の試料を汚染しているコアグラーゼ陽性ブドウ球菌株が非定形コロニーを形成する頻
度は低い。
備考3. この他のコロニーは,備考1.及び備考2.に記述したような定形・非定形外観を呈さずに平板
上に存在する可能性のある残りのコロニーすべてであり,それらはバックグラウンド・フロ
ーラ[微生物そう(叢)]とみなされる。
全平板を更に24±2時間,37 ℃で再度培養し(6.1参照),新たに発育した定形コロニーに印を付ける。
存在する非定形コロニーについても,すべて印を付ける。
9.3.1.2
確認 9.3.1.1に従って選択したコロニーの表面から,滅菌した白金線(6.4)で釣菌し,ブレイン
ハートインフュージョンブロス(ブイヨン又は液体培地)(5.6)の入った試験管又は瓶に移す。37 ℃で24
±2時間培養する(6.1参照)。適切な大きさ(例,10 mm×75 mm)の滅菌済み試験管に入ったウサギ血し
ょう(5.7)0.3 mL(他に製造業者による規定のない限り)に,各培養液0.1 mLを無菌的に加え,37 ℃で
培養する。試験管を傾けて,培養4〜6時間後に血しょう凝固が起こるか否かを調べる。
試験結果が陰性の場合は,24±2時間の培養後に再検査するか,製造業者の規定する時間で培養した後
に検査を行う。
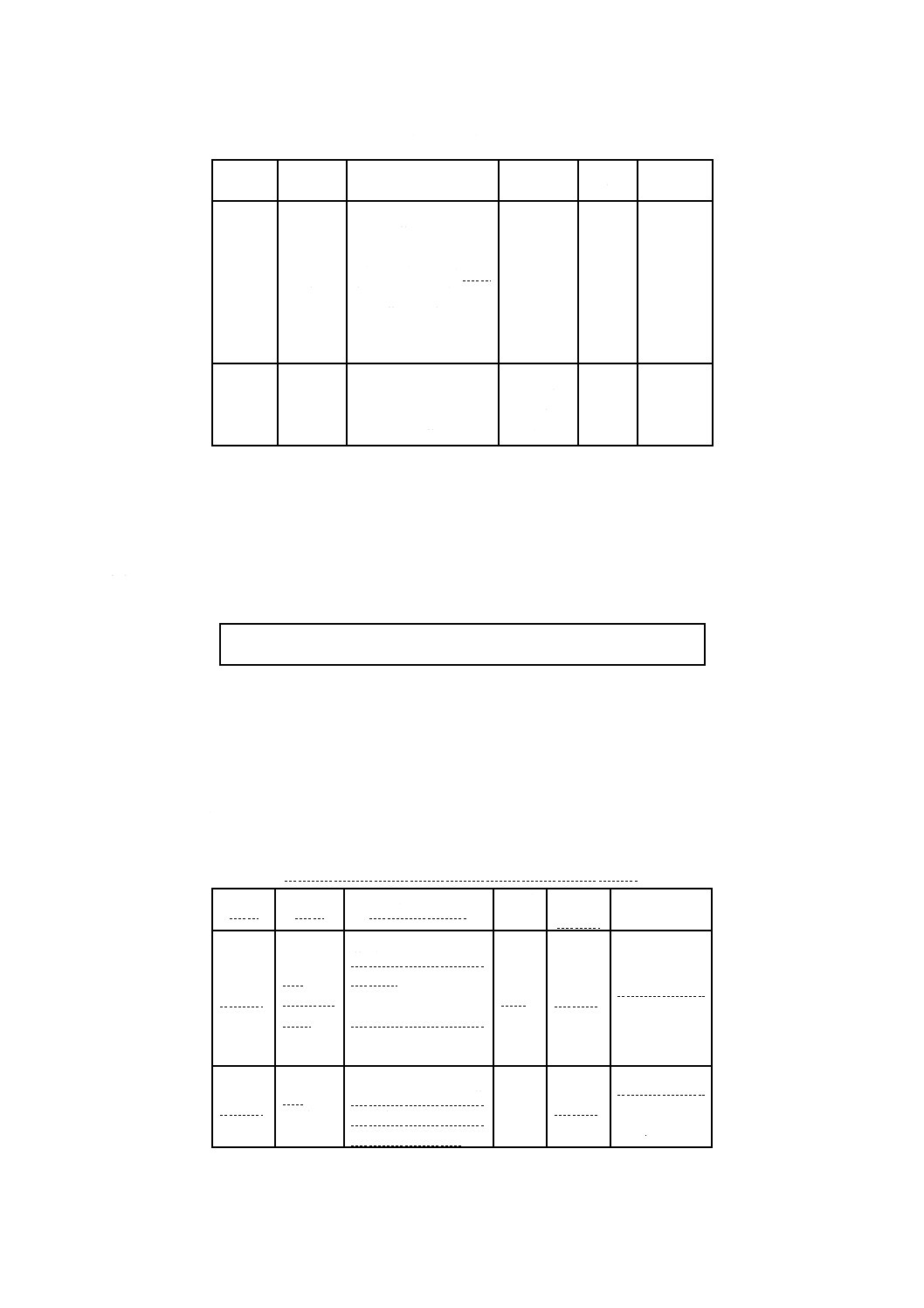
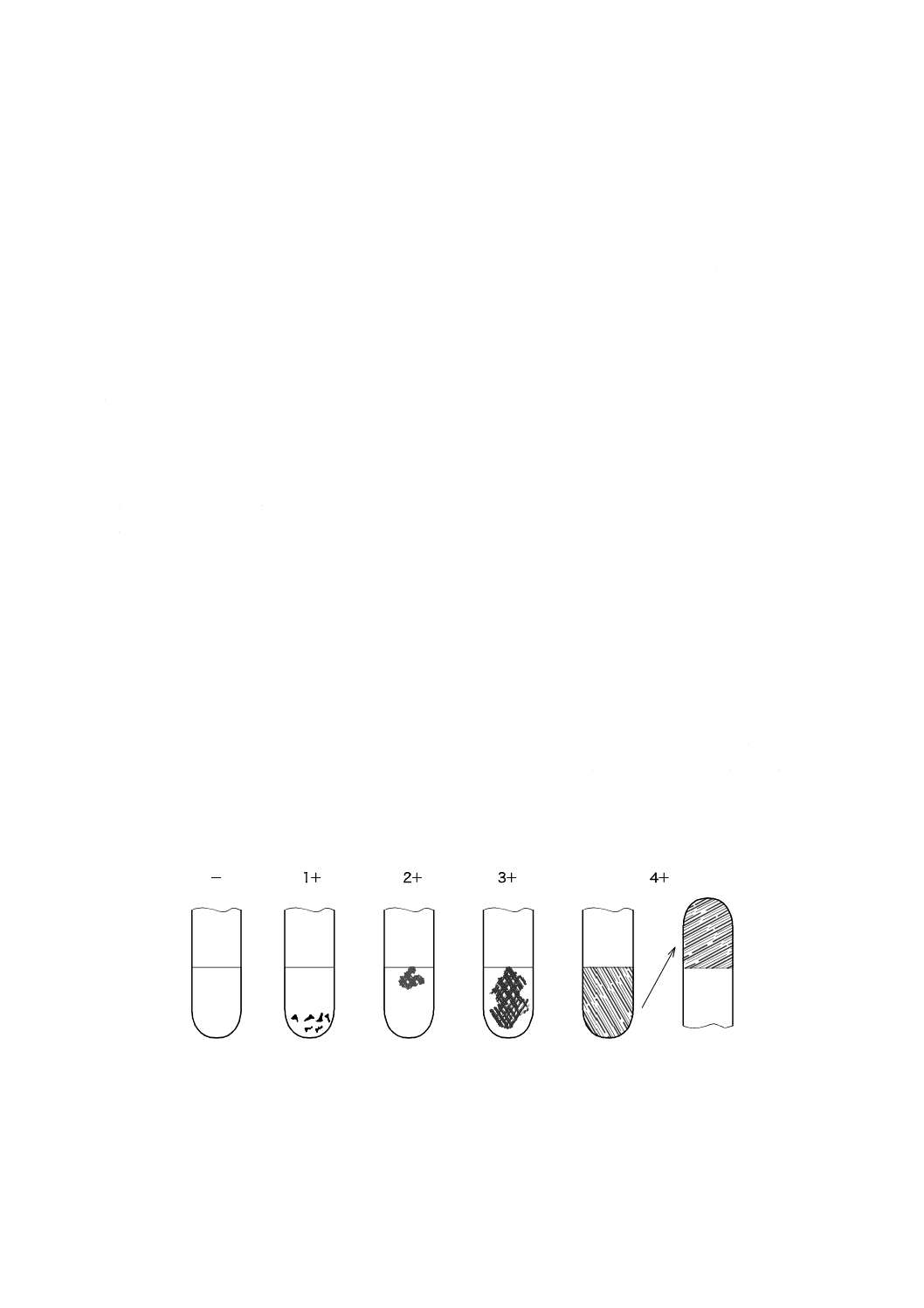
図1に示す採点指針に従って,3+以上のコアグラーゼ反応が得られた場合は,コアグラーゼ試験陽性と
みなす。1+〜2+の反応は中間とみなす。各回分の血しょうについて,陰性対照として,滅菌したブレイン
ハートインフュージョンブロス(ブイヨン又は液体培地)(5.6)0.1 mLを推奨量のウサギ血しょう(5.7)に
加え,菌を接種せずに培養する。対照血しょうが凝固反応を示さなければ,試験を有効とする。それぞれの
試験管について試験し,1個以上のコロニーがコアグラーゼ陽性と確認された試験管を,陽性と記録する。
− 陰性:フィブリン形成の形跡なし。
1+ 陽性:小さく,まとまりのない凝塊が認められる。
2+ 陽性:小さいがまとまっている凝塊が認められる。
3+ 陽性:大きくまとまっている凝塊が認められる。
4+ 陽性:試験管の全内容物が凝固し,試験管を倒置しても動かない。
図 1 コアグラーゼ試験反応の採点方法
10
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.3.2
ウサギ血しょうフィブリノーゲン寒天培地 24±2時間培養(必要に応じて,更に24時間培養す
る。)すると,コアグラーゼ陽性ブドウ球菌は,周囲にコアグラーゼ活性を示す析出物のハローを伴った黒
色又は灰色(若しくは,ほぼ白色)の小さなコロニーを形成する。培養初期には,プロテウス(Proteus)
属のコロニーが,コアグラーゼ陽性ブドウ球菌のコロニーと同様の外観を呈することがある。しかし,24
時間又は48時間の培養後には,幾分茶色がかった拡散コロニーとなるため,ブドウ球菌との識別が可能と
なる。コアグラーゼ活性を示すコロニーが1個以上認められれば,試験結果を陽性とする。
備考 ウサギ血しょうフィブリノーゲン寒天培地を用いる方法はコアグラーゼ反応に基づいているた
め,コアグラーゼ活性を改めて確認する必要はない。
10. 試験結果の表現
10.1 検出法 試験結果の判定に従って,試料中のコアグラーゼ陽性ブドウ球菌の有無を記録する。この
とき,試験試料の質量(g)又は体積(mL)を明記する。
10.2 生菌数測定法
10.2.1 希釈段階の選択 接種した液体選択培地における希釈段階ごとに(9.1.2及び9.2.2),ベアード・パ
ーカー選択寒天培地による試験(9.3.1)によってコアグラーゼ陽性ブドウ球菌の存在が確認された試験管
の数,又はウサギ血しょうフィブリノーゲン寒天培地(9.3.2)によってコアグラーゼ反応陽性のコロニー
の存在が確認された試験管の数を記録する。これらを陽性管とする。連続した三つの希釈段階を選択し,
MPN指数を求める(JIS K 3701による)。
備考 試料懸濁液及び試料が液体の場合は,これを希釈液とみなす。
10.2.2 算出法 JIS K 3701による。
11. 精度 MPN法では,試験結果に大きな変動が生じる可能性のあることがよく知られている。規定の
信頼限界は,試験結果のランダム分布に完全に基づいている。その他,より重要となり得る変動の原因と
して,MPN推定には由来しないものがある。こうした影響を見越して,JIS K 3701の附属書Bの表2の
カテゴリーを使用する。これは,考えられる試験管の組合せを,その発生確率に準じてまとめたものであ
る。
備考 粉乳試料に関する国際共同試験(参考文献[3]参照)でこの規格に記載した方法と同様のMPN
法を用いて試験を実施したところ,全体の75 %において,二つの単独試験結果間の差はその
算術平均の1.25倍未満であった。二つの試験結果間に認められた最大差は,その算術平均の1.94
倍であった。
12. 試験報告書 試験報告書は,次の事項を明記する。
a) 試験試料を完全に特定するために必要な全情報
b) 使用した試験試料の採取方法(判明している場合)
c) 使用した試験方法(検出法又は生菌数測定法,及び使用培地)
d) この規格で規定していないあらゆる操作又は任意としたあらゆる操作についての詳細,及び試験結果
に影響を及ぼした可能性のある全事象についての詳細
e) 得られた試験結果(用いた表記方法を明確に示す。)
11
K 3703-3:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1]
IDF 83:1998, Milk and milk-based products−Detection of thermonuclease produced by coagulasepositive
staphylococci in milk and milk-based products
[2]
IDF 60C:1997, Milk and milk-based products−Detection of coagulase-positive staphylococci−Most probable
number technique
[3]
Chopin, A., Malcolm, S., Jarvis, G., Asperger, H., Beckers, H.J., Bertona, A.M., Cominazzini, C., Carini, S.,
Lodi, R., Hahn, G., Heeschen, W., Jans, J.A., Jervis, D.l., Lanier, J.M., O'Connor, F., Rea, M., Rossi, J.,
Seligmann, R., Tesone, S., Waes, G., Mocquot, G. and Pivnick, H. Comparison of four media and methods for
enumerating Staphylococcus aureus in powdered milk: ICMSF Methods Studies: XV. J. Food. Prot., 48,1985,
pp. 21-27
[4]
Baird-Parker, A.C. An improved diagnostic and selective medium for isolating coagulase positive
staphylococci, J. Applied Bacteriology, 25(1), 1962, pp. 12-19
[5]
Smith, B.A. and Baird-Parker, A. C. The use of sulphamezathine for inhibiting Proteus spp. on Baird-Parker's
isolation medium for Staphylococcus aureus. J. Applied Bacteriology, 27(1), 1964, pp. 78-82
[6]
Beckers, H.L. et al. Evaluation of a pour-plate system with rabbit plasma-bovine fibrinogen agar for the
enumeration of Staphylococcus aureus in food. Can. J. Microbiol., 30, 1984, pp.470-474
[7]
Sawhney, D. The toxicity of potassium tellurite to Staphylococcus aureus in rabbit plasma fibrinogen agar, J.
Applied Bacteriology, 61,1986, pp. 149-155
1
2
K
3
7
0
3
-3
:
2
0
0
8
1
2
K
3
7
0
3
-3
:
2
0
0
8
附属書(参考)JISと対応する国際規格との対比表
JIS K 3703-3:2008 コアグラーゼ陽性ブドウ球菌(黄色ブドウ球菌など)の菌数測定
方法−第3部:低菌数の検出法及び最確数(MPN)法による生菌数測定法
ISO 6888-3:2003 食品及び動物用飼料の微生物試験−コアグラーゼ陽性ブドウ
球菌(黄色ブドウ球菌など)の菌数測定方法−第3部:検出法及び低菌数MPN
法
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごと
の評価及びその内容
表示箇所:本体
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目番号
内容
項目番号
内容
項目ごとの
評価
技術的差異の内容
1.適用範囲
培地を用いて低菌数
のコアグラーゼ陽性
ブドウ球菌を検出す
る方法について規定。
ISO
6888-3
1
JISとほぼ同じ。
MOD/削除
MOD/追加
培地試験方法に限定
黄色ブドウ球菌を追加
工業標準化法の対象とならな
い事項を削除
利用者の利便性のため。実質的
な差異はない。
2.引用規格
JIS K 3701
JIS K 3702
JIS K 3703-1
JIS K 3703-2
2
ISO 7218
ISO 6887-1
ISO 6888-1
ISO 6888-2
IDT
−
ISO/TS 11133-2
ISO 8261
ISO/TS 11133-2
MOD/削除
IDT
−
食品は適用範囲外であるため。
JIS K 8008
−
MOD/追加
−
追加した用語を規定するため。
3.定義
用語の定義を規定
3
JISとほぼ同じ。
MOD/追加
用語(水)を追加。
JISとして必要な用語を規定。
4.一般原則
コアグラーゼ陽性ブ
ドウ球菌検出のため
の操作を規定。
4
JISとほぼ同じ。
MOD/追加
参照規格を追加
利用者の利便性のため。技術的
な差異なし。
5.希釈液及び
培地
培地及び試薬(ベアー
ド・パーカー選択寒天
培地及びウサギ血し
ょうフィブリノーゲ
ン寒天培地など)につ
いて規定。
5
JISとほぼ同じ。
MOD/追加
MOD/追加
MOD/変更
菌株の入手先を追記(表3など)
培地の性能基準表(表5,表6,
表7)を追記。
水の温度(沸騰水を精製水)を
変更(5.3.2)。
利用者の利便性のため。技術的
な差異なし。
利用者の利便性のため。技術的
差異はない。
利用者の安全のため。
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
3
K
3
7
0
3
-3
:
2
0
0
8
1
3
K
3
7
0
3
-3
:
2
0
0
8
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごと
の評価及びその内容
表示箇所:本体
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的
差異の理由及び今後の対策
項目番号
内容
項目番号
内容
項目ごとの
評価
技術的差異の内容
6.装置及び器
具
通常の微生物検査に
用いる装置及びガラ
ス器具(細菌培養器及
び乾燥キャビネット
など)について規定。
6
JISとほぼ同じ。
MOD/追加
MOD/変更
6.4及び6.5に装置(白金線及び
白金耳)を追加。
表3記載の菌株番号(ATCC8739)
を変更。
利用者の利便性のため。技術的
差異はない。
原規格の誤記載(ATCC8732)
を訂正。
7.サンプリン
グ方法
試料のサンプリング
方法について規定。
7
JISと同じ。
IDT
−
−
8.試料の調製
試料の調製について
規定。
8
JISと同じ。
IDT
−
−
9.手順
手順(試料,試料懸濁
液,増菌及び生菌数測
定法など)について規
定。
9
JISとほぼ同じ。
MOD/変
更・追加
MOD/追加
9.1.1パラフィンを流動パラフィ
ンに変更し,調整方法を具体的
に記載。
9.1.3懸濁液の調製条件(試験管
の内容物をよくかくはん)を追
記。
利用者の利便性のため。
10.試験結果
の表現
試験結果の表現(コア
グラーゼ陽性ブドウ
球菌の有無など)につ
いて規定。
10
JISと同じ。
IDT
−
−
11.精度
試験結果に大きな変
動が生じる可能性の
ある精度について規
定。
11
JISと同じ。
IDT
−
−
12.試験報告
書
試験報告書(使用培地
及び試験結果など)に
ついて規定。
12
JISと同じ。
IDT
−
−
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

1
4
K
3
7
0
3
-3
:
2
0
0
8
1
4
K
3
7
0
3
-3
:
2
0
0
8
JISと国際規格との対応の程度の全体評価:MOD
備考1. 項目ごとの評価欄の記号の意味は,次のとおりである。
― IDT……………… 技術的差異がない。
― MOD/削除……… 国際規格の規定項目又は規定内容を削除している。
― MOD/追加……… 国際規格にない規定項目又は規定内容を追加している。
― MOD/変更……… 国際規格の規定内容を変更している。
2. JISと国際規格との対応の程度の全体評価欄の記号の意味は,次のとおりである。
― MOD…………… 国際規格を修正している。
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。