K 0420-71-30 : 2000
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法に基づいて,日本工業標準調査会の審議を経て,通商産業大臣が制定した日
本工業規格である。
JIS K 0420-71-30には,次に示す附属書がある。
附属書A(参考) ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) の管理と飼育のための
環境要素
附属書B(参考) データ記録の推奨形式
附属書C(参考) 参考文献
JIS K 0420 シリーズは,次に示す各部からなる。
JIS K 0420-71-10 水質−淡水魚[ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) (真骨類,
コイ科)]に対する化学物質の急性毒性の測定−第1部:止水法
JIS K 0420-71-20 水質−淡水魚[ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) (真骨類,
コイ科)]に対する化学物質の急性毒性の測定−第2部:半止水法
JIS K 0420-71-30 水質−淡水魚[ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) (真骨類,
コイ科)]に対する化学物質の急性毒性の測定−第3部:流水法
JIS K 0420-73-10 水質−セネデスムス (Scenedesmus subspicatus) 及びセレナスツルム (Selenastrum
capricornutum) を用いた淡水藻類の成長阻害試験
K 0420-71-30 : 2000
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目次
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 2
1A. 引用規格 ······················································································································ 2
2. 原理 ······························································································································ 2
3. 試験生物及び試薬 ············································································································ 3
4. 装置 ······························································································································ 4
5. 試験環境 ························································································································ 5
6. 手順 ······························································································································ 5
6.1 魚の状態 ······················································································································ 5
6.2 限度試験 ······················································································································ 5
6.3 予備試験 ······················································································································ 5
6.4 最終試験 ······················································································································ 5
7. 試験結果の表現 ··············································································································· 6
7.1 妥当性 ························································································································· 6
7.2 LC50の算定 ·················································································································· 7
8. 試験報告 ························································································································ 8
附属書A(参考) ゼブラフィッシュ(Brachydanio rerio Hamilton−Buchanan) の管理と飼育のための環境
要素 ·································································································································· 10
附属書B(参考) データ記録の推奨形式 ················································································ 12
附属書C(参考) 参考文献·································································································· 14
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 0420-71-30 : 2000
水質−淡水魚
[ゼブラフィッシュ(Brachydanio rerio Hamilton−
Buchanan)(真骨類,コイ科)]に対する
化学物質の急性毒性の測定−
第3部:流水法
Water quality−Determination of the acute lethal toxicity of
substances to a freshwater fish [Brachydanio rerio
Hamilton−Buchanan (teleostei, Cyprinidae)] −
Part3 : Flow-through method
序文 この規格は,1996年に第2版として発行されたISO 7346-3, Water quality−Determination of the acute
lethal toxicity of substances to a freshwater fish [Brachydanio rerio Hamilton−Buchanan (teleostei, Cyprinidae)]
−Part 3 : Flow-through methodを元に,技術的内容を変更することなく作成した日本工業規格であるが,対
応国際規格で規定していない規定内容(3.1試験生物における試験種及び推奨条件の付表1,3.2標準希釈
水の調製方法及びその備考で同等の希釈水)を追加している。
JIS K 0420-71は,3部からなり,ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) に対する化学
物質の致死急性毒性を測定する方法を述べる。ここでは,ゼブラフィッシュの使用を勧めているが,他種
の魚を使用してはならないということではない。ここに述べる方法は,例えば,試験における希釈水の水
質及び温度といった条件を変えることによって,他種の淡水魚及び海水魚に応用できる。
JIS K 0420-71の3部の中から,止水法,半止水法及び流水法のいずれかを選択することができる。JIS K
0420-71-10 (ISO 7346-1) に述べる止水法では,試験溶液の交換はなく,初期溶液をそのまま使用する。こ
のため,簡易な装置が用いられるという利点があるが,試験容器内の化学物質が試験実施中に減少したり,
水質が全体的に低下するかもしれない。この規格で述べる流水法では,試験溶液をほぼ連続的に交換する
ことによって上記の問題は解決されるが,使用する装置はより複雑なものになる。JIS K 0420-71-20 (ISO
7346-2) で述べる半止水法では,試験溶液を24時間又は48時間ごとに交換するため,この方法は他の二
つの方法の折衷案ともいえるものである。
流水法は水中で不安定な物質を含むほとんどの種類の物質に対して使用することができ,試験物質の濃度
はどの段階においても測定される。止水法は,試験期間中,その濃度が比較的一定であるような物質の試
験に限られる。半止水法では,24時間又は48時間ごとに溶液の交換を行うことによって,試験期間中,
物質濃度をある程度に維持した状態で試験することができる。揮発性の高い物質には特別な配慮を必要と
する。
2
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
物質が溶解度に近い濃度で致死濃度となるかもしれないので,試験物質の濃度を調節したり維持しやすく
するために,方法の項で示されているように少量の溶媒を使用してもよい。
なお,この規格で点線の下線を施してある箇所は,対応国際規格にはない事項である。
1. 適用範囲 この規格は,一定の水質条件下で,安定な不揮発性の単一物質の,淡水魚の1種[ゼブラ
フィッシュ (Brachydanio rerio Hamilton−Buchanan) (真骨類,コイ科)通称ゼブラフィッシュ]に対する
急性毒性致死濃度を測定する流水法について規定する。
この方法は,試験条件下でゼブラフィッシュ (Brachydanio rerio) に対する,各試験物質の幅広い意味で
の急性毒性を決めるのに適用できる。
環境水質基準を規定するには,この方法で得られた結果だけでは不十分である。
この方法は,試験生物1)として,幾つかの他種の淡水魚にも応用できる。
この方法は,試験条件,特に希釈水の量と質及び温度を適宜変えることによって,他の淡水魚,海水魚
又は汽水の魚に応用してもよい。
備考 この規格の対応国際規格を,次に示す。
ISO 7346-3 : 1996 Water quality−Determination of the acute lethal toxicity of substances to a
freshwater fish [Brachydanio rerio Hamilton−Buchanan (teleostei, Cyprinidae)] −Part 3 :
Flow-through method.
1A. 引用規格 次に掲げる規格は,この規格に引用することによって,この規格の規定の一部を構成する。
発行年を付記していない引用規格は,その最新版(追補を含む。)を適用する。
JIS K 8121 塩化カリウム(試薬)
JIS K 8122 塩化カルシウム二水和物(試薬)
JIS K 8622 炭酸水素ナトリウム(試薬)
JIS K 8995 硫酸マグネシウム七水和物(試薬)
2. 原理
− 一定の条件下で水中に溶存している化学物質と接触させ,24時間,48時間,72時間及び96時間の暴
露期間後,ゼブラフィッシュ (Brachydanio rerio) の致死試験個体数が50%となる物質濃度を決める。
これらの半数致死濃度を,それぞれ,24時間LC50, 48時間LC50, 72時間LC50及び96時間LC50と
定義する。
− 試験は次の2段階で実施する。
a) 予備試験 急性の半数致死濃度のおおよその目安を求め,最終試験で用いる濃度範囲を決めるのに
用いる。
1) ゼブラフィッシュ (Brachydanio rerio) のほかに次に示す淡水魚種は,この規格に示した方法をそのまま
使用できる。
− ブルーギル (Lepomis macrochirus) (真骨類,バス科)
− ヒメダカ(メダカ) (Oryzias latipes) (真骨類,グッピー科)
− ファットヘッドミノー (Pimephales promelas) (真骨類,コイ科)
− グッピー (Poecilia reticulata) (真骨類,グッピー科)
しかし,1種類での試験結果を元に,他の種を用いた場合の結果を推定することはできない。
3
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 最終試験 この試験の結果だけを報告する。
− 試験期間中,試験濃度が比較的一定である(すなわち,設定濃度の±約20%以内にある。)ことを示
す信頼できる資料を入手できる場合には,LC50の算定の際に,測定濃度又は設定濃度のどちらを使
用してもよい。
− 分析によって実際の濃度が比較的一定であるが,設定濃度の約80%未満又は120%を超えることが示
された場合には,分析値をLC50の算定に使用すべきである。
− 試験期間中,試験濃度が許容範囲にあるということを示す資料を入手できない場合又は試験中のどの
段階においても,明らかな試験化学物質の濃度の低下が認められた(又は疑われた)場合には,分析
データが利用可能であるか否かにかかわらず,LC50をこの試験方法によって決定することはできな
い。この場合には,必ずしも試験が無効となるのではなく,その物質のLC50はx mg/L以下(xは設
定濃度から与えられるが)とはいえる。
3. 試験生物及び試薬 試薬は分析用と認められたものを使用する。溶液の調製に使用する水は,ガラス
製蒸留器で精製した水か又は少なくともこれと同等な純度のイオン交換水とする。
3.1
試験生物
− 試験種は,ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) (真骨類,コイ科),又は付表1
に示す魚種を用いる。
− 試験魚は,体長30±5mmで,体重0.3±0.1g相当(ゼブラフィッシュ以外の魚種を用いる場合は,付
表1による。)を,単一の保存群から選別する。この保存群はあらかじめじゅん(馴)化し,少なくと
も試験前の7日間又は2週間は希釈水で,試験で使用するのと同様の水質及び照明条件下で,連続的
に通気(空気を気泡状にして)して飼育しておく(3.2参照)。
− 試験開始の24時間前までは通常のえさ(餌)を与える。
− 試験魚は見た目に明らかな病気及び外観的奇形があってはならない。試験魚は試験中,又は試験前2
週間は病気の治療をしてはならない。
− 試験終了後,生存している魚は適切に処分する。
− ゼブラフィッシュの管理及び飼育のための環境条件を附属書Aに示す。
3.2
標準希釈水 使用時に調製する標準希釈水は,pH 7.8±0.2,全硬度約250mg/L(炭酸カルシウムと
して,対応国際規格ではカルシウム硬度約250mg/Lとなっているが修正した。)であり,蒸留水又はイオ
ン交換水中に次の濃度の塩を含んでいる。
294.0mg/L
CaCl2・2H2O
123.3mg/L
MgSO4・7H2O
63.0mg/L
NaHCO3
5.5mg/L
KCl
− 次のように調製する。
a) 塩化カルシウム溶液 JIS K 8122に規定する塩化カルシウム二水和物 (CaCl2・2H2O) 11.76gを水に溶
かして1Lとする。
b) 硫酸マグネシウム溶液 JIS K 8995に規定する硫酸マグネシウム七水和物 (MgSO4・7H2O) 4.93gを水
に溶かして1Lとする。
c) 炭酸水素ナトリウム溶液 JIS K 8622に規定する炭酸水素ナトリウム (NaHCO3) 2.59gを水に溶かし
て1Lとする。
4
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 塩化カリウム溶液 JIS K 8121に規定する塩化カリウム (KCl) 0.23gを水に溶かして1Lとする。
− 上記四つの溶液を,それぞれ25mlずつ混ぜ合わせ,水を加えて1Lとする。
− 溶存酸素の濃度が酸素飽和値 (ASV) の少なくとも90%に達し,pH値が7.8±0.2で一定になるまで希
釈水に通気する。もし,必要があれば,水酸化ナトリウム溶液又は塩酸を加えて,溶液のpHを調節
する。こうして調製した希釈水は試験の使用前にさらに通気する必要はない。
備考 希釈には飲料水(必要なら脱塩素したもの)を使用してもよいが,良質の天然水又は標準希釈
水(3.2)(人工調製水)が望ましい。全硬度は,10〜250mgCaCO3/Lで,pH 6.0〜8.5の水が望ま
しい。標準希釈水(3.2)の調製に用いるイオン交換水及び蒸留水は電気伝導率が1mS/m (10μS/cm)
以下とする。
3.3
試験物質の貯蔵液
− 試験物質の貯蔵液は,一定量の希釈水,イオン交換水又はガラス容器で蒸留した水に既知量の試験物
質を溶かして調製する。
− 貯蔵液は,試験物質の安全性に合わせて適切な頻度で調製する。
− 貯蔵液を調製したり,試験容器へ移しやすくするために,水に溶けにくい物質は適切な手段,超音波
装置及び魚に対する毒性の低い有機溶媒を使って溶かしたり,分散させたりしてもよい。もし,その
ような有機溶媒を使用するときには,その試験溶液での濃度は0.1ml/L又は0.1g/Lのいずれか大きい
ほうを超えてはならない。
− 有機溶媒を用いる場合,2種の対照区,すなわち,一つは試験容器で使用した最高濃度の溶媒を含む
もの,他方は溶媒及び試験物質のいずれも含まないものを用意しなければならない。
3.4
試験溶液 必要な濃度の試験溶液を調製するため,試験物質の貯蔵液の適量を希釈水に加える。貯
蔵液を蒸留水又はイオン交換水で調製する際には,貯蔵液は希釈水10Lに対して100ml以下の量を加える
のが望ましい。
4. 装置 魚のいる液体に接触したり,魚が接触したりするすべての器具は不活性で試験物質を著しく吸
着したりしないものでなければならない。
通常の試験室用の装置及び
4.1
試験容器
− 試験容器は試験物質の性質への対応及び試験の妥当性の基準[特に7.1b)]を達成するための必要性に
応じて異なった形状となる。揮発性物質に対しては,密封系が要求される。不揮発性物質が試験され
る場合には,容器は開放形でよい。試験容器の容量は,試験期間中,水1L当たりの試験魚の比率が
1.5gを超えないものとする。
− 使用前に,試験容器を非イオン性の洗剤などでよく洗浄する(試験容器に化学物質が強く吸着してい
ることが予想される場合には,事前に酸及び溶媒で洗浄しておく。)。
4.2
温度制御装置 試験溶液及び貯蔵用水槽の水の温度を,適切な方法を用いて,23±1℃に調節する。
4.3
溶液置換装置 試験容器中の試験物質を20%以内で設定濃度に維持し,容器中の溶存酸素の濃度が
60%ASV以下にならないようにするのに十分な速度で試験容器中の試験溶液を交換するための投与及び混
合装置。
4.4
たも網 対照容器及びすべての試験容器(4.1)専用に,ナイロン(ポリアミド系樹脂)又は他の化学
的に不活性な材料で作られたたも網を準備する。
5. 試験環境
5
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− 溶液の準備と貯蔵,魚の飼育などすべての操作及び試験は,空気中に空中由来の汚染物質が有害濃度
にはないような施設内で行う。
− 魚の習性を変化させるような,好ましくない妨害がないように気をつける。すべての試験は,一日の
明期12〜16時間をもつ通常の試験室照明のもとで行う。
6. 手順
6.1
魚の状態
− 保存群に何らかの変化があった場合にはいつでも,この規格で示した方法を用いた毒性試験を,適切
な基準物質[例えば,二クロム酸カリウム (K2Cr2O7)]を用いて行う。得られた試験結果は,同じ試
験室であらかじめ得た結果とある程度一致しなければならない。
− 試験魚を事前のいかなる試験にも用いてはならない。
− 貯蔵用水槽の水の温度を23±1℃に維持する。
6.2
限度試験
− この規格に示す手順を用いて,限度試験を行ってもよい。限度試験では,試験条件下における溶解度
又は100mg/Lのいずれか低いほうの濃度で実施し,96時間LC50がこの濃度以上であることを示す。
限度試験において魚の死亡がない場合,追加試験は必要としない。
− 限度試験は,10尾の魚及びこれと同数の魚を用いた対照区で実施する。
備考1. 二項定理は,10尾の魚を用いて死亡例がない場合,96時間LC50が限度試験濃度以上である信
頼度は99.9%であることを示している。死亡例が見られた場合,完全な試験(6.3,6.4参照)
の実施を考慮したほうがよい。準致死影響が見られた場合,これを記録しておくとよい。
6.3
予備試験
6.3.1
可能なら,6.3.2で述べているような予備止水試験に代わって,同じ濃度幅,試験溶液中の魚の数,
観察を流水法で行うのが望ましい。
6.3.2
− 標準希釈水(3.2参照)少なくとも2.5L,なるべく5L,を6個の試験容器にそれぞれ加え,必要な場
合には,溶存酸素の濃度が少なくとも飽和値の90%になるまで通気する。
− 試験物質の貯蔵液(3.3参照)の適量を適切な等比濃度,例えば,1 000mg/L, 100mg/L, 10mg/L, 1mg/L
及び0.1mg/Lとなるように5個の容器に加え試験溶液を調製する。6番目の容器には何も加えず,対
照区とする。溶液は23±1℃になるように調節し,保たなければならない。試験中に強制的に通気す
る必要はない。
− 各容器に魚3尾を入れる。
− 少なくとも1日に2回,各容器の死亡個体数と溶存酸素の濃度を記録する。死亡した魚は除去する。
− 最終試験に必要な濃度範囲を設定するのにデータが不十分な場合には,濃度範囲を変更してこの予備
試験を繰り返す。
6.4
最終試験
− ほぼ等比級数,例えば,8mg/L, 4mg/L, 2mg/L, 1mg/L及び0.5mg/Lになるように,少なくとも5個の濃
度区を選択し,予備試験で魚がすべて死亡した最小濃度区及び96時間で死亡例が見られなかった最高
濃度区を含むようにする。
− プロビット法でLC50値を算定するには,設定した濃度区において少なくとも二つの連続濃度区で,0
〜100%の死亡率が得られるようなものでなければならない。
6
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− 必要なデータを得るのに,さらに狭い範囲の濃度設定がなくてはならない場合もあるし,逆に,広い
範囲の濃度設定が必要とされる場合もある。
− 少なくとも6個の試験容器(4.1)と付帯装置を用意する。1個(又は2個)の試料容器を除いて,試験
に必要な一連の濃度になっている試験物質を試験容器に注入する。残りの試験容器のうちの1個(備
考2.)に対照区として,標準希釈液だけを入れる。
− 試験物質を溶かすため又は分散させるために有機溶媒を使用した場合には,第2の対照区として,試
験溶液の中でその溶媒が最大濃度となる有機溶媒を含んだ標準希釈水の入った容器を準備する。
− 試験溶液を23±1℃に調節した後,次の手順で各容器に少なくとも魚7尾を入れる。
備考2. 試験容器1Lを用いる場合には,希釈水だけの2個の対照区と,2個の溶媒対照区を設けるとよ
い。
− 化学的に不活性な軟らかく細かい目のたも網(4.4)を用いて,保存群体から無作為に魚を選び,手早く
試験容器に移す。移す際に落としたり,取扱いを誤ったりした魚はすべて処分する。
− 試験に際しては,すべての魚を30分間以内に容器に入れるようにする。
− 少なくとも25L/dの速度で試験溶液を交換するように装置を調節する(4.3)。液の交換は連続的,間欠
的のどちらでもよい。流出液の溶存酸素の濃度が60%ASV以上であれば,交換速度は12L/dまで下げ
ることができる。
− 交換に使用する試験溶液は,試験容器に加える前まで23℃に近い温度で調製され,維持されるのが望
ましい。
− 試験期間中,少なくとも1日に1回は各容器で死亡した魚の数を記録する。
− 死亡した魚はできるだけ早く容器から取り出す。頻繁に観察すれば,例えば,各濃度における半数生
存時間を計算することができる。
− 魚のいかなる異常行動でも記録しておく。
− 可能であるなら,少なくとも試験の最初と最後に貯蔵液と試験容器から流出する溶液の試験物質濃度
を測定する。
− 少なくとも1日に1回及び試験期間の最初と最後に,貯蔵液と各試験容器から流出する溶液の溶存酸
素の濃度,pH,温度を測定する。
− データを記録するのに適当な形式を,附属書Bに示す。
7. 試験結果の表現
7.1
妥当性 次の必要条件が満たされているならば,その結果は妥当なものと判断する。
a) 試験中試験溶液の溶存酸素の濃度は,少なくともASV(飽和酸素濃度附属書B参照)の60%であった。
b) 試験期間中,試験物質の濃度の大きな低下が認められ(又は,疑われ)ない(ただし,3.を参照)。
c) 対照区の魚の死亡率が10%又は1容器当たり1尾を超えていなかった。
d) 対照区で異常な行動をする魚の割合が10%又は1容器当たり1尾を超えていなかった。
e) 魚の保存群に対する基準化学物質[例えば,二クロム酸カリウム (K2Cr2O7) ]の24時間のLC50値が
得られる場合,同じ試験室であらかじめ得られた結果におおよそ一致していた。
7.2
LC50の算定
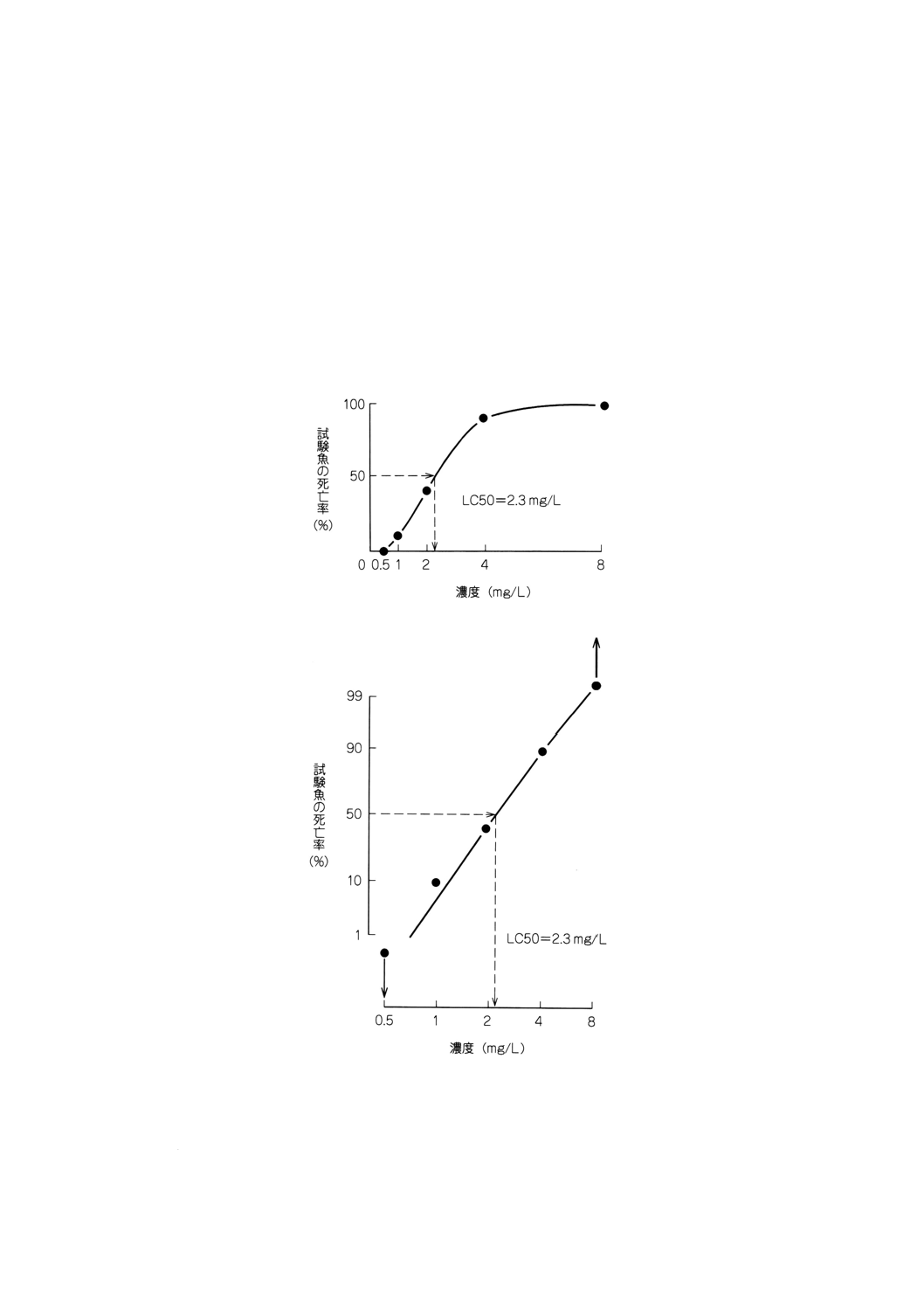
− LC50の評価を簡単なグラフで算定することが適切と考えられる場合は,試験物質の濃度に対する死
亡率(各試験容器の試験魚の割合として表す。)をプロットしてグラフを作成して算定する。軸に線形
目盛を使用すると,S字形の関係が図示され,このグラフから死亡率が50%となる濃度を補間するこ
7
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
とによってLC50を求める(図1参照)。
− より的確なのは,確率及び対数目盛の軸をもつグラフ紙(対数確率紙)にデータをプロットすること
である。このようにプロットしたデータは直線関係を示し,上記と同様にLC50を補間することがで
きる(図2参照)。
− この線とLC50の95%信頼限界を求めることが必要な場合,及びこのような統計がしばしば試験結果
の表現に有効である場合は,データをグラフ的に解析することができる〈附属書C[2]〉。
− 計算機器が利用できる場合には,プロビット解析を利用することができる〈附属書C[1]〉。
− 24時間,48時間及び可能な場合,72時間,96時間のLC50を算定するのに十分なデータが利用でき
るならば,24時間,48時間,72時間及び96時間で,死亡率が100%となった最低濃度と死亡率が0%
となった最高濃度を記録する。これらの濃度はおそらくLC50が存在する範囲を示すであろう。
図1 LC50のグラフからの補間(線形目盛)
図2 LC50のグラフからの補間(対数確率目盛)
8. 試験報告 報告書は,次の事項を含んでいなければならない。
a) この規格の引用
8
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 試験物質についての化学的同一性とその他利用できるすべての情報[例えば,溶解度,揮発性,オク
タノール/水分配係数,分解速度]
c) 希釈水,貯蔵液,試験溶液の調製方法
d) 試験魚の詳細なじゅん化条件及び1L当たりの魚の質量などを含む,この規格のどこにも示されなか
った試験に関するすべての化学的,生物学的,物理学的データ
e) 試験の妥当性を評価したときに考慮したデータ
1) 溶存酸素濃度
2) 対照区の魚でみられた死亡率
3) 異常行動がみられた対照区の魚の割合
4) 基準物質のLC50値
f)
試験した設定濃度(可能ならば,分析値),試験開始後24時間,48時間,72時間及び96時間経過後
の各時点での死亡率に関する表にする
g) 可能ならば24時間,48時間,72時間及び96時間での試験物質のLC50値と信頼限界;計算方法及び
実施した化学分析方法に関する引用文献も記するのがよい
h) 濃度−応答曲線のこう配(可能ならば,95%信頼限界)
i)
濃度−応答関係を図示したもの
j)
試験条件下での魚のすべての異常な行動と試験物質によるすべての外観的影響
k) この規格で示された手順と違ったすべての内容,その理由
付表1 試験に推奨される魚種
推奨される魚種
推奨試験温度 (℃) 試験魚の推奨全長 (cm)
ヒメダカ
(Oryzias latipes)
20〜25
3.0+2.0
ブルーギル
(Lepomis macrochirus)
20〜25
5.0+2.0
ファットヘッドミノー
(Pimephales promelas)
20〜25
5.0+2.0
グッピー
(Poecilia reticulata)
20〜25
3.0±1.0
ニジマス
(Oncorhvnchus mykiss)
13〜17
8.0±4.0
9
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A(参考)
ゼブラフィッシュ(Brachydanio rerio Hamilton−Buchanan)
の管理と飼育のための環境要素
序文 この附属書は,ゼブラフィッシュ (Brachydanio rerio Hamilton−Buchanan) の管理と飼育のための環
境要素について参考として示したもので,規定の一部ではない。
A.1 一般 この種は,インドのコロマンデル海岸原産で,水の流れの速いところに生息する。一般的な観
賞魚であるため,その飼育及び養殖の方法に関する情報は,熱帯魚の養殖についての標準的な参考書で得
ることができる。最近,Laale[5]によりその生態がまとめられている。
この魚の体長は45mmを超えることはほとんどない。その体は円筒形で,銀色の地に7〜9本の濃い青
の縦じま(縞)が入る。このしまは尾びれ,しりびれに達する。背は緑がかった紺色である。雄は雌より
も細く,金色の光沢をもつ。雌は雄に比べてより銀色で,腹部が大きく特に産卵前に著しい。
A.2 環境要素
− この魚は,広い範囲の温度,pH,水の硬度に耐える能力をもつ。Axelrod[4]は温度範囲は15.5〜43.3℃
で,pHは6.6〜7.2であると報告している。
− 全硬度300mg/kg(炭酸カルシウムとして),pHが7.7〜8.2の水道水を用いても,この魚を繁殖,飼育
し,管理できる。通常は26±1℃で飼育するが,産卵を誘発するには27±1℃に昇温する。
A.3 材料と方法
− この魚の産卵のためには,ガラス水槽の容量は70Lあれば十分である。後で,し(仔)魚を容量200 L
の水槽に移す。
− 成魚はよく卵を食べるので,産卵されたばかりの卵及びし魚を守る手段が必要とされる。
− 方法は,成魚を水中の網かごの中に隔離するというものである。これによって雌が産んだ卵は網目を
通って成魚が泳いで行けない水槽の底に落ちる。
− 網かごは網目が3mmのプラスチック製で,寸法はおおよそ250×250×80mmのものである。網かご
は水槽の縁にくくりつけ,網を60mm水に浸けてかごの上端は水面から出すようにする。
− 水の浄化に砂ろ過システム(小石を敷いた底面)は,卵を傷つけるかもしれないので,使用しないほ
うがよい。水槽を1日に8時間照射することが望ましい。
A.4 産卵準備期間
− この期間を約2週間続ける。雄と雌を別々の水槽で飼育し,生きえ(餌)であるホワイト・ワーム (white
worms) (ヒメミミズの類),ミジンコ,ブラインシュリンプ (Artemia) を与える。期間中,魚の数は
容量70Lの水槽当たり30尾以下にする。
− 2週間後には,雄は深い金色の光沢をもつようになり,雌は卵で大きく膨張してくる。
A.5 飼育段階 産卵をする水槽は,次のようにして準備する。
10
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− 水槽を新鮮な水道水で満たして27℃で48時間おき,水槽の縁に,魚が泳ぐ約1Lの大きさの空間をも
ったプラスチック製のかごを下げる。朝,かごに雌6尾を入れ,凍結乾燥したブラインシュリンプを
えさ(餌)として与える。
− 夕方,かごに雄を9尾加えて,消灯する前にもう一度凍結乾燥したブラインシュリンプをえさとして
魚に与える。
− 産卵は朝の照明で誘発され,点灯後,約4時間で完了する。卵は付着しにくく,網目を通って成魚の
泳いでいけないところに達する。
− 雌の産卵が終わった後,成魚を除き卵はふ化するまでそのままにして置く。
A.6 し(仔)魚の発育
− 卵は4〜5日間でふ化し,し魚は水槽のへり近くに集まり,24〜48時間じっと動かない。し魚が自由
に泳ぐようになったとき,市販されている粉状の魚のえさを与える。3週間後には,新たにふ化した
ばかりのブラインシュリンプをえさとして与えることができ,それからの成長は更に速くなる。1か
月間後には,幼魚を水槽200Lに移し,生えさと人工飼料とを混ぜたものを与えることができる。
− 3か月間で性的にも成熟し,体長は3.5cmになる。ある系統では,幼生の発育途上で,自然発生的な
異常が観察されていることに注意すべきである[9]。
− その後の研究により,給じ(餌)要因が奇形の原因であり,特にゼブラフィッシュは,この要因に影
響されやすいということ(ほかの種では,同じ市販商品である魚のえさを与えても正常に生育したが。)
が明らかとなっている[7]。
11
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(参考) データ記録の推奨形式
序文 この附属書は,データ記録の推奨形式を参考として示したもので,規定の一部ではない。

12
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表1 データ記録の推奨形式
13
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C(参考) 参考文献
序文 この附属書は,文献を参考として記述したものであり,規定の一部ではない。
[1] FINNEY, D.J. Statistical Methods in Biological Assay, Wycombe, United Kingdom, Griffin (1978).
[2] LITCHFIELD. J. T.and WILCOXON. F.A simplified method of evaluating dose-effect experiments.
J.Pharmacol. Exp. Ther. 96 (1949), pp.99-113.
[3] STEPHAN, C.E. Methods for calculating an LC 50. Aquatic Toxicology and Hazard Evaluation. ASTM (1977),
ST, p.634.
[4] AXELROD, H. P. Breeding Aquarium Fishes Book 1. T.F.H. Publication, 1967.
[5] LAALE, H. W. The biology and use of zebra fish (Brachydanio rerio) in fisheries research. A literature review.
J. Fish Biol. 10(2) (1977), pp.121-173.
[6] MERTENS, J. Year-round controlled mass reproduction of the zebra fish. Aquaculture 2 (1973), pp.245-249.
[7] NEWSOME, C.S. and PIRON, R.D. Aetiology of skeletal deformities in the Zebra Danio fish (Brachydanio rerio
Hamilton−Buchanan) , J. Fish Biol. 21 (1982), pp.231-237.
[8] NIIMI, A.J. and LAHAM, Q.N. Influence of breeding time interval on egg number, mortality and hatching of
the zebra fish (Brachydanio rerio). Can. J. Zool. 52 (1974), pp.515-517.
[9] PIRON., R.D. Spontaneous skeletal deformities in the zebra fish (Brachydanio rerio) bred for fish toxicity tests.
J. Fish Biol. 13 (1978), pp.79-84.

14
K 0420-71-30 : 2000
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
平成9年度 国際整合化調査研究委員会 構成表(平成10年3月現在)
氏名
所属
(委員長)
○ 並 木 博
横浜国立大学名誉教授
○ 宮 崎 正 浩1) 工業技術院標準部消費生活規格課
谷 重 男2) 通商産業省環境立地局産業施設課
林 明 夫3) 通商産業省環境立地局環境指導課
畑 野 浩
環境庁水質保全局水質規制課
佐 藤 寿 邦
横浜国立大学工学部
中 村 和 憲
工業技術院生命工学工業技術研究所
田 尾 博 明
工業技術院資源環境技術総合研究所水圏環境保全部
○ 福 井 学
工業技術院資源環境技術総合研究所水圏環境保全部
田 中 宏 明
建設省土木研究所下水道部
○ 菅 谷 芳 雄
国立環境研究所地域環境研究グループ
○ 土 屋 悦 輝
東京都立衛生研究所環境保健部
○ 渡 辺 真利代
東京都立衛生研究所環境保健部
○ 竹 内 準 一
東京都下水道局
日 野 隆 信
千葉県衛生研究所
小 倉 光 夫
神奈川県環境科学センター水質環境部
○ 坂 本 勉
財団法人日本規格協会技術部
橋 本 繁 晴
財団法人日本規格協会技術部
○ 髙 月 峰 夫
財団法人化学品検査協会安全性評価技術研究所
○ 梅 崎 芳 美
社団法人産業環境管理協会名誉参与
横 倉 清 治
社団法人日本環境測定分析協会(三菱マテリアル株式会社)
竹 島 正4) 社団法人日本下水道協会(東京都下水道局)
狩 野 久 直
日本錬水株式会社研究所
久 島 俊 和
オルガノ株式会社総合研究所
○ 川 瀬 晃
セイコー電子工業株式会社科学機器事業部
米 倉 茂 男
元東京都立工業技術センター(現東京都立産業技術研究所)
岩 﨑 岩 次
社団法人日本工業用水協会
(事務局)
宮 寺 秀 雄
社団法人日本工業用水協会
本 郷 秀 昭
社団法人日本工業用水協会
備考
1):発足当初は,西出徹雄(工業技術院標準部消費生活規格課)
2):発足当初は,乾 敏一(通商産業省環境立地局産業施設課)
3):発足当初は,藤冨正晴(通商産業省環境立地局環境指導課)
4):発足当初は,山田昭捷(東京都下水道局)
○は微生物・細菌関係の小委員会委員兼任
(文責 菅谷芳雄)



